大西洋鳕(Gadus morhua)是鳕形目鳕科鳕属鱼类,作为一种蛋白质含量高、脂肪含量低、肉质致密的水产品广受欢迎,销量呈逐年递增的趋势。鳕形目鱼类品种繁多,从感官特点上难以分辨其捕捞海域、来源和种类,而不同的鱼类品种市场价格差异大,造成以次充好或标识错误的现象时有发生[1]。曾多次出现过用“油鱼”即棘鳞蛇鲭(Ruvettus pretiosus)和异鳞蛇鲭(Lepidocybium flavobrunneum)冒充“大西洋鳕鱼”的产品进行贩卖,导致消费者食用后出现过敏、腹泻的情况[2]。目前,我国鳕鱼成分鉴定标准或真伪检测方法主要有2种,均基于实时荧光定量PCR(quantitative real-time PCR, qPCR)技术[2-3]。但是,该方法需要在实验环境分区的条件下进行,对实验器皿、人员操作、防污染措施都有较高的要求[4],且依赖复杂精密的温控设备,成本高,在一定程度上限制了它的应用场景,无法达到现场快速检测的目的[5]。因此,建立一种灵敏、操作简便、特异性强,能够快速检测大西洋鳕鱼及其相关制品的方法迫在眉睫。
本文首次研究利用重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)快速鉴定大西洋鳕鱼及其制品的方法。RPA技术是模拟DNA复制机制,用重组酶、单链结合蛋白和DNA聚合酶代替传统PCR的热循环解链过程,实现了在恒定适宜温度(37~56 ℃)下核酸的快速(15~20 min)扩增[6]。作为一种新型的恒温核酸扩增技术,RPA技术与PCR技术具有相似的功能,都有较强的灵敏性和特异性,除此之外RPA技术有反应时间短,操作简便,不需精密仪器等优点[7-8]。自2006年RPA技术被发明后,已广泛应用于有害微生物检测、病毒检测以及临床诊断等重要领域,也有应用于畜禽肉类检测上的报道[9-10],但目前还没有应用RPA技术检测水产品真伪的研究。本研究将RPA技术与侧流层析试纸条技术(lateral flow dipstick,LFD)相结合实现检测结果可视化,其原理是因RPA-LFD体系中存在核酸外切酶Ⅳ(endonuclease Ⅳ,NFO)、5′端带有荧光FAM基团的探针以及带有生物素标记的反向引物[11],使得杂交扩增出的产物带有双标记。将稀释后的产物滴加在LFD试纸条上,双标产物会与试纸条抗FAM抗体结合,形成三元复合物,当其流经检测线时,会与检测线上的生物素抗体结合显色,可以根据检测线的显色情况判断检测样品的真伪[12]。而未杂交的产物与LFD试纸条上的抗FAM抗体结合,形成不含有生物素的两元复合物,与质控线上的抗FAM抗体的抗体结合显色[13]。
本研究基于RPA-LFD技术建立了针对大西洋鳕鱼现场快速检测的方法,具有特异性高、灵敏度强、操作简便、结果可视等优点,为大西洋鳕鱼的现场快速检测提供了技术支持。
1 材料与方法
1.1 材料与试剂
大西洋鳕、狭鳕(Theragra chalcogramma)、南极犬牙鱼(Dissostichus eleginoides)、异鳞蛇鲭、马舌鲽(Reinhardtius hippoglossoides)等冷冻产品,京东超市及上海市农贸市场。Ezup柱式动物基因组DNA抽提试剂盒(Sangon),上海生工生物工程有限公司;DNA恒速快速扩增试剂盒及HybriDetect试纸条、DNA恒温快速扩增WLN8230KIT试剂盒、超快速核酸WLR8203释放剂,潍坊安普未来生物科技有限公司。
1.2 仪器与设备
Vortex-2漩涡混匀仪,上海沪析实业有限公司;NanoDrop3300荧光分光光度计,赛默飞世尔科技公司;Centrifuge 5430小型台式高速冷冻离心机,Eppendorf艾本德;Light Cycler 480实时荧光PCR仪,瑞士Hoffmann-La Roche有限公司。
1.3 样品DNA提取
利用Ezup柱式动物基因组DNA抽提试剂盒(Sangon,B518 251-0050)提取DNA,取4条大西洋鳕的鱼肉组织各25 mg以及狭鳕、南极犬牙鱼、异鳞蛇鲭、马舌鲽的鱼肉组织各25 mg剪碎置于1.5 mL的离心管中,加入180 μL的Buffer ACL和20 μL的蛋白酶K溶液,振荡混匀置于56 ℃水浴下5 h使细胞裂解。随后加入200 μL Buffer CL和200 μL无水乙醇充分颠倒混匀,转入吸附柱收集管中,静置2 min,以10 000 r/min室温离心1 min,倒掉收集管中的废液。再将吸附柱放回收集管中,加入500 μL CW1 solution,以10 000 r/min室温离心30 s,倒掉收集管中的废液。再将吸附柱放回收集管中,加入500 μL CW2 solution,以10 000 r/min离心30 s,倒掉收集管中的废液。将吸附柱重新放回收集管中,以12 000 r/min室温离心2 min,去残留的CW2 solution。最后取出吸附柱,放入1.5 mL离心管中,加入150 μL CE Buffer静置3 min后以12 000 r/min室温离心2 min,收集DNA溶液并按照CL3036~CL3043对所提取的基因组DNA进行编号。用NanoDrop3300荧光分光光度计测定样品的DNA浓度,置于-20 ℃保存备用。
1.4 模板DNA的鉴定
利用MiFish引物[14-15],序列如表1所示,对样品DNA线粒体基因组上的12S区域进行PCR扩增,并将产物进行一代测序,测序结果与GenBank (http://www.ncbi.nlm.nih.gov/genbank/)上的物种序列进行BLAST比对,鉴定样品的物种种类。鉴定结果为:CL3036~CL3039均为大西洋鳕鱼,CL3040为狭鳕鱼,CL3041为南极犬牙鱼,CL3042为异鳞蛇鲭,CL3043为马舌鲽。
表1 MiFish引物序列信息
Table 1 Sequences information of the MiFish primers
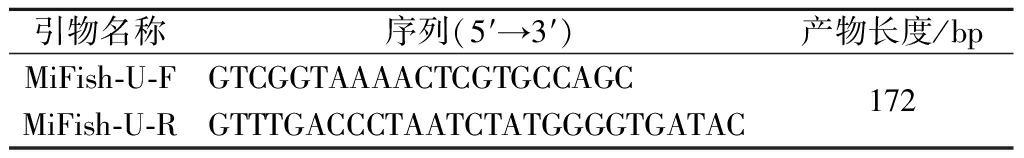
引物名称序列(5′→3′)产物长度/bpMiFish-U-FGTCGGTAAAACTCGTGCCAGCMiFish-U-RGTTTGACCCTAATCTATGGGGTGATAC172
1.5 RPA-LFD引物和探针的设计
根据我国进出口市场以及大型水产品交易市场的调研结果,选择异鳞蛇鲭、小鳞犬牙南极鱼、莫氏犬牙南极鱼、裸盖鱼、马舌鲽等常用来冒充大西洋鳕鱼的5种水产品品种,从GenBank上下载5种鱼类的线粒体基因组序列(表2),利用PrimedRPA软件进行初步比对,筛选出基因序列中同源性相对较高的保守区域,再根据RPA引物的设计原则,利用MEGA-X工具和人工筛选,设计针对大西洋鳕鱼的高特异性引物及探针。其中下游引物5′端带有生物素标记,探针5′端用FAM基团修饰,nfo的识别位点用dSpacer(四氢呋喃,THF)修饰,3′末端用C3-Spacer标记。设计好的引物由苏州金唯智生物科技有限公司合成,探针由生工生物工程(上海)股份有限公司合成,序列见表3。
表2 大西洋鳕鱼和常见冒充鳕鱼的鱼类
Table 2 Atlantic cod and other popular species used for adulterated cod products

物种名称拉丁学名GenBank序列号大西洋鳕鱼Gadus morhuaNC 036931.1异鳞蛇鲭Lepidocybium flavobrunneumNC 13587小鳞犬牙南极鱼Dissostichus eleginoidesNC 100907莫氏犬牙南极鱼Dissostichus mawsoniNC 36200裸盖鱼Anoplopoma fimbriaNC 018119.1马舌鲽Reinhardtius hippoglossoides NC 111784.1
表3 大西洋鳕鱼RPA-LFD扩增引物和探针
Table 3 RPA-LFD amplifying primers and probes for Gadus morhua

引物名称序列(5′→3′)上游引物F15′-GCTGAATAATCCTTGTAATGCAATTTAA-3′下游引物R15′-(Biotin)-CTAAAGAAAGAAGAATTATTGGGG-TGATT-3′探针T15′-(FAM)-AACTTTCTCAACTTTTATAATTTTTA-AAACTAATT(dSpacer)CTTCTACCACGGTAAA-(C3 spacer)-3′上游引物F25′-CACCTTGACATTTATGTGAGCAACCTCT-3′下游引物R25′-(Biotin)-ATGTGTTCGATGAAACGCTAAGC-CTAT-3′探针T25′-(FAM)-AGTCTAAGTAAAATACTTGATTTCG-GCTCAAGAG(dSpacer)TCTGTGGTTAAAGTCC-(C3 spacer)-3′
1.6 RPA-LFD反应条件的确立
以拷贝数为103拷贝/μL的CL3036为大西洋鳕鱼DNA扩增模板,确定RPA-LFD的扩增体系。根据DNA恒温快速扩增试剂盒的操作说明书,配制含有A buffer 29.4 μL、10 μmol/L的上下游引物各2 μL、10 μmol/L的探针0.6 μL和DNA模板2μL的体系,将其振荡混匀加入B buffer 2.5 μL及灭菌去离子水11.5 μL构建50 μL的RPA反应体系,在38 ℃金属浴反应12 min。将反应产物用无菌去离子水稀释50倍,用带有抗FAM和Biotin标记的LFD试纸条对稀释后的产物进行检测。LFD试纸条上的质控线和检测线均有条带即为阳性扩增,仅质控线有条带为阴性扩增,若质控线无条带则实验结果无效。
1.7 大西洋鳕鱼RPA-LFD引物及探针筛选
以CL3036大西洋鳕鱼为阳性对照,CL3042异鳞蛇鲭为阴性对照,灭菌去离子水为空白对照,利用DNA恒温快速扩增试剂盒筛选大西洋鳕鱼RPA-LFD的最佳引物及探针。配制50 μL RPA体系,在38 ℃金属浴反应12 min,用LFD试纸条对稀释后的产物进行检测。根据已知扩增样品的物种信息判断LFD试纸条检测结果的准确性,筛选出可以特异性扩增大西洋鳕鱼的引物及探针。
1.8 RPA-LFD反应条件的优化
针对不同的目标物种所设计的引物和探针,RPA-LFD最佳反应温度和时间均有差异[16]。本实验以大西洋鳕鱼CL3036的基因组DNA作为阳性模板,以CL3042的基因组DNA为阴性模板,分别配制出5组50 μL的RPA体系,将其静置于36、38、40、44、48 ℃的金属浴中反应12 min,将扩增产物用无菌去离子水稀释50倍后滴加在LFD试纸条上,5 min后观察条带显色情况并拍照记录,确定最佳反应温度。在最优反应温度下,以大西洋鳕鱼CL3036的基因组DNA作为阳性模板,以CL3042的基因组DNA为阴性模板,设置梯度反应时间:8、10、12、14、16 min。按照RPA-LFD实验步骤,将RPA体系恒温孵育相应时间,根据LFD试纸条显色情况,确定最佳反应时间[17]。
1.9 RPA-LFD特异性的测定
在最佳反应条件下,以CL3036~CL3043的基因组DNA为模板,灭菌去离子水为空白对照,进行RPA-LFD扩增检测,验证大西洋鳕RPA-LFD检测方法的特异性。
1.10 现场快速检测市售“鳕鱼”制品
利用DNA恒温快速扩增试剂盒对20份市售带有“鳕”字的水产品进行RPA-LFD现场快速检测,鉴别其是否为大西洋鳕。在检测现场取鱼肉组织30 mg左右,将其剪碎研磨至匀浆状,取20 μL的组织样与40 μL的超快速核酸释放剂振荡混匀,用恒温可调温式保温垫作为现场实验简易热量来源装置,将其温度调节到一档:35~40 ℃,将组织样与快速核酸释放剂混合液静置于保温杯垫上5 min,使样品DNA快速释放。取混合液中的上清液2 μL作为DNA模板,配成50 μL的RPA体系。随后将保温垫温度调节到二档40~45 ℃,将50 μL的RPA体系静置于保温杯垫上反应12 min,反应产物用无菌去离子水稀释50倍后滴加在LFD试纸条进行检测。现场快速检测结果与PCR扩增后的一代测序结果进行比对,验证RPA-LFD现场快速检测结果的准确性。
2 结果与分析
2.1 RPA-LFD最佳引物和探针的确定
根据RPA引物和探针的设计原则,针对大西洋鳕鱼ND2保守区设计了2对引物及对应的探针,并以CL3036标准DNA为阳性模板,CL3042标准DNA为阴性模板,dd双蒸水为空白对照分别用2组引物及探针进行RPA-LFD扩增检测,结果如图1所示,第一对引物和探针测试结果为CL3036阳性、CL3042及空白对照为阴性,检测结果符合实验预期。利用第二对引物和探针进行扩增的CL3042阴性对照组出现假阳性,与实验预期不符。由此确定上游引物F1:5′-GCTGAATAATCCTTGTAATGCAATTTAA-3′、下游引物R1:5′-(Biotin)-CTAAAGAAAGAAGAATTATTGGGGTGATT-3′及探针T1:5′-(FAM)-AACTTTCTCAACTTTTATAATTTTTAAAACTAATT(dSpacer)CTTCTACCACGGTAAA-(C3 spacer)-3′。

图1 引物探针筛选结果
Fig.1 Result of primer and probe screening
注:1~3分别为用引物F1、R1、探针T1对CL3036、CL3042和 PCR水进行的RPA-LFD扩增实验结果图;4~6分别为用引物 F2、R2、探针T2对CL3036、CL3042和PCR水进行的 RPA-LFD扩增实验结果图
2.2 RPA-LFD检测反应条件的优化
反应温度优化实验的结果如图2所示,反应温度过高使阴性样品产生阳性条带影响实验结果,温度过低条带显色不明显,根据实验结果确定最佳温度为44 ℃。

图2 不同培养温度下的实验结果
Fig.2 Results of different incubation temperature
注:A1~A5分别为CL3036在不同的温度下的RPA-LFD实验结 果图,A1-36 ℃;A2-38 ℃;A3-40 ℃;A4-44 ℃;A5-48 ℃; B1~B5分别为CL3042在不同的温度下的RPA-LFD实验结 果图,B1-36 ℃;B2-38 ℃;B3-40 ℃;B4-44 ℃;B5-48 ℃; A6、B6为空白对照组
反应时间优化实验的结果如图3所示,反应时间低于12 min会反应不完全导致显色不明显,超过16 min会出现假阳性,故实验最佳时间确定为14 min。

图3 不同培养时间下的实验结果
Fig.3 Results of different incubation time
注:A1~A5分别为CL3036在不同的反应时间下RPA-LFD 实验结果图,A1-8 min,A2-10 min,A3-12 min, A4-14 min,A5-16 min,A6-空白对照组;B1~B5分别 为CL3042在不同的反应时间下进行的RPA-LFD实验结 果图,B1-8 min,B2-10 min,B3-12 min,B4-14 min, B5-16 min,B6-空白对照组
2.3 RPA-LFD特异性实验
对CL3036~CL3039大西洋鳕鱼、CL3040狭鳕鱼、CL3041南极犬牙鱼、CL3042异鳞蛇鲭、CL3043马舌鲽等8种水产品以及灭菌去离子水作为空白对照进行RPA-LFD扩增检测(图4)。结果表明,CL3036~CL3039出现阳性反应,其他样品均为阴性,检测结果与PCR扩增测序结果一致,证明本研究建立的大西洋鳕鱼RPA-LFD检测方法特异性良好。

图4 引物探针的特异性检测结果
Fig.4 Results of specific test of primer and probe
注:1~4-大西洋鳕鱼;5-狭鳕鱼;6-南极犬牙鱼; 7-异鳞蛇鲭;8-马舌鲽;9-灭菌去离子水
2.4 现场实时检测市售“鳕鱼”制品结果
对20份市售带有“鳕”字的水产品进行RPA-LFD现场快速检测,鉴定其是否为大西洋鳕鱼。检测样品中15份为大西洋鳕鱼,剩余5份非大西洋鳕鱼制品。随后将20份样品按序编号,利用PCR扩增进行一代测序鉴定其物种。RPA-LFD检测结果与测序结果一致,见表4。
表4 野外实时检测市售“鳕鱼”类及其他鱼类制品
Table 4 Real-time testing on “cod” and other fish products sold in the market in the field
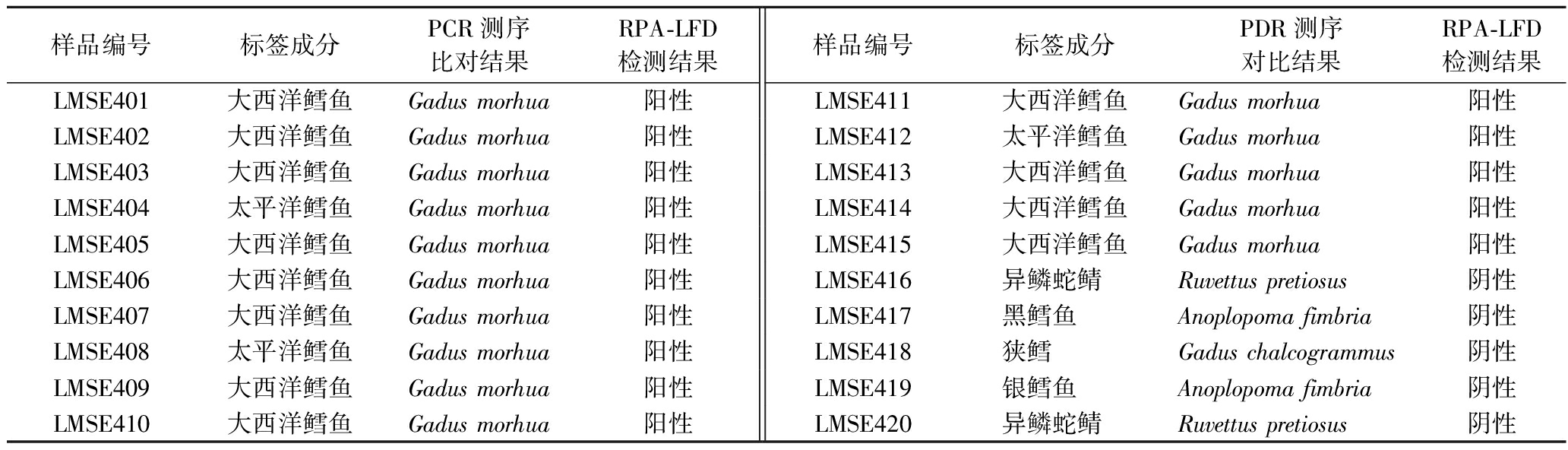
样品编号标签成分PCR测序比对结果RPA-LFD检测结果样品编号标签成分PDR测序对比结果RPA-LFD检测结果LMSE401大西洋鳕鱼Gadus morhua阳性LMSE411大西洋鳕鱼Gadus morhua阳性LMSE402大西洋鳕鱼Gadus morhua阳性LMSE412太平洋鳕鱼Gadus morhua阳性LMSE403大西洋鳕鱼Gadus morhua阳性LMSE413大西洋鳕鱼Gadus morhua阳性LMSE404太平洋鳕鱼Gadus morhua阳性LMSE414大西洋鳕鱼Gadus morhua阳性LMSE405大西洋鳕鱼Gadus morhua阳性LMSE415大西洋鳕鱼Gadus morhua阳性LMSE406大西洋鳕鱼Gadus morhua阳性LMSE416异鳞蛇鲭Ruvettus pretiosus 阴性LMSE407大西洋鳕鱼Gadus morhua阳性LMSE417黑鳕鱼Anoplopoma fimbria阴性LMSE408太平洋鳕鱼Gadus morhua阳性LMSE418狭鳕Gadus chalcogrammus阴性LMSE409大西洋鳕鱼Gadus morhua阳性LMSE419银鳕鱼Anoplopoma fimbria阴性LMSE410大西洋鳕鱼Gadus morhua阳性LMSE420异鳞蛇鲭Ruvettus pretiosus 阴性
3 讨论
近年来,曾多次出现过将“油鱼”棘鳞蛇鲭和异鳞蛇鲭冠以“大西洋鳕鱼”的名字贩卖,消费者购买假鳕鱼食用后,发生腹泻的事件时有发生[18-19]。林霖等[20]利用SN/T 3589.7—2013对常见的鳕鱼制品进行检测,发现该技术由于需建立标准曲线容易出现假阳性,并且无法应用于抽取的全部鳕鱼制品,反应过程也需要PCR仪等高精密仪器无法做到现场实时快速检测。此外,李新光等[21]、王敏等[22]应用DNA条形码技术,对市场上随机抽取的鳕鱼制品进行检测,结果显示该方法可以检测出众多鳕鱼品种,如大西洋鳕鱼、格陵兰鳕鱼(Gadus ogac)、狭鳕、绿青鳕(Pollachius virens)等。该方法具有检测范围广、操作简单、鉴定效率高等优点,但存在混合制品获得单一的DNA条形码片段难度大,检验操作复杂,结果分析难等缺点。SAULL等[23]基于大西洋鳕鱼的cyt b基因设计出4对LAMP引物,在63 ℃下恒温扩增60 min,检测出大西洋鳕鱼。该方法特异性强、灵敏度高但是检验所需的引物设计难度大,反应时间较长,应用于鳕鱼制品的现场快速检测存在一定难度[24]。所以目前已有的检测方法由于需要大型精密实验仪器,实验操作复杂或对实验环境要求高,反应时间长等原因均无法在现场完成对大西洋鳕鱼的实时检测。
而RPA技术作为新型核酸扩增技术,具有灵敏性强、效率高、成本低、易操作等特点。研究人员只需要根据目标物种的核酸序列设计并合成RPA上、下游引物及探针,就可以利用RPA试剂盒进行RPA反应。本文所提出的RPA-LFD实验方法,是将RPA技术与侧流层析试纸条技术相结合,做到了在短时间内结果可视,不需要PCR仪等精密仪器,在控温式保温杯内即可完成扩增反应,具有灵敏性强、特异性高、易操作、能够现场快速检测等优点[25-26]。RPA试验的关键节点为设计高特异性的引物和探针,大多数常用的PCR引物、探针不适合用于RPA反应体系。目前,获得一对“好”引物的具体规则还未完全明确,也没有专门的设计软件可供使用,因此通过试验来筛选最佳引物是不可缺少的环节。本试验结果表明温度和反应时间也是重要的试验条件,温度过高、过低,或者反应时间过长、过短均可能对整个实验造成根本性的影响,因此,也需要对反应条件和体系进行优化,以达到最好的检测效果。
4 结论
综上,本研究所建立的大西洋鳕鱼RPA-LFD方法可以准确、高效地检测出大西洋鳕鱼的真伪。该方法为大西洋鳕鱼的现场快速检测提供了科学依据,具有良好的应用前景,为其他水产品现场快速检测提供了新思路。RPA-LFD技术填补了传统检测技术依赖精密实验仪器、无法完成现场快速检测的技术空缺,在现场快速检测和低资源环境检测领域存在巨大优势。但RPA技术存在引物和探针设计难度大,没有专门的设计软件,实验条件需要人为优化等局限。这需要科研人员的共同努力,不断完善RPA研究体系,为快检领域提供技术支持。未来RPA技术在突发疾病病原检测、食品质量安全检测、低资源环境检测领域会有新的突破,将会得到广泛的应用和推广。
[1] 汪艺, 冯俊丽, 戴志远, 等.实时荧光定量聚合酶链式反应快速鉴定三种鳕鱼[J].核农学报, 2020, 34(10):2 190-2 198.
WANG Y, FENG J L, DAI Z Y, et al.Rapid identification of three cod species by quantitative real-time polymerase chain reaction[J].Journal of Nuclear Agricultural Sciences, 2020, 34(10):2 190-2 198.
[2] 郭淼, 索一平, 毕思丹, 等.DNA检测技术在鳕鱼及其制品鉴定中的应用[J].食品安全质量检测学报, 2020, 11(21):7 700-7 707.
GUO M, SUO Y P, BI S D, et al.Application of DNA-based methods for the identification of cod fish and its products[J].Journal of Food Safety & Quality, 2020, 11(21):7 700-7 707.
[3] 杜亚楠, 赵笑, 范小瑞, 等.重组酶聚合酶扩增技术的研究进展及其应用[J].上海农业学报, 2018, 34(6):117-122.
DU Y N, ZHAO X, FAN X R, et al.Advances and applications of recombinase polymerase amplification[J].Acta Agriculturae Shanghai, 2018, 34(6):117-122.
[4] 林霖, 王坤, 吴佳辉, 等.Exo探针-RPA法现场快检牛肉产品中猪肉成分[J].食品科技, 2018, 43(11):349-353.
LIN L, WANG K, WU J H, et al.Detection of pork ingredient in beef product by exo probe-RPA method on-site rapid[J].Food Science and Technology, 2018, 43(11):349-353.
[5] WANG Y H, WANG Q, BERGMANN S M, et al.Development and comparative evaluation of real-time PCR and real-time RPA assays for detection of tilapia lake virus[J].Molecular and Cellular Probes, 2021, 60:101776.
[6] HUANG Q J, CHEN Y, LIU H, et al.Establishment of a real-time Recombinase Polymerase Amplification (RPA) for the detection of decapod iridescent virus 1 (DIV1)[J].Journal of Virological Methods, 2022, 300:114377.
[7] JIA T H, YU Y X, WANG Y J.A recombinase polymerase amplification-based lateral flow strip assay for rapid detection of genogroup II noroviruses in the field[J].Archives of Virology, 2020, 165(12):2 767-2 776.
[8] DAHER R K, STEWART G, BOISSINOT M, et al.Isothermal recombinase polymerase amplification assay applied to the detection of group B streptococci in vaginal/anal samples[J].Clinical Chemistry, 2014, 60(4):660-666.
[9] 马文娣, 田逸英, 焦志远, 等.重组酶聚合酶扩增技术在植物病原快速检测中的应用[J].植物保护, 2021, 47(3):1-5;13.
MA W D, TIAN Y Y, JIAO Z Y, et al.Recombinase polymerase amplification and its applications in quick detection of plant pathogens[J].Plant Protection, 2021, 47(3):1-5;13.
[10] 兰海鸥, 柯义强, 马咸莹, 等.重组酶聚合酶等温扩增技术在食品安全检测领域的应用[J].食品与发酵工业, 2019, 45(14):233-238.
LAN H O, KE Y Q, MA X Y, et al.Application of recombinase-polymerase mediated isothermal amplification in food safety analysis[J].Food and Fermentation Industries, 2019, 45(14):233-238.
[11] 林霖, 冯荣虎, 王坤, 等.牛肉真伪鉴别荧光RPA现场快检方法建立[J].食品科技, 2018, 43(6):322-326.
LIN L, FENG R H, WANG K, et al.Construct beef authentication on-site rapid detection method based on fluorescent RPA technology[J].Food Science and Technology, 2018, 43(6):322-326.
[12] 施宁雪, 靳晶豪, 陈孝仁.重组酶聚合酶扩增技术及其在生命科学领域的应用[J].江西农业学报, 2021, 33(10):62-72.
SHI N X, JIN J H, CHEN X R.Recombinase polymerase amplification technology and its application in field of life sciences[J].Acta Agriculturae Jiangxi, 2021, 33(10):62-72.
[13] JIANG W, REN Y L, HAN X G, et al.Recombinase polymerase amplification-lateral flow (RPA-LF) assay combined with immunomagnetic separation for rapid visual detection of Vibrio parahaemolyticus in raw oysters[J].Analytical and Bioanalytical Chemistry, 2020, 412(12):2 903-2 914.
[14] MIYA M, GOTOH R O, SADO T.MiFish metabarcoding:A high-throughput approach for simultaneous detection of multiple fish species from environmental DNA and other samples[J].Fisheries Science, 2020, 86(6):939-970.
[15] MIYA M, SATO Y, FUKUNAGA T, et al.MiFish, a set of universal PCR primers for metabarcoding environmental DNA from fishes:Detection of more than 230 subtropical marine species[J].Royal Society Open Science, 2015, 2(7):150088.
[16] 王亚磊, 张海洋, 王权, 等.产单核细胞李氏杆菌RPA-LF快速检测方法的建立[J].中国兽医科学, 2020, 50(1):1-9.
WANG Y L, ZHANG H Y, WANG Q, et al.Rapid detection of Listeria monocytogenes with isothermal recombinase polymerase amplification and lateral flow analysis[J].Chinese Veterinary Science, 2020, 50(1):1-9.
[17] 张珊珊, 李楠, 郝镯, 等.布鲁氏菌RPA-LFD快速检测方法的建立与应用[J].中国兽医科学, 2021, 51(10):1 215-1 220.
ZHANG S S, LI N, HAO Z, et al.Development and evaluation of a rapid visualization detection method for Brucella based on RPA-LFD[J].Chinese Veterinary Science, 2021, 51(10):1 215-1 220.
[18] 信红梅, 姚琳, 陆键萍, 等.Real-time PCR法检测水产品中异鳞蛇鲭、棘鳞蛇鲭源性成分[J].食品科学, 2020, 41(24):273-280.
XIN H M, YAO L, LU J P, et al.Detection of Lepidocybium flavobrunneum and Ruvettus pretiosus derived components in aquatic products by real-time PCR[J].Food Science, 2020, 41(24):273-280.
[19] 楼叶青, 胡艺凡, 郑方媛, 等.应用聚合酶链式反应和限制性内切酶酶切技术鉴别鳕鱼[J].肉类研究, 2019, 33(10):57-62.
LOU Y Q, HU Y F, ZHENG F Y, et al.Identification of cod by polymerase chain reaction and restriction endonuclease digestion[J].Meat Research, 2019, 33(10):57-62.
[20] 林霖, 陈国培, 何永盛, 等.鳕鱼产品属性鉴别及细鳞壮鳕检测方法建立[J].食品工业, 2017, 38(4):208-212.
LIN L, CHEN G P, HE Y S, et al.Cod fish product authentication and Albatrossia pectoralis detection method construction[J].The Food Industry, 2017, 38(4):208-212.
[21] 李新光, 王璐, 赵峰, 等.DNA条形码技术在鱼肉及其制品鉴别中的应用[J].食品科学, 2013, 34(18):337-342.
LI X G, WANG L, ZHAO F, et al.Application of DNA barcoding to identify commercial fish and fish products[J].Food Science, 2013, 34(18):337-342.
[22] 王敏, 刘荭, 黄海, 等.DNA条形码技术在深圳鱼肉制品鉴定中的应用[J].食品科学, 2015, 36(20):247-251.
WANG M, LIU H, HUANG H, et al.Identifying fish products in Shenzhen through DNA barcoding[J].Food Science, 2015, 36(20):247-251.
[23] SAULL J, DUGGAN C, HOBBS G, et al.The detection of Atlantic cod (Gadus morhua) using loop mediated isothermal amplification in conjunction with a simplified DNA extraction process[J].Food Control, 2016, 59:306-313.
[24] 肖璐, 邬旭龙, 王印, 等.环介导等温扩增技术及其应用[J].动物医学进展, 2015, 36(7):113-117.
XIAO L, WU X L, WANG Y, et al.Loop-mediated isothermal amplification and its application[J].Progress in Veterinary Medicine, 2015, 36(7):113-117.
[25] 于灵芝, 陶凌云, 魏晓锋.可视化核酸检测技术RPA-LFD的研究和应用进展[J].实验动物与比较医学, 2021, 41(6):547-553.
YU L Z, TAO L Y, WEI X F.Research and application progress in visualized RPA-LFD nucleic acid detection technology[J].Laboratory Animal and Comparative Medicine, 2021, 41(6):547-553.
[26] 孙晓红, 后来旺, 李达容, 等.重组酶等温扩增技术在分析检测中的应用研究进展[J].食品与发酵工业, 2020, 46(24):265-270.
SUN X H, HOU L W, LI D R, et al.Research progress on the application of isothermal recombinase amplification in analytical detection[J].Food and Fermentation Industries, 2020, 46(24):265-270.