芽孢杆菌为革兰氏阳性菌,是一类好气性细菌。该菌无毒性,能分泌蛋白酶等多种酶类和抗生素,并因其芽孢分化的特性,对高温、干燥、化学物质有强大的抵抗性,十分便于生产、加工及保存,因此,被广泛应用于生物农业等多个领域[1-2]。
目前,芽孢杆菌微生态制剂的干燥工艺主要包括喷雾干燥和真空冷冻干燥[3]。由于真空冷冻干燥技术是利用升华原理完成物料的干燥,因此物料在干燥过程中会保持较低的温度,对于一些温度敏感型物质的干燥具有独特的优势,能获得具有较高活性的产物,但生产周期较长,产量较小,不适合规模化的生产过程。喷雾干燥是工业生产中最常用的一种干燥技术,能实现物料干燥的连续操作,获得的产品呈粉末状,粒径均匀,操作灵活[4]。使用喷雾干燥技术将益生菌微胶囊化,不仅可使菌体与外界的不良环境分开,掩蔽气味,形成近似于球状的固体微颗粒,便于添加使用,也有利于储存和运输[5]。但喷雾干燥中采用的高温与快速脱水过程会对益生菌造成多重胁迫,如热胁迫、脱水胁迫、氧化胁迫等,易使菌粉损失几个数量级的活菌数[6-8]。工业化生产芽孢杆菌微生态制剂还受到许多制约:(1)制剂工艺不够完善,枯草芽孢杆菌在喷雾成粉末后,大量失活;(2)产品质量不稳定,在储存过程中极易失活,货架期较短[2-4]。因此,优化生产工艺,制备高活菌数、耐保藏的微生态制剂,将对工业化生产起到一定的助力。
为减少喷雾过程中的细胞损伤,通常使用高保护性的载体材料加强对菌体的保护。KHEM等[9]采用正十六烷萃取的方法,表征了喷雾干燥后益生菌表面疏水性的变化,他们提出,同样具有疏水基团的天然乳清蛋白,能较好地包埋益生菌,保护菌体活性。通常单一保护剂不足以帮助菌体抵抗外界恶劣的环境,复配保护剂中各类壁材在喷雾干燥中能够发挥各自作用,在干燥和保存期间维持较高的细胞存活率,达到最佳保护效果[10]。比如,有些大分子保护剂通过将菌体包裹起来发挥保护作用,并且能增强低分子保护剂的作用,协同发挥作用。肖怀秋等[11]研究发现,糖类与蛋白质联用作为复合抗热保护剂比单一保护剂抗热保护效果更好,可减轻喷雾干燥对菌体亚细胞结构及生物大分子损伤。AGUDELO等[12]研究发现,蔗糖或海藻糖能提高鼠李糖乳杆菌菌体存活率,而复合型保护剂能将菌体存活率提高780倍。
本试验以1株枯草芽孢杆菌(Bacillus subtilis)BS08为研究对象,研究以不同包埋顺序配置而成的复合抗热保护剂对枯草芽孢杆菌喷雾干燥菌体存活影响,通过菌粉表面形态的观察以及一级反应动力学验证微生态制剂的稳定性效果,并采用响应面法优化复合保护剂配方,制备高活菌数、耐保藏的微生态制剂,为枯草芽孢杆菌的喷雾干燥提供理论与技术支持。
1 材料与方法
1.1 材料
1.1.1 实验菌种及培养基
本研究所用枯草芽孢杆菌(Bacillus subtilis)BS08,由福州大学食品科学技术研究所保藏;菌种活化采用牛肉膏蛋白胨固体斜面培养基,种子培养采用牛肉膏蛋白胨液体培养基。
牛肉膏蛋白胨培养基(g/L):牛肉膏5、蛋白胨10、NaCl 5,pH 7.4,固体培养基加入15~20 g琼脂;发酵培养基(g/L):酵母浸膏14、无水葡萄糖14、MgSO4 1,pH 7.2~7.4。所有培养基配制完成后均于121 ℃灭菌20 min,经检验无菌后备用。
1.1.2 主要实验材料
海藻糖为食品级,山东盛源生物科技有限公司;脱脂乳为食品级,伊利集团;蔗糖为分析纯,国药集团化学试剂有限公司;明胶、阿拉伯胶、黄原胶为分析纯,西陇化工股份有限公司。
1.1.3 主要仪器与设备
SW-CJ-2FD型超净工作台,上海智诚分析仪器制造有限公司;MC-SY1913型电磁炉,中国美的集团;THL-16L型低速离心机,上海安亭科学仪器制造厂;DHG-905AA型电热恒温鼓风干燥箱,上海精宏实验设有限公司;SP-1500型喷雾干燥机,上海顺仪实验设备有限公司;HH-2型恒温水浴锅,金坛市新航仪器厂;QYSW-10B型超纯水机,重庆前沿水处理设备有限公司;Helios G4 CX型扫描电子显微镜,美国 FEI公司。
1.2 实验方法
1.2.1 菌悬液制备及喷雾干燥
枯草芽孢杆菌BS08于牛肉膏蛋白胨固体培养基活化,用接种环刮取1环接种至种子液培养基中进行种子培养,37 ℃、150 r/min恒温振荡培养 24 h;按5%(体积分数)接种量将种子液接种于发酵培养基,37 ℃、180 r/min 恒温培养48 h;将发酵菌液于5 000 r/min离心20 min,弃上清液,沉淀用等质量无菌生理盐水重新悬浮,上述操作重复2次,通过旋涡振荡制成菌悬液。将壁材溶解在去离子水中,配制成一定浓度的壁材溶液。经过均质机均质15 min,90 ℃水浴加热5 min,使壁材溶液充分溶解均匀,冷却至室温后,将菌悬液和壁材等体积混合均匀,喷雾干燥制备益生菌菌粉。设定喷雾干燥工艺参数:进料速度500 mL/h,入口温度150 ℃,出口温度84 ℃,雾化压力 0.1 MPa。
1.2.2 微胶囊壁材的选择
从蛋白质类壁材、碳水化合物类壁材以及亲水胶体类壁材3类壁材中选取脱脂乳、明胶、海藻糖、蔗糖、阿拉伯胶和黄原胶6种壁材作为保护剂进行单因素试验,分别配制质量分数为10%、15%、20%、25%的溶液,与菌悬液混合进行喷雾干燥,以未添加抗热保护剂作对照,考察不同保护剂对菌粉活菌数的影响,以确定3种较优壁材。
1.2.3 微胶囊壁材包埋顺序的确定
将选择的3种壁材按不同包埋顺序复配成抗热保护剂,与菌液混合进行喷雾干燥,测定喷雾干燥后的活菌数和芽孢数,确定最优的复配方法。
1.2.4 微胶囊稳定性评估
将壁材喷雾干燥后的菌粉在30、37、50、60 ℃ 4个温度下进行加速贮藏实验,通过平板菌落计数考察喷雾干燥菌粉的稳定性。
1.2.5 扫描电镜观察菌粉形貌
采用Helios G4 CX扫描电子显微镜,将喷雾干燥菌粉样品取少许粉末样品撒于电镜的样品盖上,喷金,于10 kV加速电压条件下进行成像观察。
1.2.6 喷雾干燥工艺条件的响应面优化
根据单因素比较试验结果,确定研究变量及水平,用Design Expert 12软件对变量进行Box-Behnken设计,以喷雾干燥后菌粉活菌数含量为响应值进行响应面分析。对不同处理方法产生的结果进行分析,并建立二次响应面回归模型,根据拟合的回归方程得出最佳工艺参数,由此确定最优响应因子水平。最后,基于最佳水平,进行验证性实验,与预测值比较。
表1 Box-Behnken 实验因素水平表
Table 1 Box-Behnken level table

水平因素A(明胶)/%B(阿拉伯胶)/%C(海藻糖)/%-120151502520201302525
2 结果与分析
2.1 枯草芽孢杆菌微生态制剂喷雾干燥壁材的选择
不同保护剂对菌粉活菌数的影响结果如图1所示,蛋白质类抗热保护剂脱脂乳以及明胶喷雾后活菌数明显高于对照组,壁材质量分数为25%时喷雾干燥后活菌数均达到最高,分别为2.65×1012、6.83×1013 CFU/g。因此,选择质量分数为25%的明胶进行后续的复配及响应面优化。蛋白质类保护剂具有起到促进乳状液形成的作用,能够将菌体包裹起来,在菌体表面形成“隔热屏障”从而实现抗热保护[12]。

图1 不同浓度的壁材对菌粉活菌数的影响
Fig.1 Effects of different concentrations of wall materials on the viable counts of bacterial powder
由于单一的糖类保护剂难以使发酵菌液聚集成粉状,因此以质量分数25%明胶和不同浓度的碳水化合物类壁材进行复配,糖类保护剂海藻糖及蔗糖在喷雾干燥后的活菌数明显高于对照组。在不同保护剂添加量的对比试验中,10%海藻糖、20%海藻糖和15%蔗糖条件下菌体活菌数较高,分别为7.27×1013、7.10×1013和3.30×1013 CFU/g。通过检测芽孢量对比其芽孢存活率,20%海藻糖,芽孢存活率达到了98%以上;而10%海藻糖,芽孢存活率仅为67%。因此,以质量分数为20%的海藻糖作为壁材时,喷雾干燥后的活菌数可以达到较优值。碳水化合物类壁材具有黏度低、固液浓度高、溶解性能好等特点。其对菌体能实现抗热保护的原因是因为糖类物质能够通过结构中的羟基与细胞膜、细胞器膜或蛋白质极性基团形成众多氢键或在蛋白质表面形成水化层,可以在细胞失水的时候进行水置换,从而保护细胞膜及蛋白质生物大分子的结构稳定性[13]。如海藻糖与益生菌脂质膜上的极性基团具有良好的亲和性,从而降低干燥时的相转移温度,对益生菌有更好的保护作用,因而能够提高益生菌的存活率[14-15]。
胶体类抗热保护剂黄原胶和阿拉伯胶喷雾后活菌数随着使用浓度的变化有着较大差异,15%黄原胶和20%阿拉伯胶喷雾后的活菌数分别为4.42×1013和6.48×1013 CFU/g。然而以黄原胶为壁材时,集粉率较低,且喷雾后的菌粉黏性较大,不容易分散。因此选择20%阿拉伯胶进行后续的复配及响应面优化。亲水胶体类壁材具有优越的成膜性,在宽pH值范围的体系中仍具有好的乳液稳定性,并且用量少[16]。
2.2 喷雾干燥微胶囊壁材包埋顺序的确定
蛋白质类、糖类和亲水胶体类壁材的抗热保护机制不同,各有优越特性,三者联用能起到更好的抗热保护效果。根据单因素试验,得出各类壁材的最佳使用浓度:明胶25%、阿拉伯胶20%、海藻糖20%。因此选择明胶、阿拉伯胶、海藻糖联用作为复合抗热保护剂,为充分发挥其保护效果,进一步研究不同的包埋顺序配制成的复合保护剂对喷雾干燥后菌粉的保护效果,根据由内层到外层包埋顺序的不同分为4组:A组(先明胶后阿拉伯胶)、B组(先阿拉伯胶后明胶)、C组(明胶+阿拉伯胶+海藻糖)和D组(阿拉伯胶+明胶+海藻糖),以喷雾干燥后菌粉的活菌数和稳定性为指标,以确定最优的壁材包埋顺序,并通过扫描电镜观察菌粉外观形貌。
2.2.1 活菌数测定
3种壁材按不同包埋顺序配制成抗热保护剂,与菌液混合进行喷雾干燥,测定喷雾干燥后的活菌数和芽孢数,结果如图2所示。4组中,C组活菌数最高,为1.42×1014CFU/g,其次为B、D组,均为1.37×1014CFU/g。3种壁材都具有价格低廉的优点。明胶是一种优良的保护性胶体,也是一种良好的乳化剂和稳定剂。通常明胶质量浓度越大,陈化温度越低、pH越接近等电点,明胶越容易形成胶凝网络结构且网络越致密[17],试验所用明胶等电点在pH 4.5~5.3。阿拉伯胶能够在每1个油滴周围形成保护膜,使乳化液增加稳定性,是非常良好的天然水包油型乳化稳定剂。阿拉伯胶的自然pH呈弱酸性,在质量分数为25%时,pH在4~5,因此与明胶溶液混溶,能够起到协同作用,效果更佳。海藻糖化学结构中的羟基可以极性基团形成氢键,代替极性基团周围丢失的水分子,形成水化层,维持生物大分子天然结构与细胞(器)膜的完整性[18],但单独使用时无法有效地包埋菌体,通常与蛋白、胶体等复配使用,以提高微胶囊膜的致密性[14]。
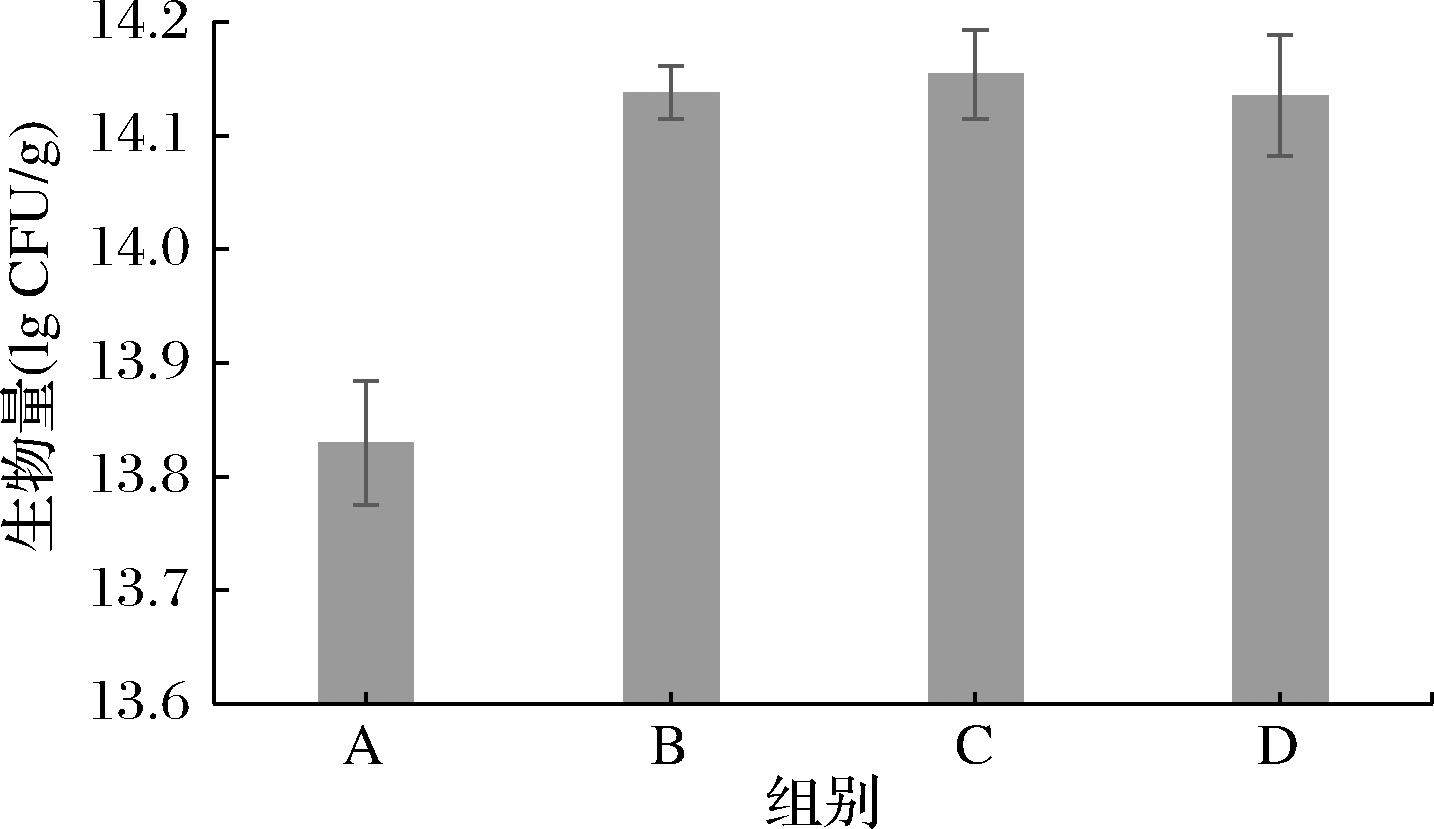
图2 不同顺序包埋壁材对菌粉活菌数的影响
Fig.2 Effect of wall materials embedded in different order on the viable counts of bacterial powder
2.2.2 喷雾干燥后菌粉稳定性评估
微生物的失活速率与菌种特性以及所处营养条件与温度有关,其失活过程符合一级反应动力学[19-20],如公式(1)所示。
dN/dt=-kN
(1)
移项积分得:
ln(Nt/N0)=-kt
lgNt=lgN0-kt/2.303
式中:N0,初始活菌数,CFU/g;Nt,一定时刻残存活菌数,CFU/g;k,失活常数;t,失活时间,h。
同时,加速实验中的经典恒温法的理论依据是Arrhenius的指数定律,其对数形式见公式(2)。
lgk=-E/2.303RT+lgA
(2)
式中:A,比例常数;E,微生物失活所需活化能,4.186 J/mol;T,温度,K。
在30、37、50、60 ℃ 4个温度下将以4种不同包埋顺序喷雾干燥所得的菌粉进行加速贮藏实验,结果如表2所示。
表2 不同存放温度下菌粉的稳定性
Table 2 Stability of bacterial powder at different storage temperatures

组别存放时间/h活菌数/(CFU·g-1)30 ℃37 ℃50 ℃60 ℃A03.20×10143.20×10143.20×10143.20×1014162.94×10142.90×10142.87×10142.70×1014482.80×10142.67×10141.42×10148.60×1013722.32×10142.09×10144.80×1013962.04×10141.82×10143.76×10132.82×10131201.38×10141.66×10131.33×1013B02.68×10142.68×10142.68×10142.68×1014162.28×10142.18×10141.01×10141.67×1014481.95×10141.70×10147.20×10135.30×1013721.63×10141.32×10143.80×1013963.60×10132.70×10131201.52×10148.70×10132.10×10139.00×1012C04.12×10144.12×10144.12×10144.12×1014164.09×10143.74×10143.55×10142.68×1014484.06×10143.60×10143.34×10141.78×1014723.94×10143.40×10142.66×10141.40×1014963.68×10142.88×10142.34×10148.30×10131203.10×10142.32×10142.04×10143.80×1013D04.30×10144.30×10144.30×10144.00×1014164.15×10143.88×10143.54×10142.98×1014483.88×10143.60×10143.32×10141.66×1014723.65×1014963.27×10143.02×10142.97×10145.92×10131202.97×10142.78×10141.84×10142.46×1013
将表2数据以 lgN-t作图,并作线性回归,求出的k值与温度T作lgk-T图,得到4个回归方程如表3。最终,通过一级反应动力学分析,可以对4组菌粉的稳定性进行预测。
表3 加速贮藏实验回归方程
Table 3 Regression equation of accelerated storage experiment

组别回归方程Algk=-2794.1/T+6.538 8Blgk=-2560.4/T+ 5.816 6Clgk=-2995.4/T+6.849 2 Dlgk=-2721.9/T+6.026 2
由表4可知,当3种壁材溶液复配时,胶囊中的枯草芽孢杆菌得到了有效的保护,其中以C组(明胶-阿拉伯胶-海藻糖)菌粉稳定性最佳。加速试验表明,若4 ℃存放1年后的活菌数为1.57×1014 CFU/g,数量级不变;在25 ℃条件存放1年后活菌数也仅下降2个数量级。
表4 菌粉储藏1年活菌数 单位:CFU/g
Table 4 Viable counts of bacterial powder stored for one year

组别储藏温度4 ℃25 ℃A2.60×10138.19×108B7.89×10127.26×107C1.57×10141.59×1012D1.05×10144.30×1011
2.2.3 扫描电镜观察
喷雾干燥后的菌粉在扫描电镜下观察到的形貌如图3所示,从表观上解释了不同包埋顺序的抗保护剂的保护效果。不同的抗热保护剂不同,得到的颗粒的形貌也不尽相同。当将阿拉伯胶与明胶两种壁材溶液进行复配时,得到的菌粉颗粒变形严重,出现凹陷或皱缩的形貌特征,这是由于高温导致溶质在汽化的液滴表面迅速析出,并形成壳层,壳层内溶液温度不断上升至高温,使内部气化分子在壳层最薄弱处克服阻力而冲出壳层,外壳产生孔洞皱缩。当将阿拉伯胶、明胶与海藻糖3种壁材溶液进行复配时,如图3-c和图3-d所示,菌粉颗粒外观呈现平滑完整的球形颗粒,仅少量菌粉颗粒因为高温出现孔洞导致内容物流出的现象,大部分保持良好完整的形貌特征。可见,海藻糖的加入提高了微胶囊膜的致密性,从而更有效地保护胶囊中的物质不被高温高压所破坏。海藻糖是多种生物面临脱水胁迫时由机体分泌的保护性双糖[21],它的保护机制主要源于两点:(1)它可以在生物组织脱水时替代水分子,保持生物大分子的结构不因脱水而剧变[22];(2)它在干燥状态下具有很高的玻璃态转化温度,因此形成的干颗粒通常处于无定形态,对其他处于结晶态的糖类相比,无定形态的高黏度可减少有害的化学反应[21]。但亦有研究指出,当海藻糖被用作单一的保护载体时,它的保护作用非常有限[18,23]。因此,通常将海藻糖与其他类型的保护剂联用,起到协同保护的效果。

a-明胶+阿拉伯胶;b-阿拉伯胶+明胶; c-明胶+阿拉伯胶+海藻糖;d-阿拉伯胶+明胶+海藻糖
图3 不同顺序包埋壁材所得菌粉的扫描电镜图
Fig.3 Scanning electron microscope (SEM) of bacteria powder by embedding wall materials in different order
2.3 枯草芽孢杆菌微生态制剂喷雾干燥复合壁材响应面优化
2.3.1 Box-Behnken试验结果
采用Design-Expert 12软件对3个因素分别在3个水平上进行Box-Behnken设计,以喷雾干燥菌粉的活菌数(CFU/g)为响应值,对枯草芽孢杆菌微生态制剂制备工艺条件进行优化,如表5所示。根据响应曲面结果的方差分析(表6)可知,A2、B2、C2对菌粉活菌数的影响极显著,B、C影响显著,说明壁材中的明胶浓度、阿拉伯胶浓度、海藻糖浓度是喷雾干燥过程中的重要控制因素。模型F=15.19,P=0.000 8<0.05,表明模型方程显著;失拟项P=0.631 5>0.05,差异无统计学意义,说明数据中无异常点,无需引入更高次数的项,模型适当。因素B的P值最小,说明阿拉伯胶浓度对活菌率的影响最显著,3个因素对活菌率影响的次序为B>C>A,即阿拉伯胶浓度>海藻糖浓度>明胶浓度。
本模型相关系数R2=0.951 3,说明因变量与自变量之间的线性关系显著,校正相关系数R2Adj=0.888 6,说明该模型能解释约88.8%(>80%)响应值的变化,进一步表明方程的拟合度较好。根据软件得出回归模型的各因素三维响应面图以及等高线图如图4可知曲面图发生弯曲,因此根据显著性检验与响应面图可以看出,3个因素对Y都是非线性的。
表5 Box-Behnken试验设计及结果
Table 5 Design and experiment results of Box-Behnken

组别w(明胶)/%w(阿拉伯胶)/%w(海藻糖)/%活菌数/(CFU·g-1)12520204.60×101422020157.20×101332515158.68×101342015203.20×101353020156.60×101362020251.20×101473015205.75×101383020252.50×101493025203.21×1014102520205.80×1014112525252.80×1014122520204.38×1014132520205.90×1014142525151.92×1014152520205.50×1014162515252.16×1014172025202.10×1014
表6 响应曲面结果的方差分析
Table 6 Variance analysis results of response surface
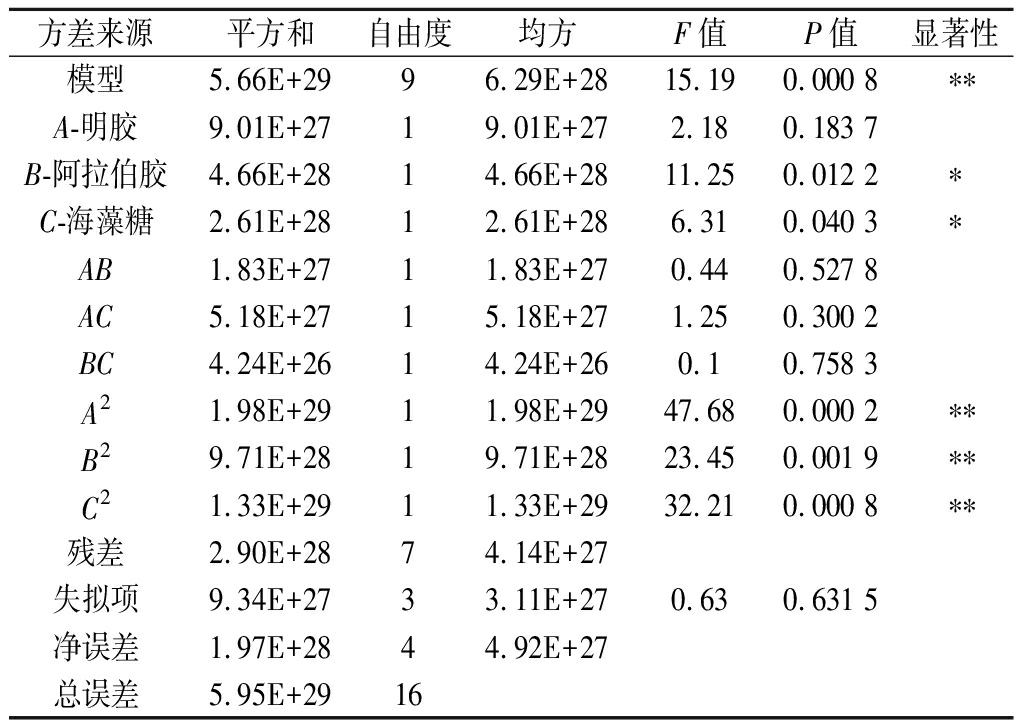
方差来源平方和自由度均方F值P值显著性模型5.66E+2996.29E+2815.190.000 8∗∗A-明胶9.01E+2719.01E+272.180.183 7B-阿拉伯胶4.66E+2814.66E+2811.250.012 2∗C-海藻糖2.61E+2812.61E+286.310.040 3∗AB1.83E+2711.83E+270.440.527 8AC5.18E+2715.18E+271.250.300 2BC4.24E+2614.24E+260.10.758 3A21.98E+2911.98E+2947.680.000 2∗∗B29.71E+2819.71E+2823.450.001 9∗∗C21.33E+2911.33E+2932.210.000 8∗∗残差2.90E+2874.14E+27失拟项9.34E+2733.11E+270.630.631 5净误差1.97E+2844.92E+27总误差5.95E+2916
注:*差异显著,P<0.05;** 差异极显著,P<0.01
经二次回归拟合后得回归方程:
活菌数=-9.944 55×1015+3.973 88×1014A+2.451 53×1014B+2.684 90×1014C+8.550 00×1011AB+1.440 00×1012AC-4.120 00×1011BC-8.663 50×1012A2-6.075 50×1012B2-7.120 50×1012C2
由回归方程得到预测喷雾干燥菌粉最大值为5.985 12×1014CFU/g。得到各因素最佳的质量分数配比为明胶(A)26%,阿拉伯胶(B)24%,海藻糖(C)为24%。这与添加单个保护剂相比,活菌数提高了1个数量级;与无添加任何保护剂的菌粉活菌数相比,提高了3个数量级。

a-明胶和阿拉伯胶;b-明胶和海藻糖;c-阿拉伯胶和海藻糖
图4 海藻糖、明胶和阿拉伯胶添加量的交互作用对活菌数的影响的响应面图
Fig.4 Response surface plots of interaction between trehalose, gelatin and arabic gum addition on on the viable counts
2.3.2 验证性试验
经过响应面分析法优化后的工艺条件为:明胶(A)质量分数为 26%,阿拉伯胶(B)质量分数为24%,海藻糖(C)质量分数为24%。预测喷雾干燥菌粉最大值为5.98×1014CFU/g。基于最佳工艺条件,进行3组验证性试验。得到实际值平均数为5.80×1014CFU/g,与预测值相吻合。
3 结论
研究结果表明,蛋白质类保护剂、碳水化合物类保护剂和亲水胶体类保护剂联用作为复合抗热保护剂比单一保护剂抗热保护效果更好,能较好地提高菌体的热耐受性。同时,以明胶-阿拉伯胶-海藻糖为包埋顺序配制的保护剂对枯草芽孢杆菌的保护效果最好,且通过稳定性评估,产品在4 ℃环境中贮藏1年,预计活菌数可保持在1014 CFU/g以上,数量级不变。采用中心组合设计响应面优化技术对复合抗热保护剂配方进行了优化,获得了优化的抗热保护剂组分,即明胶添加量26%、阿拉伯胶24%和海藻糖添加量24%。在此最优条件下,活菌数为5.80×1014CFU/g,与无添加任何保护剂相比,提高了3个数量级。
[1] ADHIKARI P A, KIM W K.Overview of prebiotics and probiotics:Focus on performance, gut health and immunity:A review[J].Annals of Animal Science, 2017, 17(4):949-966.
[2] STANDEN B T, RODILES A, PEGGS D L, et al.Modulation of the intestinal microbiota and morphology of tilapia, Oreochromis niloticus, following the application of a multi-species probiotic[J].Applied Microbiology and Biotechnology, 2015, 99(20):8 403-8 417.
[3] 张晓宁, 陈境, 麻丽丽, 等.影响冷冻及喷雾干燥制备益生菌发酵剂活性因素分析[J].中国乳品工业, 2021, 49(4):29-34.
ZHANG X N, CHEN J, MA L L, et al.Analysis of the influence of different factors on the activity of probiotics producing fermentation agents by freezing and spray drying[J].China Dairy Industry, 2021, 49(4):29-34.
[4] KESHANI S, DAUD W R W, NOUROUZI M M, et al.Spray drying:An overview on wall deposition, process and modeling[J].Journal of Food Engineering, 2015, 146:152-162.
[5] 田文静, 孙玉清, 刘小飞.益生菌微胶囊技术及其在食品中的应用研究进展[J].食品工业科技, 2019, 40(16):354-362.
TIAN W J, SUN Y Q, LIU X F.Research progress on microcapsulation technology and its application in food[J].Science and Technology of Food Industry, 2019, 40(16):354-362.
[6] GARRE E, RAGINEL F, PALACIOS A, et al.Oxidative stress responses and lipid peroxidation damage are induced during dehydration in the production of dry active wine yeasts[J].International Journal of Food Microbiology, 2010, 136(3):295-303.
[7] FU N, WOO M W, SELOMULYA C, et al.Inactivation of Lactococcus lactis ssp.cremoris cells in a droplet during convective drying[J].Biochemical Engineering Journal, 2013, 79:46-56.
[8] 张瑞. 果胶+明胶/乳清蛋白双层微胶囊包埋鼠李糖乳杆菌研究[D].哈尔滨:东北农业大学, 2017.
ZHANG R.Study on Lactobacillus rhamnosus treated by Pectin+Gelatin/whey protein double layer microcapsules[D].Harbin:Northeast Agricultural University, 2017.
[9] KHEM S, SMALL D M, MAY B K.The behaviour of whey protein isolate in protecting Lactobacillus plantarum[J].Food Chemistry, 2016, 190:717-723.
[10] G MEZ ZAVAGLIA A, TYMCZYSZYN E, DE ANTONI G, et al.Action of trehalose on the preservation of Lactobacillus delbrueckii ssp.bulgaricus by heat and osmotic dehydration[J].Journal of Applied Microbiology, 2003, 95(6):1 315-1 320.
MEZ ZAVAGLIA A, TYMCZYSZYN E, DE ANTONI G, et al.Action of trehalose on the preservation of Lactobacillus delbrueckii ssp.bulgaricus by heat and osmotic dehydration[J].Journal of Applied Microbiology, 2003, 95(6):1 315-1 320.
[11] 肖怀秋, 李玉珍, 林亲录, 等.枯草芽孢杆菌Prob1822复合抗热保护剂的研究[J].中国酿造, 2019, 38(10):49-54.
XIAO H Q, LI Y Z, LIN Q L, et al.Compound anti-thermal protectant of Bacillus subtilis Prob1822[J].China Brewing, 2019, 38(10):49-54.
[12] AGUDELO J, CANO A, GONZ LEZ-MART
LEZ-MART NEZ C, et al.Disaccharide incorporation to improve survival during storage of spray dried Lactobacillus rhamnosus in whey protein-maltodextrin carriers[J].Journal of Functional Foods, 2017, 37:416-423.
NEZ C, et al.Disaccharide incorporation to improve survival during storage of spray dried Lactobacillus rhamnosus in whey protein-maltodextrin carriers[J].Journal of Functional Foods, 2017, 37:416-423.
[13] 王岩, 刘宇, 侯美如, 等.海藻糖复配保护剂对三种益生菌稳定性影响效果的试验研究[J].农业开发与装备, 2015(12):58-59.
WANG Y, LIU Y, HOU M R, et al.Experimental study on the effect of trehalose compound protectant on the stability of three probiotics[J].Agricultural Development & Equipments, 2015(12):58-59.
[14] 张玉华, 孟一, 凌沛学, 等.海藻糖和透明质酸对冻干双歧杆菌细胞的保护作用[J].食品科学, 2010, 31(7):236-241.
ZHANG Y H, MENG Y, LING P X, et al.Protective mechanisms of trehalose and hyaluronic acid on lyophilized Bifidobacterium longum[J].Food Science, 2010, 31(7):236-241.
[15] ARSLAN S, ERBAS M, TONTUL I, et al.Microencapsulation of probiotic Saccharomyces cerevisiae var.boulardii with different wall materials by spray drying[J].LWT-Food Science and Technology, 2015, 63(1):685-690.
[16] 章智华, 钟舒睿, 彭飞, 等.微胶囊壁材及制备技术的研究进展[J].食品科学, 2020, 41(9):246-253.
ZHANG Z H, ZHONG S R, PENG F, et al.Progress in microcapsule wall materials and preparation techniques[J].Food Science, 2020, 41(9):246-253.
[17] 陈海华. 明胶的凝胶特性及多糖对明胶凝胶特性的影响[J].粮油加工, 2009(5):130-133.
CHEN H H.Gelation characteristics of gelatin and effects of polysaccharides on gelatin properties[J].Cereals and Oils Processing, 2009(5):130-133.
[18] HOOBIN P, BURGAR I, ZHU S C, et al.Water sorption properties, molecular mobility and probiotic survival in freeze dried protein-carbohydrate matrices[J].Food & Function, 2013, 4(9):1 376-1 386.
[19] 姚卫蓉, 钱科, 姚惠源.双歧杆菌活菌粉的制备[J].无锡轻工大学学报, 2002, 21(6):569-573.
YAO W R, QIAN K, YAO H Y.The applications of the porous starch II:Bifidobacterium powder[J].Journal of Wuxi University of Light Industry, 2002, 21(6):569-573.
[20] 赵瑞香, 王大红, 孙俊良, 等.嗜酸乳杆菌微胶囊的热稳定性及热动力学研究[J].农业工程学报, 2006, 22(10):222-225.
ZHAO R X, WANG D H, SUN J L, et al.Thermal stability and thermodynamics of Lactobacillus acidophilus microcapsule[J].Transactions of the Chinese Society of Agricultural Engineering, 2006, 22(10):222-225.
[21] KILBURN D, TOWNROW S, MEUNIER V, et al.Organization and mobility of water in amorphous and crystalline trehalose[J].Nature Materials, 2006, 5(8):632-635.
[22] CROWE L M.Lessons from nature:The role of sugars in anhydrobiosis[J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2002, 131(3):505-513.
[23] HU Y Q, WU T T, WU C H, et al.Formation and optimization of chitosan-nisin microcapsules and its characterization for antibacterial activity[J].Food Control, 2017, 72:43-52.