漆酶(EC 1.10.3.2)是一种多铜氧化酶,可氧化包括酚类、非酚类物质和一些无机化合物等在内的多种底物[1]。因其催化反应过程的唯一副产物是水,被认为是一种环保型绿色催化剂[2],在食品[3]、纺织[4]、环境修复[5]和造纸[6]等方面有重要应用。漆酶来源广泛,在细菌[7]、真菌[8]、植物[9]和动物[10]中均有发现,但是,野生型漆酶的总体产酶水平较低,不利于实现工业化生产。
随着基因工程和酶工程的迅速发展,大肠杆菌(Escherichia coli)因其发酵周期短、操作简单、产量高等优势,已成为重组蛋白生产的常用宿主[11]。虽然包括Klebsiella pneumoniae[12]、Proteus hauseri[13]和Streptomyces cyaneus[14]等多种细菌漆酶均成功表达于E.coli中,但是表达形式主要还是胞内酶。针对胞内酶,可通过添加溶菌酶或者超声波破碎法回收,但前者增加了处理成本,而后者会因操作过程中不可控的机械作用或者破碎后产生的细胞碎片大小不一而影响蛋白回收效果,均存在弊端。有研究通过共表达磷脂酶C[15]或者α-溶血素分泌系统和YebF分泌系统[16]能将漆酶从胞内分泌至胞外,前者胞外酶活力可达到1 257.22 U/L而后者可达2 401.3 U/L。上述研究虽实现了胞外表达,但是产量不高。
在细菌中,核糖体结合位点(ribosome binding site,RBS)和其他调节性RNA序列是翻译起始和蛋白质表达的有效控制元件[17],适当调整RBS序列可以大大提高蛋白质的表达水平[18]。有研究通过RBS策略组合优化了四氢嘧啶合成的3个途径酶,将四氢嘧啶的产量提升至521.24 mg/L[19]。源自噬菌体phi X174的裂解蛋白E可以帮助细胞裂解,原理是通过在革兰氏阴性菌细胞膜上形成一个跨膜孔道结构,细胞胞质内容物会在渗透压的作用下从该孔道排出[20]。此时,细菌会变成不含核酸、核糖体及其他内容物的空壳,能有效实现胞内酶的胞外生产。
本研究将枯草芽孢杆菌(Bacillus subtilis)来源的漆酶CotA表达于E.coli BL21(DE3),通过核糖体结合位点、诱导表达条件及共表达裂解蛋白,显著提高了CotA的分泌表达水平。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
菌株E.coli JM109,E.coli BL21(DE3)和质粒pCDF Duet-E保存于本研究室。委托苏州金唯智公司按照E.coli密码子偏好性将漆酶CotA(Accession WP_003243170.1)合成于载体pET24a中,宿主为E.coli JM109。
1.1.2 试剂
柱回收试剂盒,Thermo fisher公司;大肠杆菌感受态制备试剂盒、Prime STAR Max DNA聚合酶,大连TaKaRa公司;卡那霉素、质粒提取试剂盒、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、ABTS,上海生工生物工程(上海)股份有限公司;一步克隆试剂盒,南京诺唯赞公司;酵母粉、胰蛋白胨,英国OXOID公司;蛋白marker,上海翊圣生物公司;蛋白电泳Loading buffer、Bis-Tris 预制凝胶,Invitrogen 公司。其他常规试剂及药品为国产或进口分装。
1.1.3 培养基
LB固体培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,琼脂粉20,自然pH。
LB液体种子培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,自然pH。
TB液体发酵培养基(g/L):胰蛋白胨12,酵母粉24,丙三醇5,KH2PO4 2.31,K2HPO4 12.54,自然pH。
1.2 实验方法
1.2.1 产漆酶重组菌株的构建与表达
委托苏州金唯智公司按照E.coli密码子偏好性合成CotA(Accession WP_003243170.1),所用载体为pET24a,宿主为E.coli JM109。将菌株E.coli JM109/pET24a-CotA接种至含有卡那霉素抗性的LB培养基中37 ℃,220 r/min条件下培养12 h后,按照质粒提取试剂盒说明书提取质粒pET24a-CotA,将漆酶表达质粒pET24a-CotA转化入感受态细胞E.coli BL21(DE3),得到重组菌株CotA-RBS。将CotA-RBS接种于含有卡那霉素抗性的LB培养基中培养12 h,按照2%(体积分数,下同)接种量接种于TB培养基中,37 ℃,220 r/min条件下培养至OD600约为0.8时,加入1 mmol/L Cu2+和0.1 mmol/L IPTG,20 ℃,220 r/min条件下继续发酵至28 h。定时取样测定酶活力和OD600,将最高酶活力对应的样品处理后进行SDS-PAGE验证。
1.2.2 重组RBS菌株的构建与表达
基于在线软件RBS Calculator和RBS Library Calculator(https://www.denovodna.com/software/)预测具有不同翻译起始效率的RBS序列(表1)。以pET24a-CotA为模板,采用一步克隆法将质粒pET24a-CotA上原始RBS序列替换成所选RBS序列,按照表2所示引物进行PCR,扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,循环34次;最后72 ℃延伸10 min。得到扩增片段后回收纯化,步骤参考柱回收说明书。将经过纯化的片段转化进感受态细胞E.coli JM109中,挑取3~5个转化子送公司进行验证。将验证正确的菌株重新活化培养12 h后,参考质粒提取说明书提取质粒,得到重组质粒pET24a-CotA-RBS1、pET24a-CotA-RBS2、pET24a-CotA-RBS3、pET24a-CotA-RBS4和pET24a-CotA-RBS5。
表1 本研究所选RBS序列
Table 1 The sequence of selected RBS in this study

序列名称翻译起始速率碱基序列RBS010 118.285′-TTTGTTTAACTTTAAGAAGGAGA-3′RBS1882 376.365′-CGGCTAGAGGAATTTACCATACTAATTTGATTTAAGGAGGTTTTTTT-3′RBS2151 570.205′-GGAAUUGUGAGCGGAUAACAAUUCCCCUCUAGAAAUAAUUGUGAUUAAUGUUAAUAAGGAGGUUUUUAU-3′RBS378 760.665′-GGAAUUGUGAGCGGAUAACAAUUCCCCUCUAGAAAUAAUUUUGUUUAACAUUAAUAAGGAGGUAUUCAU-3′RBS412 901.815′-GGAAUUGUGAGCGGAUAACAAUUCCCCUCUAGAAAUAAUUUUGUUUAAUUUUAAGAGGGAGGUAUACAU-3′RBS57 695.435′-GGAAUUGUGAGCGGAUAACAAUUCCCCUCUAGAAAUAAUUUUGUUUAAGUUUAAGAGGGAGGUAUAGGU-3′
表2 本研究所用引物
Table 2 The primers used in this study

引物名称碱基序列RBS1-F5′-AGGAATTTACCATACTAATTTGATTTAAGGAGGTTTTTTTATGACGCTGGAGAAATTTGT-3′RBS1-R5′-AAATCAAATTAGTATGGTAAATTCCTCTAGCCGATTATTTCTAGAGGGGAATTGTTATCC-3′RBS2-F5′-TGTGATTAATGTTAATAAGGAGGTTTTTATATGACGCTGGAGAAATTTGTT-3′RBS2-R5′-ATAAAAACCTCCTTATTAACATTAATCACAATTATTTCTAGAGGGGAATTGTTATCC-3′RBS3-F5′-TTTGTTTAACATTAATAAGGAGGTATTCATATGACGCTGGAGAAATTTGTT-3′RBS3-R5′-ATGAATACCTCCTTATTAATGTTAAACAAAATTATTTCTAGAGGGGAATTGTTATCC-3′RBS4-F5′-TTTGTTTAATTTTAAGAGGGAGGTATACATATGACGCTGGAGAAATTTGTT-3′RBS4-R5′-ATGTATACCTCCCTCTTAAAATTAAACAAAATTATTTCTAGAGGGGAATTGTTATCC-3′RBS5-F5′-TTTGTTTAAGTTTAAGAGGGAGGTATAGGTATGACGCTGGAGAAATTTGTT-3′RBS5-R5′-ACCTATACCTCCCTCTTAAACTTAAACAAAATTATTTCTAGAGGGGAATTGTTATCC-3′
注:下划线表示一步克隆对应的同源臂序列
将各重组质粒转化进感受态细胞E.coli BL21(DE3)中,构成重组RBS替换菌株CotA-RBS1、CotA-RBS2、CotA-RBS3、CotA-RBS4和CotA-RBS5。将重组菌株CotA-RBS和各重组RBS替换菌株划线至含有卡那霉素抗性的LB固体培养基中培养,将单菌落接入LB液体培养基中活化,按照2%接种量转接至TB发酵培养基中,37 ℃,220 r/min条件下培养至OD600约为0.8时,依次加入终浓度为1 mmol/L Cu2+和0.1 mmol/L IPTG诱导表达,在20 ℃,220 r/min条件下培养20 h后取样测定胞内酶活力,确定最优RBS替换菌株。
1.2.3 正交实验优化诱导条件
为了进一步提高重组漆酶的表达水平,以诱导OD600、发酵温度、IPTG诱导浓度和Cu2+添加浓度为因素,设计如表3所示正交实验表。在正交实验条件下发酵CotA-RBS5并比较不同条件对酶表达水平的影响。通过计算各条件下的k值和极差R,确定影响CotA表达的关键因素及最佳诱导条件。
表3 正交实验因素与水平
Table 3 Factors and levels of orthogonal experimental test

水平因素A(诱导时OD600)B(发酵温度)/℃C(IPTG浓度)/(mmol·L-1)D(Cu2+浓度)/(mmol·L-1)10.8200.050.520.8250.2130.8300.1241.2200.1151.2250.05261.2300.20.571.5200.2281.5250.10.591.5300.051
1.2.4 共同表达裂解蛋白E释放胞内酶
为促进漆酶的胞外生产,将裂解蛋白表达质粒pCDF Duet-E与pET24a-CotA-RBS5共同转化入感受态细胞E.coli BL21(DE3)中,得到重组共表达菌株CotA-RBS5-E。利用最优诱导条件进行发酵培养。分别发酵至不同OD600时加入终浓度为2 mmol/L的阿拉伯糖诱导表达裂解蛋白E,定时取样测定胞外酶活力和OD600。
1.2.5 漆酶活性测定
漆酶活性测定采用ABTS法:总体系为3 mL,将100 mmol/L 柠檬酸-柠檬酸钠缓冲液(pH 3.5)和底物1 mmol/L ABTS放入30 ℃水浴锅中预热5 min后向石英比色皿中依次加入2.4 mL柠檬酸-柠檬酸钠缓冲液(pH 3.5)、0.1 mL经适当稀释的酶液及0.5 mL底物ABTS。每分钟氧化1 μmol底物ABTS所需要的酶含量为一个漆酶活力单位(U)。酶活力按公式(1)计算:
酶活力![]()
(1)
式中:ΔOD/Δt,每分钟吸光值的变化;ε,显色物的摩尔消光系数L/(mmol·cm)。底物ABTS在420 nm处的摩尔消光系数为ε=36 L/(mmol·cm)。
1.2.6 SDS-PAGE电泳分析
发酵液12 000 r/min离心10 min后的上清液即为胞外可溶部分,菌体部分用柠檬酸-Na2HPO4缓冲液(pH 6.0)重悬进行超声波破壁,超声波细胞破碎仪工作条件为:超声波2 s, 暂停4 s,总时长5 min。将破碎后的样品低温高速离心20 min,上清液即为重组菌株胞内可溶部分,菌体沉淀为胞内不溶部分,沉淀用柠檬酸-Na2HPO4缓冲液(pH 6.0)重悬,将所有样品进行SDS-PAGE蛋白电泳验证。蛋白样品上样量为30 μL,V(蛋白样品上样量)∶V(4×SDS蛋白上样缓冲液)=3∶1混合、95 ℃煮沸15 min,进行SDS-PAGE凝胶电泳,设置恒压120 V。
2 结果与讨论
2.1 产漆酶重组菌株的构建与表达
基于E.coli密码子偏好性合成漆酶CotA(Accession WP_003243170.1)基因,并克隆至pET24a的RBS序列之后,得到表达质粒pET24a-CotA(图1)。
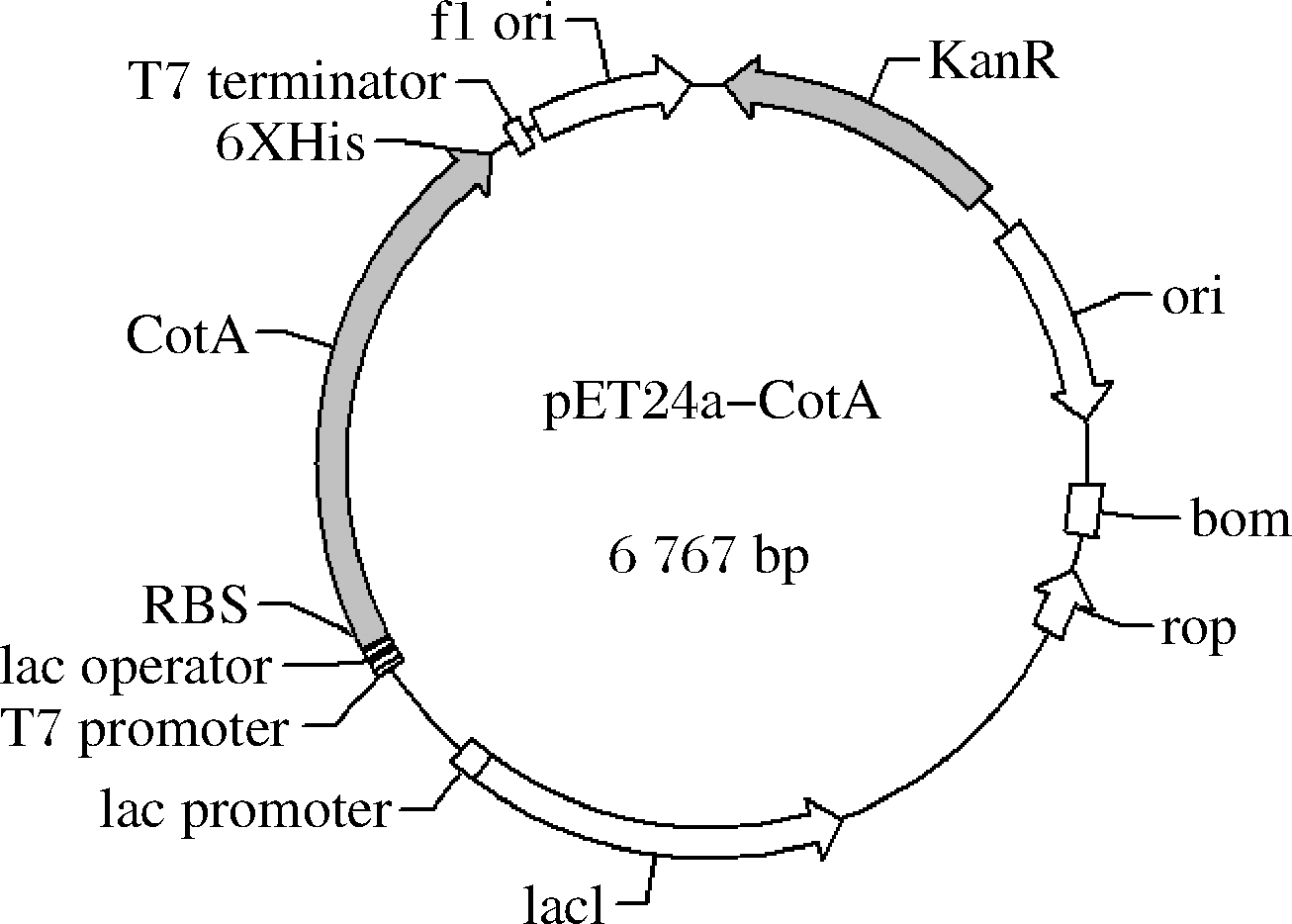
图1 漆酶表达质粒pET24a-CotA
Fig.1 The plasmid pET24a-CotA expressed for laccase
将表达质粒转入感受态细胞E.coli BL21(DE3)中得到产漆酶重组菌株CotA-RBS。为探究漆酶CotA的表达情况,设定基本诱导条件为:诱导起始OD600 0.8,诱导剂IPTG终浓度0.1 mmol/L,Cu2+添加终浓度1 mmol/L,20 ℃、220 r/min条件下发酵28 h,测定其发酵过程曲线。如图2-a所示,随着细胞密度的增加,胞内酶活力不断升高;发酵20 h,酶活力达到最大(449 U/L)。SDS-PAGE分析显示,胞内可溶和不溶部分均有CotA条带(理论量58.5 kDa),且胞内不溶部分条带明显粗于可溶部分(图2-b)。上述结果表明,CotA在E.coli成功表达,但大部分以包涵体形式存在。大量的研究表明,翻译速率过快导致酶分子错误折叠是包涵体形成的首要原因。本研究采用了T7强启动子及其RBS,可能使CotA的转录和翻译均处于较高水平。此外,Cu2+有助于漆酶的折叠与组装[21]。重组菌采用的发酵培养基中的Cu2+浓度并不高(1 mmol/L)。因此,进一步优化RBS序列及诱导表达条件将有助于CotA的活性表达。

a-发酵过程曲线;b-SDS-PAGE验证
图2 重组菌株CotA-RBS的表达情况分析
Fig.2 Expression analysis of the recombinant strain CotA-RBS
2.2 重组RBS替换菌株的构建与表达
蛋白质翻译过程的速率主要由翻译起始速率和翻译延伸速率决定,其中起始速率主要受mRNA上的RBS序列、起始密码子及翻译起始区二级结构影响[22]。为了进一步提高漆酶的表达水平,对RBS序列进行优化,探究不同翻译起始速率对表达水平的影响。在T7启动子和CotA序列条件下,在线软件RBS Calculator推荐的RBS序列(RBS1)的翻译起始速率是原始RBS序列(RBS0)的87.2倍(表1)。在上述同样的邻近序列条件下,RBS Library Calculator共推荐具有不同翻译起始速率的364个RBS序列。为提高所选RBS序列的代表性,基于翻译起始速率将上述RBS序列分为4组(160 000~100 000、100 000~50 000、50 000~10 000、10 000~0),依次选取RBS2、RBS3、RBS4和RBS5进行表达验证(表1)。构成重组RBS替换菌株后测定胞内漆酶的表达水平。如图3所示,重组菌株胞内CotA-RBS5较出发菌株的449 U/L提高了1.75倍,达到1 236 U/L,而其他翻译起始速率高于出发菌株的重组菌株的胞内酶活力均有不同程度的降低。上述结果表明,较低的翻译起始速率有利于漆酶的高效表达。研究发现,在细菌表达系统中,过高的翻译起始速率可能降低核糖体与mRNA翻译起始区域结合的稳定性[23]。此外,高的翻译起始速率还会导致后续翻译过程中核糖体之间发生碰撞的概率提高,引起核糖体脱落及表达效率下降[23]。因此,在后续工作中将进一步分析比RBS5翻译起始速率更低或者接近的RBS对漆酶表达水平的影响。
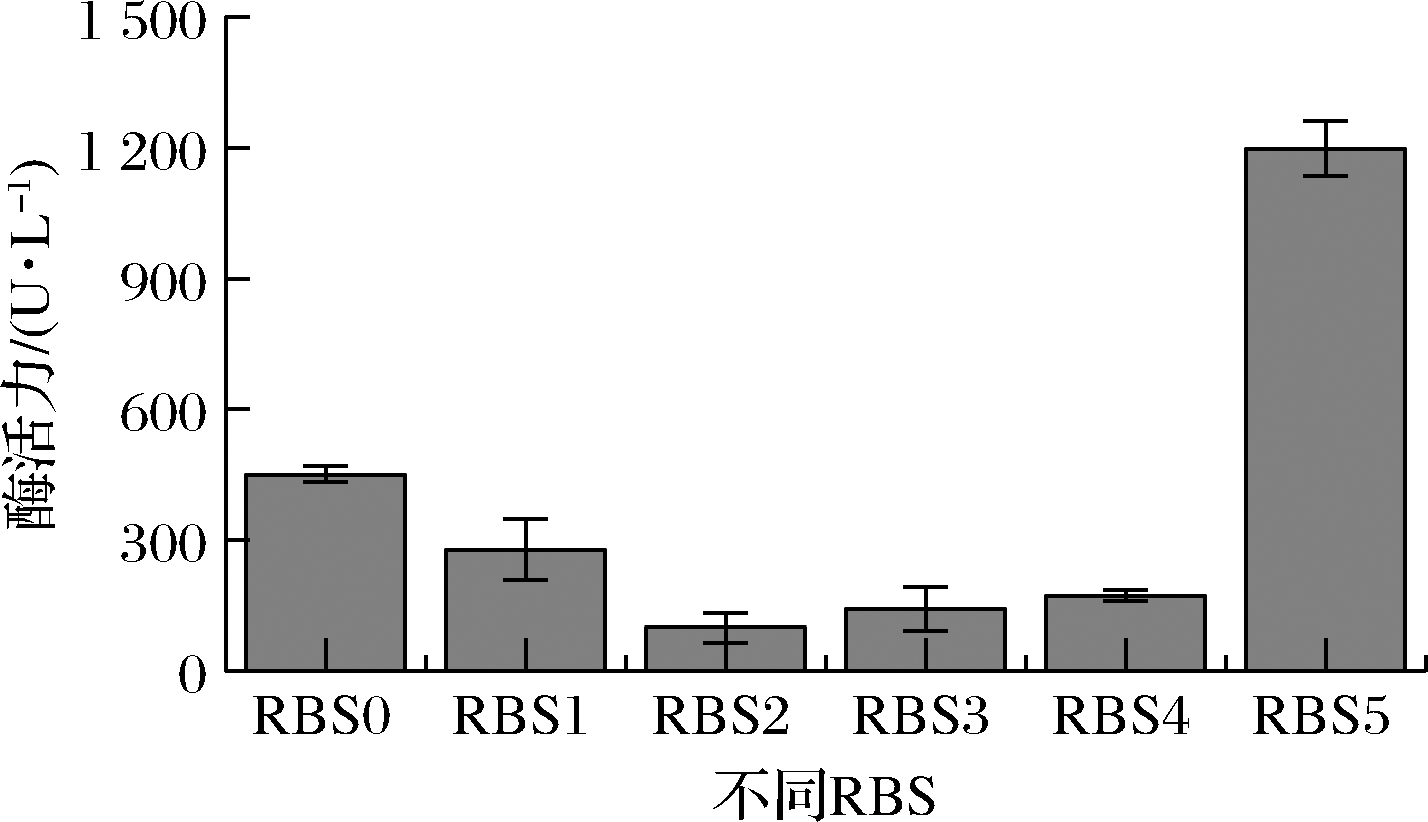
RBS0-出发菌株CotA-RBS胞内酶;RBS1-CotA-RBS1胞内酶; RBS2-CotA-RBS2胞内酶;RBS3-CotA-RBS3胞内酶; RBS4-CotA-RBS4胞内酶;RBS5-CotA-RBS5胞内酶
图3 重组RBS替换菌株胞内可溶部分酶活力
Fig.3 The intracellular soluble enzyme activity of recombinant strains with RBS substitutions
2.3 正交实验优化诱导条件提高漆酶表达水平
诱导条件优化是有效提高蛋白表达的策略之一。选择合适的起始诱导OD600、发酵温度和IPTG添加浓度可以帮助减少包涵体的生成,Cu2+作为辅助因子可以帮助激发漆酶活性[24]。为进一步提高重组菌株胞内酶的表达水平,对24 h时各组胞内酶活力的数据进行处理,分别计算各因素下的k值和极差R,确定最佳诱导条件。如表4所示,Cu2+浓度、诱导OD600、发酵温度和IPTG浓度对CotA表达的影响依次降低,Cu2+添加浓度的极差R远远高于其他影响因素的极差。所有添加2 mmol/L Cu2+浓度的实验组胞内酶活力均高于其他相同IPTG添加浓度、发酵温度或者起始诱导OD600的实验组,说明Cu2+添加浓度对CotA胞内表达水平的影响最大。证实了Cu2+是漆酶催化中心的重要组成部分,Cu2+的存在有助于漆酶的折叠与组装[21],其作为辅助因子可激发漆酶的活性[24]。
表4 正交实验优化结果
Table 4 Results of the orthogonal experimental test

组别因素A(起始诱导OD600)B(发酵温度)/℃C(IPTG浓度)/(mmol·L-1)D(Cu2+浓度)/(mmol·L-1)10.8200.050.520.8250.2130.8300.1241.2200.1151.2250.05261.2300.20.571.5200.2281.5250.10.591.5300.051k13 322.3461 714.1272 151.802469.823k22 283.5872 630.9042 958.052946.881k31 801.9093 062.8112 297.9895 991.138R1 520.4371 348.684806.2505 521.315
由图4可知,最佳的诱导条件组合为诱导起始OD600为0.8,IPTG诱导浓度为0.1 mmol/L,Cu2+添加浓度为2 mmol/L,发酵温度为30 ℃。在此条件下,胞内酶活力可达到7 926 U/L,较未优化前(1 236 U/L)提高了5.4倍。
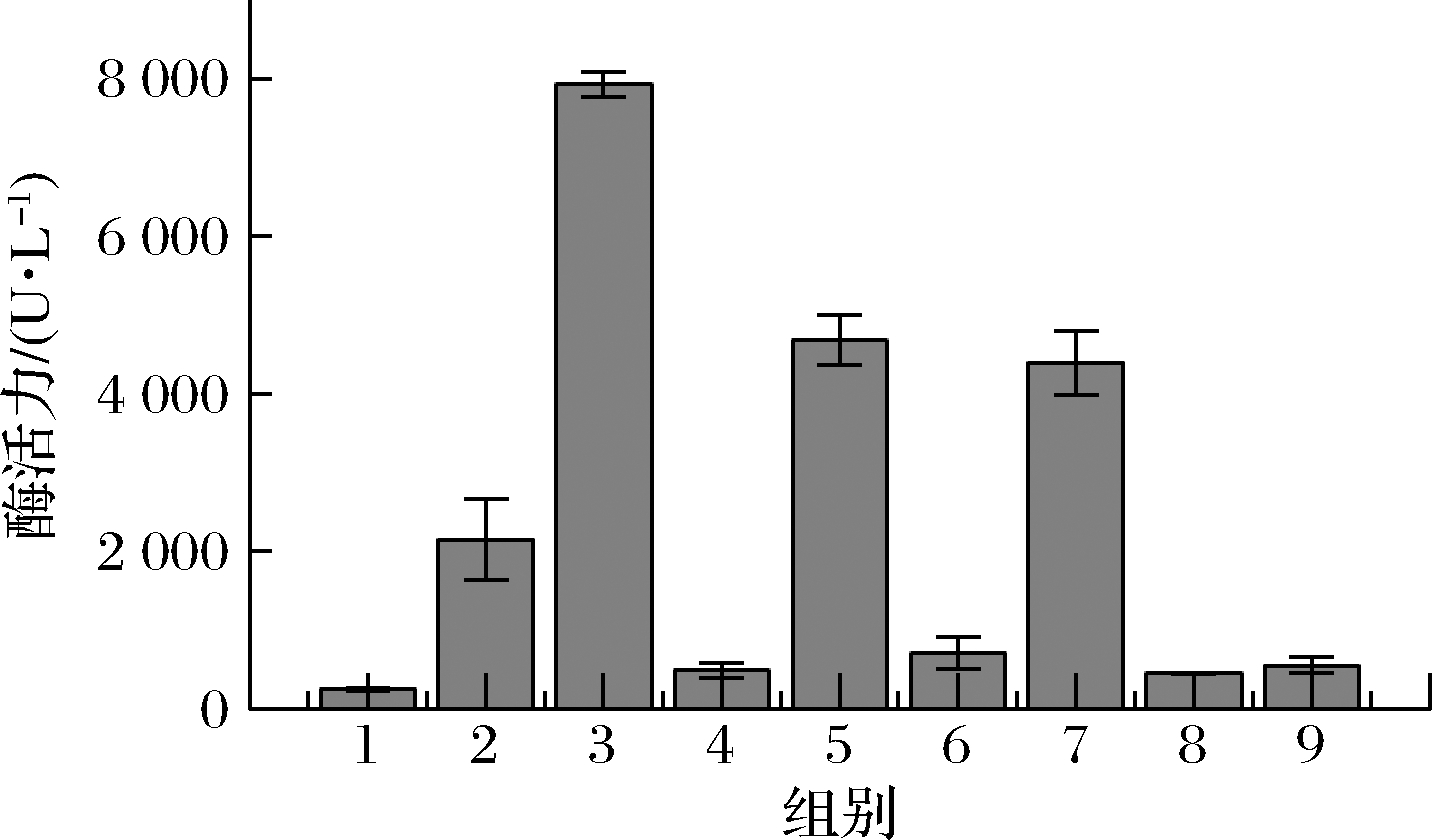
图4 重组菌株CotA-RBS5正交实验胞内酶活力
Fig.4 The intracellular activity of the orthogonal experimental test of recombinant strain CotA-RBS5
为探究诱导条件和RBS对细胞生长及漆酶胞外生产的影响。基于此,我们对比了重组菌株CotA-RBS和CotA-RBS5诱导条件优化前后的细胞生长和胞外酶活力情况。由图5可知,替换最优RBS和优化诱导条件均会影响细胞生长。诱导条件优化前,CotA-RBS和CotA-RBS5仅在发酵32 h后产生胞外漆酶(图5-a和图5-c)。诱导条件优化后,CotA-RBS和CotA-RBS5胞外酶活力分别提前至发酵24 h和10 h。其中,重组菌株CotA-RBS5发酵24 h胞外漆酶活力达到最大值(4 984 U/L),比CotA-RBS高117.6倍(图5-b和图5-d)。值得注意的是,CotA并没有融合分泌信号,且相同诱导条件下CotA-RBS5的菌体生长明显低于CotA-RBS。因此,在优化后的诱导条件下CotA-RBS5细胞可能发生了裂解,使胞内的CotA释放至胞外。大量的研究表明,外源基因的过量表达对细胞生长造成胁迫甚至裂解[25]。如图3和图4所示,RBS及诱导条件优化均提高了胞内的CotA表达水平。因此,较高的CotA胞内表达水平导致了CotA-RBS5细胞的裂解。

a-重组菌株CotA-RBS发酵条件优化前;b-重组菌株CotA-RBS发酵条件优化后; c-重组菌株CotA-RBS5发酵条件优化前;d-重组菌株CotA-RBS5发酵条件优化后
图5 重组菌株CotA-RBS和CotA-RBS5胞外酶活力和OD600
Fig.5 The extracellular activity and OD600 of recombinant strains CotA-RBS and CotA-RBS5
2.4 共表达裂解蛋白E促进漆酶的胞外生产
为简化下游分离提取过程,更好地实现漆酶的胞外生产,探索含有噬菌体裂解蛋白E的重组菌CotA-RBS5-E的诱导表达条件,考察细胞裂解对漆酶胞外生产的影响。向感受态细胞E.coli BL21(DE3)中共同转化裂解蛋白E表达质粒pCDF Duet-E(图6)和RBS优化后的漆酶表达质粒pET24a-CotA-RBS5,构成重组菌株CotA-RBS5-E。
在优化后的诱导条件下,分别培养至OD600=3.0、3.5和4时(分别对应图7-b~图7-d)时加入终浓度为2 mmol/L的阿拉伯糖,在30 ℃、220 r/min条件下继续培养,定时取样测定OD600、胞外可溶部分酶活力。漆酶活性检测发现,加入阿拉伯糖开始诱导裂解蛋白E后,胞外很快能检测到漆酶活性。随着发酵时间的延长,除较早开始诱导(OD600=3时诱导)的重组菌株的OD600先上升后下降外(图7-b),其他实验组的OD600均很快下降并最终维持稳定;胞外漆酶活性由急至缓上升,幅度明显,说明细胞发生裂解,裂解蛋白E成功发挥作用。当OD600=3.5时开始诱导裂解蛋白,重组菌CotA-RBS5-E发酵至30 h时,胞外酶活力达到最高(10 283 U/L),是对照组(5 695 U/L)的1.8倍。由此可知,共表达裂解蛋白E可以使细胞裂解作用加强,促进漆酶的胞外生产。
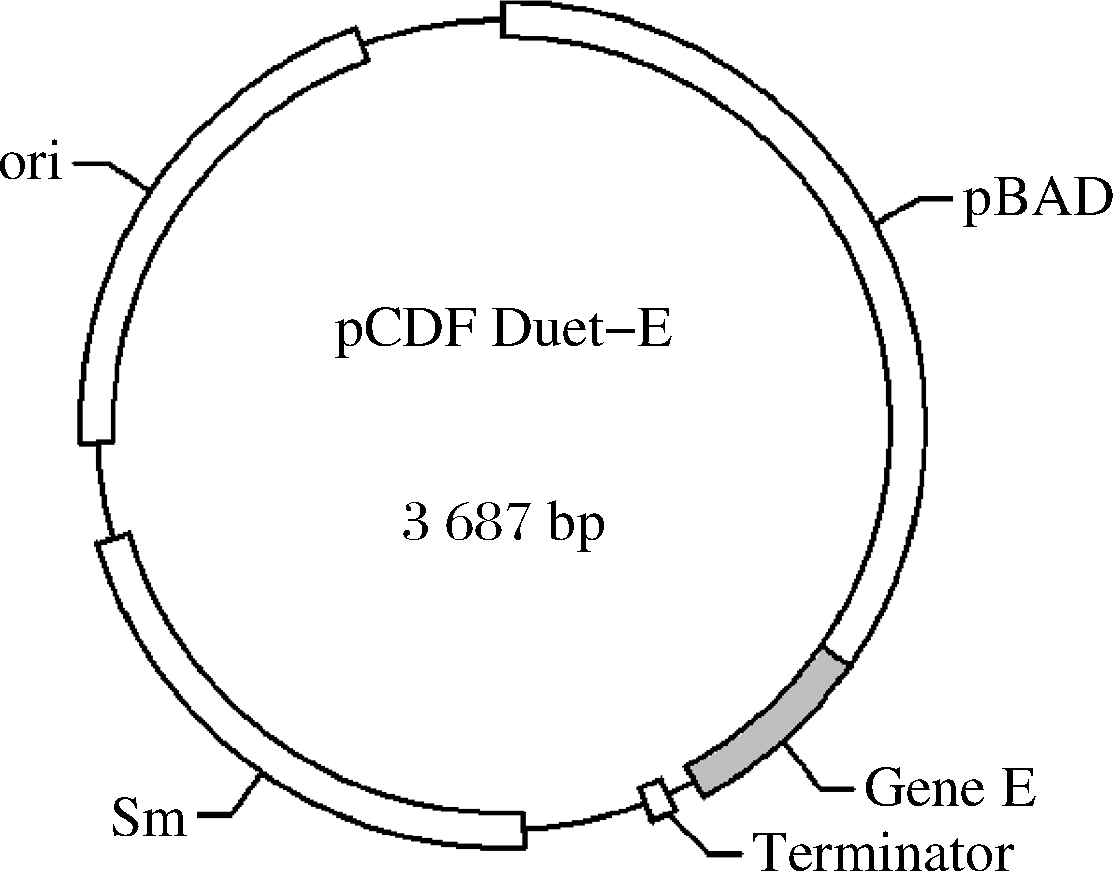
图6 裂解蛋白表达质粒pCDF-Duet-E
Fig.6 The plasmid pCDF-Duet-E expressed for lysis protein
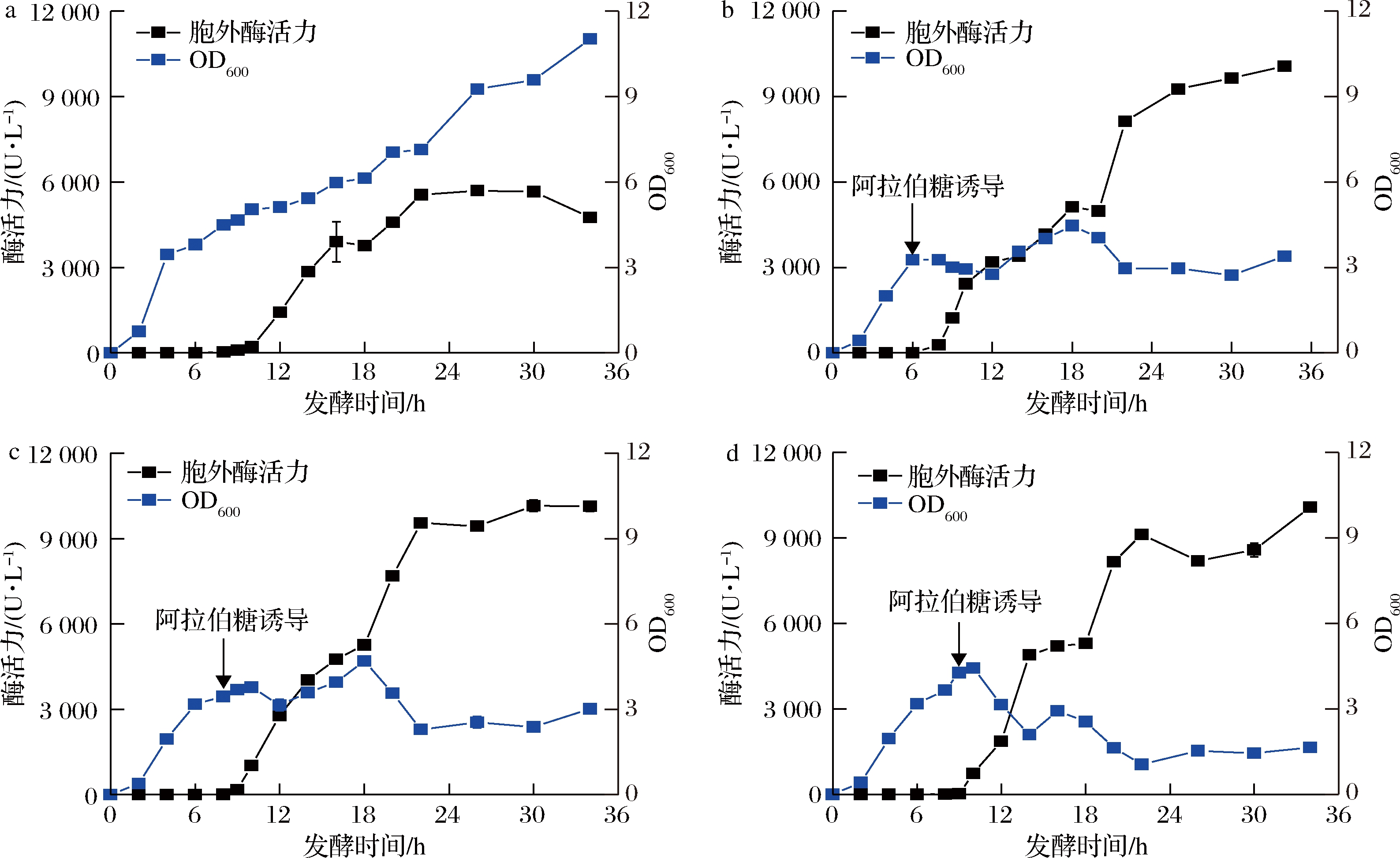
a-对照组;b-OD600=3;c-OD600=3.5;d-OD600=4
图7 不同OD600时诱导裂解蛋白后胞外CotA活性及OD600分析
Fig.7 The analysis of extracellular activity and OD600 after inducing lysis protein at different OD600
为进一步探究RBS优化、诱导条件优化和裂解蛋白E对胞内酶的表达和裂解效率的影响,测定发酵至20 h时各个样品中胞内外漆酶的分布情况。如图8所示,诱导条件优化前后出发菌株CotA-RBS均仅在胞内产酶且优化效果不明显,替换最优RBS后若不经诱导条件优化,重组菌株CotA-RBS5仅在胞内产酶。经诱导条件优化后,胞外可检测到漆酶活性,占总酶活力比例约为27%,说明需要在最优RBS和诱导条件的共同作用下,细胞才会提前发生破裂释放胞内酶。通过共表达裂解蛋白E,胞外酶的占比大幅提高。其中,OD600=4时诱导裂解蛋白E的裂解效率最高,可达93%,说明在裂解蛋白E的作用下,细胞破裂的程度加剧,胞内酶的释放作用加强。此外,诱导裂解蛋白的时间也是影响细胞产酶的重要因素,过早或者过晚诱导,体系中的总酶活力会有不同程度的下降。推测可能是由于过早诱导会导致细胞在密度不够充足的情况下发生裂解作用,影响细胞的积累进而漆酶总产量低;过晚诱导时,裂解蛋白表达量较多,细胞裂解过度致使细胞生长情况变差,不利于后期胞内酶的产生与积累。

a-诱导条件优化前;b-诱导条件优化后;c-诱导条件优化后,CotA-RBS5和CotA-RBS5-E在不同OD600诱导裂解蛋白E
图8 发酵20 h时各样品胞内和胞外CotA酶活力分析情况
Fig.8 Activity analysis of intracellular and extracellular CotA in each sample when fermented at 20 h
3 结论
大肠杆菌作为常用的原核表达系统之一,拥有周期短、成本低、操作简便的优势,常被用来异源表达漆酶蛋白,然而漆酶在大肠杆菌宿主中常常以胞内酶的形式出现,无法分泌至胞外,往往需要通过破壁的手段得到目的蛋白,增加了下游分离提取的成本。本研究成功通过RBS序列优化,将胞内CotA从449 U/L提升至1 236 U/L。利用正交实验设计,确定了最佳诱导条件为细胞培养至OD600约为0.8时加入终浓度为2 mmol/L Cu2+和0.1 mmol/L IPTG,于30 ℃继续诱导,并确定了Cu2+在发酵过程中起到了激发漆酶活性的关键性作用。最佳诱导条件下,胞外CotA酶活力可达7 926 U/L,较优化前提升了5.4倍;同时发现,通过降低翻译起始速率和优化诱导条件,细胞提前裂解,胞内酶释放至胞外,胞外酶活力可达4 984 U/L。最后,通过共表达裂解蛋白E,促进了细胞裂解,提高了胞外酶的产量,在菌体浓度OD600达到3.5时诱导裂解蛋白E表达,胞外CotA酶活力在发酵30 h达到10 283 U/L。研究结果为漆酶的工业化生产提供了重要的基础数据。
[1] AUSEC L, BERINI F, CASCIELLO C, et al.The first acidobacterial laccase-like multicopper oxidase revealed by metagenomics shows high salt and thermo-tolerance[J].Applied Microbiology and Biotechnology, 2017, 101(15):6 261-6 276.
[2] GUAN Z B, LUO Q, WANG H R, et al.Bacterial laccases:Promising biological green tools for industrial applications[J].Cellular and Molecular Life Sciences:CMLS, 2018, 75(19):3 569-3 592.
[3] HECK T, FACCIO G, RICHTER M, et al.Enzyme-catalyzed protein crosslinking[J].Applied Microbiology and Biotechnology, 2013, 97(2):461-475.
[4] NAVAS L E, CARBALLO R, LEVIN L, et al.Fast decolorization of azo dyes in alkaline solutions by a thermostable metal-tolerant bacterial laccase and proposed degradation pathways[J].Extremophiles:Life Under Extreme Conditions, 2020, 24(5):705-719.
[5] DAI X L, LV J, YAN G X, et al.Bioremediation of intertidal zones polluted by heavy oil spilling using immobilized laccase-bacteria consortium[J].Bioresource Technology, 2020, 309:123305.
[6] SHARMA D, CHAUDHARY R, KAUR J, et al.Greener approach for pulp and paper industry by xylanase and laccase[J].Biocatalysis and Agricultural Biotechnology, 2020, 25:101604.
[7] FENG S Z, SU Y R, DONG M Z, et al.Laccase activity is proportional to the abundance of bacterial laccase-like genes in soil from subtropical arable land[J].World Journal of Microbiology & Biotechnology, 2015, 31(12):2 039-2 045.
[8] BRIJWANI K, RIGDON A, VADLANI P V.Fungal laccases:Production, function, and applications in food processing[J].Enzyme Research, 2010, 2010:149748.
[9] DAVARPANAH S J, AHN J W, KO S M, et al.Stable expression of a fungal laccase protein using transplastomic tobacco[J].Plant Biotechnology Reports, 2012, 6(4):305-312.
[10] LI Q, WANG X H, KORZHEV M, et al.Potential biological role of laccase from the sponge Suberites domuncula as an antibacterial defense component[J].Biochimica et Biophysica Acta (BBA)-General Subjects, 2015, 1850(1):118-128.
[11] NG I S, ZHANG X, ZHANG Y, et al.Molecular cloning and heterologous expression of laccase from Aeromonas hydrophila NIU01 in Escherichia coli with parameters optimization in production[J].Applied Biochemistry and Biotechnology, 2013, 169(7):2 223-2 235.
[12] LIU Y H, HUANG L, GUO W, et al.Cloning, expression, and characterization of a thermostable and pH-stable laccase from Klebsiella pneumoniae and its application to dye decolorization[J].Process Biochemistry, 2017, 53:125-134.
[13] TAN S I, NG I S, YU Y J.Heterologous expression of an acidophilic multicopper oxidase in Escherichia coli and its applications in biorecovery of gold[J].Bioresources and Bioprocessing, 2017, 4:20.
[14] ECE S L, LAMBERTZ C, FISCHER R, et al.Heterologous expression of a Streptomyces cyaneus laccase for biomass modification applications[J].AMB Express, 2017, 7(1):86.
[15] WANG T N, ZHAO M.A simple strategy for extracellular production of CotA laccase in Escherichia coli and decolorization of simulated textile effluent by recombinant laccase[J].Applied Microbiology and Biotechnology, 2017, 101(2):685-696.
[16] WANG T N, ZHAO M.A simple strategy for extracellular production of CotA laccase in Escherichia coli and decolorization of simulated textile effluent by recombinant laccase[J].Applied Microbiology and Biotechnology, 2017, 101(2):685-696.
[17] SALIS H M, MIRSKY E A, VOIGT C A.Automated design of synthetic ribosome binding sites to control protein expression[J].Nature Biotechnology, 2009, 27(10):946-950.
[18] 彭政. 芽孢杆菌降解羽毛角蛋白关键步骤解析及角蛋白酶的高效表达[D].无锡:江南大学, 2020.
PENG Z.Analysis of key steps in degradation of feather keratin by Bacillus and efficient expression of keratinase[D].Wuxi:Jiangnan University, 2020.
[19] 魏伟伟, 王阳, 堵国成, 等.大肠杆菌四氢嘧啶合成途径的构建与优化[J].食品与生物技术学报, 2021, 40(7):30-41.
WEI W W, WANG Y, DU G C, et al.Construction and optimization of ectoine synthesis pathway in Escherichia coli[J].Journal of Food Science and Biotechnology, 2021, 40(7):30-41.
[20] 吴家鑫, 王玉, 李政, 等.细菌菌蜕的研究进展[J].北京联合大学学报, 2013, 27(1):73-75;81.
WU J X, WANG Y, LI Z, et al.Progress in research on bacterial ghosts[J].Journal of Beijing Union University, 2013, 27(1):73-75;81.
[21] 张宁. 大肠杆菌产CotA蛋白的高效诱导表达、分离纯化及酶学性质的研究[D].哈尔滨:东北林业大学, 2012.
ZHANG N.The induction, purification and characterization of protein CotA from Escherichia coli[D].Harbin:Northeast Forestry University, 2012.
[22] 常美会, 初晓宇, 伍宁丰.翻译速率对重组蛋白表达影响的研究进展[J].中国农业科技导报, 2017, 19(4):45-50.
CHANG M H, CHU X Y, WU N F.Progress on the influence of translation rate on the expression of recombinant proteins[J].Journal of Agricultural Science and Technology, 2017, 19(4):45-50.
[23] TULLER T, ZUR H.Multiple roles of the coding sequence 5′ end in gene expression regulation[J].Nucleic Acids Research, 2014, 43(1):13-28.
[24] BALDRIAN P, GABRIEL J.Copper and cadmium increase laccase activity in Pleurotus ostreatus[J].FEMS Microbiology Letters, 2002, 206(1):69-74.
[25] DING J J, LIANG G H, ZHANG K, et al.Extra metabolic burden by displaying over secreting:Growth, fermentation and enzymatic activity in cellobiose of recombinant yeast expressing β-glucosidase[J].Bioresource Technology, 2018, 254:107-114.