发酵乳杆菌是一类具有耐酸、耐胆盐、降解不易消化糖类等优良特性的专性异型发酵乳酸菌,普遍存在于自然发酵制品以及人类和动物的肠道中[1-4]。发酵制品的生产和感官特性主要依赖于发酵剂的稳定性,在发酵过程中,发酵剂若被噬菌体侵染,则可能影响食品风味和口感。目前,噬菌体污染已被认为是乳制品行业发酵失败的主要原因[5]。
噬菌体具有很强的感染力,发酵剂被噬菌体污染后活力下降,可能出现发酵缓慢,pH值不正常等情况。除烈性噬菌体外,溶原性噬菌体污染也是引起发酵失败的原因之一,它由特定的基因来引导整合至细菌染色体,并作为原噬菌体保持休眠状态,在特定物理或化学条件下,部分溶原性噬菌体可被诱导为烈性噬菌体,从而影响发酵的进行[6-8]。在发酵食品的生产过程中,噬菌体有多种污染途径,发酵剂菌株可以通过进化出噬菌体抗性系统来自然地防止噬菌体的入侵[9],在材料和工业设施上使用物理化学方法也可以防止噬菌体污染,如热处理、使用化学杀菌剂等[10]。
本研究以发酵乳杆菌(Lactobacillus fermentum)IMAU32579为研究对象,通过紫外线和丝裂霉素C对其进行诱导,并评估热处理及常见化学杀菌剂对诱导出的噬菌体的灭活效果,为工业生产中噬菌体防治措施的建立提供数据支持和理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株
发酵乳杆菌(Lactobacillus fermentum)IMAU32579保藏于内蒙古农业大学乳品生物技术与工程教育部重点实验室。
1.1.2 培养基
MRS液体培养基(g/L):植物蛋白胨10,酵母粉5,牛肉膏10,葡萄糖20,柠檬酸钠2,无水乙酸钠5,MnSO4 0.054,MgSO4 0.2,吐温-80 1 mL,121 ℃灭菌15 min。
MRS固体培养基:MRS培养基中加入15 g/L的琼脂,121 ℃灭菌15 min。
MRS半固体培养基:MRS培养基中加入7 g/L的琼脂,121 ℃灭菌15 min。
RSM(100 mL):10 g脱脂乳,115 ℃灭菌15 min后立即取出,迅速急冷。
TMG:10 mmol/L Tris-HCl、10 mmol/L MgSO4、1 g明胶,加水至1 L、pH调至7.4,121 ℃灭菌15 min。
1.1.3 试剂与仪器
丝裂霉素C,罗恩试剂公司;乙醇、异丙醇、NaClO,天津鑫伯特化工有限公司。
UV-1700紫外可见分光光度计,日本岛津株式会社分析仪器部;DHP-9272电热恒温培养箱,上海一恒科学仪器有限公司;DL-CJ-2F超净工作台,北京东联哈尔仪器制造有限公司;Eppendorf 5810R台式高速冷冻离心机,德国 Hambury 公司;JEM-1200透射电子显微镜,日本JEOL公司 。
1.2 实验方法
1.2.1 菌株的活化
将发酵乳杆菌IMAU32579以2%(体积分数,下同)接种量接种于5 mL MRS液体培养基中,置于37 ℃培养24 h,得到第一代菌。将第一代菌液传代两次后,得到第三代培养菌株,置于4 ℃冰箱备用。
1.2.2 菌株的诱导
1.2.2.1 紫外线诱导
在超净工作台中,将5 mL菌液(OD600≈0.4)注入培养皿中缓慢摇动使其平铺后,打开培养皿盖,置于紫外灯(254 nm)下,使菌液液面与紫外灯距离为10~15 cm,分别照射10、20、30、40、50 s,以未照射菌液为对照。37 ℃培养,每隔1 h取样测定OD600值,重复3次。将诱导液8 000×g,5 min离心过滤,即获得可能的噬菌体裂解液,采用双层平板法检测是否存在噬菌斑。
1.2.2.2 丝裂霉素C诱导
在处于迟滞期(OD600≈0.2)的菌液中添加丝裂霉素C使其终质量浓度分别达到1.8、1.9、2.0、2.1、2.2 μg/mL,以不添加丝裂霉素C的空白组作为对照。37 ℃培养,每隔1 h测定其OD600值,重复3次。将诱导液8 000 ×g,5 min离心过滤,即获得可能的噬菌体裂解液,采用双层平板法检测是否存在噬菌斑。
1.2.3 噬菌体增殖
将已活化的宿主菌以2%的接种量接入MRS培养基中,37 ℃培养至OD600≈0.5,加入噬菌体裂解液,37 ℃培养3~4 h直至菌液澄清。8 000×g离心5 min后收集上清液得到噬菌体悬浮液,经0.22 μm无菌滤膜过滤得到噬菌体裂解液。置于4 ℃冰箱备用。
1.2.4 噬菌体的浓缩和检测
将RNase A、DNase I加入溶源性发酵乳杆菌裂解液中至终质量浓度1 μg/mL,37 ℃静置30 min。然后加入终浓度为0.5 mol/L的NaCl和100 g/L的聚乙二醇8000冰浴4 ℃过夜后取出,12 000×g离心20 min后得到的沉淀重新溶解于SM缓冲液中。将经过浓缩之后的噬菌体裂解液进行双层平板法计数。
1.2.5 噬菌体形态观察
取效价达到108 PFU/mL噬菌体原液用作电镜观察。取微量噬菌体悬液滴加于复膜铜网上,滴1滴2%磷钨酸(pH 7.0),静置滴染30 s后,用滤纸吸去未干的染液,放置在室温下自然干燥,然后使用透射电子显微镜观察噬菌体的形态。
1.2.6 不同温度对噬菌体的灭活效果
配制MRS、RSM、TMG培养基,分别分装900 μL于1.5 mL EP管中。将100 μL噬菌体裂解液分别加入上述培养基中混合摇匀,分别进行63、72 ℃水浴培养,将不同时间间隔下(0、1、2、3、4、5 min)的噬菌体裂解液取出,以10倍梯度稀释噬菌体裂解液,采用双层平板法对不同培养条件下的噬菌体计数,37 ℃培养24 h,计算其灭活效果。
1.2.7 化学杀菌剂对噬菌体的灭活效果
1.2.7.1 乙醇对噬菌体的灭活效果
分装900 μL不同体积分数(10%、20%、30%、50%、75%、100%)乙醇溶液于1.5 mL EP管中,然后分别加入100 μL噬菌体裂解液,混合均匀,37 ℃培养,于不同时间间隔下(0、15、30、45、60 min)取出,采用双层平板法对不同浓度乙醇处理下的噬菌体计数,37 ℃培养24 h,计算其灭活效果。
1.2.7.2 异丙醇对噬菌体的灭活效果
分装900 μL不同体积分数(10%、30%、50%、100%)异丙醇溶液于1.5 mL EP管中,然后分别加入100 μL噬菌体裂解液,按1.2.7.1的方法计算其灭活效果。
1.2.7.3 NaClO对噬菌体的灭活效果
分装900 μL不同质量浓度(100、200、400、800 mg/L)NaClO溶液于1.5 mL EP管中,然后分别加入100 μL噬菌体裂解液,按1.2.7.1的方法计算其灭活效果。
1.2.8 数据统计与分析
所有独立试验均进行3次重复。数据均采用Origin 2018软件作图分析。使用SPSS软件,采用单向方差分析,比较数据间显著性差异(P<0.05)。
2 结果与分析
2.1 发酵乳杆菌的诱导
2.1.1 紫外线对发酵乳杆菌的诱导
紫外线照射可使噬菌体由溶原途径进入裂解途径,是较为经典的诱导方法[11]。发酵乳杆菌菌悬液经过紫外(254 nm)照射不同时间以及不同培养时间下OD600值的变化情况如图1所示。发酵乳杆菌IMAU32579经5个不同时间段的紫外照射后,5种诱导液自0 h开始菌体密度较对照菌开始下降,但对上述诱导液进行双层平板法检测时,均未有噬菌斑出现。
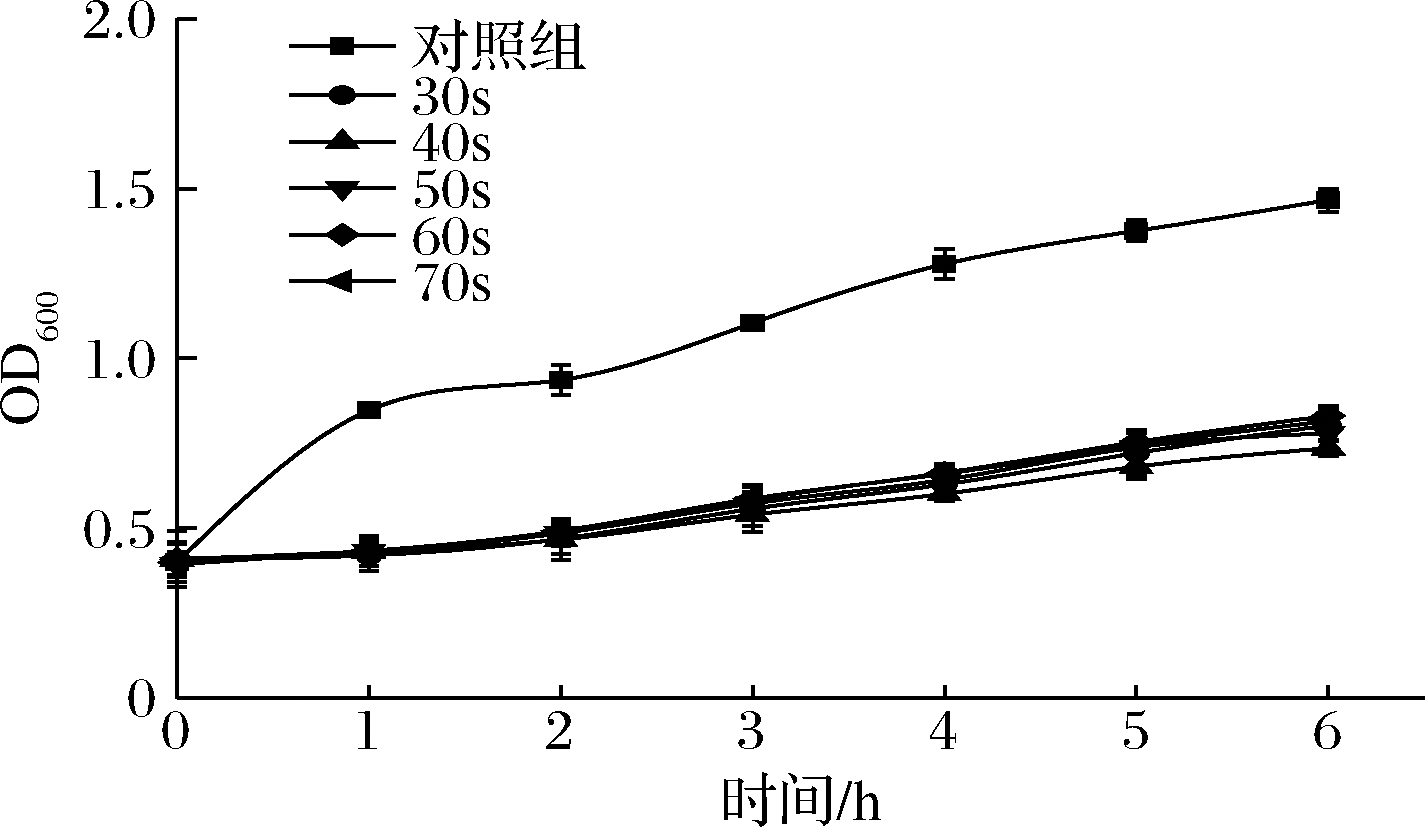
图1 发酵乳杆菌IMAU32579经紫外线诱导 后的OD600值的变化
Fig.1 Changes in the OD600 values of Lactobacillus fermentum IMAU32579 after UV induction
郭静[12]将甲基营养型芽孢杆菌置于紫外灯(254 nm)下,照射40 s后,其诱导液的OD600值呈先下降后上升的趋势,对诱导液进行双层平板检测,发现有噬菌斑产生。杨敏[13]对30株水稻白叶枯病菌进行紫外照射诱导,结果显示仅成功诱导出2株噬菌体,28株未诱导出噬菌体,说明还有其他原因影响诱导能力。
有研究报道,前噬菌体具有一个紧密的抑制系统用来维持其稳定的休眠状态,虽可在某些外界刺激条件下被诱导,但是否可被成功诱导与菌株特性、前噬菌体稳定性等多种因素有关[14]。本研究菌株经紫外照射后,虽然其OD600值有所降低,但并未成功诱导出噬菌体。推测OD600值下降的原因可能是由于紫外照射而引起的菌株生长抑制。
2.1.2 丝裂霉素C对发酵乳杆菌的诱导
丝裂霉素C是从头状链霉菌培养液中分离提取的一种抗生素,能够使细胞DNA解聚,阻止DNA的复制,是一种常见的噬菌体诱导剂[15]。PEI等[16]使用0.7 μg/mL丝裂霉素C诱导142株乳酸菌,结果表明,在添加诱导剂后8 h内,所有受试菌中有8株菌株裂解,产生噬菌体。因此,本研究使用丝裂霉素C为诱导剂,对发酵乳杆菌IMAU3257进行诱导。
由图2可知,经不同浓度丝裂霉素C诱导后的诱导液在培养1 h后,OD600值虽低于对照组,但仍呈上升趋势。随着培养时间的增长,菌株生长受到抑制,OD600值下降,推测可能有噬菌体存在。对上述诱导液进行双层平板法检测后发现,丝裂霉素C质量浓度为1.9 μg/mL,培养时间为6 h时,有噬菌斑产生,说明成功诱导出噬菌体。
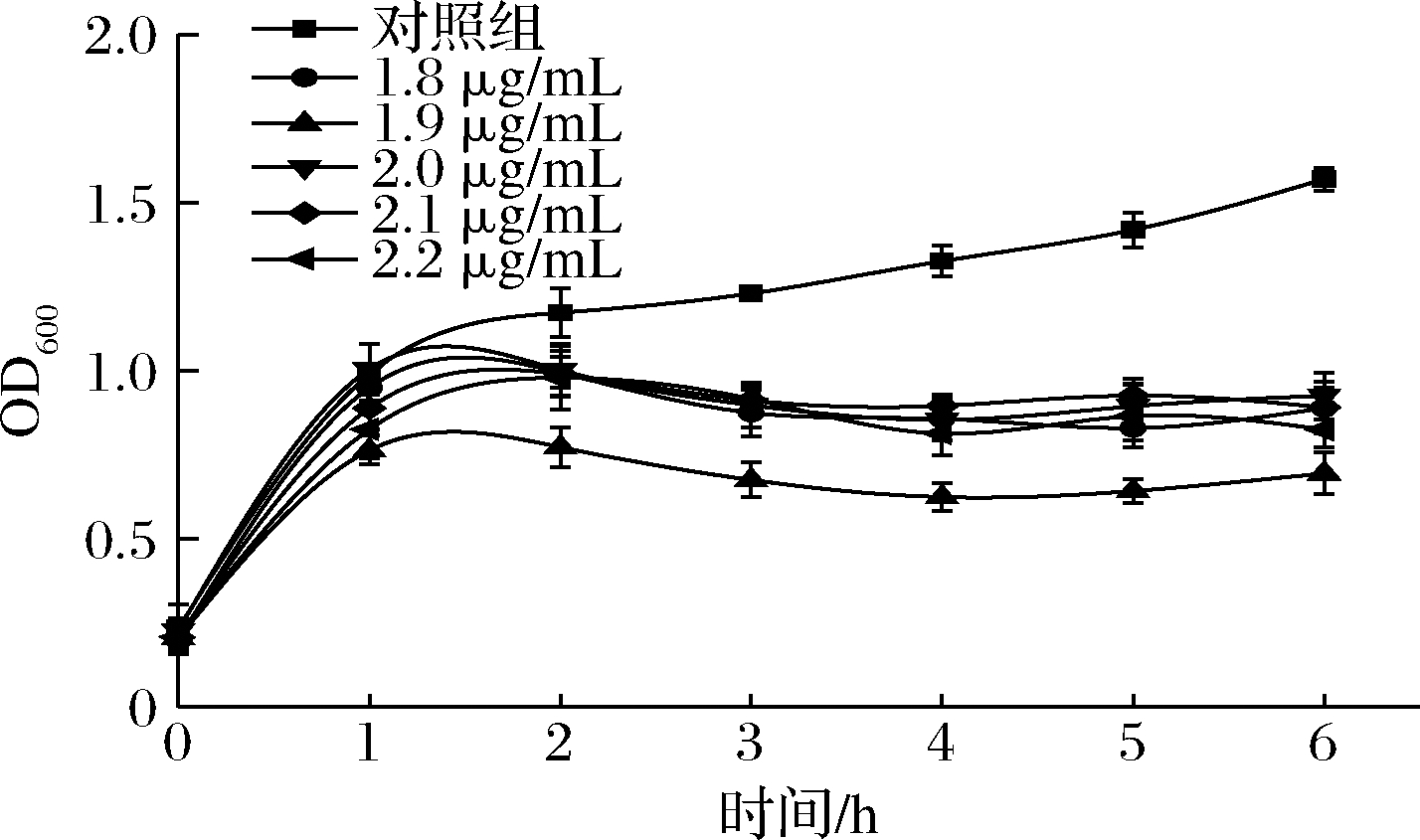
图2 发酵乳杆菌IMAU32579经丝裂霉素C诱导 后的OD600值的变化
Fig.2 Changes in the OD600 values of L.fermentum IMAU32579 after mitomycin C induction
2.2 噬菌体的形态
经1.9 μg/mL丝裂霉素C诱导后,双层平板上观察到清晰透明的噬菌斑(图3-a),将该噬菌体命名为LFP-VB1。利用透射电子显微镜观察噬菌体形态,结果如图3-b所示。由图3-b可知,噬菌体LFP-VB1的头部直径为(62.86±2.01) nm,尾部为非收缩性尾,长(259.26±2.00) nm,宽(12.52±2.01) nm。依照国际病毒分类委员会分类标准[17],该噬菌体属于尾噬菌体目(Caudovirales)、长尾噬菌体科(Siphoviridae)。

a-噬菌斑图;b-电镜图
图3 噬菌体LFP-VB1的噬菌斑及电镜图
Fig.3 Phage plaque and electron micrograph of phage LFP-VB1
2.3 不同温度对噬菌体LFP-VB1的灭活效果
热处理是最常用的传统灭活微生物的方法,其作用机理是利用加热使微生物的蛋白质、核酸等发生不可逆变性,致使其失活。
如图4所示,噬菌体LFP-VB1对高温极敏感。当温度为63 ℃时,用3种培养基培养的噬菌体,在处理4 min均可失活;72 ℃时,噬菌体对数级下降速率较63 ℃更快,但同样在4 min时完全失活。
TRUCCO等[18]测定了德氏乳杆菌温和噬菌体(Cb1/204和Cb1/342)在不同温度和不同培养基(RSM和MRS)下的活性,结果显示,温度为63 ℃时,噬菌体Cb1/204和Cb1/342在MRS完全失活所需要的时间为10 min和20 min,在RSM培养基中处理30 min后仍无法全部灭活;在72 ℃处理后显示,两种温和噬菌体快速失活。林泽永等[19]使用63 ℃和72 ℃处理短乳杆菌烈性噬菌体,噬菌体分别在处理10 min和5 min时,完全灭活。
上述研究结果显示,发酵乳杆菌噬菌体LFP-VB1不具有耐热性,63 ℃处理4 min即可完全失活。因此,可通过热处理控制噬菌体LFP-VB1的污染。

图4 在63 ℃和72 ℃不同培养基对噬菌体 LFP-VB1的灭活作用
Fig.4 Effect of different culture medium at 63 ℃ and 72 ℃ on the inactivation of phage LFP-VB1
2.4 不同化学杀菌剂对噬菌体LFP-VB1的灭活效果
2.4.1 乙醇对噬菌体LFP-VB1的灭活效果
乙醇是一种安全有效的化学杀菌剂,可通过破坏蛋白质的肽键,进而使噬菌体衣壳蛋白的结构发生改变,最终达到灭活效果[20-21]。将发酵乳杆菌噬菌体LFP-VB1置于不同浓度乙醇溶液中处理60 min后的灭活效果如图5所示。

图5 不同浓度乙醇对噬菌体LFP-VB1的灭活效果
Fig.5 Effect of ethanol concentration on the inactivation of phage LFP-VB1
由图5可知,10%和20%的乙醇对噬菌体LFP-VB1的灭活效果较差;30%乙醇处理60 min后,噬菌体LFP-VB1的效价下降1.58个对数级;体积分数为75%和100%的乙醇在处理前15 min对噬菌体的灭活效果较强,分别使其下降3.02和2.93个对数级,随着处理时间增加,灭活效果减弱,处理60 min后,噬菌体分别下降4.71和4.21个对数级,100%乙醇的灭活效果在60 min后低于75%乙醇,原因可能是乙醇浓度过高导致噬菌体表面蛋白质迅速凝固,形成一层膜,阻止乙醇溶液向噬菌体内部流入,使其灭活效果受到影响[22]。
CAPRA等[23]评价了不同浓度乙醇对乳酸菌噬菌体PL-1和J-1的灭活效果,结果显示,10%和50%的乙醇对噬菌体活性几乎没有影响(T99>45 min),75%和100%的乙醇是灭活噬菌体PL-1和J-1的最有效溶液,T99值的范围为5.5~10.3 min。林泽永等[19]评价了不同浓度乙醇对短乳杆菌噬菌体φB23的灭活效果,结果表明用75%的乙醇溶液处理10 min时,可使噬菌体完全失活;当乙醇溶液体积分数为50%时,噬菌体效价下降较慢,处理20 min后完全灭活;当采用30%的乙醇处理,30 min内不能使其失活[19]。本研究中,不同浓度的乙醇对噬菌体LFP-VB1的活性影响较小,60 min内处理后,均不能使其完全失活,说明噬菌体LFP-VB1对乙醇的耐受性较高。
2.4.2 异丙醇对噬菌体LFP-VB1的灭活效果
将发酵乳杆菌噬菌体LFP-VB1置于不同浓度异丙醇溶液中处理60 min后的灭活效果如图6所示。

图6 不同浓度异丙醇对噬菌体LFP-VB1的灭活效果
Fig.6 Effect of isopropanol concentration on the inactivation of phage LFP-VB1
由图6可知,用10%、20%、50%、100%异丙醇处理15 min,噬菌体效价分别下降0.98、1.17、1.33和0.58个对数级,随着处理时间延长,灭活效果减弱,效价下降趋势稳定。30%异丙醇处理60 min灭活效果最佳,使噬菌体下降2.28个对数级。研究表明,100%的异丙醇处理5 min可使Lactobacillus helveticus噬菌体CNRZ832-B1和CNRZ0241完全失活[24], 处理15 min可使嗜热链球菌噬菌体031-D完全失活[25]。对于本研究来说,异丙醇溶液对噬菌体LFP-VB1的灭活效果较差,100%异丙醇作用60 min,仍不可使噬菌体完全灭活,说明与上述噬菌体相比,噬菌体LFP-VB1对异丙醇的抗性较强。
2.4.3 NaClO对噬菌体LFP-VB1的灭活效果
由图7可知,100 mg/L NaClO处理60 min的灭活效果最差,仅使噬菌体下降1.83个对数级;随着NaClO浓度及处理时间增加,其对噬菌体LFP-VB1的灭活作用增强。质量浓度为800 mg/L,处理60 min,灭活效果最佳,但也未能使噬菌体LFP-VB1完全灭活,仅使其下降6.29个对数级。SU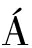 REZ等[7]研究发现,100 mg/L NaClO可使乳球菌噬菌体001和QF12在5 min内完全灭活;噬菌体046和QP4经100 mg/L NaClO处理后,T99值分别为32.7和8.8 min,300和200 mg/L的NaClO可使它们分别在45 min、30 min后完全失活,NaClO可有效灭活上述乳球菌噬菌体。另有研究表明,800 mg/L NaClO对噬菌体活力的影响最大,15 min时可使植物乳杆菌噬菌体B2完全失活,30 min时可使噬菌体B1、FAGK1、FAGK2完全失活;400 mg/L的NaClO效果略差,5 min内使4种噬菌体达到99%灭活;200 mg/L的NaClO对噬菌体灭活效果不佳,达到99%灭活的时间均大于45 min[26]。对于本研究来说,NaClO浓度越高对噬菌体灭活效果越佳,但800 mg/L NaClO作用60 min后,仍不能使噬菌体完全失活,说明与上述噬菌体相比,噬菌体LFP-VB1对NaClO的抗性较强。
REZ等[7]研究发现,100 mg/L NaClO可使乳球菌噬菌体001和QF12在5 min内完全灭活;噬菌体046和QP4经100 mg/L NaClO处理后,T99值分别为32.7和8.8 min,300和200 mg/L的NaClO可使它们分别在45 min、30 min后完全失活,NaClO可有效灭活上述乳球菌噬菌体。另有研究表明,800 mg/L NaClO对噬菌体活力的影响最大,15 min时可使植物乳杆菌噬菌体B2完全失活,30 min时可使噬菌体B1、FAGK1、FAGK2完全失活;400 mg/L的NaClO效果略差,5 min内使4种噬菌体达到99%灭活;200 mg/L的NaClO对噬菌体灭活效果不佳,达到99%灭活的时间均大于45 min[26]。对于本研究来说,NaClO浓度越高对噬菌体灭活效果越佳,但800 mg/L NaClO作用60 min后,仍不能使噬菌体完全失活,说明与上述噬菌体相比,噬菌体LFP-VB1对NaClO的抗性较强。
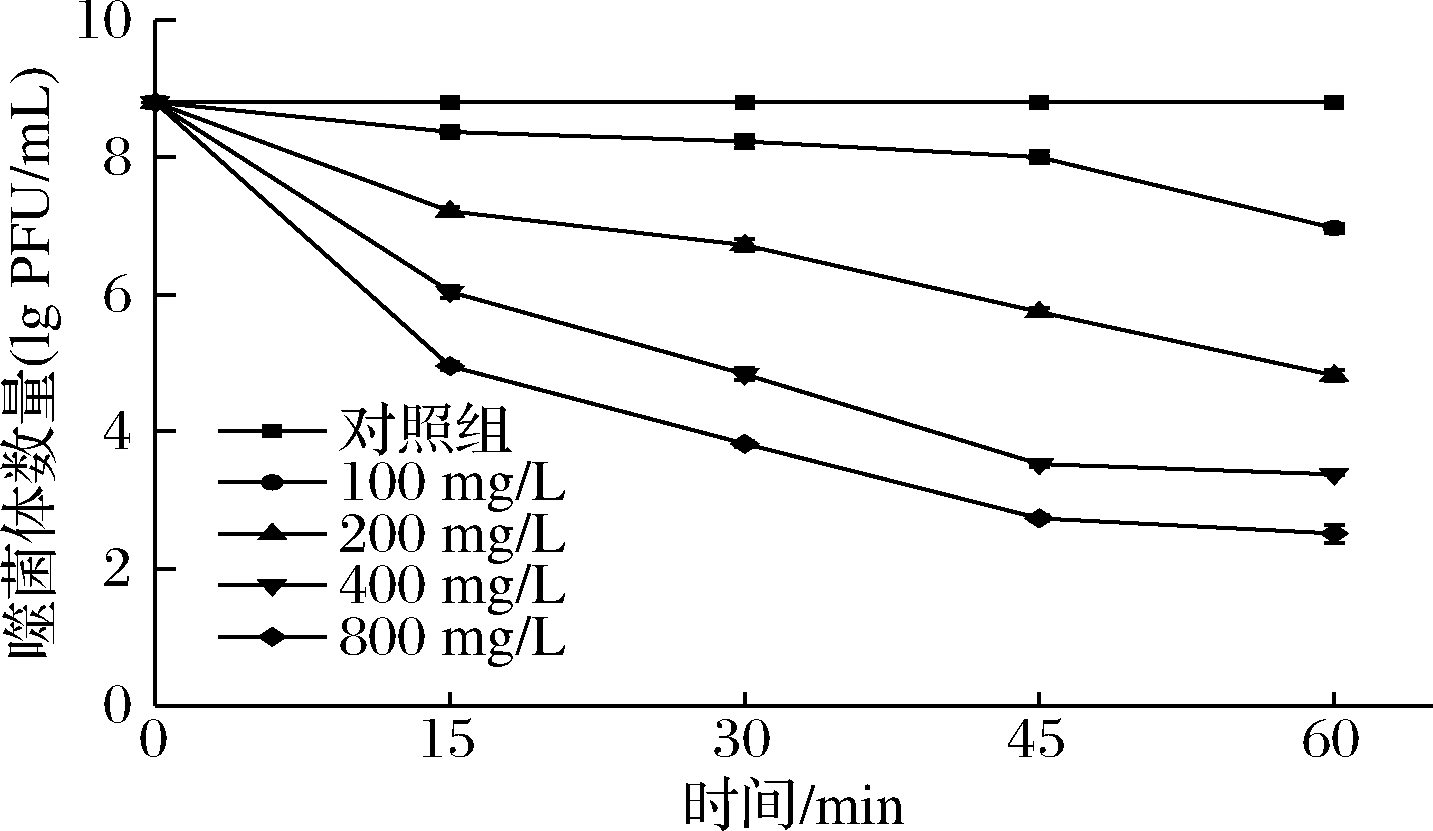
图7 不同浓度NaClO对噬菌体LFP-VB1的灭活效果
Fig.7 Effect of NaClO concentration on the inactivation of phage LFP-VB1
3 结论
本研究以发酵乳杆菌IMAU32579为研究对象,通过1.9 μg/mL丝裂霉素C成功诱导出发酵乳杆菌噬菌体。该噬菌体属于长尾噬菌体科,命名为LFP-VB1。LFP-VB1对温度较为敏感,63 ℃处理即可使其完全失活;对常见化学杀菌剂(乙醇、异丙醇、NaClO)不敏感,800 mg/L NaClO处理60 min也仅能使其下降6.29个对数级。本研究可为构建噬菌体防治措施,提高相关产品稳定性提供理论基础。
[1] SOLOVEVA I V, NOVIKOVA N A, TOCHILINA A G, et al.The probiotic strain Lactobacillus fermentum 39:Biochemical properties, genomic features, and antiviral activity[J].Microbiology, 2021, 90(2):219-225.
[2] 张秀红. 溶源性发酵乳杆菌及其温和噬菌体的研究[D].济南:山东大学, 2006.
ZHANG X H.Studies on lysogenic Lactobacillus fermentum and its temperate bacteriophages[D].Jinan:Shandong University, 2006.
[3] 赵岩. 中国人群肠道中发酵乳杆菌的基因差异及其对肠道的生理调节作用[D].无锡:江南大学, 2021.
ZHAO Y.Genetic difference and intestinal regulatory function of Limosilactobacillus fermentum in Chinese population[D].Wuxi:Jiangnan University, 2021.
[4] ZHAO Y, YU L L, TIAN F W, et al.An optimized culture medium to isolate Lactobacillus fermentum strains from the human intestinal tract[J].Food & Function, 2021, 12(15):6 740-6 754.
[5] GARNEAU J E, MOINEAU S.Bacteriophages of lactic acid bacteria and their impact on milk fermentations[J].Microbial Cell Factories, 2011, 10(Suppl 1):S20.
[6] 周园, 王岚, 李旗, 等.噬菌体在鲍曼不动杆菌耐药过程中的作用[J].沈阳医学院学报, 2013, 15(3):140-141, 144.
ZHOU Y, WANG L, LI Q, et al.The effect of bacteriophages on drug-resistance of Acinetobacter baumannii[J].Journal of Shenyang Medical College, 2013, 15(3):140-141;144.
[7] SU REZ V B, REINHEIMER J A.Effectiveness of thermal treatments and biocides in the inactivation of Argentinian Lactococcus lactis phages[J].Journal of Food Protection, 2002, 65(11):1 756-1 759.
REZ V B, REINHEIMER J A.Effectiveness of thermal treatments and biocides in the inactivation of Argentinian Lactococcus lactis phages[J].Journal of Food Protection, 2002, 65(11):1 756-1 759.
[8] MASKE B L, DE MELO PEREIRA G V, DA SILVA VALE A, et al.Viruses in fermented foods:Are they good or bad? Two sides of the same coin[J].Food Microbiology, 2021, 98:103794.
[9] MAHONY J, MOSCARELLI A, KELLEHER P, et al.Phage biodiversity in artisanal cheese wheys reflects the complexity of the fermentation process[J].Viruses, 2017, 9(3):45.
[10] 柴诗语, 郭静, 马瑞瑞, 等.食品工业中噬菌体灭活方法研究进展[J].中国乳品工业, 2019, 47(11):36-40.
CHAI S Y, GUO J, MA R R, et al.Inactivation methods of bacteriophages in food industry[J].China Dairy Industry, 2019, 47(11):36-40.
[11] FAN C, FANG C, ZHANG Y, et al.A new method for determining the frequency of induction of λ prophage[J].Virologica Sinica, 2002, 17(4):367-370.
[12] 郭静. 溶原性芽孢杆菌噬菌体的生物学特性及其灭活方法[D].呼和浩特:内蒙古农业大学, 2019.
GUO J.Biological characteristics and inactivation methods of lysogenic Bacillus phage[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[13] 杨敏. 水稻白叶枯病菌前噬菌体高效释放的诱导剂鉴定及转座酶在其中的功能研究[D].杭州:浙江大学, 2020.
YANG M.Identification of an inducer for high-efficiency prophage release of Xanthomonas oryzae pv.oryzae and functional analysis of associated transposases[D].Hangzhou:Zhejiang University, 2020.
[14] HO C H, STANTON-COOK M, BEATSON S A, et al.Stability of active prophages in industrial Lactococcus lactis strains in the presence of heat, acid, osmotic, oxidative and antibiotic stressors[J].International Journal of Food Microbiology, 2016, 220:26-32.
[15] 季晖. 药理学[M].2版.南京:东南大学出版社, 2019.
[16] PEI Z M, SADIQ F A, HAN X, et al.Identification, characterization, and phylogenetic analysis of eight new inducible prophages in Lactobacillus[J].Virus Research, 2020, 286:198003.
[17] MAHONY J, VAN SINDEREN D.Current taxonomy of phages infecting lactic acid bacteria[J].Frontiers in Microbiology, 2014, 5:7.
[18] TRUCCO V, REINHEIMER J, QUIBERONI A, et al.Adsorption of temperate phages of Lactobacillus delbrueckii strains and phage resistance linked to their cell diversity[J].Journal of Applied Microbiology, 2011, 110(4):935-942.
[19] 林泽永, 梁倩雯, 苏燧, 等.一株短乳杆菌烈性噬菌体的分离鉴定与生化特性[J].食品与发酵工业, 2022,48(12):226-232.
LIN Z Y, LIANG Q W, SU S, et al.Isolation, identification and biochemical characterization of a virulent phage strain of Lactobacillus sp[J].Food and Fermentation Industries, 2022,48(12):226-232.
[20] 吴淑梅, 吴清, 王晓波, 等.乙醇复方手消毒液的消毒性能及毒性观察[J].中国消毒学杂志, 2009, 26(6):637-639.
WU S M, WU Q, WANG X B, et al.Observation on toxicity and disinfection function of glycerol-alcohol hand-washing solution[J].Chinese Journal of Disinfection, 2009, 26(6):637-639.
[21] 段晓杰, 王萌, 陈丽媛, 等.乙醇工艺对同种异体肌腱病毒灭活效果的研究[J].中国药事, 2021, 35(5):544-551.
DUAN X J, WANG M, CHEN L Y, et al.Study on the effect of ethanol process on virus inactivation of allogeneic tendon[J].Chinese Pharmaceutical Affairs, 2021, 35(5):544-551.
[22] SECHAUD L, CLUZEL P J, ROUSSEAU M, et al.Bacteriophages of lactobacilli[J].Biochimie, 1988, 70(3):401-410.
[23] CAPRA M L, QUIBERONI A, REINHEIMER J A.Thermal and chemical resistance of Lactobacillus casei and Lactobacillus paracasei bacteriophages[J].Letters in Applied Microbiology, 2004, 38(6):499-504.
[24] QUIBERONI A, SU REZ V B, REINHEIMER J A.Inactivation of Lactobacillus helveticus bacteriophages by thermal and chemical treatments[J].Journal of Food Protection, 1999, 62(8):894-898.
REZ V B, REINHEIMER J A.Inactivation of Lactobacillus helveticus bacteriophages by thermal and chemical treatments[J].Journal of Food Protection, 1999, 62(8):894-898.
[25] BINETTI A G, REINHEIMER J A.Thermal and chemical inactivation of indigenous Streptococcus thermophilus bacteriophages isolated from Argentinian dairy plants[J].Journal of Food Protection, 2000, 63(4):509-515.
[26] BRIGGILER MARC M, DE ANTONI G L, REINHEIMER J A, et al.Thermal, chemical, and photocatalytic inactivation of Lactobacillus plantarum bacteriophages[J].Journal of Food Protection, 2009, 72(5):1 012-1 019.
M, DE ANTONI G L, REINHEIMER J A, et al.Thermal, chemical, and photocatalytic inactivation of Lactobacillus plantarum bacteriophages[J].Journal of Food Protection, 2009, 72(5):1 012-1 019.