中国传统米酒,是以优质稻米作为原料,添加自然培养的糖化发酵剂酒药后发酵酿制而成的传统酒精饮料[1]。其历史悠久,风味独特,长久以来深受国人青睐。一般酿造米酒经常被认为是属于黄酒的范畴,但由于酿造工艺的差异,如不以麦曲作为糖化剂等,米酒的品质及风味特性与中国传统典型黄酒有明显差异[2]。中国米酒类型众多,具有较明显的地域特征,不同地区的米酒可以呈现截然不同的酿造特点和品质差异[3-4]。近年来米酒产业发展迅速,但与黄酒相比,米酒研究相对较少,对于造成米酒品质差异的原因仍缺乏清晰的认识,对不同类型米酒的可控生产以及米酒品质的改善,仍有较大的困难。
虽然米酒酿造较为广泛,但传统米酒的酿造方式一般都为典型的边糖化边发酵、高浓度、多菌种混合发酵方式,其中酿造微生物主要来源于酒药[5]。酒药中的霉菌等糖化微生物分泌水解酶进行原料的糖化,同时酵母进行酒精的发酵[6]。由于不同来源的酒药具有不同的发酵特性,因此对米酒的酿造和品质有着显著的影响[7],甚至决定了米酒的类型。邹凌波等[8]研究发现,传统酿造米酒可分为高酒精度低糖型和低酒精度高糖型2种主要类型。酿造这2类米酒的酒药分别为糖化发酵型酒药(saccharification and fermentation-type Jiuyao,SFJ)和糖化型酒药(saccharification-type Jiuyao,SJ)。但是关于这2类酒药的内在差异并不明晰,同时由于缺少明确的指标参数,对酒药进行快速分类或评价也比较困难,通常需要经过较长时间的发酵实验才能确定[1]。
酒药中存在含有包括霉菌、酵母和细菌等数十个种属的微生物。其中优势霉菌主要是根霉(Rhizopus)、曲霉(Aspergillus)和毛霉(Mucor)属微生物[9],根霉属微生物是酒药中糖化相关酶类的最主要贡献者[1]。优势酵母在绝大部分酒药中主要是非酒精发酵的扣囊复膜酵母(Saccharomycopsis fibuligera)[10],而且许多酒药中的酿酒酵母(Saccharomyces cerevisiae)含量很低,却有较好的酒精发酵能力[9]。一般认为,酿酒酵母的数量及其发酵特性是影响酒药发酵性能的主要因素,同时米酒发酵过程中还原糖、α-氨基氮等营养成分和环境因素也会对酵母的生长代谢有显著影响。有研究表明,高浓度葡萄糖对于酿酒酵母的生长代谢有抑制作用[11]。在葡萄酒酿造中,不同的酿酒酵母发酵对于氮源的需要也存在较明显的差异[12]。当发酵液的可溶性固形物浓度大于21 °Bx时,需要酵母可同化氮含量至少达到200 mg/L,才能使酿酒酵母正常生长。啤酒酿造中,啤酒酵母的增殖对α-氨基氮含量及组成也有要求,其中α-氨基氮主要由蛋白酶催化谷物蛋白分解产生[5]。由于米酒高浓度、多菌种以及双边发酵的特殊性,高浓度还原糖的抑制、氨态氮的相对不足等现象可能更容易发生,进而影响米酒的发酵。相关研究目前很少见, 而明确影响传统酒药发酵特性的关键因素,对于更好地理解米酒发酵过程及品质控制十分重要。
本研究主要针对米酒中最主要的大米酿造米酒(不含其他辅料或添加剂以及不添加酒精的发酵米酒)所用的2种不同类型的典型酒药(即SJ和SFJ),基于米酒发酵过程中的多个发酵参数考察其发酵特性差异,分析探讨造成这2种酒药发酵特性差异的主要原因, 为更好地理解米酒的发酵机制,科学地评价酒药类型及质量提供一定的参考。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
大米,市售;糖化型酒药SJ,江苏某米酒生产企业;糖化发酵型酒药SFJ,湖北某米酒生产企业;酿酒酵母分离自SFJ的酵母,并于实验室保存;酸性蛋白酶(食品级),市售。
1.1.2 主要试剂
NaOH、H2SO4、Na2CO3、三氯乙酸、无水葡萄糖、可溶性淀粉、KIO3、HCl,分析纯,上海国药集团;无水茚三酮、3,5 - 二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、无水乙醇,色谱纯,美国Sigma-Aldrich 公司。
1.1.3 主要仪器
SYNERGY纯水仪,美国 Millipore 公司;PL2002电子天平,瑞士 Mettler Toledo 公司;5810R台式高速离心机,德国 Eppendorf 公司;恒温培养箱,上海博迅医疗生物仪器公司;CYTATION3酶标仪,美国 Bio-Tek 公司;1260 Infinity II高效液相色谱仪,美国Agilent公司。
1.2 实验方法
1.2.1 酒药提取液的制备
参照文献[14],利用白酒酒曲浸提法,将0.5 g酒药粉碎后溶于20 mL缓冲液中,于30 ℃摇床200 r/min振荡浸提40 min后,8 000 r/min离心,上清液作为酒药提取液备用(1 mL酒药提取液含酶量=0.025 g酒药含酶量)。
1.2.2 实验室条件米酒的发酵及米酒酒液的准备
参照文献[15]的方法,选定米酒酒药进行实验室条件下的米酒酿造。取原料大米100 g,室温(25 ℃)浸泡24 h后蒸饭,迅速冷却至室温,以料水比1∶2.5(g∶mL),加酒药0.5 g加水拌匀搭窝,于30 ℃静置发酵。每日定时从米酒酒醪中取样,经10 000 r/min离心5 min后得到米酒酒液备用。
1.2.3 主要理化指标分析
酒药的发酵力按照失重法进行测定[1]。酒药的发酵力(g/0.5 g酒药)定义为在本实验条件下,添加 0.5 g 酒药,在 30 ℃米酒发酵过程中,72 h内由于发酵产生CO2导致发酵醪液质量的损失。米酒的发酵质量损失(g)定义为本实验条件下,添加 0.5 g 酒药,在 30 ℃米酒发酵过程中,每24 h 由于发酵产生CO2导致发酵醪液质量的损失。
米酒及酒药还原糖含量测定采用DNS法[16]。酒药还原糖含量通过测定酒药提取液中还原糖含量换算得到。米酒乙醇含量采用HPLC测定[17]。米酒及酒药α-氨基氮含量采用茚三酮比色法测定[18]。酒药α-氨基氮含量通过测定酒药提取液中α-氨基氮含量换算得到。
米酒及酒药糖化酶活力测定按照文献[19]的方法。1个酶活力单位(U/g)定义为1 g酒药或1 mL米酒酒液在40 ℃、pH 4.6下,1 h水解可溶性淀粉产生1 mg葡萄糖所需要的酶量。米酒及酒药淀粉酶活力测定参照文献[20]的碘比色法。1个酶活力单位(U/g)定义为1 g酒药或1 mL米酒酒液在60 ℃、pH 6.0下,5 min内水解1 mg淀粉所需要的酶量。米酒及酒药酸性蛋白酶活力测定按照GB 1886.174—2016《食品安全国家标准 食品添加剂 食品工业用酶制剂》进行测定,1个酶活力单位(U/g)定义为,1 g酒药或1 mL米酒酒液在40 ℃、pH 3.0 条件下,1 min水解酪蛋白产生1 μg 酪氨酸所需要的酶量。
米酒发酵过程中发酵液酵母的计数采用血细胞计数板法[21]。酒药中酿酒酵母数量的测定方法采用荧光定量PCR法[22]。
1.2.4 不同因素对米酒发酵的影响
本研究主要考察酒药中酵母数、蛋白酶及发酵过程中还原糖对米酒发酵的影响。具体实验设计详见表1。其中在SJ进行米酒发酵时,于发酵起始0 h时分别添加活化后的酿酒酵母和蛋白酶,分别得到发酵初始酵母浓度与SFJ类似的模拟酒药样品(SJ-酵母),发酵初始蛋白酶活力略高于SFJ的模拟酒药样品(SJ-蛋白酶);于SJ发酵进行到48 h时添加蛋白酶,得到蛋白酶活力接近此时SFJ蛋白酶活力的发酵样品(SJ-补加蛋白酶),以未添加的样品SJ和SFJ作为对照。
表1 不同因素对米酒发酵影响的实验设计
Table 1 The experimental design about the influence of different factors on the fermentation of Mijiu

样品名称酒药类型影响因素添加时间/h酿酒酵母蛋白酶还原糖SJ(对照1)SJ---SFJ(对照2)SFJ---SJ-酵母SJ0--SJ-蛋白酶SJ-0-SJ-补加蛋白酶SJ-48-SJ-蛋白酶+还原糖SJ-048SFJ-还原糖SFJ--48
考察还原糖的影响时,对于SFJ和SJ-蛋白酶样品,于发酵进行到48 h时添加葡萄糖溶液,分别得到还原糖含量达到200 g/L以上(略高于此时SJ发酵液还原糖含量)的发酵样品(SFJ-还原糖和SJ-蛋白酶+还原糖),并以未添加葡萄糖的样品SFJ和SJ-蛋白酶为对照。
1.2.5 数据分析
用SPSS进行方差分析(ANOVA)及相关性分析并进行t检验。使用Origin进行相关性系数热图绘制。
2 结果与分析
2.1 不同类型酒药酿造米酒发酵过程差异分析
利用2种不同类型的典型酒药进行米酒发酵,发酵过程各参数变化如图1所示。SFJ在发酵48 h后发酵质量损失就显著增加,96 h时达到质量损失高峰(图1-a),发酵168 h时酒精积累可达15%左右(图1-c)。而SJ发酵质量损失变化迟缓,还原糖和α-氨基氮含量变化在24 h内与SFJ发酵过程类似,而后基本没有显著消耗(图1-a、图1-b、图1-d),酒精积累量很低(图1-c)。两者的发酵过程基本符合高度低糖型和低度高糖型米酒的发酵特点[8]。
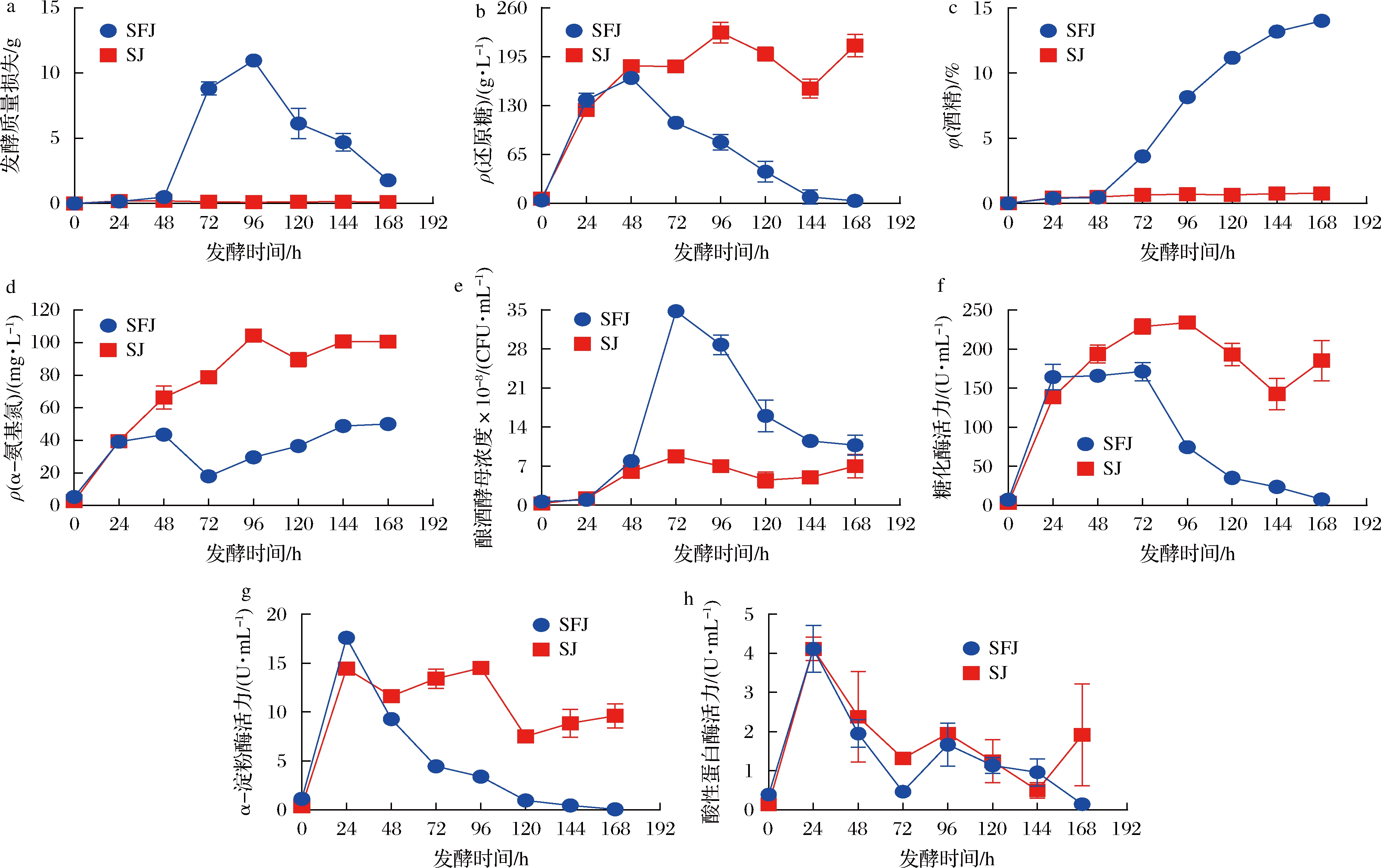
a-发酵质量损失;b-还原糖含量;c-酒精含量;d-α-氨基氮含量;e-酵母浓度;f-糖化酶活力;g-α-淀粉酶活力;h-酸性蛋白酶活力
图1 两种典型酒药米酒酿造过程中发酵参数的变化
Fig.1 Changes of fermentation parameters during the brewing process of Mijiu with two typical Jiuyao
从发酵过程的酵母数和相关酶活性分析(图1-e~图1-h)可以看出, 相较于SJ样品,SFJ发酵至48 h后,其发酵表现旺盛主要是由于酵母迅速增殖。同时SFJ发酵过程中糖化酶、α-淀粉酶活力明显下降,但2个样品的蛋白酶活性变化趋势基本类似。此外,在SFJ发酵过程中,α-氨基氮的含量相对较低,可能与其酵母的快速生长消耗较多的α-氨基氮有关。造成上述发酵差异的主要原因可能与2种酒药的酿酒酵母以及发酵开始后淀粉水解酶类活性不同造成的还原糖含量差异有关。
对这2种米酒酒药主要发酵参数进行测定,结果如表2所示。整体而言,这2种酒药的发酵参数存在显著差异。除还原糖外,SFJ各项参数均显著高于SJ。由于米酒发酵中酒药用量较小,不同酒药中还原糖和α-氨基氮含量的差异实际上对发酵过程相关参数的影响很小。
表2 两种酒药的主要发酵参数
Table 2 Main fermentation parameters of two kinds of Jiuyao

发酵参数SFJSJ方差分析(P值)酿酒酵母含量×10-7/(CFU·g-1)11.3±0.2 1.15±0.4 0.012发酵力/[g·(0.5 g)-1 酒药]9.3±0.50.5±0.10.003糖化酶活力/(U·g-1)255.3±28.467.8±300.045α-淀粉酶活力/(U·g-1)375.9±3.3116.3±6.10.001酸性蛋白酶活力/(U·g-1)242.4±21.341.1±7.10.018α-氨基氮含量/(mg·g-1)168.5±4.595.3±2.30.005还原糖含量/(mg·g-1)93±9.6168.8±3.6 0.002
除去还原糖和α-氨基氮含量,进一步对酒药其他发酵参数与发酵过程参数进行了相关性分析。如图2所示,与发酵过程参数比较相关的主要是酒药的酸性蛋白酶活力和α-淀粉酶活力。一般认为,酵母的生长和代谢是决定酒精发酵过程的主要因素。

AC-酒精含量;YN-酵母数量;FL-发酵质量损失;RS-还原糖含量; α-AN-α-氨基氮含量
图2 酒药部分发酵参数与米酒发酵过程参数的相关性分析
Fig.2 Correlations between partial fermentation parameters of Jiuyao and the process parameters of Mijiu fermentation
注:***表示P<0.01,具有显著相关性
根据表2的数据,虽然SFJ中的酿酒酵母数量明显较高,约为SJ的10倍, 但是相关性分析(图2)显示,酒药中的酵母数量与发酵过程整体参数变化相关性不大,可能不是引起二者发酵差异的主要因素。而与发酵过程中酵母数量变化整体较为相关的是酒药的蛋白酶活力。根据表2的结果,SFJ的酸性蛋白酶活力远高于SJ(近6倍)。由于酿酒酵母的生长与α-氨基氮含量密切相关[23],而蛋白酶直接影响α-氨基氮的含量,虽然发酵过程中两者的蛋白酶活力变化差异不大,但发酵初期蛋白酶活力的差异可能是影响这2种酒药发酵差异的一个重要因素,其影响着酵母能否在发酵前期快速增殖,进而影响酒精的发酵。但酒药的蛋白酶活力与发酵过程α-氨基氮含量的变化整体上相关性不大。虽然蛋白质是水解产生α-氨基氮的主要因素,但由于酵母的消耗,使得两者的整体相关性不强。关于蛋白酶在米酒发酵中的作用,相关研究目前还不多见。
α-淀粉酶和糖化酶主要用于糖化过程中淀粉的水解和还原糖的产生。但是相关性分析(图2)显示,酒药的α-淀粉酶和糖化酶活力整体上并未表现出与发酵过程中还原糖含量有明确的相关性,这可能也主要与酵母对糖的消耗有关。虽然酒药的液化酶和糖化酶活力是目前分析酒药质量的常用指标,但直接用于评价酒药类型和品质并不恰当[1,24-25],他们可能主要是通过发酵过程中引起糖含量的变化而起作用。米酒发酵过程中,酿酒酵母的生长有时会受到高还原糖浓度的抑制[26],特别是甜型米酒积累的高还原糖浓度可能会影响酵母的发酵。虽然SFJ的糖化酶与淀粉酶活力均明显高于SJ(表2),发酵0~24 h时SFJ也具有相对较高的淀粉水解酶活性和还原糖含量(图1-b、图1-f、图1-g),但随着酵母的迅速增加(图1-e),还原糖被快速消耗(图1-b),避免了高浓度还原糖的影响。而SJ酒药在发酵前期(0~72 h)酵母增殖较慢(图1-e)随着还原糖的积累,进而可能会抑制酵母的生长和代谢,使得SJ米酒发酵质量损失一直处于较低的水平(图1-a)。
根据以上结果,造成SFJ发酵性能高于SJ的原因可能与酒药中的酿酒酵母数量关系不大。2种酒药的发酵特性差异可能主要与蛋白酶影响了发酵初期酵母增殖有关,也可能受到发酵过程中积累了高浓度的还原糖影响。为了明确影响酒药发酵特性的关键因素,进一步对酵母和还原糖浓度对米酒发酵的影响进行考察。
2.2 发酵参数控制对酒药米酒发酵特性的影响
2.2.1 酒药酵母含量及蛋白酶活力对米酒发酵的影响
根据SFJ和SJ两种酒药中酵母数量和蛋白酶活力的差异,通过控制SJ发酵初始时的酵母含量和蛋白酶活性作为模拟酒药,考察这2个因素对酒药发酵性能的影响。
利用SJ在发酵0 h时分别添加酿酒酵母得到的SJ-酵母(模拟酵母含量较高的SFJ酒药)和添加酸性蛋白酶得到的SJ-蛋白酶(模拟酸性蛋白酶活性较高的SFJ酒药)两个样品,分别进行发酵。
如图3-a~图3-c所示,发酵24 h和48 h后,两者就分别开始出现较明显的发酵质量损失增加、还原糖消耗加快和酒精明显积累的现象。为了进一步验证酸性蛋白酶对SJ发酵米酒的影响,在SJ米酒发酵至48 h时再添加酸性蛋白酶(SJ-补加蛋白酶样品),观察其与发酵初始添加的差异。此时添加酸性蛋白酶虽然显著提高了之后的α-氨基氮水平(图3-d),但并不能促进米酒的发酵,其他发酵参数与对照的SJ样品比较类似,而与初始添加酸性蛋白酶的SJ-蛋白酶样品存在显著差异。综上,初始添加酿酒酵母和酸性蛋白酶都可以明显改善酒药的发酵性能。且初始添加酸性蛋白酶可以使SJ整体发酵特点和酶活力变化趋势更加接近SFJ,最终的酒精产率也更高,而48 h时再添加酸性蛋白酶对米酒发酵影响不大。综上,酒药中的酿酒酵母数量和酸性蛋白酶活力对酒药的发酵特性都有重要影响,但两者的作用存在差异。

a-发酵质量损失;b-还原糖含量;c-酒精含量;d-α-氨基氮含量;e-酵母浓度;f-糖化酶活力;g-α-淀粉酶活力;h-酸性蛋白酶活力
图3 初始酿酒酵母数及蛋白酶活性对糖化型酒药SJ米酒发酵的影响
Fig.3 Effects of initial yeast number and protease activity on the fermentation of Mijiu with Jiuyao SJ
造成这种现象的原因应该与酿酒酵母在发酵初期的增殖密切相关,而酵母含量的变化影响了整个发酵过程。由于酿酒酵母的添加,使得SJ-酵母样品的酵母数量在发酵24 h后就开始明显增加(图3-e),从而表现出其发酵质量损失显著提升,并较早达到质量损失的高峰。但由于酵母数激增,α-氨基氮消耗过快,影响了发酵中后期酵母的生长代谢,最终影响了乙醇的产量。而发酵初始蛋白酶的添加,使得SJ-蛋白酶样品在发酵初期大量产生α-氨基氮(图3-d),α-氨基氮供应的改善,促进了酵母的繁殖(图3-e),使得发酵48~72 h质量损失显著提升(图3-a)。虽然SJ-蛋白酶样品在发酵初始酿酒酵母数较低,但由于具有较高的蛋白酶活力,使得该样品仍然得到了类似于SFJ的发酵结果,表明酒药的酸性蛋白酶活力对于酿酒酵母的增殖以及米酒的发酵似乎比酵母数更为重要。由于酿酒酵母在自然酒药中的广泛存在,而酒药的酸性蛋白酶对于酵母的增殖具有明显的促进作用,因此,酒药的酸性蛋白酶活力可以认为是调节酒药发酵特性,甚至改变酒药类型的一个关键因素。
值得注意的是,SJ在米酒发酵至24 h后,其α-氨基氮含量高于SFJ发酵样品(图1-d),但其酵母仍未大量繁殖。而发酵至48 h时再添加酸性蛋白酶(图3,SJ-补加蛋白酶样品),添加之后α-氨基氮含量得到了显著提高,但也未能促进其酵母增殖,增加发酵质量损失(图3-a、图3-e),可能是SJ和SFJ中酿酒酵母的发酵特性不同导致。SJ中的酿酒酵母可能需要更高浓度的α-氨基氮才能在发酵初期大量繁殖进行发酵,正如发酵初始添加蛋白酶的SJ样品(SJ-蛋白酶)所表现的一样(图3-a、图3-d、图3-e)。在对照样品SJ的发酵初期,由于α-氨基氮含量难以满足其酵母增殖的要求,导致酵母增殖缓慢,发酵质量损失水平较低(图1-a、图1-d、图1-e)。虽然48 h后α-氨基氮通过逐渐积累或者补加蛋白酶而增加到较高水平(图3-d),但由于其他因素的影响,如还原糖积累到较高浓度可能对酿酒酵母的增殖产生抑制,出现类似葡萄酒迟滞发酵的情况[13],最终造成发酵质量损失始终处于较低水平。因此,发酵初期充足的α-氨基氮供应,对于酒药的发酵性能是十分重要的。而发酵初期α-氨基氮的供应主要与酒药的酸性蛋白酶活力有关。这进一步表明酸性蛋白酶活力对于酒药发酵特性的重要性。
综上所述,虽然酿酒酵母的数量及其发酵特性对于酒药的发酵性能非常重要,但是酸性蛋白酶活力可能对其发酵性能更为关键,更适合于在米酒的实际生产中,通过调控发酵初期α-氨基氮水平促进酿酒酵母的增殖,进而改变酒药的发酵特性。在本研究中,SJ-蛋白酶样品由于在发酵初始添加了酸性蛋白酶,从而产生了足够的α-氨基氮,令酵母于发酵初期大量繁殖,使得SJ中的酵母数量及其发酵特性不再是影响酒药发酵性能的关键因素,基本达到了SFJ的发酵水平,实现了从糖化型酒药到糖化发酵型酒药的转变。王斯维等[1]在模拟米酒发酵的实验中也发现适当提高蛋白酶活力可以增加米酒的发酵质量损失和乙醇含量,说明酒药的蛋白酶活力对于酒药发酵力有重要作用。CAI等[9]也发现酒精产率较高的酒药其蛋白酶活性也较高。因此,酒药的酸性蛋白酶活力可作为区分糖化型酒药和糖化发酵型酒药的一个重要依据。当然,这一结论还需要得到更多研究的验证。此外,过量的蛋白酶也会产生更高含量的α-氨基氮,从而可能产生过多的高级醇,影响米酒的风味与品质[1]。控制酸性蛋白酶活性在合适的水平,仍然需要进一步研究。
2.2.2 发酵过程中还原糖含量对酒药米酒发酵的影响
造成SFJ与SJ发酵差异的另一个可能因素是发酵过程中较高的还原糖浓度会对酵母增殖产生抑制。48 h是2种米酒发酵出现明显差异的关键节点,在48 h前,两者的发酵表现基本类似,48 h后SJ样品的还原糖及糖化酶和α-淀粉酶水平较明显地高于SFJ(图1)。
如图4所示,添加了还原糖的SFJ米酒发酵样品(SFJ-还原糖),其发酵质量损失与对照SFJ米酒发酵差别不大(图4-a)。而对于初始添加酸性蛋白酶的SJ样品,48 h补加还原糖后,SJ-蛋白酶+还原糖的发酵明显受到抑制。该样品的发酵特点整体上更接近于未添加的对照样品SJ,而与仅初始添加蛋白酶的SJ-蛋白酶样品产生明显差异。
以上结果表明,较高浓度的还原糖对不同酒药的发酵进程产生的影响不同。由于自然酒药中的酵母发酵特性存在差异,除了对氮源的需求不同外,对较高浓度的还原糖抗性也存在差异[13, 27-28]。SFJ中的酵母对高浓度还原糖的抗性较高,因此还原糖含量的提高并未影响SFJ的米酒发酵,这一特性有利于此类酒药生产较高酒精度的米酒。而对于SJ,其中的酵母明显对还原糖的抗性较弱,一旦还原糖浓度升高到一定程度,就会对酵母产生抑制,影响酒精发酵。这种特性显然也有利于高糖度、低酒精度的甜型米酒的生产。同时这也解释了之前SJ发酵24 h以后以及发酵48 h补加酸性蛋白酶后,在较高α-氨基氮条件下,仍然未能得到较高发酵质量损失的原因(图1、图3-a)。虽然不同酵母对高浓度还原糖抗性不同,由于米酒发酵首先需要进行糖化,发酵初始还原糖浓度通常不高,只要酿酒酵母能够迅速增殖,及时消耗还原糖,维持还原糖浓度在较低的水平,就能够实现边糖化边发酵。而要使酵母迅速增殖,酸性蛋白酶提供α-氨基氮仍然是关键因素。

a-发酵质量损失;b-还原糖含量;c-酒精含量;d-α-氨基氮含量;e-酵母浓度;f-糖化酶活力;g-α-淀粉酶活力;h-酸性蛋白酶活力
图4 发酵过程中还原糖浓度变化对2种不同酒药米酒发酵的影响
Fig.4 Effects of reducing sugar content on fermentation of Mijiu with two different Jiuyao
3 结论
本研究针对自然培养的2种不同类型米酒酒药,糖化型酒药(SJ)和糖化发酵型酒药(SFJ),通过米酒发酵,对这2种酒药的发酵特性差异及其影响因素进行了分析。基于酒药主要发酵参数与米酒发酵过程参数进行相关性分析,通过调节发酵参数、模拟不同酒药进行的米酒发酵实验,结果表明,虽然酒药中酿酒酵母的数量及其发酵特性对于酒药的发酵性能非常重要,但是酒药的酸性蛋白酶活力可能是能够调节酒药发酵特性的一个更为关键的因素。通过提高酒药的酸性蛋白酶活力,可在发酵初期提供必要的α-氨基氮,从而促使酿酒酵母增殖更快,进而提高其发酵力,甚至可以将糖化型酒药转变为糖化发酵型酒药。因此,酒药的酸性蛋白酶活力可作为一个预测米酒发酵特性的重要指标以及酒药分类的重要依据。但是作为指标的酸性蛋白酶活力水平,尚需进一步确定。目前关于酒药蛋白酶对米酒发酵的影响研究尚不多见,而本研究中涉及酒药的样本数量也有限,研究结论还需要得到更多的实践检验。本研究结果为米酒酒药的分类以及米酒生产的质量控制提供了一定的参考。
[1] 王斯维. 中国传统米酒酒药酿造酶系的研究[D].无锡:江南大学, 2020.
WANG S W.Study on the enzyme system of Jiuyao for traditional Mijiu brewing[D].Wuxi:Jiangnan University, 2020.
[2] 谢广发. 黄酒酿造技术(第二版)[M].北京:中国轻工业出版社, 2016.
XIE G F.Brewing Technology of Huangjiu[M].2th ed.Beijing:China Light Industry Press, 2016.
[3] 王文平, 熊英梅, 陈赛浙, 等.不同地区米酒曲细菌多样性解析及表型预测[J].食品工业科技, 2021, 42(20):134-139.
WANG W P, XIONG Y M, CHEN S Z, et al.Analysis of bacterial diversity and prediction of phenotype in rice wine koji from different regions[J].Science and Technology of Food Industry, 2021, 42(20):134-139.
[4] 焦晶凯. 传统酿造米酒微生物多样性及优势菌特性的研究[D].哈尔滨:哈尔滨工业大学, 2012.
JIAO J K.Microbes diversity and characteristics of dominant bacteria in original Chinese rice wine[D].Harbin:Harbin Institute of Technology, 2012.
[5] 顾国贤. 酿造酒工艺学[M].北京:中国轻工业出版社, 2009.
GU G X.Brewing Technology[M].Beijing:China Light Industry Press, 2009.
[6] ZHANG B, KONG L Q, CAO Y, et al.Metaproteomic characterisation of a Shaoxing rice wine “wheat Qu” extract[J].Food Chemistry, 2012, 134(1):387-391.
[7] 王菲, 钟小丹, 戴彩霞, 等.原料米和酒曲对米酒滋味品质影响的评价[J].食品研究与开发, 2017, 38(20):80-84.
WANG F, ZHONG X D, DAI C X, et al.A comparative study on the taste profile characterization of rice wine fermented by different kinds of rice and rice wine koji[J].Food Research and Development, 2017, 38(20):80-84.
[8] 邹凌波, 王栋, 余海燕, 等.基于理化指标和风味成分的酿造米酒分类及其相关特性分析[J].食品与发酵工业, 2019, 45(13):78-84.
ZOU L B, WANG D, YU H Y, et al.Classification and characteristics of typical fermented Mijiu based on physicochemical parameters and flavor components[J].Food and Fermentation Industries, 2019, 45(13):78-84.
[9] CAI H Y, ZHANG T, ZHANG Q, et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology, 2018, 73:319-326.
[10] CHEN C, LIU Y, TIAN H X, et al.Metagenomic analysis reveals the impact of JIUYAO microbial diversity on fermentation and the volatile profile of Shaoxing-Jiu[J].Food Microbiology, 2020, 86:103326.
[11] 时桂芹, 任菲, 谢冰宗, 等.高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J].食品工业科技, 2019, 40(20):94-100.
SHI G Q, REN F, XIE B Z, et al.Effect of high-glucose condition on antioxidant activity and metabolism of saccharomy cescerevisiae[J].Science and Technology of Food Industry, 2019, 40(20):94-100.
[12] 黄小晶. 氮源对酿酒酵母发酵特性的影响[D].杨凌:西北农林科技大学, 2016.
HUANG X J.Effects of assimilable nitrogen on the fermentation characteristics of Saccharomyces cerevisiae[D].Yangling:Northwest A & F University, 2016.
[13] 谢诗怡. 解决冰酒发酵迟滞问题的实验研究[D].大连:大连工业大学, 2018.
XIE S Y.Experimental study on the method of solving stuck and slow fermentation of icewine[D].Dalian:Dalian Polytechnic University, 2018.
[14] 沈怡方. 白酒生产技术全书[M].北京:中国轻工业出版社, 2015.
SHEN Y F.Encyclopedia of Baijiu Production Technology[M].Beijing:China Light Industry Press, 2015.
[15] 邹凌波. 酶法酿造米酒新技术的研究[D].无锡:江南大学, 2019.
ZOU L B.Study on the new technology of mijiu-making by enzymes[D].Wuxi:Jiangnan University, 2019.
[16] 赵凯, 许鹏举, 谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学, 2008, 29(8):534- 36.
ZHAO K, XU P J, GU G Y.Study on determination of reducing suger content using 3,5-dinitrosalicylic acid method[J].Food Science, 2008, 29(8):534-536.
[17] NARENDRANATH N V, THOMAS K C, INGLEDEW W M.Effects of acetic acid and lactic acid on the growth of Saccharomyces cerevisiae in a minimal medium[J].Journal of Industrial Microbiology and Biotechnology, 2001, 26(3):171-177.
[18] 王斯维, 王栋, 陶玲玲, 等.黄酒和米酒中氨基酸态氮测定方法的比较[J].食品与发酵工业, 2019, 45(23):232-238.
WANG S W, WANG D, TAO L L, et al.Comparative study on methods for determination of amino acid nitrogen in Huangjiu and Mijiu[J].Food and Fermentation Industries, 2019, 45(23):232-238.
[19] LI Z M, BAI Z H, WANG D L, et al.Cultivable bacterial diversity and amylase production in three typical Daqus of Chinese spirits[J].International Journal of Food Science & Technology, 2014, 49(3):776-786.
[20] YOO Y J, HONG J, HATCH R T.Comparison of alpha-amylase activities from different assay methods[J].Biotechnology and Bioengineering, 1987, 30(1):147-151.
[21] MARIN A, DENIMAL E, GUYOT S, et al.A robust generic method for grid detection in white light microscopy Malassez blade images in the context of cell counting[J].Microscopy and Microanalysis, 2015, 21(1):239-248.
[22] 王鹏. 地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡:江南大学, 2017.
WANG P.Effects of Bacillus licheniformis inoculation on the microbial community structure and metabolism during strong flavored liquor brewing process[D].Wuxi:Jiangnan University, 2017.
[23] GUTIÉRREZ A, CHIVA R, SANCHO M, et al.Nitrogen requirements of commercial wine yeast strains during fermentation of a synthetic grape must[J].Food Microbiology, 2012, 31(1):25-32.
[24] 相飞, 汪立平.传统甜酒曲的模糊综合评价及优势丝状真菌的分离鉴定[J].食品与发酵工业, 2014, 40(8):78-83.
XIANG F, WANG L P.Fuzzy synthetic evaluation in sweet rice wine starter and identification of dominated filamentous fungus[J].Food and Fermentation Industries, 2014, 40(8):78-83.
[25] 张翠翠, 郭波, 陈雅轩, 等.高质量酒曲的制备工艺及酒曲活力评价[J].安徽农业科学, 2019, 47(6):166-169;172.
ZHANG C C, GUO B, CHEN Y X, et al.Preparation process of high-quality jiuqu and vigor evaluation of jiuqu[J].Journal of Anhui Agricultural Sciences, 2019, 47(6):166-169;172.
[26] 赵光鳌. 黄酒工业手册[M].北京:中国轻工业出版社, 2020.
ZHAO G A.Handbook of Huangjiu Industry[M].Beijing:China Light Industry Press, 2020.
[27] ZEMAN
 KOV
KOV J, KODEDOV
J, KODEDOV M, PAPOU
M, PAPOU KOV
KOV K, et al.Four Saccharomyces species differ in their tolerance to various stresses though they have similar basic physiological parameters[J].Folia Microbiologica, 2018, 63(2):217-227.
K, et al.Four Saccharomyces species differ in their tolerance to various stresses though they have similar basic physiological parameters[J].Folia Microbiologica, 2018, 63(2):217-227.
[28] 徐成龙, 王珍珍, 余瞻, 等.食用植物酵素中酵母菌的分离鉴定及耐受性研究[J].食品与发酵工业, 2021, 47(4):80-86.
XU C L, WANG Z Z, YU Z, et al.Isolation, identification and tolerance of yeast in edible plant Jiaosu[J].Food and Fermentation Industries, 2021, 47(4):80-86.