荸荠(Heleocharis dulcis)属于单子叶莎草科,又称马蹄、芍、凫茈、地栗、通天草等[1-4]。荸荠原产于中国和印度,在我国已有3 000多年的栽培历史,广泛分布在长江流域及以南各省的低洼地区,我国种植面积超5万hm2,年产鲜果百万吨以上,其中广西是我国最大的荸荠主产区,以桂林市和贺州市种植居多,产量居全国首位[5-7]。荸荠以其地下球茎为食用器官,可鲜食、熟食或供药用,是一种优良的药食同源果蔬类食品[8-11]。荸荠肉质细嫩、营养丰富、汁多味甜、清脆爽口,有南方“地下雪梨”,北方“江南人参”之美誉[12]。荸荠削皮生食脆甜多汁、生津止渴,烹饪可做成美味佳肴,荤素皆宜[13]。荸荠不但口感好,营养也高,含有蛋白质、脂肪、粗纤维、黄酮类、甾醇等诸多功能活性成分[14],研究表明荸荠皮渣中含有酚类物质[15]、膳食纤维[16]、天然色素[17-18]、多糖[6,19]等物质,因此荸荠具有清热解毒、凉血生津、利尿通便、化湿祛痰、消食除胀的功效。据研究报道,在荸荠中所含生物类多糖具有促进人体生长发育、加快体内3大物质(糖、脂肪、蛋白质)代谢、维持生理功能的需要、调节酸碱平衡等功能[20]。
多糖又称多聚糖,多糖是生物体内除蛋白质和核酸外的又一类重要信息分子,具有多种生物活性。研究发现,多糖具有抗肿瘤、抗病毒、抗突变、抗衰老、抗凝血、降血糖和环境治理等作用[21-22]。因其来源广泛,没有毒副作用,而且药物质量通过化学手段容易控制等优点,成为当今新药及功能保健品和绿色食品添加剂发展的新方向[9]。
目前关于荸荠的研究大多是以荸荠皮为原料,提取荸荠多糖,以全荸荠为原料研究未见报道。本实验以全荸荠为原料优化水提法提取多糖,考察提取剂浓度、料液比、解析时间及提取时间等因素的影响,并在单因素试验基础上正交优化提取工艺,提高多糖的提取率并对其进行抗氧化性能测定,可以为该植物的进一步开发利用提供理论参考。
1 材料与方法
1.1 材料与设备
1.1.1 试验材料
荸荠购买于安徽省合肥市庐江县。
葡萄糖、抗坏血酸、硫酸亚铁、磷酸氢二钠、磷酸二氢钠,天津博迪化工有限公司;苯酚,西陇化工股份有限公司;浓硫酸,上海振企化学试剂有限公司;木瓜蛋白酶,河南万邦实业有限公司;无水乙醇、过氧化氢,江苏强盛功能化学股份有限公司;DPPH,上海化成工业发展有限公司;水杨酸,上海科丰实业有限公司;以上试剂均为分析纯。
1.1.2 试验设备
GZX-9023MBE型电热鼓风干燥箱,上海博迅医疗生物仪器股份有限公司;FA2004B型电子分析天平,上海市安亭电子仪器厂;LD-T350高速万能粉碎机,上海顶帅电器有限公司;Allegra64R型电动离心机,美国贝克曼库尔特;HH-4型数显恒温水浴锅,金坛市杰瑞尔电器有限公司;V-5100B可见分光光度计,上海元析仪器有限公司;SHZ-D型循环水真空泵,河南佰泽仪器有限公司。
1.2 试验方法
1.2.1 原料预处理
选取新鲜的荸荠,去除病虫害果实,洗净切片,60 ℃烘干,用粉碎机粉碎后,过60目筛获得荸荠干粉,备用。
1.2.2 葡萄糖标准曲线的制作
精确称取经105 ℃干燥至恒重的葡萄糖标准品10 mg,置于100 mL容量瓶中,加水适量使其溶解,定容。用移液管精密移取0、0.1、0.2、0.3、0.4、0.5、0.6 mL的葡萄糖标准品溶液,分别置于20 mL试管中,依次加水至2.0 mL,另加1.0 mL体积分数5%的苯酚溶液,摇匀,分别迅速滴加浓硫酸5.0 mL,在室温下显色20 min,以空白校正零点,于490 nm处检测其吸光值,以葡萄糖浓度为横坐标,吸光度值为纵坐标绘制标准曲线[23]。
1.2.3 荸荠多糖的提取
精确称取荸荠干粉1.0 g,置于100 mL烧杯中,按设定的料液比(荸荠干粉∶乙醇)加入设定浓度的乙醇溶液解析设定的时间,乙醇解析完成后,加入80 ℃,按液料比20∶1(mL∶g)加入蒸馏水,按设定的时间在80 ℃下恒温热水浸提[24],将经过热水浸提后的上清液减压抽滤至10 mL的容量瓶中,用蒸馏水洗涤残渣2~3次,将洗涤液转至容量瓶中,定容,得到荸荠多糖提取液。
1.2.4 多糖含量的测定
将10 mL荸荠多糖提取液稀释25倍,取0.5 mL稀释液于25 mL具塞试管中,加水稀释至2 mL,加入1.0 mL 5%的苯酚溶液,摇匀,分别迅速滴加浓硫酸5.0 mL,在室温下显色20 min,以空白校正零点,于490 nm处检测其吸光值,代入葡萄糖标准曲线中,计算样品中多糖的浓度,荸荠多糖的得率计算如公式(1)所示[25-26]:
多糖得率![]()
(1)
式中:ρ,荸荠多糖的浓度,mg/mL;V,样品溶液总体积,mL;m,荸荠干粉的质量,g;25,稀释倍数。
1.2.5 单因素试验
1.2.5.1 乙醇体积分数对荸荠多糖得率的影响
分别称取1.0 g的荸荠干粉于5个100 mL烧杯中,加入50%、60%、70%、80%、90%(体积分数)乙醇溶液5 mL,设定解析时间为30 min,浸提时间20 min,按照1.2.3中的方法处理提取液,再按照1.2.4中的方法测定荸荠多糖的得率,分析乙醇体积分数对荸荠多糖得率影响。
1.2.5.2 料液比对荸荠多糖得率的影响
分别称取1.0 g荸荠干粉于5个100 mL烧杯中,加入80%乙醇溶液1.0、3.0、5.0、7.0、9.0 mL即料液比1∶1、1∶3、1∶5、1∶7、1∶9(g∶mL),设定解析时间为30 min,浸提时间20 min,提取液处理及多糖得率测定同1.2.5.1。
1.2.5.3 解析时间对荸荠多糖得率的影响
分别称取1.0 g的荸荠干粉于5个100 mL烧杯中,再分别加入80%(体积分数)乙醇溶液5 mL,解析20、25、30、35、40 min,设定浸提时间20 min,提取液处理及多糖得率测定同1.2.5.1。
1.2.5.4 提取时间对荸荠多糖得率的影响
分别称取1.0 g的荸荠干粉于5个100 mL烧杯中,再分别加入80%(体积分数)的乙醇溶液5 mL,设定解析时间为30 min,浸提10、20、30、40、50 min,提取液处理及多糖得率测定同1.2.5.1。
1.2.6 正交试验
以单因素试验结果为依据,由于乙醇体积分数对荸荠多糖得率影响较小,故排除此因素的影响,选取料液比、解析时间、提取时间为考察条件,进行正交试验。正交试验因素水平见表1。
表1 L9(33)正交试验因素水平表
Table 1 L9(33) orthogonal experimental factors and level design

水平因素A料液比(g∶mL)B解析时间/minC提取时间/min11∶4281521∶5302031∶63225
1.2.7 荸荠多糖抗氧化活性的测定
1.2.7.1 DPPH自由基清除能力的测定
DPPH自由基清除活性按照YOSHIDA等[27]方法进行测定。抗坏血酸(VC)作为天然水溶性抗氧化剂,具有较强的还原性,因此本实验将VC设为阳性对照,精确移取0.2、0.4、0.6、0.8、1.0 mg/mL样品溶液或VC对照溶液3.0 mL于25 mL具塞试管中,分别加入80 mg/L DPPH的乙醇溶液4.0 mL,蒸馏水1.0 mL,避光,摇匀,放置30 min。以无水乙醇作为对照,在517 nm处测定样品吸光值[28],DPPH自由基清除能力计算如公式(2)所示:
DPPH自由基清除能力![]()
(2)
1.2.7.2 ·OH清除能力的测定
以VC作为阳性对照,在25 mL具塞试管中依次加入浓度为6 mmol/L FeSO3溶液2.0 mL,浓度为6 mmol/L水杨酸-乙醇溶液2.0 mL,精确移取质量浓度0.2、0.4、0.6、0.8、1.0 mg/mL的荸荠多糖粗提液或VC溶液3.0 mL,浓度为6 mmol/L H2O2 溶液2.0 mL,于37 ℃条件下反应0.5 h。用蒸馏水代替荸荠多糖粗提液作空白对照,在510 nm处测定样品吸光度,平行测定3次,取平均值记录数据,·OH清除能力计算如公式(3)所示[29]:
·OH清除率![]()
(3)
式中:Ax,样品液吸光度;A0,空白对照的吸光度;Ax0,不加水杨酸时提取液自身的吸光度。
1.2.8 数据统计分析
利用SPSS21、Origin Pro 9.0及Graph Pad Prism软件分别对单因素试验、正交试验及抗氧化试验所得到的数据进行分析。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
分别以葡萄糖质量浓度和样品在490 nm处吸光度值作为横、纵坐标,得到线性回归方程:y=9.667 9x-0.004,R2=0.999 5。
2.2 单因素试验结果
2.2.1 乙醇浓度对多糖得率的影响
由图1可知,随着提取剂乙醇体积分数的增加,荸荠多糖的得率增大,当乙醇体积分数为80%时,荸荠多糖得率最大为19.92%,这可能是因为荸荠中的多糖在该浓度的溶剂中溶出扩散程度几乎达到最大所致;超过80%,随着乙醇体积分数增加,荸荠多糖得率降低,高浓度的乙醇可能会促使其他醇溶性物质溶出,导致多糖的相对含量降低,且乙醇容易挥发,导致多糖提取量随之下降[30]。因此80%乙醇为荸荠多糖的最佳提取体积分数。
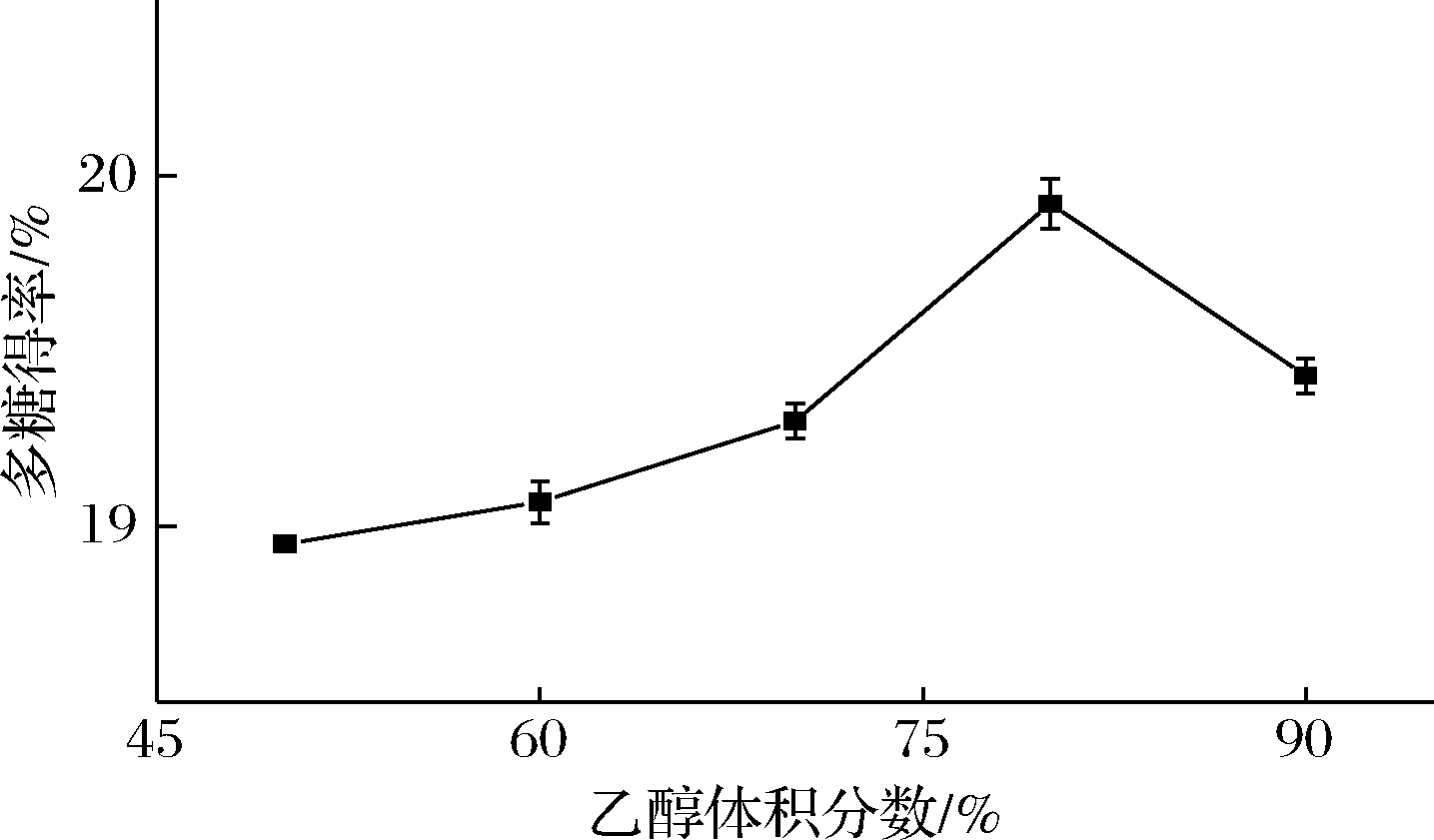
图1 乙醇体积分数对多糖得率的影响
Fig.1 Effect of the ethanol concentration on the extraction yield of polysaccharide
2.2.2 料液比对多糖得率的影响
如图2所示,多糖得率在料液比为1∶5(g∶mL)时最大,为16.59%,之后随着料液比增加多糖得率下降。得率的增大是由于提取剂体积增大,提取出的多糖含量增加,而当料液比过大时,醇溶性杂质会随着多糖分子的溶出而溶出[31],使多糖的相对含量降低,导致得率下降。因此料液比1∶5(g∶mL)为荸荠多糖的最佳提取比例。由图2可知,料液比对荸荠多糖的得率影响显著,但由于操作过程中平行组间测定时间过长或过短导致误差偏大。
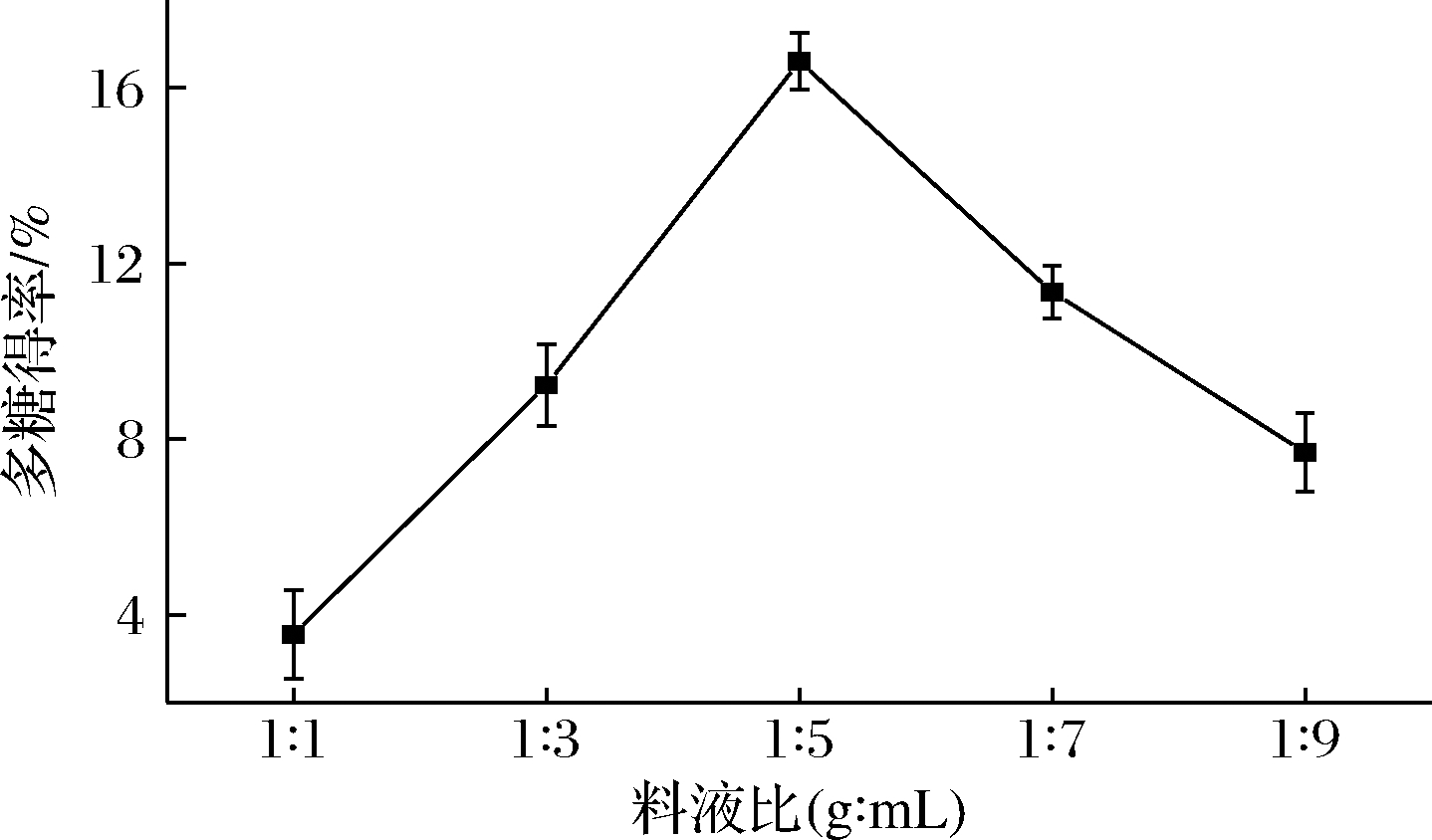
图2 料液比对多糖得率的影响
Fig.2 Effect of solid-liquid ratio on the extraction yield of polysaccharides
2.2.3 解析时间对多糖得率的影响
由图3可知,随着解析时间的延长,多糖得率增大;当解析30 min时多糖得率最大为15.23%;随后随着解析时间的再延长多糖得率降低。分析可得,随着乙醇解析时间的增加,被溶出的多糖相对含量增加,得率增大;如果解析时间过长,会导致杂质溶出增多,多糖相对含量下降,致使得率降低。因此解析30 min为荸荠多糖的最佳解析时间。由图3可知,解析时间对荸荠多糖的得率影响显著,但由于解析结束后未同时进入提取阶段导致误差偏大。
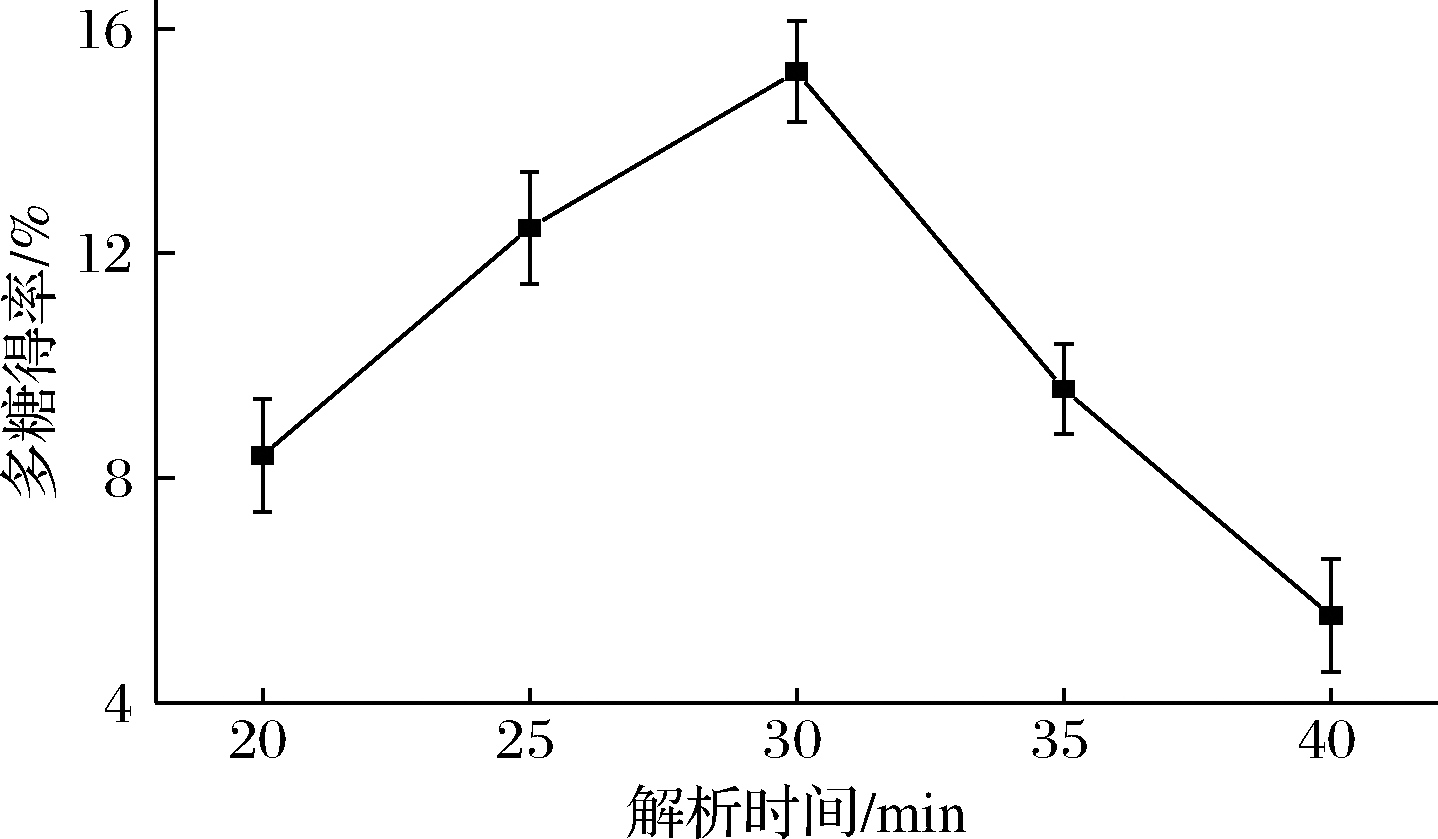
图3 解析时间对多糖得率的影响
Fig.3 Effect of parsing time on the extraction yield of polysaccharides
2.2.4 提取时间对多糖得率的影响
由图4可知,随着恒温热水提取时间延长,多糖得率增大,当提取20 min时,多糖得率最大,为16.97%;之后随着提取时间再延长多糖得率降低。据图4分析,提取时间延长,解析出的多糖被分解的越多,造成损失[32],从而导致得率降低。因此提取20 min为荸荠多糖的最佳提取时间。由图4可知,提取时间对荸荠多糖的得率影响显著,但由于提取结束后未同时测定导致误差偏大。
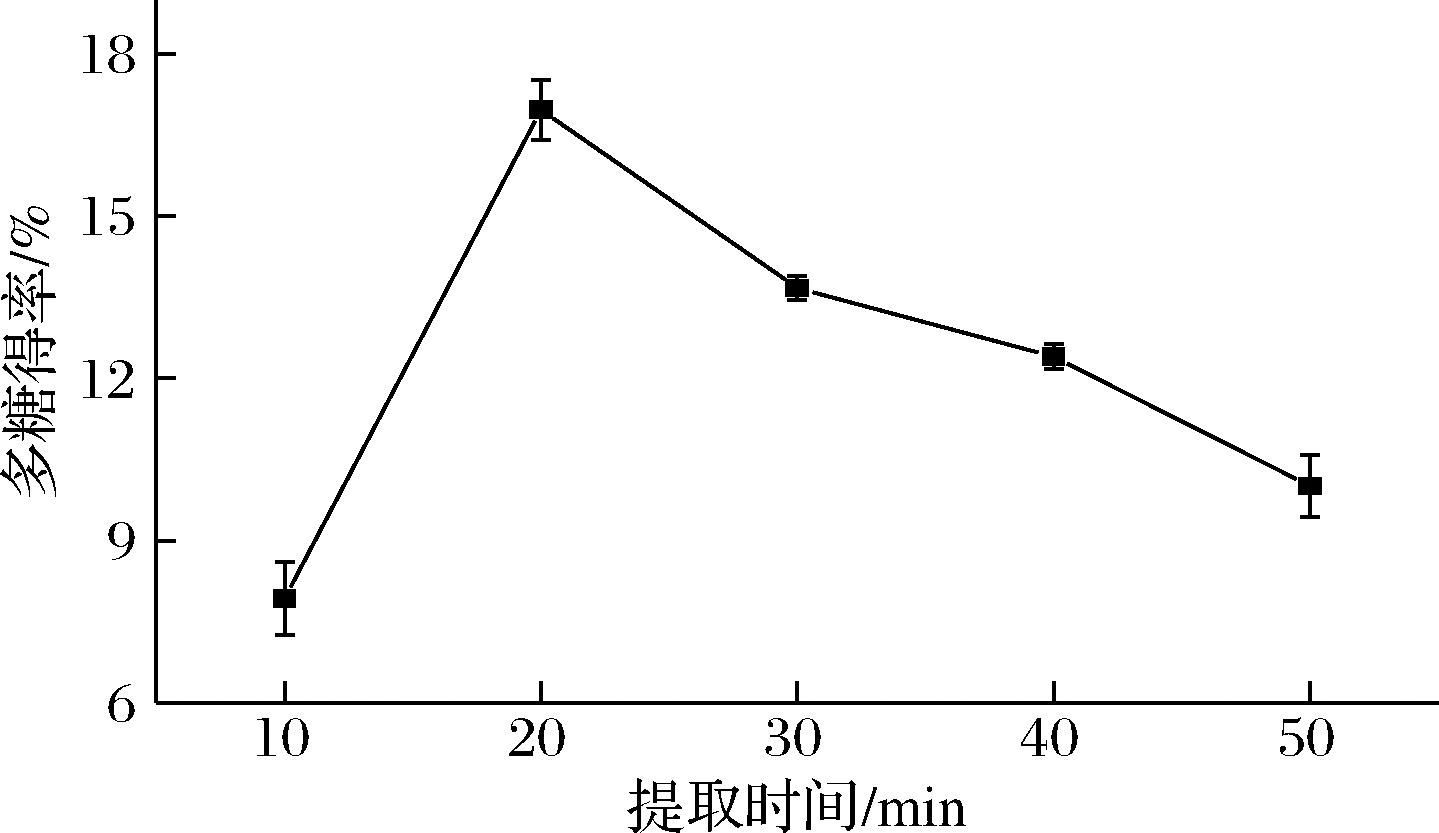
图4 提取时间对多糖得率的影响
Fig.4 Effect of extration time period on the extraction yield of polysaccharides
2.3 正交试验结果
结合单因素试验结果,可以看出4个因素中料液比、解析时间及提取时间对荸荠多糖的得率影响较为明显,而乙醇体积分数对荸荠多糖得率的影响不大,因此选取提取时间、料液比及解析时间3个因素进行正交优化试验[33-34]。
由表2中R值可知,3种因素对荸荠多糖得率影响的主次顺序为料液比>解析时间>提取时间,料液比成为影响荸荠多糖得率的首要因素,其次是解析时间、提取时间。荸荠多糖的最佳提取参数组合为A2B3C2,即料液比1∶5(g∶mL)、解析时间32 min、提取时间20 min。
用SPSS 21统计软件对试验结果进行方差分析,由表3可知,因素A、B、C在P<0.01水平上有极显著性差异。
表2 L9(33)正交试验设计及结果
Table 2 L9(33) orthogonal array design and experimental results
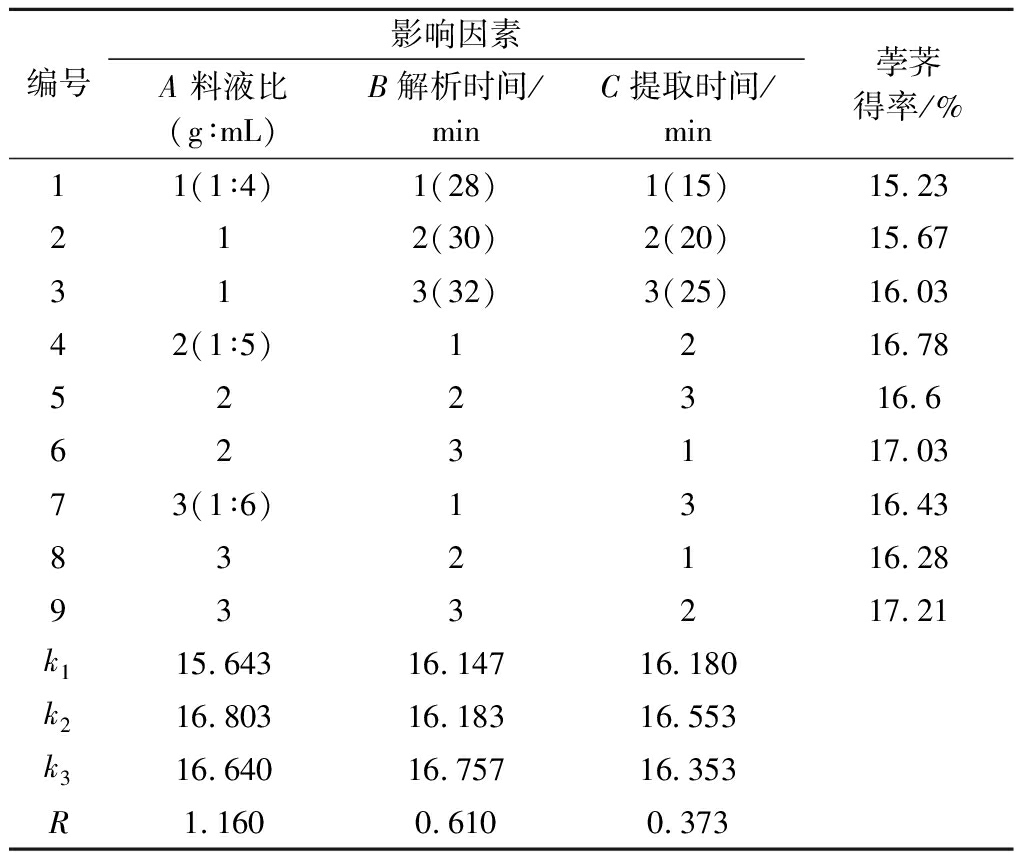
编号影响因素A 料液比(g∶mL)B解析时间/minC提取时间/min荸荠得率/%11(1∶4)1(28)1(15)15.23212(30)2(20)15.67313(32)3(25)16.0342(1∶5)1216.78522316.6623117.0373(1∶6)1316.43832116.28933217.21k115.64316.14716.180k216.80316.18316.553k316.64016.75716.353R1.1600.6100.373
表3 正交试验方差分析结果
Table 3 Analysis of variance for the orthogonal array design
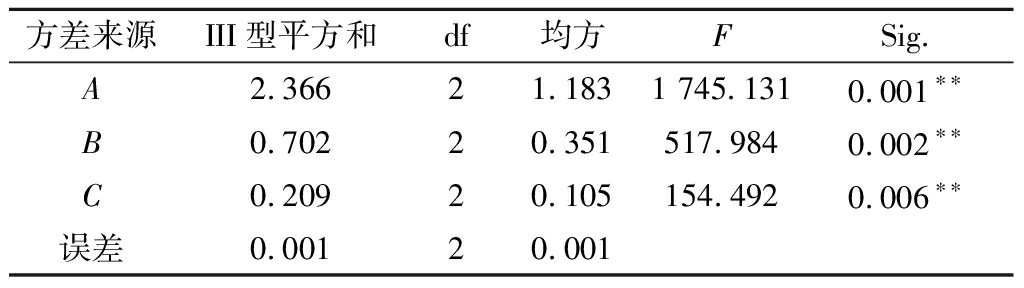
方差来源III型平方和df均方FSig.A2.36621.1831 745.1310.001∗∗B0.70220.351517.9840.002∗∗C0.20920.105154.4920.006∗∗误差0.00120.001
注:**,表示在P<0.01水平上有极显著差异
为验证正交试验工艺组合料液比1∶5(g∶mL)、解析时间32 min、提取时间20 min,进行3次平行验证试验。结果表明,在该组合工艺条件下,荸荠多糖平均提取率为17.86%,证明该正交试验优化结果准确可靠。
2.4 荸荠多糖抗氧化活性的研究
2.4.1 多糖提取液对DPPH自由基的清除能力
由图5可知,在本研究的浓度范围内,清除率随着多糖质量浓度的增加而增大。VC对DPPH自由基具有很强的清除能力,当VC质量浓度为0.2 mg/mL时,清除效果已经达到85%。与VC相比,荸荠多糖对DPPH自由基清除作用稍差,当质量浓度为1.0 mg/mL,其清除率最高可达73.68%。经数据分析,荸荠多糖对DPPH自由基的IC50为0.142 mg/mL,其IC50小于10 mg/mL,说明荸荠多糖具有较好的抗氧化效果。VC对DPPH自由基的IC50明显小于荸荠多糖,所以VC对DPPH自由基清除效果优于荸荠多糖。
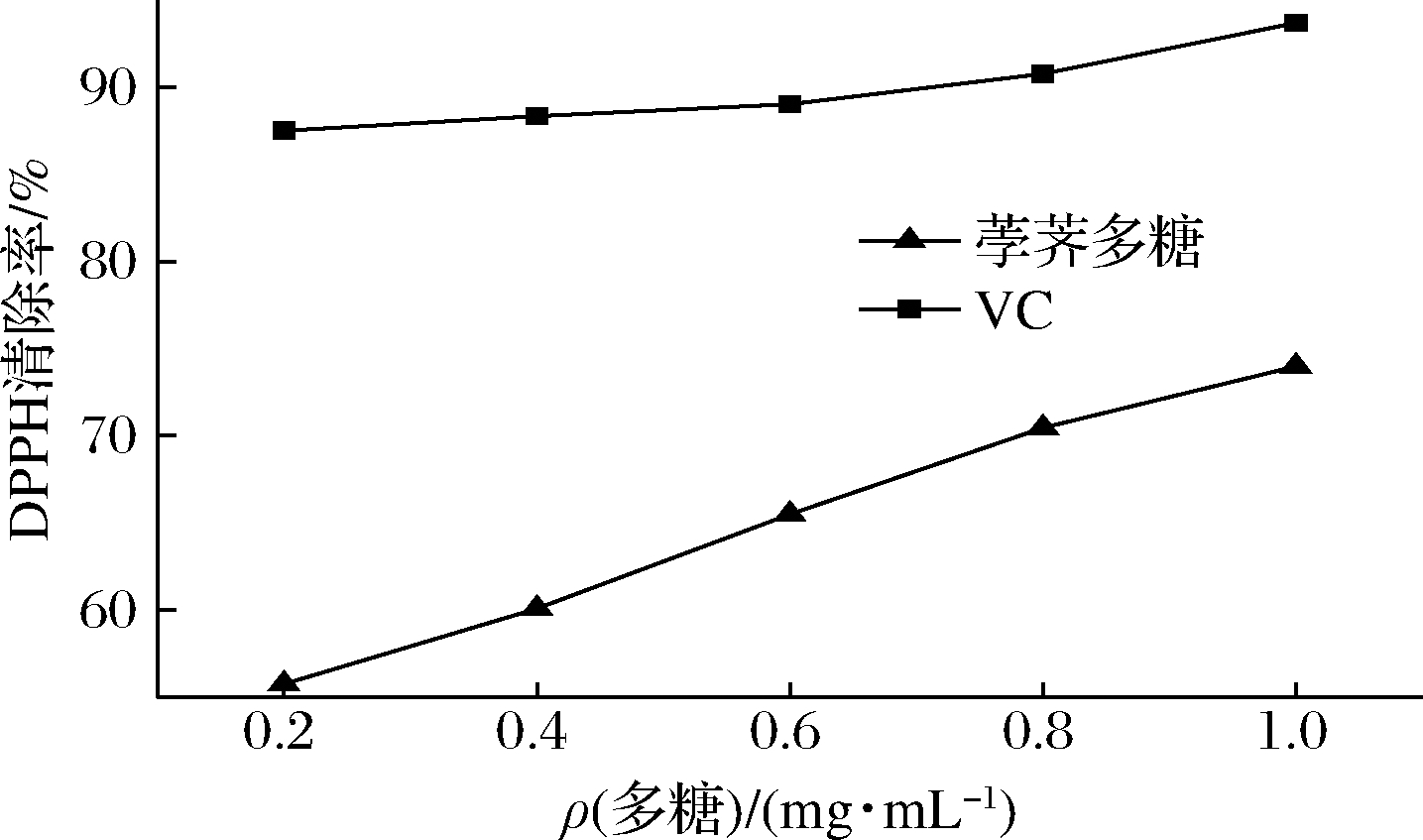
图5 多糖粗提液对DPPH自由基的清除能力
Fig.5 Scavenging effect of crude polysaccharide on DPPH free radicals
2.4.2 多糖粗提液对·OH的清除能力
由图6可知,在本研究的浓度范围内,清除率随着多糖质量浓度的增加而增大。VC对·OH具有很强的清除能力,当VC质量浓度为0.2 mg/mL时,清除效果已经达到85%。与VC相比,荸荠多糖对·OH清除作用稍差,当荸荠多糖质量浓度为1.0 mg/mL时,多糖对·OH的清除率最大为72.67%。多糖对·OH的IC50值为0.177 mg/mL。VC对·OH的IC50明显小于荸荠多糖,所以VC对·OH清除效果优于荸荠多糖。
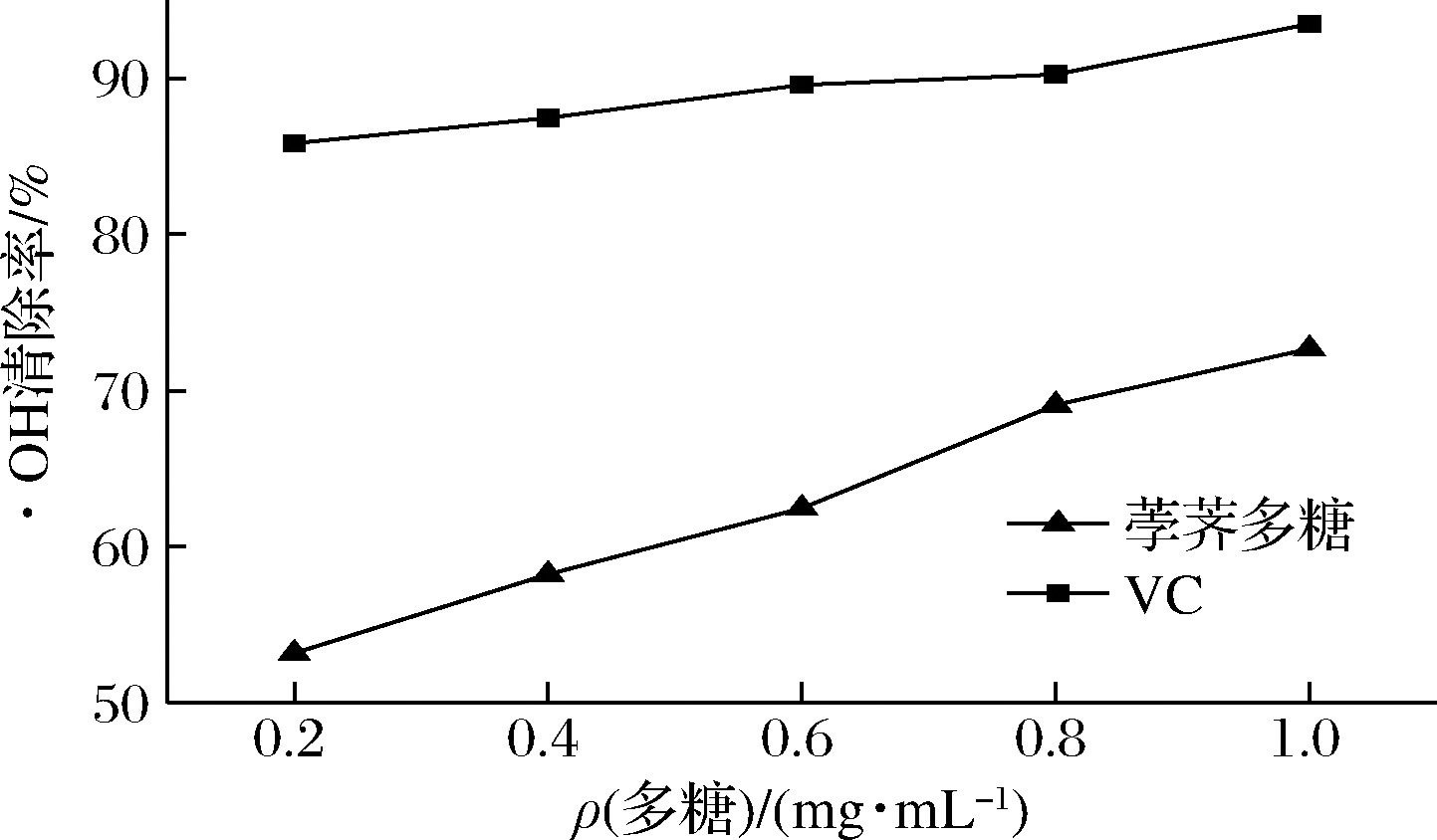
图6 多糖粗提液对·OH的清除能力
Fig.6 The scavenging effect of crude polysaccharide on hydroxyl radical
3 结论与讨论
通过水提法对全荸荠的多糖进行提取,考察了料液比、乙醇体积分数、解析时间、提取时间等对提取率的影响,通过L9(33)正交试验优化确定的最优工艺参数组合为A2B3C2,即料液比为1∶5(g∶mL)、解析时间32 min、浸提时间20 min,在此最佳条件下荸荠多糖得率为17.86%。体外抗氧化活性结果显示,荸荠多糖具有良好的抗氧化性,而且荸荠多糖对DPPH自由基和·OH的清除率与其浓度呈正相关性,但效果均小于同一浓度下VC的清除力。荸荠多糖对DPPH自由基和·OH的IC50值分别为0.142和0.177 mg/mL,当多糖质量浓度为1.00 mg/mL对DPPH自由基和·OH的清除率分别为73.98%和72.67%。荸荠多糖可作为天然抗氧化剂应用于食品、化妆品、保健品等行业,有关荸荠多糖的抗氧化机理及构效关系有待进一步探讨。
[1] 王海平, 黄和升,田青.鲜切荸荠无硫护色条件优化及贮藏品质研究[J].食品科技,2019,44(10):68-73.
WANG H P,HUANG H S,TIAN Q.Study on optimization of non-sulfur color protection and storage quality for fresh-cut chufa[J].Food Science and Technology,2019,44(10):68-73.
[2] 李长乐, 潘永贵.鲜切荸荠表面黄化过程中黄酮类物质和抗氧化活性变化[J].食品科学,2018,39(19):212-217.
LI C L,PAN Y G.Changes in flavonoid content and antioxidant activity of fresh-cut Chinese water chestnut during surface etiolation[J].Food Science,2018,39(19):212-217.
[3] 罗杨合, 陈振林,高志明,等.干法超微粉碎荸荠皮[J].食品工业科技,2011,32(5):287-289.
LUO Y H,CHEN Z L,GAO Z M,et al.Ultra-fine pulverization onEleocharis tuberose peel by dry-processing[J].Science and Technology of Food Industry,2011,32(5):287-289.
[4] 中国科学院中国植物志编辑委员会. 中国植物志第十一卷[M].北京:科学出版社,1961.
Editorial Board of Flora of China.Chinese Academy of Sciences.Flora of China,Volume 11[M].Beijing:Science Press,1961.
[5] 詹歌, 周存山,严佳慧,等.不同蒸煮条件对荸荠水分分布、营养成分及抗氧化活性的影响[J].食品与发酵工业,2020,46(16):171-176.
ZHAN G,ZHOU C S,YAN J H,et al.Effects of different cooking conditions on water distribution,nutrients and antioxidant activity of Chinese water-chestnut[J].Food and Fermentation Industries,2020,46(16):171-176.
[6] 汪建红. Box-Behnken试验设计优化内部沸腾法提取荸荠皮多糖工艺[J].食品研究与开发,2019,40(10):115-119.
WANG J H.Optimization ofextraction technology of polysaccharide in Eleocharis tuberosa peel by inner ebullition with Box-Behnken experimental design[J].Food Research and Development,2019,40(10):115-119.
[7] 伍淑婕, 黄双全,聂辉,等.荸荠皮活性成分提取分离研究进展[J].食品科技,2018,43(10):289-293.
WU S J,HUANG S Q,NIE H,et al.Review on extraction and separation of active constituents from Eleochairis toberosa peel[J].Food Science and Technology,2018,43(10):289-293.
[8] 李官丽, 聂辉,苏可珍,等.基于感官评价和电子鼻分析不同蒸煮时间荸荠挥发性风味物质[J].食品工业科技,2020,41(15):1-7;14.
LI G L,NIE H,SU K Z,et al.Analysis of volatile flavor substances of Chinese water chestnut in different steaming and boiling time based on sensory evaluation and e-nose[J].Science and Technology of Food Industry,2020,41(15):1-7;14.
[9] 王颖, 曾霞,周天,等.荸荠多糖提取条件研究[J].食品研究与开发,2015,36(10):49-51.
WANG Y,ZENG X,ZHOU T,et al.Study on extraction technology of polysaccharides from Eleochairis toberosa[J].Food Research and Development,2015,36(10):49-51.
[10] 刘兵, 段振华.马蹄的贮藏保鲜与加工利用研究进展[J].食品研究与开发,2016,37(18):212-215.
LIU B,DUAN Z H.Progress research on storage and processing utilization of water chestnut[J].Food Research and Development,2016,37(18):212-215.
[11] 刘小林, 孟祥志.荸荠的资源开发利用研究进展[J].食品研究与开发,2021,42(3):212-217.
LIU X L,MENG X Z.Progress research on resource development and utilization of water chestnut[J].Food Research and Development,2021,42(3):212-217.
[12] 李作美, 邵杰.荸荠皮中生物活性物质的研究进展[J].中国食物与营养,2009,15(6):60-62.
LI Z M,SHAO J.Research progress of biological activity material in Eleochairis toberosa peel[J].Food and Nutrition in China,2009,15(6):60-62.
[13] NIE H,HUANG S Q,LI X C,et al.Identification of compounds from chufa(Eleocharis dulcis)peels with inhibitory acrylamide formation activity[J].Revista Brasileira DE Farmacognosia,2019,29(4):483-487.
[14] 赵广河, 陈振林.荸荠活性成分与功能作用研究进展[J].食品研究与开发,2011,32(9):235-237.
ZHAO G H,CHEN Z L.Study on active ingredients and functions of Eleochairis toberosa[J].Food Research and Development,2011,32(9):235-237.
[15] PARR A J,WALDRON K W,NG A,et al.The wall-bound phenolics of Chinese water chestnut(Eleocharis dulcis)[J].Journal of the Science of Food and Agriculture,1996,71(4):501-507.
[16] 赵力超, 毛新,黄利华,等.荸荠皮膳食纤维酶化学法提取工艺研究[J].食品工业科技,2009,30(11):244-246;250.
ZHAO L C,MAO X,HUANG L H,et al.Study on extraction of dietary fiber from water chestnut pericarp byzymochemistry method[J].Science and Technology of Food Industry,2009,30(11):244-246;250.
[17] 李行任, 刘珊,罗杨合,等.荸荠皮天然色素的纯化及其稳定性和抗氧化活性[J].食品与发酵工业,2014,40(8):89-95.
LI H R,LIU S,LUO Y H,et al.Purification,stability and antioxidant activities of natural pigment from Chufa(Eleocharis tuberosa) peels[J].Food and Fermentation Industries,2014,40(8):89-95.
[18] 罗杨合, 陈振林,谢复青,等.马蹄皮棕色素的微波提取工艺研究[J].中国调味品,2009,34(1):92-94;99.
LUO Y H,CHEN Z L,XIE F Q,et al.Study on the technology of microwave-assisted extracting brown pigment from water chestnut peel[J].China Condiment,2009,34(1):92-94;99.
[19] 詹歌, 周兴虎,屠康,等.荸荠皮中果胶的酸法提取工艺[J].食品与生物技术学报,2010,29(6):859-864.
ZHAN G,ZHOU X H,TU K,et al.Study on acidolysis extraction of pectin from Chinese water chestnut peel[J].Journal of Food Science and Biotechnology,2010,29(6):859-864.
[20] 吕雯姣, 余兆硕,唐柳欢,等.响应面优化超声波辅助水酶法提取荸荠多糖[J].农产品加工,2016(23):1-5.
LYU W J,YU Z S,TANG L H,et al.Optimization of Eleocharis dulcis polysaccharides extraction with ultrasonic assistant aqueous enzymatic by response surface methodology[J].Farm Products Processing,2016(23):1-5.
[21] 唐洁. 植物多糖生物活性功能的研究进展[J].食品研究与开发,2006,27(5):130-132.
TANG J.The study extension of biological activities of plant polysaccharide[J].Food Research and Development,2006,27(5):130-132.
[22] 刘姚, 欧阳克蕙,葛霞,等.植物多糖生物活性研究进展[J].江苏农业科学,2013,41(1):1-4.
LIU Y,OUYANG K H,GE X,et al.Research progress on the biological activity of plant polysaccharides[J].Jiangsu Agricultural Sciences,2013,41(1):1-4.
[23] 李惠, 熊忠飞,李喜宏.响应面法优化芦笋多糖提取工艺及抗氧化性研究[J].中国调味品,2020,45(5):1-6;12.
LI H,XIONG Z F,LI X H.Research on optimization of extraction process and antioxidant activity of asparagus polysaccharides by response surface methodology[J].China Condiment,2020,45(5):1-6;12.
[24] 张家晨, 秦良云,刘怡,等.响应面法优化西藏金耳多糖提取工艺研究[J].食品研究与开发,2020,41(11):113-117.
ZHANG J C,QIN L Y,LIU Y,et al.Study on optimization of polysaccharide extraction fromTremella aurantialba in Tibet by response surface methodology[J].Food Research and Development,2020,41(11):113-117.
[25] 吴玉柱, 崔维建,李妍.超声波辅助提取玉木耳多糖及其抗氧化活性分析[J].食品工业科技,2020,41(23):142-148.
WU Y Z,CUI W J,LI Y.Ultrasound assisted extraction of polysaccharides from Auricularia cornea Ehrenb.and its antioxidant activity analysis[J].Science and Technology of Food Industry,2020,41(23):142-148.
[26] 张梓原, 徐伟,王鑫,等.黄精多糖的提取工艺对比研究[J].包装工程,2020,41(9):51-58.
ZHANG Z Y,XU W,WANG X,et al.Comparative study on extraction technologies of polysaccharides from Rhizoma polygonatum[J].Packaging Engineering,2020,41(9):51-58.
[27] YOSHIDA T,MORI K,HATANO T,et al.Studies on inhibition mechanism of autoxidation by tannins and flavonoids radical-scavenging effects of tannins and related polyphenols on 1,1-diphenyl-2-picrylhydrzyl radical[J].Chemical and Pharmaceutical Bulletin(Chem Pharmaceut Bull),1989,37(7):1 919-1 921.
[28] 薛娟, 杨继东,刘龙江,等.黄柏多糖的含量测定及抗氧化活性研究[J].化学工程师,2020,34(3):73-75;79.
XUE J,YANG J D,LIU L J,et al.Study on content determination and antioxidation of polysaccharide from Phellodendron[J].Chemical Engineer,2020,34(3):73-75;79.
[29] 王荣琨, 王钦,罗欣,等.不同提取方法对竹荪多糖提取率及抗氧化性影响[J].中国食用菌,2020,39(3):24-28.
WANG R K,WANG Q,LUO X,et al.Effects of different extraction methods on the extraction rate and antioxidant properties of Dictyophora indusiata polysaccharide[J].Edible Fungi of China,2020,39(3):24-28.
[30] 郎德龙. 超声波提取桔梗多糖工艺研究[J].黑龙江工业学院学报,2019,19(11):63-66.
LANG D L.Extraction technology of platy-codonGrandiflorum polysaccharide by ultrasonic technology[J].Journal of Heilongjiang University of Technology(Comprehensive Edition),2019,19(11):63-66.
[31] 李珊, 梁俭,冯彬,等.响应面法优化超声波辅助提取山竹果皮多糖的工艺及其体外抗氧活性研究[J].食品研究与开发,2020,41(10):103-110.
LI S,LIANG J,FENG B,et al.Response surface methodology promoted ultrasound-assisted extraction of polysaccharides from mangosteen peels and evaluation of antioxidant activity in vitro[J].Food Research and Development,2020,41(10):103-110.
[32] 张玉娜, 王倩文,张双灵.水提醇沉法提取香菇多糖的最佳工艺研究[J].青岛农业大学学报(自然科学版),2020,37(1):43-46.
ZHANG Y N,WANG Q W,ZHANG S L.Optimum technique research on the extraction of lentinan with ethanol subsiding method[J].Journal of Qingdao Agricultural University(Natural Science),2020,37(1):43-46.
[33] SHI Y L,CHEN C,ZHAO C S.Optimal design of butterfly shaped linear ultrasonic motor using finite element method and response surface methodology[J].Journal of Central South University,2013,20(2):393-404.
[34] ZHOU Q,JIAN Y Q,YI P,et al.A comprehensive review on pronephrium penangianum[J].Israel Journal of Chemistry,2019,59(5):371-377.