食源性致病菌是指在食品加工和流通过程中引入的致病病原菌,大肠杆菌(Escherichia coli)是最常见的低感染剂量高致病性肠道病原体,可引起腹泻和出血性结肠炎等疾病,是食品公共卫生领域的严重威胁[1]。曹铁红等[2]监测通化区农贸市场销售肉与肉制品食源性致病菌污染状况发现,E.coli检出率为18.37%;国译丹等[3]监测云南省外卖餐饮微生物污染状况发现,E.coli检出率为16.48%;张艳等[4]监测南充市熟肉制品微生物污染情况发现,E.coli检出率为46.4%。由此可见,食品加工与流通环节易感染大肠杆菌并产生潜在安全风险。传统热处理杀菌方式会对食品热敏性成分和色香味产生不良影响,人工防腐剂由于化学品使用量和使用条件的限制,应用也受限。抗菌肽热稳定性好、抗菌活性高、生物毒副作用少且不易产生耐药性,可作为食品防腐保鲜剂使用[1]。当前抗菌肽研究以膜损伤效应靶点居多,主要是因为该靶点可解决现有抗生素难以彻底杀灭处于减速生长期与休眠期致病病原体的不足,细胞膜结构相对保守且具备快速杀菌效应,且真核与原核细胞结构差异使得抗菌肽具有较好细胞选择性[5]。目前,抗菌剂以蛋白质酶解制备的抗菌多肽研究较多[6-8],金属抗菌肽研究鲜见,金属抗菌肽是含有金属离子的新型抗菌肽,除可以起到良好抗菌和抗氧化等生物活性外,还能为食品提供多肽营养与金属离子,具有很好的研究价值。课题组发现,金属抗菌肽SIF4对金黄色葡萄球菌有良好抑菌活性[9],在模拟食品体系中能保持较好抑菌稳定性[10],但抑菌机理尚不明确。探究SIF4对大肠杆菌的抑菌机理可为其在食源性大肠杆菌生物抑制的理论与应用研究提供支持。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
金属抗菌肽![]() 本课题组制备;大肠杆菌ATCC 25922,菌种保藏中心获得;牛肉膏、胰蛋白胨,北京博星公司;Triton X-100,武汉卡诺斯公司;对硝基苯磷酸二钠(disodium p-nitrophenylphosphate,PNPP)和邻硝基苯-β-D-半乳糖苷(o-nitrobenzene-β-D-galactoside,ONPG),北京百奥莱博公司;其他试剂为国产分析纯。
本课题组制备;大肠杆菌ATCC 25922,菌种保藏中心获得;牛肉膏、胰蛋白胨,北京博星公司;Triton X-100,武汉卡诺斯公司;对硝基苯磷酸二钠(disodium p-nitrophenylphosphate,PNPP)和邻硝基苯-β-D-半乳糖苷(o-nitrobenzene-β-D-galactoside,ONPG),北京百奥莱博公司;其他试剂为国产分析纯。
1.1.2 仪器与设备
LDZX-40SAI蒸汽灭菌锅,上海博迅公司;Sizer2000电位仪,Malvern;BBS-SSC超净工作台,济南腾览公司;DH-360恒温培养箱,北京科伟公司;UV—2500紫外可见分光光度计,日本Shimadzu公司;TAS-990原子吸收光谱仪,北京普析公司。
1.2 实验方法
1.2.1 最小抑菌浓度(minimum inhibitory concentration,MIC)测定
准确吸取0.05×10-3~1.0 mg/L的SIF4溶液1.0 mL 加入培养皿中,倒入牛肉膏蛋白胨培养基并混匀,凝固后准确吸取0.1 mL对数生长期E.coli(6×108CFU/mL)涂布于培养基表面,37 ℃培养24 h,观察菌落生长情况,菌落被完全抑制的最低浓度为MIC。
1.2.2 大肠杆菌抑菌生长曲线绘制
取对数生长期菌液于6 500 r/min离心10 min,菌体用10 mmol/L PBS(pH 7.4,下同)洗涤3次以除去残留培养基和代谢物,PBS重新悬浮菌体使OD600 nm=0.5,加入SIF4使终质量浓度分别为0.2 mg/L(1/2 MIC)、0.4 mg/L(MIC)和0.8 mg/L(2 MIC),37 ℃、130 r/min培养24 h,间隔2 h取样测定OD600 nm,以未加SIF4的PBS组为对照组。
1.2.3 细胞壁通透性的测定
取对数生长期菌液6 500 r/min离心10 min,菌体用PBS冲洗3次并重悬(OD600 nm=0.5)。取重悬液50 mL加入SIF4使终浓度分别为1/2 MIC、MIC和2 MIC,未加SIF4为对照组。所有试验组37 ℃、130 r/min温育3 h,间隔0.5 h吸取5 mL菌悬液于6 500 r/min离心10 min,取上清液与0.5 mL 1 g/L PNPP溶液混匀,37 ℃暗处理30 min,加入0.2 mL 1 mol/L NaOH终止反应,测定OD405 nm值[11]。
1.2.4 胞内K+泄露的测定
取对数生长期菌液6 500 r/min离心10 min,用无菌去离子水洗涤菌体3次并重悬(OD600 nm=0.5),加入SIF4使终浓度为1/2 MIC、MIC和2 MIC,37 ℃温育3 h,间隔30 min取样,10 000 r/min离心10 min,测定上清液K+浓度,未加SIF4为阴性对照,Triton X-100(100 mg/L,下同)为阳性对照[12]。
1.2.5 胞内生物大分子泄露的测定
取对数生长期菌液于6 500 r/min离心10 min,菌体用PBS洗涤3次并重悬(OD600 nm=0.5),加入SIF4使终浓度为1/2 MIC、MIC和2 MIC,37 ℃温育5 h,间隔1 h取培养液5 mL,6 500 r/min离心10 min,上清液用0.22 μm滤膜过滤并测定OD280 nm和OD260 nm。以PBS组和Triton X-100组为阴性和阳性对照[13]。
1.2.6 细胞表面疏水性的测定
取对数生长期菌液于6 500 r/min离心10 min,PBS洗涤菌体3次并用0.1 mol/L KNO3溶液(pH 6.2)重悬(OD600 nm=0.5),加入SIF4使终浓度分别为1/2 MIC、MIC和2 MIC,未加SIF4为对照组,37 ℃、130 r/min培养30 min后取出测定OD600 nm(A0);取SIF4与菌体混悬液4.8 mL加入0.2 mL十六烷并充分混匀,室温静置30 min至完全分层后吸取水相测定OD600 nm(A1)[14]。表面疏水性用细菌吸附率(%)表示,按公式(1)计算:
细菌吸附率![]()
(1)
1.2.7 细胞膜通透性的测定
取对数生长期菌液于6 500 r/min离心10 min,菌体用PBS洗涤3次,用10 mL无菌M9乳糖诱导培养基重悬,37 ℃、130 r/min诱导培养8 h,6 500 r/min离心10 min,菌体用β-半乳糖苷酶反应缓冲液重悬(OD600 nm=0.2);加入SIF4至50 mL菌悬液使终浓度为1/2 MIC、MIC和2 MIC,加入200 μL 1 g/L ONPG充分混匀,37 ℃温育5 h,间隔1 h取出样品加入50 μL 1 mol/L Na2CO3终止反应,6 500 r/min离心5 min,测上清液![]()
1.2.8 细胞表面电位的测定
取对数生长期菌液于6 500 r/min离心10 min,用无菌超纯水洗涤3次并重悬(OD600 nm为0.2~0.3),加SIF4至50 mL菌悬液中使终浓度分别为1/2 MIC、MIC和2 MIC,37 ℃温育30 min,6 500 r/min离心10 min,菌体用无菌超纯水重悬(OD600 nm=0.05),室温下测定细胞表面电位。以无菌超纯水组和Triton X-100组为阴性与阳性对照[15]。
1.2.9 数据处理方法
试验结果以表示(n=3),仅进行组间均数差异多重比较,采用SPSS 25.0进行单因素ANOVA分析,方差齐性时采用最小显著差异法,非齐性时用塔姆黑尼T2法。
2 结果与分析
2.1 金属抗菌肽SIF4最小抑菌浓度测定
SIF4对大肠杆菌的抑制效果如表1所示。对照组菌落数较多,SIF4浓度在0.05~0.3 mg/L时,菌落数随SIF4浓度增加呈递减趋势,SIF4为0.4 mg/L或更高时未发现菌落生长,因此,SIF4对大肠杆菌的MIC为0.4 mg/L。
表1 SIF4对大肠杆菌生长抑制的影响
Table 1 Inhibitory effect of SIF4 on the growth of E.coli
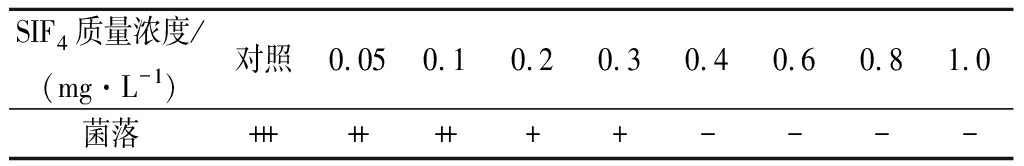
SIF4质量浓度/(mg·L-1)对照0.050.10.20.30.40.60.81.0菌落+++++++++----
注:“+”表示培养皿中有菌落生长,“-”表示培养皿中无菌落生长
2.2 金属抗菌肽SIF4对大肠杆菌抑菌生长的影响
SIF4对大肠杆菌抑菌曲线如图1所示。由图1可看出,对照组菌体对数生长期为10~12 h,16 h后进入衰亡期;1/2 MIC组培养14 h后进入衰亡期,比对照组提前约2 h;MIC组和2 MIC组培养12 h后进入衰亡期,菌体密度与对照组和1/2 MIC相比有显著降低,衰亡期后细胞凋亡速度明显快于对照组和1/2 MIC组。SIF4处理后菌体稳定期与衰亡期均有不同程度提前,可诱导菌体提前凋亡。

图1 SIF4对大肠杆菌的抑菌曲线
Fig.1 Inhibitory curve of SIF4 against E.coli
2.3 金属抗菌肽SIF4对细胞壁通透性的影响
碱性磷酸酶是位于细胞周质空间的胞内非特异性磷酸单酯酶,是磷酸基团转移、生物大分子合成及细胞分化等关键酶,可调控胞内Ca2+,细胞壁受损时胞外可检测到该酶,是细胞壁通透性的重要评价指标[16]。SIF4对细胞壁通透性影响如图2所示。
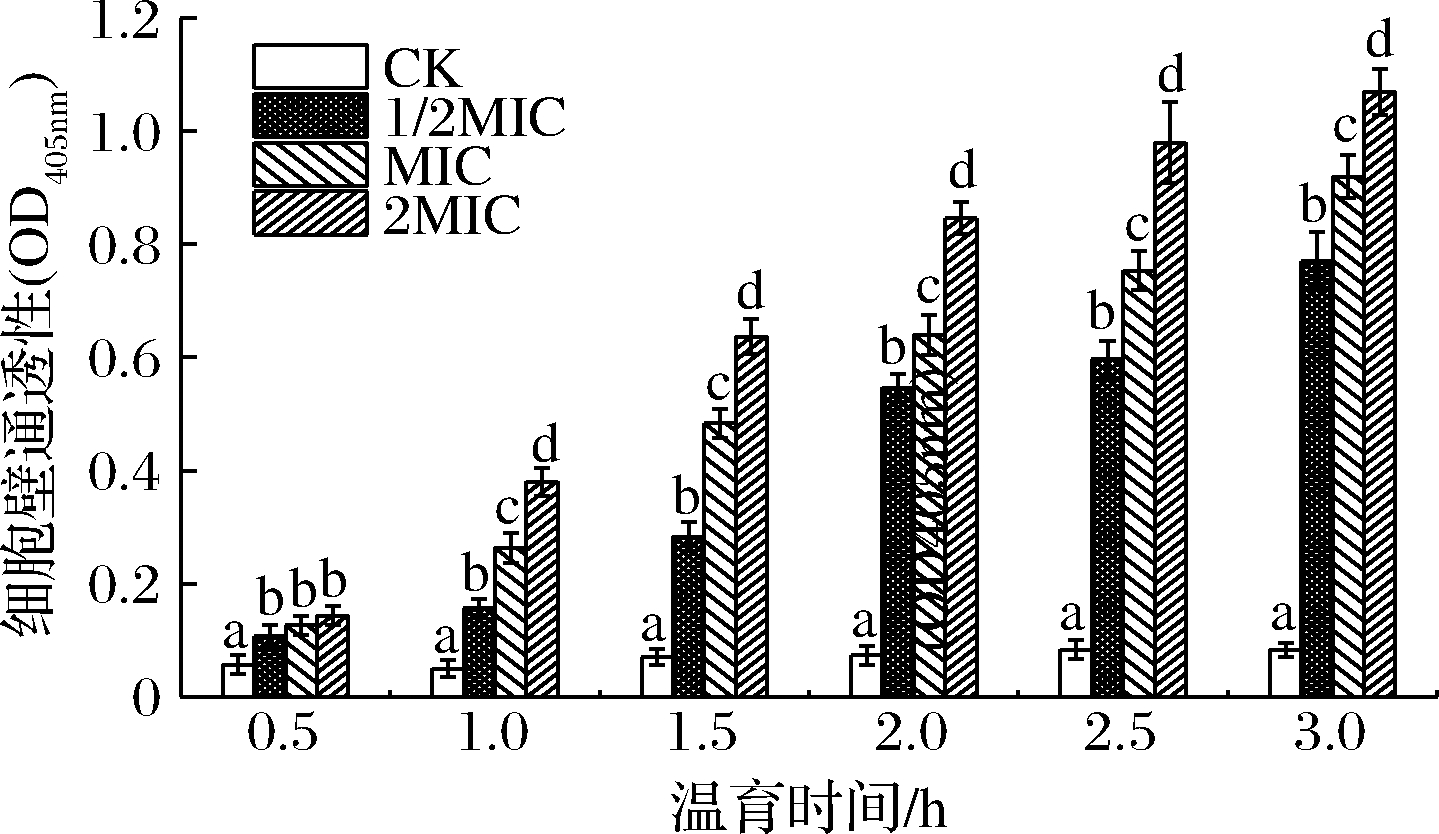
图2 SIF4对细胞壁通透性的影响
Fig.2 Effect of SIF4 on cell wall permeability 注:字母相同者表示差异不显著(P>0.05),字母不同者表示 差异显著(P<0.05)(下同)
试验组与对照组均存在显著差异(P<0.05)。温育0.5 h时,1/2 MIC、MIC和2MIC组间差异不显著,可能是由于温育30 min内抗菌肽处于膜吸附阶段;温育1 h后,各试验组间均存在显著差异(P<0.05),细胞壁通透性与SIF4浓度和温育时间呈正相关。SIF4对细胞壁的损伤可能是由于金属抗菌肽SIF4结构中的Fe2+能取代细胞壁表面Mg2+,或与细胞壁带负电荷脂多糖结合,或结合到某特定负电荷区域使细胞壁结构改变并使通透性增强[17],与李婷等[18]的结果一致。
2.4 金属抗菌肽SIF4对胞内K+泄露的影响
细胞膜受损后可使胞内离子泄露并引起代谢紊乱,K+是离子泄漏的典型代表,小分子电解质比核酸与蛋白质等大分子物质优先泄露[19]。SIF4对胞内K+泄露的影响如图3所示。
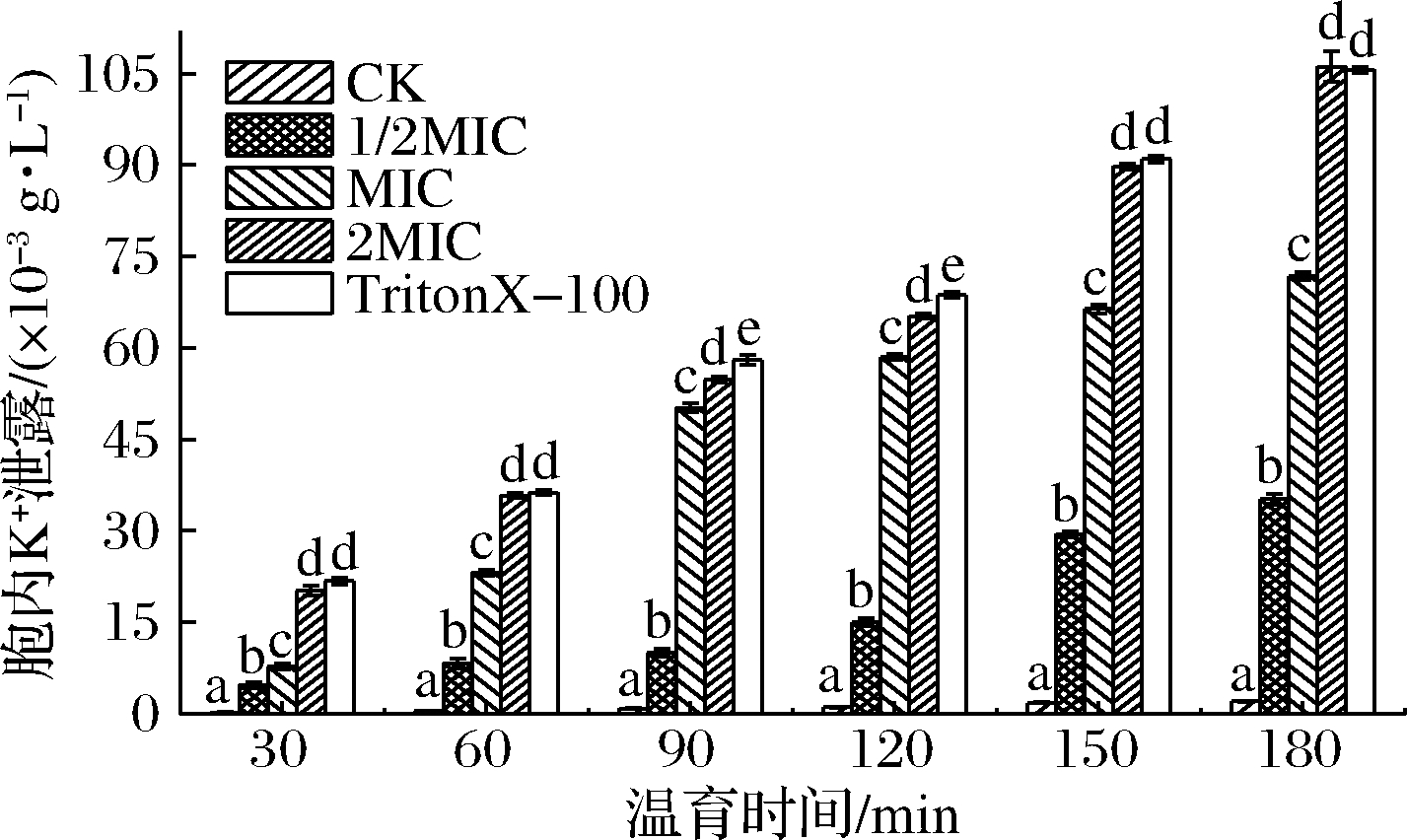
图3 SIF4对胞内K+泄露的影响
Fig.3 Effect of SIF4 on intracellular K+ leakage
试验组与对照组均有显著差异(P<0.05),对照组胞外仅能检测到极低浓度K+。胞内K+泄露随SIF4浓度升高和温育时间延长呈递增趋势,各试验组胞内K+泄露有显著差异(P<0.05),与唐文婷[12]的结果一致。试验还发现,2 MIC组与Triton X-100组差异不显著,表明SIF4在2 MIC(0.8 mg/L)时与Triton X-100对胞内K+泄露影响基本相同。细胞膜受损可破坏细胞膜K+离子通道并影响Na+-K+-ATP酶活性,使基于细胞膜转运的代谢无法完成并诱导细胞提前程序性凋亡。
2.5 金属抗菌肽SIF4对胞内生物大分子泄露影响

a-核酸;b-蛋白质
图4 SIF4对胞内生物大分子泄露的影响
Fig.4 Effect of SIF4 on intracellular macromolecular leakage
细胞膜受损除引起胞内离子与小分子物质泄漏外,还会诱导胞内核酸与蛋白质等生物大分子泄露,核酸与蛋白质分别在260和280 nm处有特征性紫外吸收,测定这2处波长光吸收值可监测胞内生物大分子泄露状态[20]。SIF4对胞内生物大分子泄露影响如图4所示。温育1 h时,1/2 MIC组与对照组无显著差异,可能是由于温育60 min内主要为膜吸附阶段,并未引发细胞膜受损,温育2 h后,试验组与对照组均存在显著差异(P<0.05)。随着SIF4浓度升高与温育时间延长,胞内生物大分子泄露呈递增趋势,表明SIF4能破坏细胞膜并增强膜渗透性,推断细胞膜可能是金属抗菌肽SIF4抗菌效应靶点,与戴锦铭[21]的结果一致。研究还发现,2 MIC组与Triton X-100组差异均不显著,表明2 MIC组对细胞膜损伤与Triton X-100相似,Triton X-100为双亲和结构,可将膜蛋白解离,对细胞膜破坏性比较强[22]。
2.6 金属抗菌肽SIF4对细胞表面疏水性的影响
细胞表面疏水性是影响细菌非特异性粘附到其它物质或界面的重要因素[23]。正十六烷是一种对细胞无损伤的疏水性溶剂,对菌体吸附率改变可表征细胞表面疏水性变化。SIF4对细胞表面疏水性影响如表2所示。
表2 SIF4对细胞表面疏水性的影响 单位:%
Table 2 Effect of SIF4 on CSH
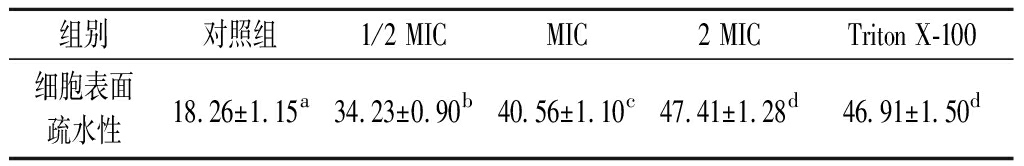
组别对照组1/2 MICMIC2 MICTriton X-100细胞表面疏水性18.26±1.15a34.23±0.90b40.56±1.10c47.41±1.28d46.91±1.50d
试验组与对照组有显著差异(P<0.05)。表面疏水性随SIF4浓度增加显著递增(P<0.05),可能是由于金属抗菌肽结构中的Fe2+通过静电作用吸附在带负电荷细菌表面,使疏水域暴露并增强表面疏水性。大肠杆菌等电点pI为4.4,试验所用KNO3缓冲液pH值(pH 6.2)高于大肠杆菌pI,细菌带负电荷,有助于抗菌肽与菌体表面静电吸附,吸引电负性基团造成重排并增强表面疏水性。表面疏水性增强可诱导细胞膜混乱,疏水性越强膜损伤越严重[24],与LEE等[25]结果一致,但与赵清风等[26]研究相悖,可能是由于Ag+与SIF4抗菌机制不同。
2.7 金属抗菌肽SIF4对细胞膜通透性的影响
大肠杆菌在以乳糖为唯一碳源时可诱导生成β-半乳糖苷酶,细胞膜受损后,胞外ONPG可渗透入胞内并被水解为半乳糖和邻-硝基苯酚(o-nitrophenol,ONP),ONP在415 nm处有特征性紫外吸收。一定浓度范围时,ONP吸光值与细胞膜通透性成正比,可作为细胞膜通透性评价的重要指标[27]。SIF4对细胞膜通透性影响如图5所示。
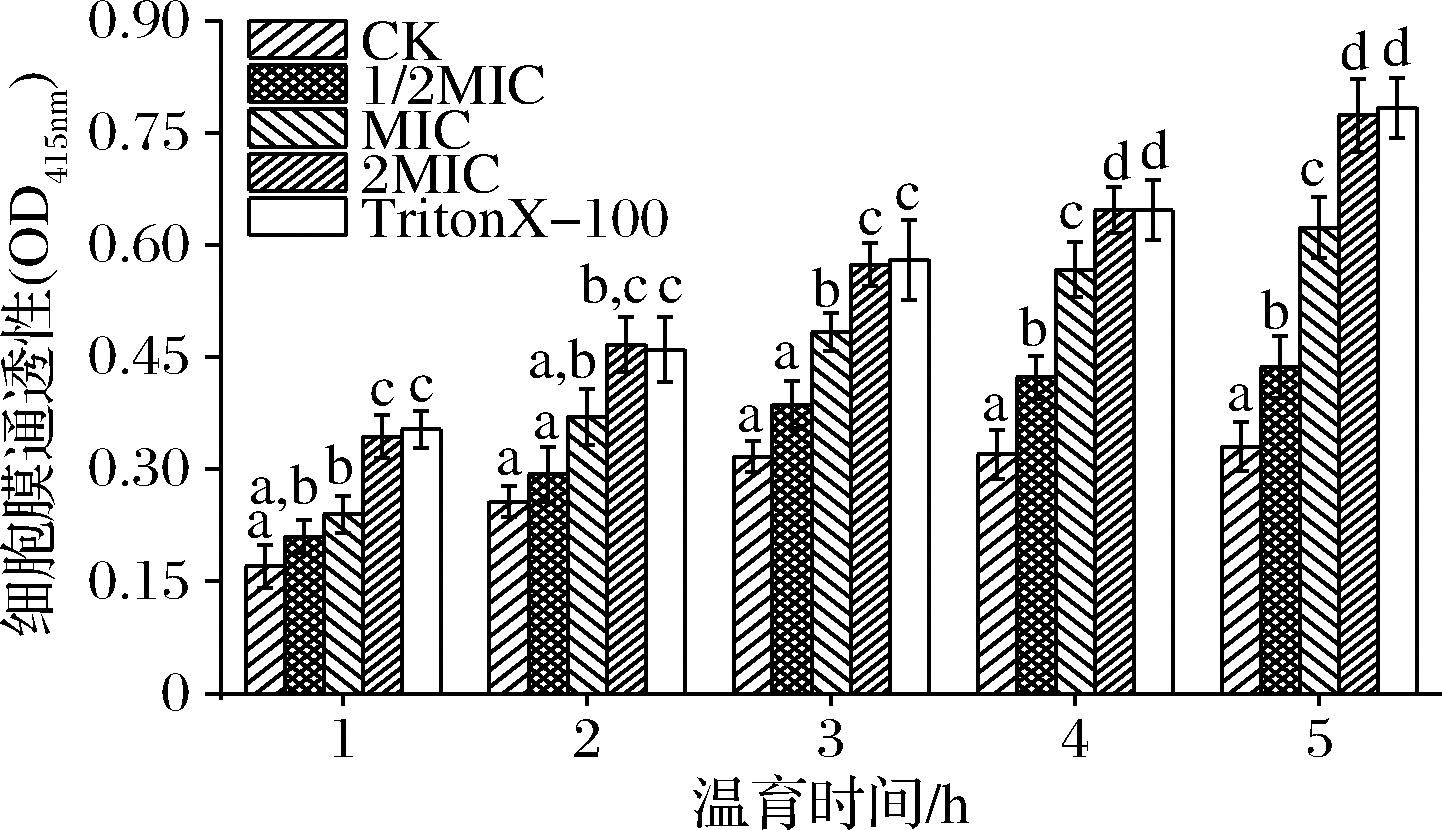
图5 SIF4对细胞膜通透性的影响
Fig.5 Effect of SIF4 on CMP
温育1~3 h时,1/2 MIC组与对照组无显著差异,可能是由于抗菌肽浓度较低,2 MIC组和MIC组及1/2 MIC有显著差异(P<0.05),推测细胞膜损伤可能以“毯式模型”进行,SIF4疏水端通过静电吸附聚集在细胞膜表面形成“毯式”结构,当集聚在细胞膜表面抗菌肽浓度达到阈值后,可由“毯式模型”破坏细胞膜结构并造成细胞膜瞬间坍塌而引起膜破裂,作用于G-菌的抗菌肽常以“毯式模型”方式进行[5]。温育4~5 h,1/2 MIC与对照组也存在显著差异(P<0.05),可能是由于温育时间较长时,SIF4逐步静电吸附到细胞膜表面并达到抗菌阈值[6]。研究还发现,温育1 h后,MIC和2 MIC组与对照组有显著差异(P<0.05),可能是由于MIC或2 MIC浓度时,静电吸附并聚集在膜上抗菌肽可很快达到抗菌阈值[6]。
2.8 金属抗菌肽SIF4对细胞表面zeta电位影响
表面电位绝对值越小菌体越易发生聚沉和黏附,常用zeta电位表征[28]。SIF4对细胞表面zeta电位影响如图6所示。
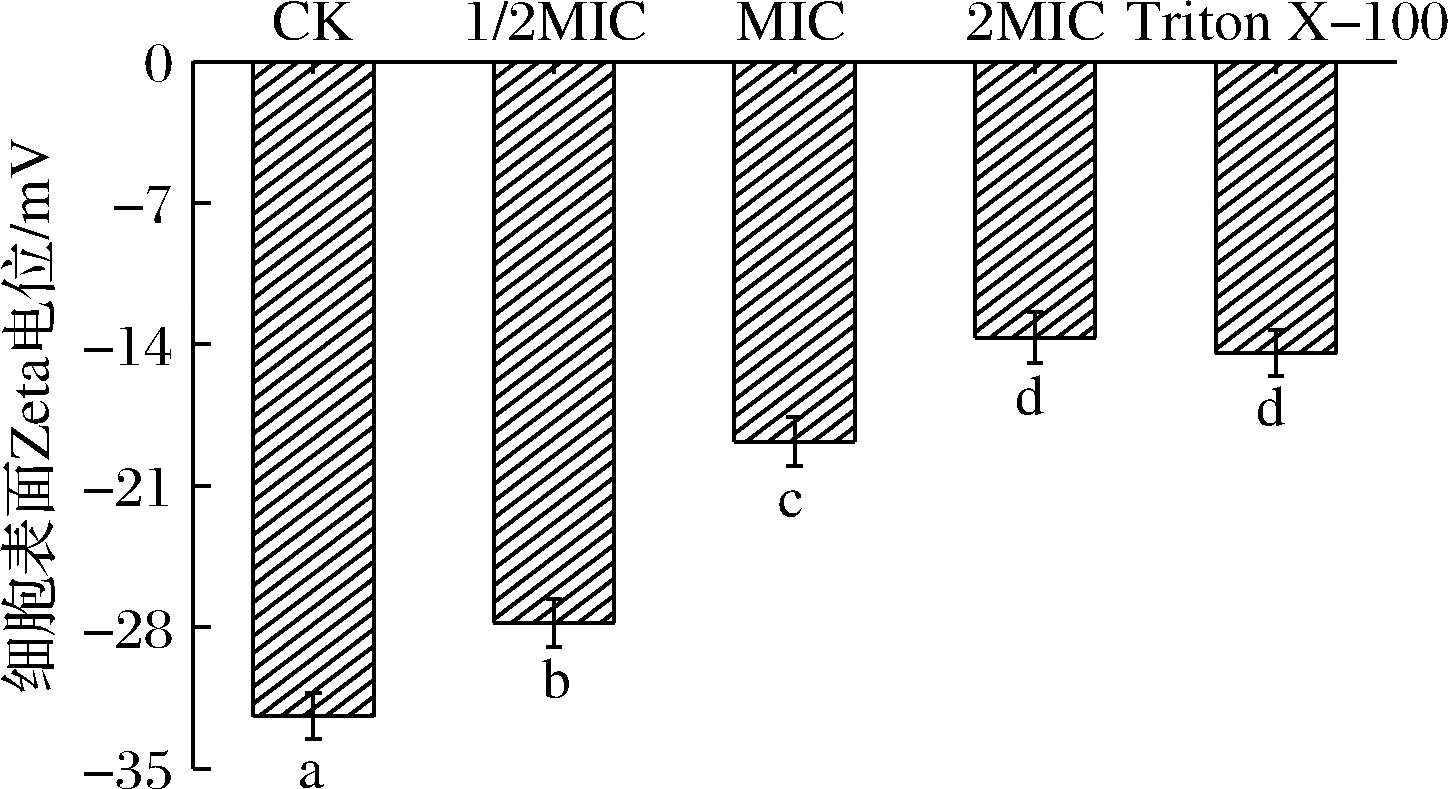
图6 SIF4对细胞表面zeta电位的影响
Fig.6 Effect of SIF4 on cell surface zeta potential
由图6可知,试验组zeta电位与对照组有显著差异(P<0.05);细胞表面zeta电位(y)与SIF4浓度(x)呈负相关(y=24.06 x-31.59,R2=0.907 4)。通常情况下,zeta电位0~±5 mV时菌体易凝聚,±10~±30 mV不稳定,±30~±40 mV或更大有良好稳定性[29]。1/2 MIC组zeta电位为(-27.28±1.19)mV,菌体开始表现不稳定,MIC组和2 MIC组zeta电位分别上升至(-18.82±1.20)mV和(-13.66±1.26)mV,表明菌体稳定性变差,2 MIC组与Triton X-100组差异不显著(P>0.05)。
3 结论与讨论
细胞壁(膜)结构的完整对维持细胞形态与胞内环境有重要作用,受损时可引起细胞通透性增强甚至出现不可逆孔洞,造成胞内离子及生物大分子物质泄露并诱导细胞凋亡。研究发现,SIF4对大肠杆菌有较好抑菌活性,可破坏其细胞壁(膜)结构并引起胞内K+和生物大分子泄露,使菌体代谢紊乱并诱导菌体凋亡。SIF4处理后能增强表面疏水性,引起细胞膜混乱并导致膜受损,还能影响细胞表面zeta电位,使菌体聚沉和黏附,推测大肠杆菌细胞膜损伤以“毯式模型”进行。研究认为,大肠杆菌菌体表面带负电荷,SIF4为阳离子抗菌肽[9],可通过静电吸附聚集在菌体表面并干扰膜电位,以“毯式模型”破坏细胞膜结构,造成细胞聚沉和代谢紊乱,诱导菌体凋亡,SIF4可作为一种潜在的新型食品抗菌剂用于致病性大肠杆菌的生物抑制。
[1] LE N MADRAZO A,SEGURA CAMPOS M R.Review of antimicrobial peptides as promoters of food safety:Limitations and possibilities within the food industry[J].Journal of Food Safety,2020,40(6):e12854.
N MADRAZO A,SEGURA CAMPOS M R.Review of antimicrobial peptides as promoters of food safety:Limitations and possibilities within the food industry[J].Journal of Food Safety,2020,40(6):e12854.
[2] 曹铁红, 刘桂华.通化市2014-2018年肉与肉制品中食源性致病菌检测结果分析[J].中国卫生工程学,2020,19(1):39-41.
CAO T H,LIU G H.Analysis on detection results of foodborne pathogens in meat and meat products in Tonghua city from 2014 to 2018[J].Chinese Journal of Public Health Engineering,2020,19(1):39-41.
[3] 国译丹,范璐,汤小召,等.2018年云南省外卖餐饮的微生物污染状况调查[J].食品安全质量检测学报,2019,10(22):7 633-7 638.
GUO Y D,FAN L,TANG X Z,et al.Investigation on microbial contamination status of takeaway catering in Yunnan Province in 2018[J].Journal of Food Safety & Quality,2019,10(22):7 633-7 638.
[4] 张艳,蒋君,伏子奇.2015—2017年南充市熟肉制品加工过程微生物污染情况监测[J].预防医学情报杂志,2018,34(11):1 410-1 413.
ZHANG Y,JIANG J,FU Z Q.Surveillance of microbial contamination in processing of cooked-meat products in Nanchong from 2015 to 2017[J].Journal of Preventive Medicine Information,2018,34(11):1 410-1 413.
[5] 肖怀秋, 李玉珍,林亲录,等.抗菌肽多靶点作用抑菌机理研究进展[J].食品与生物技术学报,2021,40:1-9.
XIAO H Q,LI Y Z,LIN Q L,et al.Advances on multiple-targets action mechanism of antimicrobial peptides[J].Journal of Food Science and Biotechnology,2021,40:1-9.
[6] FU J,YANG H,WANG H, et al.Antimicrobial peptide bsn-37 inhibits the growth of Escherichia coli by targeting its cell wall and membrane[J].Material Express,2020,10(8):1 260-1 264.
[7] MORRONI G,SANTE L D,SIMONETTI O,et al.Synergistic effect of antimicrobial peptide LL-37 and colistin combination against multidrug-resistant Escherichia coli isolates[J].Future Microbiology,2021,16:221-227.
[8] YI L H,ZENG P,LIU J,et al.Antimicrobial peptide zp37 inhibits Escherichia coli O157:H7 in alfalfa sprouts by inflicting damage in cell membrane and binding to DNA[J].LWT,2021,146:111392.
[9] 肖怀秋, 李玉珍,林亲录,等.花生肽亚铁胃肠仿生消化产物对金黄色葡萄球菌的抑菌机理研究[J].食品与发酵工业,2020,46(18):111-116.
XIAO H Q,LI Y Z,LIN Q L,et al.Antibacterial mechanism of gastrointestinal biomimetic digestants from peanut peptide-ferrous on Staphylococcus aureus[J].Food and Fermentation Industries,2020,46(18):111-116.
[10] 肖怀秋, 李玉珍,林亲录,等.金属抗菌肽SIF4在人工模拟食品体系中的抑菌稳定性[J].食品与发酵工业,2021,47(22):121-125.
XIAO H Q,LI Y Z,LIN Q L,et al.Antimicrobial stability of metal antimicrobial peptide SIF4 in artificial simulated food systems[J].Food and Fermentation Industries,2021,47(22):121-125.
[11] MARRI L,DALLAI R,MARCHINI D.The novel antibacterial peptide ceratotoxin A alters permeability of the inner and outer membrane of Escherichia coli K-12[J].Current Microbiology,1996,33(1):40-43.
[12] 唐文婷. 基于肽—膜相互作用的模拟细胞膜法筛选抗菌肽的研究[D].无锡:江南大学,2014.
TANG W T.Research of screening for antimicrobial peptides by mimic cell membrane based on peptide-membrane interaction[D].Wuxi:Jiangnan University,2014.
[13] HAO K Y,XU B C,ZHANG G Y,et al.Antibacterial activity and mechanism of Litsea cubeba L.essential oil against Acinetobacter baumannii[J].Natural Product Communications,2021,16(3):1934578X2199914.
[14] PELLETIER C,BOULEY C,CAYUELA C,et al.Cell surface characteristics of Lactobacillus casei subsp.casei,Lactobacillus paracasei subsp.paracasei,and Lactobacillus rhamnosus strains[J].Applied & Environmental Microbiology,1997,63(5):1 725.
[15] 陈飞龙. Lactobacillus paracasei FX-6产抗菌肽对金黄色葡萄球菌作用机制及其应用研究[D].广州:华南农业大学,2016.
CHEN F L.The action mechanism on Staphylococcus aureus and application of antimicrobial peptide produced by Lactobacillus paracasei FX-6[D].Guangzhou:South China Agricultural University,2016.
[16] OKABAYASHI K,FUTAI M,MIZUNO D.Localization of acid and alkaline phosphatases in Staphylococcus aureus[J].Japanese Journal of Microbiology,1974,18(4):287-294.
[17] AGBALE C M,SARFO J K,GALYUON I K,et al.Antimicrobial and antibiofilm activities of helical antimicrobial peptide sequences incorporating metal-binding motifs[J].Biochemistry,2019,58(36):3 802-3 812.
[18] 李婷,杨舒然,陈敏,等.姜厚朴水提物对大肠杆菌和金黄色葡萄球菌的抑菌机理研究[J].现代食品科技,2016,32(2):84-92.
LI T,YANG S R,CHEN M,et al.Antibacterial mechanism of ginger mix-fried magnolia bark extract against Escherichia coli and Staphylococcus aureus[J].Modern Food Science and Technology,2016,32(2):84-92.
[19] HAKTANIR I,MASOURA M,MANTZOURIDOU F T,et al.Mechanism of antimicrobial activity of honeybee(Apis mellifera) venom on Gram-negative bacteria:Escherichia coli and Pseudomonas spp[J].AMB Express,2021,11(1):54.
[20] HAN Y J,SUN Z C,CHEN W X.Antimicrobial susceptibility and antibacterial mechanism of limonene against Listeria monocytogenes[J].Molecules(Basel,Switzerland),2019,25(1):E33.
[21] 戴锦铭. 山苍子精油对大肠杆菌O157:H7抗菌机制研究及在果蔬汁中的应用[D].镇江:江苏大学,2019.
DAI J M.Antibacterial mechanism of Litsea cubeba essential oil against Escherichia coli O157:H7 and its application in vegetable juice[D].Zhenjiang:Jiangsu University,2019.
[22] MIOZZARI G F,NIEDERBERGER P,HüTTER R.Permeabilization of microorganisms by TritonX-100[J].Analytical Biochemistry,1978,90(1):220-233.
[23] 侯利霞, 翟培,施用晖,等.家蝇抗菌肽对细菌细胞表面特性影响及其作用机理的研究[J].微生物学通报,2007,34(3):434-437.
HOU L X,ZHAI P,SHI Y H,et al.Effect on the bacterial cell surface characteristics and cell membrane of the antibacterial peptide of housefly(Musca domestica)[J].Microbiology China,2007,34(3):434-437.
[24] AZIMI S,THOMAS J,CLELAND S E,et al.Cell surface hydrophobicity determines Pseudomonas aeruginosa aggregate assembly[J].bioRxiv,2021,DOI:10.1101/2021.01.14.42 6723.
[25] LEE D G,KIM H N,PARK Y,et al.Design of novel analogue peptides with potent antibiotic activity based on the antimicrobial peptide,HP(2-20),derived from N-terminus of Helicobacter pylori ribosomal protein L1[J].BBA-Proteins Proteomics,2002,1 598(1):185-194.
[26] 赵清风, 陈介南,张林,等.AgNO3对大肠杆菌和金黄色葡萄球菌的抗菌作用及机制[J].生物加工过程,2011,9(3):52-56.
ZHAO Q F,CHEN J N,ZHANG L,et al.Antimicrobial activity and mechanism of silver nitrate on Escherichia coli and Staphylococcus aureus[J].Chinese Journal of Bioprocess Engineering,2011,9(3):52-56.
[27] KWON J,KANG H Y,YANG H.Permeabilization-free β-galactosidase-induction-based electrochemical detection of Escherichia coli[J].Sensors and Actuators B:Chemical,2021,337:129768.
[28] ZHANG X R,JIANG Z Y,YUAN H,et al.Influence of surface zeta potential on adhesion of Chlorella sp. to substratum surfaces[J].Advanced Materials Research,2013,690-693:1 431-1 434.
[29] CHAN M Y Y,BELL D J,DUNNIL P.The relationship between the zeta potential and the size of soya protein acid precipitate particles[J].Biotechnology and Bioengineering,1982,24(8):1 897-1 900.