金银花为忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾或带初开的花,是我国传统药食两用大宗中药材之一,具有清热解毒、疏散风热的功效[1]。金银花主要含有有机酸、黄酮、环烯醚萜、三萜等功效成分[2-3]。现代医学研究表明,金银花具有抗氧化、降血脂、抗炎、保肝利胆、抗病毒、抗菌和免疫调节等药理作用[3]。
体外仿生消化法是根据人体或动物的生理学功能,模拟胃肠道环境的生物学特性,能够在一定程度上反映某些药物或食物在人体胃肠道中的动态变化情况的一种方法[4-5],因而在药食两用植物的体外模拟胃肠道消化研究中已得到广泛用[6-8]。目前有关金银花抗氧化方面的研究主要集中在其提取物本身所含化学成分及体外活性的测定[9-11],这仅能单纯地分析其原有化学成分含量及抗氧化活性,但不能真实反映在胃肠消化过程中金银花有效成分和抗氧化活性的变化。基于此,本研究采用体外仿生消化法探究金银花中12种主要功能成分及抗氧化活性的变化规律,以期为金银花体外模拟胃肠消化提供一定的理论指导,同时也为正确认知和评价金银花对人体的生理学活性提供相关依据。
1 材料、试剂与仪器
1.1 材料与试剂
金银花,山东平邑,经山东中医药大学张永清教授鉴定为忍冬科植物忍冬(Lonicera japonica Thunb.)的干燥花蕾;磷酸钠、钼酸铵、硫酸亚铁(AR),天津市永大化学试剂有限公司;胃蛋白酶(≥ 250 U/mg)、胰蛋白酶(8×USP)、猪胆盐,美国Macklin公司;碳酸钠、碳酸氢钠(均为分析纯),国药集团化学试剂公司;乙腈、甲醇,赛默飞世尔科技有限公司;木犀草苷(Y13 J10H93050)、新绿原酸(P20A11L121936)、芦丁(Y24F11Y17051)、绿原酸(Y20A11K111541)、异绿原酸B(P17 N11L131404)、异绿原酸A(Y24 N8Y49009)、隐绿原酸(P16A10U95423)、马钱苷酸(K17S11B724207)、马钱苷(P24O11F128801)、异绿原酸C(P03 N11L1-29757)、断氧化马钱苷(P27 N8L49194)、金丝桃苷(P14A11F121347)(纯度大于98%),上海源叶生物科技有限公司。
1.2 实验仪器
T6紫外-可见分光光度计,北京普析通用仪器有限公司;D-37520冷冻离心机,德国Thermo Electron公司;Alpha 1-4 LD Plus冻干机,CHRIST;-80 ℃冰箱,青岛海尔特种电器有限公司;全温振荡器,太仓市实验设备厂;IKA型旋转蒸发仪,艾卡(广州)仪器设备有限公司;2690高效液相色谱仪,美国Waters公司;ZORBAX SB-C18色谱柱,美国Agilent公司。
2 实验方法
2.1 金银花体外模拟消化
2.1.1 金银花醇提物及样品溶液的制备[12]
金银花药材粉碎,过60目筛,取粉末500 g,加10倍体积65%乙醇,于75 ℃下回流提取1 h,抽滤;滤渣加5倍体积65%乙醇,提取0.5 h,抽滤。合并滤液,减压浓缩,冻干,即得金银花醇提物。精密称取3.0 g金银花醇提物溶于200 mL生理盐水,制成15 mg/mL样品溶液备用。
2.1.2 金银花醇提物模拟胃肠消化[13-14]
消化过程分为2个阶段:胃液消化和肠液消化。模拟胃消化液:精密称量2.0 g胃蛋白酶,加50 mL 0.01 mol/L HCl溶液溶解,制成模拟胃消化液;模拟肠消化液:分别精密称量0.4 g胰蛋白酶、2.5 g猪胆盐,加100 mL 0.1 mol/L NaHCO3-Na2CO3缓冲液溶解,制成模拟肠消化液。
胃液消化:分别量取20.0 mL金银花醇提物样品溶液,置50 mL离心管,恒温水浴加热至37 ℃,1 mol/L HCl溶液调pH 2.0,加4.0 mL模拟胃消化液作为模拟胃液组;胃酸对照组和空白对照组分别加入与样品溶液等体积的0.01 mol/L HCl溶液和生理盐水,并且不调整pH。37 ℃恒温水浴摇床中消化2.0 h(避光),消化过程中,自0 h开始,每隔0.5 h取样1次,90 ℃水浴1 min灭酶,13 000 r/min离心15 min(4 ℃),上清液置-80 ℃储存。
肠液消化:模拟胃液组样品溶液仍具有胃蛋白酶活性,须经90 ℃水浴灭活1 min。以1 mol/L NaHCO3-Na2CO3缓冲液调pH 7.0,加4.0 mL模拟肠消化液作为模拟肠液组;胃液消化产物中加等体积0.1 mol/L NaHCO3-Na2CO3缓冲液代替肠液作为肠液空白组。37 ℃恒温水浴摇床中消化2.0 h(避光)。取样方式同胃液消化,90 ℃水浴灭酶1 min,低温离心后上清液于-80 ℃保存。
未加消化酶的样品溶液作为空白对照组,与胃酸对照组、肠液空白组一并用于分析模拟体外消化过程中pH值等化学环境因素对金银花醇提物化学成分和抗氧化活性的影响。
2.2 金银花醇提物消化前后化学成分含量的测定[15]
2.2.1 色谱条件
HPLC:Waters 2690型,色谱柱:C18(4.6 mm×250 mm,5 μm),流动相:A为0.1%磷酸、B为乙腈,检测波长254 nm,流速1 mL/min,柱温:室温,进样量10 μL。
2.2.2 标准溶液的配制
分别取绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、金丝桃苷、芦丁、木犀草苷、马钱苷酸、马钱苷、断氧化马钱苷12种标准品适量制成混合标准品溶液,于4 ℃保存备用。
2.2.3 含量测定
将“2.1.2”中金银花醇提物的胃、肠消化液用0.22 μm滤膜过滤,进样。分析消化前后金银花醇提物中主要活性成分含量。
2.3 体外模拟消化对金银花醇提物抗氧化性的影响
2.3.1 总体抗氧化活性测定
在王谢祎等[16]研究方法基础上稍作改动。分别取3 mol/L H2SO3、0.02 mol/L 钼酸铵和0.14 mol/L Na3PO3溶液各1.0 mL,加蒸馏水至5.0 mL作为空白对照组,在695 nm处测定吸光度记为A0。取1.0 mL样品溶液为反应组,在695 nm处测定吸光度记为Ai。总体抗氧化能力计算如公式(1)所示:
ΔA=Ai-A0
(1)
式中:ΔA,吸光度差值;A0,空白组吸光度;Ai,样品溶液吸光度。
2.3.2 ·OH清除能力测定
参照赵玉静等[17]报道的方法并稍作改动。分别取9 mmol/L 水杨酸-乙醇、9 mmol/L FeSO3、消化液各1.0 mL,加1.0 mL 8.8 mmol/L H2O2,在510 nm处测定吸光度记为Ai。另以蒸馏水代替样品为样品空白组,在510 nm处测定吸光度记为A0,以蒸馏水替代H2O2为反应空白组,在510 nm处测定吸光度记为Ai0。·OH清除率计算如公式(2)所示:
(2)
2.3.3 DPPH自由基清除能力测定
参照熊文等[18]报道的方法,以样品溶液300 μL和DPPH自由基溶液3.0 mL作为样品反应组,在517 nm处测定吸光度记为Ai;以80% 甲醇 1.0 mL代替样品溶液作为样品空白组,在517 nm处测定吸光度记为A0;80%甲醇吸光度,在517 nm处测定吸光度记为At。
DPPH清除率计算如公式(3)所示:
DPPH清除率![]()
(3)
2.4 数据分析
采用SPSS 26.0和GraphPad prism 8.3软件进行数据分析和作图。单因素方差分析中P<0.05表示差异显著具有统计学意义。采用Pearson correlation test进行相关性分析。实验操作均重复3次,结果以平均值±相对标准偏差(relative standard deviation,RSD)表示。
3 结果与分析
3.1 体外仿生消化过程中金银花醇提物化学成分含量变化
从图1可以看出,仿生消化前后金银花醇提物中主要活性成分含量发生了较大变化。在模拟胃液消化过程中,绿原酸含量变化如图2-a所示,消化后绿原酸含量为(0.642 6±0.000 2)mg/mL,较空白对照组上升了14.96%。如图2-b显示,隐绿原酸在模拟胃液中消化1.0 h后含量明显上升并达最大,此时含量为(0.017±0.002)mg/mL,较空白对照组升高了20.17%;随着消化进程,隐绿原酸含量明显降低并在2.0 h达到最小,此时含量为(0.012±0.003)mg/mL,降低了46.82%。新绿原酸(图2-c)、异绿原酸A(图2-d)在模拟胃液中0.5 h内含量较空白对照组分别上升了46.00%、25.23%。在模拟胃液消化前后,金银花6种酚酸类成分含量总体相对减少,这与万坤等[19]研究结果相一致,说明胃蛋白酶和胃酸环境可促进酚酸类成分的释放酶解。在模拟肠液消化过程中,新绿原酸含量在0.5 h出现下降,1.0 h上升至最大值并逐渐下降至稳定;绿原酸、隐绿原酸、异绿原酸A、B、C等成分消化前后无明显变化(P>0.05),0 h酚酸成分含量低是因为pH环境的改变促使酚酸类成分中的酚羟基被酶解或被结合,从而使其含量下降,但对比消化前后,可知肠液消化环境对酚酸类成分无显著影响。

图1 混标、未消化样品、胃消化样品和肠消化样品典型色谱图
Fig.1 Typical chromatograms of mixed standard,undigested sample,gastric digestion sample and intestinal digestion sample 注:S-混标、A-未消化样品、B-胃消化样品和C-肠消化样品;1-新绿原酸;2-马钱苷酸;3-绿原酸;4-隐绿原酸;5-马钱苷;6-断氧化马钱苷;7-芦丁;8-金丝桃苷;9-异绿原酸B;10-异绿原酸A;11-异绿原酸C;12-木犀草苷

a-绿原酸;b-隐绿原酸;c-新绿原酸;d-异绿原酸A;e-异绿原酸B;f-异绿原酸C
图2 仿生消化过程中酚酸类成分含量变化
Fig.2 Changes of phenolic acid content during bionic digestion
模拟胃消化过程中,黄酮类成分含量变化趋势与酚酸类成分较为相似,如图3-a和图3-b所示,0.5 h的模拟胃液组中芦丁、金丝桃苷含量分别升高了11.91%和114.44%。1.0 h模拟胃液组中木犀草苷含量上升至最大值为(0.005 2±0.000 3)mg/mL(图3-c),较0 h时升高了40.33%。然而,2.0 h模拟胃液组中金丝桃苷含量相较于空白对照组降低了19.58%。模拟肠消化0 h时(图3-a),芦丁含量明显低于空白对照组,仅为空白对照组的12.78%,且呈下降趋势。模拟肠液中金丝桃苷消化前后无明显变化(P>0.05),但含量仅为空白对照组的10.54%。因此,在模拟胃液消化过程中,黄酮类成分含量总体减少,这与李如蕊等[20]、张露等[21]报道结果一致,说明胃蛋白酶和胃酸环境可促进黄酮类成分的酶解。
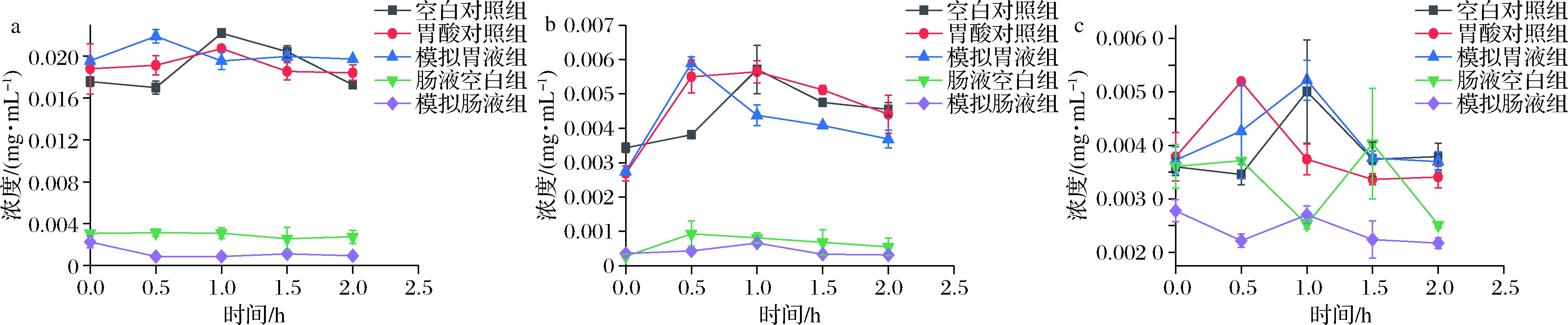
a-芦丁;b-金丝桃苷;c-木犀草苷
图3 仿生消化过程中黄酮类成分含量变化
Fig.3 Changes of flavonoid content during bionic digestion
如图4-a所示,模拟胃液组在消化0 h时,马钱苷酸含量为(0.007 5±0.000 2)mg/mL,明显低于空白对照组。此时模拟胃液组中马钱苷含量为(0.060 1±0.001 7)mg/mL(图4-b),明显高于空白对照组。而断氧化马钱苷消化前后含量无明显变化(P>0.05)。在胃液消化前后,金银花环烯醚萜类成分含量总体无明显变化,说明胃蛋白酶和胃酸环境对环烯醚萜类成分影响较小。在体外模拟肠液消化过程中,相较于空白对照组,2.0 h内金银花环烯醚萜类成分含量无显著性变化(P>0.05)。
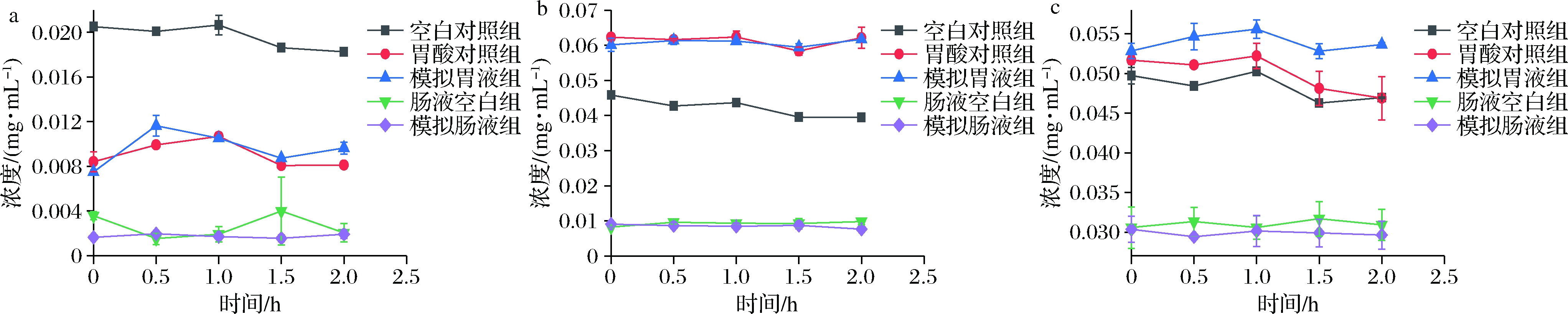
a-马钱苷酸;b-马钱苷;c-断氧化马钱苷
图4 仿生消化过程中环烯醚萜类成分含量变化
Fig.4 Changes of iridoids content during bionic digestion
3.2 仿生消化后金银花醇提物抗氧化活性变化
3.2.1 总体抗氧化活性能力
金银花醇提物及仿生消化后总体抗氧化能力结果(图5-a)显示,空白对照组(B)、模拟胃液组(GJ)和模拟肠液组(IJ)总体抗氧化能力分别为(0.526±0.023)、(0.305±0.003)和(0.202±0.006)。
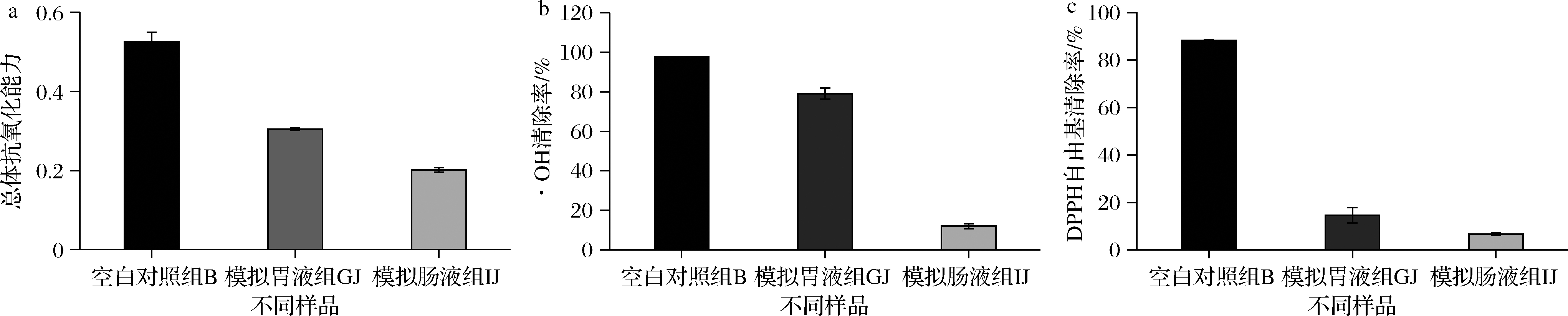
a-总体抗氧化能力;b-·OH清除率;c-DPPH自由基清除率
图5 仿生消化后金银花醇提物抗氧化能力变化
Fig.5 Changes of antioxidant capacity of ethanol extract of honeysuckle after biomimetic digestion
相较于B,金银花醇提物经过模拟胃液和模拟肠液消化后总体抗氧化能力显著降低,GJ总体抗氧化能力降低了44.36%,而IJ降低了64.98%。
3.2.2 ·OH清除能力
金银花醇提物及模拟消化后·OH清除能力如图5-b所示,金银花醇提物经过仿生消化后,空白对照组(B)、模拟胃液组(GJ)和模拟肠液组(IJ)·OH清除能力分别为(97.51±0.3)%、(79.07±2.85)%、(11.99±1.34)%,与B相比,GJ的·OH清除能力降低了18.91%,而IJ降低了87.70%。
3.2.3 DPPH自由基清除能力
金银花醇提物及仿生消化后DPPH自由基的清除能力结果如图5-c所示,空白对照组(B)、模拟胃液组(GJ)和模拟肠液组(IJ)的DPPH自由基清除率分别为(88.37±0.15)%、(14.55±3.17)%和(6.56±0.48)%,与B相比,GJ的DPPH自由基清除能力降低了85.53%,而IJ降低了92.58%。
3.3 消化前后成分含量变化与其抗氧化活性之间的相关性分析
由图6可知,在模拟胃肠道消化过程中,金银花醇提物消化前后的总体抗氧化能力、·OH清除能力以及DPPH自由基清除能力与隐绿原酸、异绿原酸A、B、C以及芦丁、金丝桃苷、木犀草苷含量之间呈良好的正相关性(P<0.05)。

图6 仿生消化前后成分含量变化与抗氧化活性之间 的相关性分析
Fig.6 Correlation analysis between the content changes of components and their antioxidant activities before and after bionic digestion
此外,金银花醇提物DPPH自由基清除能力和总体抗氧化能力之间也存在显著的相关性(P<0.05),说明酚酸以及黄酮类成分含量能够较好地反映金银花醇提物的DPPH自由基清除能力和总体抗氧化能力。
4 讨论与结论
4.1 讨论
本研究利用体外仿生消化法研究了金银花醇提物中酚酸类、黄酮类及环烯醚萜类成分含量的变化规律,并以总体抗氧化能力、·OH清除能力和DPPH自由基清除能力为指标综合评价金银花醇提物消化前后抗氧化活性的变化情况。
金银花醇提物在模拟胃液消化中环烯醚萜类成分含量无显著性差异,酚酸类和黄酮类成分含量出现下降趋势,尤其新绿原酸、隐绿原酸、芦丁和金丝桃苷等成分。空白对照组中异绿原酸A、异绿原酸C和隐绿原酸含量呈逐渐上升并趋于稳定,推测37 ℃环境会促进金银花醇提物中酚酸类物质的释放。而在胃酸对照组和模拟胃液组中,隐绿原酸、新绿原酸和异绿原酸B均出现含量先升高后下降的规律,在1.0 h达最大值,可推测胃蛋白酶和胃酸环境对它们有一定的酶解作用,并在1.0 h后酚酸类物质的酶解速度大于释放速度。模拟肠液消化过程中,由于溶液酸碱环境的改变,使得酚酸类、黄酮类和环烯醚萜类物质在0 h均出现降低情况,且降幅较大,尤其芦丁含量降幅最大。肠液对照组和模拟肠液组中因肠液碱性增加,酚酸类化合物分子结构中多具有酚羟基,容易发生反应。环烯醚萜类成分虽受到酸碱环境影响,而模拟胃、肠消化过程中无显著性变化,从而胃、肠溶液对环烯醚萜类成分不具有消化作用。由此可见,胃肠环境对酚酸及黄酮类成分的酶解作用较明显,而对酚酸类、黄酮类成分的具体酶解机制还有待进一步深入探究。
通过对比仿生消化前后的抗氧化能力可知,金银花醇提物在模拟胃肠消化过程中抗氧化能力随着酚酸类、黄酮类成分含量的下降而降低,说明经过胃液消化后金银花中的抗氧化活性成分部分被酶解,导致其抗氧化能力降低。金银花在模拟肠液消化过程中肠液消化组的总体抗氧化能力和·OH清除能力与成分含量的变化趋势一致,即在模拟肠液消化过程中,肠液酸碱环境、胰蛋白酶、胆盐环境在促进酚酸类、黄酮类成分的降解或转化的同时,抗氧化能力也随之明显降低。相关性分析结果显示,金银花醇提物仿生消化前后的抗氧化能力与其中主要成分隐绿原酸、异绿原酸A、B、C以及芦丁、金丝桃苷、木犀草苷的含量变化成正相关,且酚酸以及黄酮类成分含量能够较好地反映金银花醇提物的DPPH自由基清除能力和总体抗氧化能力。因此,酚酸类、黄酮类成分是金银花主要的抗氧化活性成分,这与徐文流等[22]、付晶晶等[23]、朱小峰等[24]报道的结果相一致。
4.2 结论
本研究结果为进一步深入研究金银花体内胃肠道消化以及正确认识金银花对人体的生物学活性提供了一定的理论指导,同时也为金银花提取物在保健食品和医药等领域的开发及应用提供了科学依据。但金银花醇提物中化学成分因其自身性质差异在模拟胃肠道环境中表现出不同的稳定性,其结构变化、降解途径、代谢产物及各成分之间是否存在相互作用仍值得进一步探究。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2020.
Chnese Plamacopoeia Comrission.Plamacopoeia of the people’s republic of China[S].Beijing:China Medical Science Press,2020.
[2] PAN H Q,ZHOU H,MIAO S,et al.An integrated approach for global profiling of multi-type constituents:Comprehensive chemical characterization of Lonicerae japonicae Flos as a case study[J].Journal of Chromatography A,2020,1 613:460674.
[3] 朱文卿,任汉书,郑媛媛,等.金银花的功能性成分及其生物活性研究进展[J].食品工业科技,2021,42(13):412-426.
ZHU W Q,REN H S,ZHENG Y Y,et al.Research progress in functional components and bioactivity of honeysuckle[J].Science and Technology of Food Industry,2021,42(13):412-426.
[4] 伍鹏,王晶晶,董志忠,等.体外仿生消化系统的研究进展—从静态到动态[J].生物产业技术,2019(6):26-41.
WU P,WANG J J,DONG Z Z,et al.Advance in biomimetic in vitro digestion systems-from static to dynamic[J].Biotechnology & Business,2019(6):26-41.
[5] 李诺,张东杰,张桂芳,等.体外模拟消化技术研究进展[J].食品与机械,2021,37(3):201-206.
LI N,ZHANG D J,ZHANG G F,et al.Advances in the study of in vitro simulated degistion[J].Food & Machinery,2021,37(3):201-206.
[6] 刘静敏,史静兰,鲁江,等.体外模拟胃肠消化过程中四种茶叶活性成分及抗氧化性变化规律[J].食品工业科技,2020,41(1):301-306.
LIU J M,SHI J L,LU J,et al.Changes of active constituents and antioxidant properties of four kinds of tea during gastrointestinal digestion in vitro[J].Science and Technology of Food Industry,2020,41(1):301-306.
[7] 李贻,贺君,张鹏敏.体外模拟胃肠道消化下刺梨抗氧化成分的释放[J].现代食品科技,2020,36(2):102-107.
LI Y,HE J,ZHANG P M.Antioxidant components release of Rosa roxburghii Tratt by in vitro simulated gastrointestinal digestion[J].Modern Food Science and Technology,2020,36(2):102-107.
[8] 陈希苗,李美英,许秋莉,等.体外模拟胃肠消化中山楂多酚及抗氧化活性的变化[J].食品科学,2019,40(5):31-37.
CHEN X M,LI M Y,XU Q L,et al.Changes in polyphenol contents and antioxidant activity in hawthorn(Crataegus pinnatifida Bunge) during simulated gastrointestinal digestion[J].Food Science,2019,40(5):31-37.
[9] 刘豪,张冬青,刘硕,等.金银花不同提取物抗氧化活性的研究[J].食品研究与开发,2016,37(1):48-52.
LIU H,ZHANG D Q,LIU S,et al.Study on the antioxidant activity of different extracts of the flower buds of Lonicera japonica[J].Food Research and Development,2016,37(1):48-52.
[10] 王桂林,徐未芳,刘乐,等.金银花不同溶剂提取物多酚含量及抗氧化活性[J].食品研究与开发,2020,41(5):104-107.
WANG G L,XU W F,LIU L,et al.The content and antioxidant activities of honeysuckle polyphenol extracted by different solvent[J].Food Research and Development,2020,41(5):104-107.
[11] 张敏敏,赵志国,刘倩,等.基于离线2D-HPLC-DPPH-ESI-Q-TOF/MS联用技术的金银花抗氧化成分系统筛选研究[J].中草药,2021,52(11):3 193-3 200.
ZHANG M M,ZHAO Z G,LIU Q,et al.Rapid discovery of trace antioxidants in Lonicerae Japonicae Flos by 2D-HPLC-DPPH-ESI-TOF/MS[J].Chinese Traditional and Herbal Drugs,2021,52(11):3 193-3 200.
[12] 宋亚玲,王红梅,倪付勇,等.金银花中酚酸类成分及其抗炎活性研究[J].中草药,2015,46(4):490-495.
SONG Y L,WANG H M,NI F Y,et al.Study on anti-inflammatory activities of phenolic acids from Lonicerae Japonicae Flos[J].Chinese Traditional and Herbal Drugs,2015,46(4):490-495.
[13] DE TAGLIAZUCCHI D,VERZELLONI E,DE BERTOLINI D,et al.In vitro bio-accessibility and antioxidant activity of grape polyphenols[J].Food Chemistry,2010,120(2):599-606.
[14] MINEKUS M,ALMINGER M,ALVITO P,et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function,2014,5(6):1 113-1 124.
[15] WANG L N,ZHANG Y Q.Quality analysis and high-performance liquid chromatographic fingerprint analysis of new cultivated kind of Lonicerae japonicae Flos “Hua Jin 6” from different harvest times[J].Chinese Medicine,2017,8(1):18-32.
[16] 王谢祎,翟宇鑫,李倩,等.南酸枣在模拟消化过程中抗氧化活性及多酚含量分析[J].食品科学,2016,37(11):7-11.
WANG X Y,ZHAI Y X,LI Q,et al.Changes in antioxidant activity and phenol content in Choerospondias axillaris fruits during simulated gastrointestinal digestion[J].Food Science,2016,37(11):7-11.
[17] 赵玉静,李建宽,张鑫,等.番石榴叶黄酮类化学成分及其抗氧化活性研究[J].中国中药杂志,2018,43(4):760-765.
ZHAO Y J,LI J K,ZHANG X,et al.Study on antioxidant activity of flavonoids from leaves of Psidium guajava[J].China Journal of Chinese Materia Medica,2018,43(4):760-765.
[18] 熊文,吴婷,曹伟伟,等.体外消化对藜蒿叶多酚含量及抗氧化活性的影响[J].现代食品科技,2020,36(1):78-83;287.
XIONG W,WU T,CAO W W,et al.Effects of in vitro digestion on phenolic acid content and antioxidant activity of Artemisia selengensis Turcz leaves[J].Modern Food Science and Technology,2020,36(1):78-83;287.
[19] 万坤,郭珍妮,李思杰,等.体外消化对高粱壳酚类物质含量及其抗氧化活性的影响[J].食品科技,2017,42(3):180-185.
WAN K,GUO Z N,LI S J,et al.Effects of simulated digestion on contents and antioxidants of phenolics of sorghum hull[J].Food Science and Technology,2017,42(3):180-185.
[20] 李如蕊,陈欣,茹月蓉,等.体外模拟消化过程中核桃花提取物抗氧化活性的变化[J].现代食品科技,2020,36(11):196-201;169.
LI R R,CHEN X,RU Y R,et al.Changes of in vitro simulated gastrointestinal digestion on the antioxidant activity of walnut flower[J].Modern Food Science and Technology,2020,36(11):196-201;169.
[21] 张露,杨斯涵,涂宗财,等.体外模拟消化对鸡爪槭叶多酚稳定性及其自由基清除和α-葡萄糖苷酶抑制活性的影响[J].天然产物研究与开发,2018,30(3):354-361.
ZAHNG L,YANG S H,TU Z C,et al.Influence of in vitro simulated digestion on stability and free radical scavenging and α-glucosidase inhibitory activities of Acer palmatum leaves polyphenols[J].Natural Product Research and Development,2018,30(3):354-361.
[22] 徐文流,贝琦,梁诗雅,等.红曲霉发酵提高金银花的抗氧化活性[J].现代食品科技,2020,36(9):47-53;163.
XU W L,BEI Q,LIANG S Y,et al.Improvement of the antioxidative activities of Flos Lonicerae japonicae through its solid-state fermentation with Monascus[J].Modern Food Science and Technology,2020,36(9):47-53;163.
[23] 付晶晶,肖海芳,宋元达.金银花等6种植物提取物总黄酮含量与抗氧化性相关性研究[J].食品与机械,2017,33(6):159-163.
FU J J,XIAO H F,SONG Y D.Acomparative study of contents of total flavonoids and their antioxidant activities in six plants[J].Food & Machinery,2017,33(6):159-163.
[24] 朱小峰,朱晓娣,王金梅.封丘产金银花不同提取物的体外抗氧化、抗凝血及α-葡萄糖苷酶抑制活性研究[J].中国药房,2016,27(34):4 804-4 806.
ZHU X F,ZHU X D,WANG J M.Study on in vitro antioxidant,anticoagulant and α-glucosidase inhibitory activities of different extracts of Lonicerae japonicae from Fengqiu[J].China Pharmacy,2016,27(34):4 804-4 806.