牛乳引起婴幼儿和儿童过敏发生率约1%~7.5%,而酪蛋白作为牛乳蛋白最主要的过敏原之一,与特异性IgG介导的儿童牛乳过敏甚至持续性过敏密切相关[1]。由酪蛋白造成的持续性过敏反应不容忽视,能够导致与胃肠道和特异性皮炎相关的过敏反应[2-3]。近年来,用于避免婴幼儿过敏的配方奶粉数量一直在增加,这些低过敏原性配方包括水解蛋白配方和合成氨基酸配方[4]。酪蛋白作为婴幼儿配方奶粉的主要蛋白原料,在含有接近25种蛋白质组分的牛乳中,具有和乳清蛋白同等的致敏潜力[5]。然而,牛乳蛋白的抗原结合表位可能因不同蛋白来源或加工方法而有差异,配方奶粉中的蛋白质来源或加工方法也可能会对其抗原反应性有影响[6]。
完整的乳蛋白原料可能具有不同程度致敏潜力,对于牛乳过敏的婴幼儿来说,低过敏性牛乳配方是一个不错的选择。传统的处理方法包括加热、高压和辐照等主要破坏蛋白的构象表位,蛋白分子仍然完整或为大分子片段,降低酪蛋白效果可能不理想[7]。蛋白酶水解被认为是在很大程度上降低以线性表位为主的酪蛋白过敏原性的最有效方法,可以通过改变蛋白质与抗体结合表位来增加或减少抗原活性[8]。然而,过度水解配方会降低乳蛋白功能价值[9]。因此,通过有效的酶解手段,实现既能消除蛋白过敏又能最大限度保留蛋白固有的特征,一直是学术界和产业界追求的目标。
本文以婴幼儿配方奶粉配料酪蛋白为研究对象,首先通过血清学评价方法分析5种不同来源酪蛋白结合牛乳过敏儿童血清IgG差异,然后对其中具有较高过敏原性的酪蛋白进行蛋白酶水解,以期为消减乳中过敏原,开发低水解度下具有低致敏配方奶粉建立基础。
1 材料与方法
1.1 蛋白样品来源
5种牛乳酪蛋白样品分别来自北京银河路经贸有限公司的酸法酪蛋白(编号CN1)和凝乳酶酪蛋白(编号CN3)、来自天津益健元生物科技有限公司的酸法酪蛋白(编号CN2)、来自北京多爱特生物科技有限公司的胶束酪蛋白(编号CN4)和酶法酪蛋白(编号CN5)。
1.2 血清样品来源
从青岛大学附属医院采集到12例牛乳过敏儿童IgG血清,经筛选得到具有较高结合牛乳酪蛋白组分能力的血清6例,年龄1~6岁(平均年龄3.7岁),男3例,女3例,取6例血清等体积混合后用于酪蛋白过敏原性测定。采集正常儿童血清3例,年龄5~9岁(平均年龄7.0岁),男2例,女1例,使用时以3例血清等体积混合血清作为阴性对照。这项研究是根据《赫尔辛基宣言》进行的,所有参与的儿童的监护人均已知情同意。
1.3 主要材料与试剂
α-胰凝乳蛋白酶、TMB双组分显色液、ECL超敏发光液、PVDF膜,北京索莱宝生物科技有限公司;碱性蛋白酶,丹麦Novozymes公司;菠萝蛋白酶、木瓜蛋白酶,南宁庞博生物工程有限公司;BCA蛋白定量试剂盒、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗人IgG,南京碧云天生物技术有限公司。
1.4 主要仪器与设备
Multiskan FC酶标仪,美国Thermo Scientific公司;DYCZ-24F电泳仪,北京六一生物科技有限公司;Tanon 5200Multi凝胶成像发光仪,上海天能科技有限公司。
1.5 实验方法
1.5.1 蛋白含量测定
分别称取酪蛋白0.100 8 g,溶于10 mL去离子水,加入蛋白质量5%的无水Na2CO3并涡旋振荡使酪蛋白完全溶解。各蛋白样品稀释1/50后用BCA法测定蛋白含量,具体操作根据试剂盒说明书进行。
1.5.2 蛋白SDS-PAGE分析
采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)法分析蛋白组成[10],稀释样品蛋白质量浓度至2 mg/mL,分离胶12%,浓缩胶4%,蛋白样品上样量20 μL,蛋白Marker上样量5 μL,利用凝胶成像仪拍照。
1.5.3 血清IgG结合酪蛋白能力测定
1.5.3.1 间接ELISA法
采用间接酶联免疫吸附(enzyme linked immunosorbent assay, ELISA)法测定酪蛋白样品的过敏原性[11]。包被液稀释蛋白为125 μg/mL后包被于96孔酶标板,4 ℃过夜,洗板3次。加封闭液于37 ℃封闭2 h,结束后洗板。加稀释1/1 600的患者血清于37 ℃温育1 h,结束后洗板。加稀释1/1 000的HRP-羊抗人IgG于37 ℃温育30 min,结束后洗板。等体积的TMB底物A液和B液混匀加入酶标板并37 ℃温育5 min。加2 mol/L硫酸终止反应,15 min内利用酶标仪测定450 nm处的吸光值。
1.5.3.2 免疫印迹法
采用免疫印迹法测定血清IgG与酪蛋白组分的结合特点[12]。按1.5.2制备SDS-PAGE凝胶,电泳结束转膜至PVDF膜。用质量分数1%的牛血清蛋白(bovine serum albumin,BSA)/TBST(Tris-HCl Tween 20)对PVDF膜封闭2 h,结束后洗涤3次。用稀释1/1 600的血清将PVDF膜小条完全浸没,4 ℃放置过夜,结束后洗涤3次。用稀释1/4 000的HRP-羊抗人IgG室温摇床1 h,用TBST洗涤3次。取ECL超敏发光液A液与B液等体积混匀,用吸管吹打在膜上显色2~5 min,凝胶成像仪拍照。
1.5.4 酪蛋白酶解
配制40 g/L酪蛋白溶液,用1 mol/L HCl或NaOH溶液调至各蛋白酶适宜pH后分别于各蛋白酶最适温度(表1)的预热30 min。待温度和pH稳定后,加入3 000 U/g蛋白酶进行水解,使用1 mol/L HCl或NaOH溶液保持反应溶液pH恒定。分别在不同反应时间取出5 mL水解液,通过调节至不适pH阻断酶解反应[13],酶解结束后统一调节水解物pH为7.5左右,于-20 ℃储存。
表1 各蛋白酶适宜反应温度和pH
Table 1 Appropriate reaction temperature and pH for each enzyme
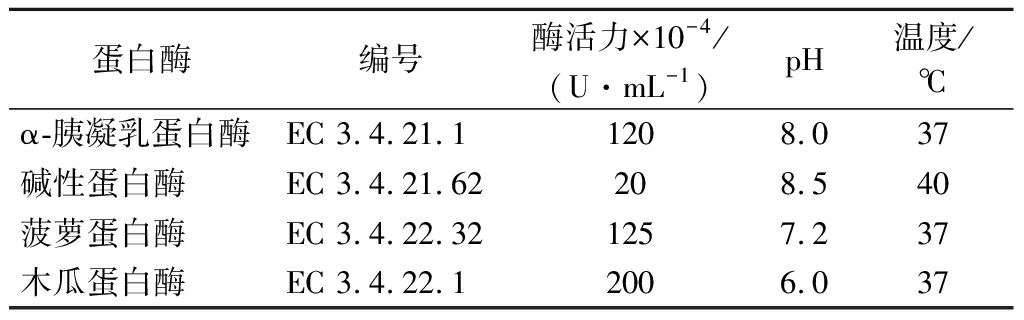
蛋白酶编号酶活力×10-4/(U·mL-1)pH温度/℃α-胰凝乳蛋白酶EC 3.4.21.11208.037碱性蛋白酶EC 3.4.21.62208.540菠萝蛋白酶EC 3.4.22.321257.237木瓜蛋白酶EC 3.4.22.12006.037
1.5.5 水解物残留过敏原性测定
间接竞争性ELISA用于测定酪蛋白水解物的残留过敏原性[14]。用包被液将未水解酪蛋白稀释至蛋白质量浓度为125 μg/mL后加入到96孔酶标板,4 ℃放置过夜,同时另取试管,水解样品稀释至125 μg/mL和稀释1/1 600的血清等体积混合后4 ℃放置过夜。一抗温育时所加样品为水解液与血清的混合液,其余步骤具体方法同1.5.3.1。
1.5.6 水解物水解度测定
酪蛋白水解液稀释1/200后采用茚三酮法测定酪蛋白水解物的水解度[15]。水解度的计算如公式(1)所示:
水解度![]()
(1)
式中:h,水解后每克蛋白质被裂解的肽键物质的量,mmol;htot,每克原料蛋白质的肽键物质的量,mmol;酪蛋白为8.2 mmol/g。
1.6 数据处理
实验数据以平均值±标准差表示,每组实验重复3次,运用SPSS 24.0软件进行单因素ANOVA分析,显著性差异(P<0.05)以不同字母表示,使用Origin 8.5软件做图。
2 结果与分析
2.1 不同来源酪蛋白原料分析
测得5种不同来源酪蛋白溶液样品的蛋白浓度及换算至酪蛋白原料中蛋白占比,结果如表2所示。5种不同来源酪蛋白中,酸法制备的酪蛋白CN1蛋白含量最高,为(8.72±0.22)mg/mL,原料中含量占比高达87.19%,其余4个酪蛋白样品之间蛋白含量则无显著差异。
表2 不同来源酪蛋白的蛋白含量测定结果
Table 2 Protein content of casein from different sources
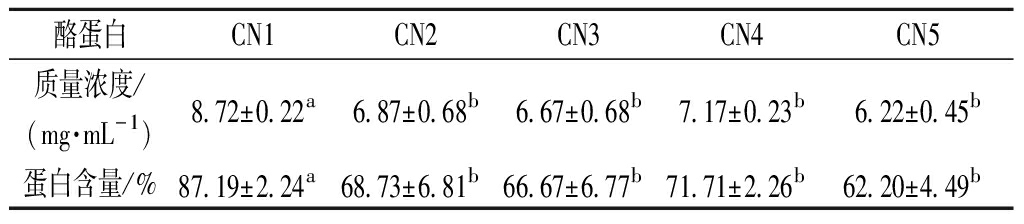
酪蛋白CN1CN2CN3CN4CN5质量浓度/(mg·mL-1)8.72±0.22a6.87±0.68b6.67±0.68b7.17±0.23b6.22±0.45b蛋白含量/%87.19±2.24a68.73±6.81b66.67±6.77b71.71±2.26b62.20±4.49b
对5种不同来源酪蛋白的蛋白组成进行蛋白电泳分析,如图1所示。5种不同来源酪蛋白含有主要条带酪蛋白,其中α-酪蛋白和β-酪蛋白含量高,κ-酪蛋白含量较低,除此之外,各酪蛋白样品中均含有少量BSA组分。牛乳蛋白中酪蛋白含量占比高达80%,并且含有母乳中缺乏的β-乳球蛋白,与牛乳蛋白不同的是,母乳蛋白易被婴幼儿和儿童消化吸收,能够更多地被胃酸溶解和更快地从胃中排空[16]。

图1 不同来源酪蛋白的SDS-PAGE图
Fig.1 SDS-PAGE of casein from different sources 注:CN1和CN2为酸法酪蛋白,CN3和CN5为酶法酪蛋白, CN4为胶束酪蛋白;α-CN,β-CN,κ-CN依次为α-, β-和κ-酪蛋白,BSA为牛血清白蛋白(下同)
此外,母乳蛋白中酪蛋白含量较牛乳低且酪蛋白初级消化物酪蛋白磷酸肽则更有助于吸收,免疫球蛋白、乳铁蛋白和溶菌酶等蛋白在胃肠道中具有初级免疫防御作用,这些不同之处也是牛乳蛋白作为母乳替代物却容易引发过敏反应的原因[17-18]。
2.2 不同来源酪蛋白样品结合血清IgG能力分析
配方奶粉中的蛋白质来源或加工方法可能会对其抗原反应性有影响[6]。不同来源酪蛋白结合过敏儿童血清特异性IgG能力的间接ELISA分析如图2所示。不同酪蛋白结合阴性血清具有差异,但吸光值均低于0.1,IgG是血清中含量最高的免疫球蛋白,这也决定了可能在阴性血清中有不同酪蛋白结合IgG的位点[19]。而当阳性血清吸光度与阴性血清吸光度之比大于2.1时,阳性血清与阴性血清有显著性差异[20]。从图2可以看到,酪蛋白结合过敏儿童血清特异性IgG的能力均显著高于结合阴性血清IgG的能力,说明该5种酪蛋白均具有一定过敏原性。凝乳酶酪蛋白CN3、胶束酪蛋白CN4和酶法酪蛋白CN5结合过敏血清特异性IgG能力无显著差异,且结合能力均显著高于酸法酪蛋白CN1和CN2。酪蛋白不同制备方法产生不同的稳定性效果,酸法酪蛋白是通过添加盐酸或硫酸等无机酸至酪蛋白等电点使其沉淀出来,而酶法酪蛋白采用凝乳酶从乳中提取酪蛋白,受凝乳基质的阻碍,产生聚集的酪蛋白胶束,且β-酪蛋白不易解离,从而保证了酪蛋白的完整性和稳定性[21-22]。因此,酶法制备的酪蛋白可能对抗原表位破坏少,结合过敏血清IgG能力较高,所以后续对酶法酪蛋白CN5采用蛋白酶水解消减过敏。
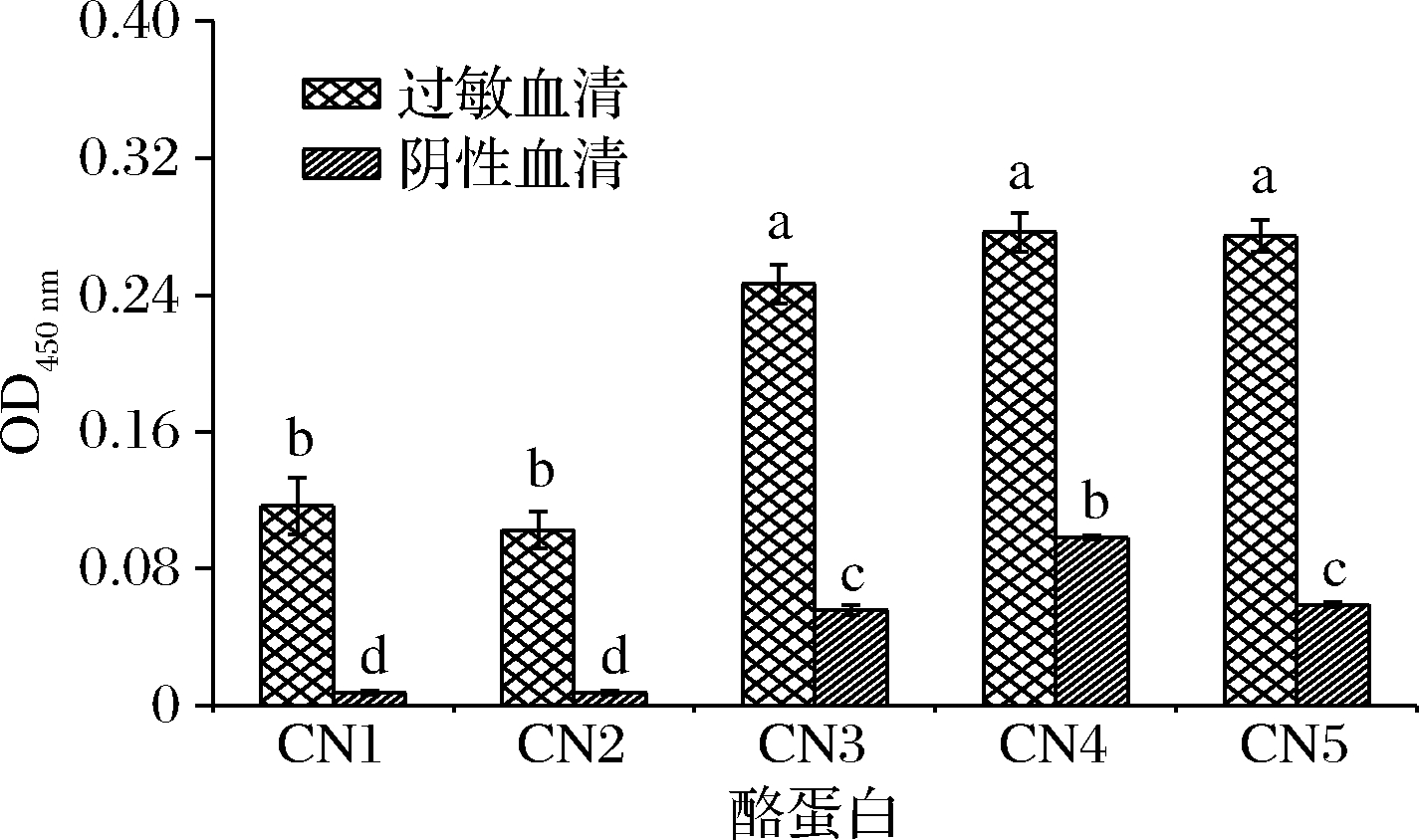
图2 不同来源酪蛋白结合血清IgG的间接ELISA分析
Fig.2 Indirect ELISA analysis of binding capacity of casein from different sources with serum IgG
在牛乳蛋白质组中含有大量可能导致过敏反应的成分[23],对不同来源酪蛋白结合过敏儿童血清IgG的组分的免疫印迹分析如图3所示。5种不同来源酪蛋白除主要组分酪蛋白与血清IgG特异结合外,还有部分乳清蛋白中的BSA结合血清IgG。有研究采用免疫印迹法对牛乳sIgG血清识别主要牛乳组分,得到血清sIgG主要识别的组分为α-酪蛋白、β-酪蛋白、β-乳球蛋白和BSA[24]。说明了儿童牛乳过敏并非由单一牛乳蛋白组分导致,几种牛乳蛋白组分都有作为过敏原的潜力。对于主要组分酪蛋白,结合血清特异性IgG最强烈的是CN3,其次为CN5,2种酪蛋白均为酶法制备的酪蛋白,而CN1和CN2两种酸法制备的酪蛋白结合血清IgG效果次之,这与图2的结果一致,即酶法制备的酪蛋白具有更高的过敏原性。酪蛋白在婴幼儿配方奶粉的应用通常是通过减少酪蛋白的含量来仿母乳化,一些婴幼儿配方奶粉中,含35%的酪蛋白和65%的α-乳白蛋白的配方奶粉比100%乳清配方奶粉过敏反应更低[25]。酪蛋白具有多个线性表位的IgG结合位点,最主要结合α和β-酪蛋白,因此对酪蛋白过敏主要消减的蛋白组分为α和β-酪蛋白。
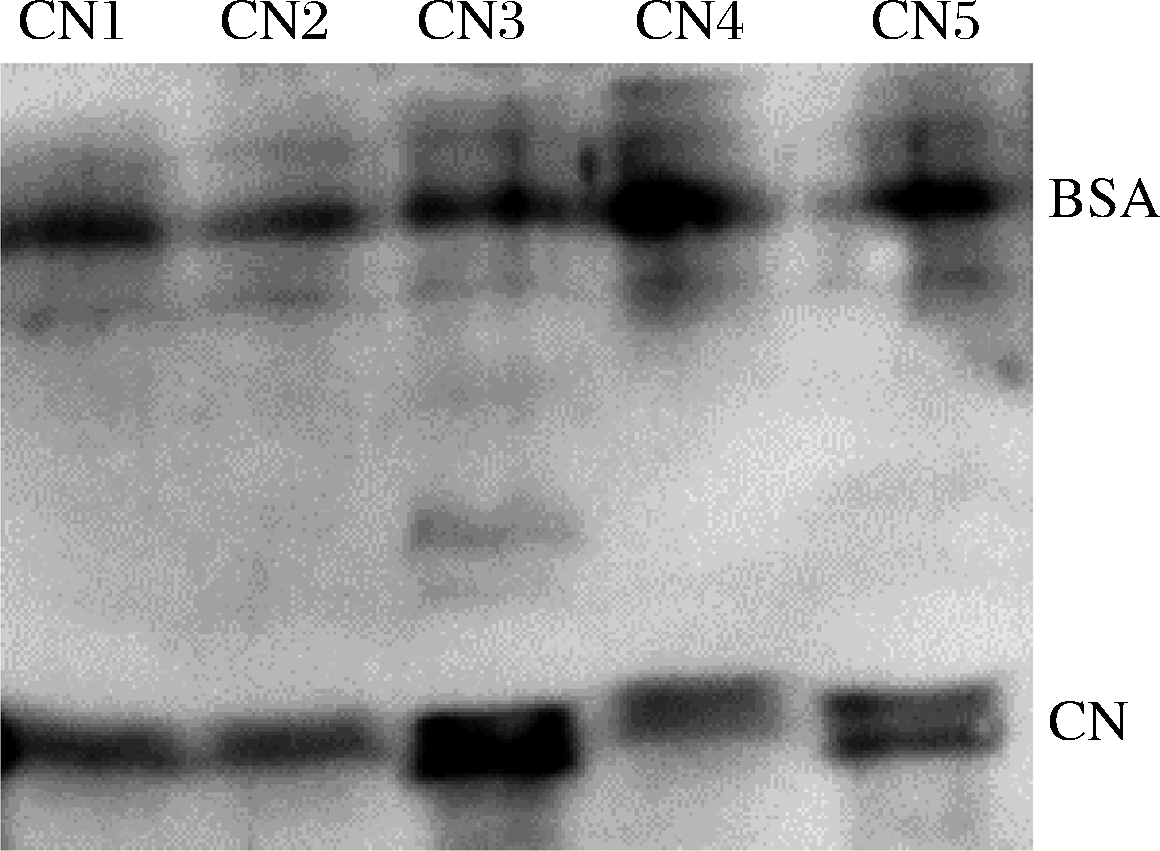
图3 不同来源酪蛋白结合血清IgG的免疫印迹图
Fig.3 Western Blotting of casein from different sources binding with serum IgG
2.3 酪蛋白水解物残留过敏原性和水解度分析
对不同来源酪蛋白结合IgG能力结果可知,酶法酪蛋白CN5具有更高的过敏原性,因此使用4种蛋白酶,α-胰凝乳蛋白酶(图4-a)、碱性蛋白酶(图4-b)、菠萝蛋白酶(图4-c)和木瓜蛋白酶(图4-d)分别对酶法酪蛋白(CN5)进行水解,取不同水解时间的水解物进行水解度和残留过敏原性结果如图4所示。

a-α-胰凝乳蛋白酶;b-碱性蛋白酶;c-菠萝蛋白酶;d-木瓜蛋白酶
图4 不同酶分别水解牛乳酪蛋白不同时间后水解物残留过敏原性和水解度
Fig.4 The residual antigenicity and degree of hydrolysis of cow’s milk casein hydrolyzed by different enzymes
水解度能够评价水解过程中蛋白降解的程度。通过茚三酮法测定了酪蛋白水解产物的水解度,可以看出水解度曲线在加入蛋白酶后都表现出了较快的反应速率,到后期增长缓慢。初期呈现较快的酶解反应速率可能是因为蛋白酶加入时,酪蛋白序列中可供酶解的位点数目多,然后随着反应的进行,可供酶解的位点数目少或蛋白酶活力下降,因此水解缓慢。α-胰凝乳蛋白酶水解酪蛋白120 min后开始趋向平缓,水解结束时最高的水解度为11%;碱性蛋白酶水解酪蛋白的水解度在反应时间内始终较快速增长,且最高的水解度为47%;菠萝蛋白酶前期反应速度较慢,后期逐渐增长,最高水解度为8%;木瓜蛋白酶水解酪蛋白反应自120 min后增长缓慢,最高水解度约5%。从结果可知,4种蛋白酶中碱性蛋白酶具有最高的水解度,可能是由于碱性蛋白酶具有广泛的酶切位点[26]。
通过间接竞争ELISA测定了酪蛋白水解物的残留过敏原性以评价蛋白酶对酪蛋白过敏的消减效果。从图4可知,4种蛋白酶都有明显降低酪蛋白过敏原性的效果,在反应时间360 min内残留过敏原性随着水解时间延长同样会逐渐缓慢变化或出现平台期,降低效果从高到低依次为菠萝蛋白酶>木瓜蛋白酶>碱性蛋白酶>α-胰凝乳蛋白酶。α-胰凝乳蛋白酶水解酪蛋白的产物残留过敏原性随水解时间增加逐渐降低,240 min开始无显著变化,残留过敏原性为22%;碱性蛋白酶在反应180 min内对过敏原性降低效果较其他3种蛋白酶低,到240 min以后变化显著,残留过敏原性为15%;菠萝蛋白酶水解酪蛋白的残留过敏原性在反应30 min就显著降低至20%以下,至360 min残留过敏原性降低到9%,反映出最好的消减效果;木瓜蛋白酶水解酪蛋白的产物残留过敏原性从180 min开始出现平台期,随着反应时间增加无明显变化,残留过敏原性降低到14%。有研究对αS1-酪蛋白进行酶解时,采用α-胰凝乳蛋白酶水解时残留过敏原性为37%,胃蛋白酶分别在pH 2.2和5.5时残留过敏原性为40%和62%[13]。一种丝氨酸蛋白酶用于水解α-酪蛋白时,发现持续水解会产生新的过敏表位[27]。因此,本研究使用蛋白酶水解酪蛋白具有更显著降低残留致敏性的效果。
结合水解度和残留过敏原性分析可以发现,水解度较低的菠萝蛋白酶和木瓜蛋白酶反而具有最低的残留过敏原性,这说明对于不同蛋白酶水解酪蛋白时,水解度的高低并不能代表残留过敏原性的高低,两者没有呈现正向关系,有研究在评估乳清蛋白水解物致敏性时也获得类似的结果[6]。这种差异主要受蛋白酶特异水解酪蛋白位点的差异,从而影响降低酪蛋白抗原结合表位的效果。
2.4 酪蛋白水解物SDS-PAGE分析
采用SDS-PAGE反映4种蛋白酶水解酪蛋白不同时间水解产物的蛋白组分变化,实验结果如图5所示。未加入蛋白酶时,蛋白条带为完整的酪蛋白条带,水解开始后,蛋白条带发生明显的变化,大分子蛋白逐渐被水解。α-胰凝乳蛋白酶和碱性蛋白酶水解酪蛋白(图5-a)在180 min以内水解物中明显含有部分完整的α-酪蛋白,但从240 min开始完整蛋白几乎被水解,这与在240和360 min残留抗原性显著降低的结果一致。从得到菠萝蛋白酶和木瓜蛋白酶水解酪蛋白(图5-b)开始,各个过敏蛋白组分被水解,蛋白分子质量降低,随着水解不断进行,蛋白条带逐渐变浅,且分子质量集中区域往更低的区域迁移,说明随着水解程度加深,大分子蛋白不断被水解为小分子的多肽。
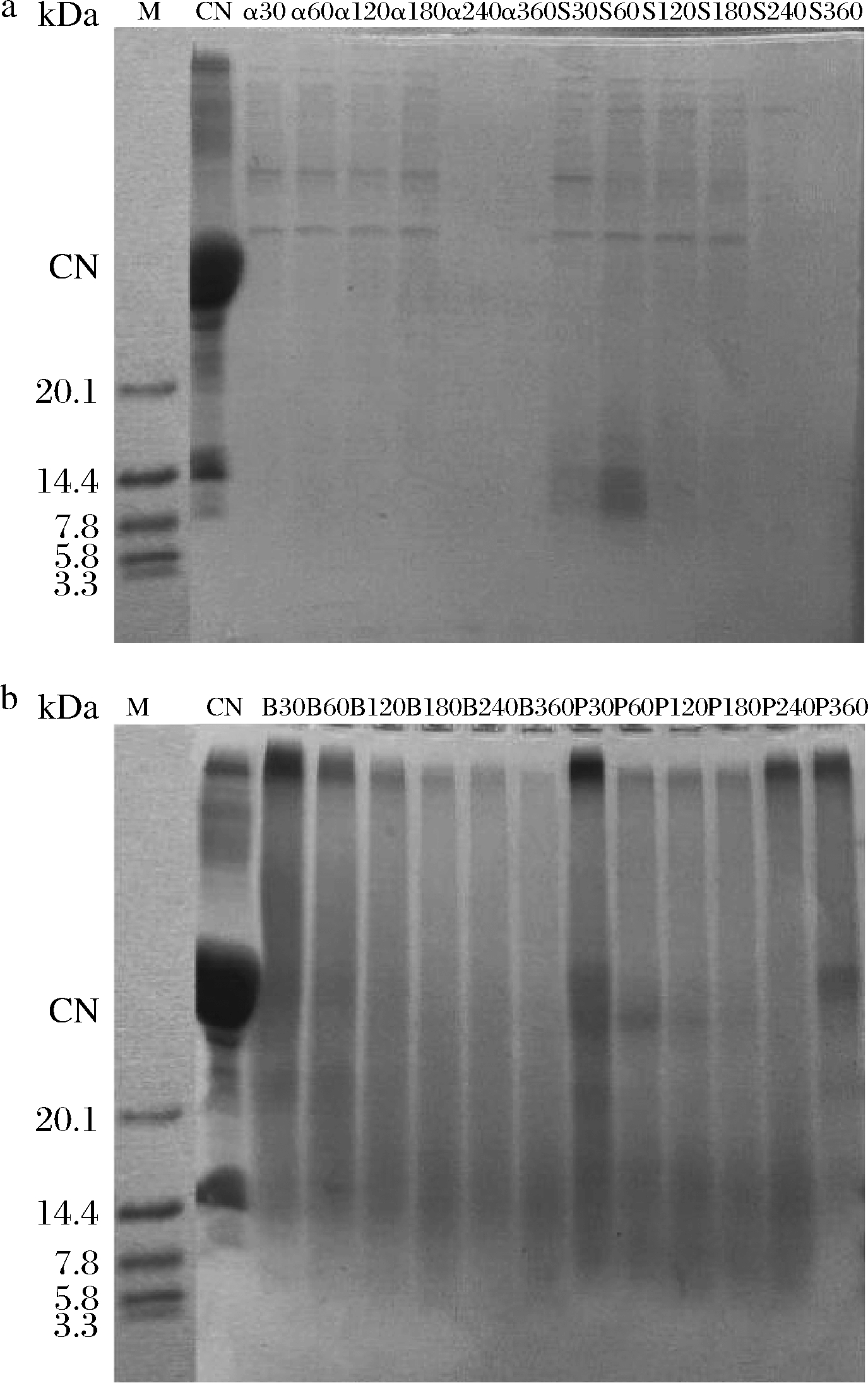
M-蛋白标准品;CN-酪蛋白;α-α-胰凝乳蛋白酶; S-碱性蛋白酶;B-菠萝蛋白酶;P-木瓜蛋白酶 a-α-胰凝乳蛋白酶、碱性蛋白酶;b-菠萝蛋白酶、木瓜蛋白酶
图5 不同酶分别水解牛乳酪蛋白不同时间后水解物的 SDS-PAGE图
Fig.5 SDS-PAGE of cow’s milk casein hydrolyzed by different enzymes 注:字母旁边的数字为水解时间,单位为min
3 结论
采用酶解法消减牛乳蛋白过敏原,生产低致敏性婴幼儿配方奶粉是可行的解决途径。本研究在对不同制备酪蛋白的过敏原性分析时均获得了较高的过敏血清IgG结合能力,说明获得的酪蛋白原料都具有过敏潜力,其中酶法制备的酪蛋白致敏潜力更高。对酶法酪蛋白针对性酶解得到,酶解可以有效消减牛乳中酪蛋白过敏,4种蛋白酶分别用于水解牛乳酪蛋白,随着反应时间增加酪蛋白残留过敏原性均显著降低并在反应后期无明显变化,α-胰凝乳蛋白酶、碱性蛋白酶、菠萝蛋白酶和木瓜蛋白酶获得残留过敏原性依次为22%、15%、9%和14%,对应水解度为11%、47%、8%和5%。尽管碱性蛋白酶水解酪蛋白能力强,但消减过敏原能力不如菠萝蛋白酶,因此,菠萝蛋白酶可以实现低水解度下特异性消减牛乳酪蛋白过敏。在低致敏性婴幼儿配方奶粉的设计中还需要进一步考虑对水解物特性与营养学相关的评价。
[1] ITO K,FUTAMURA ![]() R,et al.The usefulness of casein-specific IgE and IgG4 antibodies in cow’s milk allergic children[J].Clinical and Molecular Allergy,2012,10(1):1-7.
R,et al.The usefulness of casein-specific IgE and IgG4 antibodies in cow’s milk allergic children[J].Clinical and Molecular Allergy,2012,10(1):1-7.
[2] HE M,SUN J Q,JIANG Z Q,et al.Effects of cow’s milk beta-casein variants on symptoms of milk intolerance in Chinese adults:A multicentre,randomised controlled study[J].Nutrition Journal,2017,16(1):1-12.
[3] WERFEL T,AHLERS G,SCHMIDT P,et al.Detection of a kappa-casein-specific lymphocyte response in milk-responsive atopic dermatitis[J].Clinical And Experimental Allergy,1996,26(12):1 380-1 386.
[4] PAREKH H,BAHNA S L.Infant formulas for food allergy treatment and prevention[J].Pediatric Annals,2016,45(4):e150-e156.
[5] CHATCHATEE P,J RVINEN K M,BARDINA L,et al.Identification of IgE-and IgG-binding epitopes on αs1-casein:Differences in patients with persistent and transient cow’s milk allergy[J].Journal of Allergy and Clinical Immunology,2001,107(2):379-383.
RVINEN K M,BARDINA L,et al.Identification of IgE-and IgG-binding epitopes on αs1-casein:Differences in patients with persistent and transient cow’s milk allergy[J].Journal of Allergy and Clinical Immunology,2001,107(2):379-383.
[6] VAN ESCH B C A M,SCHOUTEN B,HOFMAN G A,et al.Acute allergic skin response as a new tool to evaluate the allergenicity of whey hydrolysates in a mouse model of orally induced cow’s milk allergy[J].Pediatric Allergy and Immunology,2010,21(4p2):e780-e786.
[7] VANGA S K,SINGH A,RAGHAVAN V.Review of conventional and novel food processing methods on food allergens[J].Critical Reviews in Food Science and Nutrition,2017,57(10):2 077-2 094.
[8] AZDAD O,MEJRHIT N,EL KABBAOUI M,et al.Effect of heating and enzymatic hydrolysis on casein cow milk sensitivity in Moroccan population[J].Food and Agricultural Immunology,2018,29(1):424-433.
[9] FAN W W,TAN X Y,XU X B,et al.Relationship between enzyme,peptides,amino acids,ion composition,and bitterness of the hydrolysates of Alaska pollock frame[J].Journal of Food Biochemistry,2019,43(4):e12801.
[10] ZHANG Y,WANG Y X,ZHAO H A,et al.Characterization of novel protein component as marker for floral origin of jujube(Ziziphus jujuba Mill.) honey[J].Journal of Agricultural and Food Chemistry,2019,67(44):12 255-12 263.
[11] SONG Y N,LI Z X,LIN H,et al.Effect of malondialdehyde treatment on the IgE binding capacity and conformational structure of shrimp tropomyosin[J].Food Chemistry,2015,175:374-380.
[12] LV L,LIN H,LI Z X,et al.Determining the effect of malondialdehyde on the IgE-binding capacity of shrimp tropomyosin upon in vitro digestion[J].Journal of the Science of Food and Agriculture,2017,97(13):4 588-4 594.
[13] AHMAD N,IMRAN M,KHAN M K,et al.Degree of hydrolysis and antigenicity of buffalo alpha S1 casein and its hydrolysates in children with cow milk allergy[J].Food and Agricultural Immunology,2016,27(1):87-98.
[14] DAMODARAN S,LI Y.A two-step enzymatic modification method to reduce immuno-reactivity of milk proteins[J].Food Chemistry,2017,237:724-732.
[15] 侯虎. 鳕鱼免疫活性肽的可控制备及其免疫活性研究[D].青岛:中国海洋大学,2011.
HOU H.The controllable preparation of pollock immunomodulating peptide and its immunity activity[D].Qingdao:Ocean University of China,2011.
[16] HOYT A E W,MEDICO T,COMMINS S P.Breast milk and food allergy:Connections and current recommendations[J].Pediatric Clinics of North America,2015,62(6):1 493-1 507.
[17] BALLARD O,MORROW A L.Human milk composition:Nutrients and bioactive factors[J].Pediatric Clinics of North America,2013,60(1):49-74.
[18] BOBE G,LINDBERG G L,FREEMAN A E,et al.Short communication:Composition of milk protein and milk fatty acids is stable for cows differing in genetic merit for milk production[J].Journal of Dairy Science,2007,90(8):3 955-3 960.
[19] PIETSCHMANN J,SPIEGEL H,KRAUSE H J,et al.Sensitive aflatoxin B1 detection using nanoparticle-based competitive magnetic immunodetection[J].Toxins,2020,12(5):337.
[20] AIMULAJIANG K,NAQVI M A,CHU W,et al.Adhesion-regulating molecule from Haemonchus contortus:Potential antigen for diagnosis of early infection in goats[J].Pathogens(Basel,Switzerland),2019,9(1):E34.
[21] LAMOTHE S,ROBITAILLE G,ST-GELAIS D,et al.Short communication:Extraction of β-casein from goat milk[J].Journal of Dairy Science,2007,90(12):5 380-5 382.
[22] HUPPERTZ T,FOX P F,KELLY A L.The caseins:Structure,stability,and functionality[M]//Proteins in Food Processing.Amsterdam:Elsevier,2018:49-92.
[23] MONACI L,TREGOAT V,HENGEL A J,et al.Milk allergens,their characteristics and their detection in food:A review[J].European Food Research and Technology,2006,223(2):149-179.
[24] DOCENA G H,FERNANDEZ R,CHIRDO F G,et al.Identification of casein as the major allergenic and antigenic protein of cow’s milk[J].Allergy,1996,51(6):412-416.
[25] VIVATVAKIN B,ESTORNINOS E,LIEN R Y,et al.Clinical response to two formulas in infants with parent-reported signs of formula intolerance:A multi-country,double-blind,randomized trial[J].Global Pediatric Health,2020,7:2333794X20954332.
[26] ZHENG H,SHEN X Q,BU G H,et al.Effects of pH,temperature and enzyme-to-substrate ratio on the antigenicity of whey protein hydrolysates prepared by Alcalase[J].International Dairy Journal,2008,18(10-11):1 028-1 033.
[27] ![]() A,BAJZERT J,BABIJ K,et al.Reduced IgE and IgG antigenic response to milk proteins hydrolysates obtained with the use of non-commercial serine protease from Yarrowia lipolytica[J].Food Chemistry,2020,302:125350.
A,BAJZERT J,BABIJ K,et al.Reduced IgE and IgG antigenic response to milk proteins hydrolysates obtained with the use of non-commercial serine protease from Yarrowia lipolytica[J].Food Chemistry,2020,302:125350.