核桃作为药食同源食品,富含亚油酸和亚麻酸,一些双歧杆菌(如短双歧杆菌CCFM683)[1]和乳杆菌(如植物乳杆菌ZS2058)[2]能将游离的亚油酸和亚麻酸转化为共轭脂肪酸,主要通过脂肪酸水合酶、氧化还原酶、乙酰乙酸脱羧酶催化,经过羟基化、脱水、双键异构、水合和脱水等步骤实现[3],从而提高其功能特性。核桃中亚油酸和亚麻酸主要是以甘油三酯的形式存在,用脂肪酶将结合态水解成游离态,再接种乳酸菌发酵,可制备富含共轭脂肪酸的发酵核桃乳。但游离态脂肪酸易氧化,且存在蛋白质及固体颗粒聚沉、油脂上浮的问题[4]。目前市场上存在养元六个核桃、伊利核桃乳、甄养脑立方原浆核桃乳等调配型的核桃乳饮料,除了短暂上市过的养元发酵核桃乳,还未见有成熟的发酵型核桃乳产品。
影响植物蛋白饮料稳定性的因素有很多,主要包括粒度、黏度、热处理、pH值、糖类、稳定剂等[5]。通过均质减小介质粒径、调节pH远离植物蛋白等电点、选择合适的杀菌条件避免微生物生长繁殖、添加稳定剂增强其乳化性能、提高分散介质的黏度等措施,可提高植物蛋白饮料的稳定性。
共轭脂肪酸与人类健康密切相关,具有抗癌[6]、抗动脉粥样硬化[7]、抗炎症[8]等功能,但极易被氧化。核桃本身含有维生素E和酚类等抗氧化物质,但因其自身含量偏低并不足以对油脂的氧化稳定产生显著性作用,可额外添加一些抗氧化剂来延缓氧化。核桃中的不饱和脂肪酸会由于脂氧合酶的催化造成油脂酸败,而55或者60 ℃处理2~10 min可以使得核桃中的脂氧合酶失活[9]。
本研究以核桃仁为原料制成核桃乳,利用具有较高共轭脂肪酸转化能力的短双歧杆菌CCFM683的发酵优势,将其中丰富的脂肪酸底物转化为共轭脂肪酸。首先筛选出合适的稳定剂,并进行复配,其次通过脂肪酸和挥发性风味物质分析筛选出合适的抗氧化剂,确定在此条件下的最优产品配方,并进行产品喜好度评价,为发酵型植物蛋白饮料的稳定性研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
核桃、白砂糖等,江苏省无锡市欧尚超市;食品级维生素C、维生素E、D-异抗坏血酸钠、茶多酚,河南天得商贸有限公司;食品级无水葡萄糖,南京泰成生物技术有限公司;果胶、结冷胶、羧甲基纤维素钠、黄原胶,广州健科生物技术有限公司;来自米曲霉的脂肪酶,Aladdin公司;短双歧杆菌CCFM683,实验室保藏菌种。
1.1.2 试剂
葡萄糖、胰蛋白胨、酵母粉、牛肉膏、无水乙酸钠、柠檬酸氢二铵、NaCl、K2HPO4、MgSO4·7H2O、MnSO4·H2O、吐温 80、十二烷基硫酸钠,国药集团化学试剂有限公司;十五烷酸甲酯内标物、14%(体积分数)三氟化硼-甲醇溶液和重氮甲烷,Sigma-Aldrich公司,用于脂肪酸分析的其他化学药品均为分析纯。
1.2 仪器与设备
ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;FE20型pH计,梅特勒-托利多仪器(上海)有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;UV-2450紫外分光光度计,日本岛津公司;5424R台式高速离心机,德国Eppendorf;GCMS-TSQ 8000 Evo气相色谱三重四级杆质谱联用仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 培养基的配制
mMRS液体培养基(g/L):蛋白胨10、牛肉膏10、葡萄糖20、乙酸钠2、酵母粉5、柠檬酸氢二铵2、K2HPO4·3H2O 2.6、MgSO4·7H2O 0.1、MnSO4·H2O 0.05、吐温80 1 mL、半胱氨酸氨酸盐0.5,pH 6.2~6.4,115 ℃灭菌20 min。
mMRS固体培养基:额外加2%(质量分数)的琼脂粉。
1.3.2 发酵菌株的活化培养
从实验室菌种库中挑选出1株已经证实具有较高共轭脂肪酸转化能力的菌株——短双歧杆菌CCFM683,它在添加了0.5 mg/mL亚油酸底物的mMRS液体培养基上,37 ℃厌氧培养18 h,共轭亚油酸的转化率为97.91%[10]。从-80 ℃冰箱中取出短双歧杆菌CCFM683的保菌管,置于冰中,融化后从保菌管中蘸取少量菌液在mMRS固体板上划线,置于厌氧工作站,37 ℃培养48 h。挑取单菌落,接入5 mL mMRS液体培养管,置于厌氧工作站,37 ℃培养18 h,传代活化3次,以达到108~109 CFU/mL的活菌数,3 000×g,离心3 min,并用无菌生理盐水重复洗涤3次以备接种用。
1.3.3 发酵核桃乳的制备
核桃破壳取仁,加入4%(质量分数)Na2CO3、10%(质量分数)Ca(OH)2混合溶液[11],60 ℃处理15 min左右,用冷水反复冲洗多次去皮。加入纯净水,料水比为1∶5(g∶mL),用胶体磨磨浆,磨浆后在65 ℃、25 MPa的条件下均质[12],得到的料液用200目筛子过滤,得发酵基料。在其中加入60 U/mL的脂肪酶,37 ℃水解3 h,85 ℃灭菌20 min。每80 mL为1份,倒入无菌的100 mL瓶中。将短双歧杆菌CCFM683接种到制备的核桃乳中,除了对照组之外,将菌株的初始接种量控制在107 CFU/mL左右,37 ℃发酵20 h,得发酵核桃乳。
1.3.4 pH的测定
将发酵核桃乳样品混合均匀,取约5 mL样品至试管中,将pH计的电极插入试管,样品液面没过电极,点击读数测定其pH,平行测定3次。
1.3.5 乳酸菌活菌数的测定
参照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》中的方法,从每份样品中吸取0.5 mL样品,并与4.5 mL无菌生理盐水溶液混合,选择3个适宜稀释梯度的样品均液,各取1 mL放入无菌培养皿中,每皿中倒入15~20 mL mMRS琼脂培养基,37 ℃培养48 h,计算各平板菌落数。
1.3.6 乳化稳定系数的测定
从不同乳化稳定剂配制好的发酵核桃乳中取样,用1.0 g/L的十二烷基硫酸钠溶液稀释100倍,在500 nm处测定吸光度值A1;4 500× g离心5 min,取其上清液,同样稀释100倍后于500 nm处测定吸光度值A2,设稳定系数R=A2/A1,进行3次平行测定。R越大,代表样品的乳化稳定性越高[13]。
1.3.7 离心沉淀率的测定
称量15 mL离心管的质量m0,倒入10 mL发酵核桃乳,再称取离心管和饮料的质量记为m1,3 800×g,离心30 min,缓缓倒掉离心管中的上清液,并擦去盖子、管壁口附着的残余液体,最后准确称量离心管和沉淀的质量记为m2[14]。按公式(1)计算样品的离心沉淀率:
离心沉淀率![]()
(1)
离心沉淀率越大,说明发酵核桃乳的稳定性越差。
1.3.8 挥发性风味物质的分析
利用固相微萃取气质联用技术分析发酵核桃乳中挥发性风味物质[15]。称取5 g样品和1 g NaCl装入20 mL的气相萃取瓶中,自动进样器将聚二甲基硅氧烷固相微萃取头插入气相瓶,50 ℃萃取30 min后解吸5 min,来提取样品中的挥发性风味成分,从而进行GC-MS分析。
气相色谱条件:RTX-WAX毛细管(30 m×0.25 mm,0.25 mm);分流比为10∶1,流速为1 mL/min,载气为He,进样口温度225 ℃,初始柱温30 ℃,保持3 min;以15 ℃/min的速率上升至225 ℃保持5 min。
质谱条件:电离方式EI离子源,电子能量70 eV,发射电流200 μA,检测电压1.4 kV,离子源温度240 ℃,接口温度230 ℃,四级杆温度150 ℃,质量扫描范围:m/z 30~500。
谱图通过NIST 2001标准谱库的检索及标准品比对进行定性,并采用峰面积归一化法定量。
1.3.9 脂肪酸组成分析
油脂的提取:按照FOLCH等[16]的方法提取样品,取200 μL样品加入4 mL氯仿-甲醇混合液(2∶1,体积比),以及适量的十五烷酸甲酯内标物,充分混匀,3 500× g,离心5 min,下层氯仿层与0.86%(质量分数)的NaCl溶液混合,并静置分层。收集有机层过滤,氮吹除去有机溶剂,将提脂瓶保存于-20 ℃冰箱中。
游离脂肪酸甲酯化:对VOLKOV等[17]的方法稍加改进。用甲醇重悬样品,并加入重氮甲烷,待黄色维持15 min后再次氮吹,重悬于正己烷,转移至上样小瓶,过0.22 μm有机滤膜后进行气相色谱分析。
总脂肪酸甲酯化:参照文献[18]的方法,将样品加入0.5 mol/L的NaOH-甲醇溶液1 mL,65 ℃恒温保持30 min。再加入14%(体积分数)的三氟化硼-甲醇溶液1 mL,70 ℃恒温保持5 min,取出冷却。继续加入正己烷和饱和NaCl溶液,2 000×g离心5 min,取上层有机相,过有机滤膜进行气相色谱分析。
采用GC-MS技术分析发酵核桃乳中的脂肪酸组成及含量。气相色谱条件:色谱柱RTX-WAX(30 m×0.25 mm×0.25 μm),进样量1 μL,分流比10∶1,He作为载气,进样器温度和检测器温度均为240 ℃,离子源温度220 ℃,强度为70 eV3。程序升温条件:初始温度为150 ℃,以5 ℃/min的速率升温至200 ℃,同时保留10 min,再以4 ℃/min的速度升至240 ℃,并保留10 min。
由GC-MS测得的谱图在NIST11标准谱库的检索及标准品比对进行定性,用面积归一化法相对定量。
1.3.10 喜好度评价
喜好度评价的参与者为食品专业在校学生,根据GB/T 16291.1—2012《感官分析 选拔、培训与管理评价员一般导则 第1部分:优选评价员》对感官候选人进行培训,选择30位评价员,男女人数相等。利用9点喜好度法对不同核桃香精和白砂糖添加量的发酵核桃乳进行感官评定[19],采用3位随机数进行样品的编号,对样品的表观、气味、滋味和质地等各项指标进行喜好度评价。用整数1~9表示对样品每项指标的喜好度,其中1为极不喜欢,2为相当不喜欢,3为一般不喜欢,4为有点不喜欢,5为既不喜欢也不讨厌,6为有点喜欢,7为一般喜欢,8为相当喜欢,9为极喜欢。
1.3.11 数据处理
每组实验进行3次平行测试,结果表示为平均值±标准偏差。使用GraphPad Prism8和Adobe Photoshop CC 2018进行数据分析。
2 结果与分析
2.1 发酵核桃乳的基本指标
发酵核桃乳在1∶5(g∶mL)料水比下,添加60 U/mL的脂肪酶,37 ℃水解3 h,巴氏杀菌后接种CCFM683,发酵20 h左右,此时pH达到(4.45±0.02)左右,活菌数约为(8.96±0.03) lg CFU/mL,共轭脂肪酸含量最高达到(1.33±0.05) mg/mL,其中共轭亚油酸(conjugated linoleic acid,CLA)约(0.79±0.06) mg/mL,而共轭亚麻酸(conjugated linolenic acid,CLNA)约(0.54±0.04) mg/mL。
2.2 乳化剂和增稠剂的复配和筛选
2.2.1 单体乳化剂和增稠剂的筛选
发酵核桃乳是热力学不稳定的乳状液体系,易在贮藏过程中变得不稳定,添加乳化剂和增稠剂是解决其稳定性的有效方法。以乳化稳定系数和离心沉淀率为指标,研究了果胶、黄原胶、结冷胶、羧甲基纤维素钠(carboxymethyl cellulose,CMC)、蔗糖酯在不同添加量时,发酵核桃乳的稳定性。结果如图1所示。
与果胶、结冷胶及CMC相比,添加黄原胶和蔗糖酯作为稳定剂时,发酵核桃乳的乳化稳定系数较低,而且离心沉淀率明显偏高,说明黄原胶和蔗糖酯对发酵核桃乳的稳定作用一般。
在添加果胶时,乳化稳定系数随着添加量的增加,呈现先上升后下降的趋势。当添加量(质量分数,下同)为0.02%~0.06%时,乳化稳定系数不断增加,超过0.06%稳定性开始下降。CMC添加量对于体系稳定性影响不大,添加量为0.6%时乳化稳定系数最高达到0.91,离心沉淀率相对较低。结冷胶添加量为0.02%时,离心沉淀率为9.05%,乳化稳定系数达到0.93。稳定性随着添加量的增加而下降,添加量为0.1%时趋于平稳。

a-果胶;b-黄原胶;c-结冷胶;d-CMC;e-蔗糖酯
图1 不同添加量的添加剂对产品乳化稳定系数和离心沉淀率的影响
Fig.1 Effects of additives concentration on emulsification stability coefficient and centrifugal precipitation rate of products
离心沉淀率越高,说明分散体系中易于团聚的颗粒越多,体系越不稳定。果胶添加量为0.06%时,离心沉淀率最小,而添加0.02%的结冷胶时,离心沉淀率最小,CMC添加量为0.45%和0.6%时离心沉淀率均较低。
综合乳化稳定系数和离心沉淀率的实验结果,单体乳化剂果胶、结冷胶和CMC分别在添加量为0.06%、0.02%和0.6%时,对于发酵核桃乳体系的稳定效果较好。
2.2.2 正交试验确定最佳复配比
根据上述添加剂的单因素试验结果,选择对发酵核桃乳体系稳定效果较好的果胶、结冷胶和CMC,设计3因素3水平的正交试验,试验因素及水平见表1,正交试验设计及结果见表2。
表1 试验因素及水平
Table 1 Experimental factors and levels
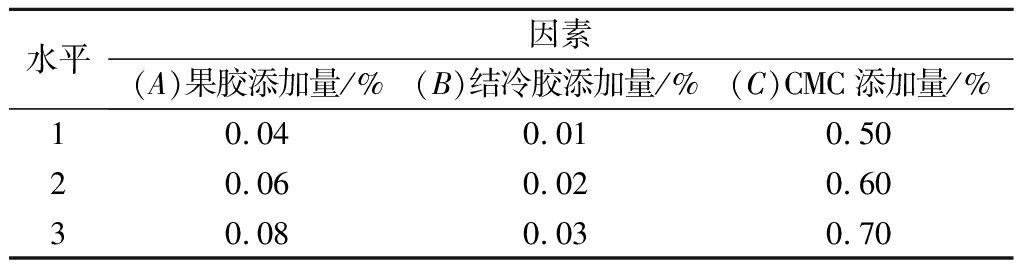
水平因素(A)果胶添加量/%(B)结冷胶添加量/%(C)CMC添加量/%10.040.010.5020.060.020.6030.080.030.70
正交试验结果分析见表3。乳化稳定系数和离心沉淀率的极差值均为RC>RB>RA,表明3个因素主次顺序为CMC添加量>结冷胶添加量>果胶添加量。由KA1>KA3>KA2,KB2>KB1>KB3,KC2>KC1>KC3可知,稳定性条件最佳组合是A1B2C2,即CMC、果胶、结冷胶添加量为0.6%、0.04%、0.02%。经验证试验,A2B2C2组合下R和离心沉淀率分别是以前的1.13倍和0.91倍,说明此优化条件下发酵核桃乳的稳定性较好。
表2 正交试验设计及结果
Table 2 Design and results of orthogonal test
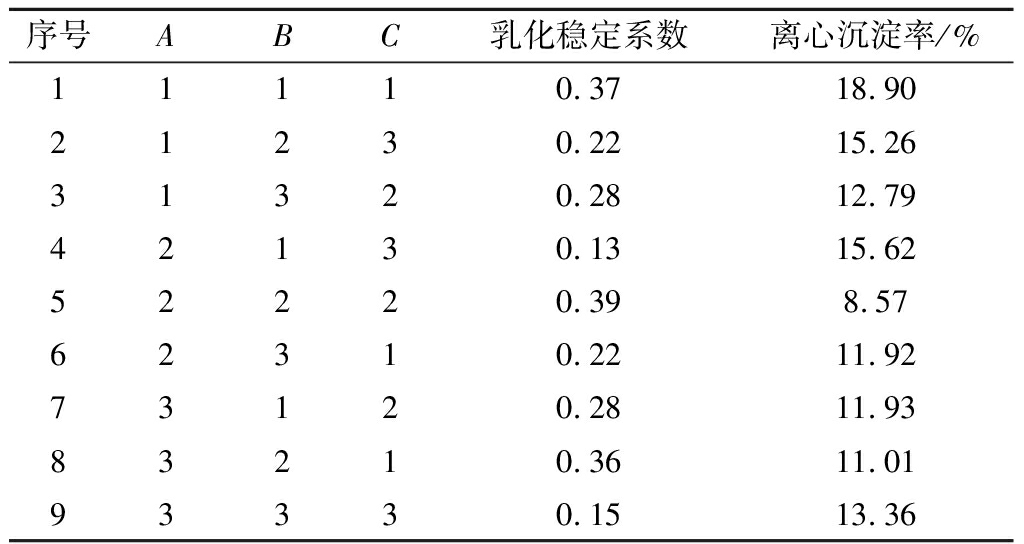
序号ABC乳化稳定系数离心沉淀率/%11110.3718.9021230.2215.2631320.2812.7942130.1315.6252220.398.5762310.2211.9273120.2811.9383210.3611.0193330.1513.36
表3 正交试验结果分析
Table 3 Analysis of the orthogonal test results

序号乳化稳定系数离心沉淀率/%ABCABCK10.870.780.9546.9541.8346.45K20.740.970.9536.1133.2934.84K30.790.650.5036.3044.2438.07K10.290.260.3215.6513.9415.48K20.250.320.3212.0411.1011.61K30.260.220.1712.1014.7512.69R0.040.100.153.613.653.87
2.3 抗氧化剂的筛选
抗氧化剂能抑制自由基氧化反应,传统的合成抗氧化剂如叔丁基对苯二酚、二丁基羟基甲苯和叔丁基对羟基茴香醚等本身可能具有潜在毒性,因此,为保证食用安全,选择低毒无害的天然抗氧化剂。
以发酵核桃乳为原料,分别添加不同质量分数的维生素C、维生素E、茶多酚和D-异抗坏血酸钠,通过比较挥发性风味物质及其脂肪酸组成,分析发酵核桃乳在贮藏过程中的风味品质变化。实验采用固相微萃取法测定产品的挥发性风味,脂肪酸甲酯化后通过GC-MS定性检测分析,结果见表4和表5。
表4 添加抗氧化剂的发酵核桃乳存储半个月后的挥发性风味物质的含量
Table 4 Content of volatile flavor substance in fermented walnut milk with the antioxidants after storage for half a month
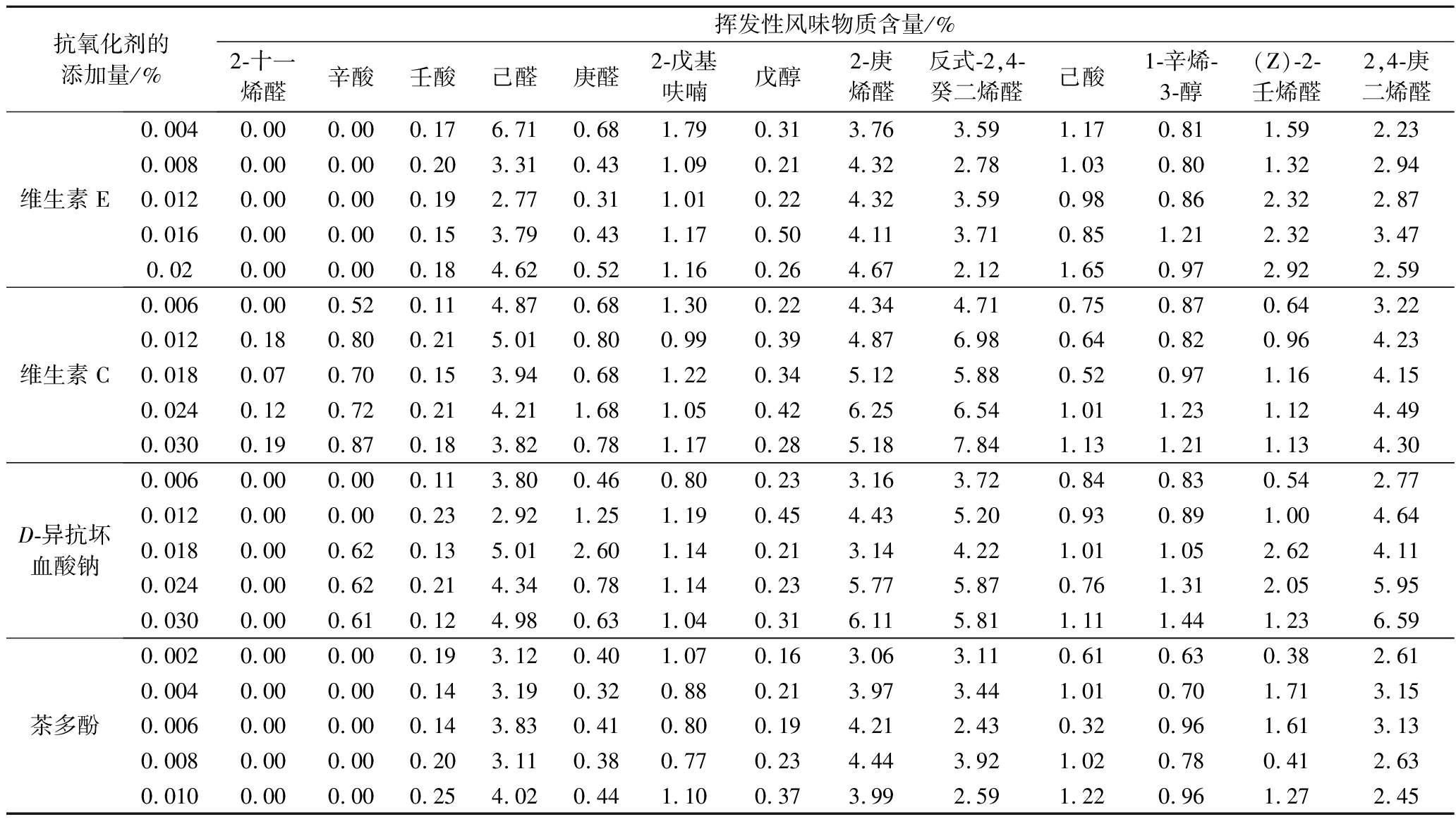
抗氧化剂的添加量/%挥发性风味物质含量/%2-十一烯醛辛酸壬酸己醛庚醛2-戊基呋喃戊醇2-庚烯醛反式-2,4-癸二烯醛己酸1-辛烯-3-醇(Z)-2-壬烯醛2,4-庚二烯醛维生素E0.0040.000.000.176.710.681.790.313.763.591.170.811.592.230.0080.000.000.203.310.431.090.214.322.781.030.801.322.940.0120.000.000.192.770.311.010.224.323.590.980.862.322.870.0160.000.000.153.790.431.170.504.113.710.851.212.323.470.020.000.000.184.620.521.160.264.672.121.650.972.922.59维生素C0.0060.000.520.114.870.681.300.224.344.710.750.870.643.220.0120.180.800.215.010.800.990.394.876.980.640.820.964.230.0180.070.700.153.940.681.220.345.125.880.520.971.164.150.0240.120.720.214.211.681.050.426.256.541.011.231.124.490.0300.190.870.183.820.781.170.285.187.841.131.211.134.30D-异抗坏血酸钠0.0060.000.000.113.800.460.800.233.163.720.840.830.542.770.0120.000.000.232.921.251.190.454.435.200.930.891.004.640.0180.000.620.135.012.601.140.213.144.221.011.052.624.110.0240.000.620.214.340.781.140.235.775.870.761.312.055.950.0300.000.610.124.980.631.040.316.115.811.111.441.236.59茶多酚0.0020.000.000.193.120.401.070.163.063.110.610.630.382.610.0040.000.000.143.190.320.880.213.973.441.010.701.713.150.0060.000.000.143.830.410.800.194.212.430.320.961.613.130.0080.000.000.203.110.380.770.234.443.921.020.780.412.630.0100.000.000.254.020.441.100.373.992.591.220.961.272.45
表5 添加抗氧化剂的发酵核桃乳存储1个月后的挥发性风味物质的含量
Table 5 Content of volatile flavor substance in fermented walnut milk with the antioxidants after storage for one month

抗氧化剂的添加量/%挥发性风味物质含量/%2-十一烯醛辛酸壬酸己醛庚醛2-戊基呋喃戊醇2-庚烯醛反式-2,4-癸二烯醛己酸1-辛烯-3-醇(Z)-2-壬烯醛2,4-庚二烯醛维生素E0.0040.000.000.1617.050.802.470.474.053.142.721.352.782.180.0080.000.000.1715.340.552.590.284.713.012.071.652.812.630.0120.000.000.1713.920.422.490.384.763.041.801.683.202.960.0160.000.000.2013.590.502.270.294.603.491.591.512.653.300.020.000.000.2016.220.642.890.365.032.642.731.563.242.41维生素C0.0060.170.650.1719.810.773.510.394.814.962.771.403.332.910.0120.150.760.2519.860.973.610.285.217.122.771.663.343.790.0180.220.970.2417.790.823.210.395.345.771.621.713.254.030.0240.220.950.2518.361.873.200.476.556.872.431.883.003.890.0300.241.100.2317.850.893.520.295.958.022.371.783.004.01D-异抗坏血酸钠0.0060.140.400.1817.700.592.680.394.723.342.531.552.862.900.0120.160.750.3116.331.453.230.484.864.772.991.784.003.710.0180.170.880.1917.372.782.910.234.214.091.981.993.983.600.0240.210.940.3117.870.873.250.486.215.782.311.903.584.870.0300.210.830.2118.250.763.280.396.575.882.641.932.465.41
续表5
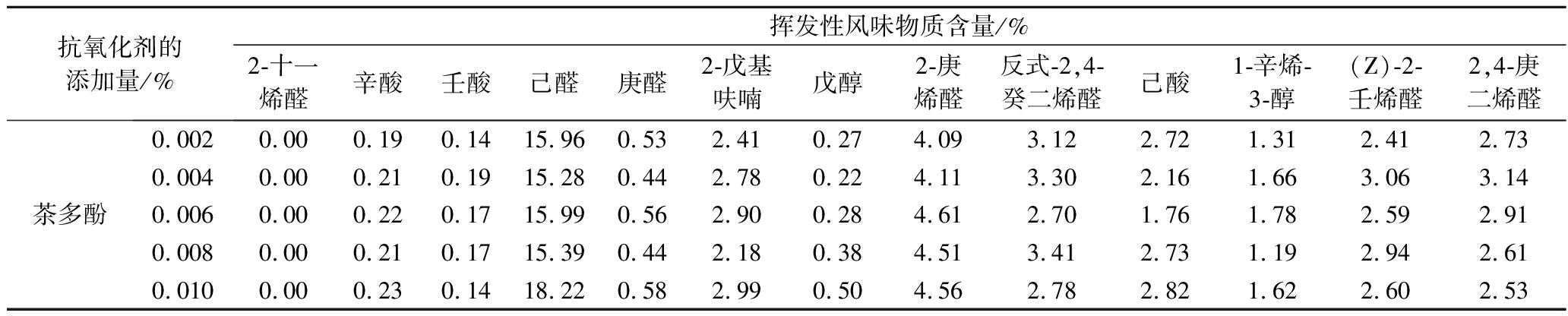
抗氧化剂的添加量/%挥发性风味物质含量/%2-十一烯醛辛酸壬酸己醛庚醛2-戊基呋喃戊醇2-庚烯醛反式-2,4-癸二烯醛己酸1-辛烯-3-醇(Z)-2-壬烯醛2,4-庚二烯醛茶多酚0.0020.000.190.1415.960.532.410.274.093.122.721.312.412.730.0040.000.210.1915.280.442.780.224.113.302.161.663.063.140.0060.000.220.1715.990.562.900.284.612.701.761.782.592.910.0080.000.210.1715.390.442.180.384.513.412.731.192.942.610.0100.000.230.1418.220.582.990.504.562.782.821.622.602.53
实验发现,发酵核桃乳的主要挥发性物质有醛酮类、醇类、酯类、有机酸类、呋喃和烷烃类,其中醛酮类21种,有机酸类8种,烷烃类7种,醇类6种,酯类3种,呋喃类2种,其他类风味物质10种。由于核桃中的脂肪酸主要是亚油酸、油酸和亚麻酸,且有研究表明亚油酸氧化产生的挥发性产物主要包括己醛、庚醛、2-庚烯醛、2-戊基呋喃、己酸等,油酸氧化产生的主要物质有2-十一烯醛、辛酸、壬酸等,而亚麻酸氧化后的挥发性产物主要有2,4-庚二烯醛[20]。结合GC-MS结果,选取2-十一烯醛和辛酸等13种物质来评价不同抗氧化剂对发酵核桃乳风味物质的影响。
分析发酵核桃乳的关键挥发性成分,发现在储存初期主要包括乙酸、1-己醇、乙醇、己醛和己酸等。添加维生素C、维生素E、茶多酚和D-异抗坏血酸钠,发酵核桃乳储存半个月后氧化产生的关键挥发性成分,主要包括2-十一烯醛、辛酸、壬酸、己醛、庚醛、2-戊基呋喃、2,4-癸二烯醛、己酸、1-辛烯-3-醇、和2,4-庚二烯醛等,对产品的风味影响较大。储存1个月后,油酸、亚油酸和亚麻酸氧化产生的关键挥发性成分含量基本都有不同程度的提高,己醛含量增加最为显著,辛酸、2-戊基呋喃、2-庚烯醛、己酸和2-壬烯醛含量增加也较明显,而2,4-癸二烯醛和2,4-庚二烯醛则部分呈现下降趋势。
与维生素C和D-异抗坏血酸钠相比,添加维生素E和茶多酚可抑制2-十一烯醛和辛酸的产生,即抑制油酸的氧化。其中,维生素E添加量为0.016%(质量分数)时,己醛含量增幅最小约为9.8%,2-戊基呋喃含量增幅为1.1%左右,己酸和2-壬烯醛含量增幅也均为最小。因此,维生素E在添加量为0.016%时对发酵核桃乳的抗氧化效果最好。添加茶多酚时,不同添加量时己醛含量增幅均超过12%,己酸和戊醇在添加量为0.004%时增幅最小(分别为1.15%和0.01%),2-戊基呋喃在0.002%的添加量时增幅最小(为1.34%),2-庚烯醛和2-壬烯醛的含量在0.004%的添加量时增幅也较小(分别为0.14%和1.35%)。因此,茶多酚在添加量为0.004%时,对发酵核桃乳的抗氧化效果最好。分析发酵核桃乳中脂肪酸含量变化,发现亚油酸明显增加,亚麻酸含量变化不明显,甚至有下降趋势,而维生素E和茶多酚作用后的油酸含量变化不明显,与挥发性风味物质的实验结果基本一致。综合来看,最终选择维生素E作为发酵核桃乳的抗氧化剂。
综上,维生素E可以有效抑制发酵核桃乳饮料的脂肪氧化和风味劣变,其最佳抗氧化添加量为0.016%(质量分数),该方法处理的发酵核桃乳饮料的脂肪氧化问题有明显改善。
2.4 发酵核桃乳的产品配方及喜好度评价
根据前文研究结果制备发酵核桃乳,并添加果胶(0.04%)、结冷胶(0.02%)和CMC(0.6%)作为稳定剂,以及维生素E(0.016%)作为抗氧化剂。在此基础上,通过产品喜好度评价,确定核桃香精以及白砂糖添加量,以获得发酵风味以及感官评价良好的发酵核桃乳产品。评定员分别从表观喜好度、气味喜好度、滋味喜好度和质地喜好度进行综合评分(图2)。
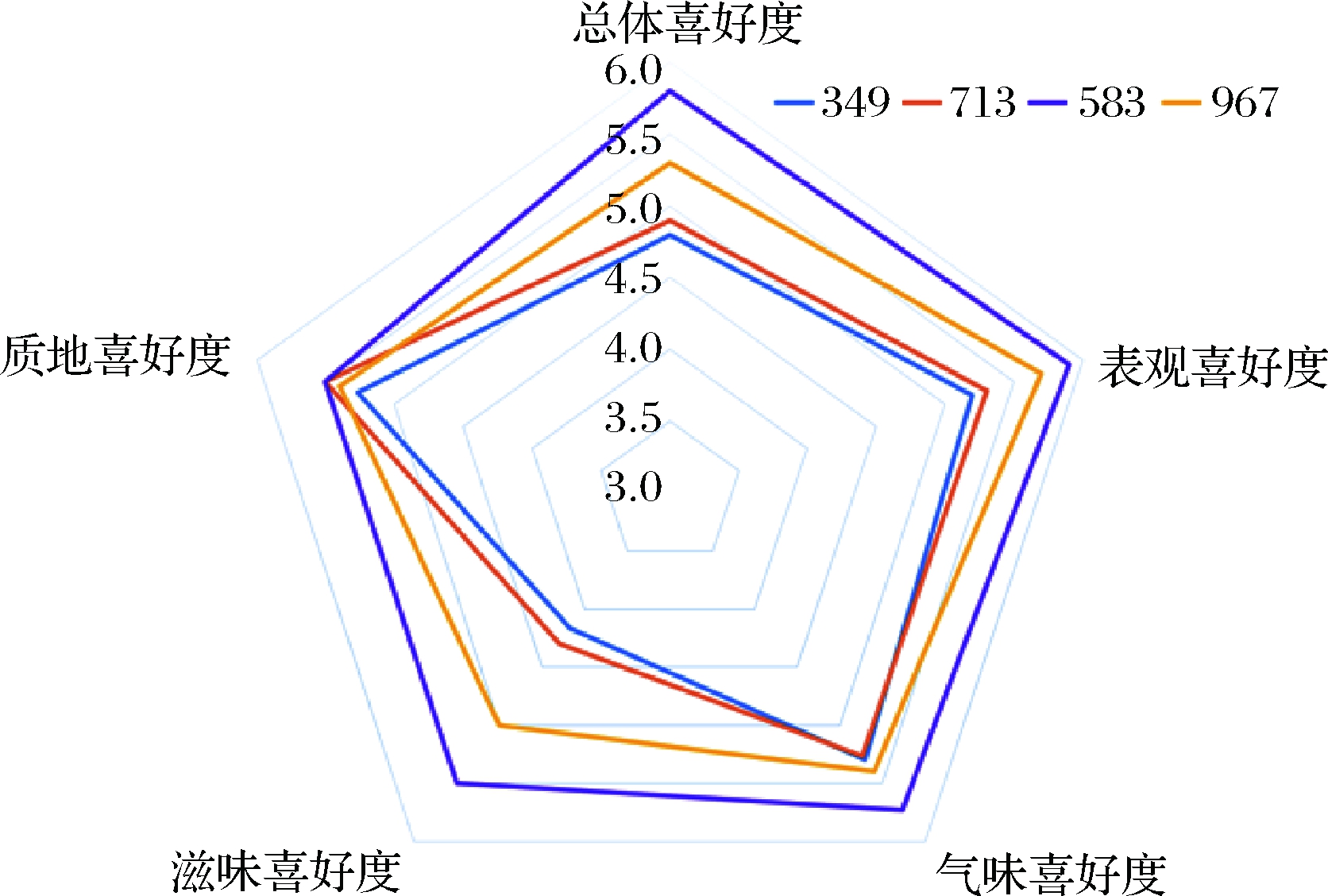
图2 不同核桃香精及白砂糖添加量的发酵 核桃乳的喜好度评价
Fig.2 Preference evaluation of fermented walnut milk with different walnut flavorant and sugar content
如图2所示,在80 mL发酵核桃乳中添加不同比例核桃香精及白砂糖,编号为583的发酵核桃乳样品,较其他组样品而言,整体喜好度得分更高。在表观喜好度和滋味喜好度方面,编号583即添加75 μL的核桃香精和10%(质量分数)白砂糖的产品评分最高,其次是添加100 μL的核桃香精和10%白砂糖的编号967、添加75 μL的核桃香精和8%白砂糖的编号713和添加100 μL的核桃香精和8%白砂糖的编号349;在气味喜好度方面,编号为583的产品整体较高,其次是编号967,而349和713的评分基本相同;在质地喜好度方面,编号为583和713的产品评分更高,其次是编号967和349。结合4个感官属性,添加75 μL的核桃香精和10%白砂糖的发酵核桃乳的总体喜好度最高,达到5.8分,此时的产品呈灰白色,质地均匀,酸甜可口,兼具核桃香味和发酵风味,其余3组产品的整体喜好评分也达到5左右,说明评定员对发酵产品的满意度较好。
3 结论
发酵核桃乳的稳定性和脂肪氧化是本研究要解决的关键问题,主要从添加乳化稳定剂、增稠剂以及抗氧化剂方面着手,最终结果如下:
(1)添加食品乳化剂和增稠剂是改善发酵核桃乳稳定性的有效方法。添加0.04%的果胶、0.02%的结冷胶和0.6%的CMC,发酵核桃乳的稳定性最好,此时乳化稳定系数为0.44,离心沉淀率7.80%。
(2)食品级抗氧化剂可以有效抑制发酵核桃乳饮料的脂肪氧化和风味劣变。添加0.016%的维生素E时抗氧化效果最好。
(3)料水比1∶5(g∶mL)的发酵基料中加入60 U/mL的脂肪酶,37 ℃水解3 h后巴氏灭菌,将菌株的初始接种量控制在107CFU/mL左右,37 ℃发酵20 h后,加入0.04%的果胶、0.02%的结冷胶、0.6%的CMC以及0.016%的维生素E进行调配,添加75 μL的核桃香精和10%白砂糖后,将pH值调整至4.1~4.2,再经过灭菌后的发酵核桃乳色泽均匀一致,质地均匀,无分层沉淀现象,酸甜可口,兼具核桃香味和发酵风味,整体喜好度评价得分5.8。
[1] YANG B,CHEN H Q,GAO H,et al.Bifidobacterium breve CCFM683 could ameliorate DSS-induced colitis in mice primarily via conjugated linoleic acid production and gut microbiota modulation[J].Journal of Functional Foods,2018,49(6):61-72.
[2] YANG B,QI H,GU Z,et al.Characterization of the triple-component linoleic acid isomerase in Lactobacillus plantarum ZS2058 by genetic manipulation[J].Journal of Applied Microbiology,2017,123(5):1 263-1 273.
[3] KISHINO S,TAKEUCHI M,PARK S B,et al.Polyunsaturated fatty acid saturation by gut lactic acid bacteria affecting host lipid composition[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(44):17 808-17 813.
[4] 胡明明, 潘开林,牛跃庭,等.植物蛋白饮料稳定性及其分析方法研究进展[J].食品工业科技,2018,39(6):334-339;344.
HU M M,PAN K L,NIU Y T,et al.Research progress on stability and stability analysis method for plant protein beverage[J].Science and Technology of Food Industry,2018,39(6):334-339;344.
[5] 吴金鋆. 复合全豆植物蛋白饮料的稳定性及流变特性研究[D].广州:华南理工大学,2010.
WU J Y.Study on the stability and rheological properties of compound whole-seed protein beverage[D].Guangzhou:South China University of Technology,2010.
[6] LAU D S Y,ARCHER M C.The 10t,12c isomer of conjugated linoleic acid inhibits fatty acid synthase expression and enzyme activity in human breast,colon,and prostate cancer cells[J].Nutrition and Cancer,2010,62(1):116-121.
[7] YANG B,CHEN H Q,STANTON C,et al.Review of the roles of conjugated linoleic acid in health and disease[J].Journal of Functional Foods,2015,15:314-325.
[8] OLSON J M,HAAS A W,LOR J,et al.A comparison of the anti-inflammatory effects of cis-9,trans-11 conjugated linoleic acid to celecoxib in the collagen-induced arthritis model[J].Lipids,2017,52(2):151-159.
[9] BURANASOMPOB A,TANG J,POWERS J R,et al.Lipoxygenase activity in walnuts and almonds[J].LWT-Food Science and Technology,2007,40(5):893-899.
[10] GAO H,YANG B,STANTON C,et al.Characteristics of bifidobacterial conjugated fatty acid and hydroxy fatty acid production and its potential application in fermented milk[J].LWT-Food Science and Technology,2020,120:108940.
[11] 李露露. 糖醇在核桃乳中的应用研究[D].无锡:江南大学,2017.
LI L L.Study on the application of sugar alcohols in walnut milk[D].Wuxi:Jiangnan University,2017.
[12] 宋佳宝. 高浓度发酵核桃乳的工艺研究[D].石家庄:河北科技大学,2020.
SONG J B.Study on Technology of walnut milk by high density fermentation[D].Shijiazhuang:Hebei University of Science and Technology,2020.
[13] 徐新德, 王恪玲,张强,等.分光光度法测定纯牛乳乳化稳定性的研究[J].中国乳业,2003(9):35-36.
XU X D,WANG K L,ZHANG Q,et al.Study on determination of emulsification stability of pure cow milk by spectrophotometry[J].China Dairy,2003(9):35-36.
[14] 黄迪宇. 青稞酒糟饮料的制备及稳定性研究[D].无锡:江南大学,2017.
HUANG D Y.Studies on the preparation and stability of highland barley draff beverage[D].Wuxi:Jiangnan University,2017.
[15] 耿明雪, 刘小鸣,赵建新,等.基于组学及感官评价的酸奶风味研究[J].食品与发酵工业,2018,44(7):250-257.
GENG M X,LIU X M,ZHAO J X,et al.Investigate the flavor characteristics of yogurt through metabolomics and sensory evaluation[J].Food and Fermentation Industries,2018,44(7):250-257.
[16] FOLCH J,LEES M,STANLEY G H S.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Biological Chemistry,1957,226(1):497-509.
[17] VOLKOV A,LIAVONCHANKA A,KAMNEVA O,et al.Myosin cross-reactive antigen of Streptococcus pyogenes M49 encodes a fatty acid double bond hydratase that plays a role in oleic acid detoxification and bacterial virulence[J].Journal of Biological Chemistry,2010,285(14):10 353-10 361.
[18] SCHWENKE D C,RUDEL L L,SORIC-THOMAS M G,et al.α-Tocopherol protects against diet induced atherosclerosis in New Zealand white rabbits[J].Journal of Lipid Research,2002,43(11):1 927-1 938.
[19] 丛懿洁, 马蕊,李银塔.原味酸奶的感官属性分析及模糊数学评价[J].中国乳品工业,2020,48(12):53-58.
CONG Y J,MA R,LI Y T.Fuzzy mathematical evaluation and sensory attributes analysis of plain yogurt[J].China Dairy Industry,2020,48(12):53-58.
[20] 何金鑫. 山核桃氧化过程中挥发性产物和品质变化的研究[D].合肥:安徽农业大学,2017.
HE J X.Study on the change of volatile components and quality in the process of oxidation of hickory[D].Hefei:Anhui Agricultural University,2017.