蜂王浆是从工蜂(Apis mellifera)的下颌和下咽腺分泌的一种乳脂状物质。它是所有蜜蜂幼虫在生命前3 d的食物;然后,工蜂们转向食用主要由蜂蜜和花粉组成的蜂粮,而蜂王终身食用蜂王浆[1-3]。蜂王浆已被应用于医疗产品、健康营养品、化妆品和商业用途。从蜂王浆中分离出的各种生物活性物质,如蛋白质、肽、脂肪酸和酚类化合物,都可用于药物研究和产品开发。蜂王浆具有抗微生物、抗氧化剂、促进伤口愈合、抗衰老、抗癌、抗炎、抗高血压、抗高血脂,还具有雌激素、神经营养作用、免疫调节功能特性[4]。但是,目前国内外关于蜂王浆对免疫功能调节作用的研究较少。本实验通过分析蜂王浆对环磷酰胺致免疫功能低下小鼠的体重、脏器指数及形态、细胞因子、白细胞计数、免疫球蛋白含量、T/B淋巴细胞增殖能力、睾酮等指标的影响,探究其免疫调节作用。着力为开发蜂产品的保健应用提供新思路,为拓宽特色蜂产品的商业用途提供理论依据的同时促进农村经济发展,符合国家当前产业结构调整及提高农民收入的政策,有利于蜂产品市场的开发。
1 材料与方法
1.1 材料与仪器
48只6~8 周龄健康 SPF 级雄性KM小鼠(37~46 g),北京维通利华实验动物技术有限公司,进行适应性喂养 3 d后用于实验,实验动物饲养于无菌环境,温度控制在20~22 ℃;酪蛋白、0.4%台盼蓝染色液和0.33%中性红染色液,北京索莱宝生物技术有限公司;胎牛血清(fetal bovine serum,FBS)和RPMI—1640 培养基,Hyclon 公司;胰酶、青霉素/链霉素、红细胞裂解液和CCK-8,碧云天生物技术研究所;脂多糖 (lipopolysaccharide,LPS)、刀豆蛋白、(Con-A)、[3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑溴盐, MTT],Sigma Aldrich 公司;IgG ELISA Kit、IgM ELISA Kit、IL-2 ELISA Kit、IL-4 ELISA Kit,北京百智生物科技有限公司;小鼠睾酮ELISA试剂盒,南京森倍伽生物科技。
BD C6 流式细胞仪,美国 Thermofisher 公司;CKX-4 倒置相差显微镜,日本奥里巴斯有限公司;Spectra MR 多功能酶标仪,美国 Dynex 公司;血液分析仪,济南汉方医疗器械有限公司。
1.2 实验方法
1.2.1 实验分组及受试样品给予
48只昆明小鼠适应性饲养3 d后,称其体重作为初始体重,随机分为空白组、酪蛋白组0.25 g/(kg·bw)、环磷酰胺(cyclophosphamide,CTX)模型组、蜂王浆低剂量组1.25 g/(kg·bw)、蜂王浆中剂量组2.5 g/(kg·bw)、蜂王浆高剂量组5.0 g/(kg·bw),共计6组,每组8只[5]。所有小鼠每日定时灌胃,蜂王浆组给予1.25、2.5、5 g/(kg·bw)蜂王浆灌胃,空白组和环磷酰胺组每日灌胃相同体积的生理盐水,酪蛋白组则依照0.25 g/(kg·bw)剂量的酪蛋白进行灌胃,连续灌胃30 d[6]。在灌胃第27天时,除空白组外,其余各组则通过连续3 d腹腔注射80 mg/(kg·bw)的环磷酰胺构建免疫低下小鼠模型,空白组注射相同体积的生理盐水。连续灌胃30 d后断食不断水,次日检测各项指标[7]。
1.2.2 检测指标
1.2.2.1 体重变化
适应性喂养3 d后,随机进行分组并记录初始体重,并且在处死前再次称量体重,记为终末体重[8]。
1.2.2.2 免疫脏器指数
对每组动物进行摘眼球取血后断颈处死,取胸腺和脾脏,称重,脏器质量(mg)/终末体重(g)即得脾脏指数和胸腺指数[8]。
1.2.2.3 脾脏和肝脏形态学观察
用甲醛固定液将分离到的脾脏和肝脏进行固定、包埋、切片、染色,镜检,采集图像,对脾脏和肝脏组织进行形态学分析。
1.2.2.4 外周血白细胞计数
对每组动物进行摘眼球取血时,取适量全血于 EDTA 抗凝管中,充分混匀,用血液分析仪对白细胞进行计数[7]。
1.2.2.5 外周血免疫球蛋白含量测定
取血于2 mL离心管中,4 ℃静置过夜,低温冷冻离心10 min,转速3 000 r/min,制得血清,取50 μL 血清,使用酶联免疫试剂盒检测血清中 IgG 和 IgM 的含量。
1.2.2.6 血清中细胞因子水平测定
另取200 μL血清,使用酶联免疫试剂盒检测血清中IL-4、IL-6的含量[9]。
1.2.2.7 小鼠脾淋巴细胞增殖能力的检测
参考文献[10]的方法制备脾细胞悬液,用完全培养基调整脾细胞浓度至 5×106个/mL,轻轻吹打使细胞悬液均质,吸取90 μL上述浓度均质后的脾细胞悬液至96孔培养板中,每个样本做6个重复,再以相同顺序向样品孔中分别添加10 μL ConA/LPS(3个ConA孔,3个LPS孔),所有样品孔加完之后将培养板放置在37 ℃、5% CO2培养箱中培养72 h,取出96孔板,每孔添加10 μL CCK-8,继续孵育2 h,使用酶标仪检测490 nm处的OD值,空白组为灌胃生理盐水小鼠淋巴细胞,淋巴细胞的增殖能力通过刺激指数(stimulation index,SI)评估[10]:
(1)
1.2.2.8 睾酮含量测定
另取50 μL血清,使用酶联免疫试剂盒检测血清中睾酮的含量[11]。
1.3 实验方法
实验数据采用 origin 9.4 进行统计学分析,通过均值±标准误差![]() 来表示,利用单因素方差分析进行组间比较,t检验进行两两比较,P<0.05 表示具有显著差异。
来表示,利用单因素方差分析进行组间比较,t检验进行两两比较,P<0.05 表示具有显著差异。
2 结果与讨论
2.1 体重变化
从表1来看,6个组间小鼠的初末体重均无统计学差异(P>0.05),灌胃期结束后,5个造模组小鼠体重与空白组相比体重增长量均降低,但差异不显著(P>0.05)。与模型组相比,蜂王浆各个剂量组体重增加量均不显著(P>0.05)。
表1 蜂王浆对免疫抑制小鼠体重的影响 单位:g
Table 1 Effect of royal jelly on body weight of immunocompromised mice

组别初始体重终末体重增重空白组42.67±0.9747.18±0.894.52±0.93酪蛋白组43.30±0.5945.52±1.322.21±1.15环磷酰胺模型组41.87±0.2845.29±1.033.42±1.22蜂王浆低剂量组42.77±0.2445.93±1.063.17±0.96蜂王浆中剂量组43.48±0.7545.32±1.381.84±1.09蜂王浆高剂量组41.97±0.6044.03±1.782.06±1.49
2.2 免疫脏器指数
如图1、2所示,对比空白组,模型组2项脏器指数显著下降(P<0.05),相比模型组,酪蛋白阳性对照组胸腺指数和脾脏指数出现了上升趋势,蜂王浆各剂量组的胸腺指数和脾脏指数也存在升高的趋势,但差异并不显著(P>0.05)。
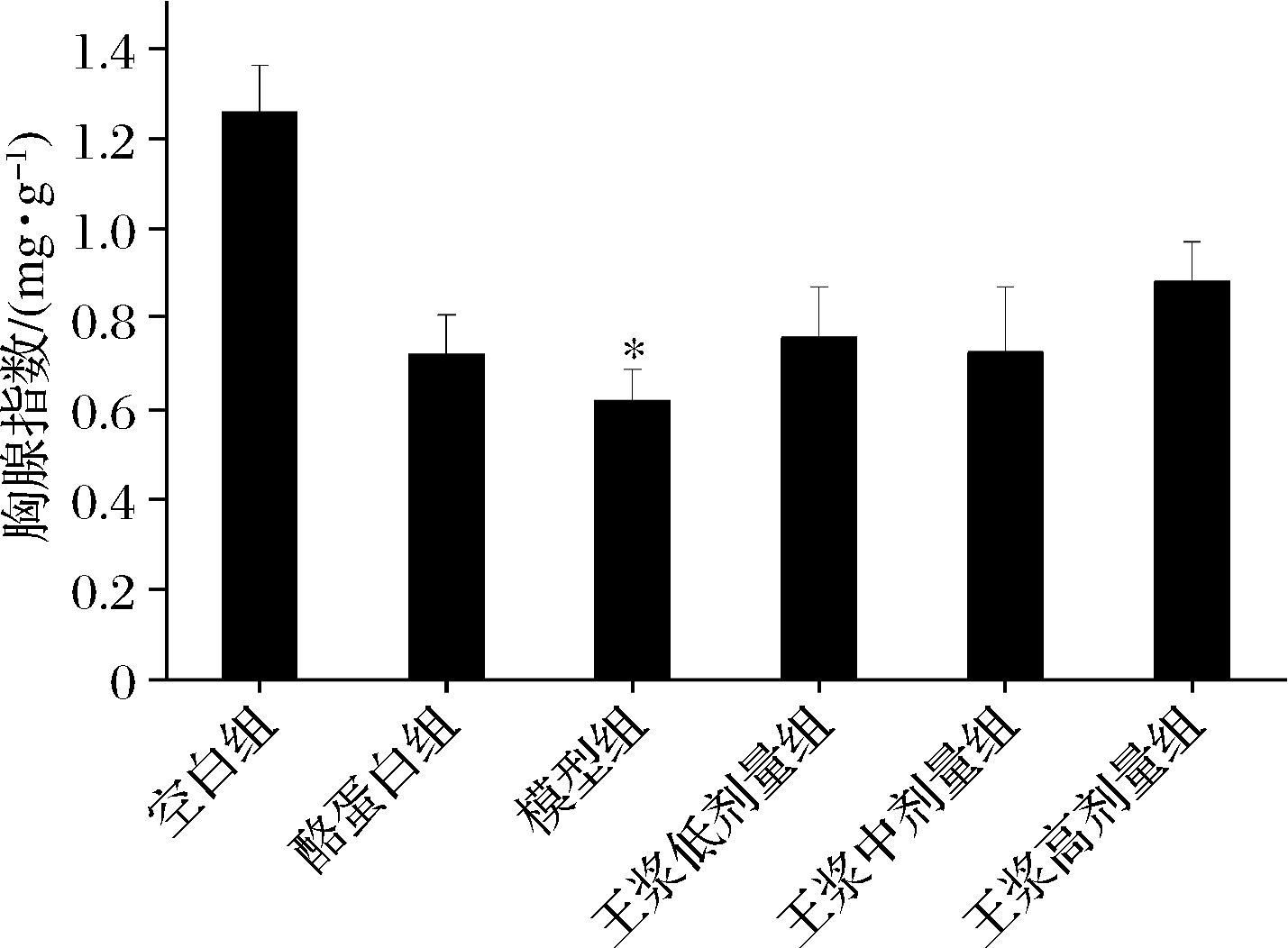
图1 小鼠胸腺指数
Fig.1 Mice thymus index 注:* P<0.05,与空白组比(下同)
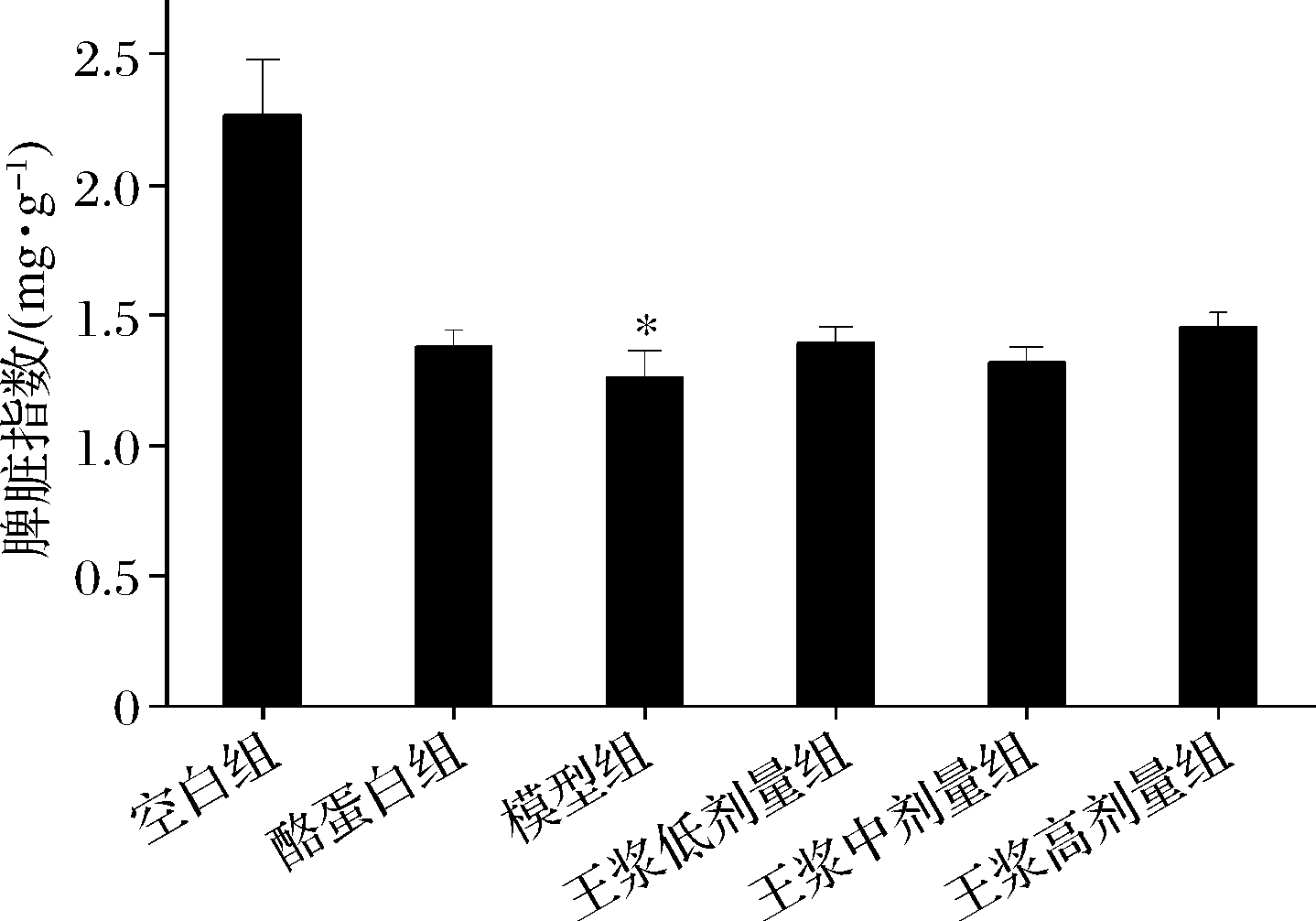
图2 小鼠脾脏指数
Fig.2 Mice spleen index
2.3 脾脏和肝脏形态学观察
脾脏 HE 染色切片如图3所示,空白组小鼠的脾脏组织形态规则完整,白髓、红髓正常,边界明晰,脾小结发育正常。环磷酰胺模型组脾脏组织中白髓和红髓界限不明确,脾小结存在严重破损现象,脾脏存在肿大现象。与环磷酰胺模型组相比,酪蛋白阳性对照组脾脏结构并无明显改观,蜂王浆中、高剂量组脾小结发育状况均有改善,结构完整清晰,蜂王浆中剂量组的结构形态得到很大程度的改善。
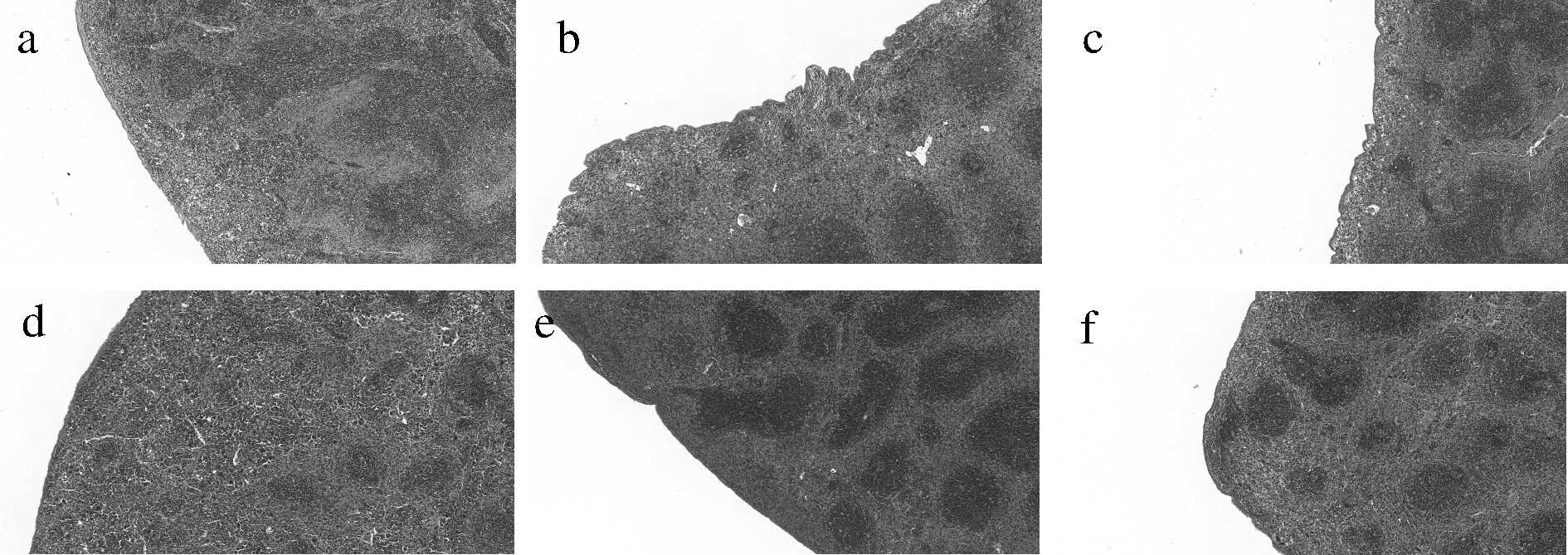
a-空白组;b-酪蛋白组;c-模型组;d-王浆低剂量组; e-王浆中剂量组;f-王浆高剂量组
图3 蜂王浆对免疫低下小鼠脾脏组织形态学 变化的影响(×5)
Fig.3 Effect of royal jelly on morphological changes in spleen tissue of immunocompromised mice
肝脏 HE 染色切片如图4所示,由小鼠的肝切片可见,空白组小鼠肝组织结构完整,汇管区无炎性细胞浸润,肝细胞状态正常。环磷酰胺模型组和酪蛋白阳性对照组中,肝细胞坏死情况较严重,肝索排列混乱无规则,存在炎性细胞浸润等现象。蜂王浆中、高剂量组较环磷酰胺模型组肝组织结构得到很大程度的改善。
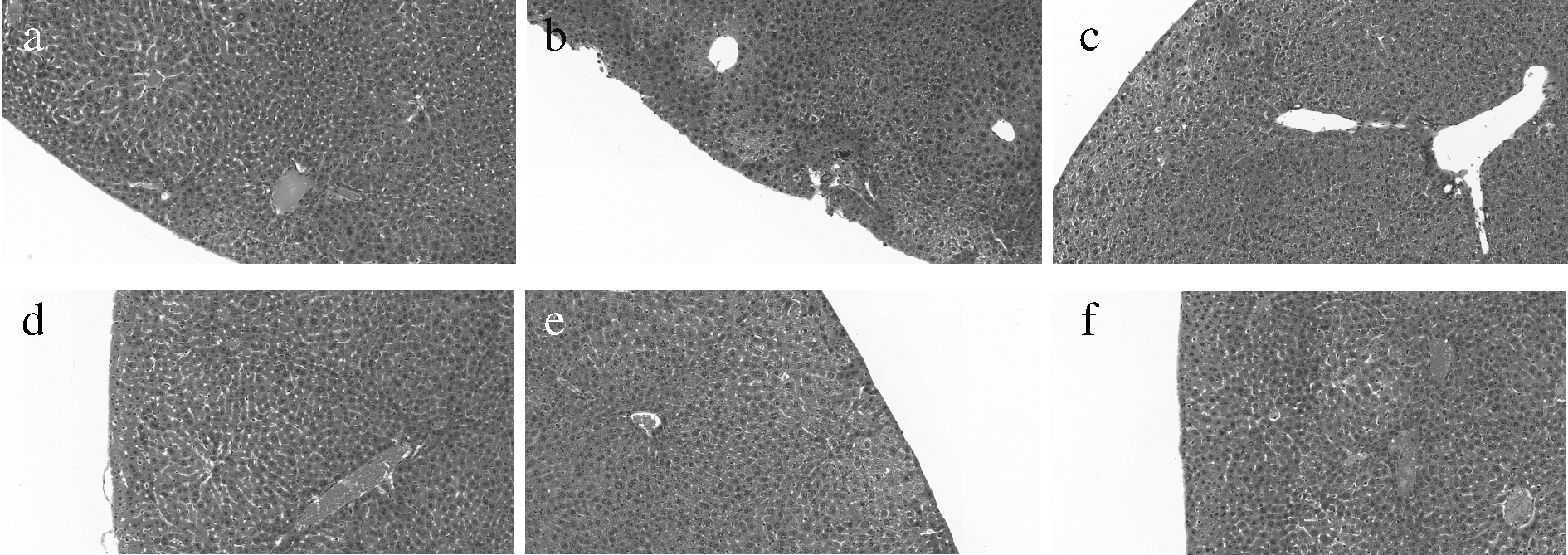
a-空白组;b-酪蛋白组;c-模型组;d-王浆低剂量组; e-王浆中剂量组;f-王浆高剂量组
图4 蜂王浆对免疫低下小鼠肝脏组织形态学 变化的影响(×10)
Fig.4 Effect of royal jelly on morphological changes in liver tissue of immunocompromised mice
2.4 外周血白细胞计数
如图5所示,与空白组相比,环磷酰胺模型组小鼠全血白细胞计数呈现显著减少趋势(P<0.05);与环磷酰胺模型组相比,酪蛋白阳性对照组白细胞含量基本无差异;蜂王浆灌胃后,各剂量组白细胞数量逐渐恢复至较高水平;与环磷酰胺模型组相比,蜂王浆中剂量组白细胞计数呈现显著上升趋势(P<0.05),且基本上恢复至空白组白细胞含量水平。
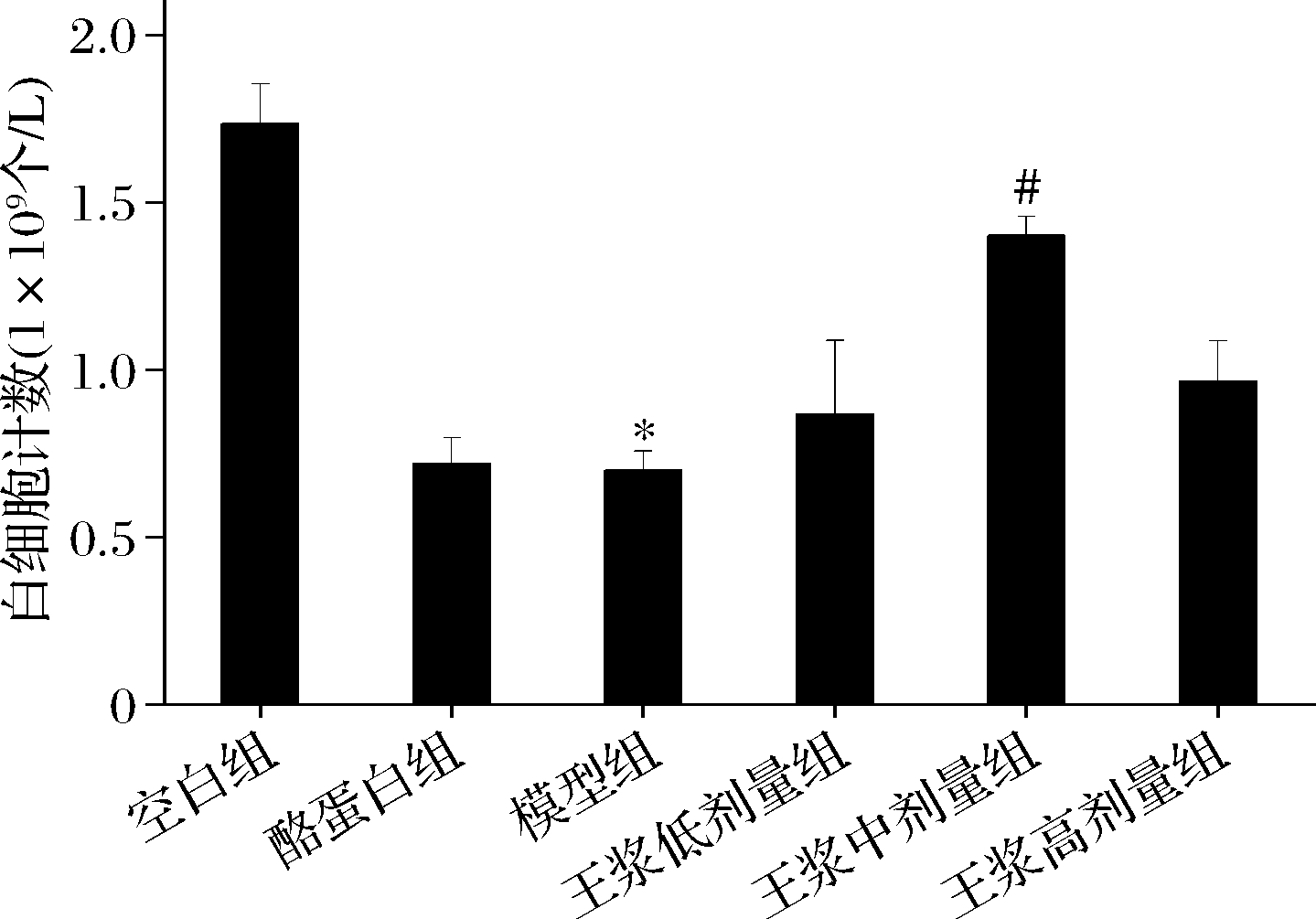
图5 小鼠外周血白细胞计数
Fig.5 White blood cell count of mice 注:#P<0.05,与模型组比(下同)
2.5 血清免疫球蛋白含量测定
如图6、7所示,与空白组相比,环磷酰胺模型组血清 IgG 和 IgM 质量浓度均呈显著下降趋势(P<0.05),酪蛋白阳性对照组血清 IgG 和 IgM 质量浓度较环磷酰胺模型组均有提高;蜂王浆中、高剂量组血清中的 IgG 和IgM水平较模型组有显著提高(P<0.05)。且蜂王浆中、高剂量组的血清IgG、IgM水平均已超过空白组。
2.6 血清中细胞因子水平测定
如图8所示,小鼠腹腔注射环磷酰胺后,小鼠血清中IL-4水平组间无显著性差异。如图9所示,与空白组相比,环磷酰胺模型组血清IL-6水平显著降低(P<0.05),说明免疫低下模型构建成功。与环磷酰胺模型组比较,酪蛋白阳性对照组血清IL-6水平呈上升趋势;经蜂王浆干预后,中、高剂量组IL-6显著升高(P<0.05),高剂量组对血清IL-6水平升高效果优于中剂量组。
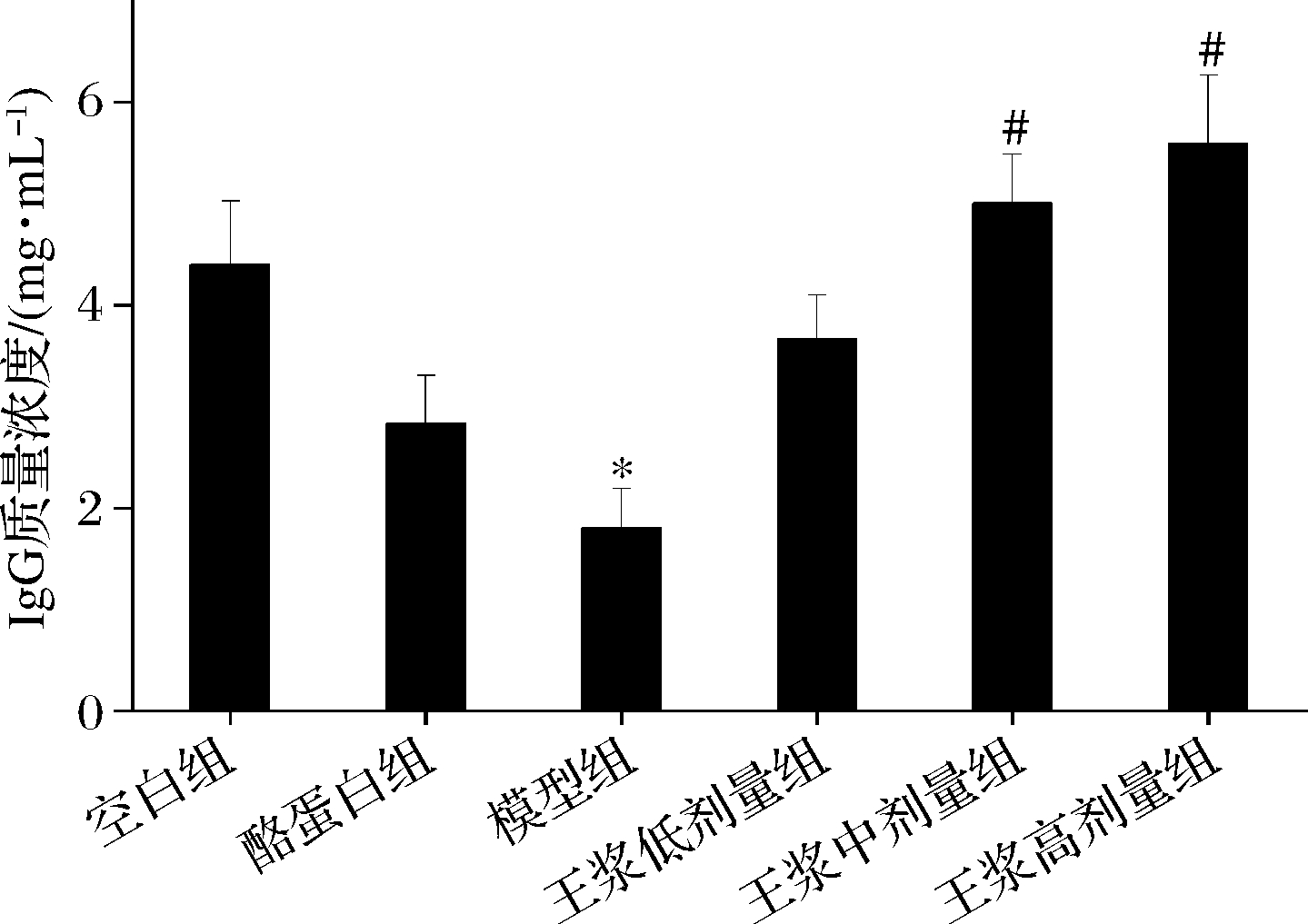
图6 小鼠血清IgG水平
Fig.6 Mice serum IgG level
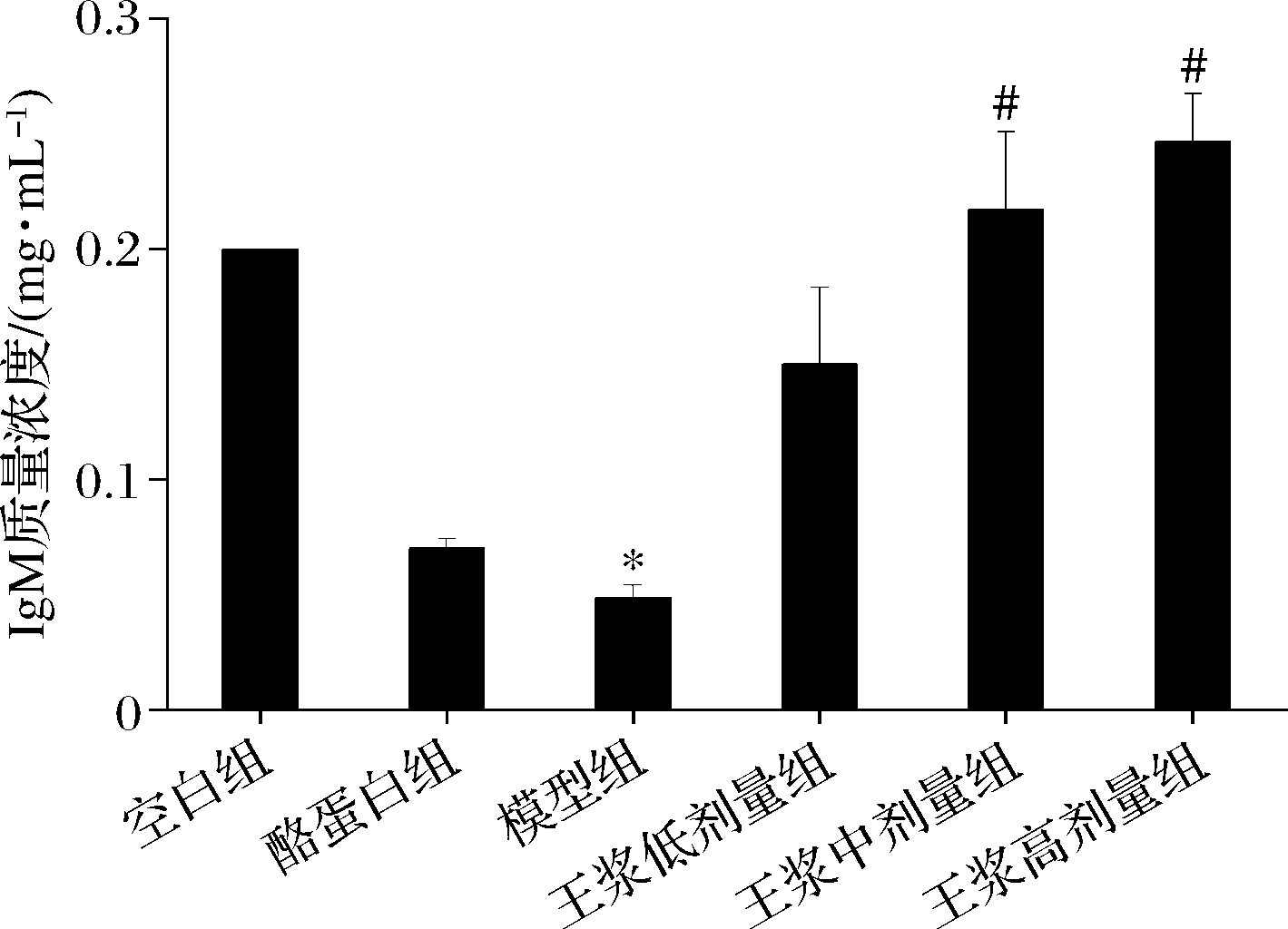
图7 小鼠血清IgM水平
Fig.7 Mice serum IgM level
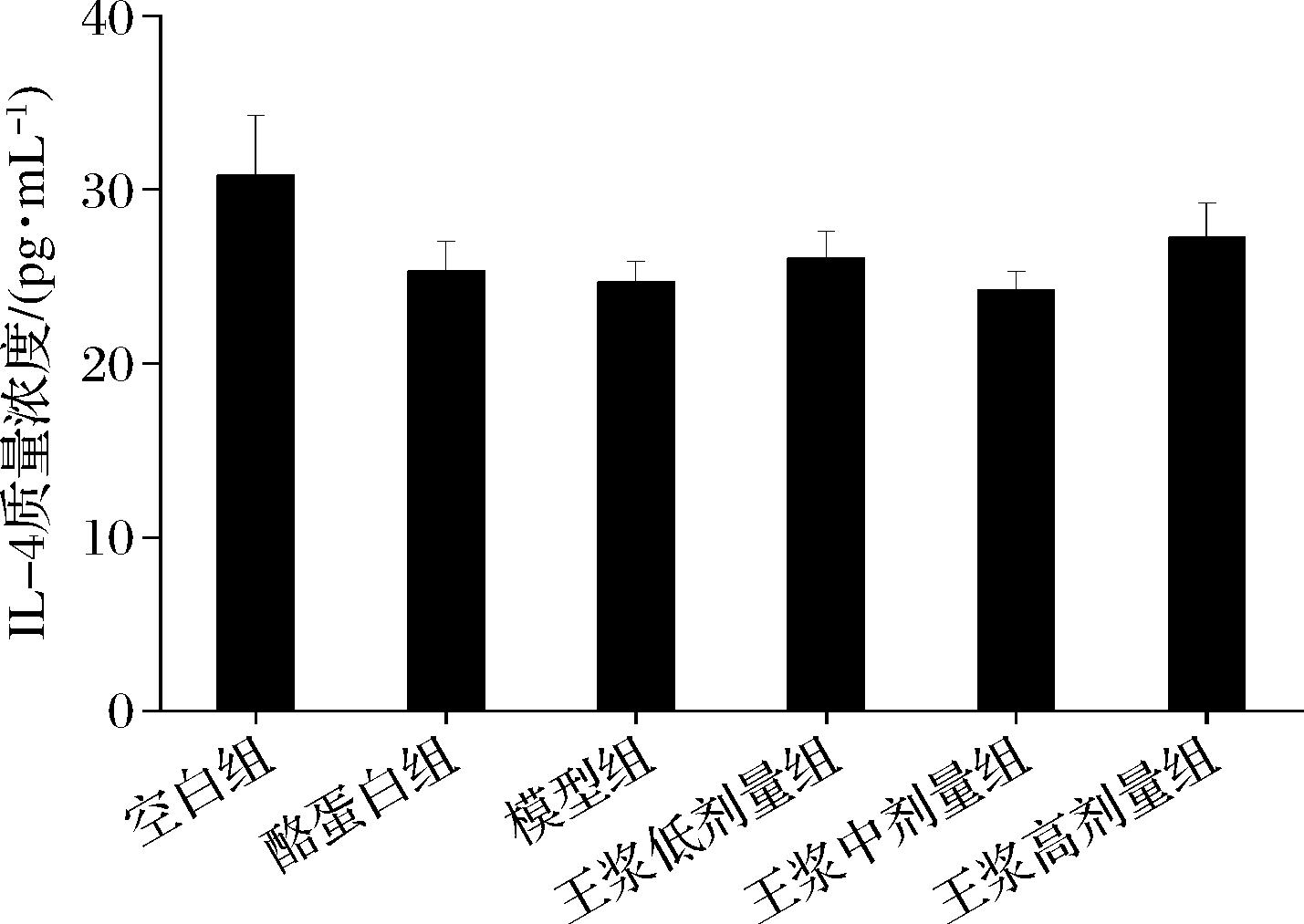
图8 小鼠血清IL-4水平
Fig.8 Mice serum IL-4 level
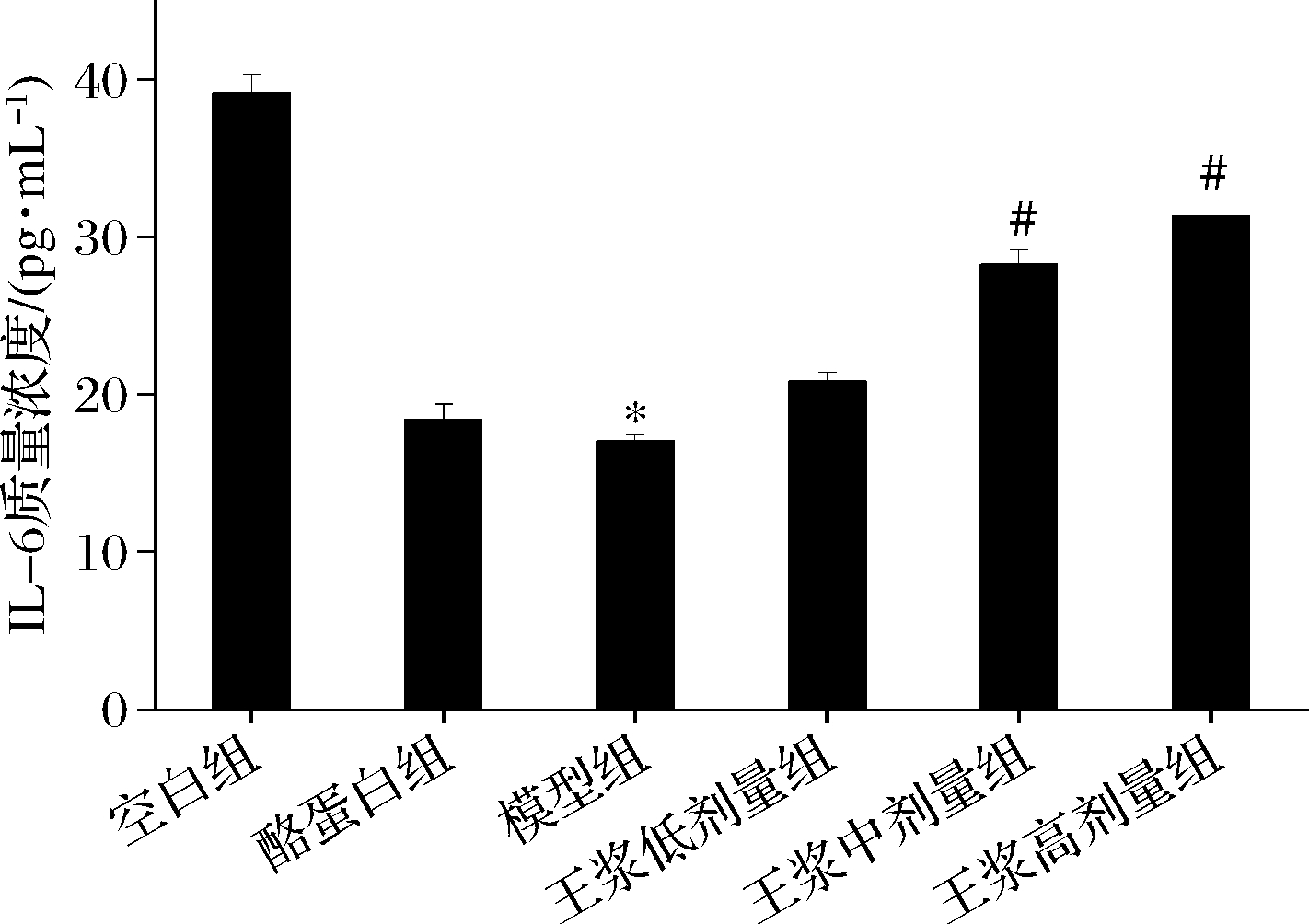
图9 小鼠血清IL-6水平
Fig.9 Mice serum IL-6 level
2.7 小鼠脾淋巴细胞增殖能力的检测
如图10所示,对比空白组,环磷酰胺模型组T淋巴细胞的增殖能力被明显抑制(P<0.05),这说明小鼠的特异性免疫功能受到影响,进一步说明造模成功。相较于环磷酰胺模型组,酪蛋白阳性对照组T淋巴细胞增殖能力有提高,但效果不显著;与环磷酰胺模型组相比,蜂王浆(中、高)剂量处理后的小鼠,其T淋巴细胞增殖能力显著增强(P<0.05)。
如图11所示,在本实验中,环磷酰胺模型组B淋巴细胞増殖显著低于空白组(P<0.05),说明通过注射环磷酰胺,小鼠的体液免疫功能受到严重损伤。酪蛋白阳性对照组与环磷酰胺模型组B淋巴细胞増殖能力差异不大;蜂王浆中、高剂量组B淋巴细胞增殖能力高于环磷酰胺模型组,其中中剂量组B淋巴细胞增殖能力具有显著提升(P<0.05)。综上可知,蜂王浆对于免疫抑制小鼠脾淋巴细胞增殖能力的促进作用较明显。
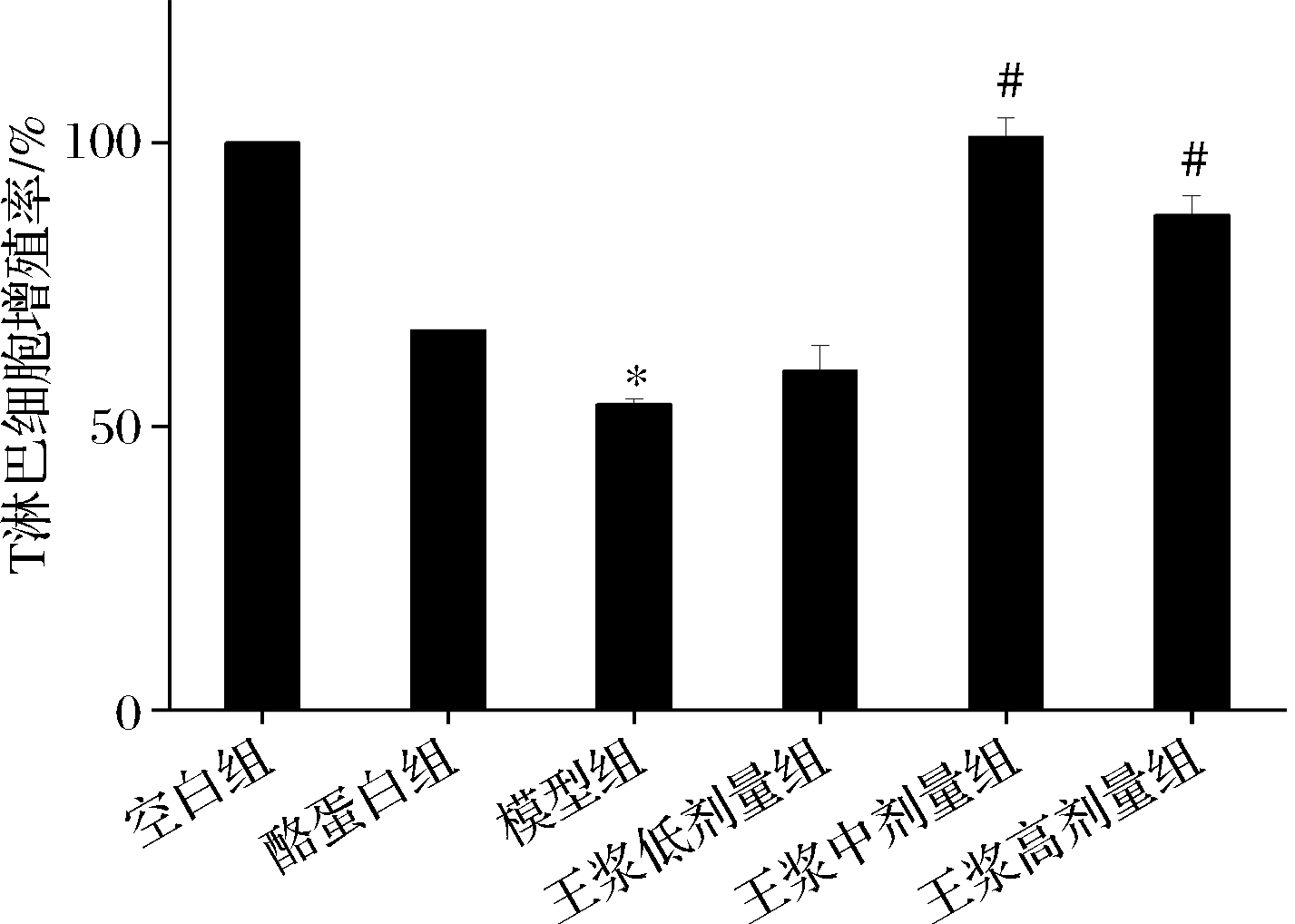
图10 T淋巴细胞增殖能力
Fig.10 T lymphocyte proliferation ability
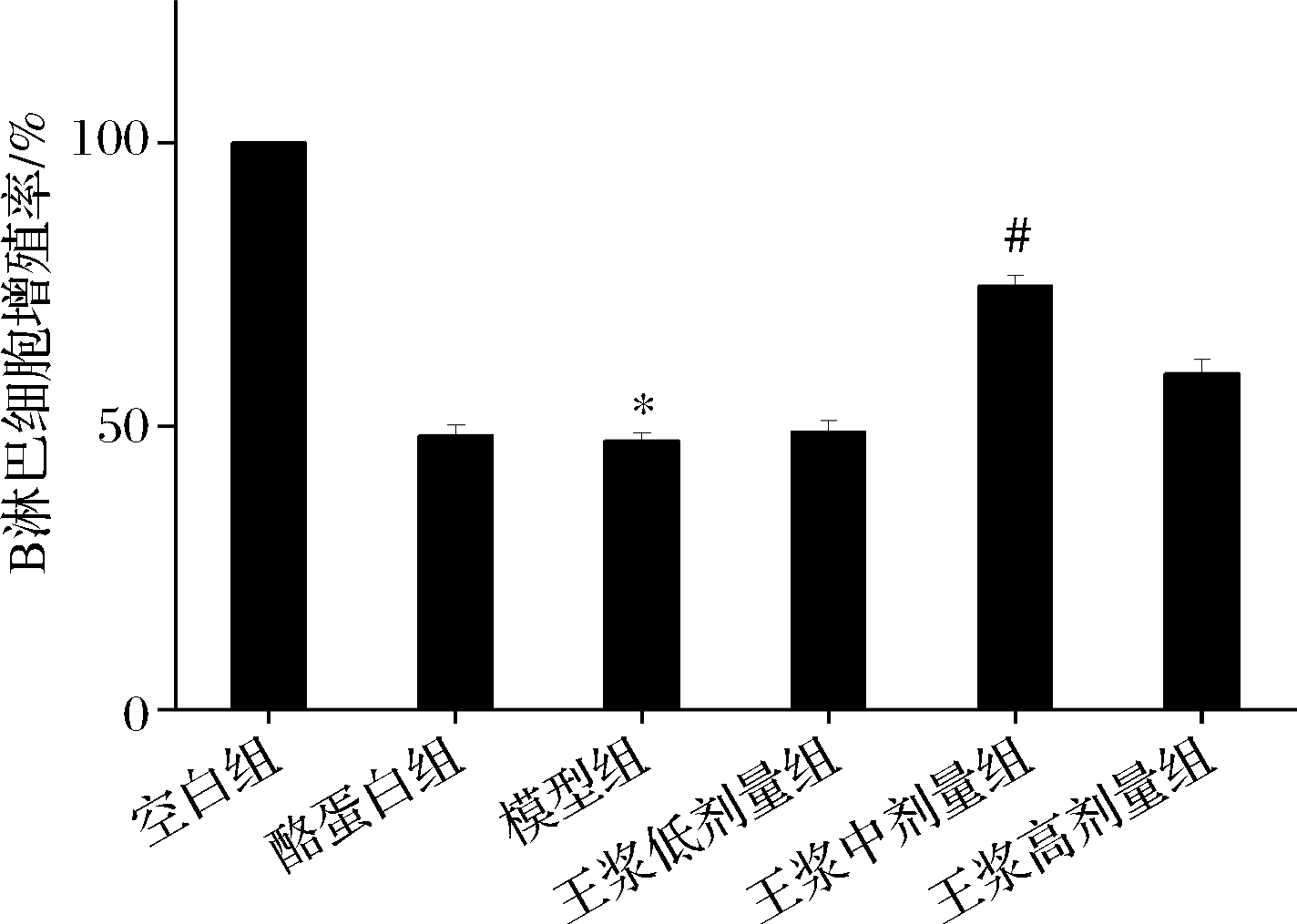
图11 B淋巴细胞增殖能力
Fig.11 B lymphocyte proliferation ability
2.8 睾酮含量测定
如图12所示,蜂王浆各个剂量组睾酮含量均低于空白组,但差异不显著;与环磷酰胺模型组相比,各剂量组血清睾酮水平无显著变化,提示通过膳食补充蜂王浆并不会对小鼠血清睾酮水平变化产生影响。
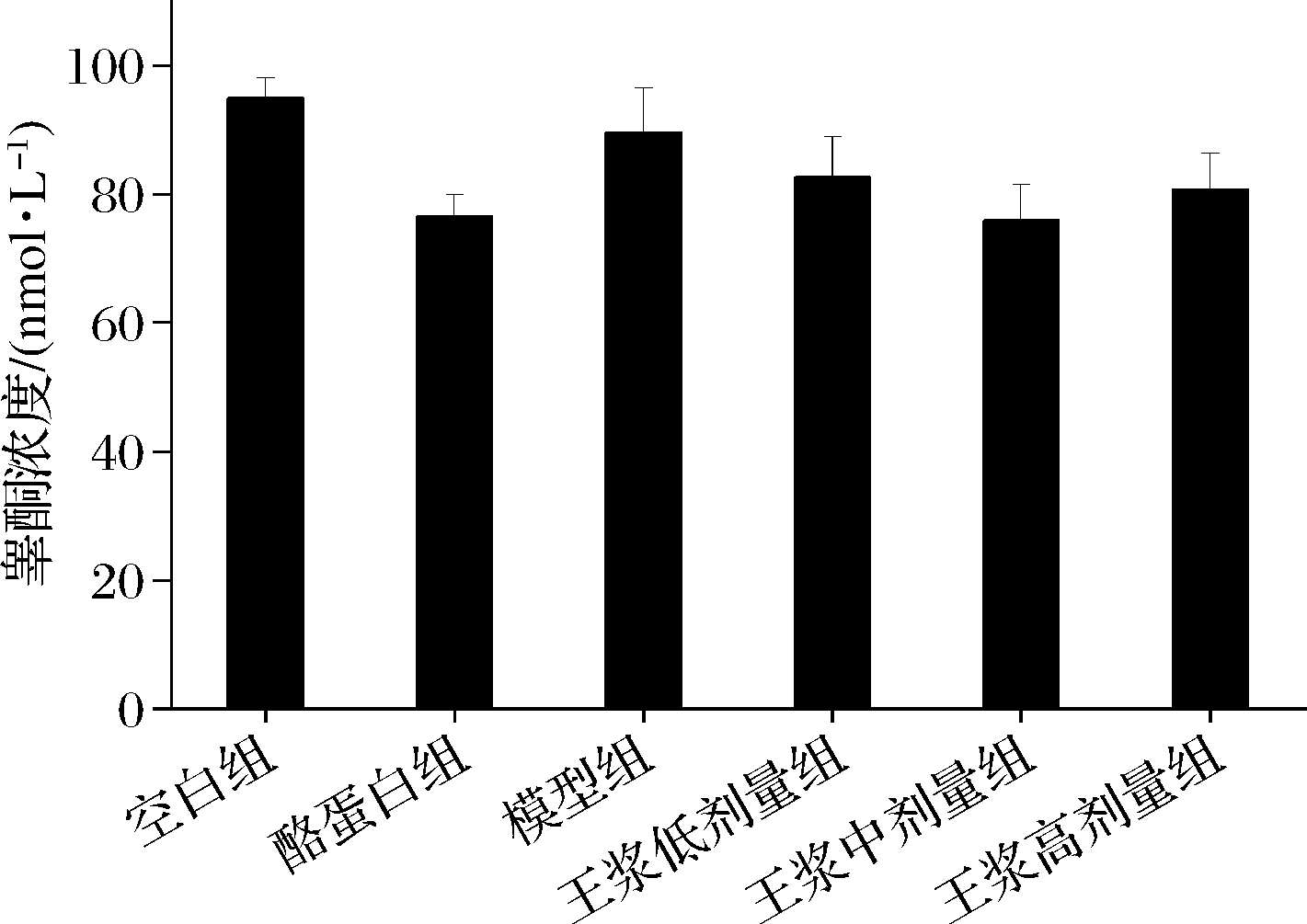
图12 血清中睾酮含量变化
Fig.12 Changes in serum testosterone levels
3 结论与讨论
蜂王浆是营养物质和生物活性化合物的丰富来源,在生物活性和药物应用中具有广泛的应用潜力。蛋白质、肽、脂质、酚类和类黄酮是影响蜂王浆各种药物特性的主要生物活性化合物[12]。
免疫调节反应具有激活抗体形成或抑制白细胞活性的功能,其在变态反应、癌症和炎症中起重要作用[13]。一项针对儿童的系统性红斑狼疮(systemic lupus erythematosus,SLE)的科学研究首次表明,蜂王浆给药3个月后,其症状显著改善[14]。蜂王浆的抗过敏因子可以抑制白细胞介素4(IL-4)的产生,IL-4是由CD3激活ovalbumin(OVA)/alum-immunized脾细胞诱导产生的。MRJP-3(70 kDa)糖蛋白抑制T细胞产生IL-4、IL-2和IFN-γ,从而抑制细胞增殖。腹腔注射MRJP-3发现在OVA/血清诱导的变态反应小鼠中抗OVA IgG1和IgE的血清免疫水平受到抑制,而可溶性MRJP-3经热处理后降低了抗原性,并维持了其对卵清蛋白抗体应答的抑制作用。体内和体外研究均表明MJRP-3具有很强的免疫调节活性[15]。此外,较低浓度的蜂王浆和3,10-HDA的水提取物通过触发刀豆蛋白A(Con-A)激活T细胞增殖并增强IL-2的产生,而较高浓度的蜂王浆水提取物、干燥蜂王浆粉末和trans-10-HDA通过降低IL-2和NO产生来抑制T细胞增殖。蜂王浆的水提取物具有复杂的生物活性和较强的免疫调节活性[16]。
众所周知,环磷酰胺是一种使用广泛的细胞毒性药物,普遍应用于肿瘤的治疗中,可对骨髓的功能产生抑制作用,使白细胞数量降低。环磷酰胺的代谢产物对细胞产生了很强的毒性作用,这一系列代谢产物通过交联作用使DNA和蛋白质烷基化。环磷酰胺可以通过抑制免疫器官的功能并造成体重下降,并且使得各种血细胞比例失衡,从而产生免疫功能的抑制[17]。
本实验先进行蜂王浆干预30 d,实验结束前3 d注射环磷酰胺,评价蜂王浆对免疫功能的调节作用。未注射环磷酰胺的小鼠作为空白组,考虑到蜂王浆干物质中含量最高的是蛋白质,故给予阳性对照组与蜂王浆中剂量组中蛋白相同剂量的酪蛋白以消除影响。
根据实验得出,各组小鼠体重增量均无显著差异,但造模后小鼠体重增量下降,免疫低下小鼠模型构建成功,这也说明选定剂量的环磷酰胺对小鼠具有较强的毒性[18]。
机体的免疫水平一定程度上受脾脏和胸腺的形态结构、功能状态的影响[18]。本实验中,环磷酰胺模型组小鼠的脾脏指数较空白组显著降低,病理检查提示存在脾脏损伤的情况;在蜂王浆不同剂量的干预下,脾脏指数和胸腺指数均出现了不同程度的改善。同时肝脏内免疫细胞含量较高,肝脏通过肝门静脉与脾脏相连,两者关系非常密切,脾损伤必然会导致肝损伤。与空白组相比,模型组小鼠的脾脏和肝脏HE切片观察可见发育状况差,形态结构不规则,而经蜂王浆干预后,小鼠的脾脏和肝脏组织结构逐渐改善。提示蜂王浆可在一定程度上对胸腺、脾脏、肝脏的发育具有促进作用以及还原修复的作用。
白细胞特有的吞噬功能使其在对抗病原体方面起着关键作用,因此,白细胞水平的下降会对免疫应答水平造成威胁,增加机体患病的概率[19]。从这个角度上讲,白细胞的含量在一定程度上也是机体免疫应答情况的反应。本实验观察到环磷酰胺造模后,小鼠外周血白细胞计数相比空白组均显著降低,在蜂王浆干预后出现改善。提示蜂王浆可以改善免疫低下小鼠的免疫功能。
IgG 在抗感染、免疫监视、吞噬并溶解靶细胞过程中发挥着重要作用,影响体液免疫水平;IgM 在初次免疫中占据重要地位,对于机体免疫防御意义重大,具有很强的抗感染作用。本研究中,模型组小鼠血清 IgG 和 IgM 含量有降低趋势,并在部分蜂王浆干预组中得到恢复。提示蜂王浆可能通过恢复 IgG 和 IgM 含量来增强机体的体液免疫。
细胞因子是由蛋白质或肽类组成,通过与相应受体结合来介导免疫应答反应[20]。环磷酰胺主要通过影响 Toll 样受体信号通路,活化 NF-κB通路,从而对机体产生毒性作用[21-22]。本实验中,相比空白组,模型组细胞因子IL-6浓度明显下降,经蜂王浆干预后,IL-6含量均升高并向空白组回归。提示蜂王浆可能通过影响细胞因子的分泌或影响相关通路而达到改善机体的免疫功能的作用。
T/B 淋巴细胞对于机体的细胞免疫和体液免疫至关重要,ConA和LPS分别诱导活化T/B 淋巴细胞,T/B 淋巴细胞的增殖活性影响着免疫应答水平的高低[23-24]。本实验中,模型组T/B淋巴细胞增值率比空白组明显降低,与模型组相比,给予蜂王浆处理能不同程度提升T/B淋巴细胞的增殖率,从而提升免疫水平。
观察到蜂王浆中剂量组小鼠外周血白细胞计数、T/B 淋巴细胞的增殖能力均高于蜂王浆低剂量、高剂量组,注意到相关研究中,蜂王浆对小鼠的巨噬细胞吞噬功能的作用也有类似的效应[25],其剂量分组与本实验相近,且其中3.06 g/kg的中剂量组的巨噬细胞吞噬指数高于1.53 g/kg的低剂量组和6.12 g/kg的高剂量组,这说明蜂王浆对免疫功能的恢复能力可能具有最佳剂量范围,剂量过低可能没有达到恢复免疫功能阈值的剂量,剂量过高则可能增加代谢负担。
通过注射环磷酰胺不仅可以产生免疫抑制,还可以引发生殖毒性,因此本实验对生殖功能相关指标进行了简单的检测。睾酮对于男性精子的生成和第二性征的形成起关键作用,血清中睾酮水平长期处于低位可对机体造成多种负面影响,如出现体重增加、肌肉质量降低、疲劳感加重、勃起功能障碍和性欲低下等症状[26]。本实验中,各个处理组之间睾酮水平均无统计学差异,提示蜂王浆可能对雄性小鼠体内睾酮水平恢复无显著影响。
本实验初步探究了蜂王浆对环磷酰胺致免疫低下小鼠的体重、免疫脏器指数、脾脏与肝脏组织形态结构、外周血白细胞数量、血清免疫球蛋白、细胞因子、脾淋巴细胞增殖能力、睾酮的影响,结果提示蜂王浆对环磷酰胺所致免疫低下小鼠的多项免疫功能均有较显著的改善作用,为蜂王浆的进一步开发利用提供了理论依据。
[1] YANG W C,TIAN Y Y,HAN M F,et al.Longevity extension of worker honey bees(Apis mellifera) by royal jelly:Optimal dose and active ingredient[J].PeerJ,2017,5:e3118.
[2] SHORTER J R,GEISZ M,ÖZSOY E,et al.The effects of royal jelly on fitness traits and gene expression in drosophila melanogaster[J].Plos One,2015,10(7):e0134612.
[3] KAYASHIMA Y,YAMANASHI K,SATO A,et al.Freeze-dried royal jelly maintains its developmental and physiological bioactivity in Drosophila melanogaster[J].Bioscience,Biotechnology,and Biochemistry,2012,76(11):2 107-2 111.
[4] 陈亚玲, 张晶.蜂王浆的研究进展[J].食品研究与开发,2015,36(2):148-152.
CHEN Y L,ZHANG J.The research progress of royal jelly[J].Food Research and Development,2015,36(2):148-152.
[5] WANG Z J,LI Y H,WANG C J,et al.Oral administration of Urtica macrorrhiza Hand.-Mazz.polysaccharides to protect against cyclophosphamide-induced intestinal immunosuppression[J].Experimental and Therapeutic Medicine,2019,18(3):2 178-2 186.
[6] MENG M,GUO M Z,FENG C C,et al.Water-soluble polysaccharides from Grifola Frondosa fruiting bodies protect against immunosuppression in cyclophosphamide-induced mice via JAK2/STAT3/SOCS signal transduction pathways[J].Food & Function,2019,10(8):4 998-5 007.
[7] 宋俊杰, 范军朝,王莹,等.山药多糖对环磷酰胺致小鼠脾脏损伤的保护作用[J].亚太传统医药,2019,15(2):15-17.
SONG J J,FAN J C,WANG Y,et al.The protective effect of Chinese yam polysaccharide on spleen injury in mice induced by cyclophosphamide[J].Asia-Pacific Traditional Medicine,2019,15(2):15-17.
[8] 邓旭坤, 段欢,刘钊,等.黄精多糖对环磷酰胺诱导小鼠免疫抑制的影响[J].中南民族大学学报(自然科学版),2018,37(2):49-53.
DENG X K,DUAN H,LIU Z,et al.Effects of Polygonatum sibiricum polysaccharide on immunosuppressive action induced by cyclophosphamide in mice[J].Journal of South-Central University for Nationalities(Natural Science Edition),2018,37(2):49-53.
[9] 叶欢颖. 霍山石斛对环磷酰胺所致小鼠肝脏和免疫系统损伤的保护作用研究[D].镇江:江苏大学,2019.
YE H Y.Protective effects of Dendrobium huorense on liver and immune system injury induced by cyclophosphamide in mice[D].Zhenjiang:Jiangsu University,2019.
[10] 朱艳,姜盛,李明亮,等.紫苏籽蛋白对免疫力低下小鼠免疫调节功能的研究[J].食品工业科技,2020,41(21):322-326;332.
ZHU Y,JIANG S,LI M L,et al.Study on immune regulation of Perilla frutescens seed protein in mice with low immunity[J].Science and Technology of Food Industry,2020,41(21):322-326;332.
[11] 陈博慧. 石斛多糖对环磷酰胺诱导雄鼠生殖损伤的影响[D].广州:暨南大学,2017.
CHEN B H.Effects of Dendrobium officinale polysaccharide on cyclophosphamide-induced reproductive damage in male mice[D].Guangzhou:Ji’nan University,2017.
[12] PAN Y M,XU J Q,JIN P,et al.Royal jelly ameliorates behavioral deficits,cholinergic system deficiency,and autonomic nervous dysfunction in ovariectomized cholesterol-fed rabbits[J].Molecules,2019,24(6):1 149.
[13] LABRO M T.Immunomodulatory effects of antimicrobial agents.Part I:Antibacterial and antiviral agents[J].Expert Review of Anti-Infective Therapy,2012,10(3):319-340.
[14] ZAHRAN A M,ELSAYH K I,SAAD K,et al.Effects of royal jelly supplementation on regulatory T cells in children with SLE[J].Food & Nutrition Research,2016,60(1):32 963.
[15] OKAMOTO I,TANIGUCHI Y,KUNIKATA T,et al.Major royal jelly protein 3 modulates immune responses in vitro and in vivo[J].Life Sciences,2003,73(16):2 029-2 045.
[16] GASIC S,VUCEVIC D,VASILIJIC S,et al.Evaluation of the immunomodulatory activities of royal jelly components in vitro[J].Immunopharmacology Immunotoxicology,2007,29(3-4):521-536.
[17] QI Q C,DONG Z H,SUN Y Y,et al.Protective effect of bergenin against cyclophosphamide-induced immunosuppression by immunomodulatory effect and antioxidation in balb/c mice[J].Molecules,2018,23(10):2 668.
[18] 冯立志, 何伟平,詹少锋,等.健脾补血方改善环磷酰胺诱导的小鼠骨髓及免疫抑制的机制研究[J].中药新药与临床药理,2019,30(8):904-909.
FENG L Z,HE W P,ZHAN S F,et al.Mechanism of Jianpi Buxue decoction on myelosuppression and immunosuppression induced by cyclophosphamide in mice[J].Traditional Chinese Drug Research and Clinical Pharmacology,2019,30(8):904-909.
[19] 王煜, 李芹,王玉海,等.金线莲液在改善环磷酰胺致免疫抑制小鼠免疫功能中的作用研究[J].医学理论与实践,2017,30(22):3 293-3 295;3 304.
WANG Y,LI Q,WANG Y H,et al.Study on effect of Anoectochilus roburghii on improving immune function in mice immunized by cyclophosphamide[J].The Journal of Medical Theory and Practice,2017,30(22):3 293-3 295;3 304.
[20] 胡婷, 彭丽萍,张琛晓.胸腺五肽联合化疗对多发性骨髓瘤患者外周血T淋巴细胞亚群的影响[J].中国当代医药,2018,25(5):74-76.
HU T,PENG L P,ZHANG C X.Effect of thymopentin combined with chemotherapy on T lymphocyte subsets in peripheral blood of patients with multipe myeloma[J].China Modern Medicine,2018,25(5):74-76.
[21] LOGANI M K,ALEKSEEV S,BHOPALE M K,et al.Effect of millimeter waves and cyclophosphamide on cytokine regulation[J].Immunopharmacology and Immunotoxicology,2012,34(1):107-112.
[22] 钟金凤, 方热军.环磷酰胺免疫抑制机制及在动物模型上的应用[J].中国免疫学杂志,2016,32(10):1 541-1 546.
ZHONG J F,FANG R J,Immunosuppressive mechanism of cyclophosphamide and its application in animal models[J].Chinese Journal of Immunology,2016,32(10):1 541-1 546.
[23] ZHANG J,CHEN J,WANG D Y,et al.Immune-enhancing activity comparison of sulfated ophiopogonpolysaccharide and sulfated jujube polysaccharide[J].International Journal of Biological Macromolecules,2013,52:212-217.
[24] 伍芳芳. 猴头菇多糖的结构表征、免疫调节活性及其机理研究[D].广州:华南理工大学,2018.
WU F F.Structural characterization,immunomodulatory activities and underlying mechanism of Hericium erinaceus polysaccharide[D].Guangzhou:South China University of Technology,2018.
[25] 杨青, 石璐,于晨,等.蜂王浆对环磷酰胺所致免疫低下小鼠免疫功能的影响[J].时珍国医国药,2011,22(4):840-842.
YANG Q,SHI L,YU C,et al.Effects of royal jelly on immunologic function of low immune mice caused by cyclophosphamide[J].Lishizhen Medicine and Materia Medica Research,2011,22(4):840-842.
[26] 曾鹏. 左卡尼汀对环磷酰胺致大鼠睾丸损伤的保护作用及机制研究[D].昆明:昆明医科大学,2020.
ZENG P.The protective effect and mechanism of L-carnitine on cyclophosphamide induced testicular injury in rats[D].Kunming:Kunming Medical University,2020.