在食品工业中,通过氢化、酯交换和分馏过程从油中分离的固态脂肪被广泛用于不同的食品中。传统塑性脂肪相较于液态油而言,具有更特殊的理化特性,如可赋予食品更佳的质地口感、更好的氧化稳定性和更长的货架期等优势。但相关研究表明摄入过量的饱和脂肪酸和反式脂肪酸会增加心血管疾病、代谢综合征的发病率,因此人们开始倾向于从天然食物中寻求饱和脂肪和反式脂肪的替代品[1]。植物油和鱼油的超分子组装可以构造零反式、低饱和脂肪酸的固态脂肪,以代替传统塑性脂肪。这种组装策略可为消费者提供更安全、营养、健康的产品。
油凝胶是一类两相胶体系统,其中凝胶剂形成小分子的连续凝胶网络,组装成液晶、胶束或自组装纤维网络[2],油被包裹在热可逆的三维凝胶网络中,在不改变其化学组成的情况下提供类似固体脂肪的功效性质[3]。油凝胶可以由不同种类的液态油及凝胶剂以不同形式组装而成,基料油包括菜籽油、花生油、玉米油、稻米油以及鱼油等。其中,鱼油作为多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)的天然来源,富含的ω-3脂肪酸具有优异的营养功能和药理作用,如促进胎儿大脑发育、减少炎症和降低心脏发病率等[4-5]。而这些人体所需的脂质必须从各种食物中获得,因此在孕妇、婴儿和儿童的饮食中加入鱼油对机体的大脑和视网膜发育具有积极作用。近年来,ω-3鱼油补充剂和含有ω-3鱼油的食物(如谷物、面包、酸奶和牛奶)消费量有所增加[6-7]。有许多凝胶剂赋予液体油结构,如酯基凝胶剂(如蜡和脂肪醇)和聚合凝胶剂(如乙基纤维素)。这些胶凝剂具有形成凝胶网络的能力进而捕获液体油[8]。诱导油凝胶形成的3个主要作用力为:范德华力、氢键、π-π堆积作用[9]。蜡是长链非极性化合物混合物,由蜡酯、碳氢化合物、脂肪酸、单、二和三酰基甘油、酮、甾醇酯的混合物组成[10]。很多天然植物蜡被用作凝胶剂,包括:米糠蜡、蜂蜡、巴西棕榈蜡、小烛树蜡、甘蔗蜡等[8,11],天然蜡由于具有多种优点,如较高的油脂结合能力、低成本等,已被批准用作食品添加剂[12]。
此外,油凝胶在食品中具有许多不同的潜在功能,包括限制油的流动性和迁移、替代饱和脂肪和反式脂肪及稳定乳液等[13]。通过将液体油固定在凝胶网络中,可以降低三酰基甘油从材料中流出或透过材料的流动性,还可以改善消化过程中胶束的形成,从而提高脂溶性生物活性物质的生物利用度[14],以此可作为递送亲脂性如类胡萝卜素和必需脂肪酸的载体,以提高功能及营养特性[15]。因此,油凝胶的开发已成为近年来食品加工领域的研究热点之一。
目前,关于油凝胶的研究主要集中在植物油凝胶,其微观、宏观和物化特性方面的研究已经较为成熟,而关于使用鱼油制备油凝胶的报道还较为鲜见。鱼油因其高ω-3脂肪酸含量而极易氧化,限制了鱼油在食品制备中的应用,但油凝胶的形成是开发稳定的鱼油制剂的一种有效方法。寻找一种优势食品级蜡构建鱼油凝胶并系统分析其理化性质,对于开发新型鱼油产品具有重要意义。该技术可用于商业化产品,如鱼油补充剂、新的ω-3油强化食品,或应用于其他产品中如人造黄油、涂抹产品、起酥油、饼干和其他相关产品。本研究以实验室自制的大黄鱼鱼油作为基料油,以米糠蜡、蜂蜡、巴西棕榈蜡等3种食品级蜡作为凝胶剂,制备一种低饱和、零反式脂肪酸的鱼油凝胶,并系统表征其物化特性及其微观结构,以期为鱼油的商业化应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大黄鱼鱼油,实验室自制;蜂蜡,河南省长葛市品众峰业有限公司;米糠蜡,浙江省湖州圣涛生物技术有限公司;巴西棕榈蜡,上海九洁实业有限公司。
1.1.2 仪器与设备
HJ-4A恒温磁力加热搅拌器,江苏金坛市宏华仪器厂;TGL-20M台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;MCR 301高级旋转流变仪,奥地利安东帕有限公司;DY1602/Empyrean多功能X射线多晶衍射仪,荷兰帕纳科公司;DSC200 F3Maia差示热量扫描仪(differential scanning calorimeter,DSC),德国Netzsch公司;DVM6超景深体视数码显微镜,德国Leica公司。
1.2 实验方法
1.2.1 油凝胶样品制备
取若干个50 mL的烧杯,称取一定质量的鱼油。分别称取相应质量的蜂蜡、巴西棕榈蜡和米糠蜡,加入到装有鱼油的烧杯中。使用恒温磁力加热搅拌器在80 ℃下搅拌至澄清,再继续在相同条件下搅拌10 min。于室温下冷却至油凝胶形成,再转入4 ℃冰箱中保存24 h备用。
1.2.2 外观形态观测
将3种不同蜡制备的油凝胶样品分装至20 mL具塞透明玻璃瓶中,每6个(即凝胶剂质量分数分别为1%、3%、5%、7%、9%、11%的油凝胶)为1组,分别将其瓶口向上、向下放置进行拍照,观测3组鱼油凝胶外观形态及临界成胶质量分数。
1.2.3 持油能力测定
称取离心空管质量(m0),取一定量油凝胶样品于5 mL的离心管中,称取质量(m1),于室温下以10 000 r/min离心15 min后,倒置析出液体油,分别于0.5、1、2、3、24 h,称取质量(m2),通过公式(1)计算持油率。每个样品进行3次重复实验。
持油率![]()
(1)
1.2.4 油凝胶流变行为分析
使用直径为25 mm的平行板(PP25/P2)对油凝胶样品进行测定,所有样品均在20 ℃下进行,几何间隙为1 mm。
1.2.4.1 静态流变性实验
测定不同剪切速率下鱼油凝胶的表观黏度,取适量鱼油凝胶均匀涂于平板上,在20 ℃条件下测定3种凝胶剂质量分数为3%、5%、7%、9%、11%的鱼油凝胶表观黏度,剪切速率范围为0.01~100 s-1,固定应变为0.05%。
1.2.4.2 动态流变性实验
在20 ℃条件下,对鱼油凝胶进行动态频率扫描,固定振幅,频率范围为1~100 rad/s,记录扫描过程中样品随频率变化的G′和G″。
1.2.5 油凝胶晶型分析
采用多功能X射线多晶衍射仪测定油凝胶的晶型。取适量油凝胶平铺于检测片的圆孔内,于室温下进行测定。测定条件:工作电压为40 kV,电流为40 mA,Cu靶,发射狭缝1 mm,接受狭缝0.1 mm。2θ扫描范围:5~45°,扫描速率为4 °/min。
1.2.6 油凝胶熔化行为分析
精确称取油凝胶样品8~12 mg,转入DSC专用铝盒中,初始温度25 ℃,以30 ℃/min的速率快速将其从室温加热至90 ℃,并保持10 min以消除结晶记忆,再以5 ℃/min的速率降至20 ℃,并保持20 min使其充分结晶,再以5 ℃/min的速率升温至90 ℃,氮气流速为20 mL/min,记录结晶及熔化过程中的热变化曲线。
1.2.7 微观结构观察
将3种不同的热油凝胶样品滴取20 μL于载玻片中间,轻轻盖上盖玻片,避免气泡产生,在4 ℃下放置24 h,置于超景深体视数码显微镜载物台上进行观察,使用应用软件LeicaSuiteLASEZ(LeicaMicrosystems)获取和处理图像。
1.2.8 数据统计分析
采用Microsoft Excel 2003软件和Origin 9.0软件对数据进行分析处理及作图,采用JADE 6.0软件对XRD图谱进行分析,结果数据为平均值±标准偏差。
2 结果与讨论
2.1 外观形态
通过改变凝胶剂的添加量制备了不同质量分数的鱼油凝胶,将具塞瓶倒立放置,以观察3种植物蜡对鱼油的胶凝行为。如图1所示,3种凝胶剂形成的鱼油凝胶在质量分数为1%时快速流动,在质量分数为3%及以上时均不流动,这说明3种蜡形成的鱼油凝胶临界凝胶质量分数均为3%。此外,鱼油凝胶的外观颜色也是影响消费者的选择因素之一。棕榈蜡和蜂蜡制备的鱼油凝胶颜色均比鱼油本身的颜色更深一些,而米糠蜡形成的油凝胶颜色呈乳白色,这可能与凝胶剂自身的颜色有关。随着蜡添加量的增加,鱼油凝胶颜色均逐渐加深,由淡黄/乳白色变为黄色。

图1 油凝胶外观形态
Fig.1 The appearance of oil gel
2.2 持油能力
由图2可知,鱼油凝胶的持油能力与凝胶剂的种类及质量分数关系密切。其中,蜂蜡形成的油凝胶持油效果最佳,且在质量分数为3%~11%时持油率均达到98%以上,这说明蜂蜡的添加量对油凝胶的持油率几乎没有影响。米糠蜡的持油能力次之,在质量分数为3%时持油率较低,持油率仅有50%左右,随着米糠蜡的增加,其持油率接近100%。巴西棕榈蜡的持油能力最差,当凝胶剂质量分数为3%和5%时,油凝胶呈微微流动状,此时的持油率分别只有50%和80%,而在质量分数为9%和11%时持油率可达到98%以上,这说明巴西棕榈蜡的添加量对油凝胶持油率的影响最为显著。3种凝胶剂对油凝胶持油能力的显著性差别可能是由于凝胶因子所形成的凝胶网络结构的差异造成。高的持油率表明油凝胶具有良好的抗油脂迁移能力,适用于改善食品工业中油脂的液体油析出问题[16]。
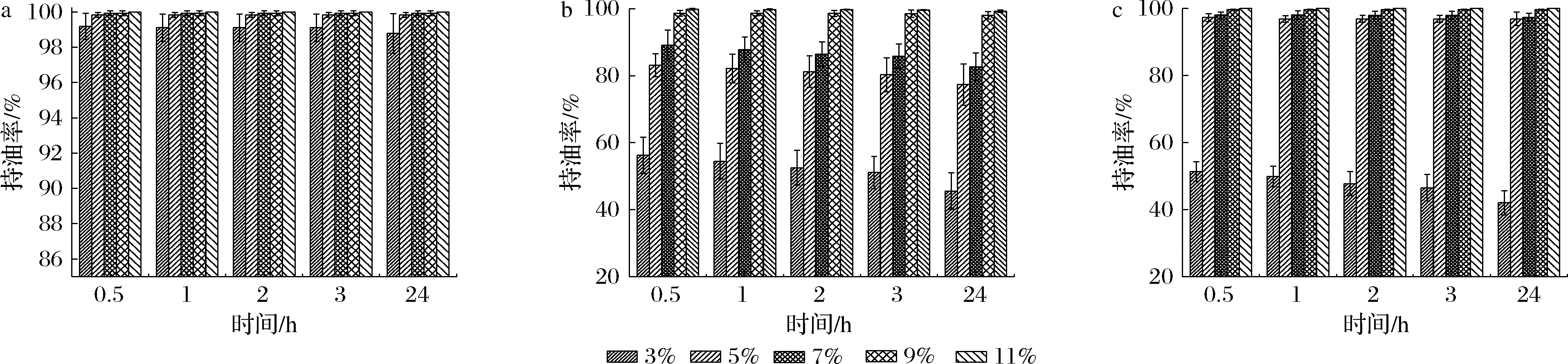
a-蜂蜡;b-巴西棕榈蜡;c-米糠蜡
图2 油凝胶样品的持油率
Fig.2 Oil holding rate of oil gel samples
2.3 流变行为
2.3.1 静态流变行为
以凝胶剂质量分数5%和9%为例,3种蜡制备的油凝胶表观黏度随剪切速率的变化如图3所示,3种蜡形成的油凝胶均在低剪切力作用下表现出较高的表观黏度,在高剪切力作用下呈现剪切变稀的流体特征。如图3-a所示,在凝胶剂质量分数为5%时,在相同剪切速率作用下,蜂蜡的表观黏度最大,其次是米糠蜡,最小的是巴西棕榈蜡。图3-b所示,在凝胶剂质量分数为9%时,巴西棕榈蜡的表观黏度最大,蜂蜡的表观黏度最小,这说明凝胶剂的种类会显著影响油凝胶的表观黏度。5%的巴西棕榈蜡油凝胶在5 s-1处表观黏度值开始趋于直线,而5%的蜂蜡和米糠蜡均在11 s-1后才开始趋于直线。这可能是与5%的棕榈蜡油凝胶在20 ℃时处于半固态没有完全凝胶化有关,这也印证了5%的棕榈蜡油凝胶持油率较低这一结果。如图3-c所示,以不同质量分数的蜂蜡制备的油凝胶为例,在低的剪切速率下,随着凝胶剂质量分数的增加,表观黏度变大,这表明油凝胶中凝胶因子的数目增加将强化凝胶化行为。
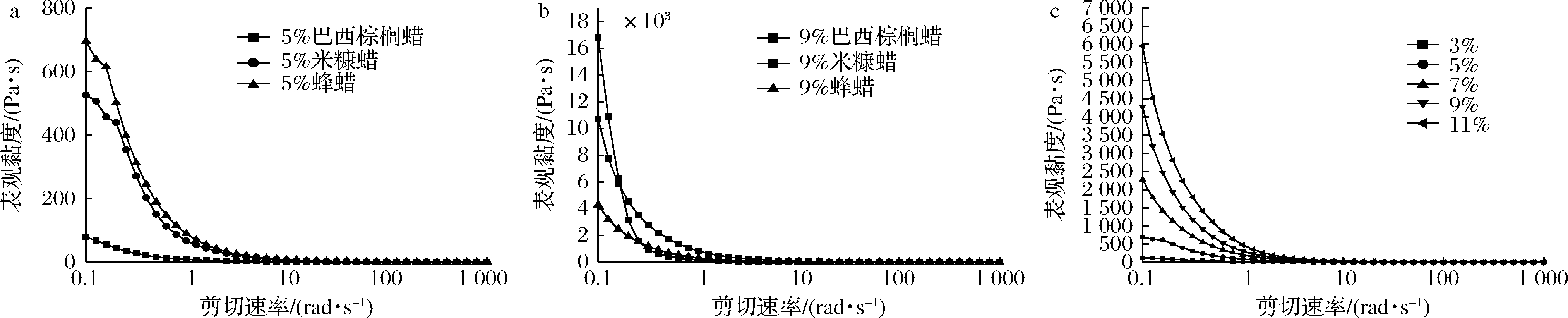
a-添加量为5%;b-添加量为9%;c-蜂蜡油凝胶
图3 油凝胶表观黏度随剪切速率变化曲线
Fig.3 Curves of apparent viscosity of oil gel with shear rate
由图3可知,所有油凝胶样品表观黏度均随剪切速率增加而呈现下降趋势。用Power-Law对数据点进行拟合,如表1所示,拟合函数的相关性(R2)在0.96~1,说明表观黏度和剪切速率试验数据的关系符合幂律方程关系式,表现为典型的剪切变稀流体。
幂律方程[17]如公式(2)所示:
η=K×γn-1,0<γ≤1
(2)
式中:η、γ、K、n分别代表表观黏度、剪切速率、稠度系数和幂律指数。
n<1,表明其为剪切变稀的假塑性流体,n值偏离1越大,则意味着剪切越易变稀,即假塑性程度越大[18]。由表1所示,米糠蜡和棕榈蜡鱼油凝胶随着剪切程度变大,越易变稀,即假塑性程度越大;而蜂蜡鱼油凝胶假塑性程度较小。由凝胶样品稠度系数观察发现,3种蜡所制备的鱼油凝胶均随凝胶剂质量分数的增加愈加黏稠,米糠蜡油凝胶黏稠程度在凝胶剂添加量为7%~9%时差异显著;而蜂蜡油凝胶和巴西棕榈蜡油凝胶均在凝胶剂添加量为9%~11%时黏稠度发生显著变化。说明当米糠蜡添加量为9%,蜂蜡或巴西棕榈蜡添加量为11%时均可使鱼油凝胶体系获得较高的黏度。
表1 油凝胶幂律指数及稠度系数
Table 1 Power law index and consistency coefficient of oil gels
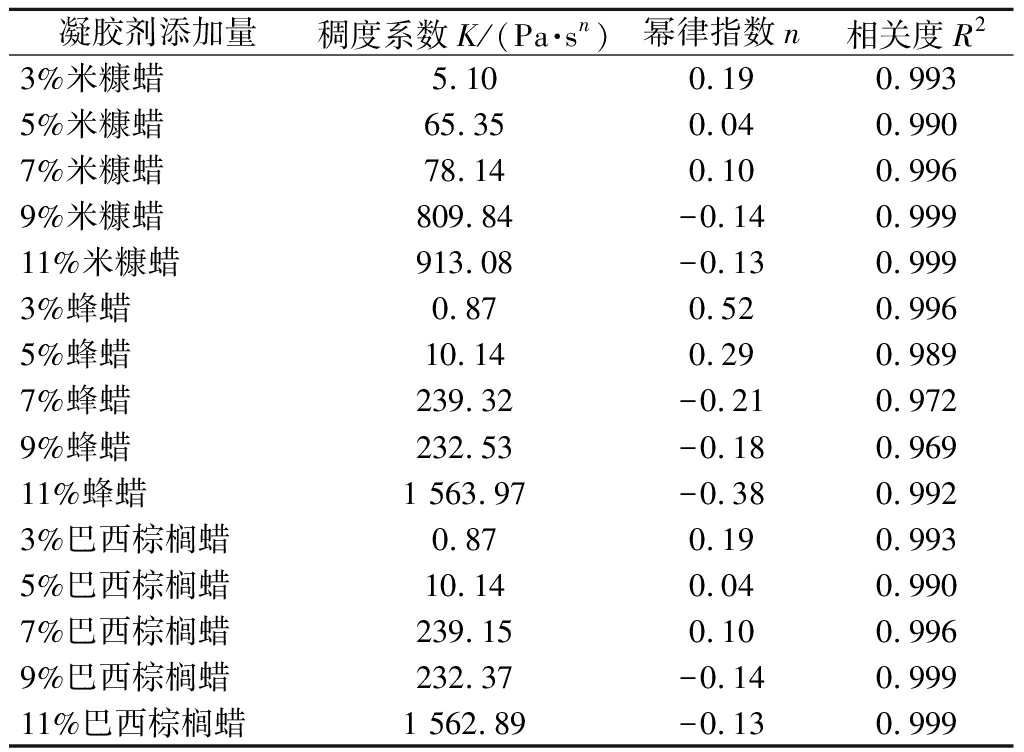
凝胶剂添加量稠度系数K/(Pa·sn)幂律指数n相关度R23%米糠蜡5.100.190.9935%米糠蜡65.350.040.9907%米糠蜡78.140.100.9969%米糠蜡809.84-0.140.99911%米糠蜡913.08-0.130.9993%蜂蜡0.870.520.9965%蜂蜡10.140.290.9897%蜂蜡239.32-0.210.9729%蜂蜡232.53-0.180.96911%蜂蜡1 563.97-0.380.9923%巴西棕榈蜡0.870.190.9935%巴西棕榈蜡10.140.040.9907%巴西棕榈蜡239.150.100.9969%巴西棕榈蜡232.37-0.140.99911%巴西棕榈蜡1 562.89-0.130.999
2.3.2 动态流变行为
角频率扫描用于研究油凝胶随时间的相关流变行为,并将样品分为强凝胶、弱凝胶或黏性凝胶[19]。由图4可知,储能模量(G′值)始终高于损失模量(G″值),所有样品均表现出凝胶化行为,且显示出更多的弹性特征。当储能模量(G′)被绘制为一个恒定值时,表明样品是一种强凝胶,否则,如果G′随着频率的增加而增加,则表明样品是较弱的凝胶[20]。这3种凝胶剂制备的所有油凝胶样品都显示出轻微的正斜率,这表明所有样品都是弱凝胶,并表明凝胶结构进行了有限重排。巴西棕榈蜡的总G′值最高,其次是米糠蜡和蜂蜡。在使用同一种凝胶剂的情况下,凝胶剂添加量的增加将导致有机凝胶的储能模量和损耗模量均增加。这表明更高质量分数的凝胶剂将有助于晶体网络更好地形成和更好的油凝胶化。这与晶体和油相之间形成的强网络结构有关,其中的晶体数目的增多从而构建了强稳定的晶体网络,有效地固定了油凝胶的网络结构[21]。这些结果表明,在选定的应力值下,巴西棕榈蜡油凝胶形成了更强的凝胶网络,具有更强的抗变形能力。

a-巴西棕榈蜡;b-蜂蜡;c-米糠蜡
图4 油凝胶黏弹性模量随角频率变化曲线
Fig.4 Curves of viscoelastic modulus of oil gel with angular frequency
2.4 晶型分析
图5展示了所有油凝胶样品的XRD图谱,每种凝胶剂形成的油凝胶均显示了相似的衍射峰。衍射峰在0.415 nm左右为α型晶体的特征峰,衍射峰在0.46 nm左右为β型晶体的特征峰,在0.380和0.420 nm附近的强衍射峰为β′晶体的特征峰。由图5可知,这3种植物蜡所制备的鱼油凝胶均含有α、β、β′这3种晶型。棕榈蜡和米糠蜡油凝胶在0.41 nm处的强衍射峰表明其以α晶型为主,而在0.37 nm处的强衍射峰显示其β′晶型也较为突出。β′晶型具有较小的晶体颗粒,可形成更细微的晶体网络结构,相比稳定的β型晶体可包裹住更多的液态油。研究结果发现,所有特征峰处的衍射强度并不随着凝胶剂质量分数的增加而随之增强,蜂蜡油凝胶在凝胶剂质量分数仅为7%即呈现出最强的衍射峰;5%的棕榈蜡油凝胶衍射强度强于7%的棕榈蜡油凝胶;9%的米糠蜡油凝胶衍射强度弱于7%的米糠蜡油凝胶。这表明晶型的差异和晶体数目的含量与蜡的种类和添加量息息相关。此外,以凝胶剂添加量9%为例,3种凝胶剂所形成的油凝胶的特征峰衍射强度也有所差异,其中巴西棕榈蜡在特征峰处衍射强度最强,米糠蜡次之,蜂蜡最弱,这可能与蜡质中的蜡酯含量高低相关,也可能与其中碳氢化合物的碳链长度有关[22]。
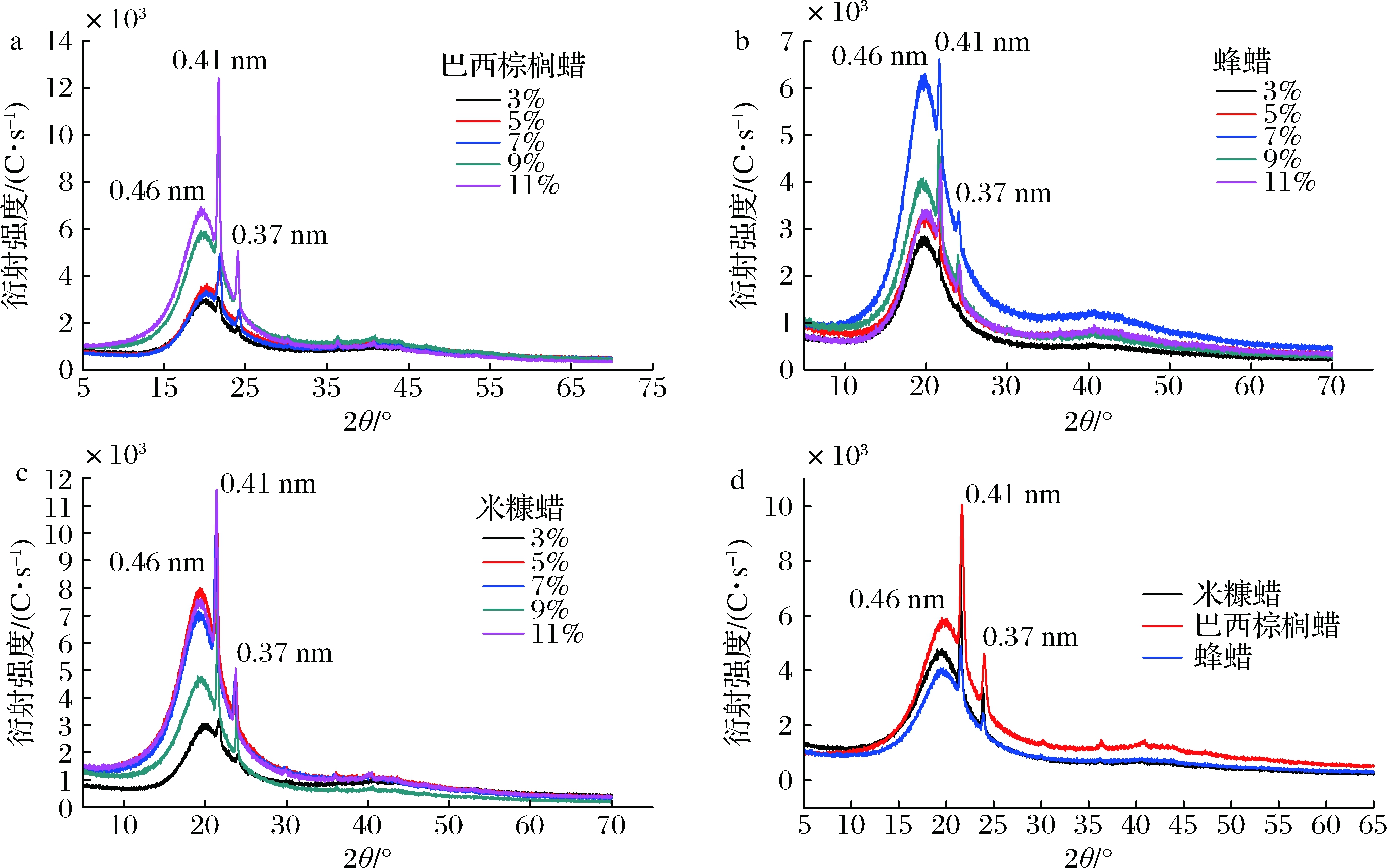
a-巴西棕榈蜡;b-蜂蜡;c-米糠蜡;d-3种油凝胶
图5 不同油凝胶的XRD图谱
Fig.5 XRD profiles of different oil gels
2.5 熔化结晶行为
由图6可见,不同蜡构建的鱼油凝胶的结晶曲线差别较大。其中蜂蜡和米糠蜡的结晶峰都只有1个,而巴西棕榈蜡的结晶峰有1~2个。米糠蜡的结晶峰较窄,蜂蜡和巴西棕榈蜡出现的是宽峰,这可能与蜡成分中的蜡酯含量高低有关。此外,蜂蜡结晶峰较宽,且蜡在较低质量分数时峰消失,这是由于在DSC测量过程中油凝胶样品较少且存在同质多晶现象,在较低的凝胶因子质量分数下不易观察到相变的过程[23]。3种蜡构建的油凝胶熔化曲线相似,只有1个熔化峰且都是尖峰。同种蜡的油凝胶的结晶温度和熔化温度均随着凝胶剂含量的增加而升高,表明油凝胶的热力学稳定性增加。随着鱼油凝胶中凝胶因子含量的降低,结晶峰值温度降低且相应的放热峰变宽,凝胶剂质量分数相同时,棕榈蜡结晶温度>米糠蜡结晶温度>蜂蜡结晶温度,而熔化峰温度巴西棕榈蜡和米糠蜡相近,蜂蜡的熔化峰值温度最低。

a-米糠蜡油凝胶结晶曲线;b-蜂蜡油凝胶结晶曲线;c-巴西棕榈蜡油凝胶结晶曲线;d-米糠蜡油凝胶熔化曲线; e-蜂蜡油凝胶熔化曲线;f-巴西棕榈蜡油凝胶熔化曲线
图6 不同油凝胶的DSC曲线
Fig.6 DSC curves of different oil gels
2.6 微观结构
通过观察油凝胶晶体网络结构以获得分子的排序和晶体的生长方向。凝胶因子通过无规则、不定向地聚集形成一维丝带状、絮状、囊泡状、纤维状等形态的聚集体,继而聚集体相互作用形成三维网络结构,进而包裹液态鱼油形成鱼油凝胶。植物蜡在油凝胶中形成的晶体颗粒相互连接成晶体链,晶体链缠结成更多的结晶区,增强了凝胶的网络结构[24]。以添加量为11%的巴西棕榈蜡、米糠蜡和蜂蜡鱼油凝胶为例,其中蜂蜡形成的晶体在一维方向上形成少量的“絮状”结构(图7);米糠蜡的小晶体以簇状结构形式呈现;棕榈蜡形成的晶体以“放射状”形态聚集成小球状结构,这些较长的结构再通过物理缠绕或相互重叠的方式构成三维网络结构。棕榈蜡的晶体形态呈“球状”,表明晶型不单一,这与前面XRD图结果验证一致。此外,球状晶体具有掩饰苦味,可压缩的性质,因此以棕榈蜡形成的鱼油凝胶弹性更好,可应用于制药工业。

a-巴西棕榈蜡油凝胶500 μm下拍摄;b-米糠蜡油凝胶500 μm下拍摄; c-蜂蜡油凝胶500 μm下拍摄;d-巴西棕榈蜡油凝胶75 μm下拍摄; e-米糠蜡油凝胶75 μm下拍摄;f-蜂蜡油凝胶75 μm下拍摄
图7 不同油凝胶的微观结构图
Fig.7 Microstructure of different oil gels
3 结论
以3种食品级蜡米糠蜡、巴西棕榈蜡、蜂蜡为凝胶剂,大黄鱼鱼油作为基料油制备了一种鱼油凝胶,当3种蜡添加量大于3%时均可在室温下成功制备油凝胶。其中蜂蜡的持油能力最优,米糠蜡次之,棕榈蜡最差,随着凝胶剂添加量的增多,持油能力也显著提高。流变行为曲线分析显示,3种凝胶剂制备的鱼油凝胶均显示出弱凝胶行为,并都属于剪切变稀流体。熔化结晶曲线表明,在使用同一种凝胶剂的情况下,随着凝胶剂质量分数的增加,其结晶温度和熔化温度均会提高,说明较高浓度的鱼油凝胶热稳定性能更好。XRD结果显示,3种油凝胶中均存在着α、β、β′这3种晶型,其中以α、β′型晶型为主,蜡的类型和添加量对油凝胶晶型种类影响不大,对晶体数目影响较大。棕榈蜡形成的油凝胶中晶体形态呈现“放射状”进而聚集成“球状”的形态,米糠蜡油凝胶的晶体呈现小簇状,晶体分布较为均匀,蜂蜡油凝胶晶体以絮状的形式存在,分布不均匀且较为稀疏,3种油凝胶晶体结构均对液体油有较强的固定作用,形成了稳定的三维网络结构。综上,结合蜡的类型和添加量,9%的巴西棕榈蜡用以制备鱼油凝胶的效果最佳,形成的鱼油凝胶稳定性也最好。本研究为富含ω-3脂肪酸的鱼油的开发利用提供了一种有效方法。
[1] ![]() H,DEMIRCI M,TOKER O S,et al.Oleogels,a promising structured oil for decreasing saturated fatty acid concentrations:Production and food-based applications[J].Critical Reviews in Food Science and Nutrition,2018,58(8):1 330-1 341.
H,DEMIRCI M,TOKER O S,et al.Oleogels,a promising structured oil for decreasing saturated fatty acid concentrations:Production and food-based applications[J].Critical Reviews in Food Science and Nutrition,2018,58(8):1 330-1 341.
[2] DASSANAYAKE L S K,KODALI D R,UENO S,et al.Crystallization kinetics of organogels prepared by rice bran wax and vegetable oils[J].Journal of Oleo Science,2012,61(1):1-9.
[3] LIM J,JEONG S,OH I K,et al.Evaluation of soybean oil-carnauba wax oleogels as an alternative to high saturated fat frying media for instant fried noodles[J].LWT,2017,84:788-794.
[4] SIDHU K S.Health benefits and potential risks related to consumption of fish or fish oil[J].Regulatory Toxicology and Pharmacology,2003,38(3):336-344.
[5] JOHN W.FINLEY F S.The chemistry,processing,and health benefits of highly unsaturated fatty acids.An overview[J].ACS Symposium Series,2001,788:2-9.
[6] GANESAN B,BROTHERSEN C,MCMAHON D J.Fortification of foods with omega-3 polyunsaturated fatty acids[J].Critical Reviews in Food Science & Nutrition,2014,54(1):98-114.
[7] JACOBSEN C.Enrichment of foods with omega-3 fatty acids:A multidisciplinary challenge[J].Annals of the New York Academy of Sciences,2010,1 190(1):141-150.
[8] SOLEIMANIAN Y,GOLI S A H,SHIRVANI A,et al.Wax-based delivery systems:Preparation,characterization,and food applications[J].Comprehensive Reviews in Food Science and Food Safety,2020,19(6):2 994-3 030.
[9] 郭胜兰,兰雅淇.基于作用力探究凝胶因子与油凝胶之间的构效关系研究进展[J].食品科学,2019,40(9):316-324.
GUO S L,LAN Y Q.Progress in structure-function relationship between gelators and oleogelation based on driving force[J].Food Science,2019,40(9):316-324.
[10] BLAKE A I,MARANGONI.Plant wax crystals display platelet-like morphology[J].Food Structure,2015,3:30-34.
[11] 王伟宁,王莹,于洋,等.甘蔗蜡制备稻米油基油凝胶及其相关性质[J].食品科学,2021,42(2):17-22.
WANG W N,WANG Y,YU Y,et al.Preparation of rice oil-based oil gel from sugarcane wax and its related properties[J].Food Science,2021,42(2):17-22.
[12] PATEL A R.Alternative Routes to Oil Structuring[M].New York:Springer International Publishing,2015.
[13] JIMENEZ-COLMENERO F,SALCEDO-SANDOVAL L,BOU R,et al.Novel applications of oil-structuring methods as a strategy to improve the fat content of meat products[J].Trends in Food Science & Technology,2015,44(2):177-188.
[14] STORTZ T A,ZETZL A K,BARBUT S,et al.Edible oleogels in food products to help maximize health benefits and improve nutritional profiles[J].Lipid Technology,2012,24(7):151-154.
[15] MARANGONI A G,IDZIAK S H J,VEGA C,et al.Encapsulation-structuring of edible oil attenuates acute elevation of blood lipids and insulin in humans[J].Soft Matter,2007(3):183-187.
[16] 孟宗,李陆茵,李兴伟,等.植物蜡及液态植物油构建油凝胶的物性研究[J].中国油脂,2019,44(11):17-22.
MENG Z,LI L Y,LI X W,et al.Physical properties of oleogels strutured by vegetable wax and liquid vegetable oil[J].China Oils and Fats,2019,44(11):17-22.
[17] 侯万国.应用胶体化学[M].北京:科学出版社,1998.
HOUW G.Applied colloid chemistry[M].Beijing:Science Press,1998.
[18] 朱建升.葵花蜡的精制及其在有机凝胶油中的应用[D].郑州:河南工业大学,2016.
ZHU J S.Purification of sunflower waxes and application in organogels[D].Zhengzhou:Henan University of Technology,2016.
[19] MALKIN A Y,ISAYEV A.Rheology concepts,methods,and applications[M].Canada:Chem Tec Publishing,2017.
[20] LIU L Y,RAMIREZ I S A,YANG J S,et al.Evaluation of oil-gelling properties and crystallization behavior of Sorghum wax in fish oil[J].Food Chemistry,2020,309.DOI:10.1016/j.foodchem.2019.125567.
[21] DONG L L,LV M,GAO X Y,et al.In vitro gastrointestinal digestibility of phytosterol oleogels:Influence of self-assembled microstructures on emulsification efficiency and lipase activity[J].Food & Function,2020,11(11):9 503-9 513.
[22] DOAN C D,TO C M,DE VRIEZE M,et al.Chemical profiling of the major components in natural waxes to elucidate their role in liquid oil structuring[J].Food Chemistry,2017,214:717-725.
[23] 钟金锋,覃小丽,刘雄.凝胶油及其在食品工业中的应用研究进展[J].食品科学,2015,36(3):272-279.
ZHONG J F,QIN X L,LIU X.Advances in oleogels and their applications in food industry[J].Food Science,2015,36(3):272-279.
[24] DA PIEVE S,CALLIGARIS S,CO E,et al.Shear nanostructuring of monoglyceride organogels[J].Food Biophysics,2010,5(3):211-217.