苹果富含维生素、膳食纤维、多酚等生物活性成分,对慢性心血管疾病、糖尿病、肥胖和癌症产生有益影响[1],深受消费者喜爱。鲜苹果含水量较高,在运输和贮藏过程中容易腐烂变质,脱水干燥不仅可以抑制微生物生长繁殖,而且还可以减小产品质量,从而达到延长保存时间、方便运输的目的[2]。常见苹果干燥方式有热风干燥、微波干燥、真空冷冻干燥、射频干燥、红外干燥等,与其他干燥方式相比,热风干燥具有操作简单、能耗和成本低、处理量大的优点,广泛应用于企业中[3]。
热风干燥过程中苹果片容易出现褐变、营养物质降解等不良反应而降低消费者可接受度[2]。预处理结合干燥技术不仅可以缩短干燥时间,提高干燥速度,还可以进一步提高干制品的品质[4]。目前,热水烫漂(water blanching,WB)和蒸汽烫漂(steam blanching,SB)是果蔬加工中比较成熟的预处理技术,在钝化酶的活性、稳定色泽、减少微生物数量以及增加生物活性成分提取率等方面发挥重要作用[5]。WANG等[6]研究了热水烫漂对冷冻干燥苹果片干燥特性和品质的影响,研究表明经过热水烫漂之后,苹果片质量损失、复水比、体积收缩率显著性增加,而硬度和维生素C的含量显著性减小,色泽变化不大。NDIAYE等[7]研究了蒸汽烫漂对芒果片过氧化物酶和多酚氧化酶活性以及色泽的影响,研究发现在蒸汽烫漂5和7 min时,过氧化物酶(peroxidase,POD)和多酚氧化酶(polyphenol oxidase,PPO)分别完全失活,烫漂时间超过5 min后,褐变指数下降。微波烫漂(microwave blanching,MB)技术,由于其加热效率高、易于操作、营养物质损失小等优点受到了人们的关注[4]。DIBANDA等[8]研究了微波烫漂对芒果、苹果、橙子和香蕉果皮的抗氧化活性,多酚含量以及褐变特性的影响。目前,国内外关于单个烫漂方式对果蔬理化性质影响的研究较多,但有关比较不同烫漂方式对苹果片品质影响的研究还很少。
本实验采用热水、蒸汽和微波对苹果片进行烫漂处理,测定苹果片在烫漂和干燥过程中的褐变、多酚及其抗氧化活性的变化情况,以期为改善苹果脆片品质提供参考。
1 材料与方法
1.1 材料与试剂
红富士苹果,甘肃天水,所有样品外形大小一致(平均单果质量180~300 g),无损伤,新鲜完整;柠檬酸,维生素C、偏磷酸、磷酸二氢钾、磷酸、丙酮、浓盐酸、正己烷、没食子酸、福林酚、碳酸钠、过硫酸钾、氯化亚铁、氯化铁等,均为分析纯,成都市科龙化工试剂厂;DPPH、三吡啶基三嗪(tripyridyltriazine,TPTZ)(试剂级),东京化成工业株式会社;ABTS(试剂级),上海如吉生物科技有限公司;水溶性维生素E(Trolox,试剂级),北京索莱宝科技有限公司;多酚标品(儿茶素、绿原酸、表儿茶素、阿魏酸、鞣花酸、根皮苷),均为色谱纯,成都普瑞法科技开发有限公司。
1.2 仪器与设备
DHG-9140电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;G70F23CN2P-BM1微波炉,广东格兰仕微波炉电器制造有限公司;AQ-180E磨粉机,慈溪市耐欧电器有限公司;L535-1离心机,湖南湘仪离心机仪器有限公司;LC-20A高效液相色谱仪,日本岛津;RE-5298旋转蒸发仪,上海亚荣生化仪器厂;SYNERGYH1MG全波长酶标仪,美国伯腾仪器有限公司;85-2A数显恒温磁力搅拌器,金坛市科析仪器有限公司;UltraScan PRO测色仪,美国HunterLab公司;PHS-3E pH计,上海雷磁仪器厂。
1.3 实验方法
1.3.1 苹果片制作工艺
新鲜苹果清洗→去皮去核→切成厚度为6 mm的薄片→切片浸没在1.5%的柠檬酸溶液中15 min→取出沥干多余的水分,进行烫漂预处理→冷却、沥干多余水分,立即冷却至室温→将冷却的苹果片在电热恒温鼓风干燥箱中干燥(70 ℃),烘至样品水分含量为5%左右→干燥的苹果脆片打粉保存在干燥器中,备用。
1.3.2 烫漂处理
WB:控制纯水温度(90±2)℃,料液比1∶4(g∶mL),处理时间180 s;SB:将纯水煮沸,蒸汽锅预热5 min,再将样品平铺在密闭的蒸汽锅中,烫漂时间90 s;MB:在微波炉载物台上平铺苹果片,控制微波功率700 W,烫漂时间60 s。
1.4 指标测定
1.4.1 水分含量测定
分别测定鲜样和浸泡、烫漂、热风干燥后的苹果片的水分含量,方法参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法。
1.4.2 干燥特性测定
将苹果片经过3种烫漂方法预处理后,平铺在70 ℃热风干燥箱里面,干燥时间为0~450 min,每隔30 min随机取3个样,测定该时刻下的样品水分含量(测量方法同1.4.1),以时间(t)为横坐标(x),以水分含量为纵坐标(y),绘制3种烫漂方式处理后的苹果片在相同干燥条件下的干燥曲线。
1.4.3 色差分析
参考DEYLAMI等[9]的方法,并略作修改。苹果片表面颜色采用测色仪测量。分别测量新鲜和浸泡、烫漂、烘干后样品的颜色。其次是测量3种烫漂方式处理后的苹果片在热风干燥过程中L*、a*、b*值随干燥时间的变化情况:将经过3种烫漂方式处理后的苹果片在同一干燥条件(70 ℃)下进行热风干燥,0~510 min内,每隔30 min取样并测定该时刻下的色差,并以干燥时间(t)为横坐标(x),以L*、a*、b*值为纵坐标(y)分别绘制L*-t、a*-t、b*-t关系曲线。ΔE根据公式(1)计算:
(1)
式中:L*,不同处理后的样品亮度值;L0*,鲜样的亮度值;a*,不同处理后的样品红绿值;![]() 鲜样的红绿值;b*,不同处理后的样品黄蓝值;
鲜样的红绿值;b*,不同处理后的样品黄蓝值;![]() 鲜样的黄蓝值。
鲜样的黄蓝值。
1.4.4 还原糖含量测定
根据NY/T 2742—2015《水果及制品可溶性糖的测定 3,5-二硝基水杨酸比色法》测定苹果片中的还原糖含量。
1.4.5 维生素C含量测定
参考RUIZ-OJEDA等[10]的方法并适当修改。准确称取3.000 g样品,提取液为3%偏磷酸溶液,料液比1∶1(g∶mL),漩涡振荡10 min,离心(3 558×g,10 min),上清液过0.22 μm水系滤膜,装入小瓶待测。采用高效液相色谱仪检测,二极管阵列检测器,Thermo BDS-C18反相色谱柱(250 mm×4.6 mm,5 μm)。液相条件:流动相0.010 mol/L磷酸二氢钾,用磷酸调pH至2.60;流速0.4 mL/min,检测波长245 nm,进样体积5 μL。配制维生素C标准溶液,检测条件和样品一致,得到标准曲线,并计算样品中维生素C的含量。
1.4.6 5-羟甲基糠醛含量测定
5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)含量的测定采用HPLC[11]。称取1.00 g试样置于25 mL容量瓶中,用体积分数10%甲醇溶液定容,充分混匀,将溶液过0.45 μm有机滤膜,之后通过液相色谱仪紫外检测器测定。液相条件:紫外检测器,Thermo BDS-C18 反相色谱柱(250 mm×4.6 mm,5 μm),流动相10%甲醇溶液,流速1.0 mL/min,检测波长283 nm,进样体积50 μL,柱温30 ℃。按照(c×V×1 000)/(m×1 000)计算5-HMF(mg/kg,干重)含量。其中c为从标准工作曲线上得到的被测组分溶液质量浓度,μg/mL;V为定容体积,mL;m为样液所代表试样的质量,g。
1.4.7 多酚含量测定
游离态多酚和结合态多酚提取,参考OKARTER等[12]的方法,略作修改。称取2.000 g苹果干粉末(湿样称10.000 g),接着加入40 mL体积分数80%冷冻丙酮水溶液,剧烈搅拌提取10 min。然后在3 558×g下离心10 min,收集上清液,剩下的残渣再按上面的提取条件重复提取5次,合并上清液并于45 ℃下旋转蒸发至干,用甲醇定容于10 mL棕色容量瓶中,提取的游离多酚在-20 ℃下保存备用。将上述游离态多酚提取后剩下的样品残渣中,加入20 mL 2 mol/L NaOH溶液,在室温下磁力搅拌2 h。取出后放入冰水浴中,用浓盐酸调整混合物的pH至2,接着加入20 mL正己烷去除脂肪,剧烈振荡5 min后,在3 558×g下离心10 min,倒掉上清液。向残渣中加入20 mL乙酸乙酯进行提取,剧烈振荡10 min,然后离心10 min,收集上清液,剩下的残渣再重复提取4次,最后合并上清液,并在45 ℃下旋转蒸发至干,甲醇定容,提取的结合多酚在-20 ℃下保存。
总酚测定参考SUN等[13]的方法,将没食子酸标准储备液(质量浓度为0.1 mg/mL)以及适量多酚样品溶液置于25 mL容量瓶中,再加入15 mL蒸馏水,之后加1.5 mL福林酚试剂,混匀。静置1 min后,加入4.5 mL体积分数20%的碳酸钠溶液,混匀定容,于75 ℃下避光反应10 min。在760 nm处测定吸光值A。以没食子酸溶液的质量浓度(mg/mL)为横坐标(x),对应的吸光值(A)为纵坐标(y),绘制标准曲线,其线性方程为:y=43.773x+0.011 3,R2=0.997,结果表示为mg GAE/g DW。
1.4.8 多酚单体测定
用HPLC测定苹果片中游离态和结合态的多酚单体含量。色谱柱:Thermo BDS-C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相A(水相):0.1%磷酸;流动相B(有机相):100%甲醇;流动相流速:0.4 mL/min;进样量5 μL;柱温40 ℃;检测器:日本岛津紫外检测器;检测波长280 nm;梯度洗脱程序:0~30 min,A相85%~40%,B相15%~60%;30~35 min,A相40%~20%,B相60%~80%;35~40 min,A相20%~10%,B相80%~90%;40~50 min,A相10%~85%,B相90%~15%;50~60 min,A相85%,B相15%。准确称取5 mg儿茶素、绿原酸、表儿茶素、阿魏酸、鞣花酸、根皮苷标准品(>98.0%)置于5 mL的棕色容量瓶中,用甲醇溶解、定容,摇匀后稀释得到不同质量浓度的溶液(0、1、5、25、50、100、200 μg/mL),过0.45 μm有机滤膜待测,按照上述液相条件制作标准曲线,以峰面积为纵坐标(y),以标准品溶液的质量浓度(μg/mL)为横坐标(x),绘制标准曲线,得到线性回归方程。
1.4.9 多酚抗氧化活性测定
1.4.9.1 DPPH自由基清除活性测定
参照LIU等[14]的方法,在10 mL试管中加入10 μL适当稀释的多酚提取液和3.5 mL DPPH自由基溶液(6×10-5 mol/L,现用现配),振荡均匀(漩涡振荡30 s),在室温下避光反应30 min,于517 nm处测定其吸光值As。同时测定空白样(甲醇代替多酚提取液)吸光值A0。按照(A0-AS)/A0计算样品对DPPH自由基的清除率S。
以Trolox溶液为标品,得到回归方程为y=0.112 3x-0.021 7,R2=0.997 4,根据样品吸光值计算最终结果,结果表示为mmol TE/100 g DW。
1.4.9.2 ABTS阳离子自由基清除活性测定
参考WANG等[15]的方法,略作修改。在10 mL试管中加入0.5 mL适当稀释的多酚提取液和3.5 mL ABTS阳离子自由基溶液,振荡混匀后在30 ℃水浴条件下反应6 min。取出,于734 nm处测定其吸光值As,同时测定空白样(甲醇代替多酚提取液)吸光值A0。按照(A0-AS)/A0计算样品对ABTS阳离子自由基的清除率S。
以Trolox溶液为标品,得到回归方程为y=0.063 2x+0.004 1,R2=0.997 5,根据样品吸光值计算最终结果,结果表示为mol TE/100 g DW。
1.4.9.3 铁离子还原能力(ferric ion reducing antioxidant power,FRAP)测定
参考DU等[16]的方法,略作修改。将25 mL FeCl3·6H2O溶液、25 mL TPTZ溶液(10 mmol/L)和250 mL醋酸缓冲液(300 mmol/L)混合均匀,得到FRAP工作液。在10 mL试管中加入0.1 mL适当稀释的多酚提取液和3.5 mL FRAP工作液,振荡混匀后在37 ℃水浴条件下反应10 min。取出,于593 nm处测定其吸光值As。以FeSO4·7H2O溶液为标品,得到回归方程为y=0.041 5x-0.001 4,R2=0.999 4,结果表示为mol FE/100 g DW。
1.5 统计分析
数据用Origin 2018软件和SPSS Statistics 26软件进行处理和分析。实验结果以平均值±标准误差表示。显著性分析采用Duncan’s检验,P<0.05判定为显著。显著性差异采用多重比较法中的标记字母法表示。
2 结果与分析
2.1 烫漂对苹果片热风干燥特性的影响
图1是苹果片经过不同烫漂方式处理后的干燥特性曲线。经过热水、蒸汽、微波烫漂后,苹果片的水分含量分别为88.14、86.86、85.22 g/100 g。

图1 苹果片经过不同烫漂方式处理后的干燥特性曲线
Fig.1 The drying characteristic curves of apple slices pretreated with different blanching methods 注:WB-热水烫漂;SB-蒸汽烫漂;MB-微波烫漂(下同)
经过热风干燥后,苹果片的水分含量高低顺序为蒸汽烫漂>微波烫漂>热水烫漂,且热水、蒸汽、微波烫漂的苹果片经过热风干燥后达到平衡水分含量的时间分别是270、350、300 min左右。热水烫漂的苹果片达到平衡水分含量的时间最短,因为该烫漂方式可能导致细胞结构破坏程度最严重,进而加快水分扩散速率。微波烫漂的苹果片干燥时间比蒸汽烫漂的短是因为微波烫漂的苹果片起始水分含量较蒸汽烫漂的低,因此干燥时间短,干燥速率高[17]。因此,相比其他2种烫漂方式,热水烫漂有助于缩短苹果片的干燥时间。
2.2 烫漂对苹果片色泽的影响
苹果片在加工过程中会发生酶促褐变和非酶褐变,由此产生的褐变物质会影响苹果片的颜色,L*、a*、b*值可以观测苹果片的褐变情况:苹果片表面褐变越严重,a*、b*值越大,L*值越小,色差ΔE表示苹果片表面颜色的总体变化情况[18]。表1显示了不同烫漂方式对苹果片色泽的影响,和新鲜苹果片相比,经过柠檬酸浸泡以后,苹果片的色泽变化较小,这可能是因为柠檬酸螯合了多酚氧化酶活性中心的铜离子导致酶活性降低的缘故[19]。经过烫漂处理之后,苹果片L*和a*值均显著降低(P<0.05),b*值变化不大,这可能是加热导致细胞破碎,里面液体流出引起反射率降低的原因[20]。干燥后的样品L*值显著降低,a*和b*值均显著升高,(P<0.05),表明苹果片色泽加深,这可能是非酶褐变反应的结果。值得注意的是,与其他2种烫漂方式相比,微波烫漂的苹果脆片L*最小,a*、b*值最大,色泽最深。此外,苹果片的ΔE大小顺序为热水烫漂<蒸汽烫漂<微波烫漂,说明微波烫漂对苹果片的色泽影响最大,热水烫漂有利于保持苹果片在热风干燥过程中的色泽稳定性。
表1 不同烫漂方式对苹果片颜色的影响
Table 1 Effects of blanching treatments on the color of apple slices

FSWBSBMBWDSDMDL∗73.0±2.2e70.5±1.9d63.2±1.1bc61.5±1.6b53.5±3.9a70.8±3.2d70.2±2.6d63.8±3.4ca∗3.4±0.6c3.6±0.6c0.6±0.1a1.2±0.2a2.6±0.4b5.3±0.8d6.8±0.7e8.2±1.1fb∗25.9±2.0bc24.7±1.7ab24.6±1.9ab23.7±1.4a26.9±3.2c33.1±1.4d33.2±2.2d35.7±1.9eΔE-2.810.311.919.57.88.514.3
注:F-鲜样;S-浸泡;WB-热水烫漂;WD-热水烫漂+热风干燥;SB-蒸汽烫漂;SD-蒸汽烫漂+热风干燥;MB-微波烫漂;MD-微波烫漂+热风干燥;同行带有不同小写字母表示差异显著(P<0.05)(下同)
2.3 烫漂对苹果片维生素C、还原糖及5-HMF含量的影响
通常选择维生素C测定以评估烫漂过程中果蔬营养素的流失程度[5]。图2显示了烫漂方式对苹果片还原糖、维生素C及5-HMF含量的影响,经过3种烫漂方式处理之后,热水烫漂导致维生素C的损失率最大,达到34%,这主要是因为维生素C从苹果浸出或扩散到热烫水中[21],而微波烫漂的苹果片维生素C含量最高,比鲜样高46%。热风干燥后,热水烫漂的苹果脆片维生素C损失最多,损失率为52%,蒸汽烫漂和微波烫漂的维生素C含量跟鲜样无显著性差异(P>0.05),这说明热水烫漂更容易造成维生素C在干燥过程中的损失,蒸汽烫漂和微波烫漂保护维生素C在热风干燥时不被降解。此外,热水烫漂的苹果片中的维生素C由于浸出损失,可能会抑制因其降解而发生的褐变,这与本研究2.2的研究结果相符。
5-HMF和还原糖含量的变化是非酶褐变的重要指标,还原糖含量与褐变程度呈负相关,5-HMF含量与褐变程度呈正相关[22]。由图2-a可知,热水烫漂苹果片的还原糖含量显著低于鲜样(P<0.05),这主要是因为还原糖浸入到水中导致其含量降低所致,同时也是热水烫漂样品色泽变化小的原因之一。
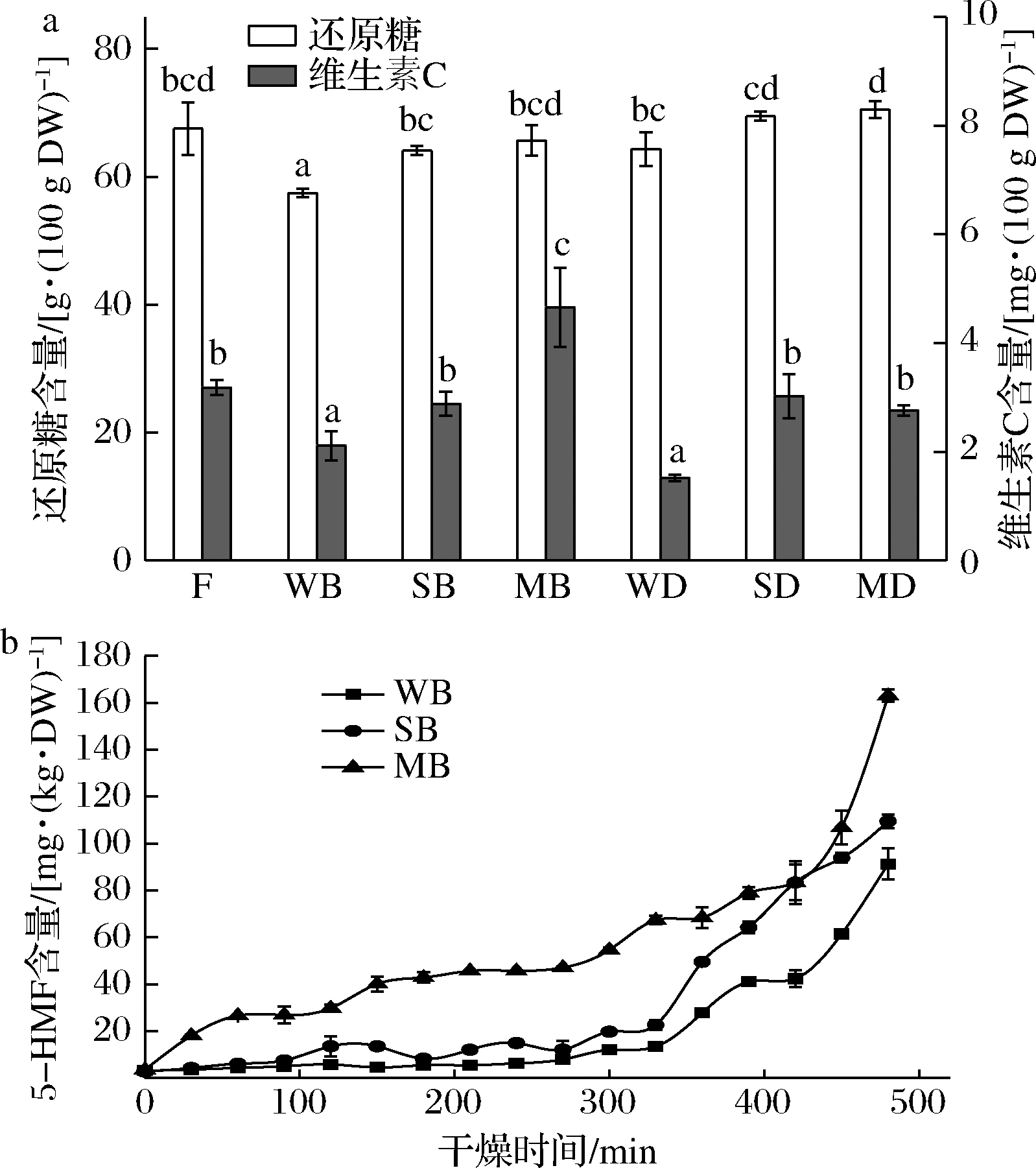
图2 烫漂方式对热风干燥苹果片还原糖、维生素C 及5-HMF含量的影响
Fig.2 Effects of blanching treatments on the contents of reducing sugar,VC and 5-HMF in hot-air drying apple slices a~d带有不同小写字母表示差异显著(P<0.05)(下同)
微波烫漂和蒸汽烫漂的苹果片还原糖含量和鲜样无显著差异(P>0.05),一般来说,干燥过程中,还原糖参加美拉德等非酶褐变反应,其含量会降低[23],但本研究中其含量并没有显著降低,其原因可能是其他大分子糖类物质降解为还原糖[24]。由图2-b可知,干燥初期,5-HMF含量较低,为(2.72±0.01)~(3.44±0.44)mg/kg。干燥时间在0~300 min时,热水烫漂和蒸汽烫漂的苹果片中5-HMF含量缓慢增加,此后随干燥时间的增加,5-HMF呈现指数增长趋势。微波烫漂的苹果片在0~400 min干燥时间内增加速度较快,超过400 min后,5-HMF含量呈指数型增加,在整个干燥过程中始终高于热水烫漂和蒸汽烫漂。这是因为微波烫漂更利于美拉德等非酶褐变反应的底物或中间产物的保留,因此更容易发生非酶褐变反应。
根据苹果片在加工过程中的色泽、还原糖和5-HMF的变化情况,说明相对于热水烫漂和蒸汽烫漂,微波烫漂处理的苹果片在干燥过程中发生了更严重的美拉德等非酶褐变反应,产生更多的褐变物质,因此苹果脆片的L*值最小,a*、b*值最大,ΔE最大,在外观上表现为颜色更暗,偏红色和黄色。
2.4 烫漂对苹果片多酚组成及其抗氧化活性的影响
2.4.1 烫漂对苹果片多酚含量的影响
植物源性食品的抗氧化活性主要来源于其中的酚类物质含量[25]。本实验研究了不同烫漂处理对苹果片多酚含量的影响,其结果如表2所示。与鲜样相比,柠檬酸浸泡处理对苹果片多酚含量没有显著性影响(P>0.05),烫漂的苹果片总多酚的含量大小顺序为微波烫漂>热水烫漂>蒸汽烫漂。热风干燥后,热水烫漂苹果片的总酚含量显著高于鲜样和微波烫漂(P<0.05),可能归因于多酚氧化酶的失活以及结构的转变,从而促进了可提取和不可提取的酚类化合物释放[26]。
表2 不同烫漂方式对苹果片多酚含量的影响 单位:mg GAE/g DW
Table 2 Effect of blanching treatments on polyphenols content of apple slices

多酚FSWBSBMBWDSDMD游离多酚9.10±0.72bc8.18±0.58ab8.22±0.44ab7.69±0.68ab10.58±2.03c8.35±0.09ab8.59±1.12abc6.94±0.52a结合多酚0.56±0.07a0.68±0.17a1.08±0.06a0.72±0.01a0.76±0.11a3.47±0.14c2.11±0.62b1.04±0.16a总多酚9.66±0.65abc8.85±0.45ab9.30±0.50abc8.42±0.68a11.34±1.91cd11.82±0.05d10.70±1.74bcd7.98±0.36a
3种烫漂方式处理后游离多酚含量和鲜样相比无显著性差异,但微波烫漂的游离多酚含量显著高于热水烫漂和蒸汽烫漂。经过干燥之后,热水烫漂和蒸汽烫漂的苹果片游离多酚含量无显著性变化(P>0.05),而微波烫漂的苹果片中游离多酚含量显著降低(P<0.05),可能是微波烫漂导致苹果片在干燥过程中发生了更严重的多酚非酶褐变反应。烫漂处理的苹果片中结合多酚的含量与鲜样差异不显著(P>0.05),热风干燥后的苹果脆片中结合多酚含量均升高,可能是因为加热引起苹果片组织结构改变,释放出更多的结合多酚[27]。
2.4.2 烫漂对苹果片多酚组成的影响
表3显示了不同烫漂方式对游离多酚和结合多酚单体含量的影响。和鲜样相比,浸泡、热水烫漂和蒸汽烫漂对这6种游离多酚的含量影响不显著(P>0.05),微波烫漂后,绿原酸、表儿茶素、鞣花酸的含量分别增加22%、26%、45%,同时儿茶素、阿魏酸和根皮苷的含量也有轻微增加,但是变化不显著(P>0.05)。热风干燥后,热水烫漂和蒸汽烫漂的游离多酚含量和鲜样无显著性差异(P>0.05),而微波烫漂的阿魏酸含量显著增加32%(P<0.05)。经过烫漂和干燥处理之后,绿原酸、鞣花酸以及阿魏酸的含量增加,这可能是因为热处理导致以共价键结合的大分子酚酸物质分解为小分子酚酸物质,使相应多酚单体含量增加[8]。热水烫漂和蒸汽烫漂造成儿茶素和表儿茶素的损失可能是因为高温导致其发生差向异构反应[27]。
苹果片中没有检测出结合态鞣花酸,因为其在在苹果片含量太低。浸泡和蒸汽烫漂对其余结合多酚单体的含量影响不显著(P>0.05),热水烫漂后,绿原酸、表儿茶素、阿魏酸和根皮苷显著增加(P<0.05),其含量分别是鲜样的2.2、4.3、1.9、1.7倍,儿茶素的含量没有显著性变化(P>0.05)。微波烫漂后只有根皮苷的含量显著增加(P<0.05),其他种类的多酚没有显著性变化(P>0.05),故由此可知,烫漂处理有利于保护结合多酚在加工过程中不被破坏。热风干燥后,5种结合多酚含量在热水烫漂、蒸汽烫漂和微波烫漂处理后均显著提高(P<0.05),这和结合多酚总量测定的结果趋势一致(表3),其中热水烫漂中儿茶素和蒸汽烫漂中表儿茶素含量是鲜样的8倍左右。
表3 不同烫漂方式对苹果片中多酚单体含量的影响 单位:mg/100 g DW
Table 3 Effects of blanching treatments on the content of polyphenol monomers in apple slices

多酚FSWBSBMBWDSDMD游离多酚 儿茶素53.4±9.1bc45.6±4.7abc52.2±1.9bc44.0±3.0ab58.3±0.2c43.4±4.2ab34.3±6.9a48.7±2.7bc 绿原酸105.4±12.0ab97.4±12.7a107.5±20.5ab101.4±12.0a128.9±2.3b102.8±3.9a97.2±12.4a111.1±6.8ab 表儿茶素38.0±6.3b31.7±5.6ab33.5±2.5ab31.5±0.8ab48.0±0.6c29.5±0.9ab26.5±1.6a37.8±1.7b 阿魏酸3.4±0.5ab2.9±0.5a2.7±0.1a2.7±0.2a3.7±0.8abc4.0±0.9bc3.0±0.2ab4.5±0.3c 鞣花酸6.5±0.7ab6.3±1.0ab7.1±0.5ab5.5±1.2a9.4±1.3c8.1±0.5bc6.9±1.1ab7.9±1.0bc 根皮苷14.6±2.0ab13.5±2.4ab14.9±0.2ab10.6±2.4a17.3±1.9b14.6±1.9ab11.4±2.6a14.8±1.0ab结合多酚 儿茶素3.19±0.24a3.83±0.59a5.54±0.75a4.90±0.63a4.06±0.39a23.14±2.01d16.74±2.82c8.69±0.09b 绿原酸3.25±0.13a3.84±0.86a7.18±0.30bc4.62±0.08a5.34±1.01ab9.12±0.71c11.74±0.67d13.48±2.55d 表儿茶素1.38±0.37a1.51±0.27a4.42±0.63b2.33±0.17a2.48±0.60a4.77±0.12b7.88±1.53c5.61±0.17b 阿魏酸0.84±0.10ab0.80±0.06ab1.57±0.13de1.14±0.17bc0.66±0.15a1.37±0.26cd2.49±0.15f1.73±0.19e 鞣花酸ndndndndndndndnd 根皮苷3.04±0.40a2.85±0.49a5.02±0.61c3.46±0.35ab4.58±0.56bc5.07±0.07c8.58±1.08d5.27±0.39c
注:nd,未检测到
2.4.3 烫漂对苹果片多酚抗氧化活性的影响
为研究烫漂和干燥过程中苹果片抗氧化活性变化,将样品中游离多酚和结合多酚分别提取出来测定抗氧化活性,其结果见图3所示。所有样品中游离多酚抗氧化活性高于结合多酚。和鲜样相比,浸泡、烫漂以及干燥处理的苹果片中游离多酚的DPPH自由基清除活性显著降低(P<0.05),ABTS阳离子自由基清除活性和还原力没有显著性变化(P>0.05),这主要是因为苹果片经过不同处理之后,其中游离多酚的含量变化小,如表2所示。干燥之后,所有样品中结合多酚抗氧化性均显著高于鲜样(P<0.05),热水烫漂苹果片中结合多酚的DPPH自由基清除活性、ABTS阳离子自由基清除活性和还原力均高于蒸汽烫漂和微波烫漂(P<0.05),其变化趋势与表2中结合多酚变化趋势相似。出现这种现象的原因可能是因为热水烫漂更容易使苹果片组织结构发生转变,释放更多的结合多酚,引起抗氧化活性增强;另一个原因可能是因为热水烫漂容易引起苹果片中多酚的化学变化,导致形成抗氧化活性更高的降解产物[26]。此外,由图3可知,烫漂引起苹果片多酚抗氧化活性变化主要来源于结合多酚。

a-DPPH自由基清除活性;b-ABTS阳离子自由基清除活性;c-FRAP还原能力
图3 烫漂方式对苹果片多酚抗氧化活性的影响
Fig.3 Effects of blanching treatments on antioxidant activity of polyphenols in apple slices 注:游离多酚组带有不同大写字母表示差异显著;结合多酚组带有不同小写字母表示差异显著(P<0.05)
3 结论
本文探讨了不同烫漂方式对苹果脆片在加工过程中的褐变及其相关物质、多酚及抗氧化活性等的影响,以期为苹果脆片品质改善提供一定的参考。研究表明热水烫漂苹果片干燥过程中色泽变化最小、产生的5-HMF含量最少、总酚的含量最高、结合多酚的抗氧化活性最强;微波烫漂的苹果片ΔE以及5-HMF含量最大,但对维生素C等营养成分的保留效果较好;多酚单体的测定表明3种烫漂方式都有利于多酚单体的保留;总之,热水烫漂更有利于减轻苹果片褐变程度以及提高抗氧化活性,而蒸汽烫漂和微波烫漂更有利于营养成分的保留。
[1] TU S H,CHEN L C,HO Y S.An apple a day to prevent cancer formation:Reducing cancer risk with flavonoids[J].Journal of Food and Drug Analysis,2017,25(1):119-124.
[2] NADIAN M H,RAFIEE S,AGHBASHLO M,et al.Continuous real-time monitoring and neural network modeling of apple slices color changes during hot air drying[J].Food and Bioproducts Processing,2015,94:263-274.
[3] ONWUDE D I,HASHIM N,JANIUS R,et al.Non-thermal hybrid drying of fruits and vegetables:A review of current technologies[J].Innovative Food Science & Emerging Technologies,2017,43:223-238.
[4] BASSEY E J,CHENG J H,SUN D W.Novel nonthermal and thermal pretreatments for enhancing drying performance and improving quality of fruits and vegetables[J].Trends in Food Science & Technology,2021,112:137-148.
[5] XIAO H W,PAN Z L,DENG L Z,et al.Recent developments and trends in thermal blanching-A comprehensive review[J].Information Processing in Agriculture,2017,4(2):101-127.
[6] WANG H O,FU Q Q,CHEN S J,et al.Effect of hot-water blanching pretreatment on drying characteristics and product qualities for the novel integrated freeze-drying of apple slices[J].Journal of Food Quality,2018,2018:1-12.
[7] NDIAYE C,XU S Y,WANG Z.Steam blanching effect on polyphenoloxidase,peroxidase and colour of mango(Mangifera indica L.) slices[J].Food Chemistry,2009,113(1):92-95.
[8] FEUMBA DIBANDA R,PANYOO AKDOWA E,RANI P A,et al.Effect of microwave blanching on antioxidant activity,phenolic compounds and browning behaviour of some fruit peelings[J].Food Chemistry,2020,302:125308.
[9] ZIABAKHSH DEYLAMI M,ABDUL RAHMAN R,TAN C P,et al.Effect of blanching on enzyme activity,color changes,anthocyanin stability and extractability of mangosteen pericarp:A kinetic study[J].Journal of Food Engineering,2016,178:12-19.
[10] RUIZ-OJEDA L M,PE AS F J.Comparison study of conventional hot-water and microwave blanching on quality of green beans[J].Innovative Food Science & Emerging Technologies,2013,20:191-197.
AS F J.Comparison study of conventional hot-water and microwave blanching on quality of green beans[J].Innovative Food Science & Emerging Technologies,2013,20:191-197.
[11] RADA-MENDOZA M,OLANO A,VILLAMIEL M.Determination of hydroxymethylfurfural in commercial jams and in fruit-based infant foods[J].Food Chemistry,2002,79(4):513-516.
[12] OKARTER N,LIU C S,SORRELLS M E,et al.Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J].Food Chemistry,2010,119(1):249-257.
[13] SUN J,CHU Y F,WU X Z,et al.Antioxidant and antiproliferative activities of common fruits[J].Journal of Agricultural and Food Chemistry,2002,50(25):7 449-7 454.
[14] LIU X F,ARDO S,BUNNING M,et al.Total phenolic content and DPPH radical scavenging activity of lettuce(Lactuca sativa L.) grown in Colorado[J].LWT-Food Science and Technology,2007,40(3):552-557.
[15] WANG L,BEI Q,WU Y N,et al.Characterization of soluble and insoluble-bound polyphenols from Psidium guajava L.leaves co-fermented with Monascus anka and Bacillus sp.and their bio-activities[J].Journal of Functional Foods,2017,32:149-159.
[16] DU L Q,SHEN Y X,ZHANG X M,et al.Antioxidant-rich phytochemicals in miracle berry(Synsepalum dulcificum) and antioxidant activity of its extracts[J].Food Chemistry,2014,153:279-284.
[17] VISHWANATHAN K H,GIWARI G K,HEBBAR H U.Infrared assisted dry-blanching and hybrid drying of carrot[J].Food and Bioproducts Processing,2013,91(2):89-94.
[18] RASOULI M,KOUSHESH SABA M.Pre-harvest zinc spray impact on enzymatic browning and fruit flesh color changes in two apple cultivars[J].Scientia Horticulturae,2018,240:318-325.
[19] AUGUSTO A,SIMÖES T,PEDROSA R,et al.Evaluation of seaweed extracts functionality as post-harvest treatment for minimally processed Fuji apples[J].Innovative Food Science & Emerging Technologies,2016,33:589-595.
[20] ZHANG X Y,SHI Q L,GAO T,et al.Developing radio frequency blanching process of apple slice[J].Journal of Food Engineering,2020,273:109832.
[21] KACHHADIYA S,KUMAR N,SETH N.Process kinetics on physico-chemical and peroxidase activity for different blanching methods of sweet corn[J].Journal of Food Science and Technology,2018,55(12):4 823-4 832.
[22] WANG C,ZHANG X L,GAO Y,et al.Path analysis of non-enzymatic browning in Dongbei Suancai during storage caused by different fermentation conditions[J].Food Chemistry,2021,335:127620.
[23] WALL M M,GENTRY T S.Carbohydrate composition and color development during drying and roasting of macadamia nuts(Macadamia integrifolia)[J].LWT-Food Science and Technology,2007,40(4):587-593.
[24] SONG C F,CUI Z W,JIN G Y,et al.Effects of four different drying methods on the quality characteristics of peeled litchis(Litchi chinensis Sonn.)[J].Drying Technology,2015,33(5):583-590.
[25] CHOI Y,LEE S M,CHUN J,et al.Influence of heat treatment on the antioxidant activities and polyphenolic compounds of Shiitake(Lentinus edodes) mushroom[J].Food Chemistry,2006,99(2):381-387.
[26] REN F Y,PERUSSELLO C A,ZHANG Z H,et al.Enhancement of phytochemical content and drying efficiency of Onions(Allium cepa L.) through blanching[J].Journal of the Science of Food and Agriculture,2018,98(4):1 300-1 309.
[27] HERAS-RAM REZ M E,QUINTERO-RAMOS A,CAMACHO-D
REZ M E,QUINTERO-RAMOS A,CAMACHO-D VILA A A,et al.Effect of blanching and drying temperature on polyphenolic compound stability and antioxidant capacity of apple pomace[J].Food and Bioprocess Technology,2012,5(6):2 201-2 210.
VILA A A,et al.Effect of blanching and drying temperature on polyphenolic compound stability and antioxidant capacity of apple pomace[J].Food and Bioprocess Technology,2012,5(6):2 201-2 210.