我国已明确提出2030年实现碳达峰,非化石能源占一次能源消费比重达到25%左右的碳减排目标。据报道,纤维素乙醇全生命周期的温室气体排放相对于等热值汽油具有明显的碳减排效应;而在纤维乙醇生产的纤维质原料水解糖化过程中,酶水解法以其条件温和、环境污染小的优势具有巨大的应用潜力。目前运行的纤维乙醇生产多以外购酶为主,发酵生产出来的粗酶液加工成可储存运输的商品酶制剂需要复杂的后加工工艺过程,在增加生产费用的同时还造成一定的损耗,加上包装、运输等费用,显著增加了纤维乙醇生产企业用酶的成本[1-3]。传统的纤维素酶发酵生产多以富含纤维素的微晶纤维素或高诱导性的乳糖为碳源,导致纤维素酶的发酵成本居高不下。本文以玉米秸秆汽爆料为发酵原料,通过就地利用秸秆汽爆预处理料作为培养基碳源生产纤维素酶,并对其进行原位水解糖化,不仅降低了原料成本,同时生产出的纤维素酶具有良好的作用效果,极具推广价值[4]。
1 材料与方法
1.1 实验材料
1.1.1 菌种
工业用里氏木霉菌株(Trichoderma reesei)TGC521,保藏编号CGMCC No.9537,由实验室自主分离选育。
1.1.2 培养基
斜面培养基:马铃薯葡萄糖琼脂培养基。
种子培养基:100 g/L麸皮汁培养基。
基础产酶培养基(g/L):天冠集团玉米秸秆汽爆料30、玉米浆1.5,KH2PO4 1.0、MgSO4 0.5、(NH4)2 SO4 5。
补料培养基(g/L):玉米秸秆汽爆料100、(NH4)2SO4 20。
1.1.3 试剂及仪器
玉米秸秆汽爆料取自河南天冠企业集团有限公司,其他原料均为市购,试剂均为分析纯或优级纯。
SHA-C型恒温振荡器,常州国华电器有限公司;恒温培养振荡器,上海智城分析仪器制造有限公司;XSP-BM-8CA型光学显微镜,上海彼爱姆光学仪器制造有限公司;TDL-5A型低速离心机,上海安亭科学仪器厂;50 L全自动发酵罐,上海国强生化工程装备有限公司。
1.1.4 实验方法
摇瓶实验:从里氏木霉固体斜面培养基上挑取一环孢子,接种于装液量为50 mL/250 mL三角瓶麸皮汁培养基,29 ℃、200 r/min培养24 h。按5%体积分数接种量接种至装液量100 mL/500 mL产酶培养基中,28 ℃,250 r/min培养条件下培养5 d,发酵液离心,取上清液测定纤维素酶活力。
发酵罐实验:50 L发酵罐中装液量35 L,以10%接种量接入菌液,于28~30 ℃,200~400 r/min,以氨水调节pH值维持4.5~4.8条件下培养5~7 d,发酵72 h后每隔12 h取样1次,测定酶活力;发酵过程中将补料培养基以3 500 mL/5 000 mL瓶装量灭菌后置于磁力搅拌器上搅拌,通过蠕动泵将物料泵入发酵罐内,调整蠕动泵流速控制补料量,以达到控制还原糖浓度、溶氧的目的。
初始碳源浓度对产酶的影响:以汽爆秸秆中纤维素含量为标准,设置20、30、40、50 g/L纤维素质量浓度梯度,考察不同初始碳源浓度对发酵产酶的影响。
初始氮源对产酶的影响:选择5 g/L硫酸铵、20 g/L蛋白胨、20 g/L酵母粉、20 g/L玉米浆等有机氮源和无机氮源,考察不同氮源对发酵产酶的影响。
麸皮对产酶的影响:设置2.5、5.0、7.5、10.0 g/L麸皮质量浓度梯度,考察麸皮对发酵产酶的影响。
利用Box-Behnken实验对影响产酶的各因子水平及交互作用进行优化与评价。根据单因素试验结果确定的最佳浓度为中心点,进行4因素3水平的实验。
溶解氧对发酵产酶的影响:通过调整搅拌转速和通气比控制发酵过程相对溶氧在一定范围内,考察溶氧对产酶的影响。
还原糖浓度对产酶的影响:通过补料调整发酵过程中还原糖含量在一定范围内,考察还原糖含量对产酶的影响。
水解实验:设置800 mL酶解体系,秸秆汽爆料为水解对象,固形物含量20%;以秸秆汽爆料为原料生产的纤维素酶为水解酶进行水解糖化,纤维素酶添加量为15 U/g绝干物料;于(50±0.5)℃、pH 4.8~5.0条件下进行水解,初始投料量为全部投料量的1/4,其余3/4分5次投入,初始加入酶的剂量为全部酶添加量的2/3,补料3次后,加入余下的1/3纤维素酶继续酶解。酶解时间48~60 h,测定终产物葡萄糖含量。
1.1.5 分析方法
滤纸酶活力的测定:参照康东亮等[5]方法。
还原糖含量及葡萄糖含量测定:参照龚爱姣[6]的方法。
2 结果与讨论
2.1 发酵培养基优化
2.1.1 碳源浓度对产酶的影响
以蒸汽爆破处理后的玉米秸秆为碳源,以汽爆秸秆中纤维素含量为标准,设置不同纤维素含量浓度梯度,考察碳源浓度对发酵产酶的影响,结果如图1所示。当碳源质量浓度为40 g/L时,酶活力水平最高,达28.24 U/mL。分析认为,碳源浓度低,营养物质缺乏,不利于菌丝生长[7];浓度过高,由于汽爆后的秸秆吸水性强,导致培养基流动性差,发酵过程供氧不足,极易形成大量孢子,亦不利于菌丝正常生长,更不利于产酶[8]。综合考虑,秸秆蒸汽爆破料碳源质量浓度(以纤维素含量计)以40 g/L最为适宜。

图1 碳源浓度对产酶的影响
Fig.1 Effect of carbon source concentration on enzyme production
2.1.2 不同氮源对产酶的影响
不同种类的氮源对产酶有极大的影响[9],如图2所示,以有机氮酵母粉和无机氮(NH4)2SO4为主要氮源时的酶活力最高,这与发酵过程中速效氮源与缓效氮源配合使用利于菌丝生长密切相关,同时也有利于酶的分泌,然而酵母膏价格昂贵不利于规模化生产[10],玉米浆相对便宜,且富含菌丝生长所需氨基酸等,与硫酸铵配合使用更具经济性,最适宜氮源组合为 5 g/L(NH4)2SO4+20 g/L玉米浆。
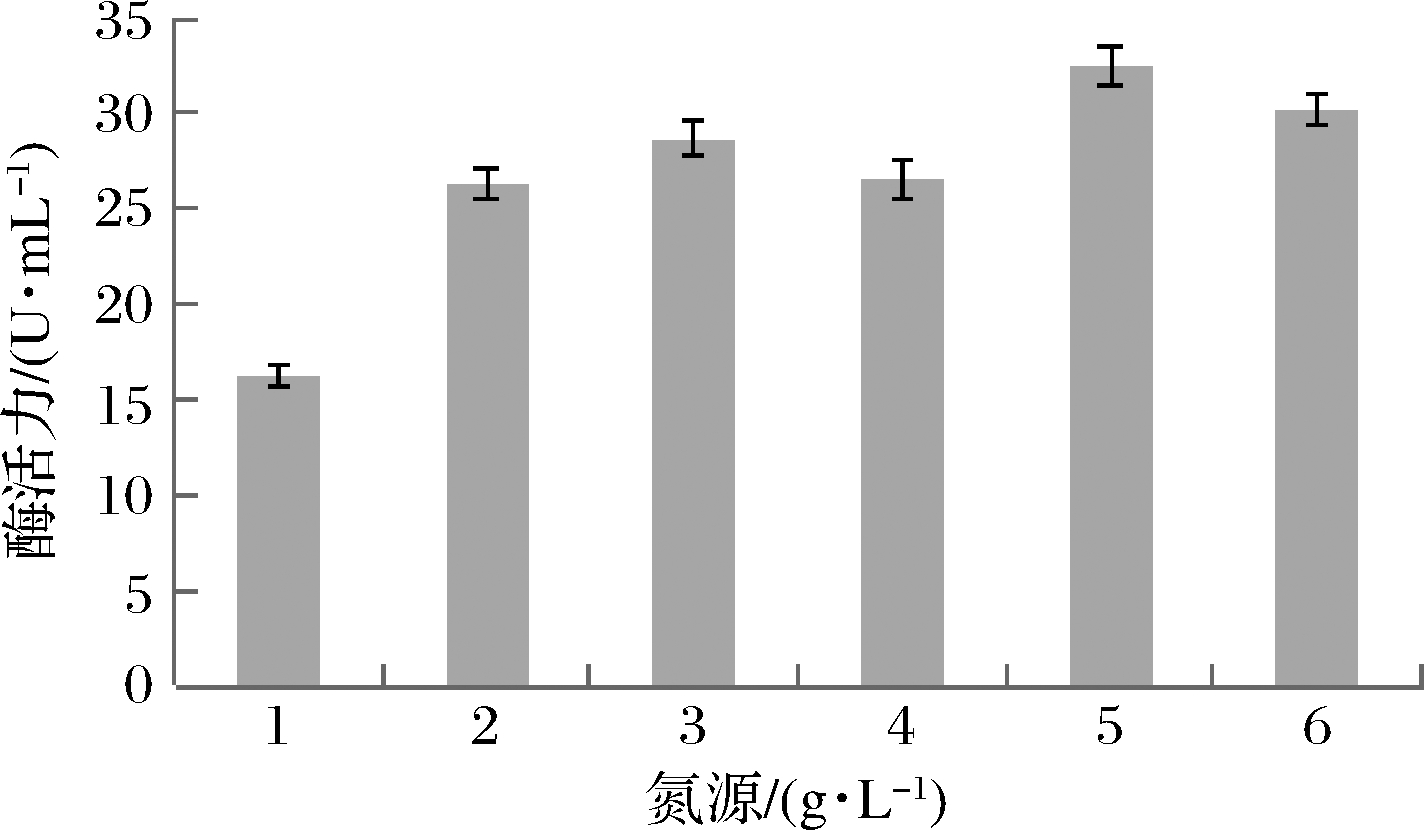
图2 不同氮源对产酶的影响
Fig.2 Effect of different nitrogen sources on enzyme production 注:1-(NH4)2SO4;2-蛋白胨;3-酵母粉;4-玉米浆; 5-(NH4)2SO4+酵母粉;6-(NH4)2SO4+玉米浆
2.1.3 麸皮添加量对产酶的影响
麸皮作为粗纤维原料在丝状真菌发酵产酶过程中,一方面利于菌丝附着成团,避免发酵过程中搅拌的剪切作用对菌丝的破坏,另一方面也为菌丝生长提供必要的营养因子。但麸皮本身含有一定量的淀粉,用量过大增加了发酵液黏度,不利于氧的溶解,易造成发酵初期孢子的大量形成,不利于产酶;麸皮中本身含有糖分,对于木霉菌株产酶可能存在反馈抑制,亦不利于产酶。因而适量的麸皮有助于酶活力的提高[11]。如图3所示,当麸皮质量浓度达到10 g/L时,酶活力最低,这可能与麸皮用量过大,发酵初期菌丝生长过旺,耗氧量大,加之发酵液黏稠,溶氧明显不足,导致孢子过早形成,加速菌丝衰老,最终酶活力低。而麸皮质量浓度为2.5 g/L时又表现出营养因子缺乏,不利于菌丝生长,结果显示5 g/L麸皮添加量对产酶最为有利。

图3 麸皮添加量对产酶的影响
Fig.3 Effect of adding amount of bran on enzyme production
2.1.4 利用实验设计软件Box-Behnken进行培养基组合优化
利用Box-Behnken实验软件对影响产酶水平各因子的水平及交互作用进行优化与评价。以单因素试验确定的最佳浓度为中心点,进行4因素3水平的实验。各因素水平的选取和结果见表1。根据表1结果,以酶活力(Y)为响应值,利用Design-Expert.V 8.0 软件对实验数据进行回归拟合,得到酶活力Y关于X1、X2、X3、X4这4个显著因素的二次多项回归模型:Y=-79.97 + 4.56X1 +0.68X2 + 0.87X3+2.20X4+0.01X1X2+0.008X1X3-0.034X1X4-0.011X1X3-0.026X1X4+0.067X3X4-0.06X12-0.072X22-0.020X32-0.090X42,对结果进行二次响应方差分析得到的结果见表2。
由表2回归方程系数显著性检验可知,各试验因素对响应值的影响不是简单的线性关系,而且4个因素之间存在交互作用,各交互项交互作用不显著。模型P<0.001,表明该模型具有较高的显著性;而模型的失拟项不显著(P=0.520 5),因此可利用该模型对酶活力进行模拟和预测。
表1 响应面实验设计及结果
Table 1 Response surface experiment design and result
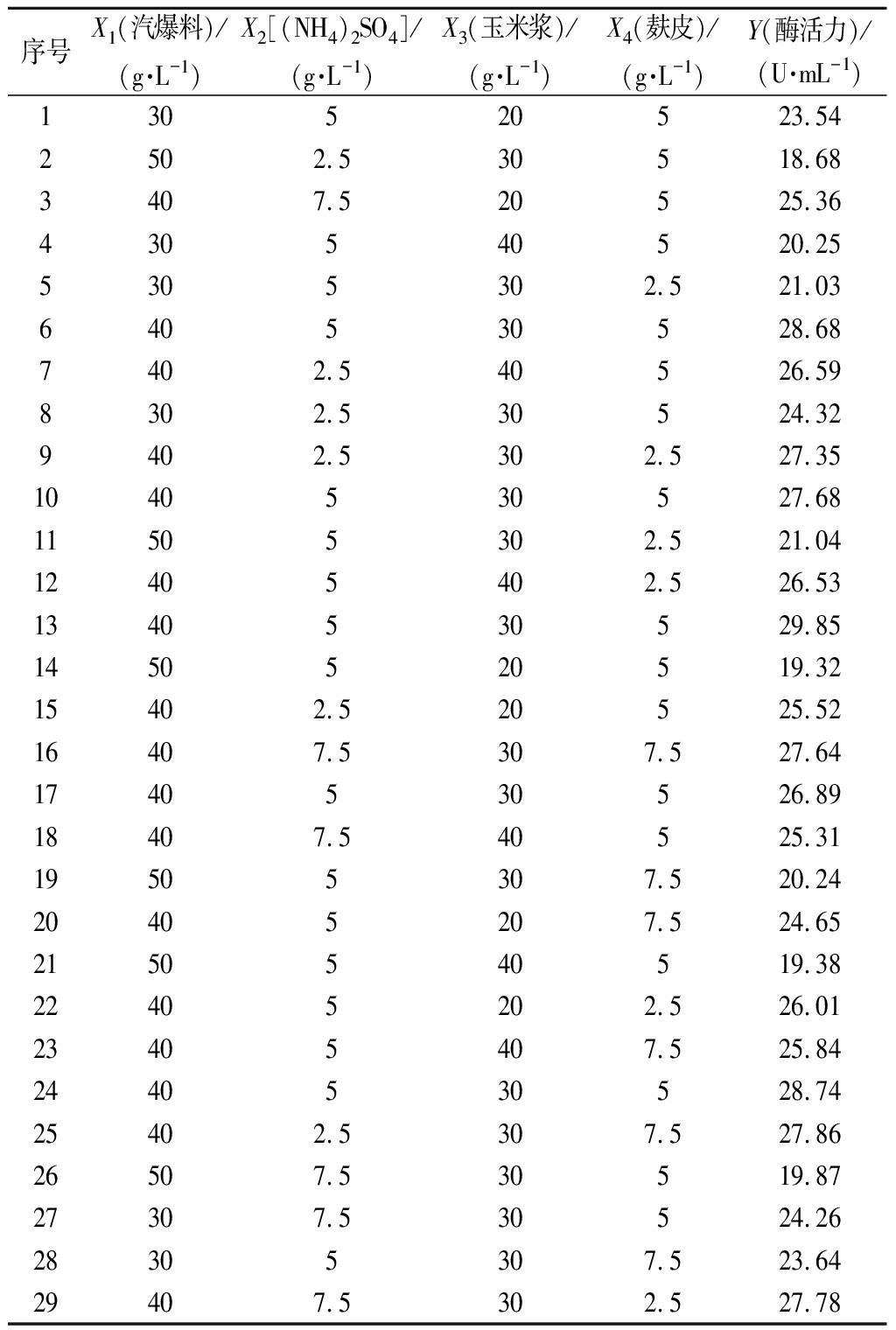
序号X1(汽爆料)/(g·L-1)X2[(NH4)2SO4]/(g·L-1)X3(玉米浆)/(g·L-1)X4(麸皮)/(g·L-1)Y(酶活力)/(U·mL-1)130520523.542502.530518.683407.520525.36430540520.255305302.521.03640530528.687402.540526.598302.530524.329402.5302.527.351040530527.6811505302.521.0412405402.526.531340530529.851450520519.3215402.520525.5216407.5307.527.641740530526.8918407.540525.3119505307.520.2420405207.524.652150540519.3822405202.526.0123405407.525.842440530528.7425402.5307.527.8626507.530519.8727307.530524.2628305307.523.6429407.5302.527.78
表2 响应面方差分析
Table 2 Response surface variance analysis
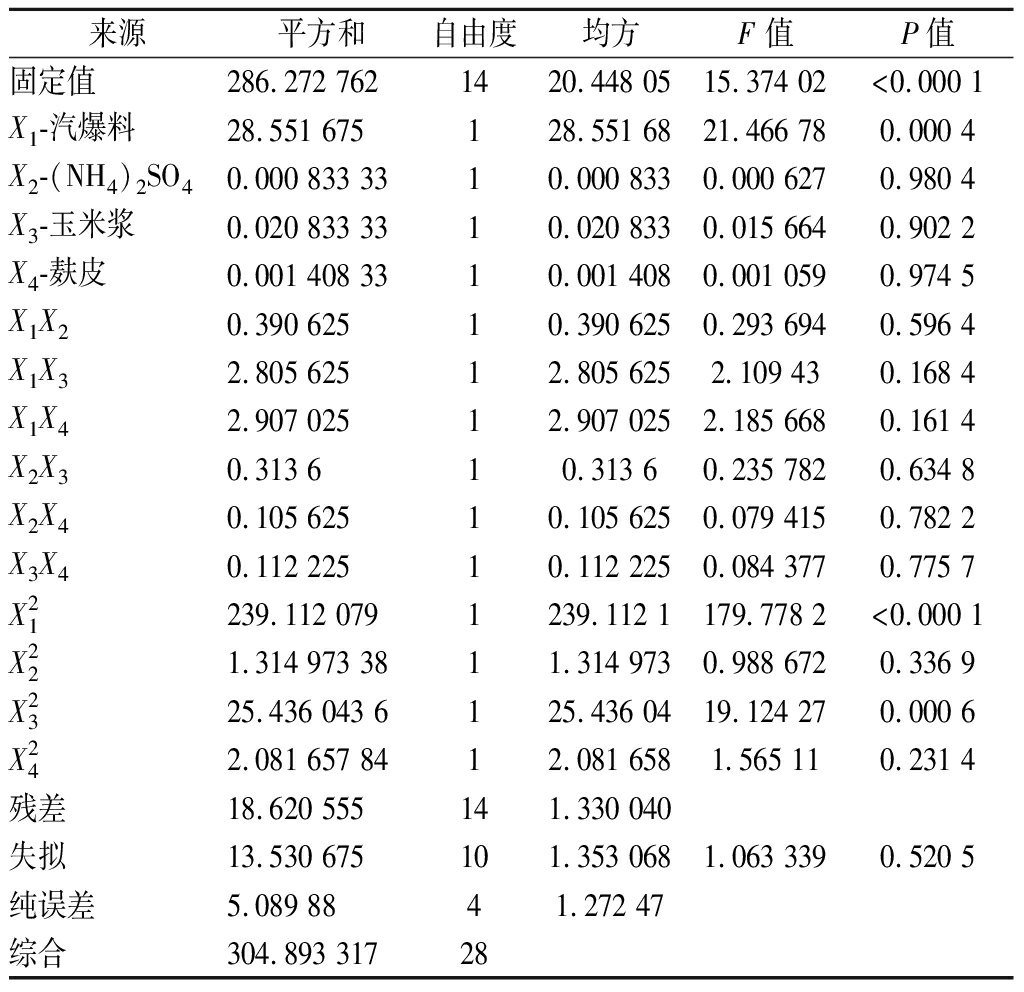
来源平方和自由度均方F 值P值固定值286.272 7621420.448 0515.374 02<0.000 1X1-汽爆料28.551 675128.551 6821.466 780.000 4X2-(NH4)2SO40.000 833 3310.000 8330.000 6270.980 4X3-玉米浆0.020 833 3310.020 8330.015 6640.902 2X4-麸皮0.001 408 3310.001 4080.001 0590.974 5X1X20.390 62510.390 6250.293 6940.596 4X1X32.805 62512.805 6252.109 430.168 4X1X42.907 02512.907 0252.185 6680.161 4X2X30.313 610.313 60.235 7820.634 8X2X40.105 62510.105 6250.079 4150.782 2X3X40.112 22510.112 2250.084 3770.775 7X21239.112 0791239.112 1179.778 2<0.000 1X221.314 973 3811.314 9730.988 6720.336 9X2325.436 043 6125.436 0419.124 270.000 6X242.081 657 8412.081 6581.565 110.231 4残差18.620 555141.330 040失拟13.530 675101.353 0681.063 3390.520 5纯误差5.089 8841.272 47综合304.893 31728
2.1.5 响应面分析
根据回归模型绘制交互作用等高线图和曲面图(图4)。响应面图形开口均朝下,玉米秸秆汽爆料、(NH4)2SO4浓度、玉米浆浓度和麸皮浓度均存在极值点,响应面覆盖了最大值所在区域。由图4-a、图4-b可知,在所设计的试验条件范围内,随着汽爆料浓度、(NH4)2SO4浓度及汽爆料浓度、玉米浆浓度的不断增大,发酵酶活力均呈先升后降趋势,当汽爆料质量浓度为40 g/L、(NH4)2SO4质量浓度为5.0 g/L、当玉米浆质量浓度为30 g/L酶活力水平有最大值。由图4-c、图4-d可以看出,当麸皮质量浓度为5.0 g/L时,酶活力水平有最大值。
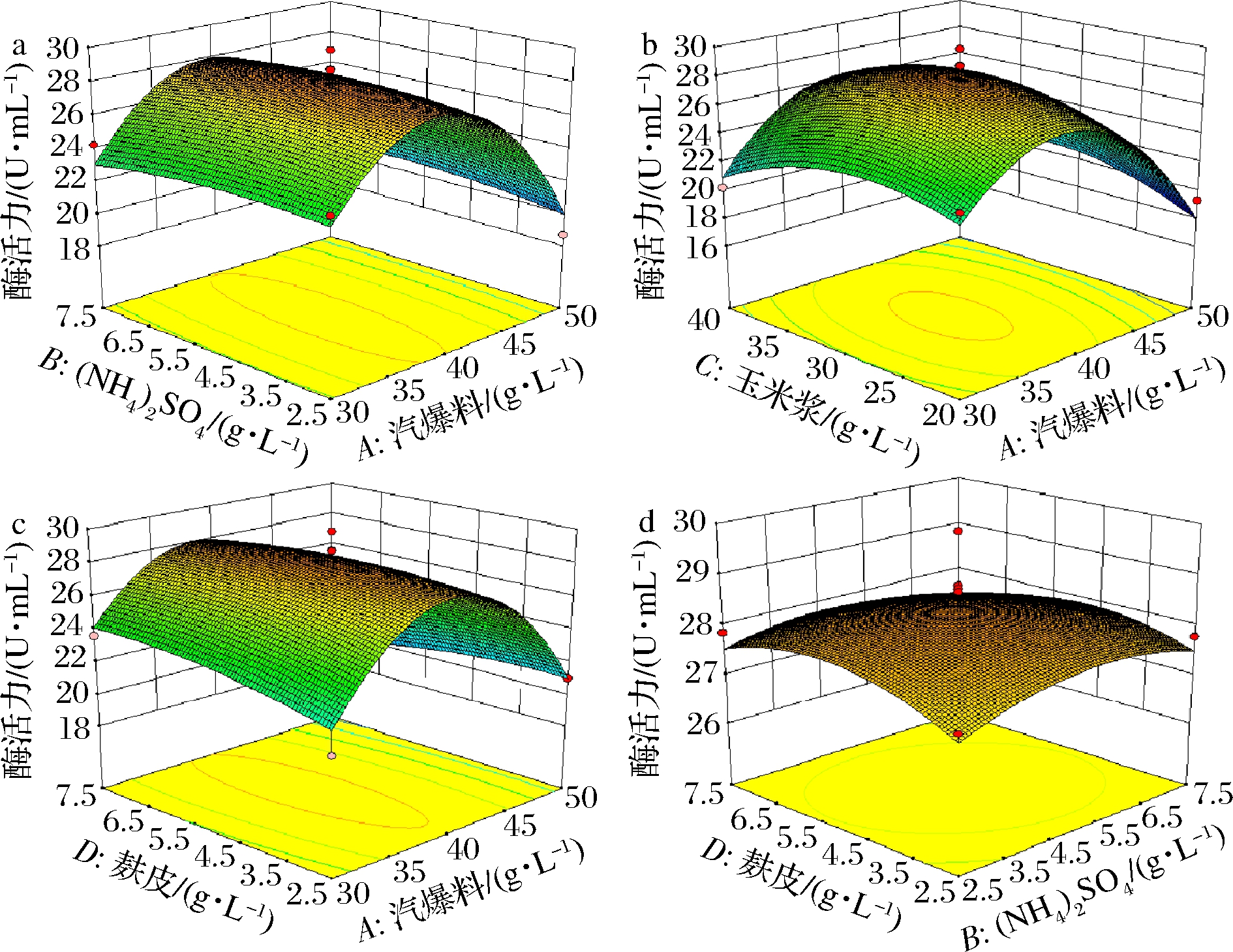
a-汽爆料与(NH4)2SO4浓度交互作用;b-汽爆料与玉米浆浓度交互作用; c-汽爆料与麸皮浓度交互作用;d-(NH4)2SO4浓度与麸皮浓度交互作用
图4 各因素交互作用
Fig.4 Diagram of interaction between diffirent factors
2.1.6 回归模型的验证
根据 Design-Expert 软件预测,根据最大响应值所对应的因素条件确定最佳培养条件为:玉米秸秆汽爆料38.6 g/L、(NH4)2SO4 4.8 g/L、玉米浆质量浓度29.7 g/L、麸皮质量浓度5.3 g/L;在该条件下模型预测酶活力最大值为28.50 U/mL。采用上述最优培养基重复实验,酶活力均值为28.76 U/mL,实验值与模型预测值相符,说明该模型能准确预测实际发酵情况。
2.2 培养条件对产酶的影响
2.2.1 溶氧对产酶的影响
真菌纤维素酶发酵产酶是一个典型的好氧过程,其产酶和菌丝生长对氧需求量极大,溶氧不足菌丝生长缓慢,且极易形成孢子,加速菌丝衰老死亡,酶活力迅速下降。溶氧过多则易造成菌丝旺长,消耗大量营养及能量,反而不利于产酶[12]。实验结果如图5所示,当发酵过程溶氧相对值控制在40%~50%,酶发酵水平最低,镜检表明,在高溶氧条件下菌丝密度大,菌丝细长,发酵过程产酶总体一直处于较低水平;当降低发酵过程溶氧控制范围后,发酵产酶活力水平呈升高趋势,但当溶氧控制范围降至10%~20%,发酵中期即有大量孢子形成,发酵酶活力增加幅度降低,表现为菌丝发酵产酶后劲不足。当溶氧在20%~30%或30%~40%时,菌丝生长密度合适,菌丝粗壮成团,分枝多,酶活力水平高。综合考虑发酵能耗及成本效应,溶氧控制以20%~30%最为适宜。
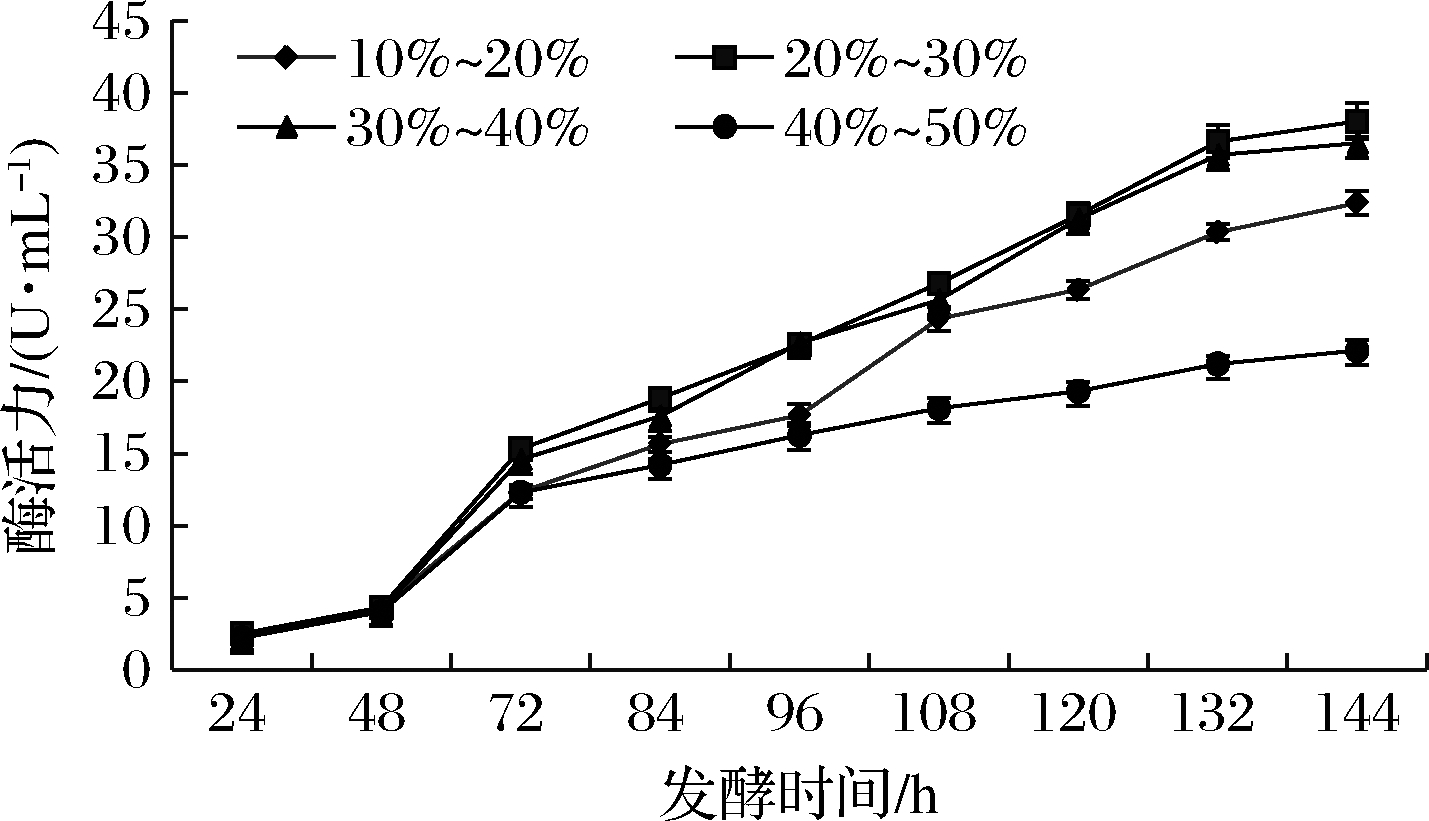
图5 不同溶氧控制范围对产酶的影响
Fig.5 Influence of different dissolved oxygen control ranges on enzyme production
2.2.2 还原糖浓度对产酶的影响
纤维素酶是诱导酶,必须在诱导剂的作用下才能大量表达。不同的诱导剂对里氏木霉表达纤维素酶的诱导效果存在差异,诱导里氏木霉产纤维素酶的物质主要是一些糖类,包括低聚糖、寡糖和单糖等。其中以槐糖的诱导效果最好,纤维素次之,乳糖和纤维二糖也有较好的诱导效果。由于纯纤维素价格高,实际应用中受到产酶成本的限制,不宜在规模化生产中使用。而秸秆经过蒸汽爆破处理后,物料中纤维素可作为诱导物诱导产酶,同时发酵过程中以分批补料方式不断提供纤维素可实现持续诱导产酶,在增加碳源的同时提供诱导物可大大提高产酶活力[13-14]。补料过程中必然造成发酵液中还原糖的变化,如图6所示,还原糖浓度过高则菌丝旺长,反馈抑制增强,不利于产酶;浓度过低则导致营养不足,菌丝生长缓慢,极易衰老死亡;实验发现,通过补料控制发酵过程还原糖含量,使得菌丝处于“半饥饿”状态最利于产酶;比较分析认为,当发酵液中还原糖质量浓度控制在2.0~3.0 g/L时,发酵产酶酶活力水平最高。

图6 不同还原糖浓度对产酶的影响
Fig.6 Influence of different reducing sugar concentrations on enzyme production
2.3 纤维素酶原位水解糖化的应用
以玉米秸秆蒸汽爆破物料为碳源生产的纤维素酶粗酶液用于蒸汽爆破料的原位水解糖化实验结果(表3)与文献报到一致[15]。在酶解条件为50 ℃、pH 4.8,以15 U/g绝干汽爆物料添加量,附加一定量的木聚糖酶,在固形物含量为200 g/L酶解液中,葡萄糖含量可达75 g/L,纤维素转化率可达85%以上,该纤维素酶作用效果极佳,兼具产业化应用的成本优势和性能优势。
表3 酶解作用结果
Table 3 Results of enzymatic hydrolysis

批次酶解液固形物含量/[g·(100 mL)-1]葡萄糖含量/(g·L-1)纤维素转化率/%120.2174.784.89220.2375.285.45320.4375.385.57420.1475.285.45520.4275.185.34619.8274.384.43
3 结论
通过对纤维素酶原位生产工艺发酵培养基优化的研究表明:对产酶影响最大的因素为玉米秸秆汽爆料、其次为玉米浆,这与菌株生长及产酶特性密切相关,经验证酶活力可达28.76 U/mL。确定最佳培养基配方为:汽爆料质量浓度38.6 g/L,(NH4)2SO4 4.8 g/L,玉米浆质量浓度29.7 g/L,麸皮质量浓度5.3 g/L;KH2PO4 1.0 g/L、MgSO4 0.5 g/L。最佳发酵工艺为:发酵相对溶氧控制范围20%~30%;还原糖含量2.0~3.0 g/L;发酵时间144 h,不同发酵批次下纤维素酶活力水平保持在35~39 U/mL。
以该发酵工艺生产的纤维素酶原位水解糖化效果显示,在低酶载量条件下可实现纤维素转化率达85%以上。
[1] 曲音波,赵建,刘国栋.纤维素乙醇工业化的必由之路:组合生物精炼[J].生物产业技术,2018(4):20-24.
QU Y B,ZHAO J,LIU G D.The only way to industrialization of cellulosic ethanol:Integrated biorefinery[J].Biotechnology & Business,2018(4):20-24.
[2] LIU C G,XIAO Y,XIA X X,et al.Cellulosic ethanol production:Progress,challenges and strategies for solutions[J].Biotechnology Advances,2019,37(3):491-504.
[3] 王岚,赵启红,陈洪章.规模化纤维素乙醇的困境与出路[J].高科技与产业化,2018(6):55-61.
WANG L,ZHAO Q H,CHEN H Z.Dilemma and outlet of large-scale cellulosic ethanol[J].High-Technology & Commercialization,2018(6):55-61
[4] 文晓霞,白光剑,李韬,等.液态发酵原位酶解糖化水稻秸秆工艺优化[J].食品与发酵工业,2021,47(4):166-172;181.
WEN X X,BAI G J,LI T,et al.Liquid fermentation and in situ enzymatic hydrolysis saccharification of rice straw[J].Food and Fermentation Industries,2021,47(4):166-172;181.
[5] 康东亮,吕世峰,阎振丽,等.里氏木霉R3液体深层发酵产纤维素酶工艺优化研究[J].河南工业大学学报(自然科学版),2006,27(5):47-50;54.
KANG D L,LYU S F,YAN Z L,et al.Study on the technics optimization for submerged fermentation of cellulase with Trichoderma reesei r3[J].Journal of Henan University of Technology(Natural Science Edition),2006,27(5):47-50;54.
[6] 龚爱姣.绿色木霉高产木聚糖酶诱变菌株的筛选及发酵产酶中试条件研究[D].南阳:南阳师范学院,2019.
GONG A J.Screening and pilot conditions of high-yield xylanase mutagenized strains of Trichoderma viride[D].Nanyanga:Nanyang Normal University,2019.
[7] 吕雄,赵晶,夏黎明.碳源对里氏木霉纤维素酶诱导合成的影响[J].食品与发酵工业,2010,36(3):1-4.
LYU X,ZHAO J,XIA L M.Effects of different carbon sources on cellulase production by Trichoderma reesei[J].Food and Fermentation Industries,2010,36(3):1-4.
[8] 苏存生,贺建龙,熊鹏,等.里氏木霉Rut-C30发酵热水预处理稻草产纤维素酶[J].食品与发酵工业,2016,42(10):14-22.
SU C S,HE J L,XIONG P,et al.Cellulase production from the hot water pretreated rice straw by Trichoderma reesei Rut-C30[J].Food and Fermentation Industries,2016,42(10):14-22.
[9] 余培铠,刘刚,栗荷天,等.Thielavia terrestris产纤维素酶液态发酵条件的优化[J].食品与发酵工业,2014,40(1):91-95.
YU P K,LIU G,LI H T,et al.Optimization of liquid fermentation conditions for cellulase production by Thielavia terrestris[J].Food and Fermentation Industries,2014,40(1):91-95.
[10] JIN E Z,MENDIS G P,SUTHERLAND J W.Integrated sustainability assessment for a bioenergy system:A system dynamics model of switchgrass for cellulosic ethanol production in the US Midwest[J].Journal of Cleaner Production,2019,234:503-520.
[11] KARAGOZ P,BILL R M,OZKAN M.Lignocellulosic ethanol production:Evaluation of new approaches,cell immobilization and reactor configurations[J].Renewable Energy,2019,143:741-752.
[12] 陈贞,林俊帆,刘庆庆,等.响应面法优化纤维素酶对黑米的酶解工艺[J].食品科技,2019,44(6):221-226.
CHEN Z,LIN J F,LIU Q Q,et al.Optimization of cellulase enzymatic hydrolysis of black rice by response surface methodology[J].Food Science and Technology,2019,44(6):221-226.
[13] 傅佑丽,石家骥,韩龙.微生物中纤维素酶的研究进展[J].曲阜师范大学学报(自然科学版),2019,45(4):91-95.
FU Y L,SHI J J,HAN L.Research progress of cellulase in microorganisms[J].Journal of Qufu Normal University (Natural Science),2019,45(4):91-95.
[14] 张晓月.可溶诱导物诱导里氏木霉纤维素酶合成机理及菌株改良[D].大连:大连理工大学,2018.
ZHANG X Y.Mechanism underlying cellulases synthesis induced by soluble inducers in Trichoderma reesei and improvement of its cellulolytic enzyme production[D].Dalian:Dalian University of Technology,2018.
[15] 林燕,张伟,华鑫怡,等.纤维素酶水解能力的影响因素及纤维素结构变化研究[J].食品与发酵工业,2012,38(4):39-43.
LIN Y,ZHANG W,HUA X Y,et al.Study on the factors affecting enzymatic hydrolysis capability and the structural changes of cellulose[J].Food and Fermentation Industries,2012,38(4):39-43.