农业废弃物属于木质纤维原料(lignocellulosic biomass,LCB),水解过程是厌氧消化(anaerobic digesters,AD)的限速步骤[1]。为此,大多数工艺通过两相AD提高沼气生产效率[2]。然而,WU等[3]发现底物水解易受高浓度酸化产物的抑制。LI等[4]和DALKILIC等[5]也报道了类似的结果:过量有机酸不仅反馈抑制酸化相中有机酸和氨氮,而且还会破坏产甲烷相的最适条件。因此,有必要对两相AD工艺进行优化以提高原料适应性和工程稳定性操作。在酸化过程中适当通风可以显著提高木质纤维素的降解效率,增加有机酸的产生,同时加速底物分解,提高产沼气效率,并且还可减少有毒气体,如H2S和NH3的产生[6-7]。为了提高降解效率,通常通过物理、化学或者生物强化方法对原料进行预处理,以提高沼气产率[8]。然而,苛刻的预处理条件和化学试剂的使用导致机械能耗和投资成本的增加,而且复杂的处理过程限制了项目的进一步应用。近年来,农业废弃物特别是干秸秆的微贮预处理技术已成为研究的热点,其基本原理是在厌氧条件下利用乳酸菌(lactic acid bacteria,LAB)生物转化可溶性碳水化合物产生大量有机酸,降低原料pH值,杀死或抑制其他有害细菌,可达到长期保存和预处理的目的[9]。干秸秆原料经过微贮处理后,干物质损失可低至1%~5%,可生化降解性能得到提高[10],主要是因为非结构碳水化合物的降解降低了LCB的生物抗性[11]。微贮处理可以解决秸秆大规模收集、保存和预处理的问题,与传统物理和化学方法相比,该技术不需要消耗大量能量和回收化学试剂,也不会在反应体系中产生抑制剂。由于在微贮预处理过程中产生大量有机酸,微贮处理过程可以取代两相AD的酸化过程,从而实现单相AD。
在AD过程中,原料的特性决定了AD时间和沼气产量[12]。例如,单一LCB的AD存在碳氮不平衡的问题,由于LCB的C/N比接近70∶1,而AD的最佳C/N比为(20∶1)~(30∶1)[13];由于猪粪原料C/N比低,AD过程中容易产生氨氮抑制,使得难以达到AD微生物群所需的最佳生长状态[14];剩余污泥(excess sludge,ES)的AD过程水解预处理是一个限制步骤,ES细胞壁结构抑制细胞内可降解物质的水解,常规污泥消化通常需要较长的停留时间[15]。为解决上述问题,越来越多的AD过程采用多种原料复配进行厌氧共消化,不仅可以有效调节单一原料的营养不平衡问题,还可以提高沼气转化效率[16]。
本文以干玉米秸秆(dry corn stover,DCS)为研究对象,深入研究了不同微生物厌氧预处理DCS过程中微生物的动态变化及DCS成分改变情况。在此基础上,比较分析了DCS两相AD(微好氧酸化+厌氧消化)与微贮DCS单相AD沼气产量的差异。最后,研究了微贮DCS和废弃物(猪粪或ES)单相厌氧共消化沼气发酵效率,以探索农业废弃物资源利用的高效途径。
1 材料与方法
1.1 原料
DCS由河南天冠企业集团有限公司提供,成分分析结果为:总固形物(total solid,TS):87.52%;挥发性固体(volatile solid,VS):82.19%;纤维素[以葡聚糖(glucan)含量计]:33.82%;半纤维素[以木聚糖(xylan)含量计]:24.99%;总氮(total nitrogen,TN):0.94%;灰分:2.24%。实验中用到的微生物:粪链球菌、发酵乳杆菌、干酪乳杆菌、枯草芽孢杆菌、巨大芽孢杆菌和纳豆芽孢杆菌等由本实验室保藏。
ES由郑州市五龙口污水处理厂提供(TS:32.51%;VS:15.51%;纤维素:2.80%;半纤维素:2.07%;TN:4.16%;灰分:17.00%),实验室冷冻保存,使用前在85 ℃水浴条件下保温1 h后加入发酵装置中进行厌氧消化。
猪粪(pig manure,PM):由南阳市卧龙牧原养殖有限公司提供(TS:31.02%;VS:19.53%;纤维素:11.93%;半纤维素:12.42%;TN:1.90%;灰分:11.49%),实验室冷冻保存,使用前在85 ℃水浴条件下保温1 h后加入发酵装置中进行厌氧消化。
1.2 实验方法
1.2.1 干玉米秸秆微贮
微贮容器采用玻璃坛子。微贮过程如图1所示,活化种子液倒入1.5 kg DCS中装入坛子,控制最终含水量为30%。微贮实验分3组:芽孢杆菌组DCS-S1(枯草芽孢杆菌∶巨大芽孢杆菌∶纳豆芽孢杆菌=1∶1∶1)、混合组DCS-S2(粪链球菌∶发酵乳杆菌∶干酪乳杆菌∶枯草芽孢杆菌∶巨大芽孢杆菌∶纳豆芽孢杆菌=1∶1∶1∶1∶1∶1)和乳酸菌组DCS-S3(粪链球菌∶发酵乳杆菌∶干酪乳杆菌=1∶1∶1),每个微生物的接种量为1.0×106个/g DCS。装填完毕后盖上玻璃碗,在坛子顶部加入适量水密封达到厌氧发酵的目的。发酵时间为28 d,每隔7 d取样进行分析测定。
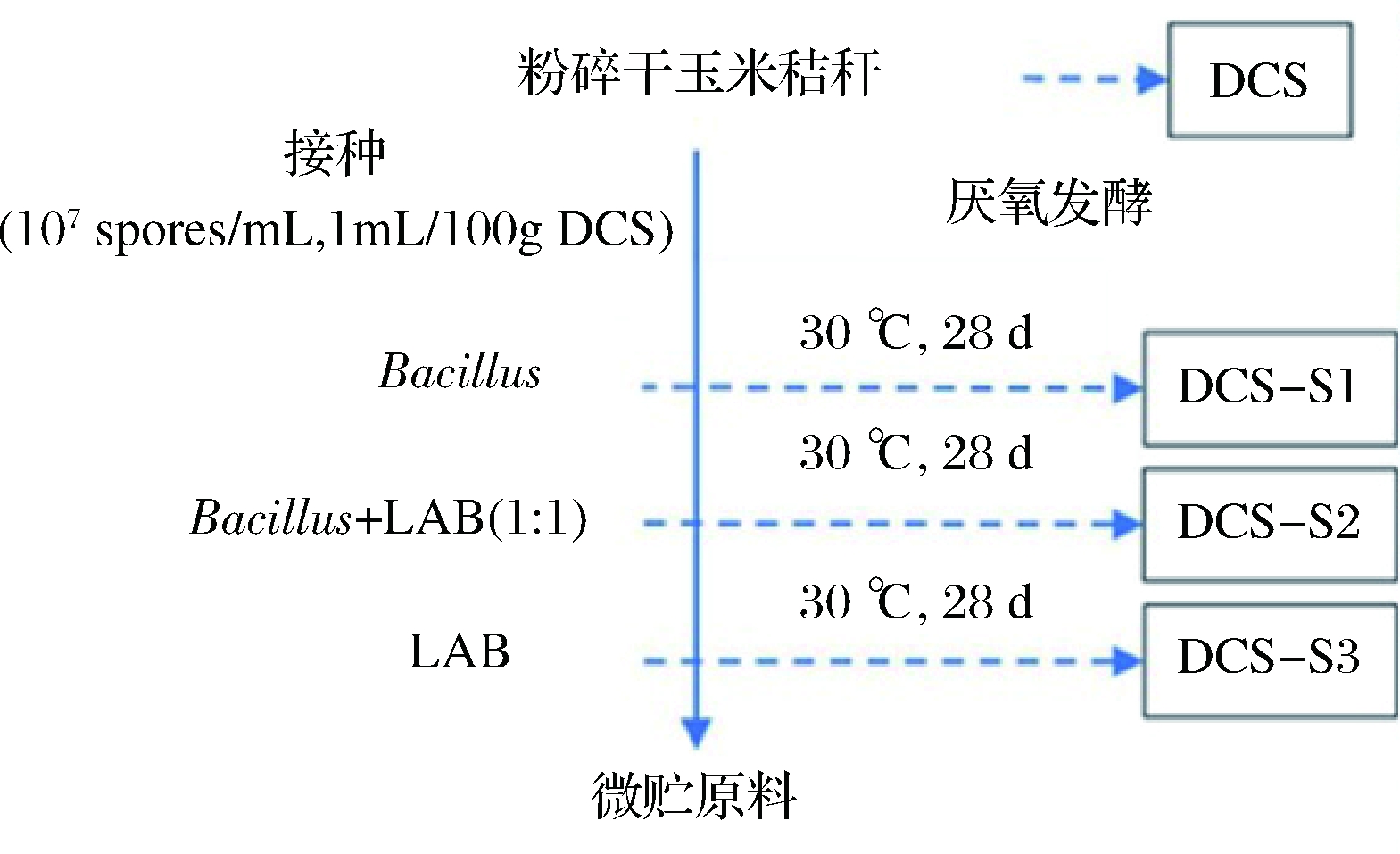
图1 干玉米秸秆微贮过程及取样时间点设置
Fig.1 The production diagram of silage used in this study with the sampling points indicated
1.2.2 厌氧消化
本研究共设置2种AD工艺(图2-a和2-b):两相(微好氧酸化相+甲烷相)AD和单相AD。
两相AD酸化相(图2-a):本实验采用自制微好氧水解酸化装置(酸化罐采用密闭装置,过程中通入空气,采用溶氧电极监控以维持反应体系溶氧浓度接近1 mg/L),反应器有效容器为5 L。实验原料为DCS,酸化相固形物浓度为8% TS,采用AD罐放出的过滤沼液配料。每天间歇机械搅拌(50 r/min 开启20 min,关闭20 min,循环)使反应体系混合均匀。酸化相温度为(35±2)℃,周期为2 d(每一批次加料120 g绝干原料)。酸化结束后,取出酸化液总量80%加入AD罐发酵沼气,余下20%作为下一批次酸化接种物。
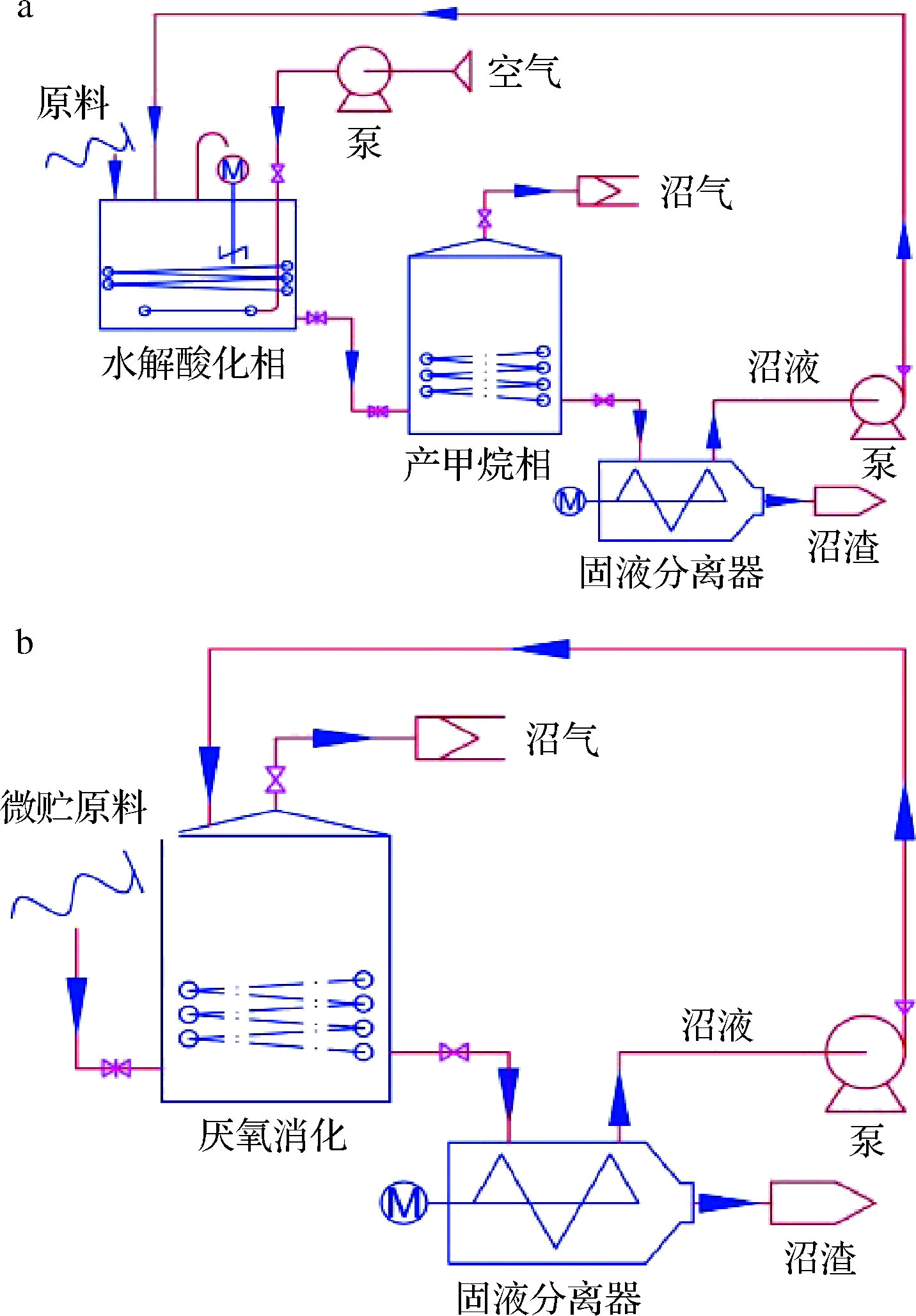
a-两相AD;b-单相AD
图2 两相AD和单相AD工艺流程图
Fig.2 Process flow charts of two-phase AD and single-phase AD
两相AD甲烷相(图2-a):本实验厌氧消化反应器为实验室自制反应装置,反应器体积为100 L,反应器内温度为(45±2)℃,整个消化试验采用半连续方式。每隔2 d加入酸化液,放出等量沼液,采用100目筛网过滤后液体用于酸化配料(沼渣烘干)。每日通过空气流量计读数记录沼气产量,并定时取样进行CH4含量分析。
单相AD(图2-b):本实验厌氧消化反应器为实验室自制反应装置,反应器体积为100 L,反应器内温度为(45±2)℃,整个消化试验采用半连续方式。每隔2 d加入微贮DCS[或微贮DCS+ES/PM混合物进行厌氧共消化,每一批次加料120 g绝干物料。其中,微贮DCS∶ES=6∶1(绝干质量比);微贮DCS∶PM=4∶1(绝干质量比),以平衡混合原料C/N],提前放出等量沼液,采用100目筛网过滤后液体用于配料(沼渣烘干),固形物浓度为8% TS。每日通过空气流量计读数记录沼气产量,并定时取样进行CH4含量分析。
1.3 分析方法
1.3.1 DNA提取、基因测序及序列分析
DNA具体提取过程参照OMEGA试剂盒Soil DNA Kit的使用说明书。通过Qubit3.0荧光计监测DNA浓度。文库制备和上机测序委托苏州金唯智生物科技有限公司完成。
1.3.2 常规指标测定及分析方法
干物质的测定采用105 ℃烘干3 h至恒重,差重法测定;TS的测定采用105 ℃烘干24 h,差重法测定;VS的测定采用550 ℃灼烧4 h,差重法测定;TN采用微量凯氏定氮法测定;纤维素和半纤维素采用美国国家重点实验室(National Renewable Energy Laboratory,NREL)提供的标准方法测定;将原料与水料液比1∶10(g∶mL)于100 r/min 振荡30 min,滤液用于pH 值、有机酸和游离糖含量测定;有机酸和游离糖含量采用高效液相色谱仪(Agilent technologies 1260 Infinity)分析检测;CH4和CO2含量采用气相色谱仪分析检测(GC7980)[12]。
TS产气率计算如公式(1)所示:
TS产气率![]()
(1)
式中:m,原料质量,g;w(TS),预处理原料的总固体质量分数,%;V,累积产气量,mL。
2 结果与分析
2.1 微贮干玉米秸秆成分分析
微贮样品的pH值、发酵时间和乳酸含量可作为微贮是否成功的重要指标[17]。由于发酵过程中乳酸和乙酸的产生,微贮样品pH值呈现逐渐降低的趋势(图3-a),特别是DCS-S2在发酵28 d后pH值为4.08,可抑制发酵过程不良微生物的代谢活动[18]。微贮样品中游离葡萄糖含量较低,说明在厌氧发酵过程中游离葡萄糖被微生物代谢产生乙酸和乳酸等有机酸类物质[19]。

a-pH值;b-乳酸浓度;c-乙酸浓度;d-木糖浓度
图3 DCS微贮过程物化性质分析
Fig.3 Physicochemical changes in DCS samples
芽孢杆菌发酵组DCS-S1样品中乙酸含量高,乳酸发酵组DCS-S3样品中乳酸含量高(图3-b、图3-c)。发酵28 d后,DCS-S3中乳酸和乙酸的含量分别为3.60%和0.45%。DCS微贮过程中木糖含量的提高(图3-d)表明原料半纤维素发生了降解。据报道,半纤维素水解可提高木质纤维素生化降解效率[20],因此,微贮可作为一种潜在的纤维原料预处理方法。对DCS进行微贮预处理,需要28 d才能达到稳定,因此本文采用微贮28 d的样品进行后续AD实验。
目前,由于季节性因素,生物质工厂收集到秸秆的存储方式一般为干储存。在干储存过程中要综合考虑降雨量、平均主导风向等气象因素,不过室外储存过程干物质损失大,需要较大的场地堆放秸秆,秸秆容易霉变和起火[21]。因此采用温和条件下的生物预处理方式(微贮)是十分必要的。由表1可知,微贮对结构性碳水化合物纤维素(以葡聚糖计)含量影响较小,说明微贮过程可以有效保存DCS。半纤维素(以木聚糖计)和木质素(酸溶木质素和酸不溶木质素)有适量降解,可能是物料可消化性高于干储存的主要原因[22],对原料后续生化转化也能起到一定的预处理作用[23]。
表1 DCS微贮前后主要成分变化情况
Table 1 Compositions of DCS and DCS silage of DM
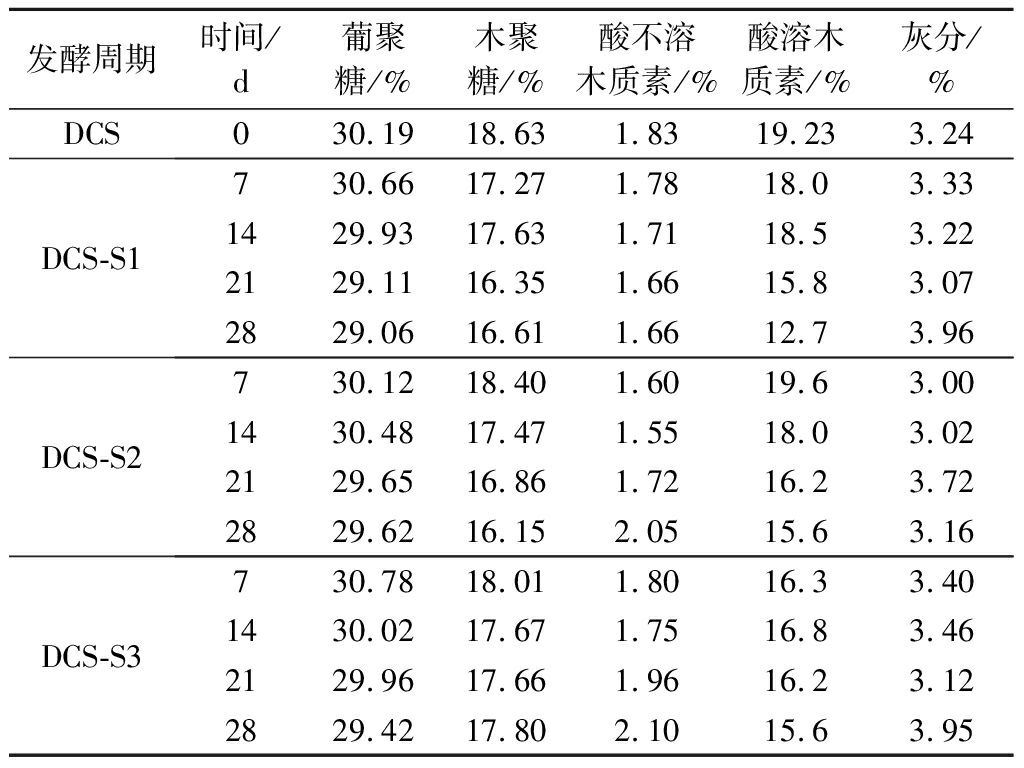
发酵周期时间/d葡聚糖/%木聚糖/%酸不溶木质素/%酸溶木质素/%灰分/%DCS030.1918.631.8319.233.24DCS-S1730.6617.271.7818.03.331429.9317.631.7118.53.222129.1116.351.6615.83.072829.0616.611.6612.73.96DCS-S2730.1218.401.6019.63.001430.4817.471.5518.03.022129.6516.861.7216.23.722829.6216.152.0515.63.16DCS-S3730.7818.011.8016.33.401430.0217.671.7516.83.462129.9617.661.9616.23.122829.4217.802.1015.63.95
注:结果数据为3 个平行的平均值
2.2 微贮干玉米秸秆细菌群落结构分析
就相对丰度而言,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)是所有样品中主要门类(图4)。特别是DCS-S1样品中,变形菌门最丰富,相对丰度达到89.37%。厚壁菌门在DCS样品中的含量(0.14%)远低于样品DCS-S3(32.71%)。相比之下,DCS中拟杆菌门相对丰度(12.53%)比DCS-S2(1.99%)高。
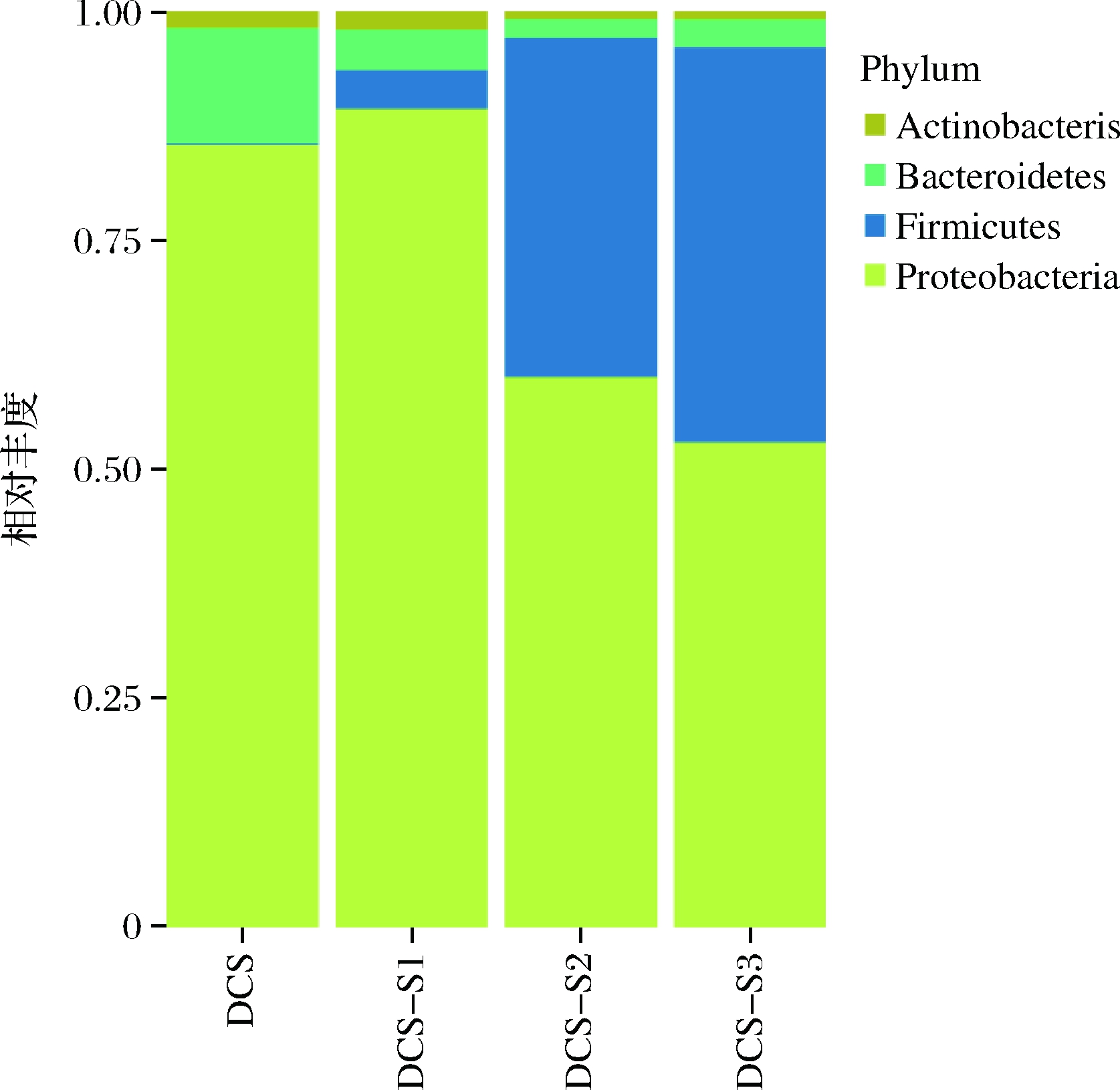
图4 DCS微贮前后原料细菌门水平相对丰度
Fig.4 Relative abundance of bacterial composition in DCS samples at phylum level
在属水平上(图5),泛菌属(Pantoea)是所有样品中最丰富的分类属,占19.16%~23.21%。DCS-S3中优势微生物鉴定为肠球菌属(Enterococcus),其相对丰度为35.47%,而在DCS中相对丰度仅为0.14%,表明接种的LAB可促进肠球菌的增殖。在微贮过程中,肠球菌能降低原料pH值并增加乳酸的量,特别是在发酵早期[24]。在低pH值,特别是4.00以下,可避免腐败微生物的繁殖代谢,微贮过程接近停止。香农多样性指数(Shannon index)结果表明,细菌群落的多样性从DCS的3.787提高到DCS-S1的3.983,但DCS-S2(3.670)和DCS-S3(3.368)的细菌多样性下降,主要是由于发酵后期LAB成为优势菌群,抑制了其他细菌的生长繁殖。乳杆菌属在DCS中为0.00%,但在DCS-S2中显著增加至14.76%,高于DCS-S3中的7.66%。因此,通过添加混合LAB和芽孢杆菌比单独添加LAB可以更多地增加乳酸杆菌数量。寡养单胞菌(Stenotrophomonas)(17.34%)和鞘氨醇杆菌(Sphingobacterium)(11.61%)是DCS的主要属,但它们在微贮样品中变得不那么丰富。在DCS中未检测到芽孢杆菌,虽然在DCS-S1和DCS-S2中有所添加,但微贮DCS-S1中芽孢杆菌的丰度较低(0.02%)。
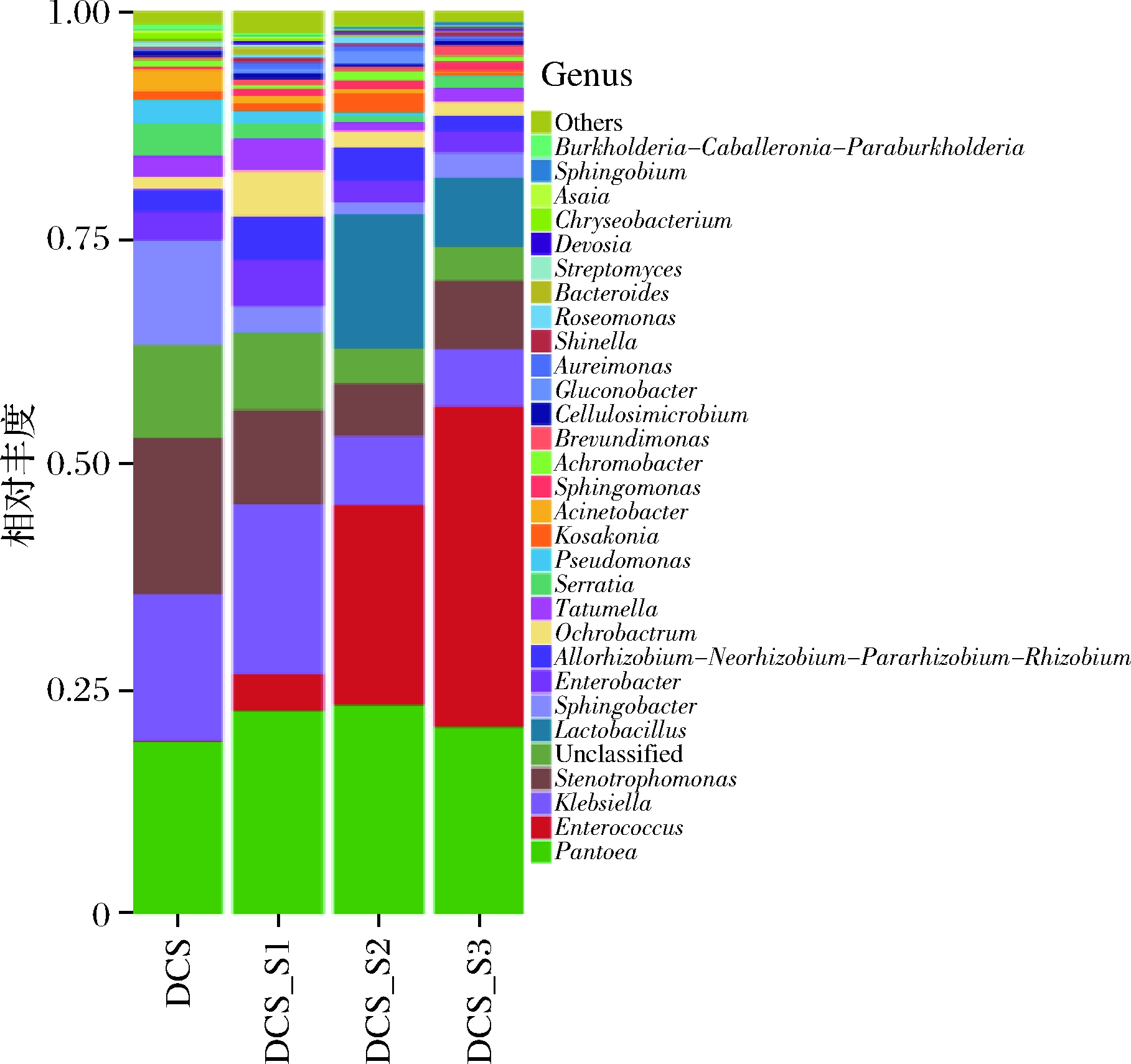
图5 DCS微贮前后原料细菌组成属水平相对丰度
Fig.5 Relative abundance of bacterial composition in DCS samples at genus level
基于细菌OTU相对丰度的相似性分析结果表明(图6):所有样品可以分成2类,一类由DCS和DCS-S1样本组成。一类由DCS-S2和DCS-S3样本组成。这种分类与微贮接种物是否添加LAB一致。因此,微贮通常依靠微生物(主要是LAB)将生物质中的可溶性碳水化合物(water soluable carbohydrate,WSC)转化为有机酸(图3-b)[25]。有机酸的产生将原料的pH值降低到4.00以下(图3-a),抑制了其他微生物的生长,从而有效保存生物质[26]。
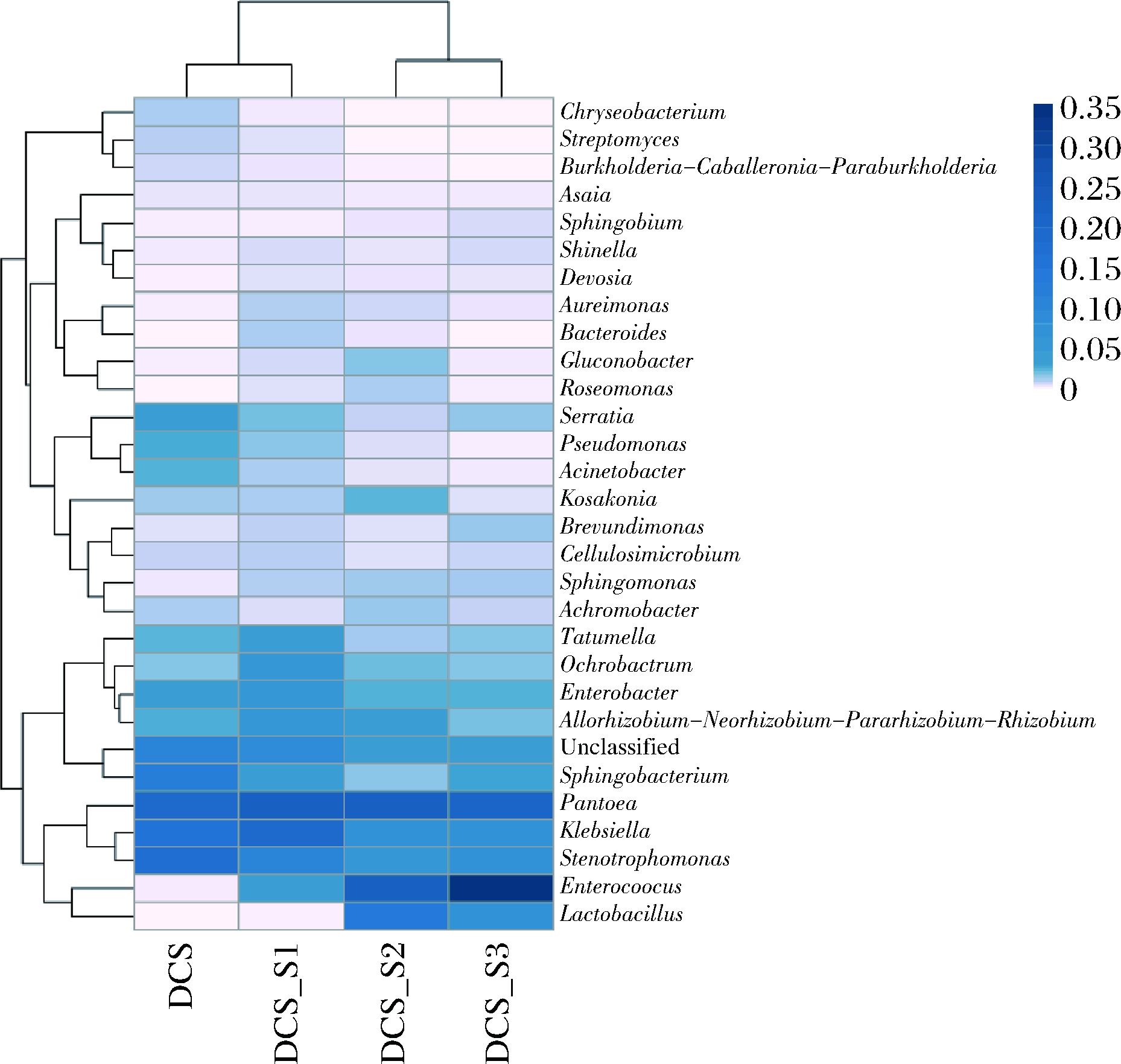
图6 基于DCS微贮前后原料细菌OTUs相对丰度 的相似性分析
Fig.6 Analysis of similarity among DCS samples fermented by microorganism based on the relative abundance of bacterial OTUs
2.3 厌氧消化
本实验以DCS和微贮DCS-S3(28 d)为原料,比较不同AD工艺对DCS微贮前后的沼气产量的影响,并考察微贮DCS-S3和ES/PM混合厌氧共消化对发酵沼气的提高作用。由图7结果可知,DCS经过微贮后产生适量有机酸(特别是乳酸和乙酸)作为甲烷的前体物质,可以取代两相AD的酸化过程,原料每天产气率有了一定程度地提高;微贮DCS和废弃物(ES/PM)厌氧共消化可有效缓解单一原料AD过程C/N不平衡问题,有效提高沼气产率。
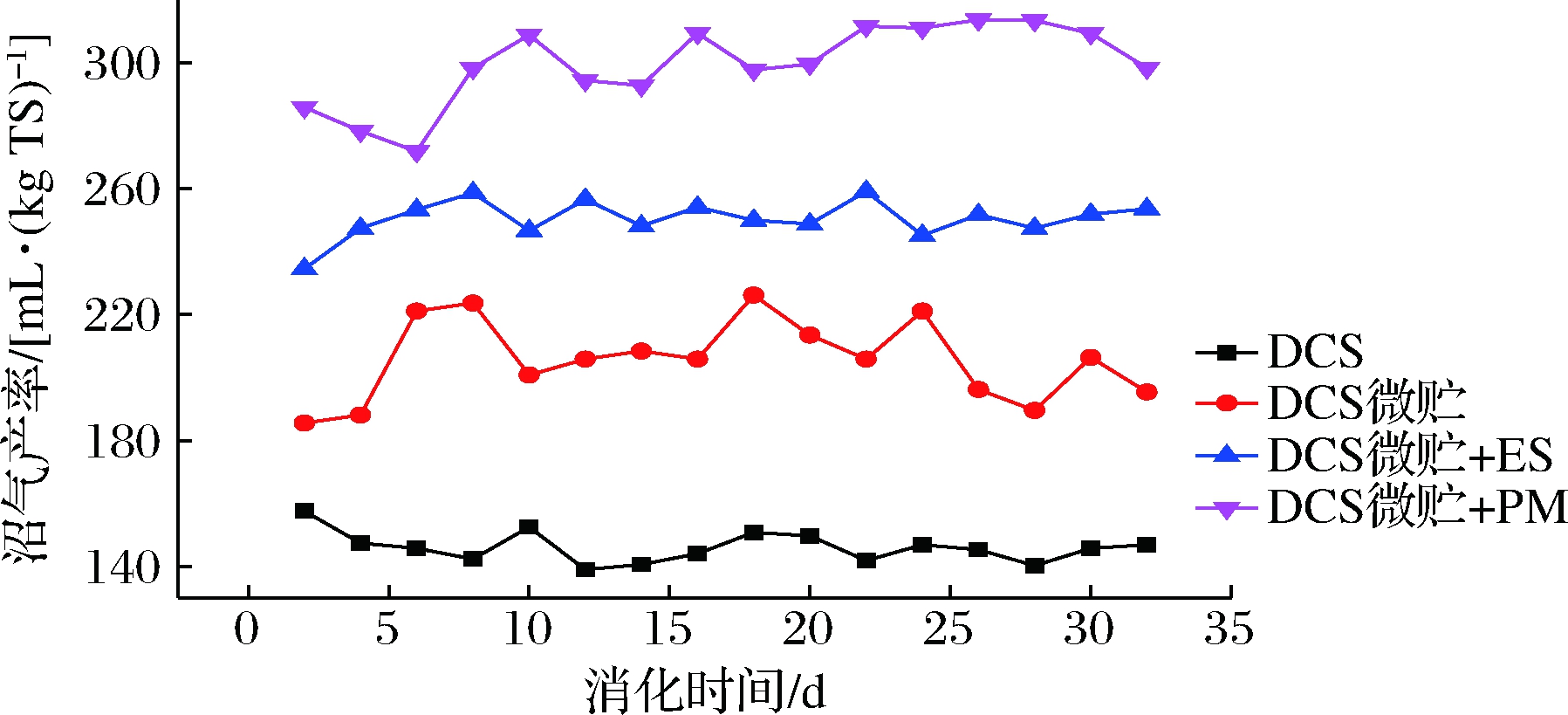
图7 原料产气率统计
Fig.7 Statistics of dairy biogas yield with materials
由图8结果可知,采用两相AD对DCS进行沼气发酵,原料累积产气量为292.06 mL/g TS,可超过传统玉米秸秆完全混合式厌氧反应器沼气发酵水平[27]。这应该是微好氧酸化过程中通气有利于木质纤维素成分的快速降解。有报道指出水解酸化细菌在通气条件下可大量分泌纤维素酶,而在厌氧环境中,水解细菌产酶能力下降,且易受到反馈抑制的影响,分解率降低[28-29]。DCS微贮预处理可以取代两相厌氧消化过程中的酸化过程,并对DCS起到一定的预处理作用。微贮DCS单相AD结果表明原料累积产气量可达到411.46 mL/g TS,较DCS两相AD提高了40.88%。
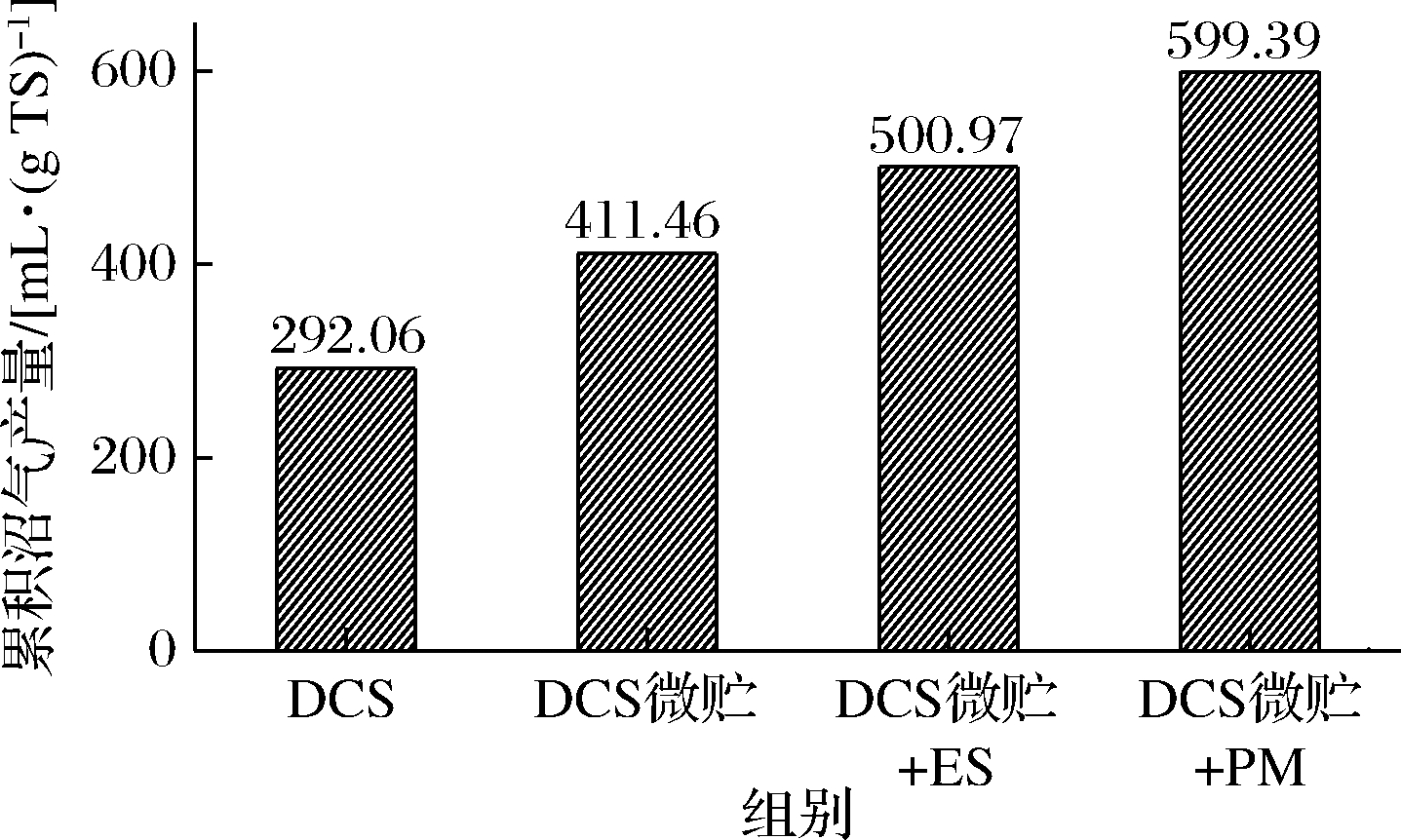
图8 原料累积沼气产量统计
Fig.8 Statistics of cumulative biogas yield with materials
提高反应器性能和稳定性的一种策略是多底物厌氧共消化[30]。本文将微贮DCS和ES/PM按照一定比例混合进行单相厌氧共消化,累积沼气产量分别达到500.97和599.39 mL/g TS(图8),较单一原料AD有明显提高。因此,有机废弃物(含氮量高)和LCB(含碳量高)共同厌氧共消化是平衡底物成分的有利策略。重要的是,2种容易获得的低成本原料含有互补的C和N含量,使其成为AD和可再生能源生产的理想底物[31]。将DCS、ES和PM混合厌氧共消化可以突破欧盟国家用带穗玉米秸秆青贮作为主要原料的局限,使用干秸秆和各种有机废弃物,适合中国国情,对彻底解决焚烧秸秆、剩余污泥填埋以及畜禽粪便面源污染问题有重要意义。
3 结论
通过对DCS进行微贮预处理,考察了不同接种微生物组合对原料的主要成分影响及微贮样品的细菌多样性分析,比较了DCS两相AD及微贮DCS单相AD在沼气产量上的差异,探讨了微贮DCS和ES/PM混合厌氧共消化对沼气产率的提高作用,得出如下主要结论:
(1)微贮可以作为秸秆沼气发酵的有效预处理方式之一。不同微生物组都能达到相应的微贮效果,只是原料中的代谢产物(如乳酸、乙酸等)含量不同,不过LAB是较适合接种物,有利于产生有机酸,降低体系pH值;
(2)DCS经过微贮后产生适量有机酸(特别是乳酸和乙酸)作为甲烷的前体物质,可以取代两相AD的酸化过程,加快AD速度。另外,适量有机酸有利于维持AD体系缓冲能力(本实验装置运行2年来反应体系pH值一直维持在7.2~7.5之间);
(3)微贮DCS和废弃物(ES/PM)厌氧共消化可有效缓解单一原料AD过程C/N不平衡问题,有效提高沼气产率。
[1] XIAO Q,CHEN W,TIAN D,et al.Integrating the bottom ash residue from biomass power generation into anaerobic digestion to improve biogas production from lignocellulosic biomass[J].Energy & Fuels,2020,34(2):1 101-1 110.
[2] SHAMURAD B,SALLIS P,PETROPOULOS E,et al.Stable biogas production from single-stage anaerobic digestion of food waste[J].Applied Energy,2020,263:114609.
[3] WU Y Y,WANG C P,LIU X J,et al.A new method of two-phase anaerobic digestion for fruit and vegetable waste treatment[J].Bioresource Technology,2016,211:16-23.
[4] LI D,LIU S C,MI L,et al.Effects of feedstock ratio and organic loading rate on the anaerobic mesophilic co-digestion of rice straw and pig manure[J].Bioresource Technology,2015,187:120-127.
[5] DALK L
L C K,UGURLU A.Biogas production from chicken manure at different organic loading rates in a mesophilic-thermopilic two stage anaerobic system[J].Journal of Bioscience and Bioengineering,2015,120(3):315-322.
C K,UGURLU A.Biogas production from chicken manure at different organic loading rates in a mesophilic-thermopilic two stage anaerobic system[J].Journal of Bioscience and Bioengineering,2015,120(3):315-322.
[6] XU S Y,SELVAM A,WONG J W C.Optimization of micro-aeration intensity in acidogenic reactor of a two-phase anaerobic digester treating food waste[J].Waste Management,2014,34(2):363-369.
[7] LIM J W,WANG J Y.Enhanced hydrolysis and methane yield by applying microaeration pretreatment to the anaerobic co-digestion of brown water and food waste[J].Waste Management,2013,33(4):813-819.
[8] CARRERE H,ANTONOPOULOU G,AFFES R,et al.Review of feedstock pretreatment strategies for improved anaerobic digestion:From lab-scale research to full-scale application[J].Bioresource Technology,2016,199:386-397.
[9] YANG X,ZHANG Z P,SONG L L,et al.Solid-state anaerobic microbial ensilage:A combined wet storage and pretreatment method for the bioconversion of lignocellulosic biomass[J].Waste and Biomass Valorization,2020,11(7):3 381-3 396.
[10] NKOSI B D,MEESKE R,LANGA T,et al.Effects of ensiling forage soybean(Glycine max(L.) Merr.) with or without bacterial inoculants on the fermentation characteristics,aerobic stability and nutrient digestion of the silage by Damara rams[J].Small Ruminant Research,2016,134:90-96.
[11] LIU S,GE X M,XU F Q,et al.Effect of total solids content on giant reed ensilage and subsequent anaerobic digestion[J].Process Biochemistry,2016,51(1):73-79.
[12] 杨旭, 常春,李洪亮,等.干玉米秸秆与废弃物混合微贮及半连续发酵产沼气能力分析[J].高校化学工程学报,2017,31(4):899-905.
YANG X,CHANG C,LI H L,et al.Mixed ensiling pretreatment and semi-continuous fermentation of dry corn stover and wastes for biogas production[J].Journal of Chemical Engineering of Chinese Universities,2017,31(4):899-905.
[13] PAUDEL S R,BANJARA S P,CHOI O K,et al.Pretreatment of agricultural biomass for anaerobic digestion:Current state and challenges[J].Bioresource Technology,2017,245:1 194-1 205.
[14] WU X,YAO W Y,ZHU J,et al.Biogas and CH4 productivity by co-digesting swine manure with three crop residues as an external carbon source[J].Bioresource Technology,2010,101(11):4 042-4 047.
[15] KIM H W,NAM J Y,SHIN H S.A comparison study on the high-rate co-digestion of sewage sludge and food waste using a temperature-phased anaerobic sequencing batch reactor system[J].Bioresource Technology,2011,102(15):7 272-7 279.
[16] CHEN S J,TAO Z,YAO F B,et al.Enhanced anaerobic co-digestion of waste activated sludge and food waste by sulfidated microscale zerovalent iron:Insights in direct interspecies electron transfer mechanism[J].Bioresource Technology,2020,316:123901.
[17] YANG X,LI H L,CHANG C,et al.The integrated process of microbial ensiling and hot-washing pretreatment of dry corn stover for ethanol production[J].Waste and Biomass Valorization,2018,9(11):2 031-2 040.
[18] MU L,XIE Z,HU L,et al.Lactobacillus plantarum and molasses alter dynamic chemical composition,microbial community,and aerobic stability of mixed(amaranth and rice straw) silage[J].Journal of the Science of Food and Agriculture,2021,101(12):5 225-5 235.
[19] SUN L,BAI C S,XU H W,et al.Succession of bacterial community during the initial aerobic,intense fermentation,and stable phases of whole-plant corn silages treated with lactic acid bacteria suspensions prepared from other silages[J].Frontiers in Microbiology,2021,12:655095.
[20] KAEWPILA C,THIP-UTEN S,CHERDTHONG A,et al.Impact of cellulase and lactic acid bacteria inoculant to modify ensiling characteristics and in vitro digestibility of sweet corn stover and cassava pulp silage[J].Agriculture,2021,11(1):66.
[21] SHINNERS K J,WEPNER A D,MUCK R E,et al.Aerobic and anaerobic storage of single-pass,chopped corn stover[J].BioEnergy Research,2011,4(1):61-75.
[22] NOIKE T,ENDO G,CHANG J E,et al.Characteristics of carbohydrate degradation and the rate-limiting step in anaerobic digestion[J].Biotechnology and Bioengineering,1985,27(10):1 482-1 489.
[23] PAULOVA L,PATAKOVA P,BRANSKA B,et al.Lignocellulosic ethanol:Technology design and its impact on process efficiency[J].Biotechnology Advances,2015,33(6):1 091-1 107.
[24] ZHAO C,WANG L H,MA G M,et al.Cellulase interacts with lactic acid bacteria to affect fermentation quality,microbial community,and ruminal degradability in mixed silage of soybean residue and corn stover[J].Animals,2021,11(2):334.
[25] SLOTTNER D,BERTILSSON J.Effect of ensiling technology on protein degradation during ensilage[J].Animal Feed Science and Technology,2006,127(1-2):101-111.
[26] WEILAND P.Biogas production:Current state and perspectives[J].Applied Microbiology and Biotechnology,2010,85(4):849-860.
[27] 杜静, 陈广银,黄红英,等.秸秆批式和半连续式发酵物料浓度对沼气产率的影响[J].农业工程学报,2015,31(15):201-207.
DU J,CHEN G Y,HUANG H Y,et al.Effect of fermenting material concentration on biogas yield in batch and continuous biogas fermentation with straws[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(15):201-207.
[28] SUN L,LIU T,MÜLLER B,et al.The microbial community structure in industrial biogas plants influences the degradation rate of straw and cellulose in batch tests[J].Biotechnology for Biofuels,2016,9:128.
[29] 温博婷. 木质纤维素原料的酶解糖化及厌氧发酵转化机理研究[D].北京:中国农业大学,2015.
WEN B T.Studies on the characteristics of lignocellulose degradation during the process of enzymatic saccharification and anaerobic digestion[D].Beijing:China Agricultural University,2015.
[30] 吴爱兵, 曹杰,朱德文,等.麦秸与牛粪混合堆沤预处理厌氧干发酵产沼气中试试验[J].农业工程学报,2015,31(22):256-260.
WU A B,CAO J,ZHU D W,et al.Pilot experiment on biogas production of dry fermentation of wheat straw and cow dung with composting pre-treatment[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(22):256-260.
[31] ROMERO-GÜIZA M S,VILA J,MATA-ALVAREZ J,et al.The role of additives on anaerobic digestion:A review[J].Renewable and Sustainable Energy Reviews,2016,58:1 486-1 499.