啶虫脒(acetamiprid)作为一种广谱的新烟碱类杀虫剂,具有高效、低毒、内吸性强等特点[1],常被用于农作物保护以及城市绿化等方面。由于啶虫脒在水中具有良好的溶解性,在农作物喷洒过程中啶虫脒大部分直接渗透进入土壤中,随着雨水的冲刷流经地表进入环境水中,危害水生生物,破坏生态平衡[3];还会经饮用水和食物等方式在人体内累积威胁人体健康,近几年不断从环境及农作物中检测出啶虫脒残留超标。目前,检测啶虫脒残留的方法主要有HPLC[6]、GC[7]、LC-MS/MS[8]等。由于啶虫脒在水中一般是痕量存在,所以需要对样品进行净化从而去除干扰物的影响,并对目标物进行富集从而提升检测的准确性。主要的前处理方法有固相萃取技术、分散固相萃取技术、QuEChERS[11]等,但是传统的样品前处理技术均有自身的缺点,如分散固相萃取法存在抗基质干扰能力差[12],固相萃取技术虽然操作简单,但该方法对目标物选择性较差,容易出现固相萃取小柱堵塞等问题[8]。因此,建立一种绿色经济、高效快速、高选择性的分析方法用于水样中啶虫脒的痕量检测尤为重要。
分子印迹技术(molecular imprinting technology,MIT)作为一种分子“钥匙”以匹配分子“锁”的方法,制备得到的分子印迹聚合物(molecularly imprinted polymer,MIP)具有构效预定性、特异识别性、广泛实用性和稳定性好等优点。常被作为固相萃取填料用来富集和分离复杂样品基质中的痕量目标物,在农兽药残留、重金属污染及植物源功能性成分的分析[18]等方面均有应用。但是传统合成方法制备得到的MIP存在印迹包埋过深、吸附容量低、识别位点不均一、选择性识别差、材料大小不一等缺点,限制了其进一步发展。而表面分子印迹技术通过将分子印迹聚合物与Fe3O4磁性纳米微球结合得到一种新型磁性分子印迹聚合物材料(magnetic molecularly imprinted polymers,MMIPs),可以有选择性地识别模板分子,利用外加磁场可达到快速分离的目的,大大缩短样品前处理时间[21]。近年来,以MMIPs作为磁性固相萃取剂,在生物分离分析中的应用研究已有相关报道,如YU等[22]以荧光纳米材料作为载体,啶虫脒为模板分子,α-甲基丙烯酸为功能单体,制备得到一种荧光分子印迹纳米材料(UCNP@MIP),印迹因子为(IF)77.84,成功地应用于苹果和草莓基质中啶虫脒的分离分析;KUMAR等[23]以吡虫啉为模板分子,丙烯酸为功能单体以及功能化的Fe3O4为磁芯,制备得到相应的MMIPs,结合LC-MS/MS对蜂蜜和茄子中的吡虫啉进行定量分析,结果表明,所合成的MMIPs能快速从复杂基质中高效地分离目标物;ZHANG等[24]通过表面分子印迹技术制备得到以哌虫啶为模板分子的MMIPs吸附剂,所得到的哌虫啶磁性分子印迹聚合物具有较高的吸附容量和选择性识别能力,表明其在分离分析技术中具有潜在的应用前景。与传统前处理技术相比,将表面分子印迹技术制备得到的MMIPs作为磁性固相萃取吸附剂具有操作简单、吸附速度快、吸附容量大、选择性高、环境友好等优点。
本文利用表面分子印迹技术在Fe3O4纳米微球表面包裹分子印迹薄层,制备得到MMIPs。以溶剂热法合成Fe3O4磁性纳米微球,在其表面包裹二氧化硅层,得到的Fe3O4@SiO2纳米微球作为磁芯,以啶虫脒为模板分子,制备得到具有特异性识别的MMIPs。将MMIPs作为磁性固相萃取吸附剂,并考察了该吸附剂对啶虫脒的特异性识别性能,最后结合高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet,HPLC-UV)成功分离和测定饮用水中的啶虫脒,适用于水样中痕量啶虫脒的分离富集测定。
1 材料与方法
1.1 试剂与仪器
啶虫脒(纯度97%)、氨水(纯度25%~28%)、FeCl3·6H2O,重庆跃翔化工有限公司;吡虫啉、噻虫啉(纯度99%),德国Dr.Ehrenstorfer公司;原硅酸四乙酯(纯度99%)、α-甲基丙烯酸、偶氮二异丁腈,上海泰坦科技股份有限公司;聚乙二醇400目,重庆迈和霆科技有限公司;NaOAc·3H2O、无水乙醇,均为分析纯,重庆市钛新化工有限公司;丙烯酸羟乙酯,上海源叶生物科技有限公司;丙烯酰胺,重庆姣姣商贸有限公司;乙二醇二甲基丙烯酸羟乙酯,上海滕怀生物科技有限公司;甲醇、乙腈(色谱纯),德国CNW公司;冰醋酸(分析纯),上海迈瑞尔化学科技有限公司;超纯水、自来水取自实验室;河水样品取自北碚附近河流段。
安捷伦1200高效液相色谱仪,美国安捷伦科技有限公司;聚四氟乙烯反应釜,郑州华特仪器设备有限公司;SZCL-3A数显智能控温磁力搅拌器,郑州科泰实验设备有限公司;KQ5200DE超声波清洗器,江苏昆山市超声仪器有限公司;DW-Ⅱ型无极调速增力搅拌器,巩义市予华特有限责任公司;TM-1810紫外分光光度计,北京普析通用仪器有限责任公司;Milli-Q-A10超纯水仪,美国Millipore公司;恒温振荡器,苏州培英实验设备有限公司;CZX-GFC.101-2-BS电热恒温鼓风干燥箱,上海博泰实验设备有限公司;CL31/CL31R多用途离心机,美国Thermo Fisher公司。
1.2 啶虫脒磁性分子印迹聚合物的制备
1.2.1 Fe3O4磁性纳米颗粒的制备
利用溶剂热法[25]制备磁性Fe3O4颗粒:1.50 g FeCl3·6H2O溶解于30 mL乙二醇中,再加入2.50 g无水醋酸钠和1 mL聚乙二醇,磁力搅拌1 h。将混合物溶液转移到聚四氟乙烯反应釜中,200 ℃下反应8 h。制备得到的黑色物质在外加磁场的作用下,用无水乙醇和去离子水各洗涤3次,真空冷冻干燥24 h,得到磁性Fe3O4纳米颗粒。
1.2.2 Fe3O4@ SiO2的制备
利用溶胶-凝胶法制备Fe3O4@SiO2:将1.50 g Fe3O4加入到100 mL异丙醇中,超声处理30 min,依次加入8 mL去离子水,5 mL氨水,强力搅拌30 min,氮气氛围下缓慢加入1 mL四乙氧基硅烷(tetraethyl orthosilicate,TEOS),室温搅拌12 h。磁分离,依次用无水乙醇和去离子水各洗涤3次,真空冷冻干燥24 h,得到Fe3O4@SiO2纳米材料。
1.2.3 啶虫脒磁性分子印迹聚合物的制备
称取1 mmol啶虫脒和6 mmol α-甲基丙烯酸加入到80 mL乙腈中,超声处理30 min,然后加入200 mg Fe3O4@SiO2磁性纳米粒子,超声30 min,混合后静置24 h,得到预组装溶液。再加入42 mmol 乙二醇二甲基丙烯酸羟乙酯交联剂,氮吹20 min,加入40 mg偶氮二异丁腈,70 ℃下强力搅拌24 h。反应结束后,利用外加磁场对聚合物进行磁分离,将所得固体用V(甲醇)∶V(乙酸)=9∶1索氏提取24 h,直至在洗脱液中用紫外吸收光谱检测不到模板分子,无水乙醇洗涤至中性,真空冷冻干燥24 h,最终得到啶虫脒MMIPs,采用同样的方法制备不加模板分子的非分子印迹聚合物。啶虫脒磁性分子印迹聚合物制备过程如图1所示。
1.3 吸附实验
1.3.1 等温吸附
利用等温吸附曲线考察MMIPs的饱和吸附量。分别取10 mg MMIPs和MNIPs添加到0.01~0.20 μg/mL啶虫脒标准液中,取上清液,用HPLC测定溶液中啶虫脒浓度变化。其吸附量计算如公式(1)所示:
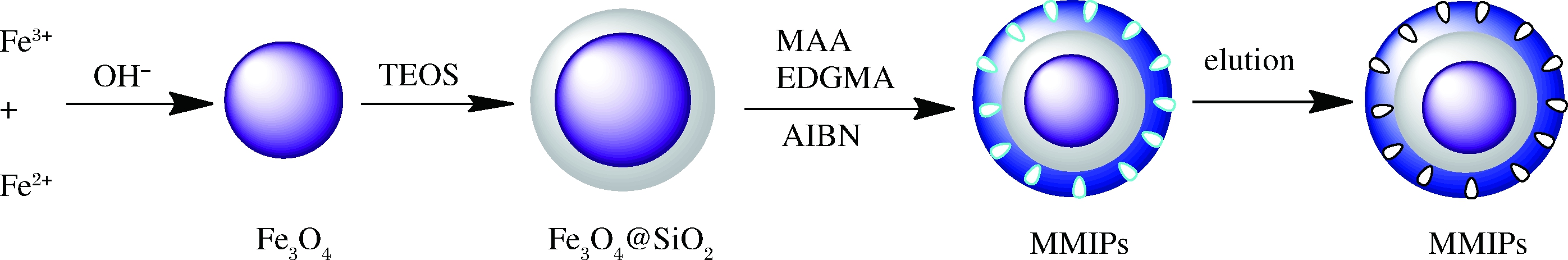
图1 MMIPs的制备过程
Fig.1 The diagram for the synthesis of MMIPs
Qe=(C0-Ce)×V/m
(1)
式中:Qe,印迹聚合物对啶虫脒的吸附量,mg/g;C0,啶虫脒初始浓度,mg/L;Ce,啶虫脒平衡浓度,mg/L;V,吸附溶液体积,mL;m,和吸附剂质量,mg。
1.3.2 动力学吸附
利用动态吸附实验考察MMIPs的吸附平衡时间。分别取10 mg MMIPs和MNIPs,分别加入200 mg/L的啶虫脒标准液,测定不同时间下的吸附量Q,绘制吸附量Q与时间t的关系曲线。采用准一级动力学方程(2)和准二级动力学方程(3)研究MMIPs对啶虫脒的吸附速率和吸附机理。
ln(Qe-Qt)=lnQ1-K1t
(2)
(3)
式中:Qt,t时的吸附量,mg/g;t,时间,min;K1为一级动力学常数;K2为二级动力学常数;Q1,拟一级动力学的理论吸附量,mg/g;Q2,拟二级动力学的理论吸附量,mg/g。
1.3.3 选择性吸附
选取吡虫啉和噻虫嗪作为啶虫脒的结构类似物进行选择性实验。将10 mg MMIPs和MNIPs置于15 mL离心管中,加入200 mg/L的啶虫脒、吡虫啉和噻虫嗪混合标准液(结构式如图2所示)进行吸附,计算吸附量Q。利用印迹因子(α)和选择性系数(β)对MMIPs的特异性识别能力进行考察[26],α,β计算如公式(4)、(5)所示。
α=QMMIPs/QMNIPs
(4)
β=α1/α2
(5)
式中:QMMIPs,MMIPs的吸附量,mg/g;QMNIPs,MNIPs的吸附量,mg/g;α1和α2分别为啶虫脒和类似物的印迹因子。
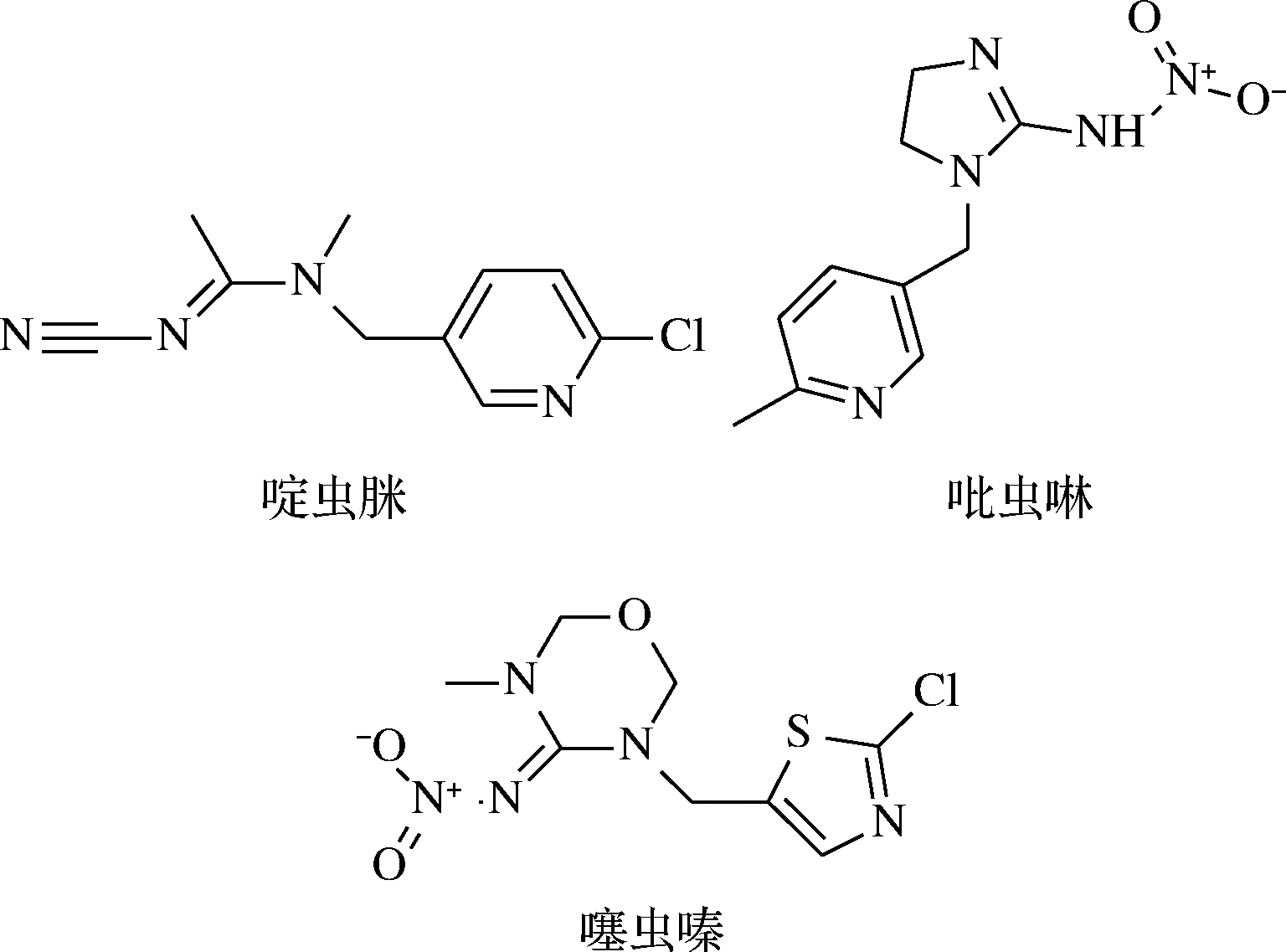
图2 啶虫脒、吡虫啉、噻虫嗪化学结构式
Fig.2 Molecular structures of acetamiprid,imidacloprid and thiamethoxam
1.4 磁固相萃取过程
将50 mg MMIPs加入到10 mL纯水中,200 r/min摇床1 h,磁分离,弃去上清液。采用体积分数10%乙酸-甲醇洗脱被吸附的啶虫脒,磁分离,收集上清液,氮吹干后,重新溶解于0.5 mL甲醇溶液中。
1.5 高效液相色谱条件
色谱柱为Waters×Bridge©C18柱(4.60 mm×250 mm,5 μm);洗脱程序:进样量20 μL;柱温35 ℃;流速1 mL/min;检测波长235 nm;流动相为乙腈∶0.1%乙酸水[V(乙酸)∶V(水)=7∶3]。
2 结果与分析
2.1 磁性分子印迹聚合物的表征
不同样品的红外光谱图如图3-a所示。曲线1中587 cm-1处的吸收峰为Fe3O4的Fe—O伸缩振动吸收峰;除1中所含特征峰外,曲线2在1 083 cm-1和780 cm-1附近出现Si—O—Si和Si—O的伸缩振动峰,说明了SiO2已经包裹在Fe3O4表面;除了曲线2和1的特征吸收峰外,曲线3在1 727 cm-1处出现了C![]() O伸缩振动峰,1 140 cm-1附近出现了C—O的伸缩振动吸收峰,说明分子印迹薄层成功的包裹在磁性Fe3O4@SiO2的表面。
O伸缩振动峰,1 140 cm-1附近出现了C—O的伸缩振动吸收峰,说明分子印迹薄层成功的包裹在磁性Fe3O4@SiO2的表面。
图3-b为Fe3O4、Fe3O4@SiO2、MMIPs样品的X射线衍射(X-ray diffraction,XRD)图。由图3-b可知,Fe3O4、Fe3O4@SiO2、MMIPs都出现了吸收峰,2θ角分别为30.0、35.5、43.14、53.8、57.08和63,对应XRD数据库中Fe3O4晶体反尖晶石结构(220)、(311)、(400)、(422)、(511)、(440)衍射面,经过SiO2和MIPs包裹的Fe3O4晶型没有变化,但是衍射峰强度有所下降,可能是由于其表面包裹了分子印迹薄层的缘故。
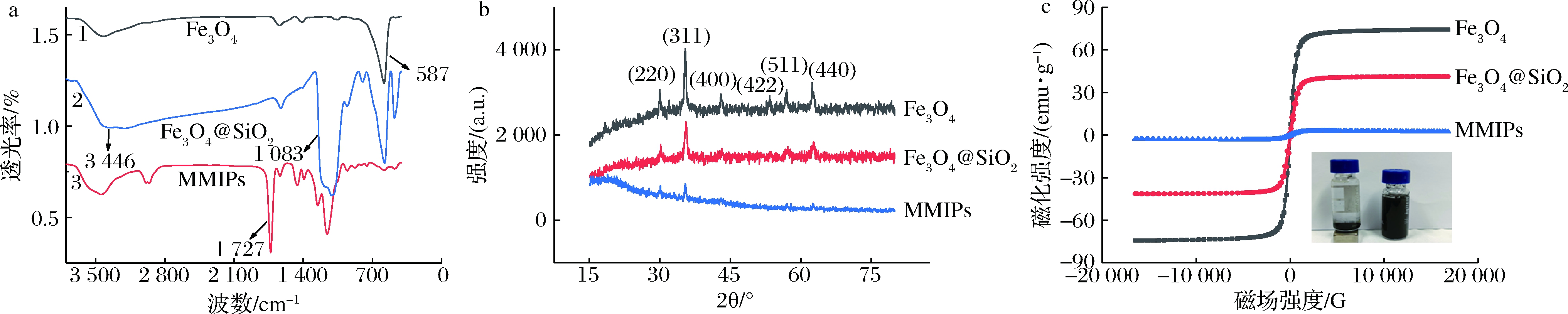
a-红外光谱图;b-X射线衍射图;c-磁滞回线图
图3 Fe3O4、Fe3O4@SiO2、MMIPs的红外光谱图、X射线衍射图、磁滞回线图
Fig.3 FT-IR spectra、X-ray diffraction and magnetization curves at 298 K patterns of Fe3O4, Fe3O4@SiO2, MMIPs
图3-c为Fe3O4、Fe3O4@SiO2、MMIPs样品的磁滞回线,结果表明,MMIPs具有很好的超顺磁性,饱和磁强度为4 emu/g。与Fe3O4、Fe3O4@SiO2的磁饱和磁强度相比有所下降,但是仍然能够满足快速分离的要求,可能是由于其表面包裹了一层分子印迹聚合物,对磁响应性有一定的影响。图3-c中右下角图为MMIP实际磁分离图,进一步说明MMIP具有良好的磁响应强度,能够在外加磁场的作用下实现快速分离。
图4为制备Fe3O4、Fe3O4@SiO2、MMIPs样品的透射电子显微镜图。磁性Fe3O4颗粒分散性好,形貌近似球状,Fe3O4@SiO2中SiO2包裹厚度大约15 nm,与Fe3O4相比,MMIPs外层厚度增加了大约35 nm,表明分子印迹薄层已经成功包裹在磁性纳米材料上。

a-Fe3O4;b-Fe3O4@SiO2;c-MMIPs
图4 透射电镜图
Fig.4 TEM images
2.2 功能单体的选择
功能单体的选择是影响MMIPs是否具有高选择性和高吸附性的关键因素,因此本文利用紫外分光光度计测定啶虫脒与不同的功能单体:α-甲基丙烯酸(α-methacrylic acid,MAA)、丙烯酰胺(acrylamide,AM)、丙烯酸羟乙酯(hydroxyethyl acrylate,HEA)、MAA-HEA的混合液,预聚合后的紫外最大吸收峰的偏移情况,如图5所示。当功能单体为MAA时,预聚合的紫外最大吸收峰发生明显的红移,可能原因是由于MAA具有酸性羟基,能与模板分子中的氯化吡啶环上的氨基形成N—H—O氢键[27],形成更稳定的预聚合物,实验结果得到的分子印迹材料能够表现出更好的印迹效果,因此选择MAA作为功能单体更为合适。

图5 啶虫脒与不同功能单体预聚合后的紫外吸收波长变化
Fig.5 Change in maximum ultraviolet absorption wavelength after prepolymerization of acetamiprid with different functional monomers
2.3 吸附性能测定
2.3.1 动力学吸附和等温吸附实验
MMIPs和MNIPs的吸附等温线如图6-a所示。随着溶液中啶虫脒质量浓度的增大,MMIPs对啶虫脒的吸附量迅速增大,饱和吸附量为43.5 mg/g。MNIPs对啶虫脒的吸附量变化不明显,并且低于MMIPs。
MMIPs和MNIPs的动力学曲线如图6-b所示。在开始35 min内,MMIPs和MNIPs对啶虫脒的吸附量迅速增加,吸附速率高;随着时间的延长,MMIPs表面的印迹识别位点逐渐被啶虫脒占据,吸附速率减缓,吸附量趋于饱和,50 min后吸附量基本不再变化,此时,MMIPs对啶虫脒的吸附达到平衡。而MNIPs不存在模板分子的识别空穴,对啶虫脒的吸附速率较为平缓。利用准一级动力学方程和准二级动力学方程对MMIPs和MNIPs的吸附动力学进行研究。结果如表1所示,经拟合分析得到的MMIPs更符合准二级动力学模型(R2=0.993 9)。

a-等温吸附线和;b-动力学吸附曲线
图6 MMIPs和MNIPs对啶虫脒的吸附性能
Fig.6 Adsorptive property of MMIPs and MNIPs
2.3.2 选择性吸附实验
啶虫脒、吡虫啉和噻虫嗪的印迹因子分别为3.8、2.14和1.9。对吡虫啉和噻虫嗪的选择性系数分别为1.8和2.0。结果如图7所示,MMIPs对3种化合物都具有吸附,对于啶虫脒的吸附性能明显优于其他2种物质,MMIPs中具有与啶虫脒结构相匹配的印迹位点,对啶虫脒有特异识别性能,因为吡虫啉与噻虫嗪与啶虫脒结构相似,分子中具有一部分相同的基团,能被少量吸附。
2.4 磁性固相萃取条件的优化
2.4.1 吸附剂用量优化
考察了不同吸附剂用量(10、30、50和100 mg)对啶虫脒回收率的影响。结果如图8-a所示,当吸附剂用量为50 mg时,啶虫脒回收率最高,而继续增加吸附剂用量回收率没有明显变化。
表1 MMIPs吸附啶虫脒的2种动力学模型参数(n=6)
Table 1 Parameters of two kinetic models for adsorption of acetamiprid starch on MMIPs
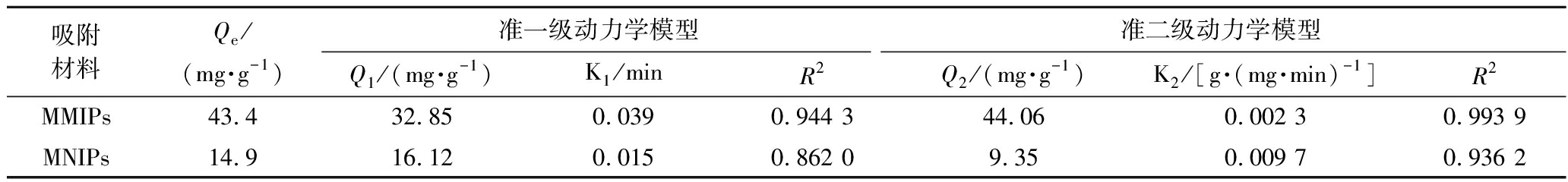
吸附材料Qe/(mg·g-1)准一级动力学模型准二级动力学模型Q1/(mg·g-1)K1/minR2Q2/(mg·g-1)K2/[g·(mg·min)-1]R2MMIPs43.432.850.0390.944 344.060.002 30.993 9MNIPs14.916.120.0150.862 09.350.009 70.936 2

图7 MMIPs对吡虫啉、啶虫脒和噻虫嗪的选择性吸附
Fig.7 Selective adsorption of MMIPs for acetamiprid, imidaclopridand thiamethoxam
2.4.2 吸附时间的优化
考察了不同吸附时间(10、30、45和60 min)对啶虫脒回收率的影响。当吸附时间为45 min时(图8-b),啶虫脒的回收率为90%,而延长吸附时间,回收率没有明显增加,表明吸附达到平衡。综合考虑回收率及吸附效率,选择45 min为吸附时间。
2.4.3 洗脱剂的优化
根据相似相溶原理,选用甲醇、5%乙酸-甲醇、10%乙酸-甲醇和20%乙酸-甲醇作为洗脱剂,结果如图8-c所示,不同溶剂的洗脱效果不同,当用纯甲醇作为洗脱剂时,啶虫脒的回收率较低,逐渐增加乙酸的含量,啶虫脒的回收率增加,在10%乙酸-甲醇之后再增加乙酸比例,回收率没有明显变化,综合考虑选择10%乙酸-甲醇作为洗脱剂。
2.4.4 振荡频率的优化
考察了不同振荡频率(100、200和300 r/min)对啶虫脒回收率的影响。如图8-d所示,当振荡频率为200 r/min时,回收率较高,进一步增大频率回收率没有明显增加,因此设置振荡频率为200 r/min。
2.5 线性范围、检出限和定量限
在不含啶虫脒的水样中按最优萃取条件进行前处理,从而获得空白基质溶液,然后以空白基质溶液逐级稀释啶虫脒的溶剂标准溶液从而得到质量浓度为10~800 μg/kg的基质标准溶液。每个浓度平行测定6次,以啶虫脒质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线。结果表明,质量浓度10~800 μg/kg,啶虫脒的基质匹配标准曲线线性关系良好,线性方程为:y=91.44x-51.70,r>0.998 7。以3倍和10倍信噪比(S/N)计算检出限(limits of detection,LOD)和定量限(limits of quantification,LOQ)分别为3.50和10.78 μg/kg。
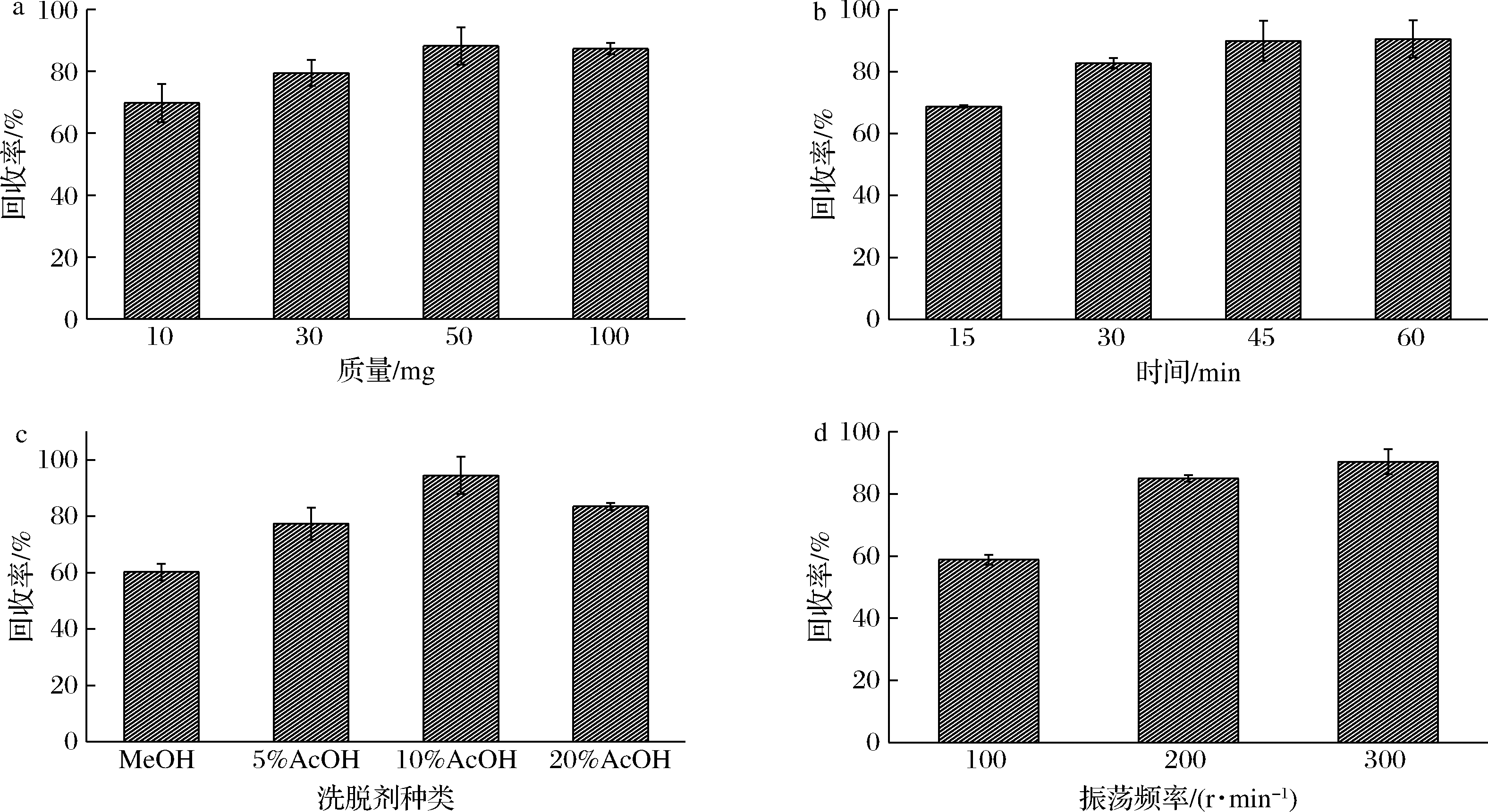
a-吸附剂用量;b-吸附时间;c-洗脱剂种类;d-振荡频率
图8 啶虫脒回收率的影响因素(n=6)
Fig.8 Influence factor of recoveries of acetamiprid
2.6 实际样品中的加标回收率和精密度
在最优磁固相萃取条件下,采用加标回收法,分别在自来水和河水中添加10、100、500 μg/kg的啶虫脒标准液,每个浓度水平测定6次,实验结果如表2所示,自来水中啶虫脒的回收率为86.94%~96.20%,相对标准偏差(n=6)为2.56%~8.25%;河水中啶虫脒的回收率为82.21%~95.50%,相对标准偏差(n=6)为1.07%~7.30%。
表2 饮用水中啶虫脒的加标回收率和精密度
Table 2 Recoveries and RSDs of acetamiprid in water samples
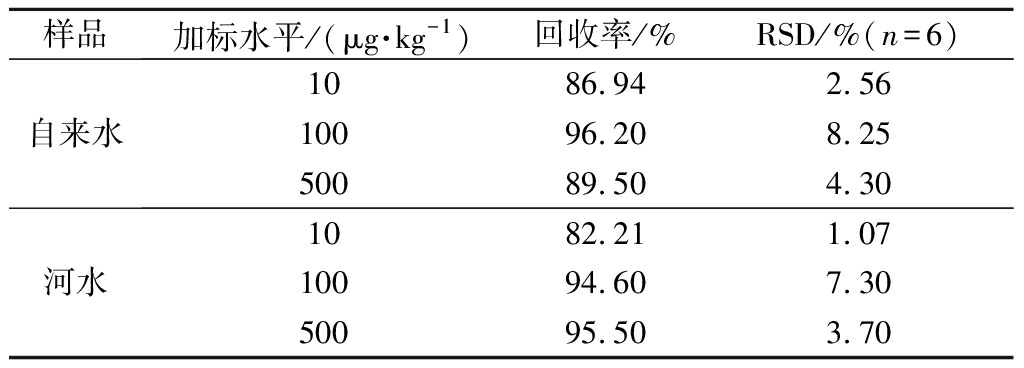
样品加标水平/(μg·kg-1)回收率/%RSD/%(n=6)自来水1086.942.5610096.208.2550089.504.30河水1082.211.0710094.607.3050095.503.70
以上结果表明本文建立的磁性固相萃取结合高效液相色谱法检测饮用水中啶虫脒的方法具有良好的精密度和准确度,MMIPs对啶虫脒具有很好的分离和富集效果(图9),适用于实际水样中啶虫脒的萃取及检测。
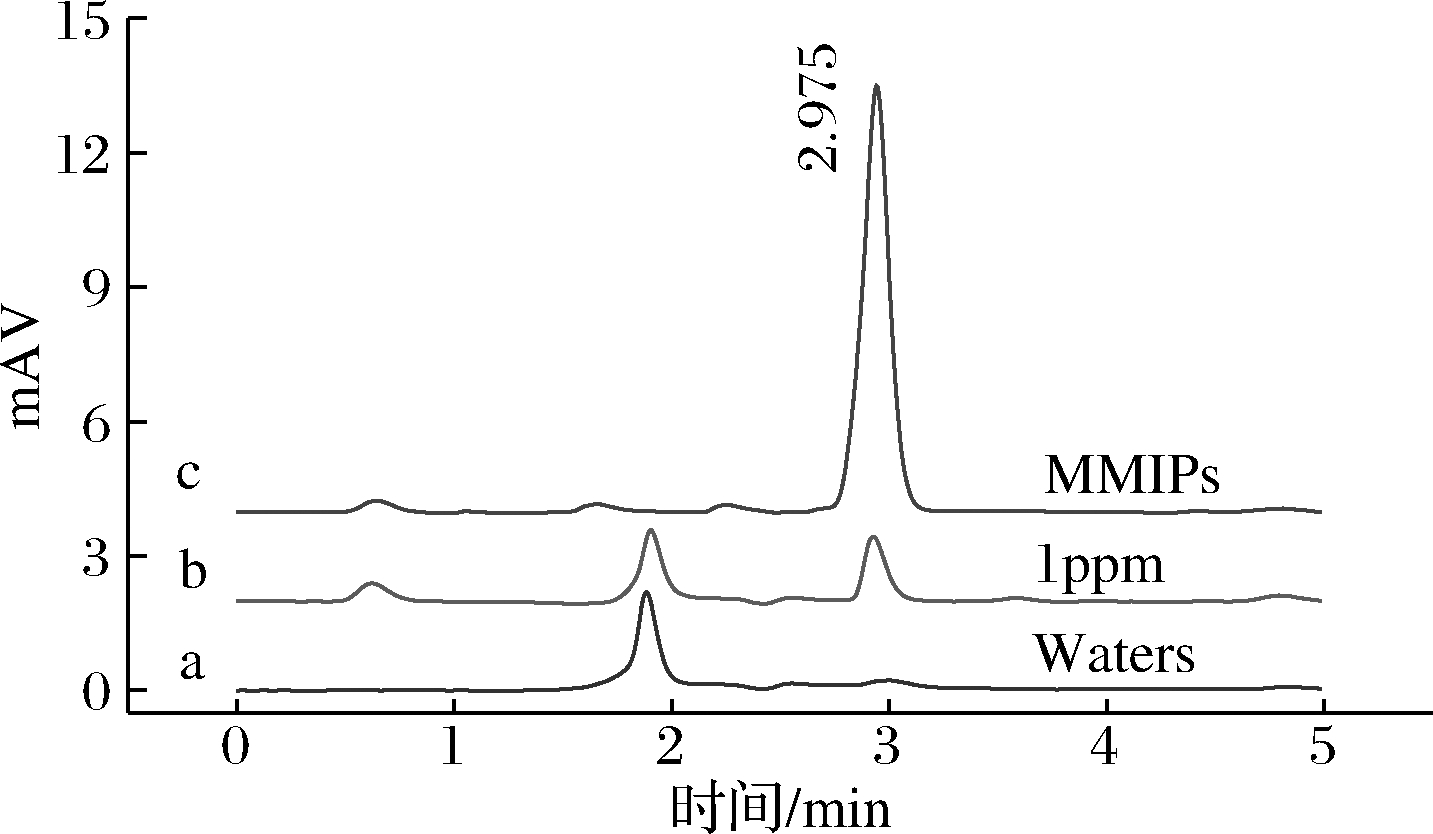
图9 MMIPs对环境水样中啶虫脒的富集效果
Fig.9 Enrichment of MMIPs for acetamiprid in water samples
3 结论
本文采用表面分子印迹技术制备啶虫脒磁性分子印迹聚合物,将材料用作磁性固相萃取吸附剂,结合HPLC-UV分析了饮用水中啶虫脒。与传统固相萃取技术相比,该方法操作简单高效、环境友好,可以选择性吸附和富集水样中的啶虫脒,为后续复杂基质中痕量啶虫脒杀虫剂残留检测提供了思路。
[1] WATANABE E.Review of sample preparation methods for chromatographic analysis of neonicotinoids in agricultural and environmental matrices:From classical to state-of-the-art methods[J].Journal of Chromatography A,2021,1 643:462042.
[2] ZHANG Y Y,LI G L,WU D,et al.Recent advances in emerging nanomaterials based food sample pretreatment methods for food safety screening[J].TrAC Trends in Analytical Chemistry,2019,121:115669.
[3] 贺艳,邓月华.水环境中新烟碱类农药去除技术研究进展[J].环境化学,2020,39(7):1 963-1 976.
HE Y,DENG Y H.A review on the removal technologies of neonicotinoid pesticides from aquatic environment[J].Environmental Chemistry,2020,39(7):1 963-1 976.
[4] CASTILLO DIAZ J M,MARTIN-LAURENT F,BEGUET J,et al.Fate and effect of imidacloprid on vermicompost-amended soils under dissimilar conditions:Risk for soil functions,structure,and bacterial abundance[J].Science of the Total Environment,2017,579:1 111-1 119.
[5] ATL
![]() Z,
Z,
![]() V,UÇGUN E,et al.Cytotoxicity and genotoxicity of clothianidin in human lymphocytes with or without metabolic activation system[J].Drug and Chemical Toxicology,2019,42(4):364-370.
V,UÇGUN E,et al.Cytotoxicity and genotoxicity of clothianidin in human lymphocytes with or without metabolic activation system[J].Drug and Chemical Toxicology,2019,42(4):364-370.
[6] GOLGE O,CINPOLAT S,KABAK B.Quantification of pesticide residues in gherkins by liquid and gas chromatography coupled to tandem mass spectrometry[J].Journal of Food Composition and Analysis,2021,96:103755.
[7] CARBONELL-ROZAS L,LARA F J,DEL O I M,et al.A novel approach based on capillary liquid chromatography for the simultaneous determination of neonicotinoid residues in cereal samples[J].Microchemical Journal,2021,161:1-7.
[8] SAMSIDAR A,SIDDIQUEE S,SHAARANI S M.A review of extraction,analytical and advanced methods for determination of pesticides in environment and foodstuffs[J].Trends in Food Science & Technology,2018,71:188-201.
[9] ZHANG Y,ZHANG Q,LI S,et al.Simultaneous determination of neonicotinoids and fipronils in tea using a modifiedQuEChERS method and liquid chromatography-high resolution mass spectrometry[J].Food Chemistry,2020,329:1-8.
[10] ZHOU W L,YUE M,LIU Q,et al.Measuring urinary concentrations of neonicotinoid insecticides by modified solid-phase extraction-ultrahigh performance liquid chromatography-tandem mass spectrometry:Application to human exposure and risk assessment[J].Chemosphere,2021,273:129714.
[11] KHANEHZAR H,FARAJI M,NEZHADALI A,et al.Combining of modified QuEChERS and dispersive liquid-liquid microextraction as an efficient sample preparation method for extraction of acetamiprid and imidacloprid from pistachio samples[J].Journal of the Iranian Chemical Society,2021,18(3):641-649.
[12] 高强,冯钰锜.磁性微纳米材料的功能化及其在食物样品前处理中的应用进展[J].色谱,2014,32(10):1 043-1 051.
GAO Q,FENG Y Q.Magnetic micro-/nano-materials:Functionalization and their applications in pretreatment for food samples[J].Chinese Journal of Chromatography,2014,32(10):1 043-1 051.
[13] CHEN L X,WANG X Y,LU W H,et al.Molecular imprinting:Perspectives and applications[J].Chemical Society Reviews,2016,45(8):2 137-2 211.
[14] MALIK M I,SHAIKH H,MUSTAFA G,et al.Recent applications of molecularly imprinted polymers in analytical chemistry[J].Separation & Purification Reviews,2019,48(3):179-219.
[15] DINALI L A F,DE OLIVEIRA H L,TEIXEIRA L S,et al.Efficient development of a magnetic molecularly imprinted polymer for selective determination of trimethoprim and sulfamethoxazole in milk[J].Microchemical Journal,2020,154:104648.
[16] XU Y,TANG Y H,ZHAO Y Y,et al.Bifunctional monomer magnetic imprinted nanomaterials for selective separation of tetracyclines directly from milk samples[J].Journal of Colloid and Interface Science,2018,515:18-26.
[17] HE Y Y,WU P,XIAO W,et al.Efficient removal of Pb(II) from aqueous solution by a novel ion imprinted magnetic biosorbent:Adsorption kinetics and mechanisms[J].PLoS One,2019,14(3):e0213377.
[18] CHENG Y,NIE J Y,LIU H D,et al.Synthesis and characterization of magnetic molecularly imprinted polymers for effective extraction and determination of kaempferol from apple samples[J].Journal of Chromatography A,2020,1630:461531.
[19] SUN H,LI Y,YANG J,et al.Preparation of dummy-imprinted polymers by Pickering emulsion polymerization for the selective determination of seven bisphenols from sediment samples[J].Journal of Separation Science,2016,39(11):2 188-2 195.
[20] 陈静钰,黄鑫,王力,等.同时脱除吡虫啉和啶虫脒农残的虚拟模板表面分子印迹的制备和应用[J].食品与发酵工业,2020,46(5):91-97.
CHEN J Y,HUANG X,WANG L,et al.Synthesis of molecularly imprinted polymers of virtual template surface and its application on simultaneously remove imidacloprid and acetamiprid[J].Food and Fermentation Industries,2020,46(5):91-97.
[21] 丁青青,张文敏,张兰.磁性纳米材料在样品前处理中的应用进展与展望[J].色谱,2020,38(1):14-21.
DING Q Q,ZHANG W M,ZHANG L.Advances in magnetic nanomaterials for sample pretreatment and future prospects[J].Chinese Journal of Chromatography,2020,38(1):14-21.
[22] YU Q R,HE C X,LI Q,et al.Fluorometric determination of acetamiprid using molecularly imprinted upconversion nanoparticles[J].Microchimica Acta,2020,187(4):1-10.
[23] KUMAR N,NARAYANAN N,GUPTA S.Application of magnetic molecularly imprinted polymers for extraction of imidacloprid from eggplant and honey[J].Food Chemistry,2018,255:81-88.
[24] ZHANG M,ZHAO H T,YANG X,et al.Preparation and characterization of surface molecularly imprinted film coated on a magnetic nanocore for the fast and selective recognition of the new neonicotinoid insecticidepaichongding (IPP)[J].RSC Advances,2016,6(5):3 714-3 722.
[25] DENG H,LI X L,PENG Q,et al.Monodisperse magnetic single-crystal ferrite microspheres[J].Angewandte Chemie,2005,117(18):2 842-2 845.
[26] FU H,XU W,WANG H X,et al.Preparation of magnetic molecularly imprinted polymer for selective identification of patulin in juice[J].Journal of Chromatography B,2020,1 145:122101.
[27] 陈静钰.表面分子印迹聚合物的制备及其对茶多酚中吡虫啉和啶虫脒脱出的研究[D].无锡:江南大学,2019.
CHEN J Y.Preparation of surface molecularlyimprinted polymer and its application in the removal of imidacloprid and acetamiprid from tea polyphenols[D].Wuxi:Jiangnan University,2019.