化橘红(Exocarpium citri Grandis)是产于广东省化州市(原化州县)的化州柚,是自古应用的特色地道药材,因其外果皮密被茸毛,习称毛橘红;而柚的外果皮光滑无毛,习称光橘红,毛橘红质量优于光橘红,明清两代更曾列为皇室贡品[1]。化橘红在宋代以后就开始入药,主治风寒咳嗽、实积暖气及喉痒痰多等症,作为一种药材,化橘红有很悠久的历史[2],胡梦君[3]采用醇提法提取化橘红黄酮,发现化橘红中的黄酮主要是柚皮苷和野漆树苷,两者占黄酮总量的84%以上,且柚皮苷含量远大于野漆树苷,柚皮苷占2种物质含量的72.45%,已有报道[4-6]柚皮苷具有多种生理活性,欧阳振宇[7]以柚皮渣为原料,超声波辅助提取柚皮苷,并用D101大孔树脂分离富集,得到纯度为83.7%的柚皮苷;柚皮苷在碱性条件下加压并以钯碳作为催化剂合成柚皮苷二氢查尔酮(naringin dihydrochlcone,Naringin DC),产率为85.2%。TANG等[8]和汤冬梅[9]以超声波辅助乙醇提取香柚皮中的柚皮苷,并用弱极性AB-8树脂分离纯化柚皮苷,NaOH溶液作为洗脱剂,得到纯度为77.26%的柚皮苷碱溶液,最后将该碱液在催化剂雷尼镍的作用下,加氢合成Naringin DC。Naringin DC作为黄酮类甜味剂,不仅具有甜度大的特点,还是一种强抗氧化剂[10-12]。
甜味是通过口腔味觉受体细胞膜上的味觉受体第一家族T1Rs识别并传递信号[13-15]。计算机分子模拟技术是一种新型的虚拟药物筛选的技术,该技术成本低,不仅能降低所需的活性筛选药物分子数量,还能提高发现先导活性化合物的效率。药效团是对受体起作用的药物小分子所共有的并与大分子之间起关键活性作用的药效特征元素及空间结构,药效特征元素可以是疏水基团、化学基团和氢键受体基团等[16]。
本研究利用化橘红提取柚皮苷单体,并催化加氢制备柚皮苷二氢查尔酮,进一步用SYBYL-X及Discovery Studio 2.5软件对柚皮苷二氢查尔酮的甜味机理及甜味药效团进行研究。
1 材料与方法
1.1 材料与试剂
正毛化橘红,化州市平定镇;柚皮苷标准品、柚皮苷二氢查尔酮标准品,上海源叶。
RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;Niconlet6700傅里叶红外光谱仪,美国热电公司;JSM-IT300扫描电镜(scanning electron microscope,SEM),日本电子株式会社;CJF-0.5不锈钢高压反应釜,巩义市予华仪器有限责任公司;SYBYL-X2.0软件,Tripos公司;Discovery Studio 2.5软件,Accelrys公司。
1.2 实验方法
1.2.1 化橘红柚皮苷提取及水沉法纯化
称取500 g化橘红粉末,在提取温度57.5 ℃,液料比60.9∶1(mL∶g),乙醇体积分数为50.8%的条件下提取化橘红柚皮苷[17]。化橘红乙醇提取液经过旋蒸回收乙醇,得到化橘红浸膏,浸膏加蒸馏水调整质量浓度为1.048 2 g/mL,10 ℃静置12 h过滤得到纯度为95.1%的化橘红柚皮苷[18]。
1.2.2 水沉产物的红外光谱分析
使用美国Nicolet6700型红外光谱仪,采用KBr压片法制样,测定水沉产物红外图谱。相关参数为:KBr与样品置于WS70-1红外线快速干燥器烘干至少2 h;于干燥器门口取10 mg样品与500 mg KBr于玛瑙研钵中混合并研至颗粒细小、无反光为止;将研磨后的粉末置于压片装置中压片,压力为20~25 MPa,压片时间为10~60 s[19]。
1.2.3 水沉产物的SEM分析
采用日本电子株式会社JSM-IT300型SEM设备观察加氢产物形貌,加氢产物进行表面喷镀金保护层处理。SEM主要技术参数为二次电子像分辨率3.0 nm;背散射电子像分辨率4.0 nm;放大倍数范围:300~5 000;电子枪加速电压20 kV;图像种类:二次电子像;标尺长度5~50 μm[20]。
1.2.4 水沉产物的核磁共振碳谱(13C nuclear magnetic resonance,13C NMR)分析
利用13C NMR分析水沉产物的碳谱,样品的制备方法为:取20 mg水沉产物充分溶解于0.6 mL氘代甲醇后移入核磁管中备用。
1.2.5 加氢产物的制备
不锈钢高压反应釜中加入1.2.1中制备的柚皮苷5.0 g,缓慢加入NaOH溶液使反应溶液终pH值为13,加入过量质量分数为10%钯碳催化剂,压力为1.5 MPa,温度设为40 ℃,置于磁力搅拌器上,在反应开始的2 h通入氢气,间隔1 h后关闭氢气阀门以保持反应速率。在12 h后结束反应,产物过滤回收催化剂,滤液通过732型阳离子交换树脂除去NaOH溶液,静置过滤烘干得到加氢改性产物[7]。
1.2.6 加氢产物的红外光谱分析
方法同1.2.2。
1.2.7 加氢产物的SEM分析
方法同1.2.3。
1.2.8 加氢产物的13C NMR分析
利用13C NMR分析加氢产物的碳谱,样品的制备方法同1.2.4。
1.2.9 Naringin DC甜度测定
参照甜度的感官比较法[21],测定样品甜度。
1.2.10 分子对接研究Naringin DC呈甜机理
G蛋白偶联受体是认可度较高的甜味受体,这类受体有2个与甜味相关的亚型,分别为T1R2、T1R3,用Discovery studio软件的modeller模块同源建模,构建蛋白质三维结构,然后用autodock vina做Naringin DC与2个蛋白受体模型的分子对接,从而从生化结构方面解释Naringin DC呈甜原因。
1.2.11 分子对接步骤
采用ChemBioDraw Ultra 12.0画出化合物柚皮苷二氢査尔酮的结构(图1),然后用ChemBio3D Ultra 12.0转化为三维结构,并使用MMFF94力场进行优化。人甜味受体T1R2和T1R3的三维结构均由SWISS-MODEL同源建模得到(模板蛋白PDB ID为5K5T)。T1R2和T1R3蛋白和柚皮苷二氢査尔酮均使用AutodockTools 1.5.6转化为PDBQT格式。采用Autodock vina 1.1.2进行分子对接研究。T1R2和T1R3蛋白活性位点的坐标均设置为:center_x=4.277,center_y=-16.512,center_z=-44.368;size_x=15,size_y=15,size_z=15。为了增加计算的准确度,将参数exhaustiveness设置为20。除了特别说明,其他参数均采用默认值。选取打分值最高的构象用PyMoL 1.7.6进行结果分析。
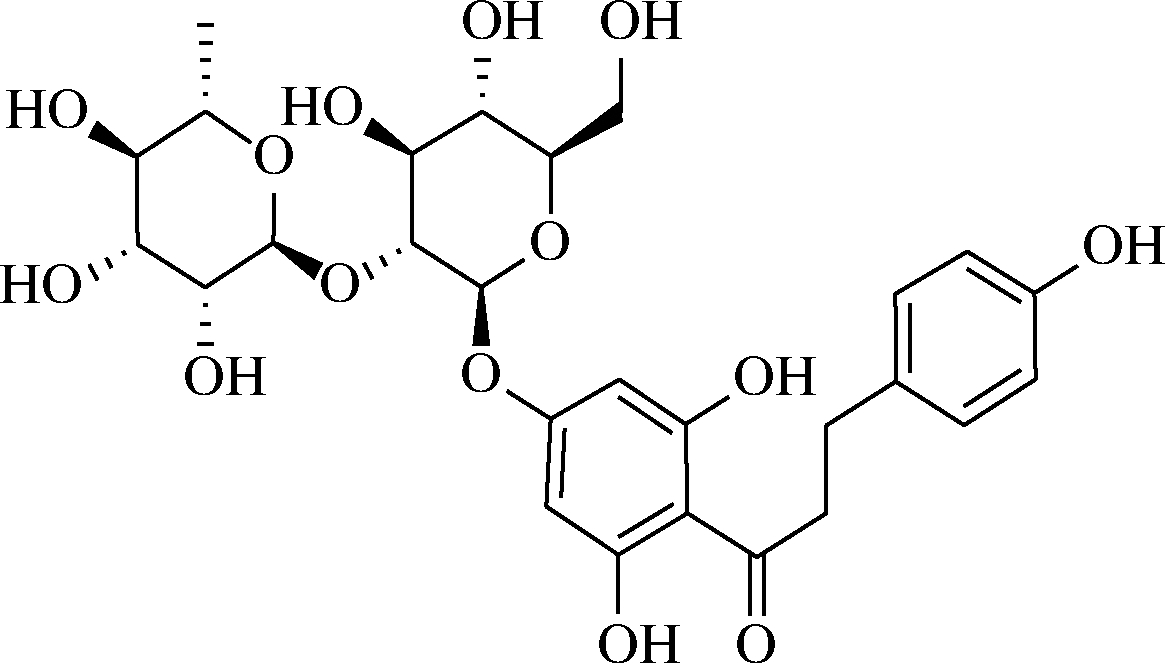
图1 柚皮苷二氢査尔酮的结构
Fig.1 Structure of naringin dihydroderone
1.2.12 药效团研究加氢改性产物呈甜机理
1.2.12.1 小分子的准备
采用ChemBioDraw Ultra 12.0画出化合物A-J的结构(图2),然后用ChemBio3D Ultra 12.0转化为三维结构,并使用MMFF94力场进行初步优化。然后将10个小分子分别用SYBYL-X 2.0进行优化。使用Tripos力场进行优化,加载Gasteiger-Huckel电荷,当能量梯度收敛达到0.005 kcal/(mol·A)或是迭代次数超过1 000,则优化停止。
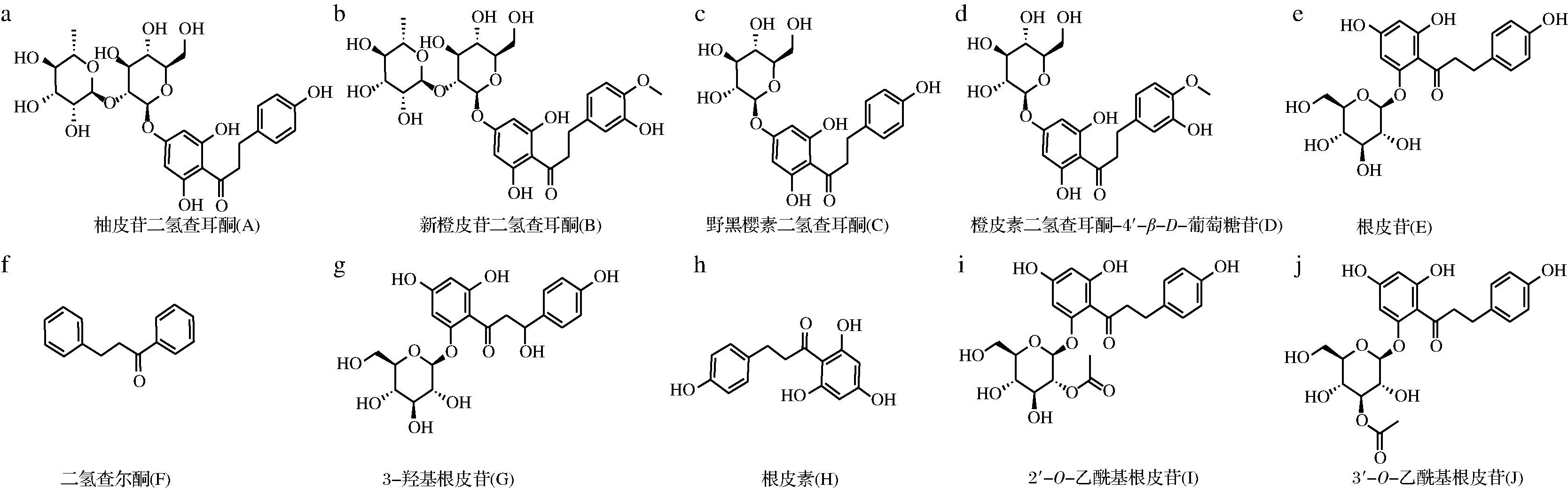
图2 十种二氢查尔酮分子结构
Fig.2 Ten molecular structures of dihydrochalcone
1.2.12.2 药效团的构建
启动Discovery Studio 2.5,使用Common Feature Pharmacophore Generation protocol 来产生药效团。
(1)将10个化合物导入 Discovery Studio 2.5
(2)为10个化合物添加药效团参数:Principal 和 MaxOmitFeat
使用View | Data Table展示Data Table,隐藏除Name以外的数据列。选择Data Table Name列的heading,鼠标右键点击选择Add Attributes,给分子添加Principal参数,点击OK。然后在Data Table中将化合物B的Principal值改为2。重复上面操作,为各小分子添加MaxOmitFeat参数,点击OK。最终得到3D Windows内容。
(3)加载protocol,输入计算参数
Ⅰ)加载protocol,双击Protocol Explorer窗口Pharmacophore下的Common Feature Pharmacophore Generation protocol。
Ⅱ)指定ligand:选择All ligands from a 3D view选项。
Ⅲ)其他参数设置:Conformation Generation设置为Best;Number of Leads That May Miss设置为2;Advanced | Complete Misses设置为1;Advanced | Feature Misses设置为1。
(4)点击Run按钮开始计算
双击Jobs Explorer 窗口中相应的行,出现Common Feature Pharmacophore Generation-html window。本次计算一共产生了10个药效团模型,可以点击ViewResults1.pl ViewResults10.pl依次察看各个药效团。
2 结果与讨论
2.1 加氢改性反应过程及机理
图3为柚皮苷催化加氢改性反应机理。
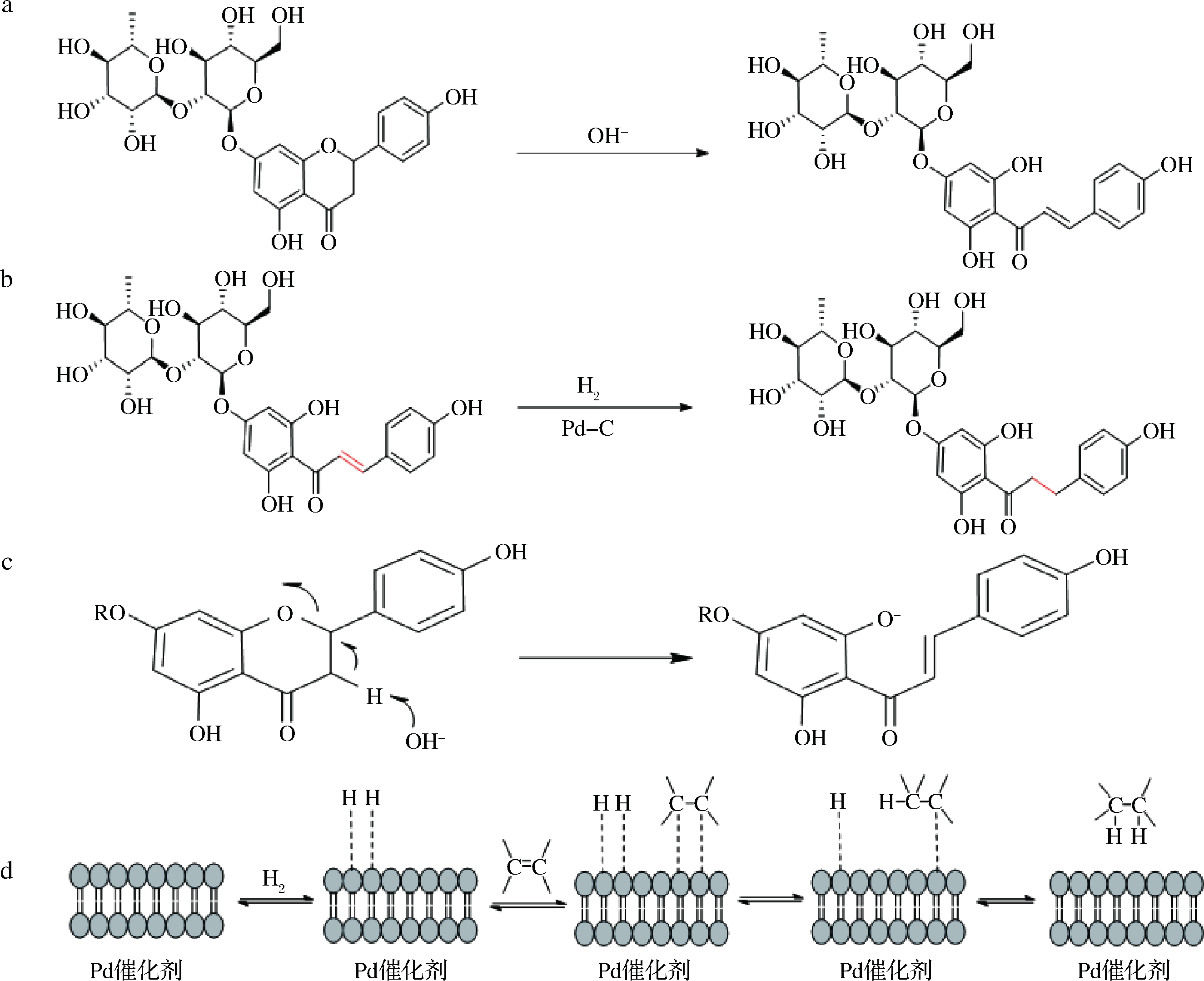
a-碱性开环;b-催化加氢;c-二氢黄酮碱性开环机理;d-Pd-C催化烯烃加氢机理
图3 柚皮苷催化加氢机理
Fig.3 Catalytic hydrogenation mechanism of naringin
首先柚皮苷在碱性条件下开环得到柚皮苷査尔酮,见图3-a及图3-b。具体反应机理如图3-c所示。碱拔掉羰基α-氢原子,成负离子,然后电子转至苄位碳上,碳氧键断开,成双键和氧负离子。
然后柚皮苷査尔酮在Pd-C催化下,加氢得到Naringin DC,催化加氢历程如图3-d所示:Pd催化剂将氢和烯吸附在它的表面,这种吸附是一种化学吸附。吸附后氢分子的原子之间的σ键变弱,氢几乎以原子状态被吸附在Pd催化剂表面,烯的π键打开,即与金属表面成键,氢逐步转到烯上,形成加成产物。
2.2 水沉产物的红外图谱
水沉得到的产物红外光谱图如图4所示。
由图4可以看出,水沉产物红外特征吸收峰分析如下:1 642.88 cm-1处有强吸收,为羰基的伸缩振动峰;3 393.71 cm-1处有宽而强的吸收峰,为羟基的伸缩振动峰,由氢键缔合后的羟基引起;2 919.28 cm-1为甲基不对称伸缩振动峰;1 521.00 cm-1为苯环上碳碳双健的骨架振动,符合柚皮苷的红外图谱[4]。
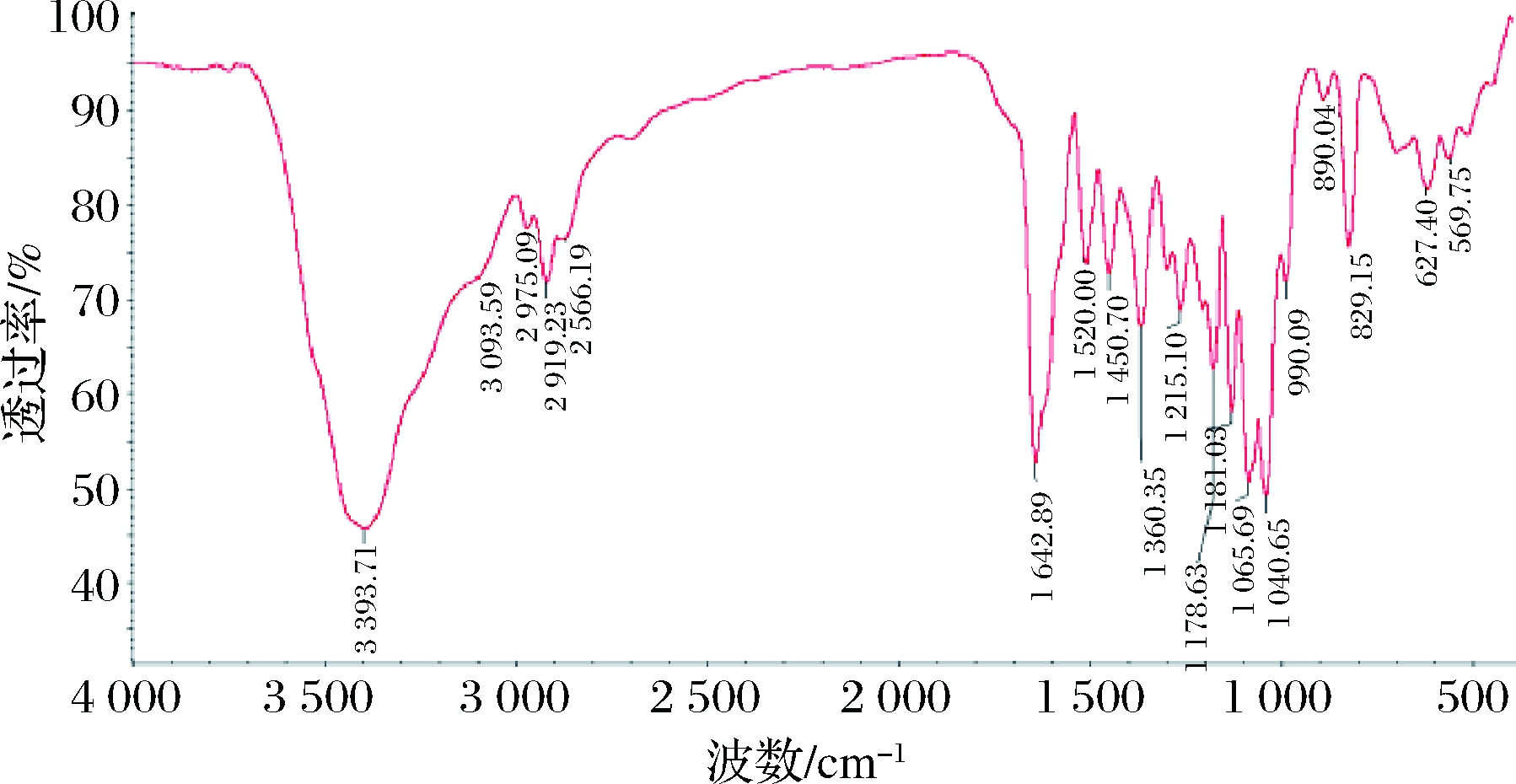
图4 水沉产物的红外光谱图
Fig.4 Infrared spectrum of aqueous precipitate products
2.3 水沉产物SEM结果
图5是不同视野下的水沉产物扫描电镜照片,可以看出加水静置过程中,柚皮苷以结晶的形式从水中析出。

注:a-×5 000;b-×2 000;c-×1 000;d-×500;e-×300
图5 水沉产物SEM照片
Fig.5 Scanning electron microscope photographs of water settlement products
2.4 加氢改性产物红外光谱结果分析
如图6所示,催化加氢产物在红外光3 390.27(—OH)、1 629.44(共轭—C![]() O)、2 923.84(甲基—CH3)、1 513.18、1 438.52 cm-1(苯环)处有吸收,初步推断为Naringin DC[4]。
O)、2 923.84(甲基—CH3)、1 513.18、1 438.52 cm-1(苯环)处有吸收,初步推断为Naringin DC[4]。
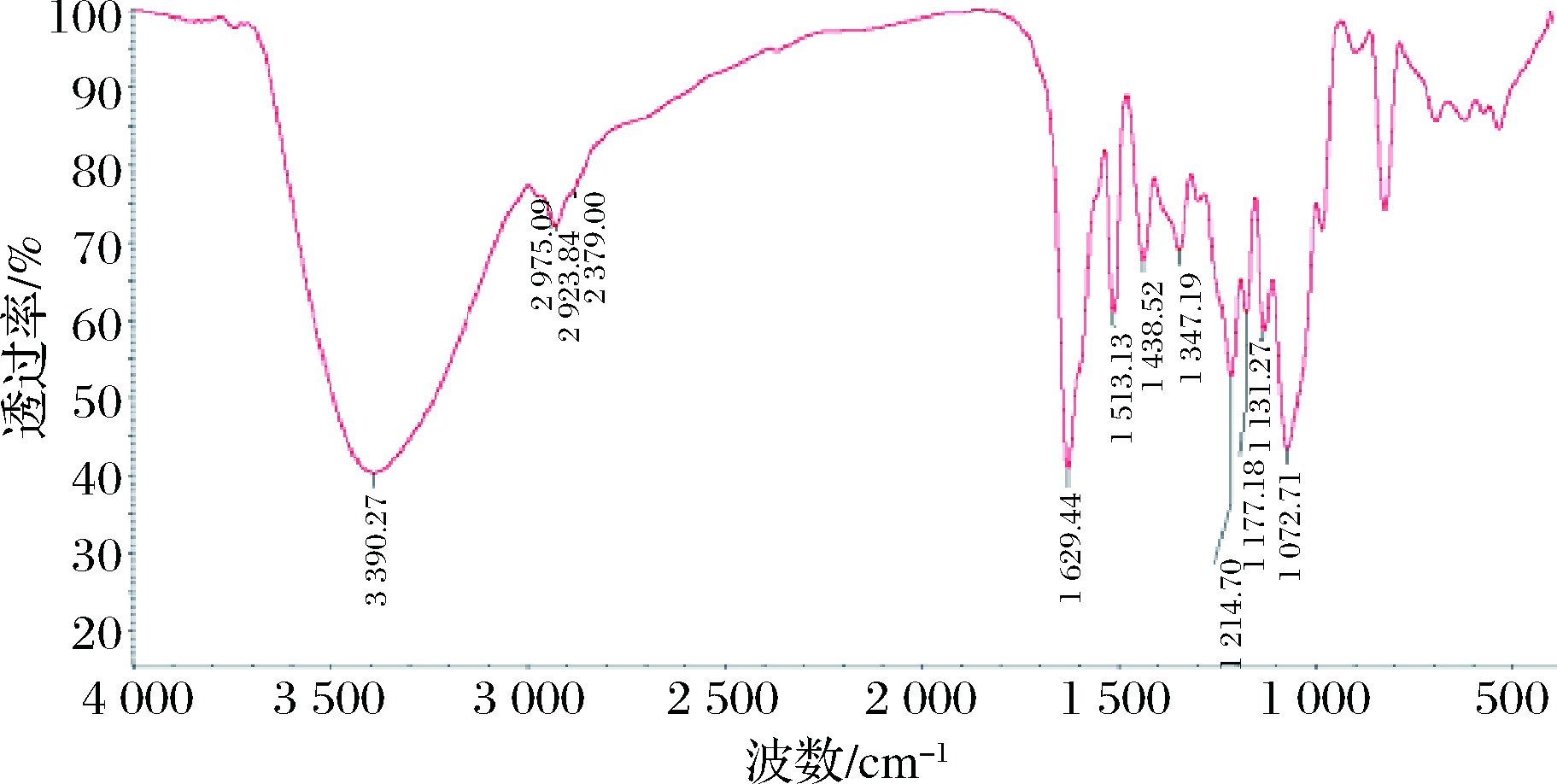
图6 催化加氢产物的红外光谱图
Fig.6 Infrared spectra of catalytic hydrogenation products
2.5 加氢改性产物SEM结果分析
图7为不同视野下的柚皮苷催化加氢改性产物扫描电镜图。

注:a-×5 000;b-×2 000;c-×1 000;d-×500;e-×100
图7 加氢改性产物SEM照片
Fig.7 SEM photographs of hydrogenated modified products
由图7可以看出,干燥的加氢改性产物是结晶状态,与Naringin DC的状态相同,由于在常温水溶液中容易形成晶体析出,因此Naringin DC在常温水溶液中的溶解度极低。
2.6 水沉产物13C NMR分析结果
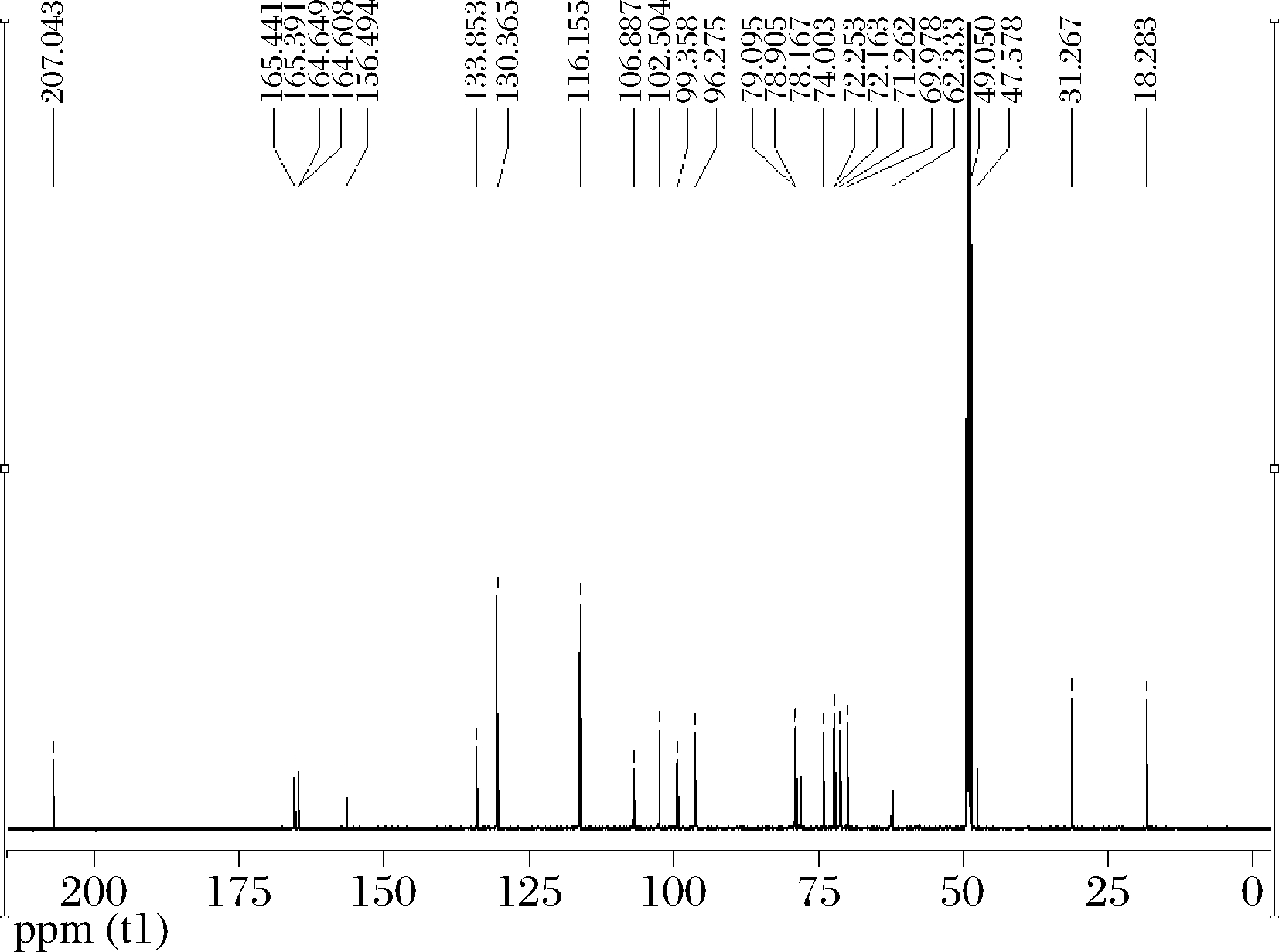
图8 水沉产物13C NMR结果
Fig.8 13C NMR of water settling products
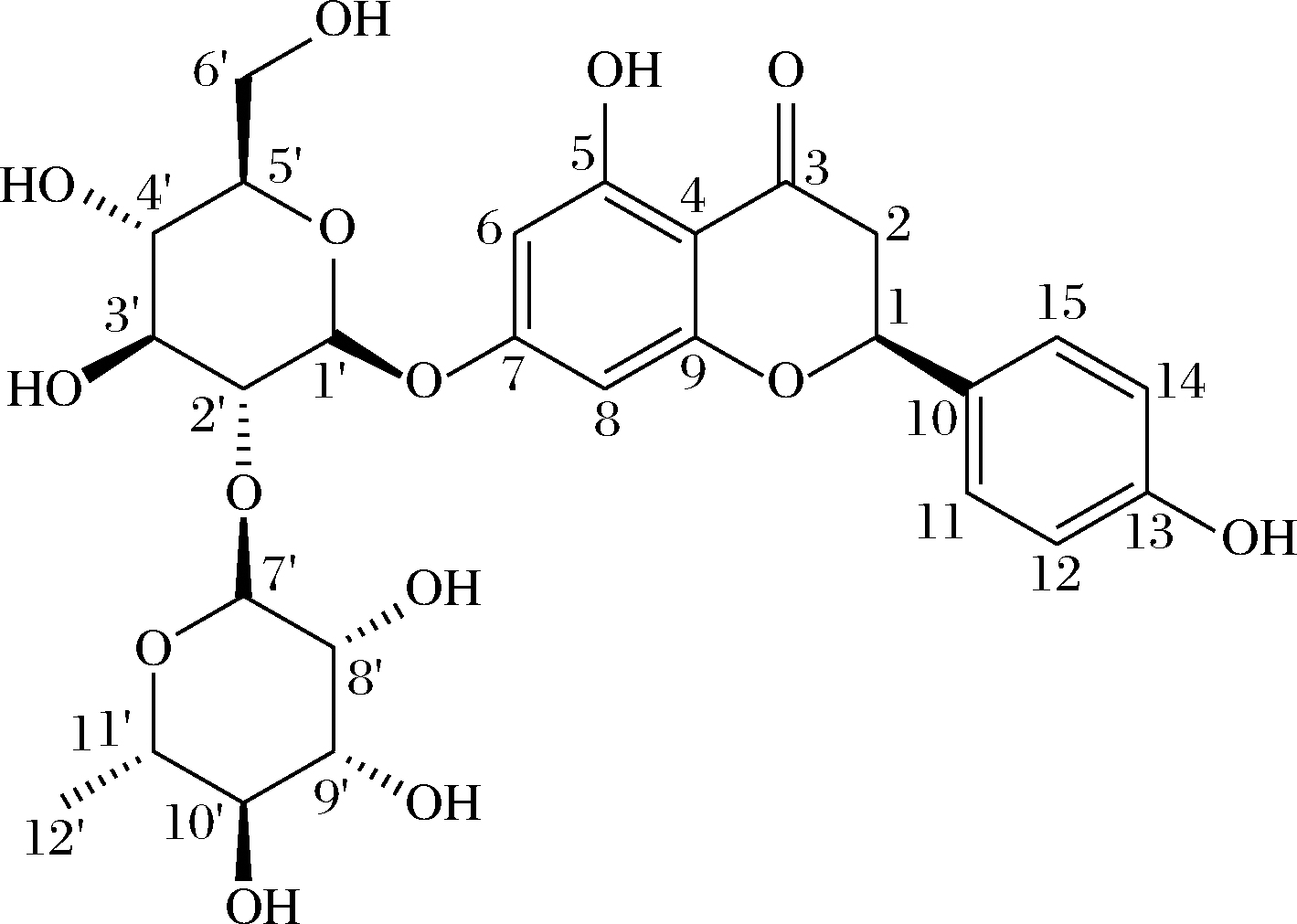
图9 柚皮苷分子结构式
Fig.9 Molecular structure formula of naringin
由图8可以看出:13C NMR,CD3OD,100 MHz,δ:207.04(C-3),165.44(C-7),164.65(C-5),164.61(C-9),156.49(C-13),133.85(C-10),130.37(C-11,15),116.16(C-12,14),106.89(C-4),102.50(C-1′,7′),99.36(C-6),96.28(C-8),79.09(C-2′),78.90(C-1),78.17(C-5′),74.00(C-3′),72.25(C-11′),72.16(C-8′),71.26(C-10′),69.98(C-9′),62.33(C-4′),47.58(C-6′),31.27(C-2),18.28(C-12′)。13C NMR图谱解析结果与柚皮苷的结构式(图9)一致,可知水沉产物是柚皮苷。
2.7 加氢产物13C NMR分析结果
由图10可知:13C NMR,CD3OD,100 MHz,δ:198.58(C-3),166.55(C-7),164.99(C-5),164.67(C-9),159.12(C-13),130.81(C-10),129.19(C-11,15),116.37(C-12,14),104.93(C-7′),102.58(C-1′),99.35(C-4),97.87(C-6),96.78(C-8),80.73(C-2′),79.12(C-5′),78.96(C-3′),78.13(C-11′),73.93(C-8′),72.18(C-10′),71.23(C-9′),70.02(C-4′),62.27(C-6′),44.19(C-2),43.97(C-1),18.28(C-12′)。13C NMR图谱解析结果与柚皮苷二氢查尔酮的结构式(图11)一致,因此加氢产物是柚皮苷二氢查尔酮。
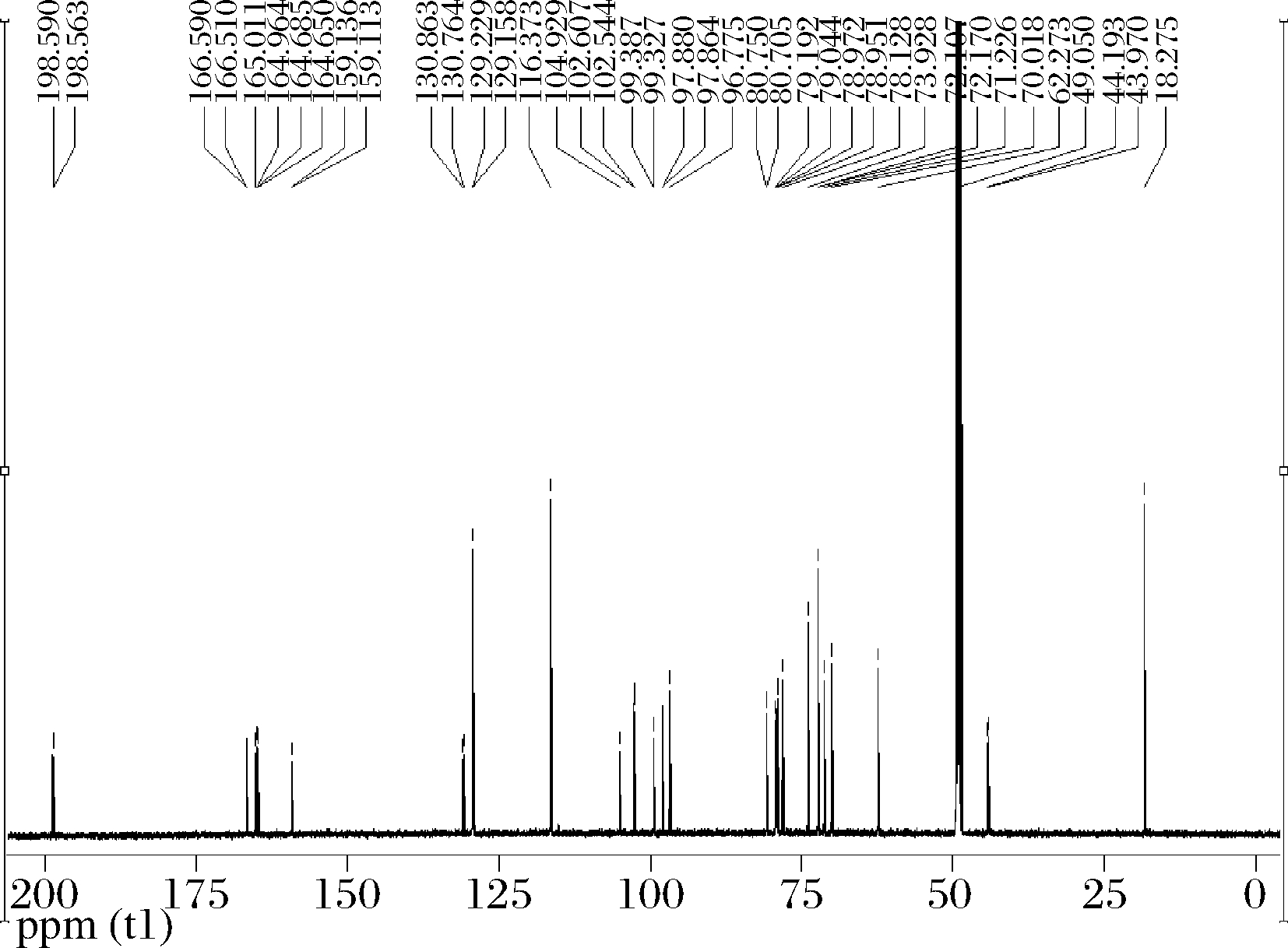
图10 加氢产物13C NMR结果
Fig.10 NMR results of hydrogenation products
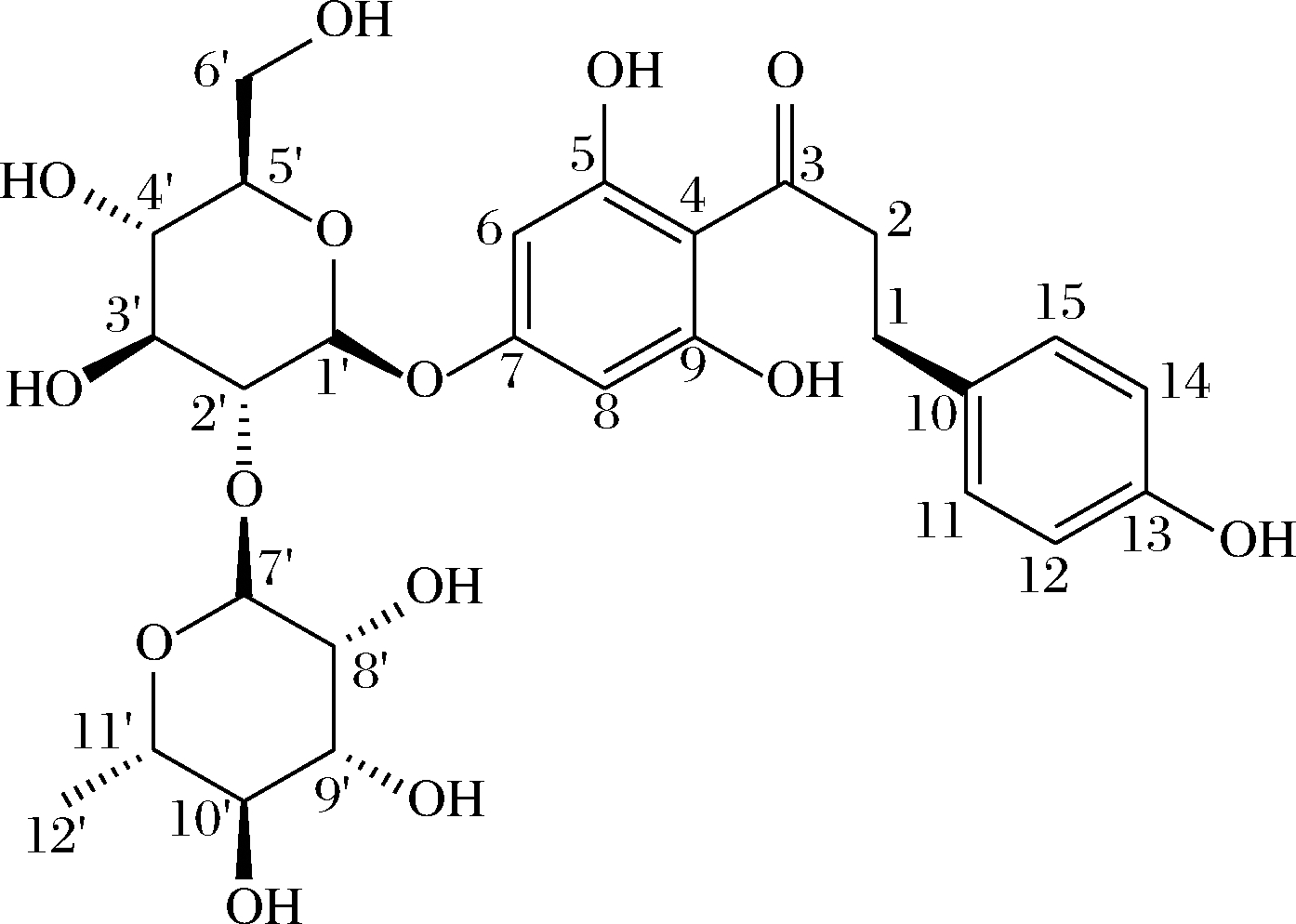
图11 柚皮苷二氢查尔酮分子结构
Fig.11 Molecular structure of naringin dihydrochalcone
2.8 甜度测定结果
根据1.2.9方法测定甜度结果如表1所示。
表1 甜度的测定结果
Table 1 Determination results of sweetness

样品样品浓度0.125%0.1%0.067%0.05%0.04%0.031 3%0.025%0.012 5%自制Naringin DC5123Naringin DC标准品4151新橙皮苷二氢查尔酮标准品13313三氯蔗糖标准品2144糖精钠标准品1910阿斯巴甜标准品3161安赛蜜标准品1172
由表1可以看出,感官比较法测得的甜度结果为:Naringin DC样品甜度为400;Naringin DC为400;NHDC为800;三氯蔗糖为400;糖精钠为500;阿斯巴甜和安赛蜜为100。
2.9 Naringin DC与G蛋白偶联受体3个亚基的结合
为了从分子水平阐明Naringin DC与人甜味受体T1R2和T1R3的作用模式,将Naringin DC分别对接至甜味受体T1R2和T1R3的活性口袋。结果如图12所示。
Naringin DC与甜味受体T1R2的作用模式如图12-a所示。Naringin DC末端的苯环与氨基酸残基Ala-166和Ile-167形成疏水性相互作用。Naringin DC可以与氨基酸残基Asp-142形成长为2.3 Å的氢键作用。所有的这些相互作用使得Naringin DC与T1R2形成稳定的复合物。
Naringin DC与甜味受体T1R3的结合模式如图12-b所示。Naringin DC的末端苯环可以分别与氨基酸残基His-145和His-388形成CH-π相互作用。重要的是,Naringin DC可以分别与氨基酸残基Thr-305和Ser-306形成长为3.5和3.3 Å的双重氢键作用。所有的这些相互作用使得Naringin DC与甜味受体T1R3形成稳定的复合物。

a-与T1R2活性口袋对接;b-与T1R3活性口袋对接
图12 分子对接结果
Fig.12 Molecular docking results
此外,计算结果显示,Naringin DC与人甜味受体T1R2和T1R3的结合能分别为-6.8和-7.0 kcal/mol,即Naringin DC与甜味受体亲和力的顺序为:T1R3>T1R2。推测Naringin DC极有可能是与人甜味受体T1R3结合,从而呈现出甜味。
总之,上述的分子对接研究对化合物Naringin DC与人甜味受体T1R2和T1R3的相互作用给予了详细的分析,为从分子水平解释Naringin DC的呈甜机理提供了新思路。
2.10 十种二氢查尔酮药效团结果
由图13~图14及表2可以看出,该药效团模型由3个药效特征组成,即1个氢键供体(紫色)和2个氢键受体(绿色)。依次点击各化合物的Name可以查看每个化合物与该药效团的匹配情况(图14)。匹配程度可以用1个量化的数值Fit值来衡量,Fit值越大,该化合物分子与药效团模型的匹配程度就越高。10种二氢查尔酮的甜味大小为B>A>D>C>J>I>E>G>F>H即NHDC>Naringin DC>橙皮素二氢查尔酮-4’-β-D-葡萄糖苷>野黑樱素二氢查尔酮>3’-O-乙酰基根皮苷>2’-O-乙酰基根皮苷>根皮苷>3-羟基根皮苷>二氢查尔酮>根皮素。
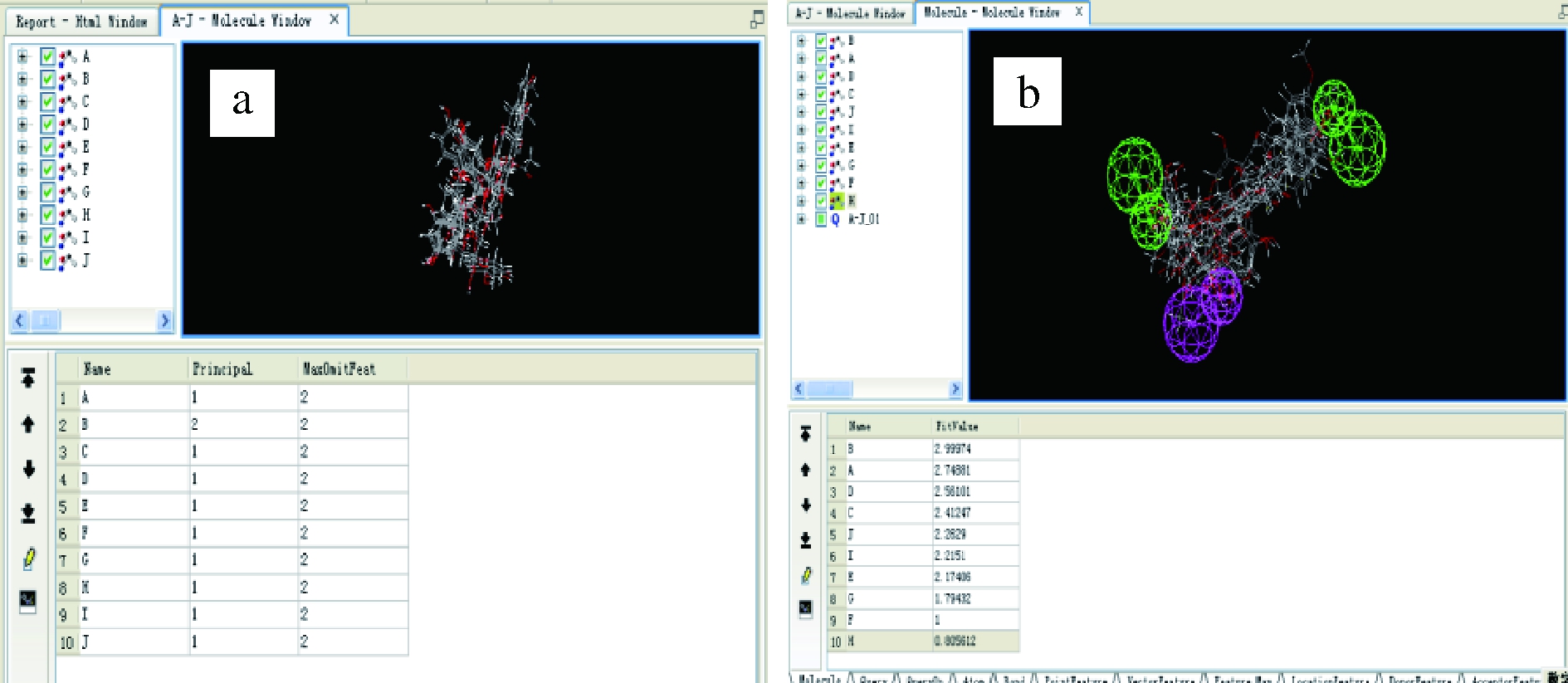
图13 药效团模型
Fig.13 Pharmacophore model
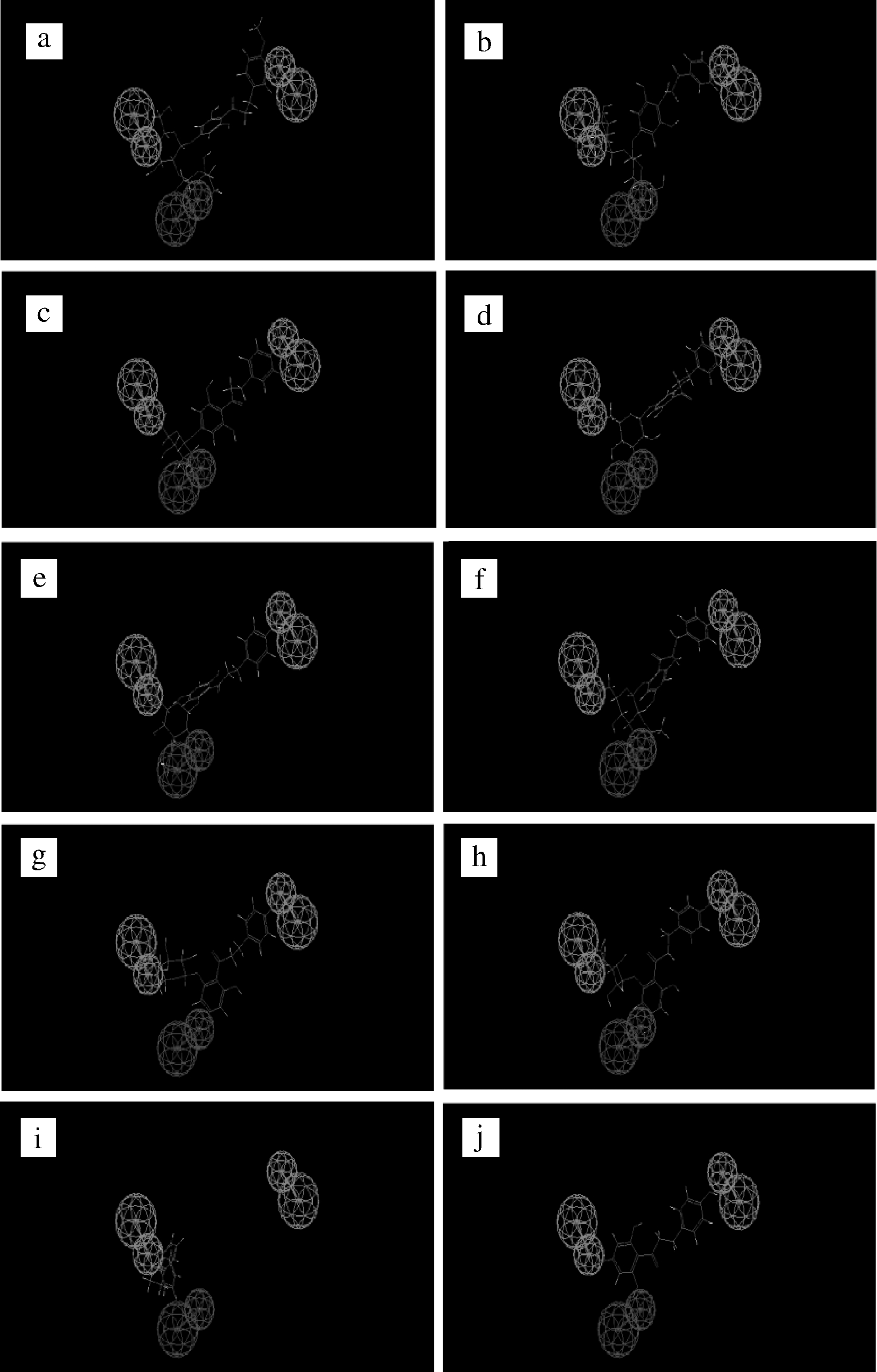
a-B;b-A;c-D;d-C;e-J;f-I;g-E;h-G;i-F;j-H
图14 化合物B、A、D、C、J、I、E、G、F和H与药效 团模型匹配情况
Fig.14 Matching of compounds B,A,D,C,J,I,E,G,F and H with pharmacophore model
表2 Fit值
Table 2 Fit value
BADCJIEGFMFit值2.999 742.748 812.561 012.412 472.262 92.215 12.174 061.794 3210.809 612
3 结论
在超声波180 W,超声时间50 min,液料比为60.9∶1(mL∶g),提取温度57.5 ℃,乙醇体积分数50.8%条件下[11],利用醇提水沉工艺纯化化橘红柚皮苷,得到纯度为95.1%的化橘红柚皮苷,不锈钢高压反应釜中加入该化橘红柚皮苷,缓慢加入NaOH溶液使终pH值为13,加入10%钯碳催化剂,在压力为1.5 MPa,温度为40 ℃,反应12 h后,反应达到平衡,产物过滤回收催化剂,滤液通过732型阳离子交换树脂除去氢氧化钠,静置过滤烘干得到催化加氢产物。通过红外光谱、SEM、液质联用表征产物结构为Naringin DC,并且其产率为90.3%,液相测定其纯度为97%~99%。该方法简单有效,得到的Naringin DC纯度高、口感清爽,甜度为400。
利用Discovery Studio软件测得Naringin DC与人甜味受体T1R2和T1R3的结合能力分别为-6.8和-7.0 kcal/moL,即Naringin DC与甜味受体亲和力的顺序为:T1R3>T1R2。Naringin DC极有可能是与人甜味受体T1R3结合,从而呈现出甜味。计算10种二氢查尔酮的药效团得到甜度大小为NHDC>Naringin DC>橙皮素二氢查尔酮-4’-β-D-葡萄糖苷>野黑樱素二氢查尔酮>3’-O-乙酰基根皮苷>2’-O-乙酰基根皮苷>根皮苷>3-羟基根皮苷>二氢查尔酮>根皮素。
[1] 徐小飞. 化橘红饮片炮制工艺及质量标准研究[D].广州:广州中医药大学,2012.
XU X F.The study of processing technology and quality standard of exocarpium decocting pieces[D].Guangzhou:Guangzhou University of Chinese Medicine,2012.
[2] 伍虹. 化橘红主要功能性成分分析及其果茶的研制[D].南昌:江西农业大学,2011.
WU H.Main functional components analysis of Exocarpium citri grandis and research on fruit tea[D].Nanchang:Jiangxi Agricultural University,2011.
[3] 胡梦君. 化橘红黄酮对LPS诱导的RAW264.7细胞的抗炎作用及其机制探究[D].武汉:华中农业大学,2017.
HU M J.The anti-inflammatory effect and mechanism of flavonoids in Exocarpium citri Grandis on LPS-induced RAW264.7 cells[D].Wuhan:Huazhong Agricultural University,2017.
[4] 张家辉. 化橘红柚皮苷调控Nrf2/HO-1及JAK2/STAT3信号通路保护脑缺血再灌注损伤的机制研究[D].南京:南京中医药大学,2017.
ZHANG J H.Naringin from Exocarpium citri Grandis ameliorates cerebral ischemia-reperfusion-induced injury via Nrf2/HO-1 and JAK2/STAT3 pathways[D].Nanjing:Nanjing University of Chinese Medicine,2017.
[5] 许鹭. 柚皮中柚皮苷的提取、分离纯化及其固体分散体与卵磷脂复合物的制备及表征[D].广州:华南理工大学,2015.
XU L.Extraction and purification of naringin in grapefruit peel and preparation and characterization of its solid dispersion and lecithin compound[D].Guangzhou:South China University of Technology,2015.
[6] 朱虹. 柚皮苷对人卵巢癌耐药细胞SKOV3/DDP的体外逆转作用及其机制[D].南昌:南昌大学,2017.
ZHU H. Mechanism and its reverse cisplatin resistance effects of naringin on human ovarian cancer cell line SKOV3/DDP in vitro[D].Nanchang:Nanchang University,2017.
[7] 欧阳振宇. 柚皮中部分有效成分的提取及二氢查尔酮的合成[D].南昌:南昌大学,2008.
OUYANG Z Y.Extraction of some kind of effective ingredients in pomelo peel and synthesis of dihydrochalcone[D].Nanchang:Nanchang University,2008.
[8] TANG D M,ZHU C F,ZHONG S A,et al.Extraction of naringin from pomelo peels as dihydrochalcone’s precursor[J].Journal of Separation Science,2011,34(1):113-117.
[9] 汤冬梅. 香柚中类柠檬苦素和柚皮苷提取纯化及二氢查尔酮合成[D].长沙:中南大学,2011.
TANG D M.Extraction and purification of limonin and naringin from pomelo and synthesis of dihydrochalcone[D].Changsha:Central South University,2011.
[10] 陈良, 刘传滨,张钦,等.新甲基橙皮苷二氢查尔酮的应用研究进展[J].饮料工业,2016,19(1):53-56.
CHEN L,LIU C B,ZHANG Q,et al.Research progress of application of neohesperidin dihydrochalcone[J].Beverage Industry,2016,19(1):53-56.
[11] 温辉梁, 欧阳振宇,胡晓波,等.新橙皮苷二氢查尔酮的研究进展[J].中国调味品,2008,33(10):70-73.
WEN H L,OUYANG Z Y,HU X B,et al.Research progress of neohesperidin dihydrochalcone[J].Chinese Condiment,2008,33(10):70-73.
[12] 彭颖, 童灿浩,王彦安,等.柚皮苷二氢查尔酮抗氧化活性的构效关系研究[J].原子与分子物理学报,2017,34(6):34-37.
PENG Y,TONG C H,WANG Y A,et al.Study on quantitative structure-activity relationship(QSAR) of naringin dihydrochalcone[J].Journal of Atomic and Molecular Physics,2017,34(6):34-37.
[13] 龚婷. 甜味受体T1R3与Gα-味导素在小鼠睾丸类固醇激素合成中的功能及作用机制研究[D].南京:南京农业大学,2016.
GONG T.Roles of sweet taste receptor T1R3 and alpha-gustducin in testicular streroidogenesis of mice[D].Nanjing:Nanjing Agricultural University,2016.
[14] GONG T,WEI Q W,MAO D G,et al.Expression patterns of taste receptor type 1 subunit 3 and α-gustducin in the mouse testis during development[J].Acta Histochemica,2016,118(1):20-30.
[15] GONG T,WEI Q W,MAO D G,et al.Effects of daily exposure to saccharin and sucrose on testicular biologic functions in mice[J].Biology of Reproduction,2016,95(6):116-118.
[16] 罗琼枝. 两色金鸡菊头状花序聚炔有效部位化学成分与抗炎活性研究[D].北京:北京中医药大学,2018.
LUO Q Z.Study on the effective components and anti-inflammatory activity of polyacetylene in the capitulum of two-color golden chicken[D].Beijing:Beijing University of Chinese Medicine,2018.
[17] 彭颖, 韦伟璇,邱松山,等.响应面优化化橘红柚皮苷超声辅助提取工艺[J].食品工业科技,2018,39(2):192-195.
PENG Y,WEI W X,QIU S S,et al.Ultrasonic-assisted exocarpium naringin extraction technique optimized by response surface methodology[J].Science and Technology of Food Industry,2018,39(2):192-195.
[18] 潘思轶,彭颖,卢琪.一种利用化橘红制备柚皮苷的方法:中国,CN109593110A[P].2 019-02-19.
PAN S Y,PENG Y,LU Q.A method for preparing naringin by using Exocarpium citri Grandis:China,CN109593110A[P].2019-02-19.
[19] 罗苏芹, 戴宏杰,黄惠华.不同制备方法对菠萝皮渣纳米纤维素的结构影响[J].包装与食品机械,2018,36(5):1-6.
LUO S Q,DAI H J,HUANG H H.Effect of different preparation methods on the structure of nanocellulose in pineapple peels[J].Packaging and Food Machinery,2018,36(5):1-6.
[20] LIU B G,ZHU X A,ZENG J,et al.Preparation and physicochemical characterization of the supramolecular inclusion complex of naringin dihydrochalcone and hydroxypropyl-β-cyclodextrin[J].Food Research International,2013,54(1):691-696.
[21] 朱甜甜, 徐淑臻,葛炳强,等.环糊精对阿斯巴甜的甜感增强作用及二者相互作用热力学[J].物理化学学报,2016,32(12):2 871-2 878.
ZHU T T,XU S Z,GE B Q,et al.Sweetness enhancement of aspartame in the presence of cyclodextrins and the thermodynamics in binding[J].Acta Physico-Chimica Sinica,2016,32(12):2 871-2 878.