白酒是由谷物发酵、蒸馏得到的高度饮料酒,含有种类众多、组成复杂的风味物质,如醛、酸、酯和高级醇类等,这些微量成分决定了酒体的风格和特点[1]。酱香型白酒因其生产周期长、工艺复杂,风味成分非常丰富。贮存时间是保证酱香风格的重要工艺措施,通过贮存老熟能够使新酒的异杂味减少,口感变得醇厚、柔和,香气也得到改善[2-4]。
由于白酒常用的仪器设备,如气相色谱-质谱联用技术和气相色谱-嗅闻-质谱联用技术等,精密性较高,样品大部分需要通过复杂的前处理才可进样分析[5-8],这不仅造成风味成分的损失,而且耗时耗力。因此,开发一种简单、快速、准确、无损的白酒分析方法是十分必要的。离子迁移色谱(ion mobility spectrometry,IMS)技术起源于20世纪60年代末70年代初,它是基于不同的气相离子在电场中迁移速度的差异来对物质进行表征的一项分析技术[9-10]。作为一种化学物质检测方法,IMS具有前处理简单、检测速度快、灵敏度高、体积小、成本低且无需真空系统,在常压下就可进行分析检测等优点[11-14],早期常用于防化侦察、应急反恐和缉毒缉私等[15]。近年来,随着气相色谱和离子迁移色谱的逐渐发展,将二者串联的仪器应运而生,气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)结合了气相色谱和离子迁移色谱技术的特点,具有双重分离及检测能力,已广泛应用于食品领域,如肉蛋类制品、油脂类、水产品、面包等[16-20]。
由于受乙醇的影响,IMS技术在酒类方面的研究多局限于低度酒,如葡萄酒、韩国真露烧酒、黄酒、荔枝酒、青梅酒等[21-25]。最早将其应用于白酒等高度酒的研究始于2014年,彭丽英等[26]利用实验室自制的离子迁移谱仪器建立了快速检测白酒中痕量邻苯二甲酸酯的方法。文献调研显示,GC-IMS应用于白酒等高度酒类的研究尚处于初步阶段,且相关实验条件并未优化。因此,本文利用模拟酒样探究了盐离子、酒精度、平衡体积、平衡温度和平衡时间对仪器分析效果的影响,选出了最优实验条件,并将其应用于不同贮存年限的酱香型白酒物质变化的研究,为GC-IMS更好地应用于白酒提供依据。
1 材料与方法
1.1 试剂与仪器
酒样:同一轮次不同贮存时间的郎酒样品各10 mL,详见表1。
乙醇,色谱级,美国Sigma-Aldrich公司;超纯水,德国Milli-Q公司;乙酸乙酯、乙酸丁酯、异丁酸乙酯、丁酸乙酯、戊酸乙酯、己酸乙酯、乳酸乙酯、异戊醇、正己醇、乙酸、糠醛均为色谱纯95%以上,Sigma-Aldrich公司;2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮、2-壬酮均为分析纯,北京国药集团化学试剂有限公司,用于校准保留指数;NaCl,分析纯,萨恩化学技术(上海)有限公司。
表1 不同贮存时间郎酒样品信息表
Table 1 Information of Langjiu Baijiu samples with different storage time
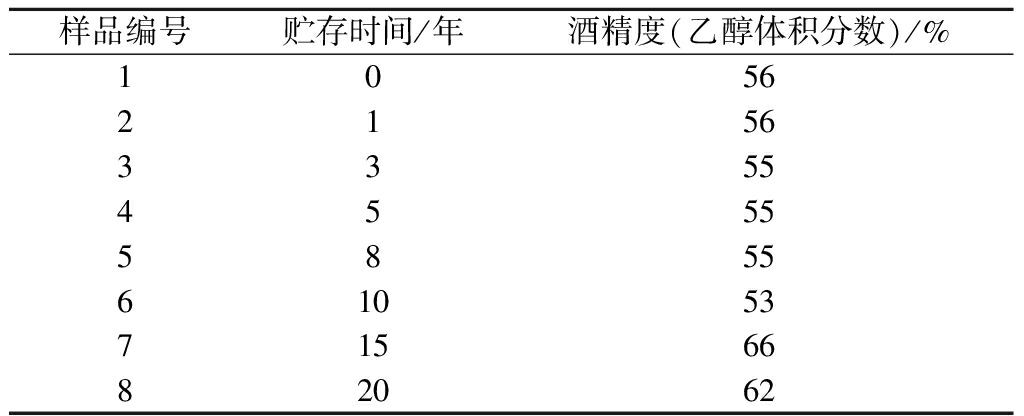
样品编号贮存时间/年酒精度(乙醇体积分数)/%1056 2156335545555855610537156682062
LAL 1T型酒精浓度计,广州市速为电子科技有限公司;Agilent 7890B气相色谱仪、DB-FFAP毛细管色谱柱(30 m×0.25 mm×0.25 μm),美国Agilent 科技有限公司;FlavourSpec®离子迁移色谱,德国 G.A.S Dortmund公司;Acrichi自动顶空进样器、20 mL顶空进样瓶,北京聚芯追风科技有限公司。
1.2 实验方法
1.2.1 模拟酒样配制
考虑到白酒在蒸馏过程中馏酒前段基酒乙醇含量较高,约为70%~80%[27-28],因此,用色谱级乙醇和超纯水配制80%模拟酒样,添加化合物及浓度如表2所示。
表2 模拟酒样中挥发性化合物信息表
Table 2 Information of volatile compounds in simulated Baijiu samples
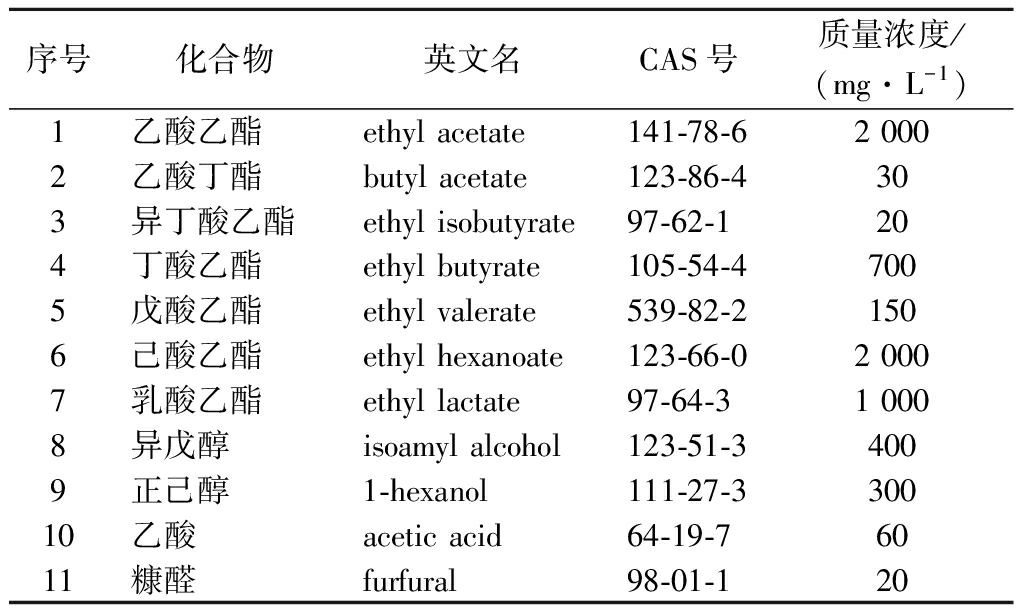
序号化合物英文名CAS号质量浓度/(mg·L-1)1乙酸乙酯ethyl acetate141-78-62 0002乙酸丁酯butyl acetate123-86-4303异丁酸乙酯ethyl isobutyrate97-62-1204丁酸乙酯ethyl butyrate105-54-4 7005戊酸乙酯ethyl valerate539-82-21506己酸乙酯ethyl hexanoate123-66-02 0007乳酸乙酯ethyl lactate97-64-31 0008异戊醇isoamyl alcohol123-51-34009正己醇1-hexanol111-27-330010乙酸acetic acid64-19-76011糠醛furfural98-01-120
这些物质均为白酒中含量较高的重要风味物质,其中乙酸乙酯、丁酸乙酯、乳酸乙酯、己酸乙酯为构成酒体的四大酯类,约占白酒总酯含量的 90%~95%,戊酸乙酯,乙酸丁酯、异丁酸乙酯为白酒贡献了重要的花果香及甜香;异戊醇和正己醇为白酒中重要的醇类物质,其中异戊醇对维持白酒风格具有重要作用,含量过低,会失去白酒固有风格;乙酸为白酒主要的挥发性酸,主要起呈味作用;糠醛在各类白酒中含量均较高,为白酒带来了焦糊风味[29-30]。因此,选择以上物质作为模拟酒样的添加物质。
1.2.2 前处理条件优化
首先考虑盐离子对酒样中物质检测的影响,以30%模拟酒样作为样品,对不加盐与加盐至饱和样品进样分析,确定酒样的检测是否需要加盐处理。其次,对酒精度进行优化,以80%模拟酒样作为母液,分别用超纯水稀释配制成酒精度为80%、70%、60%、50%、40%、30%、20%和10%的一系列模拟酒样,分别取1 mL于洁净顶空瓶中,在60 ℃下平衡10 min进样分析,探究酒精度对实验结果的影响;其次,以30%作为节点,配制相同物质含量、不同酒精度(30%、20%、10%、7%、5%)的模拟酒样,采用同上相同的分析方法,找出最适合GC-IMS分析的酒精度。最后,以最优酒精度配制模拟酒样作为样品,对平衡体积(0.5、1、2、3、4、5、6、7、8、9、10 mL)、平衡温度(20、30、40、50、60、65 ℃)、平衡时间(0、2、4、6、8、10 min)进行优化,以上实验均平行3次。
1.2.3 真实酒样制备
取适量样品于10 mL离心管中,用超纯水对酒样进行稀释处理。
1.2.4 GC-IMS条件
自动进样器条件:炉温设定(平衡温度)依实验情况而定,管温设定为90 ℃,阀温设定为85 ℃;取样时间20 s,进样时间20 s,加压时间30 s,反吹时间1 min,分析周期50 min。
GC条件:DB-FFAP色谱柱,分析时间50 min;载气为N2(纯度≥99.999%);升温程序:初始温度40 ℃,保持5 min;以2 ℃/min升温至80 ℃,保持3 min;最后以10 ℃/min升温至230 ℃,不保持;以240 ℃后运行3 min。
IMS条件:β射线,3H为放射源;漂移气为N2(纯度≥99.999%);漂移气流速150 mL/min;漂移管温度45 ℃;正离子化模式。
1.2.5 数据处理
通过仪器自带分析软件LAV(Laboratory Analytical Viewer)、定性软件GC×IMS Library Search(NIST-2014、IMS数据库) 进行化合物定性。运用LAV中插件Reporter进行样品GC-IMS谱图对比,用插件Gallery Plot进行GC-IMS指纹图谱的对比。
2 结果与分析
2.1 盐离子
图1为GC-IMS分析盐离子对模拟酒样检测影响的结果图,所有图均经过归一化处理。其中图1-a为二维谱图,迁移时间1.0处的垂直红线表示反应离子峰(reaction ion peak,RIP),RIP两侧的每个点代表一种化合物,点的颜色深浅及面积表示物质含量大小,红色越深、面积越大表示含量越高。图1-b为差谱图,以不加盐的模拟酒样作为参照样品,若其他酒样中的物质含量高于参照样品,则显示为红点,反之为蓝点。
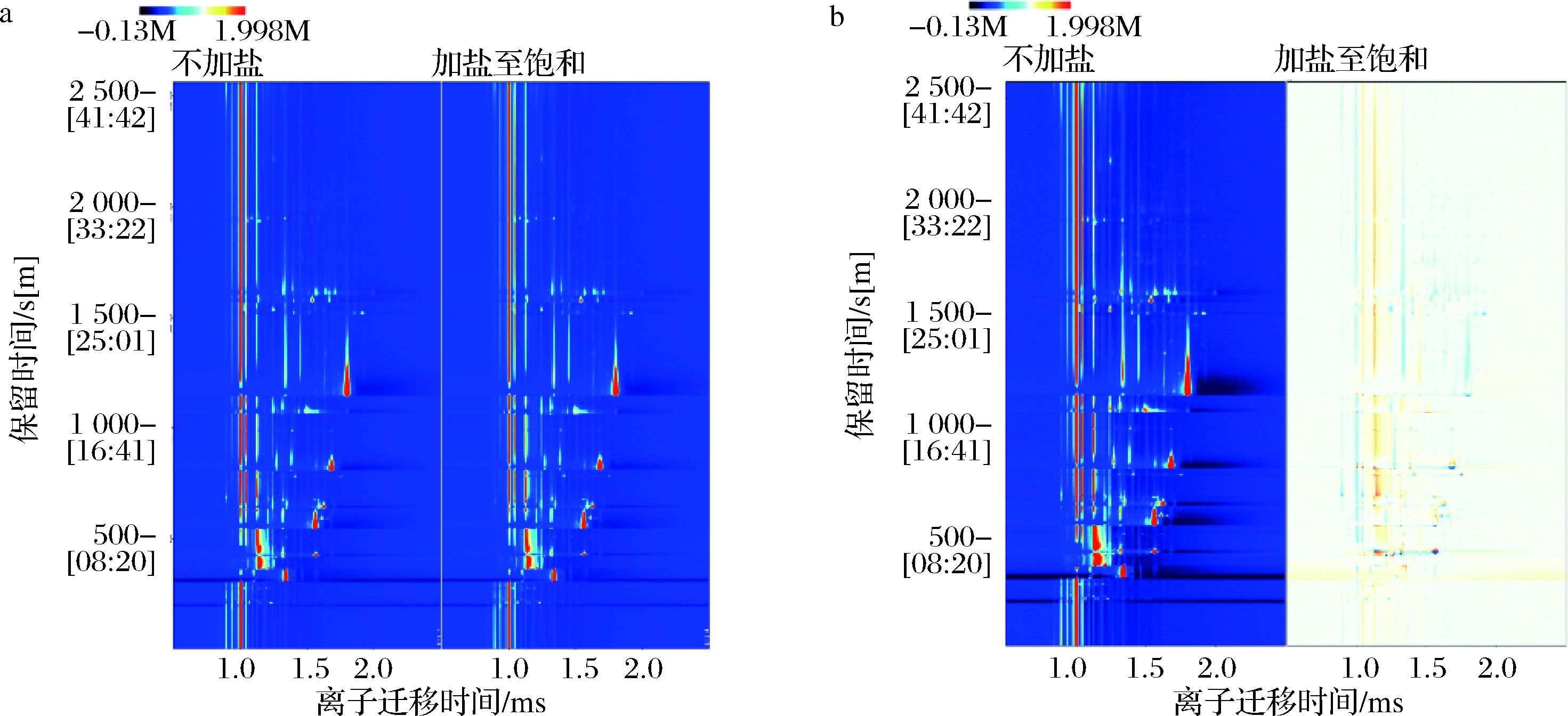
a-二维谱图;b-差谱图
图1 盐离子对模拟酒样影响的GC-IMS分析谱图
Fig.1 GC-IMS spectrum showing the effect of salt ions on simulated liquor samples
从图1-a对比可知,样品中不加盐与加盐至饱和,物质的出峰情况基本相同,即物质含量基本相同。图1-b对比可知,加盐至饱和的模拟酒样中物质的含量较不加盐稍低,因此,确定对于酒样的分析采取不加盐的措施,直接取样分析。
2.2 酒精度
图2为GC-IMS分析不同酒精度的模拟酒样结果图。其中,图2-a二维谱图上方红色曲线表示化合物峰体积之和变化情况,图2-b、图2-d和图2-f差谱图分别以酒精度为30%、30%和10%的模拟酒样作为参照样品。

a-10%~80%模拟酒样二维谱图;b-10%~80%差谱图;c-10%~30%模拟酒样二维谱图; d-10%~30%差谱图;e-5%~10%模拟酒样二维谱图;f-5%~10%差谱图
图2 不同酒精度模拟酒样GC-IMS分析谱图
Fig.2 GC-IMS spectrum of simulated liquor samples with different alcohol contents
从图2-a对比可知,随着酒精度的上升,即稀释倍数的减小,多数化合物的含量呈先上升后下降的变化趋势,当酒样酒精度为30%时化合物含量达到最大值,说明酒精度为30%是GC-IMS正常工作所能承受的最大酒精度,当酒样酒精度≥40%时,一些物质的峰强度明显减小,物质总含量显著下降。同理,图2-b中酒精度<30%的模拟酒样,随酒精度的升高,蓝色面积逐渐减小,即物质含量逐渐增加;酒精度>30%的样品,随酒精度的升高,蓝色逐渐加深且面积逐渐增大,即物质含量逐渐降低。分析显示主要有以下2个原因:首先,在有限空间的顶空瓶中,高浓度的乙醇挥发至顶空,占据了大量空间,当蒸气压达到饱和时,便抑制了其他化合物的挥发,因此,乙醇含量越高,对其他物质的挥发抑制作用越大;其次,酒精度过高也会对IMS检测造成影响,此时乙醇含量对仪器的影响不可忽略。所以,为保证实验结果的准确性,需将样品稀释后再进样分析。
最后,以酒精度30%作为节点,分析酒精度<30%时不同酒精度、相同物质含量下物质的出峰情况,以期找到最优的酒样稀释度数。结果如图2-c~图2-f所示,当酒精度>10%时,随酒精度的升高,物质的含量呈逐渐减小的趋势;当酒精度<10%时,随酒精度的降低,物质含量稍有降低,后几乎不变,说明酒精度10%为最佳稀释度数。
2.3 平衡体积
图3为GC-IMS分析不同平衡体积的模拟酒样结果。

a-二维谱图;b-三维谱图
图3 不同平衡体积GC-IMS 分析谱图
Fig.3 GC-IMS spectrum of simulated liquor samples with different equilibrium volumes
从图3-a和图3-b对比可知,随样品平衡体积的增加,物质的总含量呈现先上升后缓慢波动下降的趋势,到1和2 mL时达到最大值。从图3-b也可知,当平衡体积为1和2 mL时,酒样中被检测到的化合物最多,含量最高。由于1和2 mL样品中被检测到的物质浓度相近,根据绿色、节约原则,选则1 mL作为最优平衡体积。
2.4 平衡温度
图4为GC-IMS分析不同平衡温度的模拟酒样的结果图,其中图4-b和图4-d差谱图均以平衡温度为60 ℃的模拟酒样作为参照样品。

a-10~60 ℃二维谱图;b-10~60 ℃差谱图;c-60和65 ℃二维谱图; d-60和65 ℃差谱图
图4 不同平衡温度GC-IMS分析谱图
Fig.4 GC-IMS spectrum of simulated liquor samples with different equilibrium temperatures
图4-a和图4-b对比可知,随平衡温度的增加,物质的总含量呈逐渐增加的趋势,到60 ℃时达到最大值。其次,补充了平衡温度60和65 ℃的物质出峰情况对比(图4-c和图4-d),当平衡温度为65 ℃时,物质的总含量明显低于60 ℃,因此,60 ℃为平衡温度的拐点,低于或高于此温度,物质的出峰均有减弱的趋势。综合来看,当平衡温度为60 ℃时,总的物质浓度最高,因此确定最优的平衡温度为60 ℃。
2.5 平衡时间
图5为GC-IMS分析不同平衡时间的模拟酒样结果图。其中,图5-b差谱图以平衡时间为0 min的模拟酒样作为参照样品。从图5-a和图5-b对比可知,随样品平衡时间的增加,物质的总含量呈现逐渐上升的变化趋势,到10 min时达到最大值。总体来说,平衡时间为10 min时物质的总含量最高。

a-二维谱图;b-差谱图
图5 不同平衡时间GC-IMS分析谱图
Fig.5 GC-IMS spectrum of simulated liquor samples with different equilibrium times
2.6 同一轮次不同贮存时间的酱香型白酒分析
利用上述最优实验条件,对同一轮次不同贮存时间的酱香型白酒样品进行分析,包括单体和二聚体共积分了143个峰,其中通过谱库检索共定性出65个峰,45种化合物,如表3所示,包括15种酯类、8种醇类、1种酸类、9种醛类、8种酮类、2种含氮化合物、1种含硫化合物和1种其他。
利用LAV软件对样品及物质进行对比分析,结果如图6所示,其中图6-a为不同贮存时间酒样的二维迁移谱图,图6-b为指纹图谱,图中每一行代表1个样品,每个样品列出了平行2次的结果,每一列代表1个物质,后缀“M(Monomer)”表示物质的单体,“D(Dimer)”表示物质的二聚体,当物质浓度较高时,会出现2个化合物共用1个水合离子(或电子)的情况。二维谱图对比了不同酒样间物质数量及含量的差异情况,从图中可以发现15及20年的酒样中物质浓度显著高于其他酒样,结合指纹图谱可以发现,位于绿色框中的物质乙酸丁酯、己酸丙酯等在15及20年酒样中含量显著升高,可能与这2个样品贮存后期酸和醇的酯化反应有关。橘色框中2-庚酮、2-甲基丁酸乙酯等在不同贮存时间的酒样中随贮存时间的延长呈逐渐增长的趋势,说明这些化合物在贮存较久的酒样中有一定的积累,且年份越长的酒样中含量越高,其中酯类物质的增长与酯化反应及贮存过程酒体中金属离子形成胶体有关,减少了酯的挥发和水解;丁醇、糠硫醇、2-丙酮、2-庚酮等沸点高、极性大、不易挥发,随贮存时间延长逐渐积累;醛类物质的升高与醇类物质的氧化有关。红色框中乳酸乙酯、乙酸乙酯等随贮存时间的延长呈降低的趋势,这与其在贮存过程中逐渐水解有关;芳樟醇和2-丙醇沸点低、易挥发;辛醛的减少与酒中的溶解氧氧化有关。黑色框中2-甲基丙醇、异戊醇等随贮存时间的延长呈先上升后下降的变化趋势,这类物质可能是内部物质合成或者是分解的产物,后期的降低可能与其参与氧化反应有关。此外,除了已定性的化合物剩余未知化合物有待于进一步鉴定研究。
表3 通过GC-IMC对同一轮次不同贮存时间酱香型白酒 挥发性化合物的定性结果
Table 3 Volatile compounds of sauce flavor Baijiu with different storage times by GC-IMS

序号化合物CAS#分子式分子质量保留指数保留时间/s迁移时间/ms1丙烯醛 C107028C3H4O56.1852.8164.9451.065 122丙酮 C67641C3H6O58.1863.4173.1321.117 63乙酸 C64197C2H4O260.11 4941 726.0041.156 834丙醇M C71238C3H8O60.11 047.5357.1911.110 575丙醇D C71238C3H8O60.11 051.1362.9391.250 016异丙醇C67630C3H8O60.1926.2221.2851.210 877异丁醛C78842C4H8O72.1813.4134.7791.091 0782-丁酮C78933C4H8O72.1870.9178.8351.064 089丁醇M C71363C4H10O74.11 153.9588.5241.182 4810丁醇D C71363C4H10O74.11 153.4587.2951.376 2711异丁醇M C78831C4H10O74.11 105.8459.9451.170 8112异丁醇D C78831C4H10O74.11 105.6459.5081.362 38132-戊酮C107879C5H10O86.1996.7275.8871.373 114戊醛 C110623C5H10O86.1995.7274.5941.414 4415异戊醛 C590863C5H10O86.1867.5176.2141.171 56161-戊醇M C71410C5H12O88.11 260.1906.5321.251 63171-戊醇D C71410C5H12O88.11 260.4907.4291.508 2418异戊醇M C123513C5H12O88.11 216.7768.8681.244 119异戊醇D C123513C5H12O88.11 216.9769.4931.491 520乙酸乙酯M C141786C4H8O288.1902.1202.8131.099 3421乙酸乙酯D C141786C4H8O288.1900.8201.7911.339 6322糠醛MC98011C5H4O296.11 484.91 693.5331.082 7323糠醛D C98011C5H4O296.11 484.81 693.1321.331 83242,3-戊二酮C600146C5H8O2100.11 035.2337.5121.221 4725丙酸乙酯C105373C5H10O2102.1971.1255.6851.452 9626正己醇MC111273C6H14O102.21 364.71 265.3691.326 8627正己醇DC111273C6H14O102.21 364.11 263.281.638 7228苯乙烯C100425C8H8104.21 2921 007.6251.054 92
续表3

序号化合物CAS#分子式分子质量保留指数保留时间/s迁移时间/ms29苯甲醛C100527C7H6O106.11 524.61 835.0471.148 9830乳酸乙酯MC108509C6H8 N2108.11 353.41 224.9741.138 231乳酸乙酯DC108509C6H8 N2108.11 3531 223.5811.536 6932糠硫醇C98022C5H6OS114.21 464.21 619.81.124 04332-庚酮C110430C7H14O114.21 192.1690.7691.261 334乙酸丁酯MC123864C6H12O2116.21 087.9421.8081.237 235乙酸丁酯DC123864C6H12O2116.21 087.5421.3141.622 8836丁酸乙酯MC105544C6H12O2116.21 047356.441.190 0437丁酸乙酯DC105544C6H12O2116.21 047.6357.3691.559 5238异丁酸乙酯C97621C6H12O2116.2980.9263.2311.563 8639苯乙酮C98862C8H8O120.21 678.42 382.8471.162 13402-乙酰基吡啶C1122629C7H7 NO121.11 622.72 184.2691.119 141正辛醛C124130C8H16O128.21 301.81 041.181.405 6842仲辛酮C111137C8H16O128.21 291.31 005.1981.329 5643己酸甲酯C106707C7H14O2130.21 197.8708.8881.286 4444戊酸乙酯MC539822C7H14O2130.21 146.5568.8631.270 9545戊酸乙酯DC539822C7H14O2130.21 143.5560.8751.68146乙酸异戊酯MC123922C7H14O2130.21 133.6534.341.306 1547乙酸异戊酯DC123922C7H14O2130.21 133.9535.2031.749 3748异戊酸乙酯MC108645C7H14O2130.21 080.6410.1321.255 549异戊酸乙酯DC108645C7H14O2130.21 081.9412.3171.655 78502-甲基丁酸乙酯MC7452791C7H14O2130.21 063.9383.4311.238 54512-甲基丁酸乙酯DC7452791C7H14O2130.21 062.8381.7251.651 952壬醛C124196C9H18O142.21 396.81 379.6791.457 0
续表3
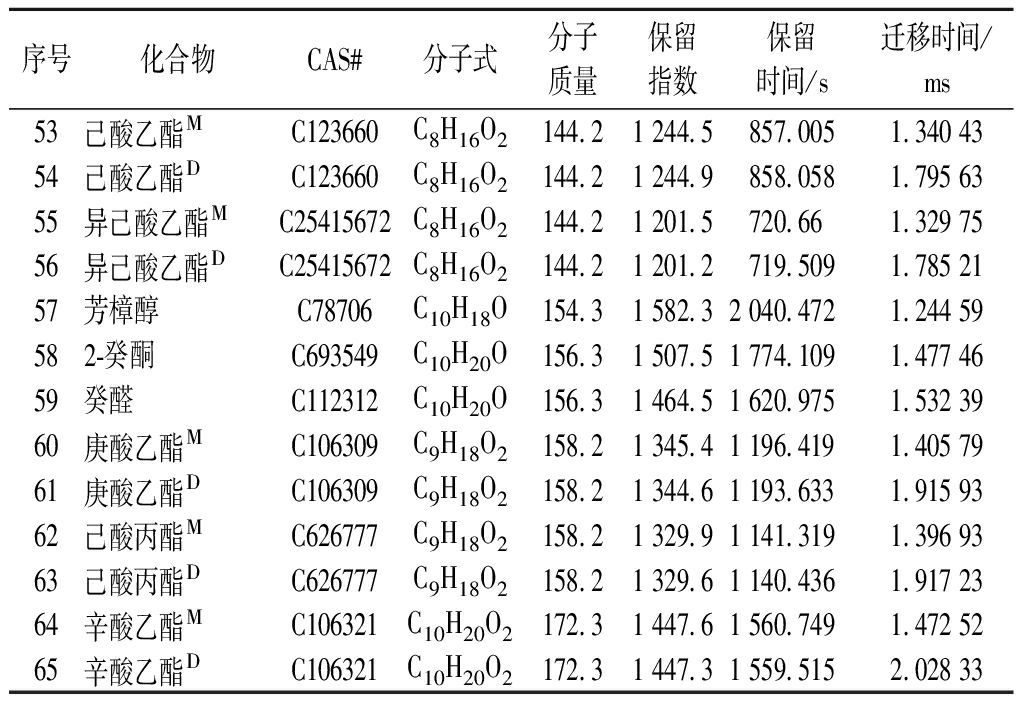
序号化合物CAS#分子式分子质量保留指数保留时间/s迁移时间/ms53己酸乙酯MC123660C8H16O2144.21 244.5857.0051.340 4354己酸乙酯DC123660C8H16O2144.21 244.9858.0581.795 6355异己酸乙酯MC25415672C8H16O2144.21 201.5720.661.329 7556异己酸乙酯D C25415672C8H16O2144.21 201.2719.5091.785 2157芳樟醇C78706C10H18O154.31 582.32 040.4721.244 59582-癸酮C693549C10H20O156.31 507.51 774.1091.477 4659癸醛C112312C10H20O156.31 464.51 620.9751.532 3960庚酸乙酯MC106309C9H18O2158.21 345.41 196.4191.405 7961庚酸乙酯DC106309C9H18O2158.21 344.61 193.6331.915 9362己酸丙酯MC626777C9H18O2158.21 329.91 141.3191.396 9363己酸丙酯DC626777C9H18O2158.21 329.61 140.4361.917 2364辛酸乙酯MC106321C10H20O2172.31 447.61 560.7491.472 5265辛酸乙酯DC106321C10H20O2172.31 447.31 559.5152.028 33
注:上标中“M(Monomer)”表示物质的单体,“D(Dimer)”表示物质的二聚体

a-二维谱图;b-指纹图谱
图6 同一轮次不同贮存时间酱香型白酒GC-IMS分析谱图
Fig.6 GC-IMS spectrum of sauce-flavor Baijiu in the same round and different storage time
3 结论与讨论
实验利用模拟酒样探究了GC-IMS应用于白酒研究的最优条件。首先,确定了酒样不需要加盐处理;其次,确定了GC-IMS正常工作所能检测酒样的最高酒精度为30%,最优酒样稀释度数为10%;最后,确定了最优平衡体积、平衡温度和平衡时间,分别为1 mL、60 ℃和10 min。在最优条件下,对同一轮次不同贮存时间的郎酒样品进行分析,发现贮存时间不超过10年的样品中,物质含量缓慢变化,多数物质在不同贮存时间的样品中随贮存时间的延长呈现增长的趋势,其中乙酸丁酯、己酸甲酯、戊醇、戊酸乙酯、庚酸乙酯、异己酸乙酯、己酸丙酯、己醇、辛酸乙酯、2-戊酮、戊醛在贮存时间为15及20年的酒样中含量显著高于其他贮存时间的酒样。
通过对酒精度、平衡体积及平衡温度等条件的优化建立了快速、无损、痕量的白酒检测新方法,为GC-IMS应用于白酒等高度酒领域提供理论与方法借鉴。但是,由于仪器自带数据库中化合物数量有限,定性方面还存在一定的不足,因此,建立完整成熟的数据库和实验方法是GC-IMS应用于各个领域的必要基础。
[1] LIU H L,SUN B G.Effect of fermentation processing on the flavor of baijiu[J].Journal of Agricultural and Food Chemistry,2018,66(22):5 425-5 432.
[2] 余乾伟.传统白酒酿造技术[M].3版.北京:中国轻工业出版社,2019:329-336.
YU Q W.Traditional Baijiu Brewing Technology[M].3rd ed.Beijing:China Light Industry Press,2019:329-336.
[3] 李大鹏,卢红梅,龙则河,等.酱香型白酒研究进展[J].酿酒科技,2013(3):82-85.
LI D P,LU H M,LONG Z H,et al.Research progress of Jiang-flavour Chinese spirits[J].Liquor Making Science & Technology,2013(3):82-85.
[4] 秦丹,何菲,冯声宝,等.不同贮存时间青稞酒挥发性香气成分分析[J].食品科学,2021,42(16):99-107.
QIN D,HE F,FENG S B,et al.Characterization of the volatile aroma compounds of Qingke Baijiu stored for different periods[J].Food Science,2021,42(16):99-107.
[5] SONG H L,LIU J B.GC-O-MS technique and its applications in food flavor analysis[J].Food Research International,2018,114:187-198.
[6] LI H H,QIN D,WU Z Y,et al.Characterization of key aroma compounds in Chinese Guojing sesame-flavor Baijiu by means of molecular sensory science[J].Food Chemistry,2019,284:100-107.
[7] JIA W,FAN Z B,DU A,et al.Recent advances in Baijiu analysis by chromatography based technology-A review[J].Food Chemistry,2020,324:126899.
[8] XI H,HUANG Y M,G RSKA-HORCZYCZAK E,et al.Rapid analysis of Baijiu volatile compounds fingerprint for their aroma and regional origin authenticity assessment[J].Food Chemistry,2021,337:128002.
RSKA-HORCZYCZAK E,et al.Rapid analysis of Baijiu volatile compounds fingerprint for their aroma and regional origin authenticity assessment[J].Food Chemistry,2021,337:128002.
[9] UETRECHT C,ROSE R J,VAN DUIJN E,et al.Ion mobility mass spectrometry of proteins and protein assemblies[J].Chemical Society Reviews,2010,39(5):1 633-1 655.
[10] 陈鑫郁,陈通,陆道礼,等.气相-离子迁移质谱在植物油种类识别中的应用[J].食品与发酵工业,2018,44(12):245-249.
CHEN X Y,CHEN T,LU D L,et al.Application of GC-IMS in variety discrimination of edible vegetable oils[J].Food and Fermentation Industries,2018,44(12):245-249.
[11] 陈通,吴志远,王正云,等.基于气相离子迁移谱和化学计量学方法判别肉的种类[J].中国食品学报,2019,19(7):221-226.
CHEN T,WU Z Y,WANG Z Y,et al.Identification of meat species by gas chromatography-ion mobility spectrometry and chemometrics[J].Journal of Chinese Institute of Food Science and Technology,2019,19(7):221-226.
[12] WANG S Q,CHEN H T,SUN B G.Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry(GC-IMS)[J].Food Chemistry,2020,315:126158.
[13] ARROYO-MANZANARES N,GARC A-NICOL
A-NICOL S M,CASTELL A,et al.Untargeted headspace gas chromatography-Ion mobility spectrometry analysis for detection of adulterated honey[J].Talanta,2019,205:120123.
S M,CASTELL A,et al.Untargeted headspace gas chromatography-Ion mobility spectrometry analysis for detection of adulterated honey[J].Talanta,2019,205:120123.
[14] 杨晓璇.基于GC-IMS和UPLC-MS/MS代谢组学技术分析不同酱油和食醋中的差异[D].济南:山东师范大学,2020.
YANG X X.Metabonomics analysis of different soy sauce and vinegar based on GC-IMS and UPLC-MS/MS[D].Jinan:Shandong Normal University,2020.
[15] ARMENTA S,ALCALA M,BLANCO M.A review of recent,unconventional applications of ion mobility spectrometry(IMS)[J].Analytica Chimica Acta,2011,703(2):114-123.
[16] ARROYO-MANZANARES N,MART N-G
N-G MEZ A,JURADO-CAMPOS N,et al.Target vs spectral fingerprint data analysis of Iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J].Food Chemistry,2018,246:65-73.
MEZ A,JURADO-CAMPOS N,et al.Target vs spectral fingerprint data analysis of Iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J].Food Chemistry,2018,246:65-73.
[17] CAVANNA D,ZANARDI S,DALL'ASTA C,et al.Ion mobility spectrometry coupled to gas chromatography:A rapid tool to assess eggs freshness[J].Food Chemistry,2019,271:691-696.
[18] GERHARDT N,SCHWOLOW S,ROHN S,et al.Quality assessment of olive oils based on temperature-ramped HS-GC-IMS and sensory evaluation:Comparison of different processing approaches by LDA,kNN,and SVM[J].Food Chemistry,2019,278:720-728.
[19] ZHANG Q,DING Y C,GU S Q,et al.Identification of changes in volatile compounds in dry-cured fish during storage using HS-GC-IMS[J].Food Research International,2020,137:109339.
[20] PU D D,DUAN W,HUANG Y,et al.Characterization of the key odorants contributing to retronasal olfaction during bread consumption[J].Food Chemistry,2020,318:126520.
[21] GARRIDO-DELGADO R,ARCE L,GUAM N A V,et al.Direct coupling of a gas-liquid separator to an ion mobility spectrometer for the classification of different white wines using chemometrics tools[J].Talanta,2011,84(2):471-479.
N A V,et al.Direct coupling of a gas-liquid separator to an ion mobility spectrometer for the classification of different white wines using chemometrics tools[J].Talanta,2011,84(2):471-479.
[22] 葛含光,温华蔚,宋旭,等.离子迁移谱法检测蒸馏酒中4种风味成分[J].食品安全质量检测学报,2016,7(2):834-838.
GE H G,WEN H W,SONG X,et al.Determination of 4 flavor components in distilled liquor by ion mobility spectrometry[J].Journal of Food Safety and Quality,2016,7(2):834-838.
[23] 祁兴普,陈通,刘萍,等.基于气相离子迁移谱黄酒产地识别的研究[J].食品工业科技,2019,40(22):273-276;281.
QI X P,CHEN T,LIU P,et al.Origin identification of yellow wine based on gas chromatography-ion mobility spectrometry[J].Science and Technology of Food Industry,2019,40(22):273-276;281.
[24] TANG Z S,ZENG X N,BRENNAN M A,et al.Characterization of aroma profile and characteristic aromas during lychee wine fermentation[J].Journal of Food Processing and Preservation,2019,43(8):e14003.
[25] HAN X Y,PENG Q,YANG H Y,et al.Influence of different carbohydrate sources on physicochemical properties and metabolites of fermented greengage(Prunus mume) wines[J].LWT,2020,121:108929.
[26] 彭丽英,王卫国,王新,等.离子迁移谱快速筛查白酒中痕量邻苯二甲酸酯的研究[J].分析化学,2014,42(2):278-282.
PENG L Y,WANG W G,WANG X,et al.Rapid screening of trace phthalate estersin-wine using ion mobility spectrometry[J].Chinese Journal of Analytical Chemistry,2014,42(2):278-282.
[27] 徐勇,蒲秀鑫,郎召伟,等.泸型酒蒸馏过程中基酒挥发性物质变化分析[J].中国酿造,2019,38(1):25-29.
XU Y,PU X X,LANG Z W,et al.Changes of volatile compounds of base liquor of Luzhou-flavor Baijiu during distillation[J].China Brewing,2019,38(1):25-29.
[28] 朱梦旭,范文来,徐岩.我国白酒蒸馏过程及原酒、成品酒中乙醛的研究[J].食品与发酵工业,2016,42(4):6-11.
ZHU M X,FAN W L,XU Y.Research on acetaldehyde from distillation cut,raw liquor,finished liquor[J].Food and Fermentation Industries,2016,42(4):6-11.
[29] 张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
ZHANG J,CHENG W,PAN T Q,et al.Research progress about flavor substances of strong flavour Chinese spirits[J].Liquor Making,2019,46(1):29-32.
[30] QIAN Y L,AN Y Q,CHEN S,et al.Characterization of Qingke liquor aroma from Tibet[J].Journal of Agricultural and Food Chemistry,2019,67(50):13 870-13 881.