草甘膦(glyphosate,Glyp)和草铵膦(glufosinate,Gluf)属于广谱、非选择性、灭生性、氨基酸类除草剂[1],极性大易溶于水,不溶于有机溶剂。草甘膦主要抑制植物体内的烯醇丙酮基莽草素磷酸合成酶,从而抑制莽草素向苯丙氨酸、酪氨酸及色氨酸的转化,使蛋白质合成受到干扰,导致植物死亡。初期的研究认为,草甘膦对动物或人类不会产生危害,因在脊椎动物中不存在莽草酸代谢路径,然而近期研究表明该抑制路径也同样影响肠道中的微生物合成3种芳香族氨基酸,进而影响肠道微生物的生态平衡[2-3]。草甘膦不仅影响蜜蜂中肠道微生物的生态平衡,降低对致病菌的抗性[4-5],而且亚慢性和慢性暴露实验[6]表明,草甘膦诱导小鼠的焦虑和抑郁等症状增加,小鼠肠道中棒状杆菌、厚壁菌、拟杆菌、乳酸菌等的数量下降。草甘膦因其毒性、抗性及对环境的不良影响,近年来在欧盟受到了严格的监管,全球其他国家和地区也提出禁止或限制使用的呼声。
草甘膦和草铵膦类除草剂被广泛施用于茶园,与茶叶中的有机物具有很强的结合能力,对其残留量分析的难度较大,常用的检测方法有免疫法、电化学法、毛细管电泳法、离子色谱法、高效液相色谱-紫外检测法、高效液相色谱-荧光法、气相色谱-氮磷检测法、气相色谱-质谱联用法和液相色谱-串联质谱法等[7-9]。其中离子色谱法、电泳法具有简单快速的特点,但检测限量较难满足国内外要求;液相色谱-串联质谱法具有较高的灵敏度和选择性,为目前检测草甘膦和草铵膦类除草剂残留量的最主要方法,而我国尚无同时测定茶叶中草甘膦和草铵膦类除草剂残留量的国家标准方法。
近年来,随着高分辨率质谱(high resolution mass spectrometry,HRMS)技术的发展,HRMS的使用对定性筛查和结构确认产生了革命性影响,且其选择性、动态范围、线性、灵敏度等有了很大的提升,从而提高了HRMS在定量分析中的应用,三重四级杆质谱无法有效排除复杂基质中的干扰物,而HRMS则可利用与之不同的数据采集达到出色的选择性和灵敏度,从而有效减少假阳性或假阴性等情况的发生。HRMS中的飞行时间质谱平台采用的准多重反应数据采集模式(time-of-flight pseudo-multiple reaction monitoring,TOF-MRM)具有目标增益功能(target enhancement),四级杆选择母离子,可选择性地增加目标碎片的占空比,提高了响应和选择性,从而大幅提升了该平台的定量分析性能。
本实验选取草甘膦和草铵膦为研究对象,采用9-芴甲氧羰酰氯(9-fluorene methoxycarbonyl chloride,FMOC-Cl)柱前衍生法测定茶叶中的草甘膦和草铵膦,利用超高效液相色谱串联高分辨质谱法检测,分别探讨衍生反应条件、净化条件、色谱分离条件、质谱检测参数等,以期建立一种高效、准确测定茶叶中草甘膦和草铵膦除草剂残留量的检测方法,为科学监控和制定标准提供数据支持。
1 材料与方法
1.1 材料与试剂
Glyp、Gluf、FMOC-Cl等,美国Sigma-Aldrich公司;乙酸铵、硼酸钠(Na2B3O7·10H2O)、氢氧化钠、硼酸等均为优级纯,阿拉丁(上海)有限公司;质谱级乙腈、甲酸和甲醇,美国Fisher公司;超纯水(≥18 MΩ·cm),实验室自制。成茶样品,当地市场。
1.2 仪器与设备
Waters I-Class Plus超高压液相色谱仪,由二元泵、柱温箱、自动进样器、脱气机等组成;WCX、MAX、MCX、HLB、C18柱,均为3 mL/60 mg;Xevo G2-XS QTOF高分辨质谱仪,配电喷雾电离源(electrospray ionization,ESI),以上均为美国沃特世有限公司生产;JY3002电子天平,梅特勒-托利多国际贸易(上海)有限公司;DZF-6050型真空干燥箱,河南巩义市予华仪器有限责任公司;ZX4漩涡振荡器,意大利VELP公司;JSP-200型高速多功能粉碎机,浙江省永康市金穗机械制造厂;N-丙基乙二胺键合固相萃取填料(primary secondary amine,PSA)、ENVI-18固相萃取填料,美国Sigma-Aldrich公司;固相萃取空柱(3 mL),生工生物(上海)工程有限公司;GWA-UN1-10超纯水器,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 样品提取、净化及衍生
提取:分别将茶叶样品置于干燥粉碎机中,粉碎过40目筛,-20 ℃冷藏,备用。准确称取1.00 g(精确至1 mg)试样于50 mL离心管中,加入超纯水20 mL,充分振荡2 min,超声波提取30 min,浸提后以5 000 r/min离心5 min,取上清液,待净化。
净化:分别用3 mL甲醇、3 mL超纯水活化固相萃取柱,取2 mL上清液过固相萃取柱,收集流出液于离心管中,待衍生。
衍生:取1.0 mL的净化液,分别依次加入0.2 mL 5% pH 9.0或10.0的硼酸钠缓冲液、0.2 mL 1.0 mg/mL的FMOC-Cl乙腈溶液,混匀后于室温下衍生0.5、1、2、4、12 h,以4 500 r/min离心5 min,过0.22 μm有机系微孔滤膜,超高效液相色谱-四级杆串联飞行时间高分辨质谱仪测定衍生产物,草甘膦和草铵膦的衍生产物分别以FMOC-Glyp、FMOC-Gluf表示。
1.3.2 色谱-质谱条件
色谱条件:色谱柱(Waters Acquity UPLC BEH C18柱,2.1 mm×50 mm,1.7 μm),柱温40 ℃,进样室温度10 ℃,流速0.3 mL/min;流动相A为2 mmol/L的乙酸铵水溶液(含体积分数为0.1%甲酸),流动相B为纯乙腈;梯度洗脱程序为0~1 min、10% B;1~5 min、95% B,5~8 min、95% B,8~8.1 min、10% B,8.1~11 min、10% B。
质谱条件:正离子(ESI+)灵敏度模式,毛细管电压3.0 kV,离子源温度130 ℃,脱溶剂气温度400 ℃;锥孔气流速60 L/h,脱溶剂气流速800 L/h,扫描时间0.2 s,扫描范围m/z 50~800,数据格式为棒状图(centroid);四级杆飞行时间质谱的二级筛查模式(MS/MS)优化采集方法:母离子质量数分别固定设为392.09(FMOC-Glyp)和404.13(FMOC-Gluf),碰撞能值分别设6、10、15、20、25、30 V,前1 min和后6 min的流动相进废液,质谱只采集1~5 min的信号。TOF-MRM定量采集方法:FMOC-Glyp设固定m/z 392.09,碎片离子214.011 9、179.085 8、170.022、88.039 5,优化后的碰撞能值为15 V,定量离子179.085 8;FMOC-Gluf设固定m/z 404.13,碎片离子179.085 8、182.058、136.052、208.038,优化后的碰撞能值为20 V,定量离子179.085 8;前1 min和后6 min的流动相进废液,质谱只采集1~5 min的信号。采用质量锁定(LockSpray)技术测定准确质量数,以200 pg/μL的亮氨酸脑啡肽溶液为锁定质量溶液,流速为5 μL/min,电压为0.53 kV,每隔30 s采集1次,在正离子模式下产生m/z 556.277 1的离子。
1.3.3 基质效应评价
分别准确称取10份样品,加水按照1.3.1的方法超声波提取,离心后取上清液2.0 mL过固相萃取柱净化,收集流出液过0.22 μm微孔滤膜,作为样品溶液。取净化后的样品溶液1.6 mL,加入0.4 mL的混合标准工作溶液至目标物终质量浓度分别为1.25~400 μg/L(FMOC-Glyp)和0.25~160 μg/L(FMOC-Gluf),衍生后注入超高效液相色谱-四级杆串联飞行时间高分辨质谱仪测定,分别作基质匹配标曲和溶剂外标曲线。另取未经净化的样品溶液1.6 mL,加入0.4 mL的混合标准工作溶液,衍生后注入超高效液相色谱-四级杆串联飞行时间高分辨质谱仪测定,分别作基质匹配和溶剂外标曲线。基质效应以基质匹配标准曲线的斜率与溶剂曲线斜率的比值评定,比值>1,表现为基质增强效应;比值<1则为基质抑制效应,用符号ME表示基质效应,按公式(1)计算:
(1)
1.3.4 方法准确度与精确度评价
分别准确称取18份样品于50 mL离心管中,加入2 mL草甘膦和草铵膦的混标溶液,配制成低、中、高3个水平(分别为定量限的2、10、40倍)的加标样品,每个加标水平做6个平行试验。分别加入超纯水18 mL,充分振荡2 min,超声提取30 min,浸提后以5 000 r/min离心5 min,取离心后的上清液,过固相萃取柱净化后衍生,过0.22 μm微孔滤膜,采用超高效液相色谱-四级杆串联飞行时间高分辨质谱仪测定,计算回收率和精密度。
1.4 数据处理
采用Waters公司的MassLynx 4.1软件,通过提取MS/MS采集方法中各通道母离子及碎片离子的质谱图,调节碰撞能量以获得各衍生产物的信号强度高、稳定性好的离子碎片,并筛选出定量离子对。TOF-MRM定量采集图选用ApexTrack的积分方法,适当调整积分参数的方式完成色谱积分,根据质谱图中碎片离子峰的强度进行定量分析。实验结果以平均值±标准偏差表示,采用SPSS 22.0进行统计分析,以P<0.05为检验标准。
2 结果与讨论
2.1 流动相的选择
分别配制以下2组流动相,组I:流动相A为2 mmol/L的乙酸铵水溶液(含体积分数0.1%甲酸),流动相B为纯乙腈;组Ⅱ:流动相A为2 mmol/L甲酸铵水溶液(含体积分数0.1%甲酸),流动相B为纯乙腈。根据上述1.3.2的流动相梯度洗脱条件进行实验。结果表明,组I的出峰效果较好,而组II的出峰有较大的拖尾现象,效果较差。这可能是乙酸铵盐的存在可以改善目标物的峰形,让目标物的峰形变得较为对称,且流动相A中甲酸可以提供一定量的H+,为形成的目标离子的质子化状态提供了H+的支撑,并维持了目标离子的质子化状态,提高了目标物的离子化程度,从而提高了目标物的检出率[10],后续试验选择第I组流动相。
2.2 质谱参数的优化
采用超纯水配制质量浓度为1 mg/L的草甘膦和草铵膦标准溶液1.0 mL,分别加入pH 9.0的5%硼酸钠缓冲溶液0.2 mL、1.0 mg/mL的FMOC-Cl衍生剂溶液0.2 mL,室温下衍生12 h,将各标准溶液注入进样器中,色谱分离后在正离子模式下进行MS/MS扫描,得到草甘膦和草铵膦衍生物的母离子及碎片离子峰的扫描图,如图1所示。毛细管电压、锥孔电压和碰撞能量是影响质谱测定结果的重要因素,锥孔电压直接影响各组分的灵敏度[11],过高的锥孔电压会导致分子离子在离子源内发生碰撞解离,从而影响母离子的丰度,进而影响检测限和灵敏度。锥孔电压40 V且不加碰撞能量下采集的质谱图中母离子(m/z 392.090 5和m/z 404.126 8)信号强度高、稳定性好,施加不同碰撞能量后采集的二级质谱图中草甘膦衍生产物显示348.097 3、214.011 9、179.085 8、170.022 0、88.039 5等5种碎片离子,草铵膦衍生产物的碎片离子主要有360.136 7、208.037 5、182.058 2、179.085 7、136.052 3、119.026 3等6种碎片离子。各碎片离子形成过程及理论质荷比(见增强出版附件图)。
由图1可以看出,草甘膦和草铵膦衍生物分别施加15和20 V碰撞能量下碎片离子m/z 179.085 8的响应最高、稳定性好,分别选择m/z 179.085 8的碎片离子与母离子392.090 5和404.126 8作为草甘膦和草铵膦衍生物测定的定量离子对。为了实现草甘膦和草铵膦的定量分析,使用TOF-MRM采集模式和Target Enhancement采集数据,该模式下四级杆中选择母离子,仪器的Target Enhancement功能可增加目标离子的灵敏度,从而大大增强了定量分析的灵敏度和选择性。
2.3 衍生条件的优化
1.0 mL质量浓度为0.1 mg/L的草甘膦和草铵膦混合标准溶液分别与pH 10.0的5%硼酸钠缓冲溶液0.2 mL、1.0 mg/mL的FMOC-Cl衍生剂溶液0.2 mL,室温下衍生0.5、1.0、2.0、4.0、12.0 h,MS/MS采集模式和TOF-MRM采集模式的检测结果如图2所示。随着衍生时间的增加,草甘膦和草铵膦与FMOC-Cl衍生产物的信号呈现先增加后下降的趋势,且方差分析结果显示差异显著(P<0.05)。草甘膦和草铵膦与FMOC-Cl衍生反应2 h时产物信号最强,过长时间的衍生反应产物稳定性下降。

a-FMOC-Glyp;b-FMOC-Gluf
图1 草甘膦和草铵膦衍生产物的碰撞能优化
Fig.1 Optimization of collision for glyphosate and glyphosate derivatives
1.0 mL质量浓度为0.1 mg/L的草甘膦和草铵膦混合标准溶液分别与pH 9.0和pH 10.0的5%硼酸钠缓冲溶液0.2 mL、1.0 mg/mL的FMOC-Cl衍生剂溶液0.2 mL,室温下衍生2 h,MS/MS模式和TOF-MRM测定结果如表1所示。草甘膦和草铵膦与FMOC-Cl在较高pH条件下反应形成的衍生产物信号较强,t检验结果显示差异显著(P<0.05),且TOF-MRM比MS/MS采集模式下目标产物的信号强度更大(P<0.05),后续实验采用TOF-MRM采集模式和硼酸盐缓冲液pH 10.0的衍生条件。
2.4 净化方法的优化
根据文献报道[12-13],采用纯水能较好地提取样品中的草甘膦和草铵膦等目标物,本文不再对提取溶剂做过多的优化,实验过程均采用纯水作为提取溶剂,超声强化提取,本文重点考察固相萃取柱和分散固相萃取法对草甘膦和草铵膦净化效果的影响。按照1.3.1的方法提取茶叶样品,分别取1.6 mL茶叶提取液加入1.0 mg/L的混合标准液0.4 mL,涡旋混匀后,过PSA、HLB、ENVI-18、C18柱,收集流出液1 mL衍生后测定。分别吸取涡旋混匀后的加标提取液2 mL,过MAX、MCX、WCX等固相萃取柱,流出液弃去不要,用1.0 mL水∶甲醇=4∶1(含体积分数1%甲酸)洗脱2次,收集洗脱液,取1.0 mL衍生后测定,各固相萃取柱的净化效果如表2和图3所示。

a-MS/MS;b-TOF-MRM
图2 衍生时间对草甘膦和草铵膦与FMOC-Cl 衍生产物形成的影响
Fig.2 Effect of derivation time on formation of glyphosate and glyphosate derivatives with FMOC-Cl 注:图中同一目标物标注不同小写字母表示差异显著,P<0.05
表1 缓冲液pH对草甘膦和草铵膦与FMOC-Cl衍生产物 形成的影响
Table 1 Effect of buffer pH on the formation of glyphosate and glyphosate derivatives with FMOC-Cl
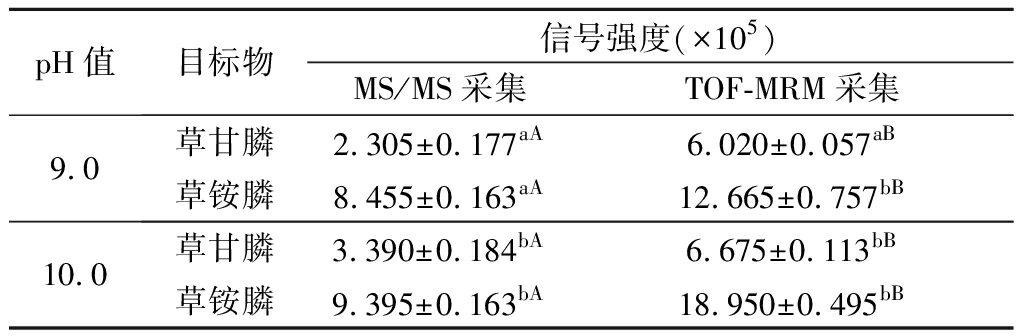
pH值目标物信号强度(×105)MS/MS采集TOF-MRM采集9.0草甘膦2.305±0.177aA6.020±0.057aB草铵膦8.455±0.163aA12.665±0.757bB10.0草甘膦3.390±0.184bA6.675±0.113bB草铵膦9.395±0.163bA18.950±0.495bB
注:同一列同种目标物标注不同小写字母表示差异显著,P<0.05;同一行标注不同的大写字母表示差异显著,P<0.05(下同)
表2 固相萃取柱对草甘膦和草铵膦的净化效果
Table 2 Purification effect of solid phase extraction column on glyphosate and glufosinate
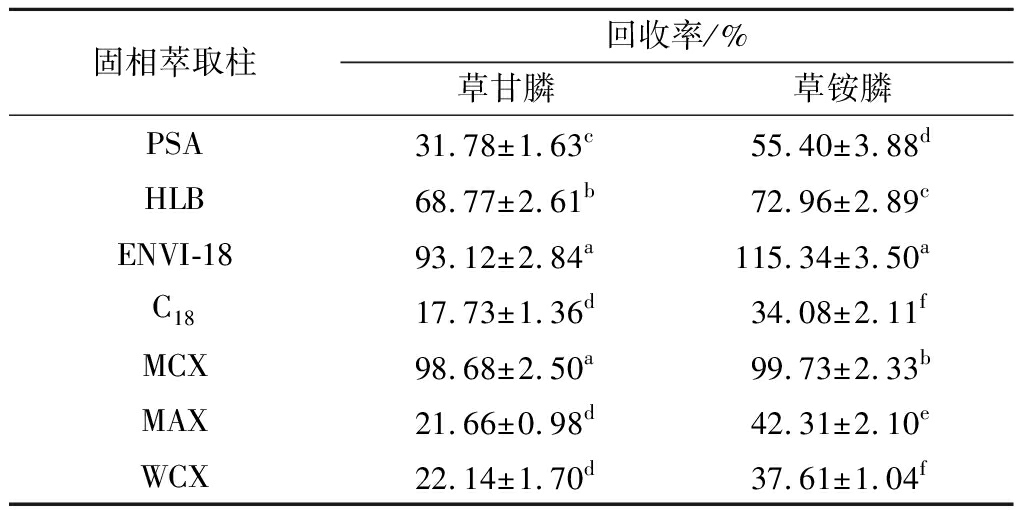
固相萃取柱回收率/%草甘膦草铵膦PSA31.78±1.63c55.40±3.88dHLB68.77±2.61b72.96±2.89cENVI-1893.12±2.84a115.34±3.50aC1817.73±1.36d34.08±2.11fMCX98.68±2.50a99.73±2.33bMAX21.66±0.98d42.31±2.10eWCX22.14±1.70d37.61±1.04f
茶叶含有较多的咖啡碱、氨基酸、色素等物质对质谱具有较强的抑制效应,需要经过净化处理,排除掉或降低这些物质的干扰,固相萃取净化方式操作快速、简便,常用于色谱-质谱分析检测中净化目标物[14]。从表2和图3可以看出,不同固相萃取柱净化对目标物的回收率差异显著(P<0.05),C18反相吸附型填料的净化效果较差、回收率低;而ENVI-18为含更高碳量的修饰型C18柱,同为反相吸附型填料,对目标物净化效果和回收率较好,可吸附茶汤中部分色素等杂质以降低其对质谱检测的影响。PSA为正相弱阴离子交换剂,其强亲和性和高容量可用于去除脂肪酸、有机酸和一些极性色素及糖类,常用于降低分析过程中出现的基质增强效应的影响,其对茶叶提取液的净化效果较差、回收率也较低。同样,MAX为反相混合模式强阴离子交换吸附剂,适用于酸性化合物,具有高度选择性与高灵敏度,该柱对茶叶提取液的净化效果较好,但回收率低。HLB为反相亲水性的改性苯乙烯聚合物,可保留极性化合物,可以去除茶叶中的咖啡碱、茶多酚、氨基酸、色素、蛋白质等杂质[15],对草甘膦和草铵膦的吸附作用小,样品的基质效应和基质干扰小,净化效果好,其保留率也能满足要求。MCX为反相混合模式强阳离子交换吸附剂,适用于碱性化合物,具有高度选择性与高灵敏度,其对目标物的净化效果较好,可有效去除茶汤中其他物质的干扰,提高质谱检测的能力[16],回收率最佳,但是需要多一步洗脱过程。WCX为反相混合模式弱阳离子交换吸附剂,适用于强碱性化合物,具有高度选择性与高灵敏度,该柱对目标物的净化效果较好,对茶汤中色素等杂质的吸附能力较强,但其回收率远低于MCX固相萃取柱。因此,采用衍生法测定茶叶中草甘膦和草铵膦类除草剂的净化可根据需求选用MCX、HLB、ENVI-18固相萃取柱,后续实验采用MCX固相萃取柱净化茶叶提取液。
2.5 方法学考察及基质效应评定
针对茶叶样品中的草甘膦和草铵膦,未经固相萃取柱净化的基质效应相对明显,杂质干扰大;经固相萃取柱净化后,基质效应分别为88.6和93.2。由此可见,MCX固相萃取柱净化处理后能有效降低超高效液相色谱-四级杆飞行时间质谱法检测Glyp和Gluf过程中的基质抑制效应。一般情况下,基质效应为85%~115%表示不存在明显的基质效应。据此判断,本检测方法对Glyp和Gluf基质效应不显著(表3)。因此,采用外标法和溶剂标准曲线法能准确定量检测茶叶样品中Glyp和Gluf的残留量,线性范围分别为1.25~400和0.25~160 μg/L,且线性相关系数均>0.99。检测限(limit of detection,LOD)是通过在空白样品中添加低浓度水平目标组分的方法确定,依据其特征离子色谱峰的信噪比(S/N)>3而测定的,Glyp和Gluf的LOD分别为1.2、0.4 μg/kg。定量限(limit of quantitation,LOQ)是以信噪比(S/N)为10计算的,Glyp和Gluf的LOQ分别为4.0、1.34 μg/kg,Glyp的LOQ低于国家标准GB/T 23750—2009《植物性产品中草甘膦残留量的测定 气相色谱-质谱法》的值(其LOQ为5 μg/kg)。

a-FMOC-Glyp总离子流图;b-FMOC-Glyp二级质谱图;c-FMOC-Gluf总离子流图;d-FMOC-Gluf二级质谱图
图3 茶叶样品过固相萃取柱净化后的色谱-质谱图
Fig.3 Chromatography-mass spectrometry of tea samples purified by different solid phase extraction columns
表3 Glyp和Gluf测定的线性范围、回归方程、相关系数及基质效应
Table 3 Linear range,regression equation,correlation coefficient and matrix effect of Glyp and Gluf determination
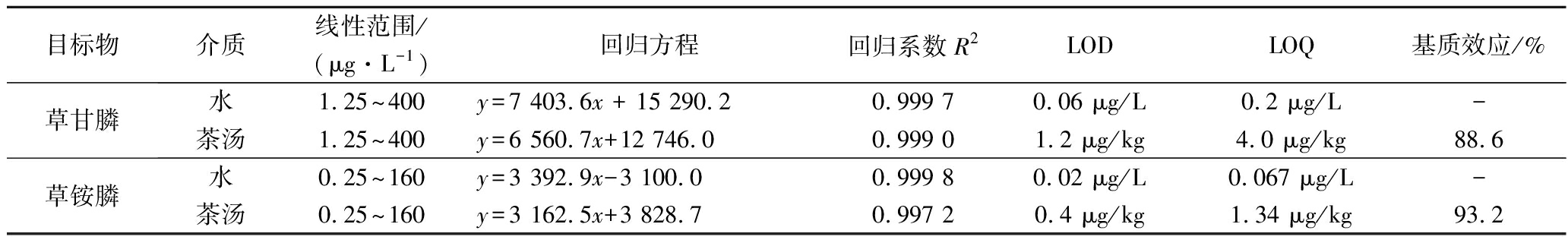
目标物介质线性范围/(μg·L-1)回归方程回归系数R2LODLOQ基质效应/%草甘膦水1.25~400y=7 403.6x + 15 290.20.999 70.06 μg/L0.2 μg/L-茶汤1.25~400y=6 560.7x+12 746.00.999 01.2 μg/kg4.0 μg/kg88.6草铵膦水0.25~160y=3 392.9x-3 100.00.999 80.02 μg/L0.067 μg/L-茶汤0.25~160y=3 162.5x+3 828.70.997 20.4 μg/kg1.34 μg/kg93.2
2.6 方法的回收率、准确度和精密度
移取适量的混合标准溶液,加入到茶样品中,配制低、中、高3个质量浓度水平(2、10、40倍LOQ)的添加试验,按照1.3.1的方法处理,过柱净化、衍生后采用超高效液相色谱-四级杆飞行时间质谱检测,每个加标水平测定6次,回收率和精密度实验测定结果如表4所示。由表4可知,Glyp和Gluf目标物在低、中、高3个加标水平下均有较好的准确度和精密度,Glyp的加标回收率为88%~103%,Gluf的加标回收率为93%~99%,相对标准偏差(relative standard deviation,RSD)均<5%,可用于茶叶样品中Glyp和Gluf残留量的测定。
表4 茶叶样品中Glyp和Gluf添加回收率及其相对标准偏差
Table 4 Recoveries and relative standard deviations of Glyp and Gluf spiked in tea samples
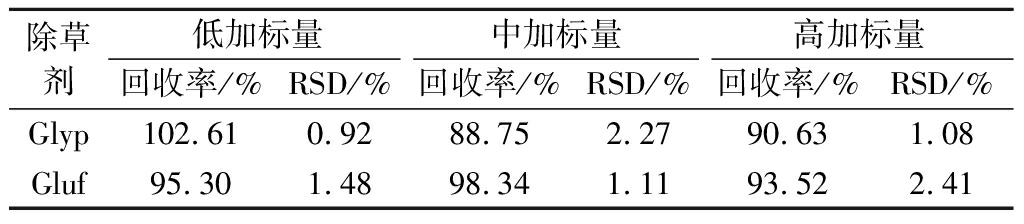
除草剂低加标量中加标量高加标量回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%Glyp102.610.9288.752.2790.631.08Gluf95.301.4898.341.1193.522.41
2.7 实际样品的测定
应用衍生高分辨质谱方法对市售的10种茶叶样品进行筛查与检测,根据Glyp和Gluf 2种除草剂标准化合物的碎片离子信息确定其在茶叶样品中的存在情况,并根据二级定量碎片离子的峰强度进行定量,结果如表5所示。7种茶叶样品中检测出含有草甘膦(质量分数为0.16~0.96 mg/kg),与文献[17]报道的测定值0.085~0.65 mg/kg相当,1种样品检出含有草铵膦,含量低于文献[17]报道的测定值0.12~0.45 mg/kg,其他样品均未检出草甘膦和草铵膦的残留。我国国家标准GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》对茶叶中草甘膦的限量值为1.0 mg/kg,未包含其代谢物氨甲基膦酸,草铵膦的临时限量值为0.5 mg/kg,未包含其代谢物N-乙酰基草铵膦和3-(甲基膦基)丙酸,实验检测的茶样中草甘膦和草铵膦的残留量均符合国家标准。
表5 茶叶样品中Glyp和Gluf含量测定 单位:mg/kg
Table 5 Content of Glyp and Gluf in different made tea
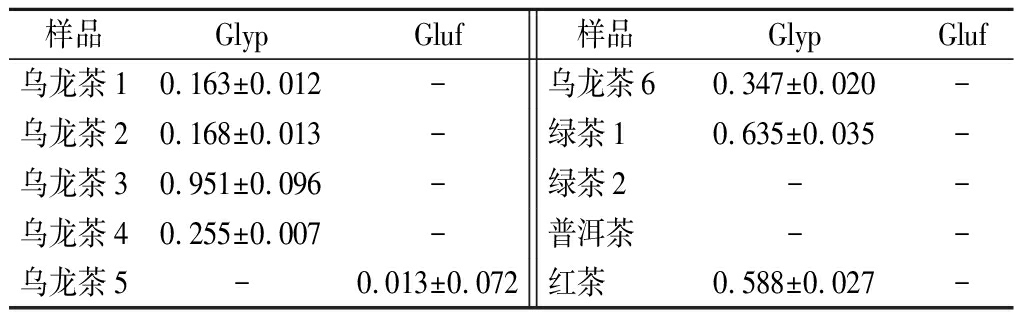
样品GlypGluf样品GlypGluf乌龙茶10.163±0.012-乌龙茶60.347±0.020-乌龙茶20.168±0.013-绿茶10.635±0.035-乌龙茶30.951±0.096-绿茶2--乌龙茶40.255±0.007-普洱茶--乌龙茶5-0.013±0.072红茶0.588±0.027-
注:“-”表示未测出
3 结论
用超纯水作为溶剂超声辅助法提取茶叶样中的草甘膦和草铵膦残留除草剂,再经过MCX固相萃取柱净化除去样品中的色素等物质后,在pH 10.0、浓度为0.1 mol/L的硼酸钠缓冲溶液中与FMOC-Cl溶液进行衍生反应2 h,以2 mmol/L的乙酸铵水溶液(含体积分数0.1%甲酸)和乙腈为流动相,HRMS检测采用电喷雾正离子化模式和准多反应监测模式下检测草甘膦和草铵膦目标物,扫描范围m/z 50~800,毛细管电压3.0 kV,锥孔电压40 V,提取锥孔电压6 V,离子源温度130 ℃;脱溶剂气温度400 ℃;锥孔气流速60 L/h,脱溶剂气流速800 L/h,扫描时间0.2 s,数据格式为棒状图(centroid),草甘膦和草铵膦的碰撞能值分别为15和20 V,定量离子为m/z 179.085 8。该方法结合了色谱对复杂样品的高分离能力和质谱的高选择性、高灵敏度及能够提供精确质量数和碎片离子等信息的优点,操作过程简单,检测速度快,可以作为茶叶中草甘膦和草铵膦残留量的检测方法。
[1] CHEN M X,CAO Z Y,JIANG Y,et al.Direct determination of glyphosate and its major metabolite,aminomethylphosphonic acid,in fruits and vegetables by mixed-mode hydrophilic interaction/weak anion-exchange liquid chromatography coupled with electrospray tandem mass spectrometry[J].Journal of Chromatography A,2013,1 272:90-99.
[2] NIELSEN L N,ROAGER H M,CASAS M E,et al.Glyphosate has limited short-term effects on commensal bacterial community composition in the gut environment due to sufficient aromatic amino acid levels[J].Environmental Pollution,2018,233:364-376.
[3] YUAN X L,PAN Z H,JIN C Y,et al.Gut microbiota:An underestimated and unintended recipient for pesticide-induced toxicity[J].Chemosphere,2019,227:425-434.
[4] EL AGREBI N,TOSI S,WILMART O,et al.Honeybee and consumer’s exposure and risk characterisation to glyphosate-based herbicide(GBH) and its degradation product(AMPA):Residues in beebread,wax,and honey[J].Science of the Total Environment,2020,704:135312.
[5] MOTTA E V S,RAYMANN K,MORAN N A.Glyphosate perturbs the gut microbiota of honey bees[J].Proceedings of the National Academy of Sciences of the United States of America,2018,115(41):10 305-10 310.
[6] AITBALI Y,BA-M’HAMED S,ELHIDAR N,et al.Glyphosate based-herbicide exposure affects gut microbiota,anxiety and depression-like behaviors in mice[J].Neurotoxicology and Teratology,2018,67:44-49.
[7] FELTON D E,EDERER M,STEFFENS T,et al.UV-vis spectrophotometric analysis and quantification of glyphosate for an interdisciplinary undergraduate laboratory[J].Journal of Chemical Education,2018,95(1):136-140.
[8] GUO H,WANG H J,ZHENG J,et al.Sensitive and rapid determination of glyphosate,glufosinate,bialaphos and metabolites by UPLC-MS/MS using a modified quick polar pesticides extraction method[J].Forensic Science International,2018,283:111-117.
[9] YOSHIOKA N,ASANO M,KUSE A,et al.Rapid determination of glyphosate,glufosinate,bialaphos,and their major metabolites in serum by liquid chromatography-tandem mass spectrometry using hydrophilic interaction chromatography[J].Journal of Chromatography A,2011,1 218(23):3 675-3 680.
[10] 吴晓刚, 陈孝权,肖海军,等.柱前衍生-超高效液相色谱-串联质谱法同时检测茶叶中草甘膦和草铵膦的残留量[J].色谱,2015,33(10):1 090-1 096.
WU X G,CHEN X Q,XIAO H J,et al.Simultaneous determination of glyphosate and glufosinate-ammonium residues in tea by ultra performance liquid chromatography-tandem mass spectrometry coupled with pre-column derivatization[J].Chinese Journal of Chromatography,2015,33(10):1 090-1 096.
[11] 王忠合, 李晓婷,胡文梅,等.超高压液相色谱-高分辨质谱法检测单丛乌龙茶中氨基酸[J].食品与发酵工业,2020,46(21):207-214.
WANG Z H,LI X T,HU W M,et al.Determination of amino acids inOolong tea by ultra-high pressure liquid chromatography coupled with high resolution mass spectrometry[J].Food and Fermentation Industries,2020,46(21):207-214.
[12] BARKER A L,DAYAN F E.Fate of glyphosate during production and processing of glyphosate-resistant sugar beet(Beta vulgaris)[J].Journal of Agricultural and Food Chemistry,2019,67(7):2 061-2 065.
[13] 潘胜东, 童廷德,叶美君,等.基于超高效液相色谱-高分辨质谱的非衍生化法测定面粉和燕麦中草甘膦及氨甲基膦酸残留[J].色谱,2019,37(12):1 321-1 330.
PAN S D,TONG T D,YE M J,et al.Determination of residual glyphosate and aminomethylphosphonic acid in wheat flour and oats samples by non-derivatization method based on ultra-performance liquid chromatography-high resolution mass spectrometry[J].Chinese Journal of Chromatography,2019,37(12):1 321-1 330.
[14] WANG F Q,LI S H,FENG H,et al.An enhanced sensitivity and cleanup strategy for the nontargeted screening and targeted determination of pesticides in tea using modified dispersive solid-phase extraction and cold-induced acetonitrile aqueous two-phase systems coupled with liquid chromatography-high resolution mass spectrometry[J].Food Chemistry,2019,275:530-538.
[15] 孙文闪, 周婷婷,章虎,等.固相萃取净化液质联用测定茶叶中的草铵膦[J].食品工业,2020,41(7):286-290.
SUN W S,ZHOU T T,ZHANG H,et al.Determination of glufosinate in tea by UPLC-MS/MS using SPE[J].The Food Industry,2020,41(7):286-290.
[16] CHEN D W,MIAO H,ZHAO Y F,et al.A simple liquid chromatography-high resolution mass spectrometry method for the determination of glyphosate and aminomethylphosphonic acid in human urine using cold-induced phase separation and hydrophilic pipette tip solid-phase extraction[J].Journal of Chromatography A,2019,1 587:73-78.
[17] 杨梅, 孙思,刘文锋,等.超高效液相色谱-串联质谱法测定茶叶中草甘膦和草铵膦的残留量[J].食品科学,2019,40(10):337-343.
YANG M,SUN S,LIU W F,et al.Determination of glyphosate and glufosinate-ammonium residues in tea by UPLC-MS/MS[J].Food Science,2019,40(10):337-343.