国际稀有糖协会(International Society of Rare Sugars,ISRS)定义稀有糖为自然界中存在但含量极少的一类单糖及其衍生物[1]。阿洛醇(C6H14O6),又称为蒜糖醇,是一种稀有糖醇和低能量甜味剂,在自然界中含量极低,但具有重要生理功能,可广泛应用于食品、医药、化工等领域[2]。
根据IZUMORI提出的稀有糖转化策略(Izumoring策略),单糖以及糖醇之间可以通过D-塔格糖3-差向异构酶、醇脱氢酶、醛糖异构酶和醛糖还原酶等酶实现相互转化,而且阿洛醇处于D/L-型糖转化的枢纽位置,经相应的酶催化可以得到D/L-阿洛酮糖和D/L-阿洛糖等高价值稀有糖[3]。
目前,阿洛醇主要采用生物转化方法生产,利用多酶反应和辅酶再生系统分别由D-葡萄糖(D-glucose)、D-果糖(D-fructose)和D-阿洛酮糖(D-psicose)生物合成阿洛醇。如图1,葡萄糖异构酶(glucose isomerase,GI)可催化D-葡萄糖为D-果糖,D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE)或D-塔格糖 3-差向异构酶(D-tagatose 3-epimerase,DTE)可催化D-果糖为D-阿洛酮糖,D-阿洛酮糖经核糖醇脱氢酶(ribitol dehydrogenase,RDH)和甲酸脱氢酶(formate dehydrogenase,FDH)催化最终得到阿洛醇[1]。本文对生物合成阿洛醇(蒜糖醇)的生物酶、生产工艺、应用领域及研究进展进行了综述,对阿洛醇(蒜糖醇)生物转化技术发展进行了展望。

GI-葡萄糖异构酶;DTE-D-塔格糖3-差向异构酶;DPE-D-阿洛酮糖3- 差向异构酶;RDH-核糖醇脱氢酶;FDH-甲酸脱氢酶
图1 由D-葡萄糖、D-果糖和D-阿洛酮糖生产阿洛醇流程图
Fig.1 Scheme of allitol production from D-glucose, D-fructose and D-psicose
1 阿洛醇的应用
1.1 低热量甜味剂
随着经济的日益发展,人民生活水平的提高,肥胖的人数越来越多。高糖饮食是导致肥胖的一个重要原因。因此,寻求有甜味但热量低的糖取代高热量高消耗的糖极为必要。目前常用的代糖甜味剂,口感仍不及蔗糖、果糖等天然甜味剂,有必要开发即有保健功能,又有良好口感的新型甜味剂以满足市场需求。稀有糖作为一种低热量碳水化合物对人体健康大有裨益。如今,D-阿洛酮糖等稀有糖已作为低热量甜味剂开始应用于食品中[4]。同样,阿洛醇具有低热量、低吸收的特点,且具有重要生理活性,可以作为甜味剂、膨胀剂应用于食品行业,有很好的市场前景[2]。
1.2 药物及药物合成中间体
2009年,OOSAKA给小鼠饲喂阿洛醇,通过观察小鼠的腹泻情况来评估阿洛醇的通便功效,并研究了阿洛醇对肠道运输和肠道含水量的影响,结果发现阿洛醇可以增加小肠内的含水量,促进小肠运输,发挥通便功效,可用于制备单糖泻药,治疗便秘[5]。此外,阿洛醇是合成氨杂糖的重要中间体,可以用于制备抗糖尿病、癌症和包括艾滋病在内的病毒感染的药物[2]。
1.3 生产其他D/L-型稀有糖的底物
根据Izumoring策略,阿洛醇处于D/L-型糖转化的枢纽位置,经合适的酶或细胞催化可以得到其他D/L-型稀有糖,例如D-阿洛酮糖、L-阿洛酮糖、D-阿洛糖和L-阿洛糖等[3]。L-型稀有糖是合成抗癌、抗病毒药物的前体。目前,L-型稀有糖的研究引起广泛关注,从阿洛醇出发寻找合适的酶生产L-型稀有糖具有重要的研究价值。
1.4 木质文物保藏处理剂
糖醇饱和法是保护受水浸渍的有机文物,特别是木质文物的有效方法。该方法对于消除糖醇结晶中的杂质是很重要的,这可以通过混合一种具有抗结晶效果的糖来实现。经研究发现,阿洛醇具有与传统抗结晶剂相似的性能,且在强真空中也能保持晶体结构,成为综合性能最好的木质文物保藏处理剂(http://www.kagawa-isf.jp/glycobio/english/pdf/culture_01.pdf)。
2 阿洛醇生产方法
2.1 自然提取法
自然界中的阿洛醇主要存在于鼠刺和紫色粉孢牛肝菌中,含量微少。从1 kg新鲜鼠刺叶片和485 g紫色粉孢牛肝菌中可分别提取出14 和1.2 g阿洛醇。大规模提取阿洛醇既消耗大量的原材料,又不利于环境保护,而且生产成本高,不适用于阿洛醇的大规模生产[6-7]。
2.2 化学合成法
1973年,英国人BALLARD和STACEY从含有13 g D-阿洛糖,4 g硼氢化钠和85 mL水的反应体系中得到11.3 g阿洛醇[8]。2010年,科学家提出顺-3-己烷-1,2,5,6-四醇经氧化可同时产生阿洛醇和半乳糖醇[2]。2016年,JUMDE等人通过区域选择性氧化还原反应催化葡萄糖得到阿洛醇(图2)[9]。化学合成法具有反应速率快,效率高的优点,但是利用该方法合成阿洛醇,要么反应底物本身也是稀有糖,原料来源受到限制,要么反应过程复杂,容易生成副产物甚至毒性副产物,导致分离纯化困难,使得阿洛醇产率和纯度降低。因此,化学合成法不利于阿洛醇的商业化生产。
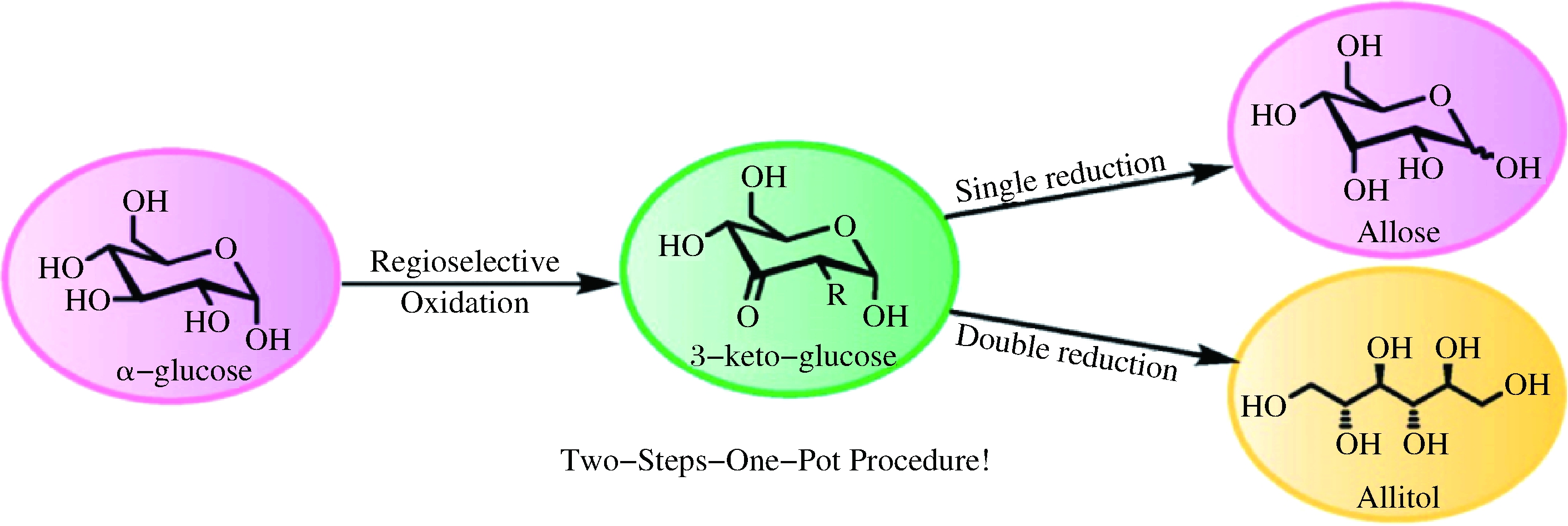
图2 氧化还原法由葡萄糖合成阿洛醇[9]
Fig.2 Allitol synthesized from glucose by chemical oxidation and reduction reactions[9]
2.3 生物转化法
当前,阿洛醇生产主要采用生物转化的方法,通过酶催化或者微生物全细胞催化的方式由D-葡萄糖、D-果糖或D-阿洛酮糖生产阿洛醇[2]。虽然生物转化法生产阿洛醇也具有一些不足,例如生物催化剂的催化活性和环境耐受性仍有待提高等,但是相比提取和化学合成方法,生物转化法具有简便高效、反应条件温和、无毒性副产物、对环境无污染、成本低廉、产量高等优点,是当前稀有糖醇生产的主要方法。
3 阿洛醇生物转化所涉及的生物酶
3.1 酮糖 3-差向异构酶
阿洛醇可由D-阿洛酮糖生物转化而来,而D-阿洛酮糖可由酮糖 3-差向异构酶由D-果糖生物转化而来。其中,DTE和DPE都可以实现D-果糖和D-阿洛酮糖之间的相互转化[10-11]。IZUMORI等首次从Pseudomonas sp.ST-24中发现了DTE,该酶最适底物为D-塔格糖,但可以转化D-果糖为D-阿洛酮糖[12]。之后,来自于Rhodobacter sphaeroides[13]的DTE也被报道可用于D-阿洛酮糖的生物转化。DTE对D-阿洛酮糖具有较高的底物特异性。来自于Agrobacterium tumefaciens[14],Clostridium cellulolyticum H10[15],和Ruminococcus sp.[16]的DTE也得到相应的研究和应用。此外,来自于Mesorhizobium loti的L-核酮糖 3-差向异构酶(L-ribulose 3-epimerases,LRE)也可催化D-果糖为D-阿洛酮糖[17]。
3.2 RDH
RDH可以转化D-阿洛酮糖为阿洛醇。RDH属于短链脱氢酶/还原酶家族(short-chain dehydrogenases/reductase family,SDR),它是一种NADH-依赖型醇脱氢酶,在生物转化法生产阿洛醇的过程中发挥重要作用。目前,在Enterbacter agglomerans 221e[18],Klebsiella pneumoniae IFO 3321[19]和Providencia alcalifaciens RIMD 1656011[20]中已经发现并鉴定得到RDH。不同来源的RDH底物专一性不同。例如,当以D-果糖为底物时,来源于Enterbacter agglomerans 221e的RDH除了可将D-果糖催化为阿洛醇外,还可将D-果糖催化为D-山梨醇,不利于阿洛醇的生产[18-19]。相比之下,来源于Klebsiella pneumoniae IFO 3321和Providencia alcalifaciens RIMD 1656011的RDH对阿洛醇具有很高的底物专一性,由D-果糖生产阿洛醇不产生其他副产物[2,19-20]。
3.3 FDH
RDH需要NAD+/NADH辅酶,催化合成阿洛醇过程中消耗大量NADH。NADH价格高,额外添加导致极高的成本,难以工业应用。为此,需要建立NADH生物再生系统。NAD+依赖型的FDH可有效地将甲酸(或甲酸盐)氧化为CO2,同时将NAD+还原为NADH(图1),实现RDH所需NADH辅酶再生,通过酶偶联法实现阿洛醇的高效生产。FDH在自然界中分布广泛,既存在于细菌(Pseudomonas sp.101[21],Staphylococcus aureus[22]等)、酵母菌(Candida boidinii[23],Ogataea parapolymorpha DL-1[24]等)、丝状真菌(Neurospora crassa[25]等)中,也存在于植物(大豆、拟南芥、橡树等)和其他高等真核生物中[26]。20世纪90年代中期,研究人员经比较发现,来自于细菌的FDH比来自酵母的FDH更加稳定,酶活性也更高[27]。此后,对来自于细菌中的FDH研究尤为广泛。FDH作为辅酶再生系统具有以下优点:其一,其催化的还原反应不可逆;其二,反应所需底物甲酸盐价格低廉,而且很多酶对甲酸盐具有很高的耐受性,对酶的活性影响小;其三,反应产生的副产物CO2对酶活性几乎没有影响,而且作为气体很容易地从反应体系中溢出,能够有效地省去后期繁琐的分离操作[26]。
4 酶转化生产阿洛醇
4.1 酶转化D-阿洛酮糖生产阿洛醇
2000年,TAKESHITA等利用RDH(来自于Klebsiella pneumoniae IF0 3321)和FDH成功实现了由D-阿洛酮糖转化生产阿洛醇,在30 ℃,pH 8.0条件下反应48 h后,得到10 g/L阿洛醇,底物几乎全部转化[19]。2016年,HASSANIN等报道了来自于Providencia alcalifaciens RIMD 1656011的RDH不仅能催化核糖醇为D-核酮糖,还能将D-阿洛酮糖转化为阿洛醇[20]。同年,HASSANIN等使用该RDH和来自于Ogataea parapolymorpha DL-1的FDH将20 mg D-阿洛酮糖在6 h内催化生成(16.7±0.62) mg 阿洛醇,并最终得到纯度为95%的阿洛醇晶体[24]。
4.2 酶转化D-果糖生产阿洛醇
TAKESHITA等在利用多酶促反应成功实现由D-阿洛酮糖生产阿洛醇的同时,又在反应体系中加入了来自于Pseudomonas cichorii ST-24的DTE酶,该酶能够催化D-果糖生成D-阿洛酮糖,进而经RDH和FDH将D-阿洛酮糖催化为阿洛醇。在相同条件下反应48 h后,10 g/L的D-果糖同样几乎全部转化成阿洛醇,并且没有任何副产物生成[19]。
虽然酶法转化可实现由D-阿洛酮糖或D-果糖生产阿洛醇,阿洛醇转化率高,所得阿洛醇晶体的纯度较高,但是该法需要额外添加辅酶NAD+/NADH,导致生产成本高,而且需要酶的分离纯化或固定化,增加了工艺复杂性和生产成本。
5 微生物全细胞转化生产阿洛醇
5.1 微生物全细胞转化D-阿洛酮糖生产阿洛醇
MUNIRUZZAMAN等利用Enterobacter agglomerans 221e实现了由D-阿洛酮糖生产阿洛醇,在30 ℃,pH 9.0条件下反应24 h后,0.5%的D-阿洛酮糖有97%转化成阿洛醇[18]。2014年,HAN等利用Klebsiella oxytoca G4A4实现了由D-阿洛酮糖生产阿洛醇,当底物D-阿洛酮糖的浓度为0.25%时,37 ℃,pH 8.0,约反应36 h后,阿洛醇的转化率达到87%[28]。2018年,HASSANIN等构建了能够同时表达RDH(Providencia alcalifaciens RIMD 1656011)和FDH(Ogataea parapolymorpha DL-1)的重组菌E.coli BL21 Star(DE3) pETDuet-1-RDH-FDH,并利用该菌进行全细胞生物转化,当底物D-阿洛酮糖的浓度为2.0%时,30 ℃,pH 7.0,反应48 h生成了19.2 mg阿洛醇[29]。本实验室构建了能够同时表达RDH(Providencia alcalifaciens RIMD 1656011)和FDH(Pseudomonas sp.101)的重组菌,并利用该菌进行微生物全细胞转化,可有效地实现由D-阿洛酮糖生产阿洛醇,底物浓度为90 g/L时转化率达到64.3%。为了克服生物转化反应中间产物的扩散限制和避免中间产物对细胞正常代谢的干扰,本实验室还发明了一种用于细胞内重组蛋白固定的三角形网状RNA支架,该RNA支架将RDH和FDH锚定在相邻空间的位置,使人工合成途径的重组酶分子在空间上相互靠近,形成人工合成通路,促进阿洛醇的高效合成并减少对宿主菌正常代谢的干扰,当利用RNA支架锚定RDH和FDH的重组菌株转化D-阿洛酮糖时,阿洛醇的产量具有明显提高[30-31]。
D-阿洛酮糖作为稀有糖价格较高。为此,本实验室利用DPE实现了以D-果糖生产D-阿洛酮糖,并分别利用酶催化法和模拟移动床色谱分离两种分离纯化方法得到了高纯度D-阿洛酮糖,最后利用冷却结晶法得到大量高纯度D-阿洛酮糖晶体[32-34],为阿洛醇生产提供重要原料。
5.2 微生物全细胞转化D-果糖生产阿洛醇
为了降低使用阿洛醇生产的原料成本,可以使用D-果糖为生产原料(图1)。2015年,ZHU等构建了重组菌E.coli BL21 Star(DE3) pCDF-rdh-fdh pET-dpe pACYC184 M-glf,该菌含有3种不同抗性的重组质粒,能够同时表达DPE(Ruminococcus sp.)、RDH(Klebsiella oxytoca)、FDH(Candida methylica)和GLF(促葡萄糖/果糖转运膜蛋白,Zymomonas mobilis)4种酶,利用此菌催化500 mmol/L D-果糖最终能得到48.62 g/L阿洛醇[35]。2020年,本实验室构建了能够同时表达DPE、RDH和FDH的双质粒重组菌,并利用补料培养获得大量菌体,用于转化D-果糖为阿洛醇,在底物D-果糖质量浓度100 g/L,45 ℃,pH 7.0条件下,反应4 h,阿洛醇转化率达到63%[36]。考虑到双质粒菌株的稳定性差,而且培养双质粒菌株需要添加2种不同抗性的抗生素,使得生产成本增加,本实验室又构建了能够同时表达DPE、RDH和FDH的单质粒重组菌,并利用该菌进行全细胞生物转化,在底物D-果糖的质量浓度为100 g/L,45 ℃,pH 6.0条件下,反应3 h,阿洛醇的转化率同样达到了63%,并利用结晶法得到了高纯度阿洛醇晶体[37]。使用单一质粒,菌株稳定性更好,而且菌株培养过程只需要添加一种抗生素,极大地提高了工艺稳定性并降低了生产成本。
5.3 采用微生物全细胞和酶相结合的方法由D-葡萄糖生产阿洛醇
虽然D-果糖成本低于D-阿洛酮糖,但仍大幅高于D-葡萄糖。D-葡萄糖转化生产D-果糖工艺成熟,葡萄糖异构酶可高效催化上述转化(图1)。因此,将葡萄糖异构酶引入阿洛醇生产流程,可实现由D-葡萄糖生物转化阿洛醇。2020年,本实验室利用固定化葡萄糖异构酶和能够同时表达DPE、RDH和FDH的重组菌作为混合催化剂以50 g/L D-葡萄糖为底物生产得到12.7 g/L阿洛醇,首次利用廉价底物D-葡萄糖生物转化阿洛醇,为大规模、低成本生产阿洛醇建立了切实可行的技术路线[36]。
综上所述,通过酶转化法和微生物全细胞转化法可分别实现由D-葡萄糖、D-果糖和D-阿洛酮糖生物转化生产阿洛醇(表1)。但相比于微生物全细胞转化法,酶转化工艺更加复杂。首先,酶转化法涉及酶的提取,甚至酶的分离纯化和酶的固定化,并且容易导致酶的损失;其次,酶转化法需要额外添加价格昂贵的辅酶NAD+/NADH。以上原因导致生产工艺流程复杂,生产成本提高,不利于阿洛醇的工业化生产。微生物全细胞转化法生产阿洛醇可以有效地避免上述问题,采用离心或过滤的简单方式可得到具有催化活性的菌体,用于阿洛醇的催化生产,而且催化过程不需要额外添加辅酶NAD+/NADH,可以直接利用胞内的辅酶参与反应。该工艺简单,生产成本低,有利于阿洛醇的工业化生产。利用酶与细胞结合的方法,以廉价底物D-葡萄糖生产阿洛醇,可进一步降低生产成本,有利于大规模工业生产。
6 展望
阿洛醇作为一种稀有糖具有重要的生理功能和应用价值。当前,阿洛醇的生产主要采用生物转化法,一是酶转化法,二是微生物全细胞转化法。其中,微生物全细胞转化法与酶转化法相比不需要细胞破碎和添加辅酶,具有明显的工艺和成本优势。但是,生物转化法生产阿洛醇,生物催化剂活性以及环境耐受性等仍有待提高,辅酶再生系统仍有待进一步完善。例如,可以采用酶分子理性设计、酶分子结构突变和高通量筛选等方式对酶分子进行进一步改造和优化;对主反应及辅酶再生反应通路进行优化设计以期得到高反应活性的催化菌株;对反应过程进行系统性优化,以进一步提高阿洛醇生产水平和生产效率。
表1 利用酶转化法和微生物全细胞转化法由D-葡萄糖、D-果糖和D-阿洛酮糖生产阿洛醇
Table 1 Production of allitol from D-glucose,D-fructose and D-psicose by using enzymatic catalysis and whole-cell catalysis

生产方法底物质量浓度/(g·L-1)D-葡萄糖D-果糖D-阿洛酮糖NADH(NAD+)温度/℃pH时间/h阿洛醇/(g·L-1)文献酶转化法--10+308.04810[19]-10-+308.04810[19]--10+407.568.35[24]细胞转化法--5-309.0244.90[18]--2.5-378.0362.20[28]-90--407.01548.62[35]--20-307.04819.2[29]-100--457.0463.4[36]-100--456.0363.44[37]50---70457.02/34 12.7[36]
[1] BEERENS K,DESMET T,SOETAERT W.Enzymes for the biocatalytic production of rare sugars[J].Journal of Industrial Microbiology & Biotechnology,2012,39(6):823-834.
[2] HASSANIN H A M,MU W M,KOKO M Y F,et al.Allitol:Production,properties and applications[J].International Journal of Food Science and Technology,2016, 52(1):91-97.
[3] IZUMORI K.Izumoring:a strategy for bioproduction of all hexoses[J].Journal of Biotechnology,2006,124(4):717-722.
[4] JIANG S W,XIAO W,ZHU X X,et al.Review on D-allulose:In vivo metabolism,catalytic mechanism,engineering strain construction,bio-production technology[J].Frontiers in Bioengineering and Biotechnology,2020,8:26.
[5] OOSAKA K.Possibility as monosaccharide laxative of rare sugar alcohols[J].Yakugaku Zasshi,2009,129(5):575-580.
[6] WU S H,LUO X D,MA Y B,et al.Two novel secoergosterols from the fungus Tylopilus plumbeoviolaceus[J].Journal of Natural Products,2000, 63(4):534-536.
[7] ZENG Y,DOU D Q,ZHANG Y,et al.Rare sugars and antioxidants in Itea virginica,Itea oblonga Hand.-Mazz.,and Itea yunnanensis Franch leaves[J].International Journal of Food Properties,2015,18(11):2 549-2 560.
[8] BALLARD J M,STACEY B E.The reaction of allitol with hydrogen halides[J].Carbohydrate Research,1973, 30(1):83-89.
[9] JUMDE V R,EISINK N N H M,WITTE M D,et al.C3 epimerization of glucose,via regioselective oxidation and reduction[J].The Journal of Organic Chemistry,2016,81(22):11 439-11 443.
[10] ZHU Z L,GAO D K,LI C,et al.Redesign of a novel D-allulose 3-epimerase from Staphylococcus aureus for thermostability and efficient biocatalytic production of D-allulose[J].Microbial Cell Factories,2019,18(1):59.
[11] ZHU Z L,LI C,LIU X,et al.Biochemical characterization and biocatalytic application of a novel D-tagatose 3-epimerase from Sinorhizobium sp.[J].RSC Advances,2019, 9(6):2 919-2 927.
[12] IZUMORI K,KHAN A R,OKAYA H,et al.A new enzyme,D-ketohexose 3-epimerase,from Pseudomonas sp.ST-24[J].Bioscience,Biotechnology,and Biochemistry,1993,57(6):1 037-1 039.
[13] ZHANG L T,MU W M,JIANG B,et al.Characterization of D-tagatose-3-epimerase from Rhodobacter sphaeroides that converts D-fructose into d-psicose[J].Biotechnology Letters,2009,31(6):857-862.
[14] KIM H J,HYUN E K,KIM Y S,et al.Characterization of an Agrobacterium tumefaciens D-psicose 3-epimerase that converts D-fructose to D-psicose[J].Applied and Environmental Microbiology,2006,72(2):981-985.
[15] MU W M,CHU F F,XING Q C,et al.Cloning,expression,and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10[J].Journal of Agricultural and Food Chemistry,2011,59(14):7 785-7 792.
[16] ZHU Y M,MEN Y,BAI W,et al.Overexpression of D-psicose 3-epimerase from Ruminococcus sp.in Escherichia coli and its potential application in D-psicose production[J].Biotechnology Letters,2012,34(10):1 901-1 906.
[17] UECHI K,TAKATA G,FUKAI Y,et al.Gene cloning and characterization of L-ribulose 3-epimerase from Mesorhizobium loti and its application to rare sugar production[J].Bioscience,Biotechnology,and Biochemistry,2013,77(3):511-515.
[18] MUNIRUZZAMAN S,TOKUNAGA H,IZUMORI K.Conversion of D-psicose to allitol by Enterobacter agglomerans strain 221e[J].Journal of Fermentation and Bioengineering,1995,79(4):323-327.
[19] TAKESHITA K,ISHIDA Y,TAKADA G,et al.Direct production of allitol from D-fructose by a coupling reaction using D-tagatose 3-epimerase,ribitol dehydrogenase and formate dehydrogenase[J].Journal of Bioscience and Bioengineering,2000,90(5):545-548.
[20] HASSANIN H A,WANG X,MU W M,et al.Cloning and characterization of a new ribitol dehydrogenase from Providencia alcalifaciens RIMD 1656011[J].Journal of the Science of Food and Agriculture,2016,96(8):2 917-2 924.
[21] D’ORONZO E,SECUNDO F,MINOFAR B,et al.Activation/inactivation role of ionic liquids on formate dehydrogenase from Pseudomonas sp.101 and its mutated thermostable form[J].ChemCat Chem,2018,10(15):3 247-3 259.
[22] POMETUN A A,BOYKO K M,YURCHENKO T S,et al.Highly-active recombinant formate dehydrogenase from pathogenic bacterium Staphylococcus aureus:Preparation and crystallization[J].Biochemistry(Moscow),2020,85(6):689-696.
[23] SLUSARCZYK H,FELBER S,KULA M R,et al.Stabilization of NAD-dependent formate dehydrogenase from Candida boidinii by site-directed mutagenesis of cysteine residues[J].European Journal of Biochemistry,2000,267(5):1 280-1 289.
[24] HASSANIN H A M,LETSIDIDI R,KOKO M Y F,et al.Synthesis of allitol from D-psicose using ribitol dehydrogenase and formate dehydrogenase[J].Tropical Journal of Pharmaceutical Research,2016, 15(12):2 701-2 708.
[25] CHOW C M,RAJBHANDARY U L.Developmental regulation of the gene for formate dehydrogenase in Neurospora crassa[J].Journal of Bacteriology,1993,175(12):3 703-3 709.
[26] 黄志华, 刘铭,王宝光,等.甲酸脱氢酶用于辅酶NADH再生的研究进展[J].过程工程学报,2006,6(6):1 011-1 016.
HUANG Z H,LIU M,WANG B G,et al.Formate dehydrogenase and its application in cofactor NADH regeneration[J].The Chinese Journal of Process Engineering,2006,6(6):1 011-1 016.
[27] TISHKOV V I,POPOV V O.Catalytic mechanism and application of formate dehydrogenase[J].Biochemistry(Moscow),2004,69(11):1 252-1 267.
[28] HAN W J,ZHU Y M,MEN Y,et al.Production of allitol from D-psicose by a novel isolated strain of Klebsiella oxytoca G4A4[J].Journal of Basic Microbiology,2014,54(10):1 073-1 079.
[29] HASSANIN H A,EASSA M A,JIANG B.Facile synthesis of bioactive allitol from D-psicose by coexpression of ribitol dehydrogenase and formate dehydrogenase in Escherichia coli[J].Journal of Food Bioactives,2018,4:117-122.
[30] 林建强, 柴玉颖,温鑫,等.一种利用重组胞内RNA支架固定重组酶促进细胞催化阿洛醇生产的方法:CN111378612A[P].2020-07-07.
LIN J Q,CHAI Y Y,WEN X,et al.Method of recombinant enzyme was immobilized on a recombinant intracellular RNA scaffold to promote the production of allitol:China,CN111378612A[P].2020-07-07.
[31] 林建强, 柴玉颖,任一林,等.用于细胞内重组蛋白固定的三角形网状RNA支架及其构建方法与应用:CN111378654A[P].2020-07-07.
LIN J Q,CHAI Y Y,REN Y L,et al.A triangular reticular RNA scaffold for intracellular fixation of recombinant proteins and its construction method and application:CN111378654A[P].2020-07-07.
[32] LI C,LIN J Q,GAO L,et al.Modeling and simulation of enzymatic gluconic acid production using immobilized enzyme and CSTR-PFTR circulation reaction system[J].Biotechnology Letters,2018,40(4):649-657.
[33] LI C,LIN J Q,GUO Q Q,et al.D-psicose 3-epimerase secretory overexpression,immobilization,and D-psicose biotransformation,separation and crystallization[J].J Chem Technol Biotechnol,2018,93(2):350-357.
[34] LI C,ZHANG C J,LIN J Q,et al.Enzymatic fructose removal from D-psicose bioproduction model solution and the system modeling and simulation[J].Journal of Chemical Technology and Biotechnology,2018,93(5):1 249-1 260.
[35] ZHU Y M,LI H Y,LIU P P,et al.Construction of allitol synthesis pathway by multi-enzyme coexpression in Escherichia coli and its application in allitol production[J].Journal of Industrial Microbiology & Biotechnology,2015,42(5):661-669.
[36] WEN X,LIN H B,REN Y L,et al.Optimization for allitol production from D-glucose by using immobilized glucose isomerase and recombinant E.coli expressing D-psicose-3-epimerase,ribitol dehydrogenase and formate dehydrogenase[J].Biotechnology Letters,2020,42(11):2 135-2 145.
[37] WEN X,LIN H B,REN Y L,et al.Efficient allitol bioproduction from d-fructose catalyzed by recombinant E.coli whole cells,and the condition optimization,product purification[J].Applied Biochemistry and Biotechnology,2020,192(2):680-697.