近年来,由于慢性病、致病微生物感染及不健康的生活方式等原因,导致免疫功能失调的发生率日益增高。目前,临床常使用化学药物,如匹多莫德、环磷酰胺、前列腺素、环孢素A、硫代氨基甲酸酯和青霉胺等来调节人体免疫功能[1-2]。但化学药物存在价格昂贵,副作用较强(如引起恶心、骨髓毒性和肝脏毒性)等缺点[3]。研究表明,免疫调节肽对先天性和获得性免疫应答反应具有调节作用,且具有无副作用、成本低的优点,为免疫调节制剂的研发开辟了新途径。
本文对近年来食物蛋白源免疫调节肽的类型、获取途径、功效评价方法及作用机制进行综述,以期为免疫调节相关功能性食品、药物的研究及开发提供参考。
1 免疫调节肽的功效评价方法
免疫调节肽的功效评价多数是通过细胞模型和动物模型进行测定,少数通过临床试验测定。淋巴细胞增殖试验、腹腔巨噬细胞吞噬功能测定、自然杀伤细胞活性测定、细胞因子(IL-2、IFN-、IL-5、IL-6)测定等体内外免疫学检测是目前常用的免疫调节功能评价方法(图1)。
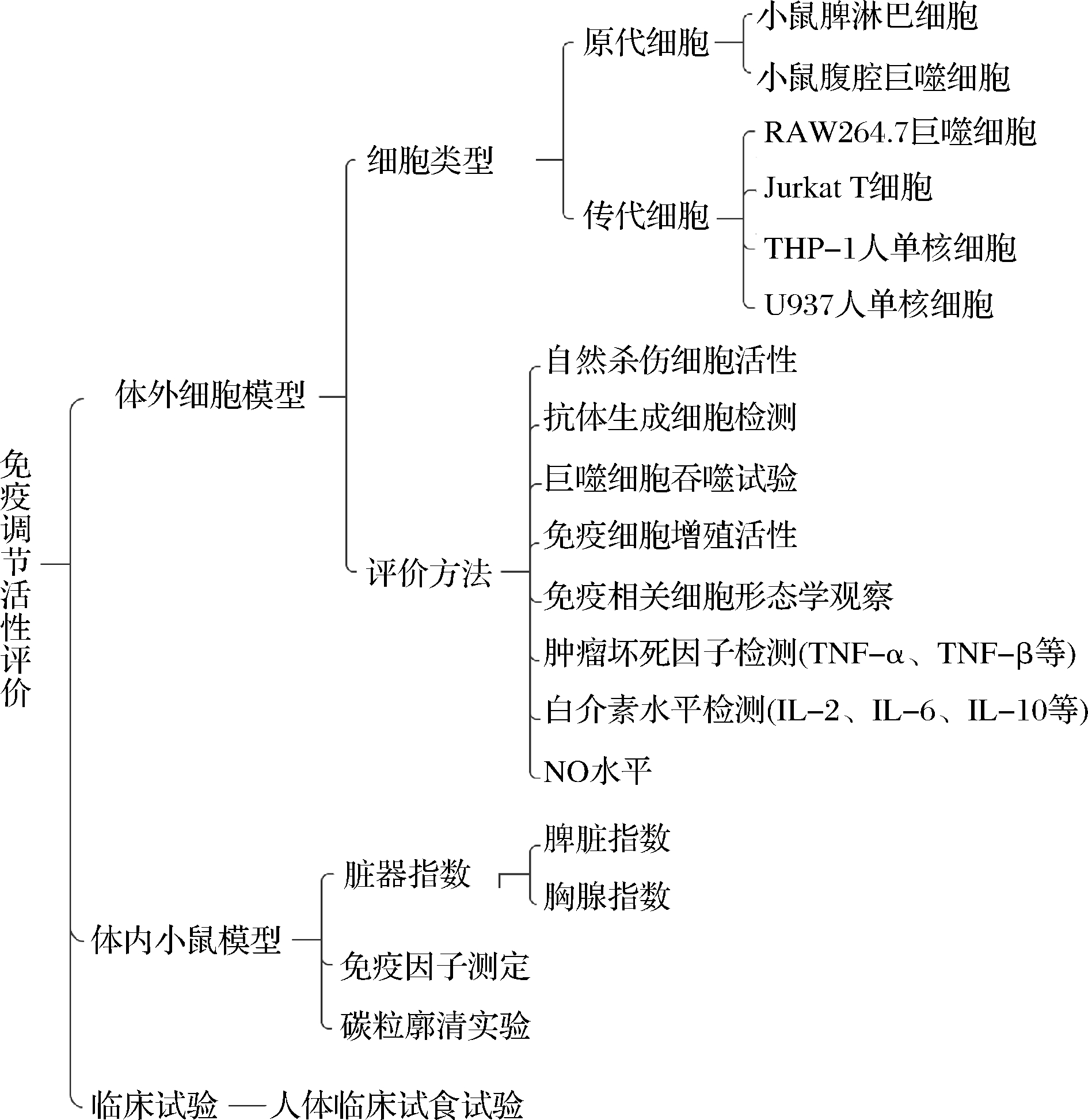
图1 食源性免疫调节肽的评价方法
Fig.1 Evaluation method of food-derived immunomodulatory peptides
1.1 体外免疫调节活性评价
多肽的体外免疫活性评价多采用细胞模型测定。细胞模型分为原代细胞和传代细胞系2种,其中传代细胞系最常用。
巨噬细胞在免疫系统中起着至关重要的作用,能够通过吞噬作用及释放细胞毒分子(如NO)或细胞因子(如TNF-α、IL-6)杀死病原体。因此,巨噬细胞是评价多肽免疫调节活性的理想细胞模型。在众多传代细胞系中,小鼠巨噬细胞系RAW 264.7在评价多肽免疫调节活性中应用最广泛。此外,U937细胞(人单核巨噬细胞模型)、THP-1细胞(人单核细胞模型)和Jurkat T细胞(人T淋巴细胞模型)也常用于评价免疫调节活性。XU等[4]从中华小公鱼胃蛋白酶产物中以RAW 264.7细胞相对增殖率为指标筛选出具有免疫调节活性的五肽YVMRF,该五肽能促进RAW 264.7细胞分化,增加NO、白细胞介素-6(IL-6)、白细胞介素-1(IL-1)和肿瘤坏死因子-α(TNF-α)的产生。LIU等[5]以U937细胞分泌IL-6的水平,从玉米醇溶蛋白嗜热菌蛋白酶产物中鉴定出5条多肽:PFNQLAG、SQLALTNPT、FLPFNQL、PFNQL和FLPPVT,其中FLPFNQL的免疫调节活性最高。
原代细胞也用作评价免疫调节活性的体外细胞模型。通常在无菌条件下取小鼠腹腔巨噬细胞或脾淋巴细胞进行培养,并用不同浓度的蛋白水解物或多肽处理细胞,孵育一段时间后,检测细胞增殖情况、形态变化或免疫调节因子的分泌水平,以评估多肽的潜在免疫调节活性。HOU等[6]在无菌条件下取小鼠脾脏分离得到原代脾淋巴细胞,以脾淋巴细胞增殖活性评价阿拉斯加鳕鱼排蛋白水解物的免疫调节活性,经分离、纯化、鉴定得到3条免疫调节肽:NGMTY、NGLAP和WT,均能促进脾淋巴细胞增殖。
1.2 体内免疫调节活性评价
多肽的体内免疫调节活性评价通常在小鼠模型上进行。小鼠口服不同浓度多肽,持续给药一段时间,试验结束后,处死小鼠,取脾脏、胸腺、血液等,测定免疫脏器指数(脾脏指数、胸腺指数)和血清中免疫因子水平等,评估多肽的免疫调节活性。多肽的给药周期和使用浓度取决于多肽的来源和结构。进行动物模型试验时一般要设置高、中、低剂量组。贺屹潮[7]用环磷酰胺建立免疫低下小鼠模型,评价大鲵肉酶解产物的免疫调节活性,试验发现,酶解产物具有较强的免疫调节活性,在试验浓度为100 mg/mL时能显著提高正常小鼠细胞免疫功能以及免疫低下小鼠的巨噬细胞吞噬活性和IL-6分泌水平。HOU等[8]以氢化可的松建立的免疫低下小鼠模型,利用不同剂量鳕鱼排蛋白水解物灌胃小鼠,发现其可以明显提高免疫低下小鼠的免疫调节作用,证实鳕鱼排蛋白水解物具有免疫调节活性。
2 免疫调节肽的构效关系及作用机制
对免疫调节肽的研究主要集中在免疫调节活性与结构(氨基酸种类、组成、序列长度等)的关系以及可能的作用机制。
2.1 免疫调节肽的构效关系
多肽的免疫调节能力大小取决于其构效关系,包括氨基酸组成、序列长度、电荷性质、亲疏水性和多肽分子结构等。根据多肽的结构特征可以预测其是否具有免疫调节活性。
多肽的氨基酸组成、种类和多肽的分子结构与其免疫调节活性息息相关。具有免疫调节作用的多肽一般由2~10个氨基酸残基组成,分子质量较小。研究发现,多肽的免疫调节活性与精氨酸、赖氨酸和组氨酸等带正电荷的氨基酸含量呈正相关[9-10]。叶盛旺等[11]从青蛤胃蛋白酶产物中筛选出分子质量<3 kDa的活性肽,免疫调节活性高,能显著增强巨噬细胞RAW 264.7的吞噬能力、NO的分泌水平和细胞因子的分泌量。多数免疫调节肽含有特定氨基酸组成,如疏水性氨基酸(缬氨酸、亮氨酸、脯氨酸、色氨酸、丙氨酸、异亮氨酸、甲硫氨酸和苯丙氨酸)和芳香基氨基酸(酪氨酸、色氨酸、苯丙氨酸)等。此外,N或C端含有精氨酸、磷酸丝氨酸、谷氨酰胺或色氨酸的免疫调节肽的免疫调节活性可能更高。可能原因是存在该结构的多肽与细胞膜的相互作用增加,更容易被免疫细胞上的受体识别,从而促进了其免疫调节活性[12-13]。从玉米蛋白得到的FLPFNQL、太子参蛋白得到的RGPPP和大米蛋白得到的YGIYPR均含有较高的疏水性氨基酸[5,9,14]。马氏珠母贝酶解得到的二肽VR含有疏水性氨基酸缬氨酸(V)和带正电荷的氨基酸精氨酸(R),在较低浓度下(0.3 mg/mL)表现出优异的体外免疫调节活性[15]。
尽管大部分免疫调节肽都含有疏水性氨基酸,但疏水性氨基酸可能并不是免疫调节肽发挥其免疫调节作用所必需的。石红岭[16]从林蛙油中性蛋白酶产物得到的免疫调节肽HYDQSYR,不含有疏水性氨基酸,但能显著促进小鼠脾细胞、RAW 264.7细胞增殖,促进IL-1β、TNF-α和NO分泌,其可能原因是该多肽整体呈正电荷且序列中存在酪氨酸(Y)残基。
2.2 免疫调节肽的作用机制
免疫调节肽对先天性免疫和获得性免疫应答反应均具有免疫调节作用。免疫调节肽具有多种靶细胞,包括单核细胞、巨噬细胞、自然杀伤细胞、T淋巴细胞和B淋巴细胞等。目前对多肽免疫调节作用的确切机制尚不完全清楚。可能的免疫调节机制有:激活巨噬细胞及其吞噬功能,上调细胞因子、NO和免疫球蛋白等诱导免疫调节剂的分泌,增加白细胞数,刺激自然杀伤细胞以及脾细胞、CD8+、CD4+、CD116+和CD56+细胞,激活转录因子核因子κB(NF-κB)和有丝分裂原激活蛋白激酶(MAPK),从而提高机体对病原体的防御能力、诱导产生分泌型IgA细胞、增强肠道黏膜免疫以及抑制宿主细胞对细菌成分(如脂多糖)的促炎反应等途径(图2)。这些作用可能通过多肽与免疫细胞表面受体的直接结合从而激活细胞表面受体介导的相关信号通路。CIAN等[17]发现柱斑紫菜水解物通过NF-κB通路、p38和JNK通路上调大鼠巨噬细胞中的IL-10水平,提高机体免疫能力。HE等[18]发现从鸭蛋清蛋白中获取的多肽TQIDKVVHFDKLPGF和WTSSTMMEER,均可促进RAW 264.7细胞分泌NO、TNF-α和IL-6,分子对接实验结果表明,该多肽与Toll样受体2(TLR2)和4(TLR4)相互作用均表现出良好的亲和力,相互作用位点图分析发现,该多肽能与受体形成稳定的氢键,有助于多肽的免疫调节活性。

图2 免疫调节肽的作用机制
Fig.2 Mechanism of immunoregulatory peptides
3 不同类型食物蛋白源免疫调节肽的制备
1984年PARKER等[19]首次从人酪蛋白酶解产物中鉴定出免疫调节肽,此后,陆续发现多种具有免疫调节活性蛋白水解物或多肽。免疫调节肽的氨基酸组成及序列与其母体蛋白息息相关。不同蛋白来源的免疫调节肽活性不同。近年来从牛乳清蛋白[20]、鱼肉蛋白[21]、蚕蛹蛋白[22]、大米蛋白[23]、小麦蛋白[24-25]、大豆蛋白[26]、羽扇豆蛋白[27-28]和微藻类蛋白[29]等多种食物蛋白中鉴定出多种免疫调节肽(表1)。
利用食物蛋白制备免疫调节肽的方法有酸水解、碱水解、化学水解、微生物水解和酶水解等[30],其中酶解法最常用。胰蛋白酶、碱性蛋白酶、胃蛋白酶、木瓜蛋白酶、糜蛋白酶、热裂解酶、风味酶和中性蛋白酶等酶常用于免疫调节肽的制备。采用酶解法,从青蛤胃蛋白酶酶解产物[12]、小麦胚芽球蛋白碱性蛋白酶酶解产物[31]和日本黄姑鱼木瓜蛋白酶酶解产物[32]中均分离鉴定出免疫调节肽。
蛋白酶解产物可通过低分子质量截留膜过滤、凝胶过滤色谱、离子交换色谱和反相-高效液相色谱(RP-HPLC)等手段进一步分离纯化获得免疫调节肽。采用多种分离纯化手段逐步对酶解产物进行分离纯化,对纯化得到的免疫调节肽进行结构表征,可得到单一的免疫调节肽。多肽氨基酸序列鉴定常用的技术是液相色谱-质谱联用(LC-MS),该技术灵敏度高、所需样品量少[33]。通过质谱分析得到多肽序列,与多肽数据库进行比对,可以解析免疫调节肽的构效关系[34]。
3.1 动物蛋白来源的免疫调节肽
乳、蛋是最早用于制备免疫调节肽的蛋白来源。由牛奶酪蛋白制备的酪蛋白磷酸肽(CPP),具有显著的抗菌活性,且能刺激人外周单核细胞产生调节性细胞因子IL-10[35]。ADAMS等[36]从牛奶酪蛋白发酵产物中得到IPP和CPP两种免疫调节肽,在没有促炎刺激剂的情况下能诱导THP-1单核细胞产生调节性细胞因子IL-10,还可诱导人脐静脉内皮细胞产生NO。KIEWIET等[37]发现牛奶乳清蛋白水解产物能够显著增加外周单核细胞表达IL-10和TNF-α,还可通过激活Toll样受体来参与免疫调节。通过酶解、微生物发酵及理化方法处理鸡蛋蛋白能制备具有免疫调节活性的多肽。蛋黄中的卵黄蛋白具有抗炎活性,能够抑制脂多糖诱导的RAW 264.7巨噬细胞产生促炎细胞因子,如TNF-α、IL-1β、IL-6和IL-10[38]。卵黄蛋白的胃蛋白酶和碱性蛋白酶酶解产物具有很强的抗炎活性,能减少NO和前列腺素E2(PGE2)的产生,而后者与多种炎症性疾病密切相关,其中诱导型一氧化氮(INOS)和环氧合酶2(COX-2)受到抑制[39]。HE等[18]发现鸭蛋清的木瓜蛋白酶水解物中的多肽TQIDKVVHFDKLPGF能显著提高RAW 264.7细胞的吞噬能力,促进NO、TNF-α和IL-6的分泌以及激活Toll样受体2和4参与免疫应答。分离自鸡肉蛋白Protex 50FP酶解产物的多肽FLWGKSY在U937细胞上显示出IL-6的抑制活性,具有较高的免疫调节活性[40]。
表1 食物蛋白源免疫调节肽的获取、功能评价列表
Table 1 The acquisition and functional evaluation of food protein-derived immunomodulatory peptides

多肽序列亲本蛋白获取方法评价方法疏水氨基酸/%文献YGIYPR大米蛋白胰蛋白酶RAW 264.7巨噬细胞增殖活性66.6[14]FLPPVT玉米醇溶蛋白嗜热菌蛋白酶LPS诱导人单核细胞系U937细胞产IL-6抑制活性83.33[5]PFNQLAG玉米醇溶蛋白嗜热菌蛋白酶LPS诱导人单核细胞系U937细胞产IL-6抑制活性57.14[5]SQLALTNPT玉米醇溶蛋白嗜热菌蛋白酶LPS诱导人单核细胞系U937细胞产IL-6抑制活性44.44[5]FLPFNQL玉米醇溶蛋白嗜热菌蛋白酶LPS诱导人单核细胞系U937细胞产IL-6抑制活性71.43[5]PFNQL玉米醇溶蛋白嗜热菌蛋白酶LPS诱导人单核细胞系U937细胞产IL-6抑制活性60[5]RGPPP太子参蛋白胃蛋白酶、胰蛋白酶小鼠脾淋巴细胞增殖活性,刺激指数,RAW264.7巨噬细胞吞噬率60[9]YGPSSYGYG太子参蛋白胃蛋白酶RAW 264.7细胞和脾淋巴细胞刺激指数;巨噬细胞吞噬活性,NO、ROS和TNF-α的分泌水平11.11[10]ECFSTA小麦胚芽球蛋白碱性蛋白酶RAW 264.7细胞吞噬活性;NO、ROS、IL-6和TNF-α分泌33.33[31]TSeMMM富硒大米蛋白碱性蛋白酶RAW 264.7细胞NO生成量、吞噬功能和增殖能力75[23]GVIK阿拉斯加鳕鱼木瓜蛋白酶、胰蛋白酶小鼠胸腺指数和脾脏指数;小肠黏液中SIgA、IgA、IgG、IL-6、IL-10的含量;血清中IgA、IgG含量;脾淋巴细胞增殖活性50[41]ACNGR阿拉斯加鳕鱼木瓜蛋白酶、胰蛋白酶小鼠胸腺指数和脾脏指数;小肠黏液中SIgA、IgA、IgG、IL-6、IL-10的含量;血清中IgA、IgG含量;脾淋巴细胞增殖活性20[41]YVMRF中华小公鱼胃蛋白酶RAW 264.7细胞相对增殖活性;生长状态;细胞因子的产生60[4]NGMTY阿拉斯加鳕鱼排胰蛋白酶小鼠脾淋巴细胞增殖活性20[6]NGLAP阿拉斯加鳕鱼排胰蛋白酶小鼠脾淋巴细胞增殖活性60[6]WT阿拉斯加鳕鱼排胰蛋白酶小鼠脾淋巴细胞增殖活性50[6]RVAPEEHPVEGRYLV青蛤胃蛋白酶RAW 264.7细胞增殖活性、中性红吞噬能力、NO和细胞因子水平的测定;一氧化氮合酶、IκB-α、NF-κB和NLRP3蛋白水平46.66[12]GRVMPVLKSPTIPFF-DPQIP人β-酪蛋白112~131位氨基酸固相合成RAW 264.7细胞增殖活性RAW 264.7细胞和THP-1细胞的趋化因子/细胞因子产生65[42]VPP牛奶酪蛋白瑞士乳杆菌、鼠李糖乳杆菌发酵人THP-1单核细胞促炎症因子和调节性细胞因子的产生100[36]IPP牛奶酪蛋白瑞士乳杆菌、鼠李糖乳杆菌发酵人THP-1单核细胞促炎症因子和调节性细胞因子的产生100[36]DHAV蚕蛹蛋白碱性蛋白酶脾淋巴细胞增殖活性及相关免疫因子表达量50[43]RGQLGPM鸡软骨中性蛋白酶脾细胞淋巴细胞增殖测定42.86[44]PNPNTN家蚕超微处理、碱性蛋白酶脾淋巴细胞增殖活性33.33[22]TQIDKVVHFDKLPGF鸭蛋清木瓜蛋白酶RAW 264.7细胞吞噬能力,NO、TNF-α和IL-6的分泌46.67[18]FLWGKSY鸡肉Protex 50FP LPS诱导的人单核细胞系U937细胞产IL-6抑制活性42.86[40]VR马氏珠母贝胰蛋白酶、胰凝乳蛋白酶小鼠脾淋巴细胞和腹腔巨噬细胞巨噬细胞50[15]AAGFLMK林蛙油中性蛋白酶小鼠脾细胞和RAW 264.7细胞增殖活性和吞噬活性71.43[16]SDLEWIR林蛙油中性蛋白酶小鼠脾细胞和RAW 264.7细胞增殖活性和吞噬活性42.86[16]HYDQSYR林蛙油中性蛋白酶小鼠脾细胞和RAW 264.7细胞增殖活性和吞噬活性0[16]
3.2 植物蛋白来源的免疫调节肽
粮食作物是食物蛋白的重要来源,是制备免疫调节肽的潜在食物蛋白。源于大豆球蛋白的大豆衍生肽可与巨噬细胞和中性粒细胞表面的受体相互作用,产生与细菌感染类似的免疫信号,如大豆衍生的43肽Lunasin具有多种免疫调节活性。XU等[14]用胰蛋白酶消化大米蛋白,以RAW 264.7巨噬细胞相对增殖活性为活性评价指标,通过大孔吸附树脂、强阳离子交换层析、凝胶过滤层析和反相高效液相色谱分离得到多肽YGIYPR,在质量浓度为12.5~100 μg/mL时能促进RAW 264.7细胞增殖。FANG等[23]在富硒大米蛋白中获得富硒多肽TSeMMM和SeMDPGQQ,均能提高RAW 264.7细胞的吞噬率和增殖能力,降低NO生成量。LIU等[5]在玉米醇溶蛋白的嗜热菌蛋白酶产物中获得FLPPVT、PFNQLAG、SQLALTNPT、FLPFNQL和PFNQL,均能抑制U937细胞生成IL-6,调节炎症反应。其中疏水性氨基酸占比较高的FLPPVT(83.33%)和FLPFNQL(71.43%)表现出更强的活性。
3.3 海洋蛋白来源的免疫调节肽
海洋蛋白来源的多肽和蛋白水解物具有多种生物学活性,如抗菌、抗氧化、降血压、抗炎和免疫调节等。已经从蛤类等甲壳类软体动物、海洋藻类、海洋鱼类等海洋来源蛋白中获取到免疫调节肽。HOU等[6]发现鳕鱼排胰酶水解产物能显著提高正常小鼠的淋巴细胞转化活性、迟发型变态反应和单核巨噬细胞吞噬能力,能显著提高免疫功能低下小鼠的免疫器官指数、迟发型变态反应、脾淋巴细胞的增殖、血清溶血素含量、碳廓清能力和腹腔巨噬细胞对鸡红细胞的吞噬率和吞噬指数等,进一步纯化鉴定得到NGMTY、NGLAP和WT 3条多肽,纯化的多肽在浓度为20 μg/mL时,淋巴细胞增殖率分别为35.92%、32.96%和31.35%。同样,LI等[41]利用木瓜蛋白酶和胰蛋白酶酶解阿拉斯加鳕鱼蛋白得到多肽ACNGR,能够改善环磷酰胺诱导的小鼠的免疫器官指数,促进脾淋巴细胞增殖,增加与肠黏膜免疫相关的SIgA、IgA、IL-6、IL-10的分泌,从而提高小肠黏膜免疫功能。分别从中华小公鱼、青蛤的酶解产物分离的多肽YVMRF、RVAPEEHPVEGRYLV,均能够促进RAW 264.7细胞的增殖活性[4,12]。海洋蛋白来源的免疫调节肽的序列通常较短,分子质量小于3 kDa。如从马氏珠母贝酶解得到的免疫调节肽VR,仅由2个氨基酸组成,在0.3 mg/mL时也可促进小鼠脾淋巴细胞增殖和腹腔巨噬细胞吞噬活性,表现出优异的体外免疫调节功能[15]。
4 生物信息学在活性肽发掘中的应用
酶解法是现阶段制备活性肽的主要途径。酶解使用的蛋白酶不能循环利用,增加了研发成本,还会影响后续的分离纯化。随着固定化酶技术的发展,将蛋白酶固定,然后对蛋白进行连续水解,能够在一定程度上控制水解度和减少酶的浪费。而且,采用酶解法制备活性肽,需要筛选酶的种类并对酶解条件进行优化,效率低、成本高,存在一定的盲目性。
随着生物信息学的发展,可采用生物信息学方法进行生物活性肽的发掘、评价。如利用PeptideCutter和BIOPEP-UWM等分析平台对已知蛋白序列进行模拟酶切。頡宇等[45]基于BIOPEP-UWM数据库,借助计算机辅助与酶解法结合,定向制备出柠条籽蛋白抗氧化肽。利用PeptideRanker分析平台,对酶切获得的多肽进行生物活性评价,分析其存在生物活性的概率。生物活性肽的开发与应用还应注意其潜在的毒性。Toxinpred平台可以预测多肽潜在的毒性,还可根据多肽序列突变选项来降低多肽的毒性。PAULINA 等[46]采用多肽组学和生物信息学方法并结合LC-ESI-MS,从牛肉的酸性乳清处理产物中得到一系列多肽序列,通过toxinpred分析毒性后,使用PeptideRanker和BIOPEP-UWM预测潜在的生物学活性,发现多肽产物中存在DPP-Ⅳ(二肽基肽酶)和ACE(血管紧张素转化酶)抑制活性。采用生物信息学方法对蛋白序列模拟酶切,再结合酶解试验进行验证,这为新型免疫调节肽的发掘与活性研究提供了新途径。
5 总结与展望
近年来,免疫功能失调引发的疾病呈上升趋势,现阶段临床使用的免疫调节药物价格昂贵,且具有一定的毒副作用,因此开发高效、经济、安全的免疫调节肽具有重要意义。本文综述了近年来食物蛋白源免疫调节肽的类型、获取途径、功效评价方法及作用机制研究进展。免疫调节肽的蛋白来源广泛,制备工艺较成熟,安全性高,分子质量小,易吸收,具有减轻自身免疫病和炎症、免疫反应及氧化应激功效,在食品、医药领域应用前景广阔。但目前对食物蛋白源免疫调节肽的研究大都集中在制备、分离纯化以及结构鉴定方面,其功效评价大都停留在细胞模型和动物模型水平,只有少部分在健康机体中得到进一步验证,且缺乏在疾病模型中的验证,与之相关的临床人体实验开展较少,仍处于试验阶段。此外,免疫调节肽的分子作用机制有待阐明,如发挥作用的氨基酸序列,以及作用的靶点等。随着现代分离、鉴定技术与生物信息学的发展,采用上述生物信息学预测与实验相结合的手段势必推动免疫调节肽的研发和应用。相信在不久的将来,新型免疫调节肽将会不断被发掘、鉴定。
[1] CORNEJO-GARC A J A,PERKINS J R,JURADO-ESCOBAR R,et al.Pharmacogenomics of prostaglandin and leukotriene receptors[J].Frontiers in Pharmacology,2016,7:316.
A J A,PERKINS J R,JURADO-ESCOBAR R,et al.Pharmacogenomics of prostaglandin and leukotriene receptors[J].Frontiers in Pharmacology,2016,7:316.
[2] AHLMANN M,HEMPEL G.The effect of cyclophosphamide on the immune system:Implications for clinical cancer therapy[J].Cancer Chemotherapy and Pharmacology,2016,78(4):661-671.
[3] SHI Q L,CHEN L J.Cereblon:A protein crucial to the multiple functions of immunomodulatory drugs as well as cell metabolism and disease generation[J].Journal of Immunology Research,2017,2017:9130608.
[4] XU B,YE L,TANG Y,et al.Preparation and purification of an immunoregulatory peptide from Stolephorus chinensis of the East Sea of China[J].Process Biochemistry,2020,98:151-159.
[5] LIU P,LIAO W,QI X P,et al.Identification of immunomodulatory peptides from zein hydrolysates[J].European Food Research and Technology,2020,246(5):931-937.
[6] HOU H,FAN Y,LI B F,et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chemistry,2012,134(2):821-828.
[7] 贺屹潮. 大鲵肉酶解肽制备及抗氧化与免疫调节活性研究[D].汉中:陕西理工大学,2020.
HE Y C.Preparation of enzymatic peptides from Chinese giant salamander(Andrias davidiauns) meat and its antioxidant and immunomodulatory activity activity[D].Hanzhong:Shaanxi University of Technology,2020.
[8] HOU H,FAN Y,WANG S.et al.Immunomodulatory activity of Alaska pollock hydrolysates obtained by glutamic acid biosensor-Artificial neural network and the identification of its active central fragment[J].Journal of Functional Foods,2016,24:37-47.
[9] YANG Q,CAI X,HUANG M.et al.A specific peptide with immunomodulatory activity from Pseudostellaria heterophylla and the action mechanism[J].Journal of Functional Foods,2020,68:103887.
[10] YANG Q,CAI X X,HUANG M C,et al.Isolation,identification,and immunomodulatory effect of a peptide from Pseudostellaria heterophylla protein hydrolysate[J].Journal of Agricultural and Food Chemistry,2020,68(44):12 259-12 270.
[11] 叶盛旺, 杨最素,李维,等.青蛤酶解多肽对RAW 264.7巨噬细胞的免疫调节作用[J].食品科学,2019,40(7):185-191.
YE S W,YANG Z S,LI W,et al.Immunomodulatory effects of peptides from enzymatic hydrolysate of Cyclina sinensis on RAW264.7 macrophages[J].Food Science,2019,40(7):185-191.
[12] LI W,YE S,ZHANG Z,et al.Purification and characterization of a novel Pentadecapeptide from protein hydrolysates of Cyclina sinensis and its immunomodulatory effects on RAW264.7 Cells[J].Marine Drugs,2019,17(1):30.
[13] SANTIAGO-L PEZ L,HERN
PEZ L,HERN NDEZ-MENDOZA A,VALLEJO-CORDOBA B,et al.Food-derived immunomodulatory peptides[J].Journal of the Science of Food and Agriculture,2016,96(11):3 631-3 641.
NDEZ-MENDOZA A,VALLEJO-CORDOBA B,et al.Food-derived immunomodulatory peptides[J].Journal of the Science of Food and Agriculture,2016,96(11):3 631-3 641.
[14] XU Z,MAO T M,HUANG L,et al.Purification and identification immunomodulatory peptide from rice protein hydrolysates[J].Food and Agricultural Immunology,2019,30(1):150-162.
[15] 邓志程. 马氏珠母贝全脏器免疫活性肽的制备及其免疫活性的研究[D].广州:广东海洋大学,2015.
DENG Z C.Study on the preparation of Pinctada martensi immunomodulating peptide and its immunity function[D].Guangzhou:Guangdong Ocean University,2015.
[16] 石红岭. 林蛙油免疫活性肽的制备及体外活性研究[D].长春:吉林大学,2020.
SHI H L.Preparation and bioactivity of immunopeptide in vitro from oviductus ranae[D].Changchun:Jilin University,2020
[17] CIAN R E,L PEZ-POSADAS R,DRAGO S R,et al.A Porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB,and p38 and JNK dependent mechanism[J].Food Chemistry,2012,134(4):1 982-1 990.
PEZ-POSADAS R,DRAGO S R,et al.A Porphyra columbina hydrolysate upregulates IL-10 production in rat macrophages and lymphocytes through an NF-κB,and p38 and JNK dependent mechanism[J].Food Chemistry,2012,134(4):1 982-1 990.
[18] HE P,WANG Q,ZHAN Q P,et al.Purification and characterization of immunomodulatory peptides from enzymatic hydrolysates of duck egg ovalbumin[J].Food & Function,2021,12(2):668-681.
[19] PARKER F,MIGLIORE-SAMOUR D,FLOCH F.et al.Immunostimulating hexapeptide from human casein:amino acid sequence,synthesis and biological properties[J].European Journal of Biochemistry,1984,145(3):677-682.
[20] FAJARDO-ESPINOZA F S,ORDAZ-PICHARDO C,SANKAR U,et al.In vitro cytomodulatory and immunomodulatory effects of bovine colostrum whey protein hydrolysates[J].International Journal of Food Science and Technology,2021,56(5):2 109-2 121.
[21] ACOSTA J,ROA F,GONZ LEZ-CHAVARR
LEZ-CHAVARR A I,et al.In vitro immunomodulatory activities of peptides derived from Salmo salar NK-lysin and cathelicidin in fish cells[J].Fish & Shellfish Immunology,2019,88:587-594.
A I,et al.In vitro immunomodulatory activities of peptides derived from Salmo salar NK-lysin and cathelicidin in fish cells[J].Fish & Shellfish Immunology,2019,88:587-594.
[22] LI Z Y,ZHAO S,XIN X D,et al.Purification and characterization of a novel immunomodulatory hexapeptide from alcalase hydrolysate of ultramicro-pretreated silkworm(Bombyx mori) pupa protein[J].Journal of Asia-Pacific Entomology,2019,22(3):633-637.
[23] FANG Y,PAN X,ZHAO E M,et al.Isolation and identification of immunomodulatory selenium-containing peptides from selenium-enriched rice protein hydrolysates[J].Food Chemistry,2019,275:696-702.
[24] WU W J,SUN C Z,WANG G,et al.Immunomodulatory activities of non-prolamin proteins in wheat germ and gluten[J].Journal of Cereal Science,2017,76:206-214.
[25] CRUZ-CHAMORRO I, LVAREZ-S
LVAREZ-S NCHEZ N,SANTOS-S
NCHEZ N,SANTOS-S NC-HEZ G,et al.Immunomodulatory and antioxidant properties of wheat gluten protein hydrolysates in human peripheral blood mononuclear cells[J].Nutrients,2020,12(6):1673.
NC-HEZ G,et al.Immunomodulatory and antioxidant properties of wheat gluten protein hydrolysates in human peripheral blood mononuclear cells[J].Nutrients,2020,12(6):1673.
[26] ASHAOLU T J,YANTIAM N,YUPANQUI C T.Immunomodulatory effects of pepsin-educed soy protein hydrolysate in rats and murine cells[J].Functional Foods in Health and Disease,2017,7(11):889-900.
[27] GAO Y,ZHANG X,REN G,et al.Peptides from extruded lupin(Lupinus albus L.) regulate inflammatory activity via the p38 MAPK signal transduction pathway in RAW 264.7 cells[J].Journal of Agricultural and Food Chemistry,2020,68(42):11 702-11 709.
[28] CRUZ-CHAMORRO I, LVAREZ-S
LVAREZ-S NCHEZ N,MILL
NCHEZ N,MILL N-LINARES M D C,et al.Lupine protein hydrolysates decrease the inflammatory response and improve the oxidative status in human peripheral lymphocytes[J].Food Research International(Ottawa,Ont.),2019,126:108585.
N-LINARES M D C,et al.Lupine protein hydrolysates decrease the inflammatory response and improve the oxidative status in human peripheral lymphocytes[J].Food Research International(Ottawa,Ont.),2019,126:108585.
[29] CIAN R E,HERN NDEZ-CHIRLAQUE C,G
NDEZ-CHIRLAQUE C,G MEZ-BELMONTE R,et al.Green Alga ulva spp.hydrolysates and their peptide fractions regulate cytokine production in splenic macrophages and lymphocytes involving the TLR4-NFκB/MAPK pathways[J].Marine drugs,2018,16(7):235.
MEZ-BELMONTE R,et al.Green Alga ulva spp.hydrolysates and their peptide fractions regulate cytokine production in splenic macrophages and lymphocytes involving the TLR4-NFκB/MAPK pathways[J].Marine drugs,2018,16(7):235.
[30] HAYES M.Food proteins and bioactive peptides:New and novel sources,characterisation strategies and applications[J].Foods,2018,7(3):38.
[31] WU W J,ZHANG M M,REN Y,et al.Characterization and immunomodulatory activity of a novel peptide,ECFSTA,from wheat germ globulin[J].Journal of Agricultural and Food Chemistry,2017,65(27):5 561-5 569.
[32] ZHANG Z W,HU X Y,LIN L,et al.Immunomodulatory activity of low molecular-weight peptides from Nibea japonica in RAW264.7 cells via NF-κB pathway[J].Marine Drugs,2019,17(7):404.
[33] ALVES T O,D’ALMEIDA C T S,SCHERF K A,et al.Modern approaches in the identification and quantification of immunogenic peptides in cereals by LC-MS/MS[J].Frontiers in Plant Science,2019,10:1470.
[34] TU M L,CHENG S Z,LU W H,et al.Advancement and prospects of bioinformatics analysis for studying bioactive peptides from food-derived protein:Sequence,structure,and functions[J].TrAC Trends in Analytical Chemistry,2018,105:7-17.
[35] MULLAISELVAN I,KANAGARAJ V,SEKAR S,et al.Studies on immunomodulatory effect of casein phospho peptide isolated from cultured dairy product[J].International Research Journal of Pure and Applied Chemistry,2020,21(23):28-40.
[36] ADAMS C,SAWH F,GREEN-JOHNSON J M,et al.Characterization of casein-derived peptide bioactivity:Differential effects on angiotensin-converting enzyme inhibition and cytokine and nitric oxide production[J].Journal of Dairy Science,2020,103(7):5 805-5 815.
[37] KIEWIET M B G,DEKKERS R,GROS M,et al.Toll-like receptor mediated activation is possibly involved in immunoregulating properties of cow’s milk hydrolysates[J].PLoS One,2017,12(6):e0178191.
[38] MERAM C,WU J P.Anti-inflammatory effects of egg yolk livetins(α,β,and γ-livetin) fraction and its enzymatic hydrolysates in lipopolysaccharide-induced RAW 264.7 macrophages[J].Food Research International(Ottawa,Ont.),2017,100(Pt 1):449-459.
[39] LEE J H,PAIK H D.Anticancer and immunomodulatory activity of egg proteins and peptides:A review[J].Poultry Science,2019,98(12):6 505-6 516.
[40] YU W L,FIELD C J,WU J P.Purification and identification of anti-inflammatory peptides from spent hen muscle proteins hydrolysate[J].Food Chemistry,2018,253:101-107.
[41] LI Q Q,WANG S K,POUNGCHAWANWONG S,et al.Effect of peptides from Alaska pollock on intestinal mucosal immunity function and purification of active fragments[J].Nutrients,2019,11(10):2 517.
[42] CAI J Y,LI X,WANG X,et al.A human β-casein-derived peptide BCCY-1 modulates the innate immune response[J].Food Chemistry,2021,348(30):129111.
[43] LI Z Y,ZHAO S,XIN X D,et al.Purification,identification and functional analysis of a novel immunomodulatory peptide from silkworm pupa protein[J].International Journal of Peptide Research and Therapeutics,2020,26(1):243-249.
[44] CAO H,CAO J F,ZHANG Y J,et al.Continuous preparation and characterization of immunomodulatory peptides from type II collagen by a novel immobilized enzyme membrane reactor with improved performance[J].Journal of Food Biochemistry,2019,43(7):e12862.
[45] 頡宇, 胡锦灵,赵宏飞,等.基于生物信息学定向制备柠条籽蛋白抗氧化肽的工艺优化[J].食品科学,2020,41(20):278-284.
JIE Y,HU J L,ZHAO H F,et al.Optimization of bioinformatics-based directional preparation of antioxidant peptide from Caragana seed protein[J].Shipin Kexue/Food Science,2020,41(20):278-284.
[46] ![]() P,W
P,W JCIAK K M,STADNIK J.Bioactive peptides from beef products fermented by acid whey-in vitro and in silico study[J].Scientia Agricola,2019,76(4):311-320.
JCIAK K M,STADNIK J.Bioactive peptides from beef products fermented by acid whey-in vitro and in silico study[J].Scientia Agricola,2019,76(4):311-320.