白酒是我国国酒,因风味特征差异而分为不同香型,其中具有独特风格的浓香型白酒深受消费者的喜爱,其饮用量和销售量在众多香型白酒中独占鳌头[1]。在影响浓香型白酒独特风格的众多风味物质中,具有甜香、水果香、窖香和青瓜香的己酸乙酯是浓香型白酒的主要特征风味物质,其含量的高低直接决定了浓香型白酒的品质[2-3]。然而,对浓香型白酒品质如此重要的风味物质,在传统酿造发酵过程中,含量却往往达不到高品质浓香型白酒的要求,造成浓香型白酒优质品率低;另外,白酒生产过程中丰富度较高的乳酸菌会产生过多的乳酸,从而生成过量的乳酸乙酯,造成乳酸乙酯和己酸乙酯比例的严重失调,加剧了浓香型白酒品质的下降[4]。因此,在浓香型白酒酿造过程中,如何提高己酸乙酯含量是稳定和提高浓香型白酒品质需解决的首要问题。
产香酵母是一类能够代谢生成酯类化合物的非酿酒酵母菌的总称,又称生香酵母,该类酵母能够利用葡萄糖等糖源代谢产生乙酸乙酯、乙酸苯乙酯、乙酸异戊酯等,在白酒酿造过程中起到非常重要的提酯增香作用[3]。将扣囊覆膜酵母和酿酒酵母共强化应用于小曲白酒酿造生产中,相比对照组,乙醇和酯的含量都有明显的提高,增强了酒体风味[5];将产香酵母长孢洛德酵母Z9Y-91强化于复糟酒生产中,相比对照组,乙酸乙酯、己酸乙酯、乙酸异戊酯、己酸异戊酯等风味酯含量上升,复糟酒感官指标得到提高[6];应用2株不同异常威克汉姆酵母对白酒固态模拟进行强化研究,结果表明2株酵母都不同程度的提高了酒糟中的风味酯含量[7]。由此可见,产香酵母是白酒酿造中品质提升的重要功能菌株。在众多产香酵母合成酯类相关研究中,有关高产乙酸乙酯的研究较多,而有关白酒4大酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)中其他3种酯的研究较少。鉴于己酸乙酯对浓香型白酒的重要性,筛选分离获得高产己酸乙酯的产香酵母不失为提高浓香型白酒酿造中己酸乙酯含量的有效途径之一,研究和选育高产己酸乙酯产香酵母菌株具有重要的现实意义。为此,本文采用传统筛选方法获取高产己酸乙酯的酵母菌株,并对其进行鉴定和发酵条件优化,为提高浓香型白酒品质提供理论基础。
1 材料与方法
1.1 菌株与试剂
大曲,泸州老窖股份有限公司、山东扳倒井股份有限公司、安徽古井贡酒股份有限公司、河北衡水老白干酒业股份有限公司等。
酵母基因组DNA提取试剂盒,北京索莱宝科技有限公司;己酸乙酯,Sigma公司;色谱级纯正庚烷,麦克林公司;耐高温淀粉酶、糖化酶,上海源叶生物科技有限公司;高粱,产自山东临沂地区;其他试剂均为国产生物或分析纯试剂。
YPD液体培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,自然pH,121 ℃条件下灭菌20 min;YPD固体培养基为在液体培养基基础上添加20 g/L的琼脂粉。
高粱酶解液参考FAN等[3]的方法:250 g高粱粉碎后,加入1 L蒸馏水,糊化后,利用耐高温淀粉酶(200 μL)于90 ℃下液化1 h,冷却至60 ℃,加入糖化酶(0.125 g)糖化2 h。随后,趁热过滤,并室温离心10 min,离心转速为10 000 r/min,上清液糖度调至8 °Brix后分装于三角瓶中(30 mL/250 mL),115 ℃灭菌20 min。
1.2 仪器和设备
YQX-SG46-280S高压蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;DL-CJ-2 ND I型生物洁净工作台,北京东联哈尔仪器制造有限公司;BL-2200H电子天平,岛津国际贸易(上海)有限公司;PHS-3C型 pH计,上海精密科学仪器有限公司;TENSUC恒温摇床,上海天呈实验仪器制造有限公司;LHS-100CL恒温恒湿培养箱,上海一恒科学仪器有限公司;TU-19紫外-可见分光光度计,北京普析通用仪器有限责任公司;CKX41-F32FL倒置荧光显微镜,日本OLYMPUS公司;Microfuge 2R离心机,北京田林恒泰科技有限公司;Tprofessional型 PCR仪,Biometra公司;TSQTM8000 evo三重四级杆气质联用仪,美国Thermo Fisher Scientific。
1.3 实验方法
1.3.1 酵母菌株的筛选和分离
酵母菌株的筛选和分离方法参照FAN等[3]的方法,将逐级稀释的不同浓度的大曲菌悬液,涂布于YPD固体培养基平板上,28 ℃倒置培养,挑取疑似酵母菌落进行划线分离后采用显微镜观察和确定。
1.3.2 高产己酸乙酯酵母菌株的筛选
将上述筛选得到的酵母分别接种于YPD液体培养基中活化24 h,以0.3%(体积分数)的接种量接入高粱酶解液培养基中,于28 ℃,180 r/min培养24 h(第1阶段-细胞积累阶段),然后加入4%(体积分数)的无水乙醇和0.04%(体积分数)的正己酸,继续发酵36 h(第2阶段-合成己酸乙酯阶段),发酵液于室温下离心(10 000 r/min,10 min),获得的上清液进行己酸乙酯含量的测定,测定方法采用GC-MS方法。
1.3.3 菌株Y9鉴定
采用菌落形态、显微镜观察、生理生化结合分子生物学技术对筛选获得的高产己酸乙酯酵母Y9进行鉴定,具体方法参照FAN等[3]的方法。
1.3.4 菌株Y9生物学特性
参照文献[3]的方法考察酵母Y9的最适生长温度和生长温度耐受性(20、25、30、35、40、45、50 ℃)、最适生长pH和生长pH耐受性(1、2、3、4、5、6、7、8、9、10、11、12)、葡萄糖耐受性(100、200、300、400、500、600、700、800、900 g/L)、NaCl耐受性(0、50、100、150、200、250、300 g/L)、己酸耐受性(体积分数0%、0.02%、0.04%、0.06%、0.08%、0.10%、0.12%)、乙醇耐受性(体积分数0%、2%、4%、6%、8%、10%、12%、14%、16%、18%、20%)和己酸乙酯耐受性(0、300、600、900、1 200、1 500和1 800 mg/L)。
1.3.5 菌株合成己酸乙酯条件优化
将酵母Y9接种于YPD液体培养基中于28 ℃活化培养24 h,按照0.3%(体积分数)接种量接种于高粱酶解液培养基中,28 ℃,180 r/min培养24 h,完成第1阶段细胞的积累,然后加入4%乙醇和0.04%(体积分数)己酸,继续培养,完成第2阶段己酸乙酯的合成。采用单因素考察培养基条件(糖度和pH)及其第2阶段发酵条件(温度、转速、接种量、乙醇添加量、己酸添加量、前体添加时机和发酵时间)对酵母合成己酸乙酯的影响。
1.3.6 己酸乙酯含量测定
发酵液中己酸乙酯含量采用GC-MS进行检测。发酵液离心后取3 mL加入到装有3 mL正庚烷的试管中,充分混匀后静置萃取2 min,取有机相部分于5 mL离心管中,加入适量无水硫酸钠除去痕量水,用有机滤膜过滤后采用GC-MS测定己酸乙酯含量,毛细管色谱柱为DB-WAX(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;分流比37:1;采用程序升温(50 ℃,保留2 min,以10 ℃/min速率升至180 ℃,保留2 min,再以6 ℃/min速率升至230 ℃,保留2 min);检测器温度250 ℃;载气为He,流速1 mL/min;EI电离源,电子能量70 eV;扫描范围50~350 amu;离子源温度250 ℃;接口温度250 ℃。
己酸乙酯标准曲线的绘制采用外标法,准确称取0.086 9 g己酸乙酯纯品,用正庚烷定容至100 mL,分别将其稀释至50、100、200、400、800倍,经GC-MS检测其峰面积,以己酸乙酯含量为X轴,峰面积为Y轴,绘制己酸乙酯标准曲线。
1.3.7 数据分析
每组试验进行3个平行,利用Excel 2020处理试验数据并绘制图表,采用IBM SPSS Statistics R24.0.0.0进行试验组间的差异显著性分析。
2 结果与讨论
2.1 高产己酸乙酯酵母菌株的筛选
通过传统分离筛选方法从不同酒厂来源的酒曲中筛选获得79株酵母,按照方法1.3.2进行发酵,发酵结束后测定其合成己酸乙酯含量,结果表明有37株酵母菌具有合成己酸乙酯的能力(图1)。但相比产香酵母合成乙酸乙酯的含量(为g/L的水平),酵母合成己酸乙酯的含量都较低,为mg/L的水平,这可能是目前很多浓香型白酒中己酸乙酯与乙酸乙酯含量比降低的原因之一[8]。在产己酸乙酯酵母中,多半产量极低,不足1.0 mg/L,仅有3株酵母产量超过3.0 mg/L,分别为酵母Y1、Y9和Y14,产量分别为3.72、4.15、3.31 mg/L;通过对3株菌株重复验证发现,酵母Y9合成己酸乙酯含量明显高于其他2株酵母,为此,将酵母Y9确定为本研究的目标菌株。
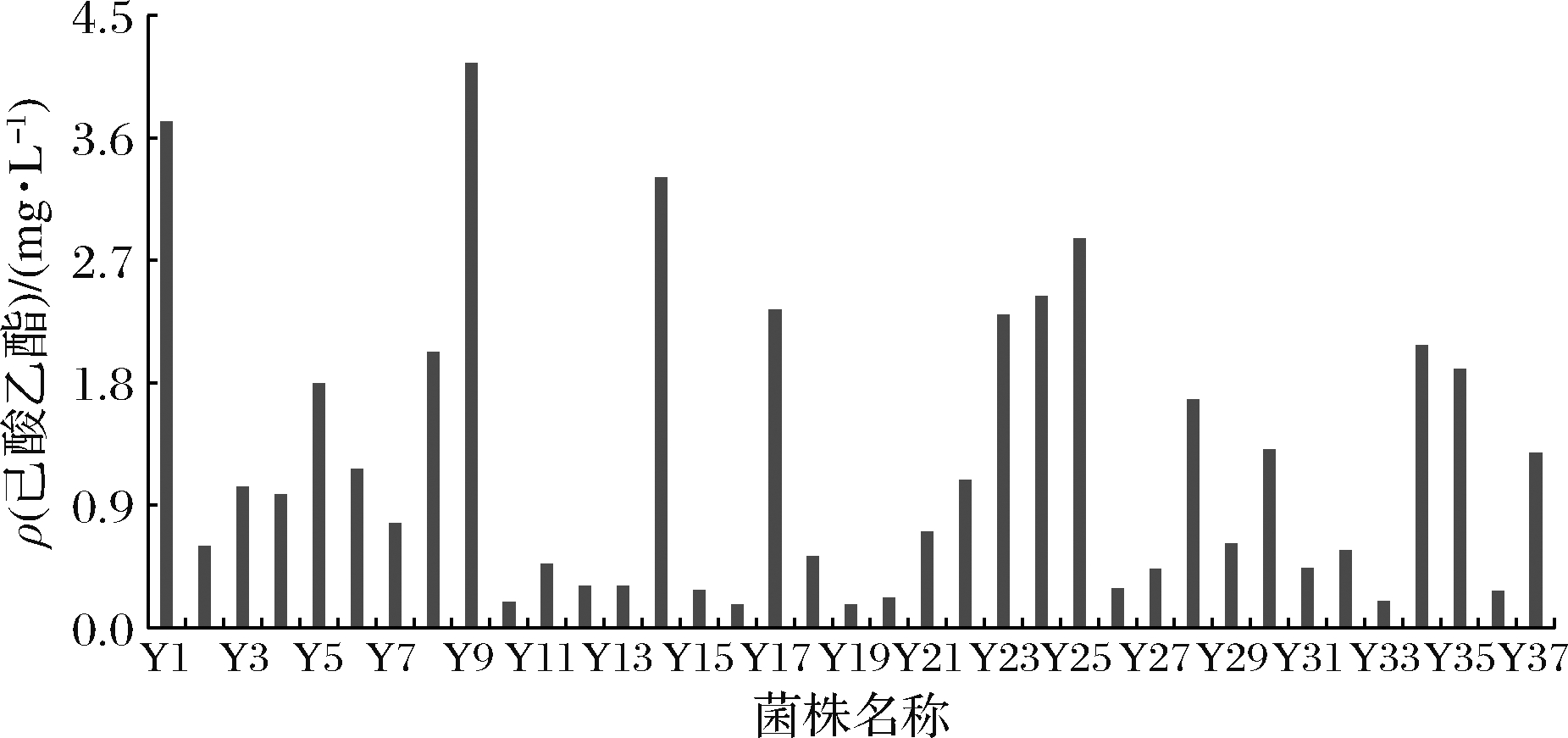
图1 不同酵母发酵液中己酸乙酯含量
Fig.1 The yield of ethyl caproate by different yeasts
2.2 酵母Y9的鉴定
2.2.1 酵母Y9形态特征
菌株Y9在YPD固体培养基上长势良好,菌落乳白色、突起、圆形,表面粗糙干燥、不透明,内部湿润易挑起(图2-a);显微镜下细胞形态特征如图2-b所示,细胞为椭圆形,一端芽殖(图2-b中椭圆标记),属酵母的典型特征,另外,还观察到假菌丝,由此可见,菌株Y9为酵母菌。

a-YPD培养基上菌落形态;b-显微镜下细胞形态
图2 酵母Y9在YPD培养基上菌落形态特征及显微镜下 细胞形态特征(10×100)
Fig.2 Colony morphology of yeast Y9 on YPD culture medium and cell morphology of yeast Y9 captured by microscope(10×100) 注:b图中椭圆圈出为出芽状态
2.2.2 生理生化
从表1可知,酵母Y9能利用葡萄糖、蔗糖、麦芽糖和半乳糖发酵产酸产气,利用木糖和纤维二糖只产气不产酸,而不能利用阿拉伯糖、可溶性淀粉和乳糖产酸或产气。该酵母碳源同化表明,其能很好的适应环境,在所试的16种碳源中均有不同程度的生长,但生长状态有所差异,主要表现为生长部位不同,这可能是由于该酵母利用不同碳源的代谢途径不同,有些碳源,如甘露醇、山梨醇、乙醇、海藻糖、柠檬酸、葡萄糖、乳糖等主要通过厌氧途径,因此菌体主要集中于液体底部,而山梨糖、鼠李糖、蔗糖、木糖、阿拉伯糖、可溶性淀粉、麦芽糖、半乳糖和纤维二糖既可通过厌氧途径也可通过有氧途径进行同化利用,由此可见,酵母Y9为兼性厌氧微生物。酵母Y9氮源同化结果表明,其能利用KNO3、(NH4)SO4、L-苯丙氨酸和尿素,而不能利用NH4NO2,并且类似碳源同化,利用不同氮源的生长代谢途径有所不同,利用L-苯丙氨酸主要通过厌氧途径,而其他3种氮源2种途径(厌氧和有氧)都可以。在其他生理生化试验中,则只有吲哚试验、淀粉水解试验和尿素试验为阳性反应,其他都为阴性反应,对比《酵母菌的特征与鉴定手册》并结合形态学观察实验结果,酵母Y9与Hyphopichia burtonii的形态特征和生理生化最为相似。
2.2.3 酵母Y9分子生物学鉴定
酵母Y9的26S rDNA D1/D2序列与Komagataella pastoris M13-2-1-13的26S rDNA序列同源性最高,相似度达到99.44%。采用Neighbor-Joining方法对该菌株及其序列相似度较高的菌株构建系统发育树(图3)。结果表明该酵母与Hyphopichia burtonii strain FBKL2.8018的亲缘关系最近。综合形态学、生理生化及分子生物学26S rDNA D1/D2测序试验结果,酵母Y9被鉴定为Hyphopichia burtonii。
表1 酵母Y9的生理生化
Table 1 Physiological and biochemical characteristics of strain Y9

生化分析结果生化分析结果糖源同化木糖液面上部和底部都生长糖源发酵葡萄糖产酸,产气山梨糖液面上部和底部都生长蔗糖产酸,产气山梨醇底部生长木糖不产酸,产气麦芽糖液面上部和底部都生长阿拉伯糖不产酸,不产气海藻糖底部生长麦芽糖产酸,产气鼠李糖液面上部和底部都生长可溶性淀粉不产酸,不产气柠檬酸底部生长半乳糖产酸,产气葡萄糖底部生长乳糖不产酸,不产气蔗糖液面上部和底部都生长纤维二糖不产酸,产气甘露醇底部生长其他试验吲哚试验阳性反应阿拉伯糖液面上部和底部都生长石蕊牛乳试验阴性反应可溶性淀粉液面上部和底部都生长甲基红试验阴性反应乙醇底部生长柠檬酸盐试验阴性反应半乳糖液面上部和底部都生长伏-普(vopp experiment,V.P.)试验阴性反应乳糖底部生长淀粉试验阳性反应纤维二糖液面上部和底部都生长尿素试验阳性反应氮源同化NH4NO2不生长明胶水解试验阴性反应(NH4)2SO4液面上部和底部都生长L-苯丙氨酸底部生长尿素液面上部和底部都生长KNO3液面上部和底部都生长

图3 酵母Y9基于26S rDNA D1/D2序列及Neighbor-Joining 法构建的系统发育树
Fig.3 Phylogenetic tree of yeast strain Y9 using Neighbor-Joining analysis based on the 26S rDNA D1/D2
2.3 特性
白酒酿造环境比较复杂,只有较强环境适应的微生物才能在白酒酿造过程中发挥更好的功能,为此,考察了酵母Y9的生物学特性。结果表明,ρ(NaCl)<150 g/L时,酵母Y9能生长,而当ρ(NaCl)≥200 g/L时,酵母Y9不能生长;酵母Y9具有较好的葡萄糖耐受性,在ρ(葡萄糖)>900 g/L时仍具有生长能力;酵母Y9的最适生长温度为25 ℃,最高耐受温度为40 ℃,在20~35 ℃生长旺盛;其最适生长pH为7,具有较宽广的pH适应性,在pH 2~12都能生长,尤其是在pH 3~10生长旺盛;Y9在乙醇体积分数为8%时能生长,属中等水平乙醇耐受性菌株[9];酵母Y9对己酸耐受性较低,在己酸体积分数高于0.04%时生长几乎停滞,但其具有较高的己酸乙酯耐受性,最高质量浓度为900 mg/L。这些特性表明酵母Y9在白酒酿造中具有一定的应用潜力。
2.4 单因素试验
2.4.1 温度对酵母Y9产己酸乙酯的影响
温度是调控微生物生长和代谢活性的关键因素,不同微生物其生长温度和代谢合成产物的最适温度会有所差异[10]。实验表明,酵母Y9合成己酸乙酯的浓度随温度的升高先增加后下降,在22~25 ℃时,其合成己酸乙酯浓度达到最高,为4.3~4.5 mg/L,这与其最适生长温度范围基本一致,表明其己酸乙酯合成与细胞增长具有一定的正相关(结果未列出),此时的温度有利于酵母细胞的生长繁殖和代谢合成己酸乙酯相关酶的活力;温度继续增高,其生长与代谢合成己酸乙酯相关的酶活力受到影响,从而引起己酸乙酯浓度降低。
2.4.2 转速对酵母Y9产己酸乙酯的影响
由生理生化结果可知,Y9在不同糖源条件下,代谢途径有所差异,表现为需氧量不同(表1),即溶氧量会影响Y9发酵代谢途径及其对应的发酵产物。实验结果表明,随着摇瓶转速的提高,酵母Y9合成己酸乙酯的浓度呈现下降趋势,即溶氧量的增加会抑制其己酸乙酯的合成,这可能是由于含氧量高会加剧乙醇和己酸对细胞的毒害作用或影响己酸乙酯合成相关酶的表达,继而导致己酸乙酯的合成降低(结果未列出)[11-12]。在静置培养方式下,酵母Y9合成己酸乙酯的量最高,达到6.2 mg/L。传统固态浓香型白酒的酿造是在密封的窖池中进行的,随着酿造时间的延长,酿造环境逐渐由有氧向微氧、极微氧或厌氧环境转变,是一个相对缺氧的环境,而酵母Y9的这一特性有助其应用于传统固态发酵浓香型白酒中。
2.4.3 乙醇添加量对酵母Y9产己酸乙酯的影响
乙醇是酵母合成己酸乙酯的重要前体物质之一,也是影响细胞生长和代谢的重要化学物质,因此,乙醇含量对酵母合成己酸乙酯具有重要的影响[3]。由图4可知,随着乙醇浓度的增加,Y9合成己酸乙酯的量呈现先增加后降低的趋势,其中在乙醇体积分数为8%时,其合成己酸乙酯的量达到最高,为9.1 mg/L。当乙醇较少时,前体物质不足会影响酵母Y9合成己酸乙酯,尤其是在未添加乙醇时,发酵液中未检测到己酸乙酯,与有乙醇存在情况比较,可以充分表明,乙醇对于酵母Y9合成己酸乙酯具有重要作用;当乙醇含量较高时则会对酵母Y9细胞产生毒害作用,影响其生长和代谢活动,导致其催化乙醇和己酸合成己酸乙酯的活力降低。由此可见,适量的乙醇添加量有助于酵母合成己酸乙酯。与本研究一致,酿酒酵母Y3401合成己酸乙酯的最适乙醇体积分数也为8%[13]。但两者在未添加乙醇时存在一定差异,这是由于酿酒酵母Y3401能利用高粱酶解液产生少量乙醇,自身提供了合成己酸乙酯的前体,而酵母Y9在高粱酶解液中合成乙醇量极低,在没有外加乙醇时,很难检测到己酸乙酯的合成[13]。
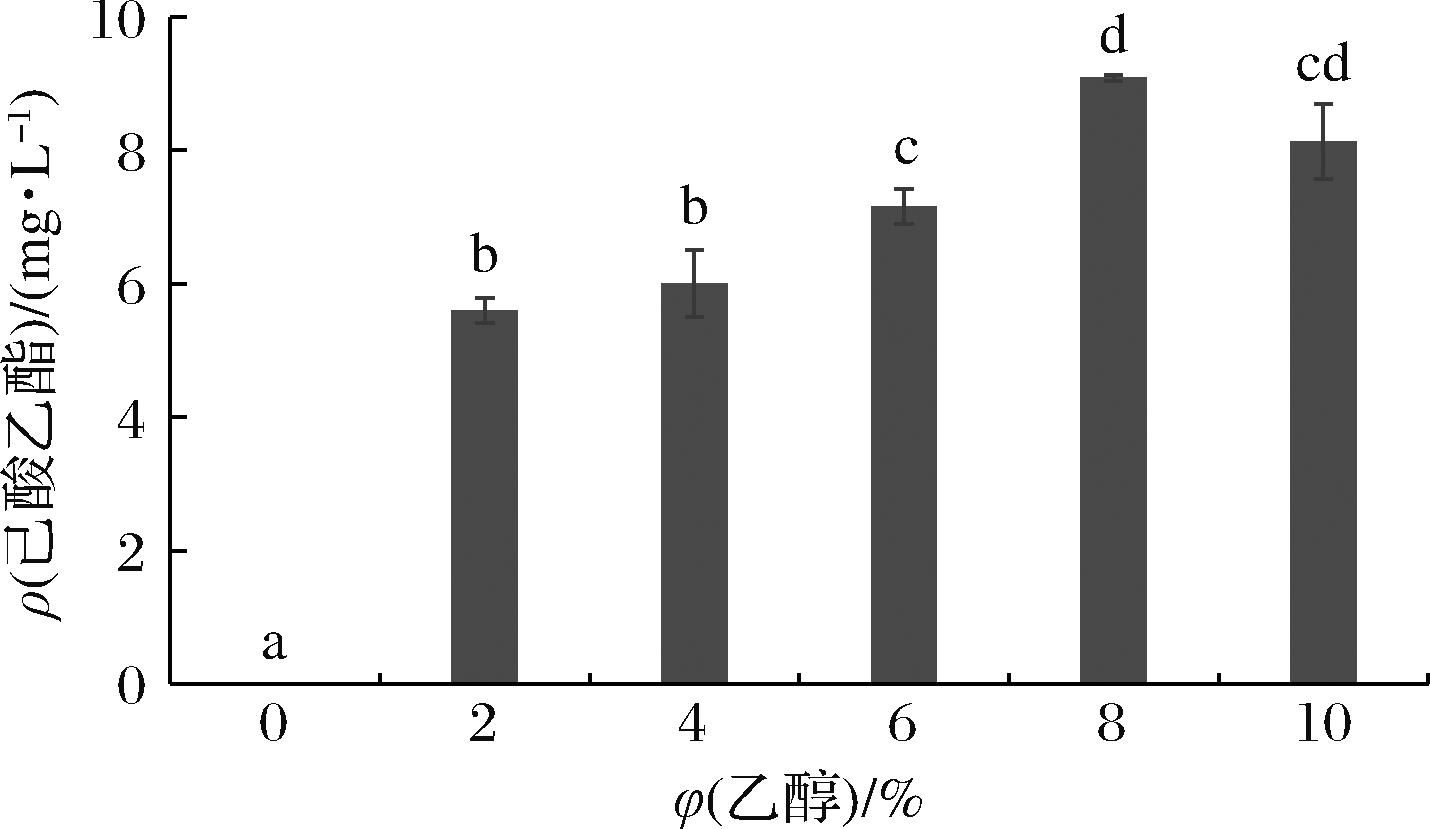
图4 乙醇添加量对酵母Y9产己酸乙酯的影响
Fig.4 Effect of ethanol content on the ethyl caproate production by yeast Y9 注:含有相同的字母表示采用Tukey test检验时组间 没有显著差异(P>0.05)(下同)
2.4.4 己酸添加量对酵母Y3401产己酸乙酯的影响
己酸是酵母合成己酸乙酯的另一重要前体,其对酵母合成己酸乙酯的影响与乙醇类似,因此,需要对其添加量进行考察[14]。如图5所示,添加适量的己酸有助于酵母Y9合成己酸乙酯,在己酸体积分数为0.04%~0.08%时,其所产己酸乙酯较高,为8.5~9.2 mg/L;当己酸体积分数低于0.04%时,前体物质含量不足,酵母Y9合成己酸乙酯的量较低,尤其是在无己酸时,发酵液中未检测到己酸乙酯,这足以证实己酸是酵母合成己酸乙酯的重要前体;当己酸添加量较高时,酵母细胞受到损伤,细胞活性降低,导致细胞合成己酸乙酯能力下降,这与酵母Y3401合成己酸乙酯的趋势类似[13]。值得注意的是,酵母Y9合成己酸乙酯最佳己酸添加量稍高于其己酸耐受的浓度,这可能是由于酵母经过第一阶段的培养,细胞生物量已达到较高浓度,此时加入己酸,高浓度的酵母细胞会快速将高毒性的己酸转化为毒性较低的己酸乙酯,从而减轻己酸对酵母生长代谢的影响,另外,加入己酸后培养温度的降低及溶氧量的减小,也在一定程度上缓解己酸对酵母的毒害作用。
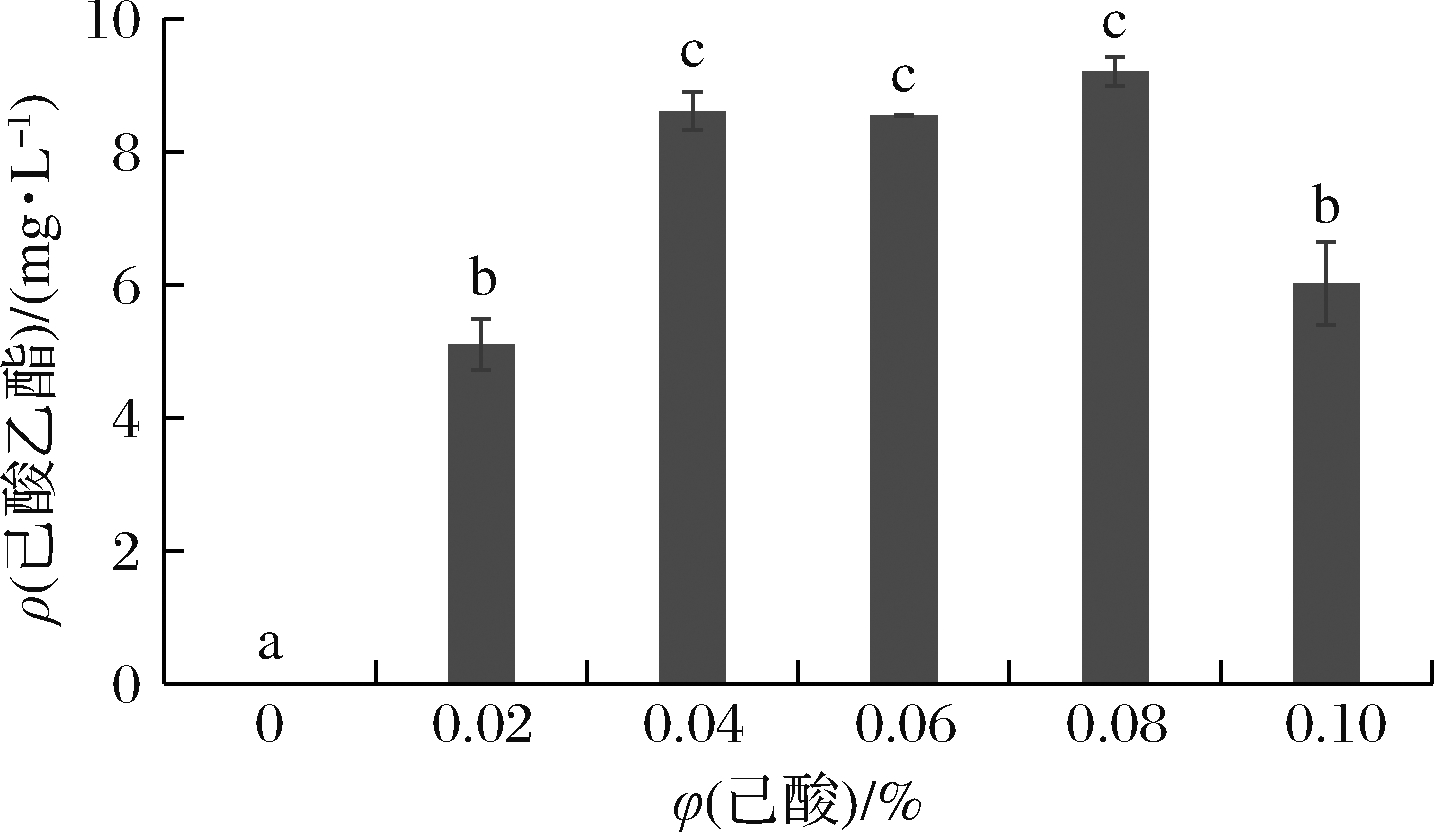
图5 己酸添加量对酵母Y9产己酸乙酯的影响
Fig.5 Effect of caproic acid content on the ethyl caproate production by yeast Y9
2.4.5 高粱酶解液糖度对酵母Y9产己酸乙酯的影响
鉴于酵母Y9主要用于提高浓香型白酒中己酸乙酯的含量,因此,本研究采用其酿造主要原料高粱的酶解液为发酵培养基探究其合成己酸乙酯能力。结果表明,随着高粱酶解液糖度的增加,酵母Y9合成己酸乙酯的浓度不断增加,在糖度为14 °Brix时(酶解高粱所得最高糖度)合成己酸乙酯浓度最高,为12.9 mg/L,这与酵母Y3401类似(结果未列出)[13]。当高粱酶解液中糖度较低时,酵母生长繁殖所需碳水化合物含量不足,影响其所产己酸乙酯含量,随糖度的增加,酵母生长繁殖所需能源得到补充,代谢活动变得活跃,促进了己酸乙酯的合成。酵母Y9具有较高的糖耐受性及渗透压耐受性,能适应较高糖度的培养基,因此,较高糖度的高粱酶解液因含有充足的碳源而有利于酵母Y9合成己酸乙酯。不同酵母对糖的耐受性不同,因此,其代谢合成酯类化合物所需糖度存在一定差异。如异常威克汉姆酵母Y3604合成乙酸乙酯所需高粱酶解液最佳糖度为8 °Brix,而异常毕赤酵母Y2合成乙酸乙酯最佳高粱酶解液糖度为12 °Brix[3,15]。
2.4.6 高粱酶解液pH对酵母Y9产己酸乙酯的影响
pH是调控酵母发酵的一个重要参数,不仅影响酵母代谢相关酶活力,而且对培养基中营养物质的状态产生影响,从而影响酵母对营养物质的吸收和利用,影响其生长和代谢[16]。基于白酒酿造环境偏酸性,因此,我们主要考察酸性条件下酵母Y9合成己酸乙酯的能力。由图6可知,随着初始pH的升高,酵母Y9合成己酸乙酯的浓度呈现增加趋势,在pH 5~7时合成己酸乙酯含量最高,这与其生长pH一致,这可能是pH主要通过影响酵母第一阶段细胞的积累来调控其己酸乙酯的合成,即酵母Y9的生物量与己酸乙酯合成量之间存在正相关,这与温度类似。
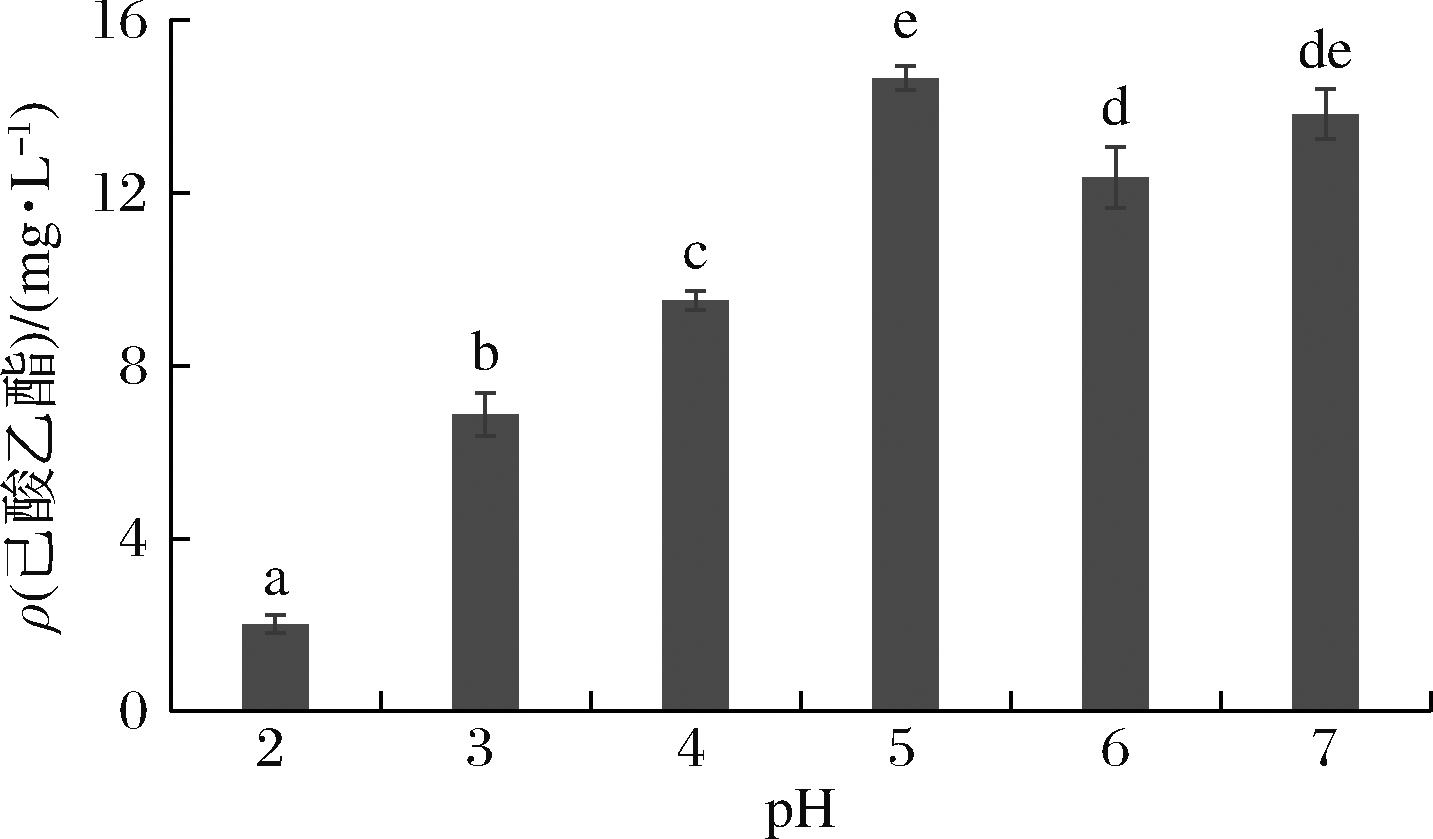
图6 高粱浸出液pH对酵母Y9产己酸乙酯的影响
Fig.6 Effect of pH of sorghum extract on ethyl caproate production by yeast Y9
2.4.7 发酵时间对酵母Y9产己酸乙酯的影响
由图7可知,在未添加前体物质乙醇和己酸时,酵母Y9不能合成己酸乙酯,这与前面结果一致;加入2种前体后,酵母Y9则快速合成己酸乙酯,尤其是在诱导阶段的12 h内,能快速将对细胞毒害作用大的己酸转化为己酸乙酯,此阶段己酸乙酯的合成量达到最高质量浓度的79%以上,而后合成速率有所降低,在发酵时间为48~60 h时达到最高,为14.6~15.0 mg/L,继续延长发酵,己酸乙酯含量有所降低,可能是酵母Y9合成己酸乙酯的速率低于将其转化为其他化合物的速率。
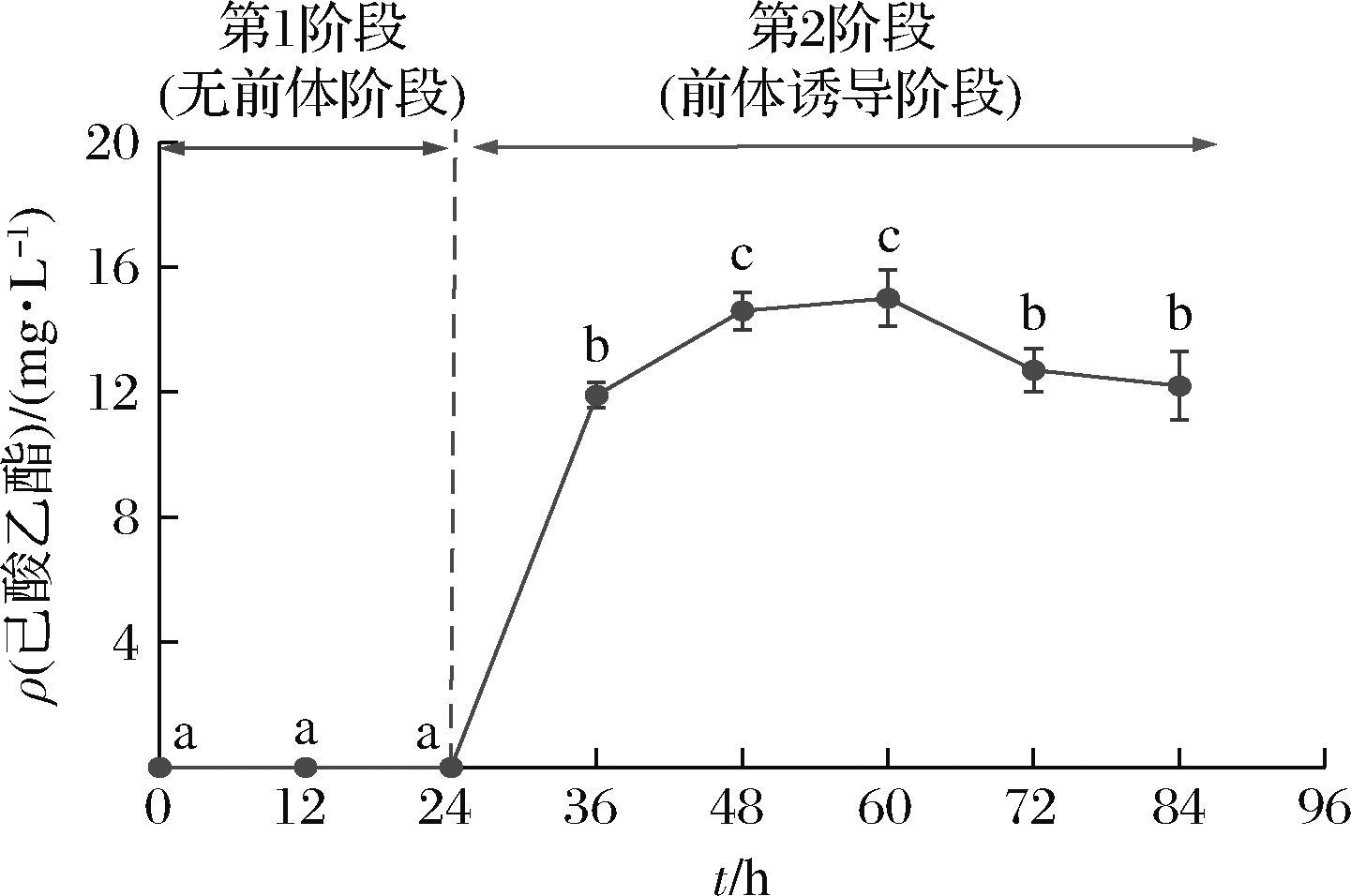
图7 发酵时间对酵母Y9产己酸乙酯的影响
Fig.7 Effect of time on ethyl caproate production by yeast Y9
3 结论
产香酵母是白酒酿造中的重要功能菌群,影响到白酒风味物质的组成和含量,尤其是酯类化合物的种类和含量。为此,本文从酒曲中筛选获得1株高产己酸乙酯的酵母菌株Y9,通过形态学观察、生理生化及分子生物学鉴定其为Hyphopichia burtonii,该酵母具有较好的NaCl和葡萄糖耐受性,能适应宽广的pH环境,属于中等乙醇耐受性菌株,具有一定的己酸和己酸乙酯耐受性,优化得到其产己酸乙酯条件,在高粱酶解液培养基糖度为14 °Brix,初始pH 5.0,乙醇体积分数为8%,己酸体积分数为0.04%,诱导温度为22 ℃,诱导阶段采用静置,发酵60 h时,己酸乙酯质量浓度达到15.0 mg/L,是优化前的3.6倍。由此可见,酵母Y9具有在浓香型白酒酿造中应用的潜力。
[1] ZHANG H M,MENG Y J,WANG Y L,et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese strong-flavor Baijiu[J].Food Chemistry,2020,312:126084.
[2] LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry,2018,66(22):5 425-5 432.
[3] FAN G S,SUN B G,XU D,et al.Isolation and identification of high-yield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].Journal of the American Society of Brewing Chemists,2018,76(2):117-124.
[4] 李俊辉, 刘英杰,隋丽娜,等.浓香型白酒增加己酸乙酯降低乳酸乙酯的研究进展[J].中国酿造,2019,38(1):1-4.
LI J H,LIU Y J,SUI L N,et al.Research progress on ethyl hexanoate-increasing and ethyl lactate-decreasing of strong-flavor Baijiu[J].China Brewing,2019,38(1):1-4.
[5] SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Research International,2020,137:109425.
[6] 王松, 陈雪玲,游玲.1株产香酵母在浓香型白酒复糟酒生产中的应用[J].中国酿造,2020,39(9):42-47.
WANG S,CHEN X L,YOU L.Application of aroma-producing yeast in the strong-flavor Baijiu production with reusing distiller’s grain[J].China Brewing,2020,39(9):42-47.
[7] WANG W H,FAN G S,LI X T,et al.Application of Wickerhamomyces anomalus in simulated solid-state fermentation for Baijiu production:Changes of microbial community structure and flavor metabolism[J].Frontiers in Microbiology,2020,11:598758.
[8] 宋瑞滨, 邵泽良,宋军.浓香型白酒生产中乙酸乙酯偏高的原因及控制措施[J].酿酒,2019,46(3):55-60.
SONG R B,SHAO Z L,SONG J.Analysis of the reasons and control measures for high ethyl acetate in Luzhou-flavor liquor production[J].Liquor Making,2019,46(3):55-60.
[9] 张强, 郭元,韩德明.酿酒酵母乙醇耐受性的研究进展[J].化工进展,2014,33(1):187-192.
ZHANG Q,GUO Y,HAN D M.Research progress in the ethanol tolerance of yeast[J].Chemical Industry and Engineering Progress,2014,33(1):187-192.
[10] ASWINI K,GOPAL N O,UTHANDI S.Optimized culture conditions for bacterial cellulose production by Acetobacter senegalensis MA1[J].BMC Biotechnology,2020,20(1):46.
[11] YOSHIMOTO H,FUJIWARA D,BOGAKI T,et al.Mechanisms of acetate ester production and control in yeasts[J].Journal of Bioscience and Bioengineering,2001,91(2):231.
[12] FUJII T,KOBAYASHI O,YOSHIMOTO H,et al.Effect of aeration and unsaturated fatty acids on expression of the Saccharomyces cerevisiae alcohol acetyltransferase gene[J].Applied and Environmental Microbiology,1997,63(3):910-915.
[13] 刘朋肖, 常煦,成柳洁,等.响应面法优化酿酒酵母Y3401产己酸乙酯发酵条件[J].中国食品学报,2021,已收录.
LIU P X,CHANG X,CHENG L J,et al.Optimization of cultural conditions for ethyl caproate production from Saccharomyces cerevisiae Y3401 by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology,2021,已收录.
[14] KURIBAYASHI T,KANEOKE M,HIRATA D,et al.Analysis of free fatty acids in sake by an enzymatic method and its application for estimating ethyl caproate and selecting yeast with high productivity of the ester[J].Bioscience Biotechnology and Biochemistry,2012,76(2):391-394.
[15] 钟姝霞, 万世旅,边名鸿,等.一株高产乙酸乙酯酵母的鉴定及产酯条件的研究[J].中国酿造,2017,36(2):75-79.
ZHONG S X,WAN S L,BIAN M H,et al.Identification and ester-producing conditions of a high ethyl acetate-producing yeast[J].China Brewing,2017,36(2):75-79.
[16] HASHEM M,ALAMRI S A,ASSERI T A Y,et al.On the optimization of fermentation conditions for enhanced bioethanol yields from starchy biowaste via yeast co-cultures[J].Sustainability,2021,13(4):1890.