刺梨(Rosa roxburghii Tratt.)系蔷薇科蔷薇属植物,广泛分布于我国西南地区,因其全身布刺且果实呈梨状得名。刺梨果实富含多糖[1]、黄酮、维生素C、维生素P和超氧化物歧化酶 [2]等多种功能物质,具有降血糖血脂[2]、抗氧化[3]、抑制卵巢癌转移和侵入[4]、抗细胞凋亡[5]、抗辐射[6]和防止DNA损伤[7]等功能,具有较大的开发潜力。但刺梨的适口性差(酸、涩、苦)[8],单果重低(15 g 左右)[9]、采收期短,不宜储藏,严重影响了鲜果的销售。刺梨露酒的制作和食用在贵州民间具有悠久的历史。利用刺梨酿造果酒具有优势[10]。实验室前期的调研结果显示,刺梨果实香气独特持久,受发酵过程影响较小,酒体果香突出,易形成稳定而清澈的酒体[8]。
目前酿造刺梨酒所使用的均为葡萄来源的商业酿酒酵母,未见到刺梨来源的酿酒酵母,而实际上刺梨果酒的发酵急需优质酿酒酵母。如何从刺梨中分离到优质酿酒酵母成为行业内的一个突出问题。当前对刺梨中酵母的研究较少,仅局限于非酿酒酵母。如刘晓柱等[11]对刺梨自然发酵过程中非酿酒酵母生物多样性的变化进行了研究,从刺梨中分离到了3株能对刺梨自然发酵过程香气成分进行调节的非酿酒酵母,1株是高产β-糖苷酶的嗜杀酵母C4[8],另2株分别为葡萄有孢汉逊酵母F13[12]和F119[13]。到目前为止尚未见到从刺梨中分离酿酒酵母的报道。本研究拟从刺梨果实中分离出与葡萄来源的商业化酿酒酵母具有同等发酵效力的酿酒酵母,并进行深入研究,以利于刺梨果酒产业的发展。
1 材料与方法
1.1 材料与试剂
贵农5号刺梨购自贵州省龙里县;YPD、WLN培养基,贵州博奥瑞杰生物科技有限公司;对照菌株ZYMAFLORE X16 ,Laffort公司;其余试剂均为国产分析纯,贵州博奥瑞杰生物科技有限公司。
1.2 仪器与设备
UH5300紫外分光光度计,日本日立公司;雷磁 PHSJ-3F 型pH计,上海仪电科学仪器股份有限公司;CKX41倒置显微镜,日本奥林巴斯公司;SA402B电子舌味觉系统,日本INSENT公司;TQ8040 NX气相质谱联用仪,日本岛津仪器有限公司。
1.3 菌株的分离与鉴定
称取100 g新鲜成熟的刺梨果肉和果皮的混合物,移入250 mL无菌锥形瓶中,封口后置于28 ℃下自然发酵,分别于3、4、5 d取样,直接在YPD固体平板上划线,28 ℃培养48 h。随后继续挑取每个平板上的单克隆,划线于YPD固体平板上,直至为纯的单克隆为止。
挑取单克隆,分别划线于YPD固体平板和鉴定培养基WLN固体平板[14]上,28 ℃培养5 d后,观察菌株的生长状态。
利用PCR扩增ITS序列,使用ITS1-ITS4通用引物对[15],反应体系为2×Taq PCR Master Mix 25 μL,10 μmol/L ITS1引物和ITS4引物各2 μL,菌液2 μL,补水至总体积25 μL。结束后取8 μL PCR 产物琼脂糖凝胶电泳检测后,剩余部分送上海生工测序,结果在NCBI上进行BLAST同源序列搜索比对。利用目标ITS序列,使用MEGA 7[16]构建邻接树,1 000次Bootstrap自检。同时利用DNAMAN软件比较CZ和X16的ITS序列差异。
1.4 菌株生长曲线和碳水化合物代谢情况的确定
测定生长曲线时,将10 mL YPD液体培养基装入15 mL玻璃试管中,然后在试管中接种菌液,终浓度为106 CFU/mL菌液,混匀,30 r/min,28 ℃培养,每20 h取样一次,测定600 nm处的菌液吸光度(A600),直至80 h[17]。利用A600绘制生长曲线。
配制氮基础液体培养基(YNB含氨基酸)[0.5%(NH3)2SO3,0.1% KH2PO3,0.01% NaCl,0.05% MgSO3,0.01% CaCl2,0.02%酵母提取物][18]测定菌株对不同碳源的利用能力,在该培养基中分别添加20 g/L的葡萄糖、D-半乳糖、D-木糖、D-阿拉伯糖、核蔗糖、D-麦芽糖、D-棉籽糖、水苏糖、甘露醇和D-山梨醇,形成不同碳源的测试培养基。接种菌液到不同碳源的测试培养基中,终浓度为106 CFU/mL,28 ℃,30 r/min,培养72 h后,测定A600。
1.5 酿酒潜力分析
15 mL的玻璃试管中装载10 mL YPD液体培养基,接种菌液到该培养基中,终浓度为106 CFU/mL,28 ℃,30 r/min,培养72 h后测A600,比较不同因素对菌株生长的影响[19]。
葡萄糖耐受性分析时在上述培养基中添加葡萄糖至终质量浓度分别为100、200、400、600 g/L。酒精耐受性测试时添加无水乙醇至其终体积分数分别为5%、9%、13%、17%。酸耐受性测试时用酒石酸/NaOH调pH分别为2.0、3.5、5.0、6.5。SO2耐受性测试时用偏重亚硫酸钾将SO2的质量浓度分别调至200、300、400、500 mg/L。
菌株产H2S的能力参照刘晓柱等[13]的方法。絮凝性测试参照杨诗妮等[20]的方法。
1.6 实验室规模的发酵分析
2 L的三角瓶用于发酵分析,瓶口用自制的水封呼吸器封口。刺梨汁中添加50 mg/L的SO2,经果胶酶过夜酶解后,用蔗糖将糖含量调至264 g/L,用酒石酸/碳酸氢钾调pH至3.6。在刺梨汁中接种菌液使菌液终浓度均为106 CFU/mL。发酵温度控制在16~18 ℃。酒精发酵结束后,经过约6个月的陈酿期,陈酿期内进行倒罐处理,澄清稳定后的原酒进行后续分析。
利用福林酚法[21]测定总酚含量。结果表示为g/L,多酚为相当于没食子酸的量。利用GB 5009.225—2016规定的酒精计法和2,6-二氯靛酚滴定法分别测定酒精度、抗坏血酸含量。利用蒽酮比色法测定总碳水化合物的含量[22]。
1.7 刺梨酒的抗氧化活性分析
1.7.1 铁离子还原能力(ferric reducing antioxidant power,FRAP)法抗氧化活性测定
使用FRAP法测定抗氧化活性[23]。取0.2 mL适当稀释的刺梨酒样,加入3.9 mL FRAP工作液(由0.3 mol/L醋酸盐缓冲液,20 mmol/L FeCl3溶液,10 mmol/L TPTZ溶液按体积比10∶1∶1组成),混匀后37 ℃反应20 min,测定反应液在593 nm处的吸光度。使用0.2 mL不同浓度的FeSO3(0.025、0.2、0.4、0.6、0.8 mmol/L)溶液与3.9 mL FRAP工作液混合,37 ℃,20 min,制定标准曲线。以0.2 mL的0.4 mg/L的维生素C工作液替代刺梨果酒进行同样操作。结果表示为100 mL酒样相当于维生素C的质量。
1.7.2 DPPH法抗氧化活性测定
DPPH自由基活性清除法测定抗氧化活性[21]。取2 mL稀释10倍的果酒样品,与2 mL 0.2 mmol/L DPPH溶液混匀,室温避光反应30 min,在517 nm波长处测定吸光度Ai。同时以无水乙醇分别替代刺梨酒样和DPPH,进行同样操作,在517 nm处分别测得Ac和Aj。DPPH自由基清除率/%=[1-(Ai-Aj)/Ac]×100,酒样的DPPH自由基清除率按着等量关系换算成维生素C当量,即100 mL刺梨酒样相当于维生素C的质量。
1.8 感官及风味分析
利用电子舌对刺梨酒进行滋味分析。采样时间120 s,采样速度为1 次/s,每个样品平行测定3次,每个平行重复采集4次[13]。利用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)和GC-MS分析刺梨果酒的香气成分,参照刘晓柱等[13]的方法。
1.9 数据统计分析
以上所有试验均重复3次,以葡萄酒来源的商业酵母X16作对照菌株[24]。所有数据表示为平均数±标准差。利用SPSS 23.0进行数据分析,使用单因素ANOVA(Games-Howell’s 比较检验)比较各平均值的差异,同时利用t-test比较两组平均数的差异,Prism 8.0用于绘图。所有图中的小写字母表示平均值间在P<0.05水平上的差异。
2 结果与分析
2.1 酿酒酵母的的筛选与鉴定
WLN培养基鉴定结果表明,共从刺梨自然发酵液中分离到14株形态各异的本地酵母。其中1株的形态与X16菌株的形态一致,呈球状突起,表面光滑,并且菌落的中间呈绿色,周边白色,在YPD固体培养基上二者也有类似特征(图1-a),显微镜下具有典型的酵母细胞形态(图1-b)。
PCR鉴定结果表明,目标菌株的ITS序列(Accession No.MW453157)与NCBI中的酿酒酵母菌株3879j(Accession No.KP204935.1)的序列相似性高达99.63%,聚类分析结果显示目标菌株和X16均位于酿酒酵母一支(图2-b),因此将该酵母菌株鉴定为酿酒酵母,命名为S.cerevisiae CZ,简称“CZ”。CZ的ITS序列的比对分析排除了相互污染的可能(图2-a)。

a-表观形态特征;b-显微形态特征
图1 菌落在不同培养基上的形态特征和经美蓝染色后 (×1 000)的特征
Fig.1 Morphological characteristics of colonies grown on different media and cell with 1 000×amplification under microscope of CZ and X16 after methylene blue staining

a-序列比对;b-进化聚类分析
图2 CZ和X16的ITS序列比对和进化聚类分析
Fig.2 The alignment of sequenced ITS between CZ and X16 and evolutionary analysis
2.2 碳源利用情况及其在YPD培养基中的生长曲线分析
碳源分析结果表明CZ和X16对同一种碳源的利用情况没有显著差异,二者偏好利用葡萄糖、半乳糖、蔗糖和麦芽糖(图3)。在YPD液体培养基中观察了CZ和X16的生长曲线,结果显示前20 h后,菌体迅速增加,到40 h时增长速度明显下降,在60~80 h达到平台期,两个菌株的表现几乎一致(图3-a)。

a-生长曲线;b-单糖;c-多糖;d-糖衍生物
图3 菌株在YPD培养基中的生长曲线和菌株对单糖、多糖以及糖衍生物的利用情况测试
Fig.3 The growth curve in YPD broth and carbon metabolism tests for monosaccharides,oligosaccharides, and carbohydrate derivatives
2.3 酿酒潜力分析
在含100 g/L葡萄糖的YPD培养基中,X16的生长显著优于CZ。但在其他浓度葡萄糖的培养基中,二者的生长状态却无显著差异。另外,从含400 g/L葡萄糖的YPD培养基开始,随着葡萄糖浓度的增加,对菌株生长的抑制程度也随着增加(图4-a)。
CZ在含不同乙醇体积分数的YPD培养基中的生长情况与X16一致,各浓度之间存在着显著差异,在13%或更高乙醇体积分数的培养基中,二者的生长受到显著抑制(图4-b)。
两个菌株的生长在pH为2的YPD液体培养基中受到显著抑制,而在pH为3.5和5中没有差异,在pH为6.5中,CZ的生长状况优于X16(图4-c)。CZ和X16在含0~500 mg/L SO2的YPD培养基中,随着SO2浓度的升高,除了CZ 在200 mg/L中与空白对照(0 mg/L)没有显著差异外,其余浓度下二者的生长状况均受到显著抑制(图4-d)。二者产H2S能力较弱(图4-e)。CZ和X16均具有高絮凝性,分别为(11.5±4.4)%和(9.6±1.3)%,且二者之间不存在显著差异。
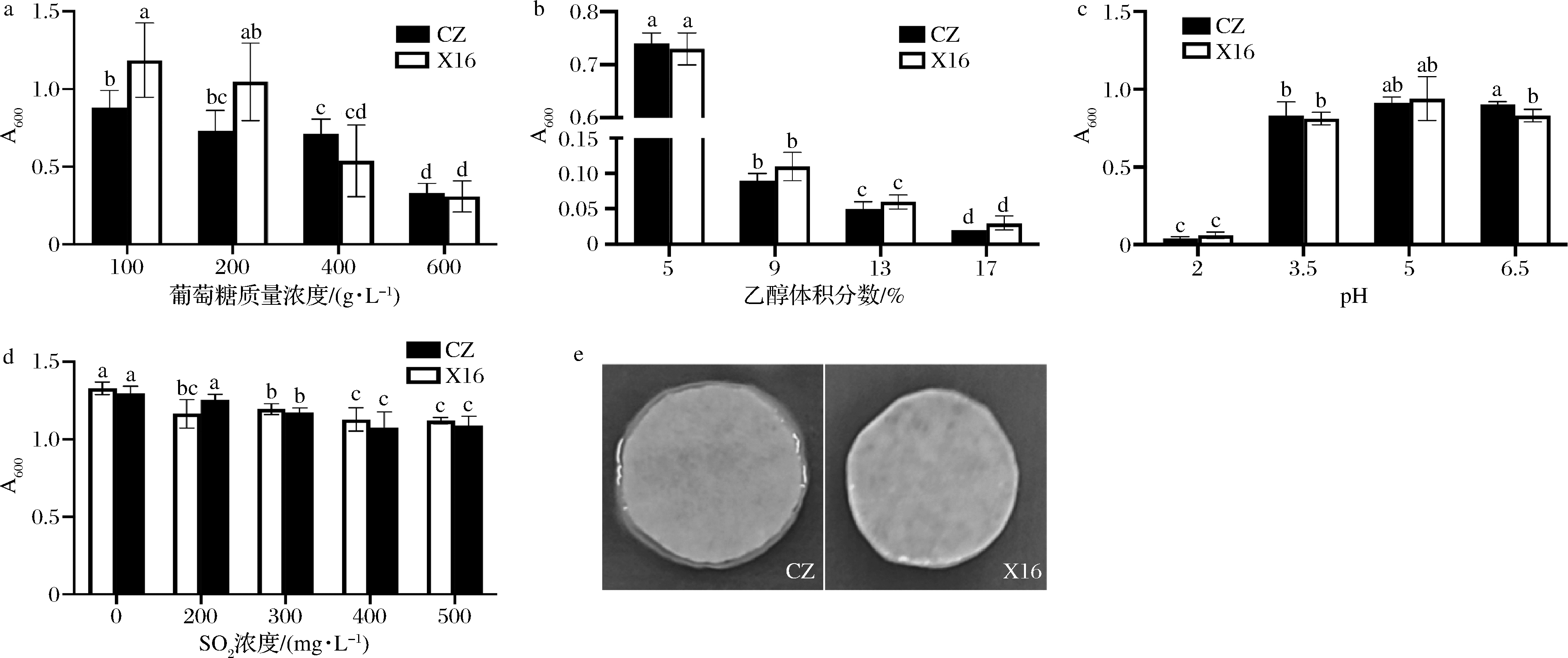
a~d-耐受性分析;e-H2S产生分析
图4 菌株的酿酒潜力分析
Fig.4 Brewing potential analysis of strains,CZ and X16
2.4 实验室规模的酿造分析
利用CZ和X16分别酿造的成品酒样,所测试的指标均不存在显著差异。X16的酒精度(12.85%vol)略高于CZ(12.75%vol)、CZ的pH(3.71)略高于X16(3.66)、CZ的总碳水化合物含量(71.7 g/L)略高于X16(66.9 g/L)、CZ的总酚含量(12.13 g/L)略高于X16(11.53 g/L)、X16的抗坏血酸含量(9.06 g/L)略高于CZ(8.38 g/L)(表1)。
表1 刺梨果酒的理化分析
Table 1 Physical and chemical analysis of R.roxbunghii wine
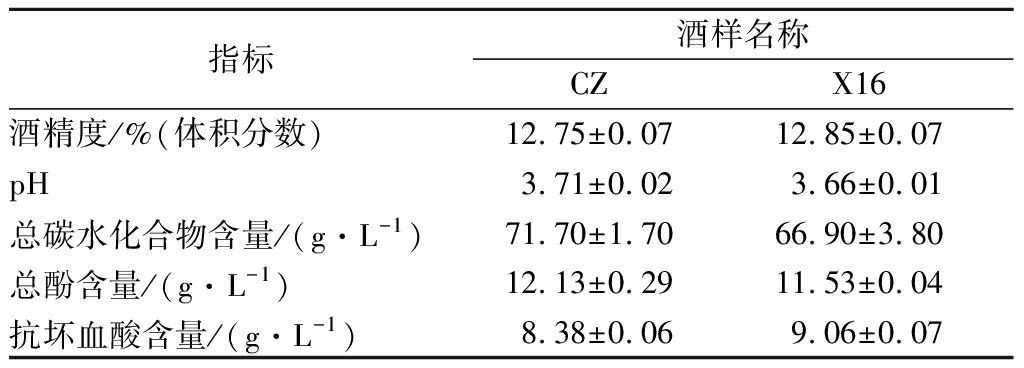
指标酒样名称CZX16酒精度/%(体积分数)12.75±0.0712.85±0.07pH3.71±0.023.66±0.01总碳水化合物含量/(g·L-1)71.70±1.7066.90±3.80总酚含量/(g·L-1)12.13±0.2911.53±0.04抗坏血酸含量/(g·L-1)8.38±0.069.06±0.07
2.5 刺梨酒的抗氧化活性分析
抗氧化活性分析结果如表2所示。总体上,X16酿造的刺梨果酒的抗氧化活性效果均略高于CZ,但二者没有统计学差异。刺梨酒对Fe3+的还原能力的结果显示,100 mL CZ酿造的刺梨酒相当于0.66 μg的维生素C,X16相当于0.69 μg。DPPH自由基清除率结果显示,两种酵母酿造的刺梨果酒,100 mL均相当于约20 mg维生素C的清除效果。
表2 刺梨酒的抗氧化活性分析
Table 2 Antioxidant activity analysis of R.roxbunghii wine
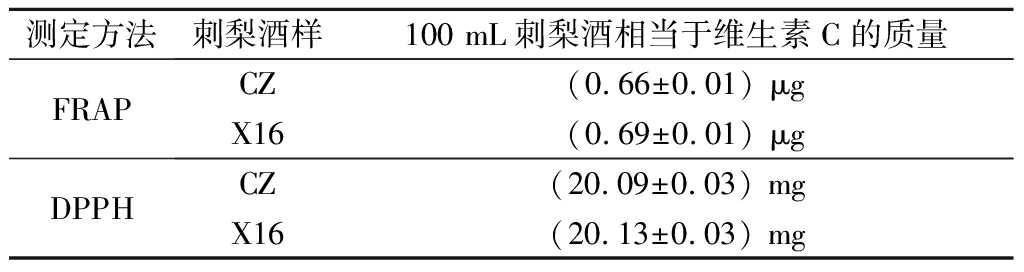
测定方法刺梨酒样100 mL刺梨酒相当于维生素C的质量FRAPCZ(0.66±0.01) μgX16(0.69±0.01) μgDPPHCZ(20.09±0.03) mgX16(20.13±0.03) mg
2.6 刺梨果酒的感官及风味分析
电子舌分析结果表明CZ纯种发酵的刺梨果酒与X16,在咸味、酸味、苦味、涩味、鲜味、丰富度、后味A、后味B响应值上均无显著差异(图5-a)。采用HS-SPME-GC-MS分析,CZ刺梨果酒中共检出63种,包括酯类31种、醇类13种、酸类6种、醛酮类3种、其他10种;X16刺梨果酒中共检测到64种,包括酯类32种、醇类12种、酸类8种、醛酮类3种、其他9种(图5-b)。

a-电子舌;b-HS-SPME-GC-MS分析结果
图5 刺梨酒的风味分析
Fig.5 The flavor analysis for R.roxbunghii wine
3 讨论与结论
本项目从刺梨果汁中获得的CZ酿酒酵母在碳源利用的偏好性、耐酒精、耐酸、耐糖、耐SO2方面具有与商业酵母X16相似的能力,同时在亚硫酸铋固体培养基上培养5 d后所产的H2S比较少,絮凝性优于X16,这些结果均说明CZ具备酿造果酒的潜力。
该菌株完全具备将刺梨果汁变成果酒的能力,无论是在颜色、澄清度、酒精度、风味还是在总酚和抗坏血酸的保留方面均与X16无明显差异。该菌株具有一定的环境耐受性,可进行小规模的刺梨果酒发酵,有一定的应用潜能。但是在中试甚至是工业化生产中的表现特性如何,需要进一步的研究评价。
[1] WANG L,LI C,HUANG Q,et al.Polysaccharide from Rosa roxburghii Tratt fruit attenuates hyperglycemia and hyperlipidemia and regulates colon microbiota in diabetic db/db mice[J].Journal of Agricultural and Food Chemistry,2020,68(1):147-159.
[2] HOU Z Q,YANG H Z,ZHAO Y,et al.Chemical characterization and comparison of two chestnut rose cultivars from different regions[J].Food Chemistry,2020,323:126806.
[3] CHEN G J,KAN J Q.Ultrasound-assisted extraction,characterization,and antioxidant activity in vitro and in vivo of polysaccharides from Chestnut rose(Rosa roxburghii Tratt) fruit[J].Journal of Food Science and Technology,2018,55(3):1 083-1 092.
[4] CHEN Y,LIU Z J,LIU J,et al.Inhibition of metastasis and invasion of ovarian cancer cells by crude polysaccharides from Rosa roxburghii Tratt in vitro[J].Asian Pacific Journal of Cancer Prevention:APJCP,2014,15(23):10 351-10 354.
[5] XU P,LIU X X,XIONG X W,et al.Flavonoids of Rosa roxburghii Tratt exhibit anti-apoptosis properties by regulating PARP-1/AIF[J].Journal of Cellular Biochemistry,2017,118:3 943-3 952.
[6] XU S J,ZHANG F,WANG L J,et al.Flavonoids of Rosa roxburghii Tratt offers protection against radiation induced apoptosis and inflammation in mouse thymus[J].Apoptosis,2018,23:470-483.
[7] XU S J,WANG X,WANG T Y,et al.Flavonoids from Rosa roxburghii Tratt prevent reactive oxygen species-mediated DNA damage in thymus cells both combined with and without PARP-1 expression after exposure to radiation in vivo[J].Aging(Albany NY),2020,12(6):16 368-16 389.
[8] LIU X Z,LI Y F,YU Z H.,et al.Screening and characterisation of β-glucosidase production strains from Rosa roxburghii Tratt[J].International Journal of Food Engineering,2021,17(1):1-9.
[9] 穆瑞. 叶片不同损失量对刺梨树体养分与产量及果实品质的影响[D].贵阳:贵州大学,2018.
MU R.Effect of different defoliation on tree nutrient,yield and fruit quality of Rosa roxburghii Tratt[D].Guiyang:Gui zhou University,2018.
[10] WANG L,ZHANG B,XIAO J,et al.Physicochemical,functional,and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J].Food Chemistry,2018,249:127-135.
[11] 刘晓柱, 李银凤,于志海,等.刺梨自然发酵过程中非酿酒酵母多样性分析[J].微生物学报,2020,60(8):1 696-1 708.
LIU X Z,LI Y F,YU Z H,et al.Biodiversity of non-Saccharomyces yeasts during natural fermentation of Rosa roxburghii[J].Acta Microbiologica Sinica,2020,60(8):1 696-1 708.
[12] 赵湖冰, 黎华,田野,等.一株刺梨非酿酒酵母的分离鉴定、生理特性及混菌发酵研究[J].食品工业科技,2020,41(16):114-120.
ZHAO H B,LI H,TIAN Y,et al.Isolation,identification,physiological characteristics and mixed fermentation of a non-Saccharomyces cerevisiae from Rosa roxburghii[J].Science and Technology of Food Industry,2019,41(16):114-120.
[13] 刘晓柱,赵湖冰,李银凤,等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业,2020,46(8):97-104.
LIU X Z,ZHAO H B,LI Y F,et al.Identification and oenological properties analysis of a strain of Hanseniaspora uvarum from Rosa roxburghii[J].Food and Fermentation Industries,2020,46(8):97-104.
[14] URSO R,RANTSIOU K,DOLCI P,et al.Yeast biodiversity and dynamics during sweet wine production as determined by molecular methods[J].FEMS Yeast Research,2008,8(7):1 053-1 062.
[15] BAI F Y,ZHAO J H,TAKASHIMA M,et al.Reclassification of the Sporobolomyces roseus and Sporidiobolus pararoseus complexes,with the description of Sporobolomyces phaffii sp.nov[J] International Journal of Systematic and Evolutionary Microbiology,2002,52(Pt 6):2 309-2 314.
[16] KUMAR S,STECHER G,LI M,et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Molecular Biology and Evolution,2018,35(6):1 547-1 549.
[17] ALDRETE-TAPIA JA,MIRANDA-CASTILLEJA D E,ARVIZU-MEDRANO S M,et al.Selection of yeast strains for tequila fermentation based on growth dynamics in combined fructose and ethanol media[J].Journal of Food Science,2018,83(2):419-423.
[18] 于景芝. 酵母生产与应用手册[M].北京:中国轻工业出版社,2005.
YU,J Z.Manual of Yeast Production and Application[M].Beijing:China Light Industry Press,2005.
[19] VIGENTINI I,BARRERA CARDENAS S,VALDETARA F,et al.Use of native yeast strains for in-bottle fermentation to face the uniformity in sparkling wine production[J].Frontier in Microbiology,2017,8,1 225.
[20] 杨诗妮, 叶冬青,贾红帅,等.本土戴尔有孢圆酵母在葡萄酒酿造中的应用潜力[J].食品科学,2019,40(18):108-115.
YANG S N,YE D Q,JIA H S,et al.Oenological potential of indigenous Torulaspora delbrueckii for winemaking[J].Food Science,2019,40(18):108-115.
[21] LIU F X,FU S F,BI X F,et al.Physico-chemical and antioxidant properties of four mango(Mangifera indica L.) cultivars in China[J].Food Chemistry,2013,138(1):396-405.
[22] YU Z H,LI J Q,HE S C,et al.Winemaking characteristics of red-fleshed dragon fruit from three locations in Guizhou province,China[J].Food Science and Nutrition,2021,9(5):2 508-2 516.
[23] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma(FRAP) as a measure of “antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[24] BORNEMAN A.R,FORGAN A.H,KOLOUCHOVA R,et al.Whole genome comparison reveals high levels of inbreeding and strain redundancy across the spectrum of commercial wine strains of Saccharomyces cerevisiae[J].G3(Bethesda),2016,6(4):957-971.