副溶血性弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐菌,广泛存在于世界范围内的河口和海洋环境中,不仅是引起水产养殖(特别是虾类养殖)中细菌性疾病出现的主要致病菌,还是海产品中引起人类食源性疾病的最常见病原菌[1]。目前防控副溶血性弧菌感染最主要的方式是使用抗生素,但是抗生素在水产养殖和农业中的滥用已导致许多细菌出现了耐药性,特别是出现了具有多重抗生素耐药性的副溶血性弧菌菌株,对人类健康和水产养殖业构成严重的威胁[2]。因而寻求抗生素的理想替代品迫在眉睫。
抗菌肽是生物体经诱导而自身合成的一种具有生物抗菌活性的小分子蛋白质,多数具有强碱稳定性、热稳定性以及杀菌、抗菌等特点,且不易使病原微生物产生耐药性,可对动物和人类的健康发挥重要作用。其中,细菌抗菌肽还具有生产周期短、成本低、得率高、提取容易等优势,被认为是传统抗生素的理想替代品[3]。因此,利用细菌产生的抗菌肽来控制副溶血性弧菌的感染已经成为一个重要的发展趋势和研究方向[4]。当前可产生抗菌肽的细菌中研究较多的是乳酸菌和芽胞杆菌,但乳酸菌所产抗菌肽的抑菌谱较窄,而芽胞杆菌本身具有抗逆性,对环境的适应力更强,且其所产抗菌肽的种类多,抑菌谱广,因此具有更大的开发和应用价值[5]。目前已有将枯草芽胞杆菌(Bacillus subtilis)所产抗菌肽应用于防治副溶血性弧菌感染的研究,如PU等[6]表明枯草芽胞杆菌产生的抗菌肽不仅可以抑制副溶血性弧菌,还可以改善虾类的生长。另外,CHENG等[7]从枯草芽胞杆菌E20发酵豆粕中提取出了抗菌肽FSB-AMP,其可抑制虾类养殖中的弧菌感染。然而,目前来自海洋环境中的产抗菌肽的枯草芽胞杆菌的报道较少,部分枯草芽胞杆菌所产抗菌肽对副溶血性弧菌的抑制作用不够强,抑菌特性的研究也不够深入。
本文从芦潮港的海泥中筛选出1株产广谱抗菌肽的枯草芽胞杆菌,其对副溶血性弧菌、腐生葡萄球菌和大肠杆菌等致病菌有较强的抑制作用,并对其生物学性质和抑菌谱进行了研究,为该抗菌肽的深入研究和应用奠定了基础。
1 材料与方法
1.1 材料与仪器
1.1.1 样品
海泥:上海市浦东新区临港新城芦潮港附近海域的海滩。
1.1.2 指示菌及培养条件
供试指示菌的种类和来源见表1,细菌于37 ℃、150 r/min培养12 h,酵母菌于30 ℃,150 r/min培养16 h。
表1 指示菌种类及来源
Table 1 Origins and classification of indicator strains
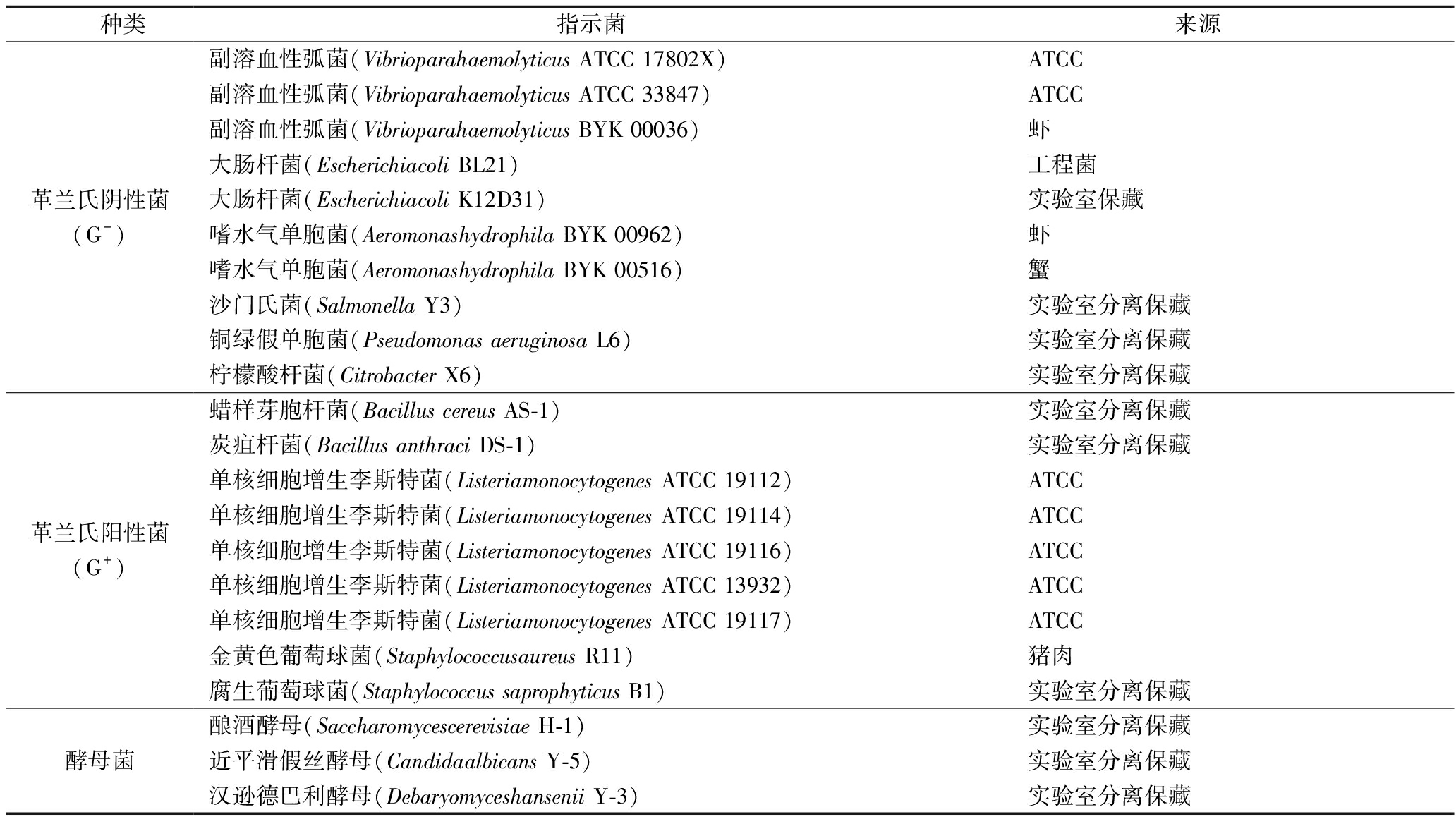
种类指示菌来源革兰氏阴性菌(G-)副溶血性弧菌(Vibrioparahaemolyticus ATCC 17802X)ATCC副溶血性弧菌(Vibrioparahaemolyticus ATCC 33847)ATCC副溶血性弧菌(Vibrioparahaemolyticus BYK 00036) 虾大肠杆菌(Escherichiacoli BL21) 工程菌大肠杆菌(Escherichiacoli K12D31) 实验室保藏嗜水气单胞菌(Aeromonashydrophila BYK 00962) 虾嗜水气单胞菌(Aeromonashydrophila BYK 00516) 蟹沙门氏菌(Salmonella Y3) 实验室分离保藏铜绿假单胞菌(Pseudomonas aeruginosa L6) 实验室分离保藏柠檬酸杆菌(Citrobacter X6) 实验室分离保藏革兰氏阳性菌(G+)蜡样芽胞杆菌(Bacillus cereus AS-1) 实验室分离保藏炭疽杆菌(Bacillus anthraci DS-1)实验室分离保藏单核细胞增生李斯特菌(Listeriamonocytogenes ATCC 19112)ATCC单核细胞增生李斯特菌(Listeriamonocytogenes ATCC 19114)ATCC单核细胞增生李斯特菌(Listeriamonocytogenes ATCC 19116)ATCC单核细胞增生李斯特菌(Listeriamonocytogenes ATCC 13932)ATCC单核细胞增生李斯特菌(Listeriamonocytogenes ATCC 19117)ATCC金黄色葡萄球菌(Staphylococcusaureus R11)猪肉腐生葡萄球菌(Staphylococcus saprophyticus B1)实验室分离保藏酵母菌酿酒酵母(Saccharomycescerevisiae H-1)实验室分离保藏近平滑假丝酵母(Candidaalbicans Y-5)实验室分离保藏汉逊德巴利酵母(Debaryomyceshansenii Y-3)实验室分离保藏
1.1.3 培养基
目标菌株分离纯化与形态观察所用培养基:LB培养基。
目标菌株初筛培养基:Landy液体培养基[8](葡萄糖20.0 g/L,L-谷氨酸5.0 g/L,酵母提取物1.0 g/L,L-苯丙氨酸 2.0 mg/L,KCl 0.5 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.15 g/L,MnSO4 5.0 mg/L,CuSO4·5H2O 0.16 mg/L,pH 7.0)。
目标菌株复筛所用种子培养基和发酵培养基:Landy液体培养基[8]。
指示菌培养基:单核细胞增生李斯特菌采用胰酪胨大豆酵母浸膏肉汤(tryptic soy broth-yeast extract,TSB-YE)培养基培养,其他细菌采用LB培养基培养,真菌采用YPD培养基培养,划线纯化时固体培养基中琼脂含量为1.8%(质量分数),进行抑菌试验时培养基中琼脂含量为1.0%(质量分数)[9]。
1.1.4 试剂及仪器
Ezup柱式细菌基因组DNA抽提试剂盒、通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)及1492R(5′-GGTTACCTTGTTAGG ACTT-3′)、木瓜蛋白酶,生工生物工程(上海)股份有限公司;碱性蛋白酶,北京索莱宝科技有限公司;其他化学试剂,国药集团化学试剂有限公司。
LDZX-30FA型立式压力蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-1F型超净工作台,上海博迅实业有限公司;隔水式恒温培养箱,上海一恒科技有限公司;PHS-25型pH计,上海仪电科学仪器股份有限公司;ZQWY-218V型卧式大容量全文振荡培养箱、ZHSY-50S型水浴恒温振荡培养箱,上海知楚仪器有限公司;H2050R型高速冷冻离心机,湖南湘仪离心机仪器有限公司;DYY-6C型电泳仪,北京六一仪器厂;A300型PCR仪,杭州朗基科学仪器有限公司。
1.2 实验方法
1.2.1 海泥样品中菌株的分离
称取10 g海泥样品于盛有90 mL无菌生理盐水的锥形瓶中,均质后90 ℃恒温水浴10 min以杀死大部分的非芽胞杆菌,再接着用无菌生理盐水进行10倍梯度稀释至10-5。分别吸取稀释度为10-2、10-3、10-4、10-5的稀释液100 μL均匀涂布于LB固体培养基上,置于37 ℃恒温培养箱中培养12 h。选取稀释倍数合适的平板,挑取具有芽胞杆菌典型形态的菌落进行划线纯化,纯化3次后编号并用甘油保藏。
1.2.2 抗副溶血性弧菌菌株的初筛与复筛
初筛:采用琼脂扩散法进行菌株初筛[10]。将上述纯化后的菌种接种至Landy液体培养基中,37 ℃、150 r/min培养12 h后,将发酵液置于4 ℃冰箱中备用。将副溶血性弧菌(V.parahaemolyticus ATCC 17802)接种至LB液体培养基中,37 ℃、150 r/min培养12 h后,制备成菌浓度为107CFU/mL的指示菌悬液。将15 mL LB培养基(含质量分数为1.0%的琼脂)与50 μL指示菌悬液混合均匀后,倒入直径为90 mm的无菌平板内。待其完全凝固后打孔(直径为7 mm),每孔加入发酵液50 μL,置于37 ℃培养12 h。观察孔周围是否形成抑菌圈。试验重复3次,选择具有抑菌活性的菌株进行下一步复筛。
复筛:将初筛得到的活性菌株于LB固体培养基上划线活化3次后,将单菌落接种到Landy种子培养基中,37 ℃、150 r/min培养24 h后,再以5%(体积分数)的接种量接种到Landy发酵培养基中,37 ℃、150 r/min培养24 h。然后将发酵液于4 ℃、10 000 r/min离心15 min,上清液经过0.22 μm的无菌滤膜过滤得到无细胞上清液,置于4 ℃冰箱中备用[9]。以副溶血性弧菌(V.parahaemolyticus ATCC 17802)、蜡样芽胞杆菌(Bacillus cereus AS-1)、大肠杆菌(Escherichia coli BL21)和炭疽杆菌(Bacillus anthraci DS-1)为指示菌,采用琼脂扩散法进行复筛,按照上述初筛的方法制备各指示菌平板,每孔加入50 μL无细胞上清液,37 ℃培养12 h后,测定抑菌圈的直径,试验重复3次。
1.2.3 活性菌株H5的鉴定
形态学鉴定:先采用平板划线法对活性菌株H5进行3次纯化,得到单菌落后根据菌落的形态特征进行初步判断,再采用革兰氏染色法对其进行染色,在光学显微镜下进一步观察其染色情况和形态。
分子生物学鉴定:使用Ezup柱式细菌基因组DNA抽提试剂盒对活性菌株H5的DNA进行提取,以提取出的H5基因组DNA为模板,27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物,进行PCR扩增[11]和琼脂糖凝胶电泳,然后将PCR扩增产物送到生工生物工程(上海)股份有限公司进行测序。然后将测序所得的16S rDNA序列在GenBank(http://www.ncbi.nlm.nih.gov)数据库中利用BLAST功能进行同源性比对,并使用MEGA5.0软件构建系统发育树,最后将该菌株的16S rDNA序列提交至GenBank数据库中。
1.2.4 活性菌株H5所产抑菌物质的抑菌谱测定
选用包括革兰氏阳性菌、革兰氏阴性菌和酵母菌在内的22株菌株作为检测的指示菌,按照1.2.2中的方法测定活性菌株H5的无细胞发酵上清液对这些指示菌的抑制作用,每孔50 μL,37 ℃培养12 h后,测量抑菌圈的直径,试验重复3次。
1.2.5 活性菌株H5所产抑菌物质的理化性质
1.2.5.1 热稳定性
分别取等量无细胞发酵上清液于离心管中,置于0、10、20、30、40、50、60、70、80、90、100、121 ℃条件下各处理10和30 min,然后立即用冰水浴冷却至室温,以未经处理的无细胞发酵上清液为对照,以副溶血性弧菌ATCC 17802为指示菌,采用1.2.2中的方法测定抑菌圈直径,并按照JAMALUDDIN等[12]的方法计算抑菌活性,试验重复3次。
1.2.5.2 酸碱稳定性
分别取等量无细胞发酵上清液于离心管中,用5 mol/L的HCl溶液和5 mol/L的NaOH溶液调节样品的pH,使其pH值分别为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0,以加无菌水至相同体积的无细胞上清液为对照,37 ℃水浴1 h后[13],再调节pH值至7.0,并用无菌水定容至相同体积,抑菌活性的测定和计算方法同上,试验重复3次。
1.2.5.3 紫外线稳定性
分别取等量无细胞发酵上清液于离心管中,置于距30 W紫外灯90 cm处照射10、20、30、40、50、60 min后[9],以未经处理的无细胞发酵上清液为对照,抑菌活性的测定方法和计算方法同1.2.5.1,试验重复3次。
1.2.5.4 金属离子稳定性测定
配制浓度均为100 mmol/L的NaCl、KCl、MnCl2、MgCl2、CaCl2、ZnCl2和AlCl3溶液,灭菌后备用。分别取等量无细胞发酵上清液于离心管中,并分别加入上述溶液使得体系中Na+、K+、Mn2+、Mg2+、Ca2+、Zn2+、Al3+的终浓度为10 mmol/L[14],以加入相同体积无菌水的无细胞上清液为对照,室温静置2 h。抑菌活性的测定方法和计算方法同1.2.5.1试验重复3次。
1.2.5.5 有机溶剂稳定性测定
取等量无细胞发酵上清液于离心管中,分别与等体积的丙酮、甲醇、乙醇、乙腈混合,对照组加入等体积的无菌水,室温下作用2 h[15],抑菌活性的测定方法和计算方法同1.2.5.1试验重复3次。
1.2.5.6 蛋白酶敏感性
将胃蛋白酶用25 mmol/L HCl-KCl(pH 2.0)配制成4 mg/mL的母液,中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶和蛋白酶K用25 mmol/L磷酸盐缓冲液(pH 7.0)也分别配制成4 mg/mL的母液,分别加入到等量的无细胞发酵上清液中,使得样品中各酶的最终质量浓度均为1 mg/mL,调节pH值至各酶作用的最适pH值,以加入相同体积无菌水的无细胞上清液为对照,37 ℃条件下水浴2 h后,再将pH值调节至7.0[16],用无菌水定容至相同体积。抑菌活性的测定方法和计算方法同1.2.5.1,试验重复3次。
2 结果与讨论
2.1 抗副溶血性弧菌菌株的筛选
本试验从上海市芦潮港海泥样品中共分离得到90株具有明显芽胞杆菌形态的菌株,依次编号为H1~H90。经过初筛共得到15株对副溶血性弧菌有抑菌活性的菌株,进一步复筛后得到6株可产生抑菌物质的活性菌株,分别为菌株H1、H5、H17、H18、H20和H26,其对4种致病菌的抑菌效果如表2所示。菌株H17仅对副溶血性弧菌有抑制作用,菌株H1、H18和H26都仅对4种致病菌中的其中3种有抑制作用,而菌株H5和H20对4种致病菌均有抑制作用,且菌株H5的抑菌活性更显著,因此选择菌株H5进行后续的试验。
表2 具有抑菌活性的菌株对4种致病菌的抑制作用
Table 2 Inhibition effect of antimicrobial bacteria against four pathogenic bacteria

活性菌株抑菌圈直径/mm副溶血性弧菌(V.parahaemolyticus ATCC 17802)(G-)蜡样芽胞杆菌(B.cereusAS-1)(G+)大肠杆菌(E.coliBL21)(G-)炭疽杆菌(B.anthraciDS-1)(G+)H113.46±0.110.00±0.0013.15±0.0914.52±0.14H528.47±0.1317.49±0.1821.25±0.1419.51±0.17H1718.88±0.150.00±0.000.00±0.000.00±0.00H189.97±0.0811.00±0.1214.14±0.270.00±0.00H2014.76±0.7016.17±0.2112.02±0.139.05±0.09H268.10±0.119.38±0.120.00±0.0012.24±0.24
2.2 活性菌株H5的鉴定
2.2.1 活性菌株H5的形态学观察
如图1-a所示,活性菌株H5在LB固体培养基平板上培养12 h后,菌落为微黄色、圆形、隆起,边缘整齐,不透明,表面粗糙;如图1-b所示,菌株H5经革兰氏染色后于光学显微镜下观察,菌体呈紫色,证明该菌株为革兰氏阳性菌,菌体呈杆状,可初步判断菌株H5属于芽胞杆菌属。

a-LB固体培养基上的菌落形态; b-革兰氏染色形态(1 000×)
图1 菌株H5的形态学特征
Fig.1 Morphological features of strain H5
2.2.2 活性菌株H5的分子鉴定
以27F和1492R为引物,菌株H5的基因组DNA为模板进行PCR扩增。用1%(质量分数)琼脂糖凝胶电泳对PCR扩增产物进行检测,在1 000~2 000 bp处形成1条清晰的扩增条带,将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果显示,菌株H5的16S rDNA序列大小为1 101 bp,采用MEGA 5.0软件以芽胞杆菌属下的8个种的模式菌株的16S rDNA序列构建系统发育树,进行1 000次bootstrap测试分析,结果如图2所示。
其中相似性最高的是B.subtilis strain NBRC 13719T(NR 112629.1),相似性为98.72%,其次是Bacillus vallismortis strain DSM 11031T(NR 024696.1),相似性为98.61%,表明菌株H5在亲缘关系上与枯草芽胞杆菌最为相近。因此,结合菌落形态学特征、菌株形态学特征和16S rDNA序列分析,将菌株H5鉴定为枯草芽胞杆菌。将菌株H5的测序结果提交到GenBank数据库中,登陆号为MK880419.1。
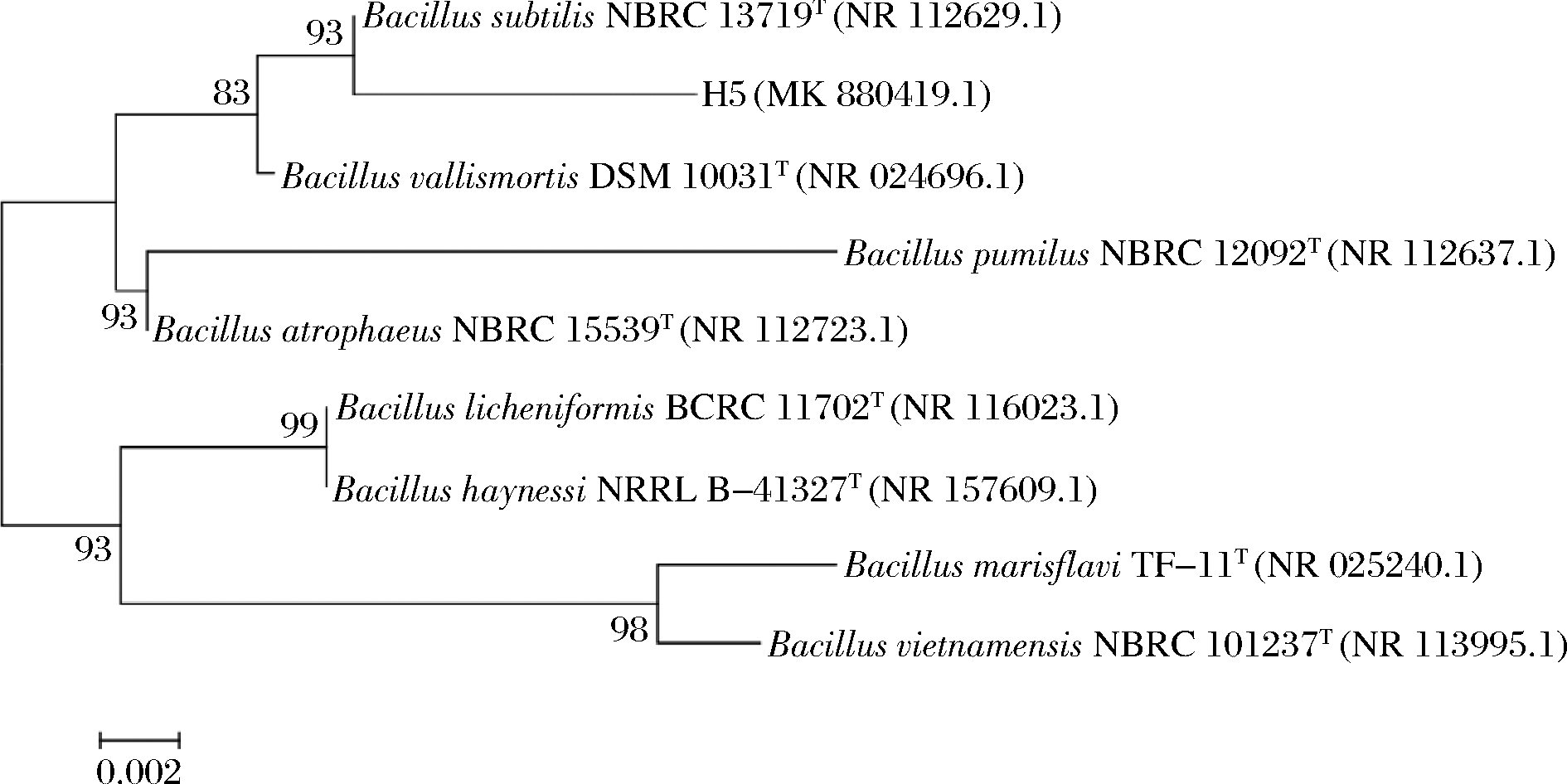
图2 基于16S rDNA基因序列构建的枯草芽胞杆菌H5 系统发育树
Fig.2 Phylogenetic tree of B.subtilis H5 based on 16S rDNA gene sequence
2.3 枯草芽胞杆菌H5的抑菌谱
如表3所示,通过对包括常见的致病菌和酵母菌在内的22株指示菌进行抑菌实验,发现B.subtilis H5对所有供试的9株革兰氏阳性菌、除嗜水气单孢菌以外的8株革兰氏阴性菌和3株酵母菌均有抑制作用,且对革兰氏阳性菌抑菌的抑制作用要大于革兰氏阴性菌。
表3 枯草芽胞杆菌抑菌谱
Table 3 Antimicrobial spectrum of B.subtilis H5
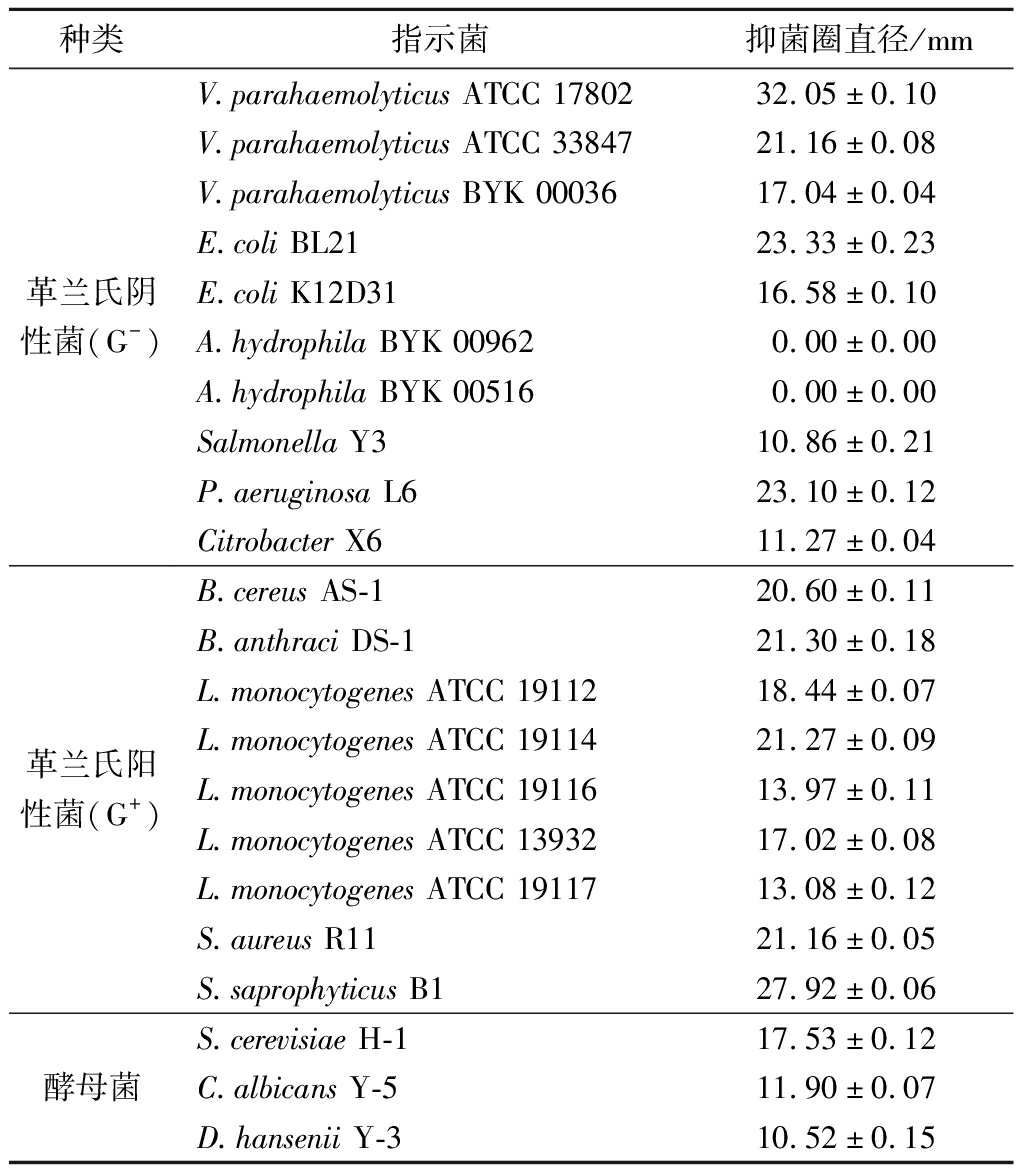
种类指示菌抑菌圈直径/mm革兰氏阴性菌(G-)V.parahaemolyticus ATCC 1780232.05±0.10V.parahaemolyticus ATCC 3384721.16±0.08V.parahaemolyticus BYK 00036 17.04±0.04E.coli BL2123.33±0.23E.coli K12D31 16.58±0.10A.hydrophila BYK 00962 0.00±0.00A.hydrophila BYK 005160.00±0.00Salmonella Y3 10.86±0.21P.aeruginosa L623.10±0.12Citrobacter X611.27±0.04革兰氏阳性菌(G+)B.cereus AS-1 20.60±0.11B.anthraci DS-121.30±0.18L.monocytogenes ATCC 1911218.44±0.07L.monocytogenes ATCC 19114 21.27±0.09L.monocytogenes ATCC 1911613.97±0.11L.monocytogenes ATCC 1393217.02±0.08L.monocytogenes ATCC 1911713.08±0.12S.aureus R1121.16±0.05S.saprophyticus B127.92±0.06酵母菌S.cerevisiae H-117.53±0.12C.albicans Y-511.90±0.07D.hansenii Y-310.52±0.15
B.subtilis H5对10株革兰氏阴性菌的抑菌圈直径在(10.86±0.21)~(32.05±0.10)mm,其中对副溶血性弧菌ATCC17802的抑制作用最强,其次是大肠杆菌和铜绿假单胞菌;其对9株革兰氏阳性菌的抑菌圈直径为(13.08±0.12)~(27.92±0.06)mm,其中对金黄色葡萄球菌、腐生葡萄球菌、蜡样芽胞杆菌和单核细胞增生李斯特菌ATCC19114有强烈的抑制作用。而朱晶婷[17]筛选出的枯草芽胞杆菌D9产生的抗菌肽仅对哈维氏弧菌、创伤弧菌、金黄色葡萄球菌有抑制作用,且抑菌圈直径均小于12.0 mm。此外,孙珊[18]筛选出的枯草芽胞杆菌W321所产抗菌肽可抑制沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌等10株致病菌。由此可见,B.subtilis H5所产的抑菌物质具有广谱的抑菌活性2。
2.4 枯草芽胞杆菌H5所产抑菌物质的理化性质
2.4.1 热稳定性
由图3可知,B.subtilis H5产生的抑菌物质在10~70 ℃下处理10 min时,其抑菌活性无显著变化;在80~100 ℃分别处理10和30 min后,其抑菌活性稍有下降,且在100 ℃条件下处理30 min,其抑菌活性仅下降了21%;在经过高压蒸汽灭菌(121 ℃,30 min)后,仍保留62%的抑菌活性。有学者研究发现,B.subtilis R75和H19产生的抗菌肽仅在121 ℃处理10 min后,其抑菌活性基本丧失,不能耐受高压蒸汽灭菌[9,19]。结果表明,B.subtilis H5产生的抑菌物质具有良好的热稳定性,可以在巴氏杀菌和高压蒸汽灭菌的条件下保持较高的抑菌活性,为其在食品加工业和医药行业中的应用奠定基础。
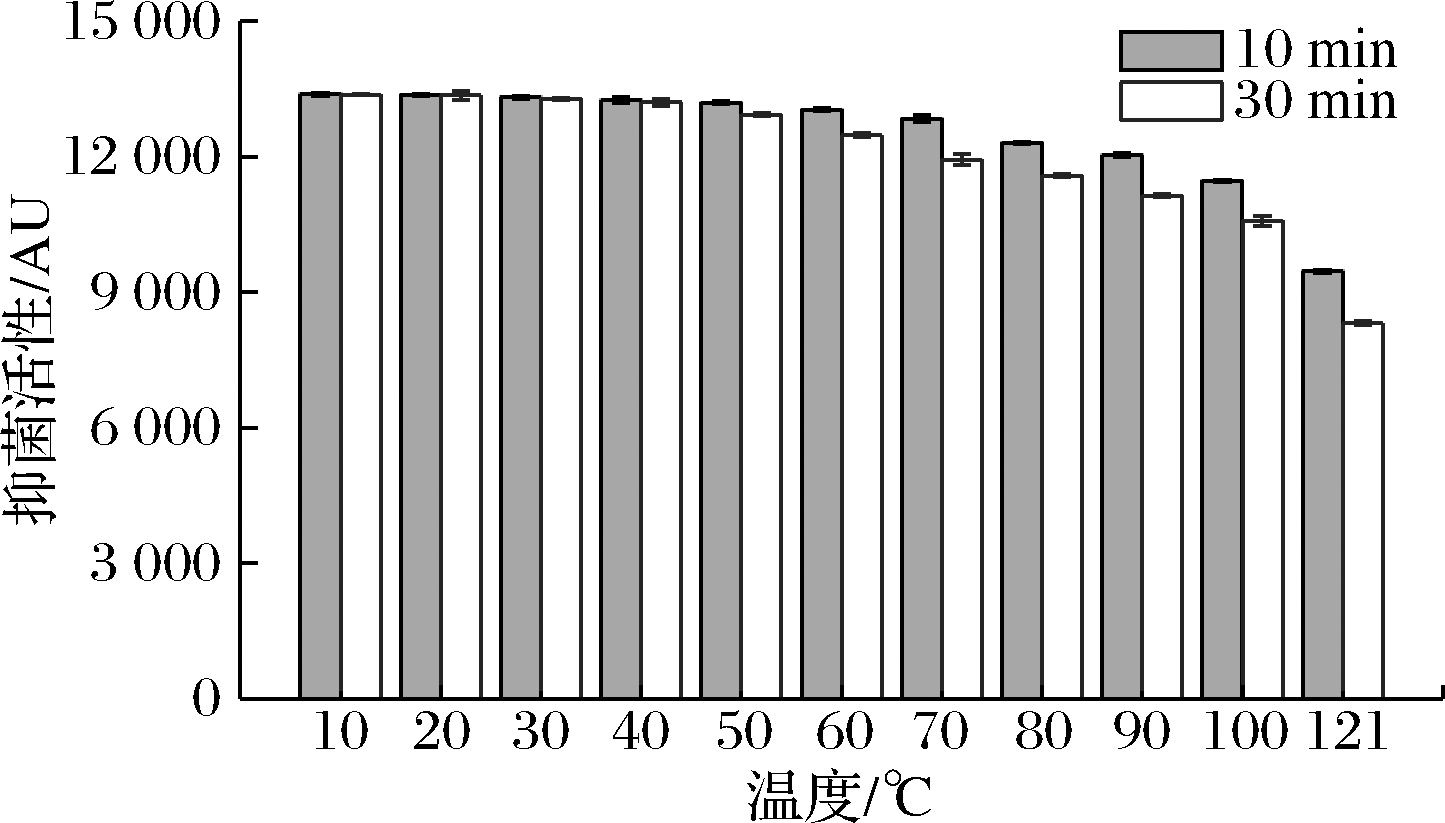
图3 温度对B.subtilis H5所产抑菌物质的影响
Fig.3 Effect of temperature on antimicrobial substance produced by B.subtilis H5
2.4.2 pH稳定性
由图4可知,B.subtilis H5产生的抑菌物质在中性和中酸性条件下的抑菌活性较高,在碱性条件下的抑菌活性略低于在酸性条件下的抑菌活性,尤其是在pH>9.0时,其抑菌活性明显下降。白杰等[20]和ANGELIKI[21]等的研究均表明抗菌肽在碱性环境中的活性损失更大,这与本研究的结果一致。另外,当pH值分别为2.0和12.0时,B.subtilis H5所产生的抑菌物质仍保留77%和67%的抑菌活性,说明其在极端酸碱的环境中仍可发挥明显的抑菌作用,而抗菌肽brevibacillin和brevibacillin V等在强酸强碱条件下基本失活[22]。结果表明,B.subtilis H5产生的抑菌物质有较好的酸碱稳定性,可耐受极端环境,有利于其在食品工业等领域的广泛应用。
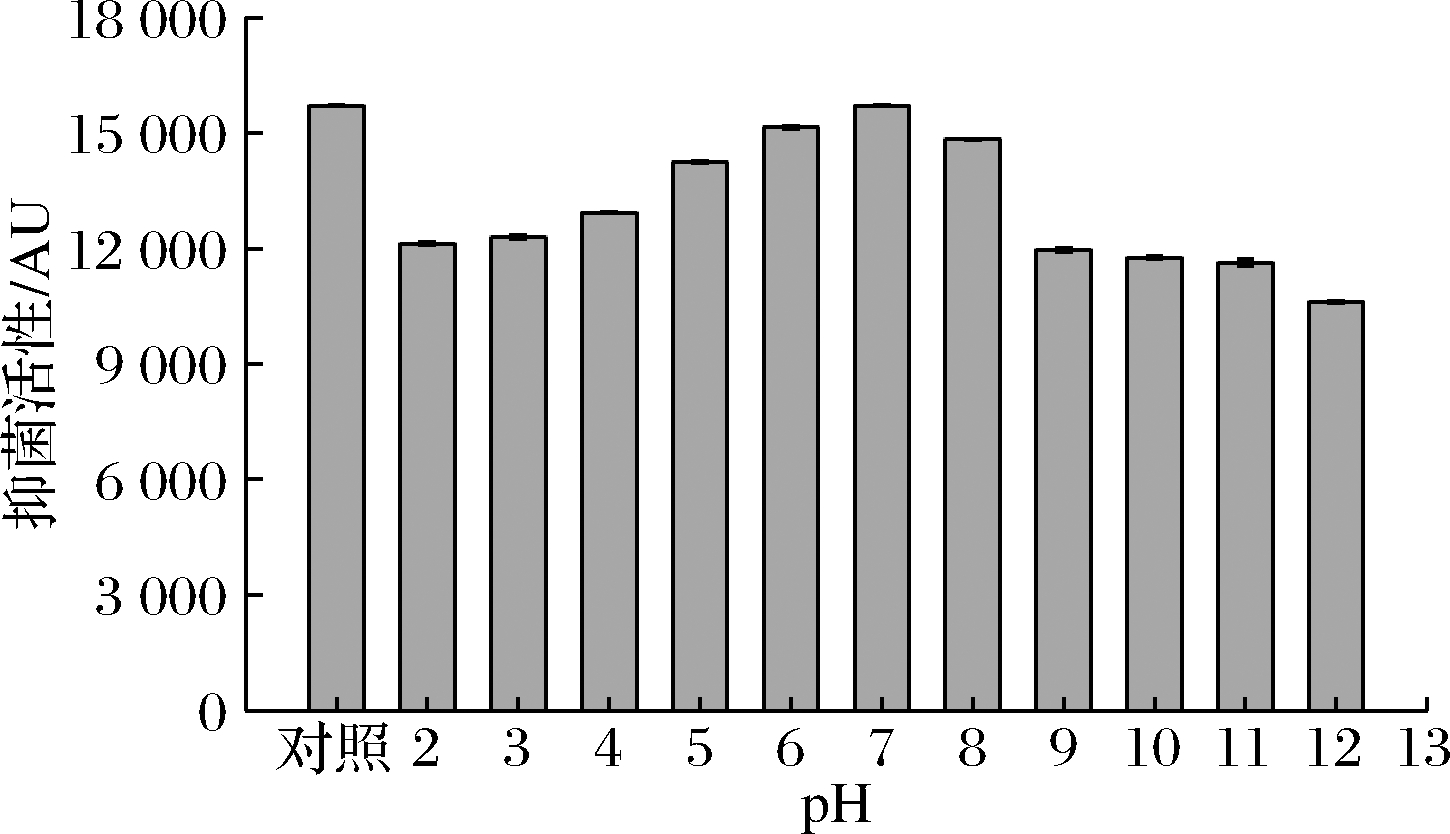
图4 pH对B.subtilis H5所产抑菌物质的影响
Fig.4 Effect of pH on antimicrobial produced by B.subtilis H5
2.4.3 紫外线稳定性
由图5可知,B.subtilis H5产生的抑菌物质经过紫外线照射处理10~60 min后,其抑菌活性基本无变化,表明其具有良好的紫外线稳定性。因此,可将紫外线杀菌技术和生物防腐剂联合应用于食品中,大大地提高食品的保鲜防腐效果,从而延长食品的保质期。
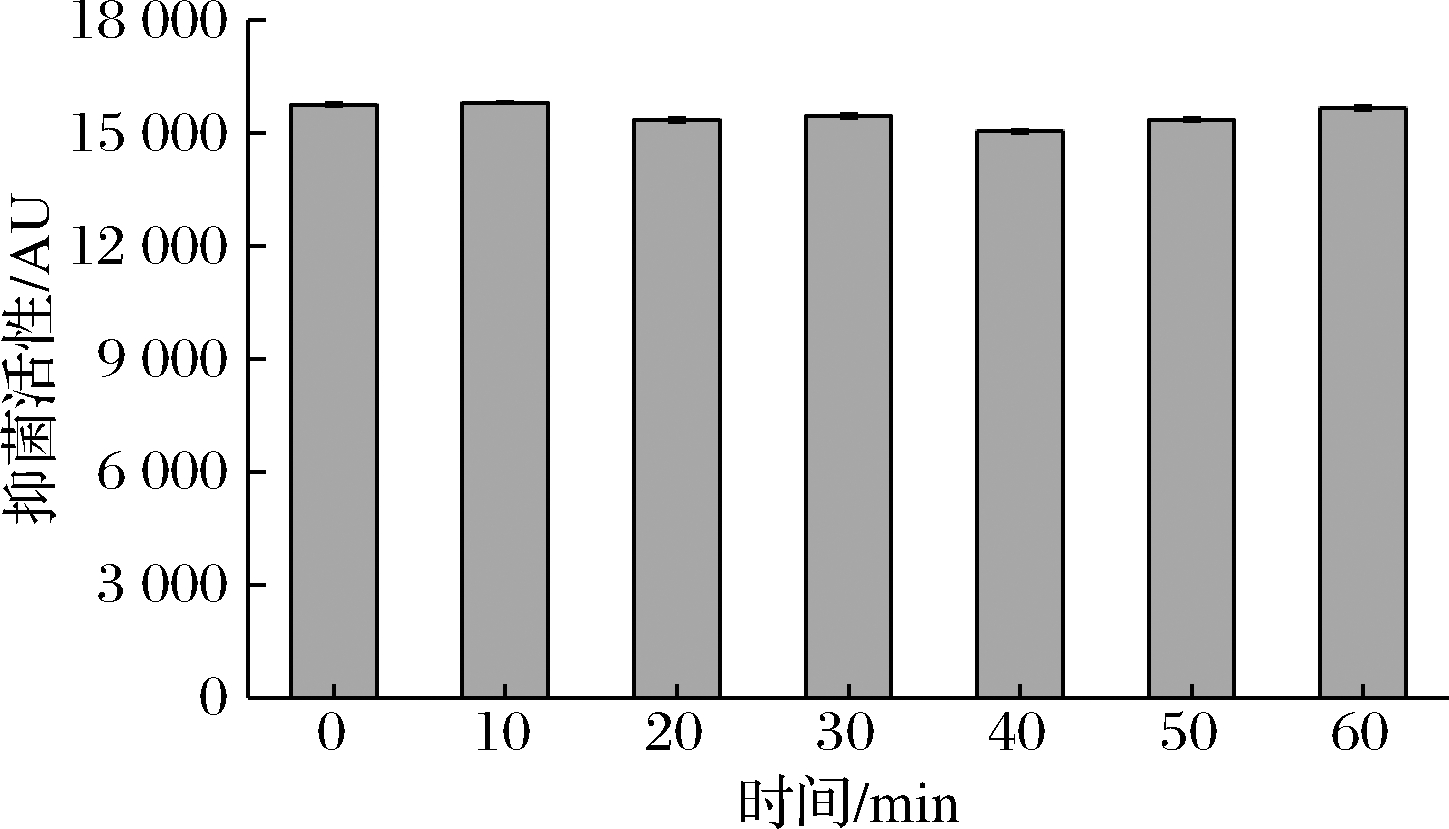
图5 紫外线对B.subtilis H5所产抑菌物质的影响
Fig.5 Effect of UV on antimicrobial substance produced by B.subtilis H5
2.4.4 有机溶剂稳定性
由图6可知,B.subtilis H5产生的抑菌物质分别与甲醇、乙醇、丙酮和乙腈在室温条件下作用2 h,发现其对4种有机溶剂具有较好的耐受能力,抑菌活性无明显变化,这为该抑菌物质的提取、分离纯化和分析提供了有力的理论依据[23]。
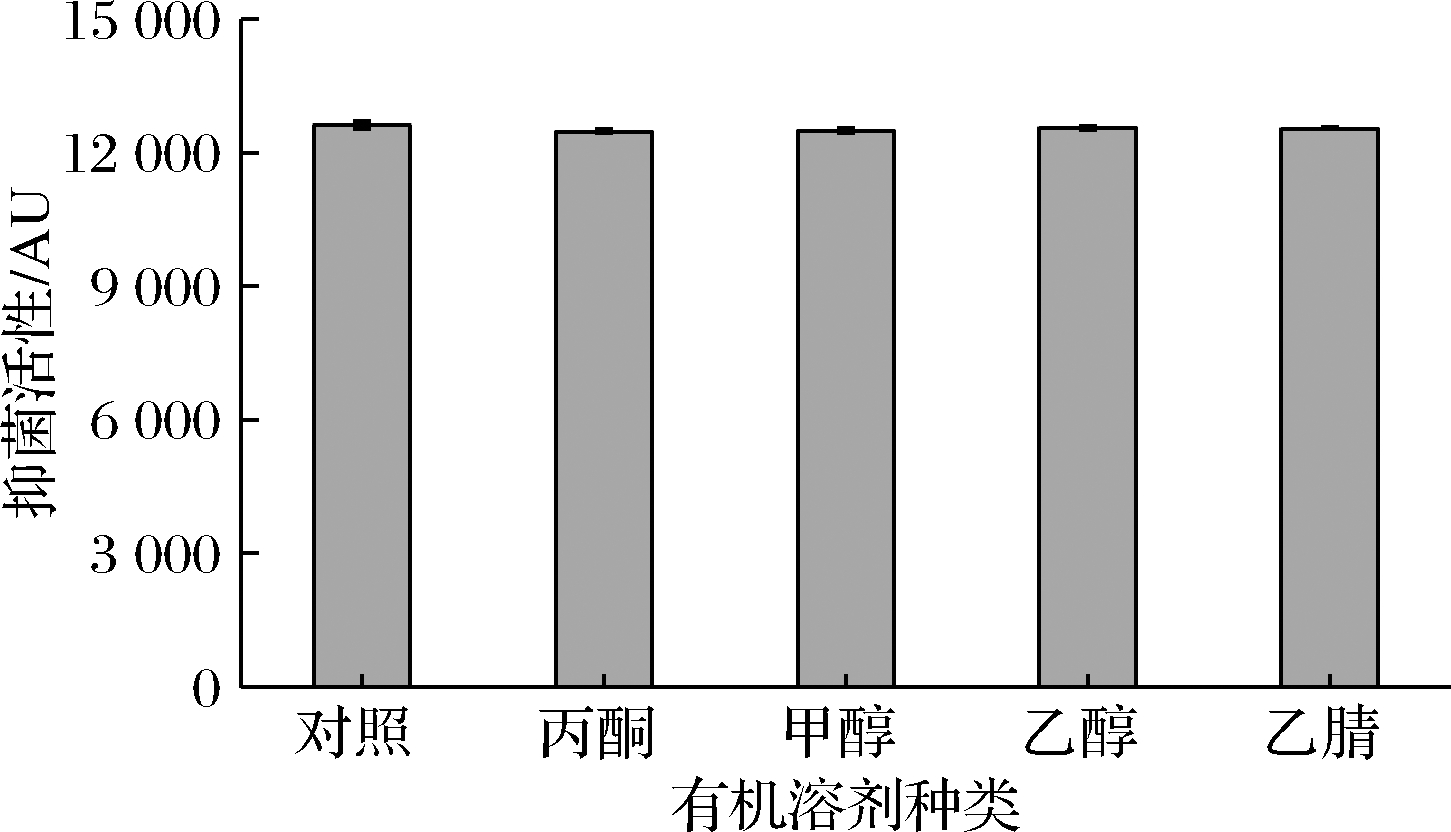
图6 有机溶剂对B.subtilis H5所产抑菌物质的影响
Fig.6 Effect of organic solvents on antimicrobial substance produced by B.subtilis H5
2.4.5 金属离子稳定性
由图7可知,供试的各种阳离子对B.subtilis H5所产抑菌物质的活性有不同程度的影响,10 mmol/L的Na+和Al3+对其抑菌活性基本无影响,Ca2+和Mg2+会抑制其约7%的抑菌活性,而Mn2+和Zn2+则可提高其抑菌活性。尚伟[24]的研究结果表明,Bacillus velezensis产生的抑菌物质同样会受到Ca2+的抑制,且高浓度的Mn2+会促进其抑菌活性。
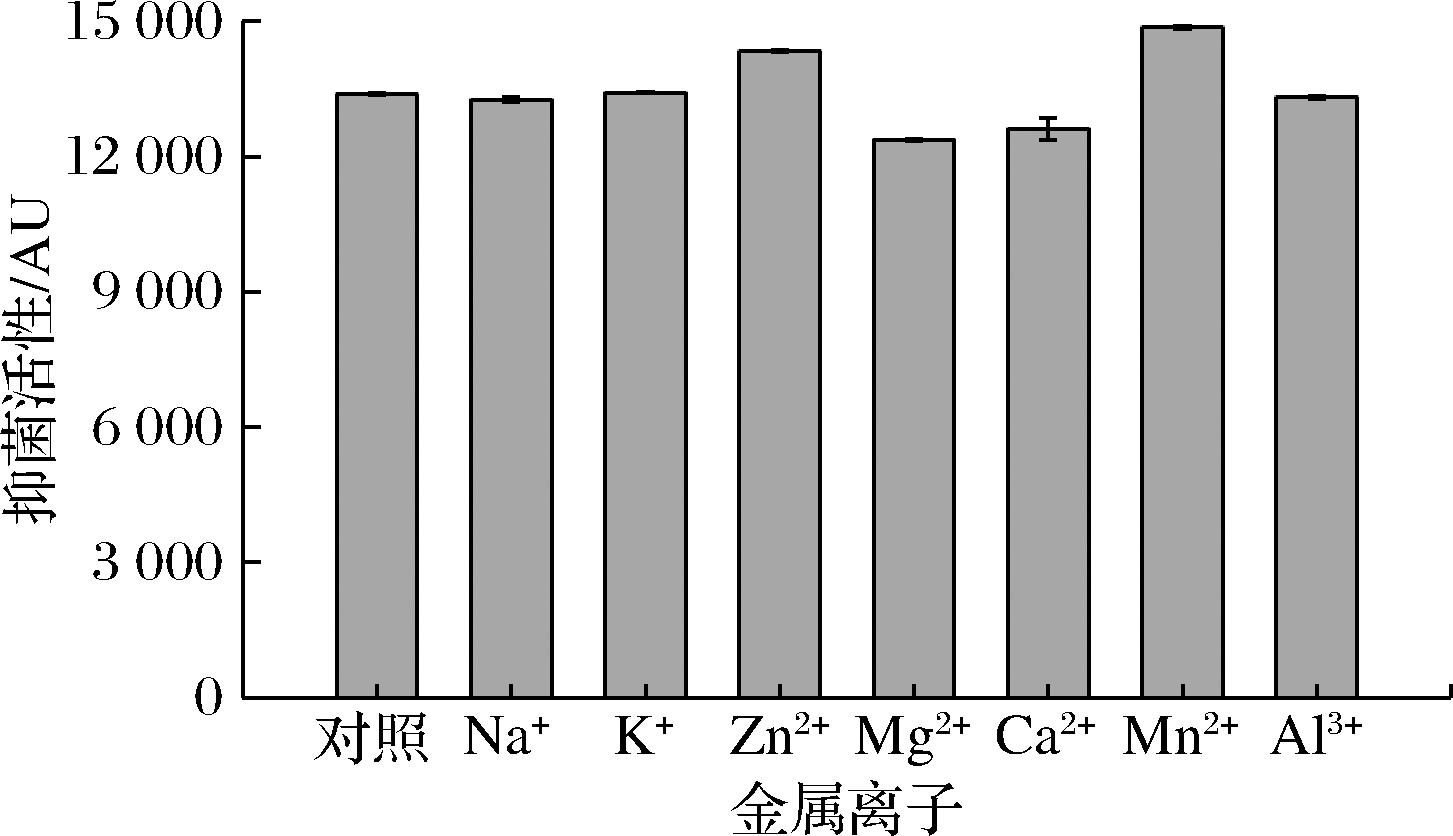
图7 金属离子对B.subtilis H5所产抑菌物质的影响
Fig.7 Effect of metal ions on antimicrobial substance produced by B.subtilis H5
2.4.6 酶稳定性
由图8可知,经过胃蛋白酶、碱性蛋白酶、蛋白酶K、木瓜蛋白酶、胰蛋白酶和中性蛋白酶处理后,B.subtilis H5所产抑菌物质的活性均有不同程度的下降,表明该抑菌物质属于蛋白质类或者肽类物质。其中,经木瓜蛋白酶、中性蛋白酶、胃蛋白酶和碱性蛋白酶处理后,抑菌物质的活性仅下降了9%~20%,说明其对大多数蛋白酶具有一定的耐受性,这与抗菌肽分子质量小和它可能有环状结构有关[25]。另外,B.subtilis H5产生的抑菌物质对蛋白酶K和胰蛋白酶最为敏感,尤其是在胰蛋白酶的作用下,其抑菌活性下降了约28%。
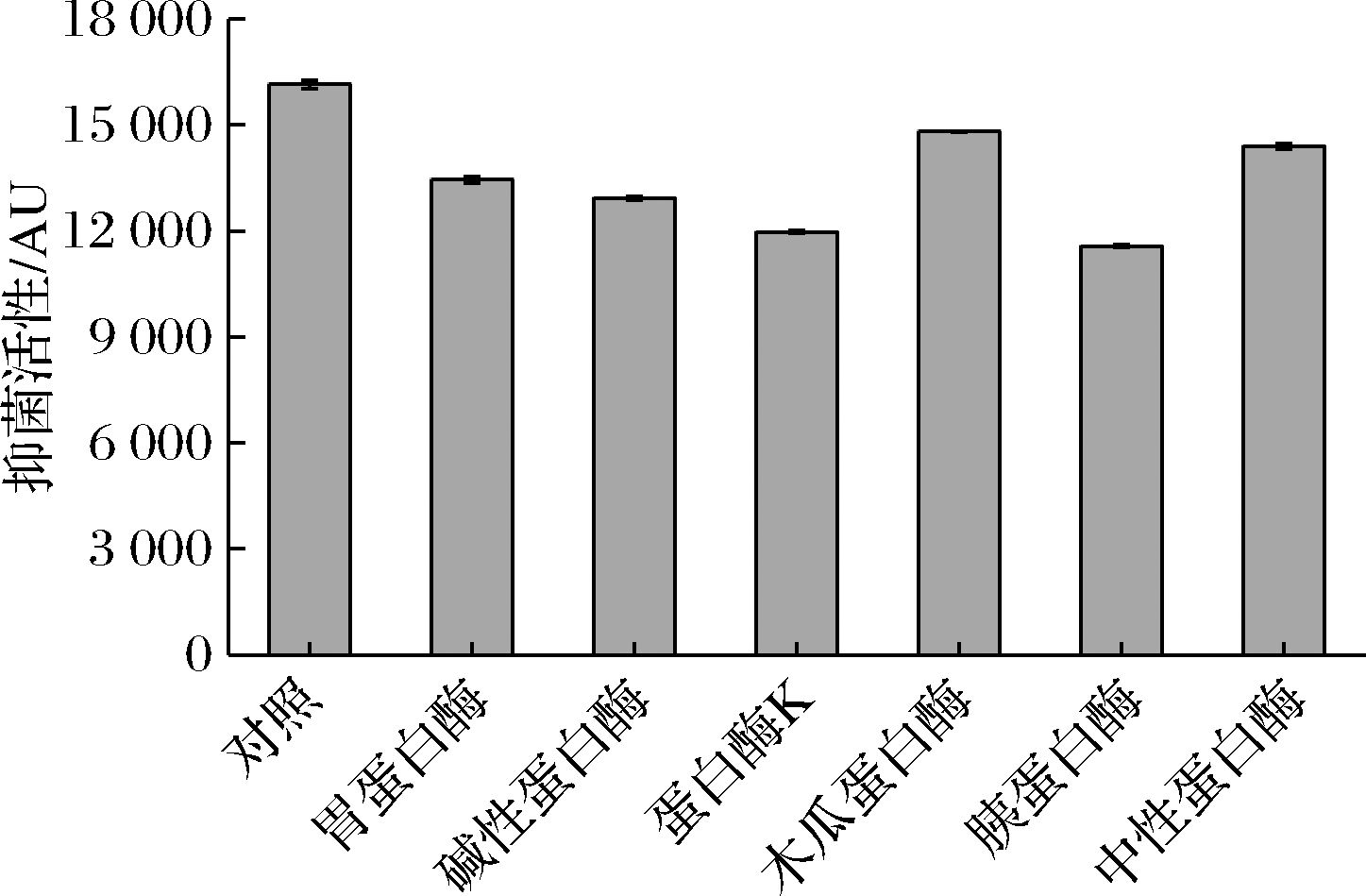
图8 蛋白酶对B.subtilis H5所产抑菌物质的影响
Fig.8 Effect of proteases on antimicrobial substance produced by B.subtilis H5
3 结论
枯草芽胞杆菌(Bacillus subtilis)是一种内生胞子的革兰氏阳性菌,在过去的几十年里,其产生抗菌物质的能力得到了广泛的认可[26]。本研究从芦潮港海泥中筛选出1株具有广谱抑菌性的枯草芽胞杆菌H5,尤其是对副溶血性弧菌、腐生葡萄球菌、大肠杆菌和铜绿假单胞菌有强烈的抑制作用。经过6种蛋白酶处理后,B.subtilis H5所产抑菌物质的活性均有不同程度的下降,可见其产生的抑菌物质属于蛋白质类或者肽类物质。通过对B.subtilis H5所产抗菌肽的理化性质进行研究,发现其具有良好的温度稳定性、紫外线稳定性和有机溶剂稳定性,可耐受高压蒸汽灭菌;可在较宽的pH范围内(2.0~11.0)保持活性,有利于其在食品工业等领域的广泛应用;10 mmol/L的Ca2+和Mg2+会抑制其抑菌活性,而Mn2+和Zn2+则可提高其抑菌活性,为其开发和应用提供了理论基础。与已报道的枯草芽胞杆菌产生的抗菌肽相比[9,17-18,25],枯草芽胞杆菌H5产生的抗菌肽不仅具有良好的稳定性,且抑菌谱更广,抑菌活性更强,在食品工业、畜牧业和医药行业等领域具有广阔的应用前景。本实验室将进一步对枯草芽胞杆菌H5所产抗菌肽的纯化、鉴定与抑菌机制等进行深入研究。
[1] 刘雪飞. 副溶血性弧菌拮抗菌的分离及其抑菌机理研究[D].沈阳:沈阳农业大学,2016.
LIU X F.Isolation and antibacterial mechanism of antagonistic bacteria against Vibrio parahaemolyticus[D].Shenyang:Shenyang Agricultural University,2016.
[2] MOK J S,RYU A,KWON J Y,et al.Distribution of Vibrio species isolated from bivalves and bivalve culture environments along the Gyeongnam coast in Korea:Virulence and antimicrobial resistance of Vibrio parahaemolyticus isolates[J].Food Control,2019,106:106697.
[3] BIERBAUM G,SAHL H G.Lantibiotics:Mode of action,biosynthesis and bioengineering[J].Current Pharmaceutical Biotechnology,2009,10(1):2-18.
[4] ALEXANDRE Y,LE BLAY G,BOISRAMÉ-GASTRIN S,et al.Probiotics:A new way to fight bacterial pulmonary infections?[J].Mèdecine et Maladies Infectieuses,2014,44(1):9-17.
[5] 孙力军, 王雅玲,陈宏.芽孢杆菌抗菌肽应用于海产品食源性病原菌控制研究展望[J].食品与发酵工业,2010,36(10):127-130.
SUN L J,WANG Y L,CHEN H.A prospect of research on Bacillus antimicrobial peptide application in the seafood safety control[J].Food and Fermentation Industries,2010,36(10):127-130.
[6] PU Y H,SUN L J,WANG Y L,et al.Modeling inhibitory activity of a novel antimicrobial peptide AMPNT-6 from Bacillus subtilis against Vibrio parahaemolyticus in shrimp under various environmental conditions[J].Food Control,2013,33(1):249-253.
[7] CHENG A C,LIN H L,SHIU Y L,et al.Isolation and characterization of antimicrobial peptides derived from Bacillus subtilis E20-fermented soybean meal and its use for preventing Vibrio infection in shrimp aquaculture[J].Fish and Shellfish Immunology,2017,67:270-279.
[8] LANDY M,ROSENMAN S B,WARREN G H.An antibiotic from Bacillus subtilis active against pathogenic fungi[J].Journal of Bacteriology,1947,54(1):24.
[9] 郝彦利, 汪立平,黄宇良,等.副溶血性弧菌拮抗菌的筛选鉴定及抑菌物质特性研究[J].食品与机械,2018,34(6):39-45;191.
HAO Y L,WANG L P,HUANG Y L,et al.Isolation and identification of antagonistic bacteria aganist Vibrio parahaemolyticus and its characteristics of antibacterial substances[J].Food & Machinery,2018,34(6):39-45;191.
[10] HUANG T P,ZHANG X J,PAN J R,et al.Corrigendum:Purification and characterization of a novel cold shock protein-like bacteriocin synthesized by Bacillus thuringiensis[J].Scientific Reports,2017,7:40975.
[11] WAN H F,LIU T,SU C W,et al.Evaluation of bacterial and fungal communities during the fermentation of Baixi sufu,a traditional spicy fermented bean curd[J].Journal of the Science of Food and Agriculture,2020,100(4):1 448-1 457.
[12] JAMALUDDIN N,ARIFF A B,WONG F W F.Purification of a bacteriocin-like inhibitory substance derived from Pediococcus acidilactici Kp10 by an aqueous micellar two-phase system[J].Biotechnology Progress,2019,35(1):e2719.
[13] ZHU X,ZHAO Y Z,SUN Y L,et al.Purification and characterisation of plantaricin ZJ008,a novel bacteriocin against Staphylococcus spp. from Lactobacillus plantarum ZJ008[J].Food Chemistry,2014,165:216-223.
[14] WANG Z X,WANG Y P,ZHENG L,et al.Isolation and characterization of an antifungal protein from Bacillus licheniformis HS10[J].Biochemical and Biophysical Research Communications,2014,454(1):48-52.
[15] 赵述淼. 猪源益生芽孢杆菌的分离筛选与应用研究[D].武汉:华中农业大学,2009.
ZHAO S M.Screening and application of a beneficial Bacillus from pigs[D].Wuhan:Huazhong Agricultural University,2009.
[16] GE J P,SUN Y Y,XIN X,et al.Purification and partial characterization of a novel bacteriocin synthesized by Lactobacillus paracasei HD1-7 isolated from Chinese sauerkraut juice[J].Scientific Reports,2016,6:19366.
[17] 朱晶婷. 副溶血性弧菌拮抗菌的筛选及其拮抗效果研究[D].舟山:浙江海洋大学,2019.
ZHU J T.Screening and antagonism characteristic of antagonistic bacteria against Vibrio parahaemolyticus[D].Zhoushan:Zhejiang Ocean University,2019.
[18] 孙珊, 郝林,王倩.枯草芽孢杆菌W321产抑菌物质的理化性质及抑菌谱研究[J].食品工业,2012,33(11):110-112.
SUN S,HAO L,WANG Q.Physical and chemical properties and antimicrobial spectrum of antibacterial substances from Bacillus subtilis W321[J].The Food Industry,2012,33(11):110-112.
[19] SHARMA N,KAPOOR R,GAUTAM N,et al.Purification and characterization of bacteriocin produced by Bacillus subtilis R75 isolated from fermented chunks of mung bean(Phaseolus radiatus)[J].Food Technology and Biotechnology,2011,49(2):169-176.
[20] 白杰, 贠建民,祝发明,等.枯草芽孢杆菌菌株B3抗菌肽的分离纯化与鉴定[J].食品与发酵工业,2018,44(8):78-85.
BAI J,YUN J M,ZHU F M,et al.Isolation,purification and identification of antibacterial peptide from Bacillus subtilis strain B3[J].Food and Fermentation Industries,2018,44(8):78-85.
[21] KARAGIOTA A,TSITSOPOULOU H,TASAKIS R N,et al.Characterization and quantitative determination of a diverse group of Bacillus subtilis subsp.subtilis NCIB 3610 antibacterial peptides[J].Probiotics and Antimicrobial Proteins,2021,13(2):555-570.
[22] WU Y B,ZHOU L B,LU F X,et al.Discovery of a novel antimicrobial lipopeptide,brevibacillin V,from Brevibacillus laterosporus fmb70 and its application on the preservation of skim milk[J].Journal of Agricultural and Food Chemistry,2019,67(45):12 452-12 460.
[23] BURIANEK L L,YOUSEF A E.Solvent extraction of bacteriocins from liquid cultures[J].Letters in Applied Microbiology,2000,31(3):193-197.
[24] 尚伟. 抗兔腹泻芽孢杆菌Tu-569菌株的筛选、发酵及应用[D].保定:河北农业大学,2012.
SHANG W.Screening,fermentation and application of Bacillus velezensis strain Tu-569 against diarrhea of rabbits[D].Baoding:Hebei Agricultural University,2012.
[25] 刘静, 王军,姚建铭,等.枯草芽孢杆菌JA抗菌物特性的研究及抗菌肽的分离纯化[J].微生物学报,2004,44(4):511-514.
LIU J,WANG J,YAO J M,et al.Properties of the crude extract of Bacillus subtilis and purification of antimicrobial peptides[J].Acta Microbiologica Sinica,2004,44(4):511-514.
[26] STEIN T.Bacillus subtilis antibiotics:Structures,syntheses and specific functions[J].Molecular Microbiology,2005,56(4):845-857.