贵州红酸汤是以鲜辣椒、鲜西红柿为主要原料,通过发酵法生产的半固态传统发酵食品,具有色泽红亮,香味浓郁,酸味醇厚的特点[1]。根据原料种类不同,贵州红酸汤分为辣椒红酸汤[2]、西红柿红酸汤[3]、辣椒与西红柿混合红酸汤[4]。辣椒作为红酸汤主要原料,季节性明显,为延长辣椒保质期并降低生产成本,工厂通常会对新鲜红辣椒进行高盐盐渍保藏,发酵时再将辣椒进行脱盐处理,脱盐时辣椒营养、风味等物质流失严重并带来水污染问题[5]。筛选耐盐乳酸菌,在高盐条件下直接生产红酸汤有利于简化生产工序、有效减少环境污染,保持产品色泽和营养。
乳酸菌属是红酸汤发酵的优势菌属,约占微生物菌群78.05%~90.26%,也是酸汤风味形成的核心微生物菌属[6]。研究表明,食盐可促进酸汤风味形成,延长保质期,但食盐浓度过高会抑制乳酸菌生长代谢,导致酸汤有机酸含量低、风味不足[7]。因此,筛选耐高盐胁迫且产酸能力强的菌株更适于酸汤工业化生产。诱变育种可改良菌株遗传特性,紫外诱变具有经济、稳定性好的特点,广泛应用于食品工业诱变育种[8]。
乳酸菌具有良好的益生功能,如降胆固醇[9]、增强免疫力[10]、抗氧化[11]等,但需其耐受人体消化才能充分发挥益生功能。本研究从传统发酵辣椒中筛选一株耐盐乳酸菌,并通过二轮紫外诱变进一步提高乳酸菌耐盐产酸能力,同时比较原始菌株和突变菌株的耐受性,包括耐酸、耐胆盐、耐人工模拟胃肠液、耐盐能力,以期为高盐红酸汤生产提供发酵菌株,从而简化辣椒脱盐工序,提高生产效率,降低生产成本,缓解工业化生产过程中红酸汤主要原料辣椒脱盐处理时所带来的营养成分流失和水污染问题。
1 材料与方法
1.1 材料与试剂
传统发酵辣椒制品,湖南邵阳农家,要求总酸>10 g/kg,NaCl添加量(以质量分数计)>6%。
MRS肉汤,杭州百思生物技术有限公司;乳酸菌成套生化鉴定管,青岛高科园海博生物技术有限公司;人工模拟胃液、人工模拟肠液,广州臻萃质检技术服务公司;其他试剂无特别说明来自国药集团化学试剂有限公司。
1.2 仪器与设备
EL340多功能酶标仪,美国Bio-Tek公司;SW-CJ-2FD(标准)双人单面净化工作台,苏州智净净化设备有限公司;IS-RDD3恒温振荡器,上海珂淮仪器有限公司;TG16K-II台式高速离心机,长沙艾迪生物科技有限公司;HWS智能型恒温培养箱,宁波江南仪器厂。
1.3 实验方法
1.3.1 耐盐乳酸菌筛选
1.3.1.1 初筛
参考熊蝶等[12]的方法称取样品,选择合适梯度稀释。每个稀释度吸取100 μL样液涂布于含1%(质量分数) CaCO3的MRS固体培养基,36 ℃,48 h培养。挑取含溶钙圈的疑似菌落,平板划线分离纯化得到单菌落,进行革兰氏染色与接触酶实验。挑选G+、接触酶阴性的单菌落并编号,于MRS液体培养基活化,接种量2%(接种量以体积分数计,下同)于质量浓度为0、40、70、100、130、160、200 g/L NaCl的MRS液体培养基,36 ℃,24 h培养,酶标仪测定OD600,挑选最高盐浓度下的D70菌株,接种2%于40、50、60、70、80、90、100 g/L的MRS液体培养基,选择D70最高的5株菌进行复筛。D70按公式(1)计算:
(1)
式中:D70,OD600值比值大于70%,%;Ax,不同NaCl质量浓度下的菌株OD600值;A0,不含NaCl下的菌株OD600值。
1.3.1.2 复筛
将复筛菌株活化,接种2%于70 g/L NaCl的MRS液体培养基中,37 ℃培养,每2 h取样,测定OD600、总酸含量,选择菌株活力、产酸能力最强的菌株进行后续实验。
1.3.2 总酸测定
参考GB/T 12456—2008《食品中总酸的测定方法》中酸碱滴定法,以乳酸计。
1.3.3 耐盐乳酸菌鉴定
生理生化鉴定:乳酸菌成套生化鉴定管;16S rDNA测序:活化的菌液于湖南擎科生物科技有限公司进行16S rDNA测序,MEGA 7.0绘制系统进化树,最终确定菌株种属。
1.3.4 紫外诱变及传代稳定性
1.3.4.1 紫外诱变时间的选择
活化菌株,4 ℃、8 000 r/min离心10 min,无菌生理盐水洗涤2次,稀释菌液至107CFU/mL,取2 mL菌液于9 cm培养皿中,无菌条件下打开皿盖,紫外(30 W,30 cm)分别照射0、5、10、15、20、25、30 s。紫外诱变后的菌液适当稀释后取200 μL涂布于含1% CaCO3的MRS平板,37 ℃培养48 h,平板计数,按公式(2)计算致死率,为避免光修复稀释涂布培养等操作应避光或在黄光、红光下进行[13]。
(2)
式中:R,致死率,%;C0:诱变前活菌浓度,CFU/mL;C1:诱变后活菌浓度,CFU/mL。
1.3.4.2 紫外诱变及突变菌株稳定性测定
将紫外诱变后的菌液适当稀释,取200 μL涂布于1% CaCO3的MRS培养基,37 ℃培养48 h。挑取溶钙圈较大,菌体稠厚的菌落接种于含80 g/L NaCl的MRS液体培养基中培养,测定OD600值、总酸。以原始菌株为对照,对耐盐、产酸量最高的乳酸菌进行二次紫外诱变并筛选出耐盐高产酸菌株,将该菌株连续培养10代,检测每代耐盐产酸性,并观察其发酵稳定性。
1.3.5 耐盐乳酸菌的耐受性
1.3.5.1 耐酸能力的测定
活化菌株,接种5%至 pH 值为2.0、3.0、4.0 的MRS培养基中,37 ℃培养3 h,活菌计数,计算存活率,即接种培养3 h前后活菌数的比值。
1.3.5.2 耐胆盐能力的测定
活化菌株,接种5%于质量浓度为 1、2、3、4 g/L猪胆盐的MRS培养基中,37 ℃培养3 h,活菌计数。
1.3.5.3 耐人工模拟胃肠液能力的测定
参照张林奇等[14]的方法修改,活化菌株,4 ℃、8 000 r/min离心10 min,无菌生理盐水洗涤2次,吸取1 mL菌液接种于9 mL人工模拟胃液,37 ℃培养2 h,活菌计数,再取经人工模拟胃液处理后的菌液1 mL接种至9 mL人工模拟肠液,37 ℃培养8 h,每2 h活菌计数。
1.3.5.4 耐盐能力的测定
活化菌株,接种5%于70、80、90、100 g/L NaCl的MRS培养基中,37 ℃培养3 h,取样活菌计数。
1.3.6 数据处理
所有试验重复3次,数据用“数值±标准差”表示。采用SPSS 22进行统计学分析,Origin 2018作图。
2 结果与分析
2.1 耐盐乳酸菌筛选
对耐盐产酸菌株进行初筛,挑选含溶钙圈的菌落划线纯化,共68株菌,均为革兰氏染色阳性、过氧化氢酶实验阴性菌。将68株菌分别于0~200 g/L不同NaCl质量浓度下培养,NaCl质量浓度最高为70 g/L时满足D70的菌株有14株,将14株菌分别于40~100 g/L不同NaCl质量浓度下培养,选择D70含量最高的5株菌进行复筛,菌株编号分别为L-8、L-14、L-22、L-29、L-31。
对初筛得到的5株菌进行复筛,并绘制不同菌株在70 g/L NaCl浓度下的OD600及产酸曲线。如图1所示,筛选的菌株均具有良好的耐盐产酸特性。其中L-14菌株与其他菌株相比,在0~10 h时菌株活力与产酸能力略为滞后,在12 h时与其他菌株基本持平,12 h后OD600与产酸能力显著高于其他菌株(P<0.05),并于26 h进入稳定期,OD600最高达(1.736±0.05),总酸含量达(13.838±0.11) g/kg。这是因为在发酵初期,菌株处于适应阶段,生长代谢缓慢,进入对数生长期后,迅速繁殖代谢产酸。不同菌株的生长代谢能力不同,其中菌株L-14在70 g/L NaCl下产酸能力最强,因此选择L-14菌株进行下一步实验。

a-生长曲线;b-产酸曲线
图1 不同菌株在70 g/L NaCl浓度下的生长产酸曲线
Fig.1 Growth and acid production curves of different strains under 70 g/L NaCl
2.2 耐盐乳酸菌的鉴定
2.2.1 生理生化鉴定
菌株生理生化结果如表1,参考《乳酸细菌分类鉴定及实验方法》[15],初步确定菌株L-14为植物乳杆菌属。
表1 菌株生理生化鉴定结果
Table 1 Physiological and biochemical identification results of strain L-14

项目结果项目结果革兰氏染色+蔗糖+过氧化氢酶-乳糖+硝酸盐还原-山梨醇+葡萄糖产酸+棉籽糖+明胶液化+阿拉伯糖+甘露糖+纤维二糖+鼠李糖-七叶苷+木糖+水杨苷+
2.2.2 16S rDNA测序
纯化后的菌液送至湖南擎科生物科技测序,测序结果与NCBI中的GenBank数据库进行BLAST比对,MEGA8软件中的邻接法(neighbour-joining,NJ) 构建系统发育树,如图2所示。菌株L-14与植物乳杆菌L.plantarum 6641(登录号:MT_463 849.1)相似度100%,结合生理生化鉴定和16S rDNA测序结果,进一步确定菌株L-14为植物乳杆菌。
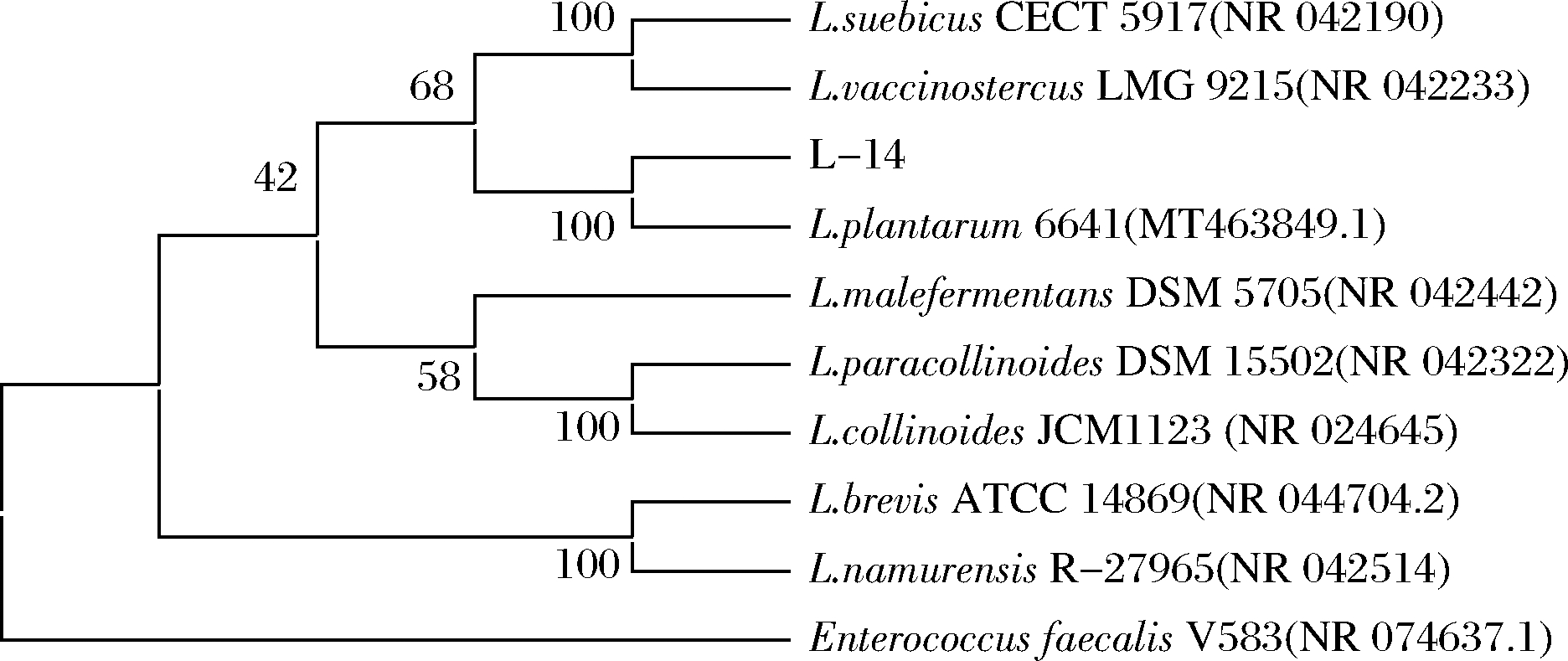
图2 菌株L-14的系统发育树
Fig.2 Phylogenetic tree of strain L-14
2.3 耐盐乳酸菌紫外诱变及遗传稳定性
2.3.1 诱变时间的选择
菌株在30 W、30 cm条件下紫外诱变,结果如图3所示,紫外照射20 s时出现90%以上的致死率。由于紫外诱变后DNA产生嘧啶二聚体,导致基因突变,根据70%~80% 致死率可提高菌株正向突变率的观点[13],紫外照射15 s时,菌株L-14致死率为79.05%,因此选择15 s为紫外诱变最佳时间。
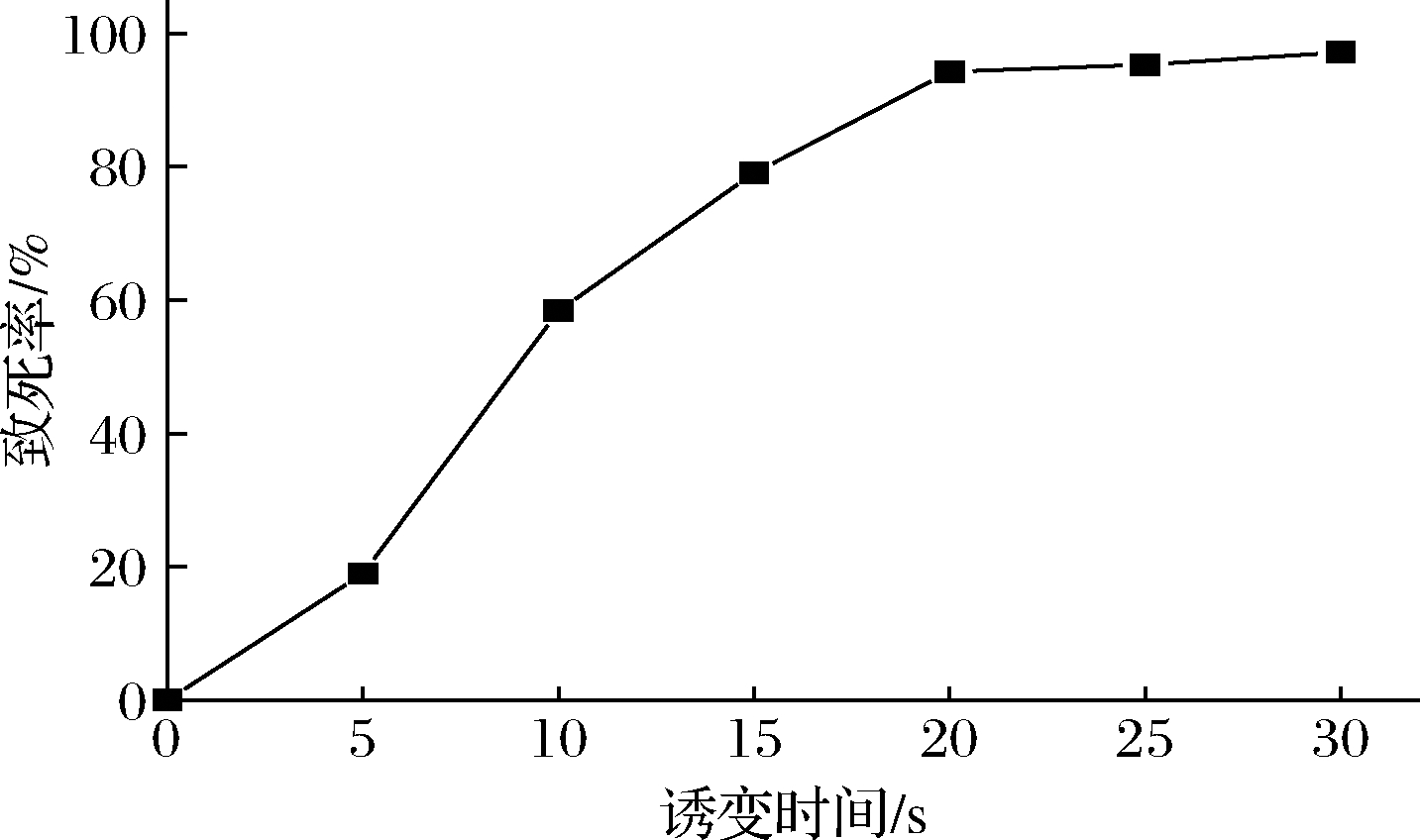
图3 诱变时间对菌株L-14的致死率的影响
Fig.3 Effect of mutagenesis time on the lethality of strain L-14
2.3.2 耐盐乳酸菌的诱变育种
对L-14菌悬液紫外照射15 s,结果如表2所示,正向突变菌株(OD600>0.347)共计23株,在80 g/L NaCl下其产酸量均高于原始菌株,其中L14U1-16菌株产酸量最高,达8.833 g/kg,较原始菌株产酸量(7.770 g/kg)提高13.68%,故选择L14U1-16进行二轮紫外诱变。
表2 一轮紫外诱变下的突变菌株产酸情况
Table 2 Acid production of mutant strains under one round of UV mutation
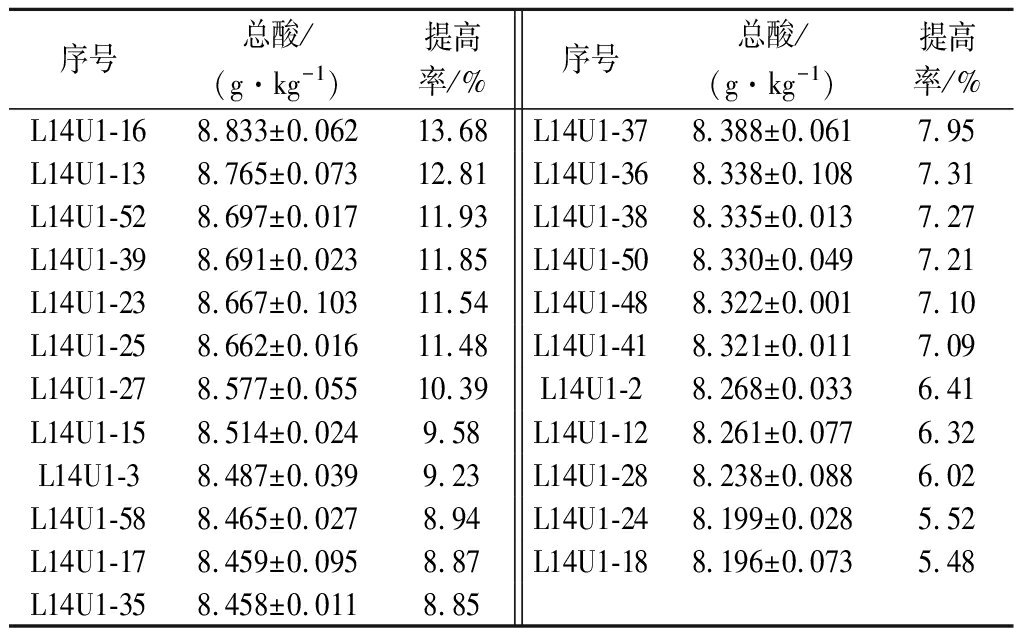
序号总酸/(g·kg-1)提高率/%序号总酸/(g·kg-1)提高率/%L14U1-168.833±0.06213.68 L14U1-378.388±0.0617.95 L14U1-138.765±0.07312.81L14U1-368.338±0.1087.31L14U1-528.697±0.01711.93L14U1-388.335±0.0137.27L14U1-398.691±0.02311.85L14U1-508.330±0.0497.21L14U1-238.667±0.10311.54L14U1-488.322±0.0017.10L14U1-258.662±0.01611.48L14U1-418.321±0.0117.09L14U1-278.577±0.05510.39L14U1-28.268±0.0336.41L14U1-158.514±0.0249.58L14U1-128.261±0.0776.32L14U1-38.487±0.0399.23L14U1-288.238±0.0886.02L14U1-588.465±0.0278.94L14U1-248.199±0.0285.52L14U1-178.459±0.0958.87L14U1-188.196±0.0735.48L14U1-358.458±0.0118.85
由表3可知,二轮紫外诱变的正向突变菌株(OD600>0.347)共计24株,在80 g/L NaCl下其产酸量均高于原始菌株,其中L14U2-3菌株产酸量最高,达8.989 g/kg,较原始菌株产酸量(7.770 g/kg)提高15.69%,较L14U1-16提高1.77%。
表3 二轮紫外诱变下的突变菌株产酸情况
Table 3 Acid production of mutant strains under two rounds of UV mutation
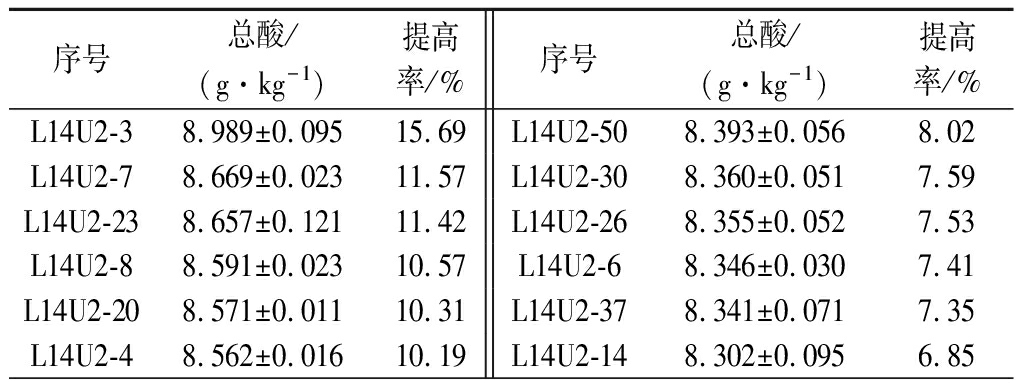
序号总酸/(g·kg-1)提高率/%序号总酸/(g·kg-1)提高率/%L14U2-38.989±0.09515.69L14U2-508.393±0.0568.02L14U2-78.669±0.02311.57L14U2-308.360±0.0517.59L14U2-238.657±0.12111.42L14U2-268.355±0.0527.53L14U2-88.591±0.02310.57L14U2-68.346±0.0307.41L14U2-208.571±0.01110.31L14U2-378.341±0.0717.35L14U2-48.562±0.01610.19L14U2-148.302±0.0956.85
续表3

序号总酸/(g·kg-1)提高率/%序号总酸/(g·kg-1)提高率/%L14U2-178.526±0.0359.73L14U2-98.293±0.0276.73L14U2-318.514±0.0279.65L14U2-108.287±0.1166.65L14U2-168.477±0.0159.10L14U2-28.222±0.0575.82L14U2-518.447±0.0178.71L14U2-288.153±0.0574.93L14U2-188.436±0.1188.57L14U2-58.096±0.0774.20L14U2-408.395±0.0338.04L14U2-18.091±0.0804.13
2.3.3 诱变菌株的遗传稳定性
分别将L14U2-3和L14U1-16置于80 g/L NaCl条件下传代培养10次,测定产酸稳定性。由表4可知,L14U2-3稳定性最好,传代过程中产酸无显著性差异,且L14U1-16呈现出显著性差异(P<0.05),遗传性状不够稳定,故选择菌株L14U2-3进行后续实验。
表4 突变菌株产酸稳定性 单位:g/L
Table 4 Acid production stability of mutant strains

传代次数L14U1-16产酸量L14U2-3产酸量18.833±0.062a8.959±0.095a28.831±0.058a8.991±0.001a38.829±0.001a8.991±0.023a48.836±0.021a8.994±0.01a58.824±0.012a8.983±0.022a68.829±0.014a8.992±0.019a78.828±0.044a8.984±0.002a88.821±0.035a8.988±0.013a98.250±0.011b8.994±0.012a108.823±0.030a8.992±0.003a
注:同一列中不同字母表示差异显著(P<0.05)
2.4 耐盐乳酸菌耐受性测定
乳酸菌的益生功能可分为肠道功能、免疫功能、代谢功能[16]。乳酸菌在人体充分发挥益生功能的前提是其能否耐受人体胃肠环境。
2.4.1 耐酸能力测定
乳酸菌在低pH环境(pH 2~3.5)中生存是适应人体胃液环境的必要条件之一[17],由图4可知,2株菌均具有良好的耐酸能力,随着pH增加,存活率均显著增加(P<0.05),在相同pH条件下,突变菌株L14U2-3存活率均高于原始菌株L-14。其中在pH 2.0时培养3 h后L-14、14U2-3存活率均高于80%,分别为(81.75±2.34)%、(85.09±1.99)%,L14U2-3较L-14存活率提高4.09%,这与蒙月月等[18]的研究相似。2株菌株存活率均随pH增大而增大,这是由于pH 较低时破坏了菌株胞内pH的动态平衡,使胞内pH随环境pH下降,从而改变细胞膜通透性,影响其对外界营养物质的吸收利用,使其生长受到抑制或延滞期延长,甚至死亡[19]。
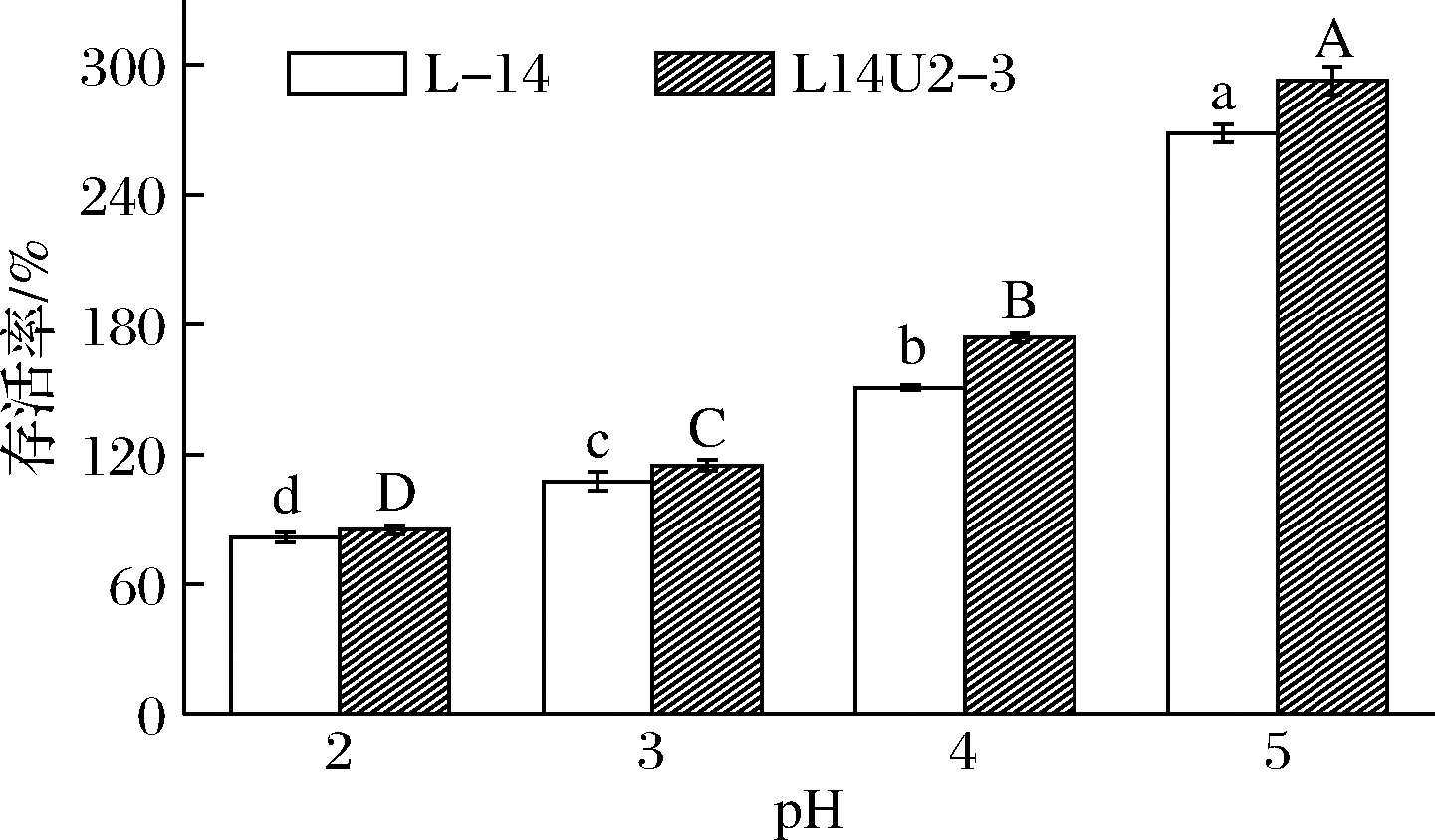
图4 乳酸菌耐酸能力的测定
Fig.4 Acid tolerance of lactic acid bacteria 注:不同字母表示同一菌株组间差异显著(P<0.05)(下同)
2.4.2 耐胆盐能力测定
将菌株L-14、L14U2-3分别置于含胆盐培养基中培养,模拟人体小肠胆盐浓度(0.3~3 g/L)波动[20]。由图5可知,菌株活菌数均随胆盐浓度升高而显著降低(P<0.05),当胆盐质量浓度为3 g/L时,活菌数均高于106 CFU/mL,分别为(6.33±0.02)和(6.01±0.33)lg CFU/mL,突变菌株L14U2-3较原始菌株L-14活菌数提高5.32%,由陈仪婷等[21]筛选的植物乳杆菌YXB12在3 g/L胆盐下活菌数为0,相比之下两株菌株对胆盐具有更好的耐受性。可能原因是植物乳杆菌自身具有几种耐受胆盐的系统和机制,在胆盐胁迫下,分子伴侣蛋白dnaK、groES等7种应激基因转录水平上调,从而提高其胆盐耐受能力[22]。
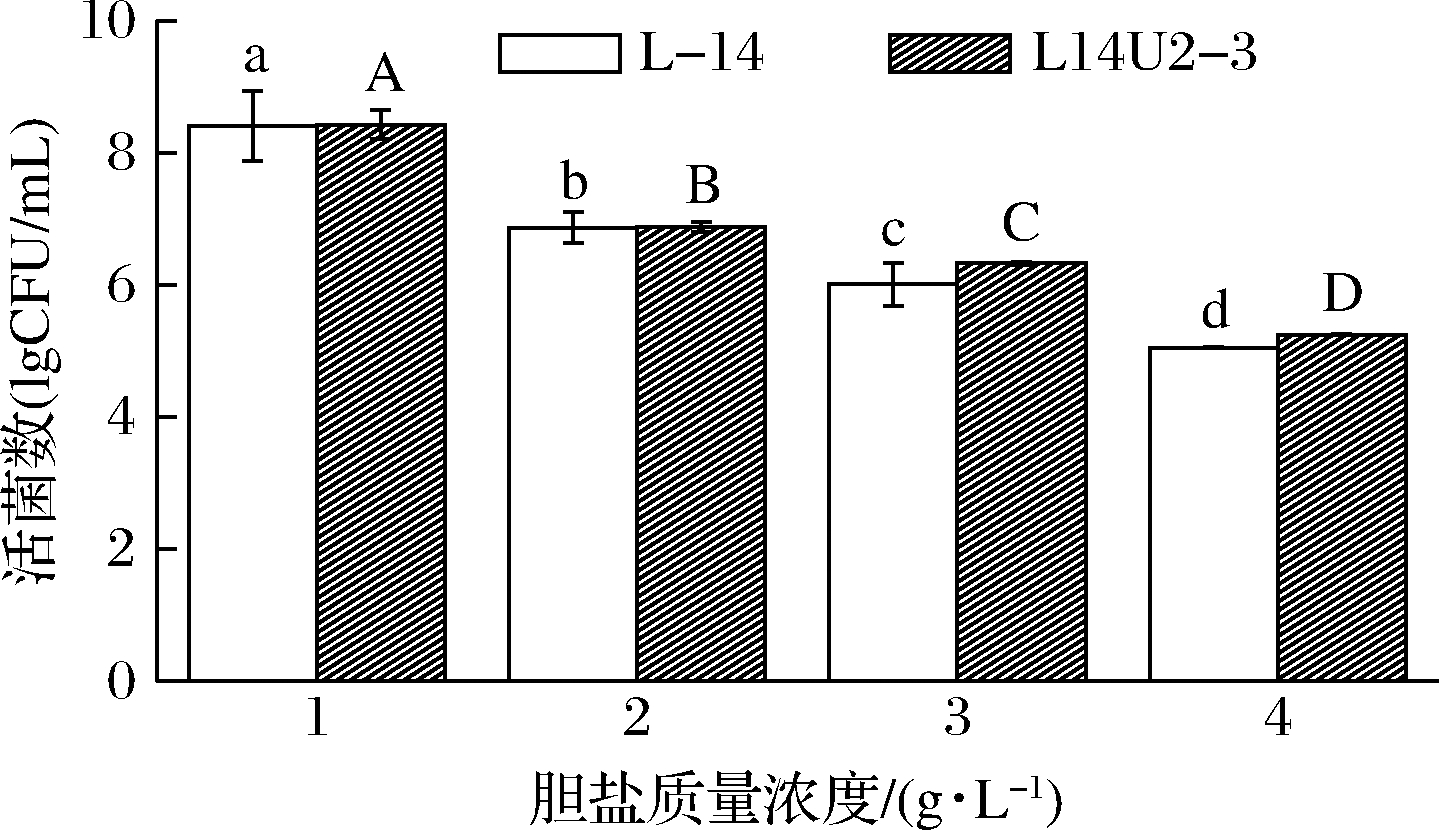
图5 乳酸菌耐胆盐能力的测定
Fig.5 Bile salt tolerance of lactic acid bacteria
2.4.3 耐人工模拟胃肠液能力测定
将菌株L-14、L14U2-3分别置于人工模拟胃液处理2 h,再经肠液处理8 h,结果如图6所示,经人工模拟胃液处理2 h,活菌数无较大变化,均高于108 CFU/mL,再经肠液处理后2 h后,活菌数显著下降(P<0.05),但在2~8 h间活菌数均维持在106 CFU/mL以上,可能原因是胃肠液中的胃蛋白酶和胰蛋白酶会抑制菌株初始被膜的形成,同时破坏成熟的被膜,从而抑制菌株生长甚至造成死亡[23]。总体而言,L-14、L14U2-3具有较强的胃肠液耐受性,这与HAN等[24]的研究结果相类似。

a-耐人工模拟胃液;b-耐人工模拟肠液
图6 乳酸菌耐人工模拟胃肠液能力的测定
Fig.6 Tolerance of lactic acid bacteria to artificial simulated gastrointestinal fluid
2.4.4 耐盐能力测定
由图7可知,原始菌株L-14培养24 h后活菌数随NaCl质量浓度增大而显著减少(P<0.05),突变菌株L14U2-3 在NaCl质量浓度>80 g/L时,活菌数显著降低(P<0.05)。NaCl质量浓度相同时,L14U2-3活菌数均高于L-14,在80 g/L NaCl质量浓度下活菌数分别为(8.89±0.003)和(8.20±0.118)lg CFU/mL,耐盐能力提高8.41%,可能是植物乳杆菌的相容性溶质调控系统有助于应对环境中的盐胁迫[25],从而提高其耐受性。
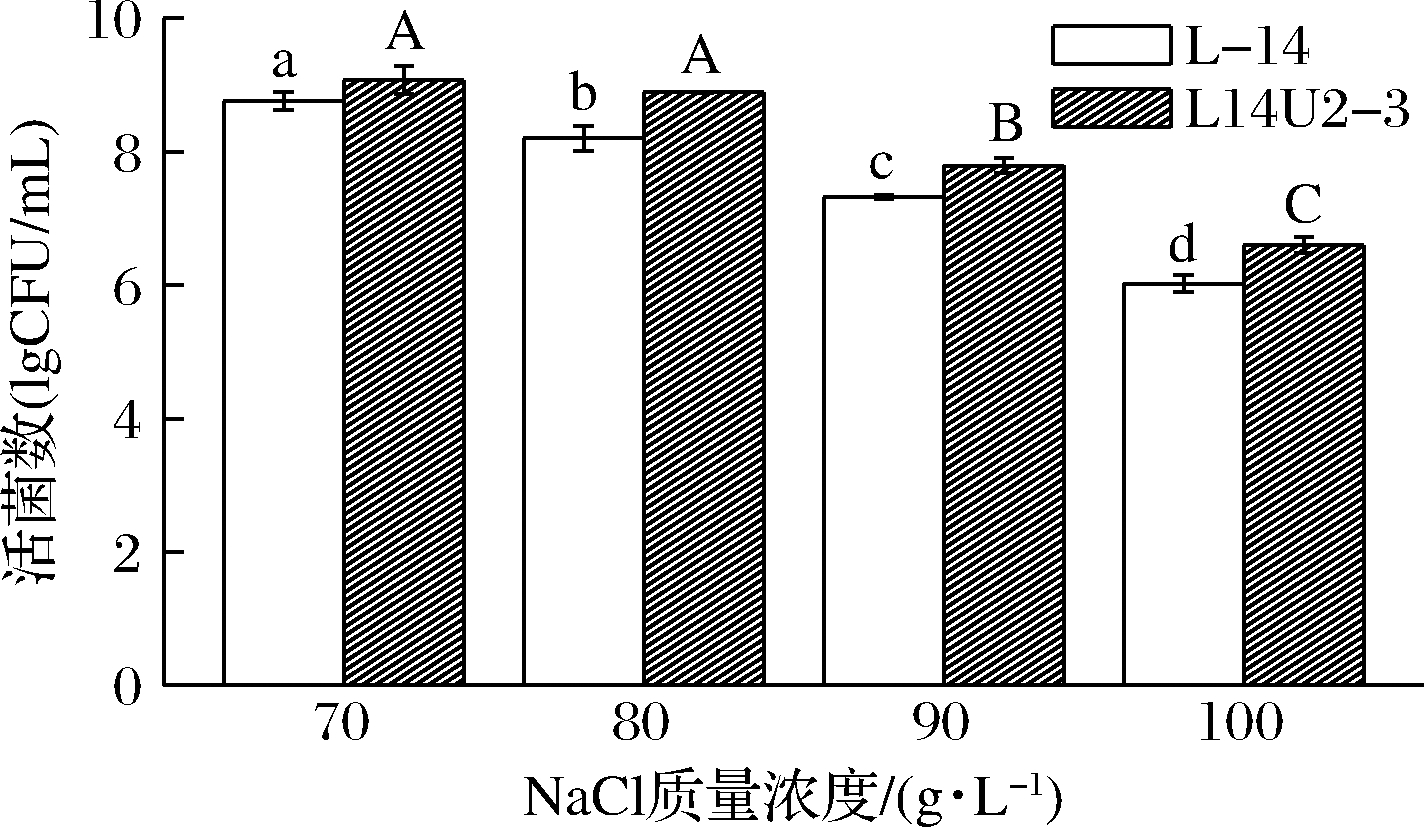
图7 乳酸菌耐盐能力的测定
Fig.7 Salt tolerance of lactic acid bacteria
3 结论与讨论
程强等[26]研究发现植物乳杆菌M616在80 g/L NaCl下基本不生长,李静等[27]从泡菜中筛选的植物乳杆菌LP-09在80 g/L NaCl下产酸量为3 g/L。本文从传统辣椒发酵食品中筛选出一株耐盐产酸菌株L-14,经鉴定菌株为植物乳杆菌(Lactobacillus plantarum)。对其进行二轮紫外诱变得到突变菌株L14U2-3,其在80 g/L NaCl下较原始菌株L-14耐盐能力提高8.41%,产酸量提高15.69%,达到8.989 g/L。同时研究发现突变菌株L14U2-3耐酸、耐胆盐、耐盐(NaCl)能力均优于原始菌株L-14,可用于红酸汤高盐发酵,简化辣椒脱盐工序,提高生产效率,降低生产成本,缓解工业化生产过程中红酸汤主要原料辣椒脱盐处理时所带来的营养成分流失和水污染问题,助力酸汤产业发展。
[1] 王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
WANG Q Q,TIAN J X,PAN Z D,et al.Analysis of dominant microflora associated with the unique flavor of Guizhou Kaili sour soup using Illumina MiSeq sequencing[J].Food and Fermentation Industries,2020,46(14):40-47.
[2] 孙孟京,赵良忠,李明,等.基于模糊数学感官评价和响应面法的红辣椒酸汤发酵工艺研究[J].食品科技,2020,45(3):142-150.
SUN M J,ZHAO L Z,LI M,et al.Based on fuzzy sensory evaluation and response surface method of red pepper sour soup fermentation process research[J].Food Science and Technology,2020,45(3):142-150.
[3] 韦明明.番茄酸汤发酵过程分析及混菌发酵工艺研究[D].南京:南京农业大学,2016.
WEI M M.Analysis of tomato sour soup fermentation process and study on the mixed culture fermentation technology for tomato sour soup[D].Nanjing:Nanjing Agricultural University,2016.
[4] XIONG K X,HAN F,WANG Z H,et al.Screening of dominant strains in red sour soup from Miao nationality and the optimization of inoculating fermentation conditions[J].Food Science & Nutrition,2021,9(1):261-271.
[5] 卿煜维,杨剑,赵玲艳,等.湖南剁辣椒降解亚硝酸盐乳酸菌筛选鉴定及发酵特性研究[J].食品与发酵工业,2020,46(1):69-74.
QING Y W,YANG J,ZHAO L Y,et al.Screening,identification and fermentation characteristic of nitrite degradation lactic acid bacteria from Hunan chopped Capsicum[J].Food and Fermentation Industries,2020,46(1):69-74.
[6] LIN L J,WU J Y,CHEN X,et al.The role of the bacterial community in producing a peculiar smell in Chinese fermented sour soup[J].Microorganisms,2020,8(9):1270.
[7] 史巧,刘毕琴,汤回花,等.发酵蔬菜菌种应用及菌群调控研究进展[J].食品与发酵工业,2021,47(5):273-281.
SHI Q,LIU B Q,TANG H H,et al.Research progress on the application of starter strains and the regulation of microflora in vegetable fermentation[J].Food and Fermentation Industries,2021,47(5):273-281.
[8] 卢承蓉,叶美芝,上官文丹,等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业,2020,46(12):14-20.
LU C R,YE M Z,SHANGGUAN W D,et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries,2020,46(12):14-20.
[9] GUAN X F,XU,Q X,ZHENG Y,et al.Screening and characterization of lactic acid bacterial strains that produce fermented milk and reduce cholesterol levels[J].Brazilian Journal of Microbiology,2017,48(4):730-739.
[10] RIAZ RAJOKA M S,SHI J L,ZHU J,et al.Capacity of lactic acid bacteria in immunity enhancement and cancer prevention[J].Applied Microbiology and Biotechnology,2017,101(1):35-45.
[11] 吕冠薇,段翠翠,高磊,等.奶豆腐来源植物乳杆菌的益生特性评价[J].食品与发酵工业,2017,43(6):134-139.
LYU G W,DUAN C C,GAO L,et al.Probiotic properties of Lactobacillus plantarum strains isolated from Dairy Toufu[J].Food and Fermentation Industries,2017,43(6):134-139.
[12] 熊蝶,袁岚玉,李媛媛,等.陕西泡菜中降解亚硝酸盐乳酸菌的筛选及其发酵特性与耐受性研究[J].食品与发酵工业,2021,47(6):139-144.
XIONG D,YUAN L Y,LI Y Y,et al.Screening,fermentation characteristics and tolerance of nitrite-degrading lactic acid bacteria in Shaanxi Paocai[J].Food and Fermentation Industries,2021,47(6):139-144.
[13] 诸葛健.工业微生物育种学[M].北京:化学工业出版社,2006.
ZHUGE J.Industrial Microbial Breeding[M].Beijing:Chemical Industry Press,2006.
[14] 张林奇,王晓蕊,史畅,等.益生菌粉中活菌稳定性及其耐受模拟胃肠液的研究[J].食品与发酵工业,2021,47(13):36-42.
ZHANG L Q,WANG X R,SHI C,et al.Stability and tolerance to simulated gastrointestinal fluids of probiotics in powder preparation[J].Food and Fermentation Industries,2021,47(13):36-42.
[15] 凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
LING D W,DONG X Z.Classification,Identification and Experimental Methods of Lactic Acid Bacteria[M].Beijing:China Light Industry Press,1999.
[16] 田珂雪,陈雪洋.乳酸菌益生功能及其在食品中的应用综述[J].河南农业,2020(27):43-45.
TIAN K X,CHEN X Y.Summary of the probiotic function of lactic acid bacteria and its application in food[J].Henan Agriculture,2020(27):43-45.
[17] JANG H J,LEE N K,PAIK H D.Probiotic characterization of Lactobacillus brevis KU15153 showing antimicrobial and antioxidant effect isolated from kimchi[J].Food Science and Biotechnology,2019,28(5):1 521-1 528.
[18] 蒙月月,陆婧婧,占萌,等.植物乳杆菌KLDS 1.0318产酸、耐酸、耐胆盐能力及其免疫特性研究[J].食品工业科技,2018,39(15):70-76.
MENG Y Y,LU J J,ZHAN M,et al.Study on the acid producing ability,acid and bile salt tolerance of Lactobacillus plantarum KLDS 1.0318 and its immunologic properties[J].Science and Technology of Food Industry,2018,39(15):70-76.
[19] DE ALMEIDA W L G Jr,FERRARI  D S,DE SOUZA J V,et al.Characterization and evaluation of lactic acid bacteria isolated from goat milk[J].Food Control,2015,53:96-103.
D S,DE SOUZA J V,et al.Characterization and evaluation of lactic acid bacteria isolated from goat milk[J].Food Control,2015,53:96-103.
[20] 黄燕燕,郭均,黎恒希,等.降胆固醇乳酸菌的体外筛选及其降胆固醇机理探讨[J].食品科学,2018,39(6):88-94.
HUANG Y Y,GUO J,LI H X,et al.In vitro screening of lactic acid bacteria for cholesterol-lowering activity and the underlying mechanism[J].Food Science,2018,39(6):88-94.
[21] 陈仪婷,张红星,谢远红,等.降胆固醇乳酸菌的筛选鉴定及其耐酸耐胆盐性能研究[J].食品与发酵工业,2018,44(5):29-33.
CHEN Y T,ZHANG H X,XIE Y H,et al.Selection of cholesterol-lowering lactic acid bacteria in vitro and study on it’s tolerance of acid and bile salts[J].Food and Fermentation Industries,2018,44(5):29-33.
[22] 胡敏.胆盐对植物乳杆菌NCU116应激基因和关键生理指标的影响[D].南昌:南昌大学,2019.
HU M.Influence of bile salt on stress gene and key physiological indexes of Lactobacillus plantarum NCU116[D].Nanchang:Nanchang University,2019.
[23] 刘蕾,武瑞赟,李军,等.类植物乳杆菌L-ZS9生物被膜态的黏附能力及形成影响因素[J].食品科学,2016,37(15):136-143.
LIU L,WU R Y,LI J,et al.Adhesion ability of Lactobacillus paraplantarum L-ZS9 and influencing factors of its biofilm formation[J].Food Science,2016,37(15):136-143.
[24] HAN Q,KONG B H,CHEN Q,et al.In vitro comparison of probiotic properties of lactic acid bacteria isolated from Harbin dry sausages and selected probiotics[J].Journal of Functional Foods,2017,32:391-400.
[25] 林松洋,郝利民,刘鑫,等.乳酸菌耐盐分子机制研究进展[J].食品科学,2018,39(3):295-301.
LIN S Y,HAO L M,LIU X,et al.Progress in molecular mechanism of salt tolerance in lactic acid bacteria[J].Food Science,2018,39(3):295-301.
[26] 程强,陈迪,王金水.Lactobacillus plantarum M616生长及代谢特性研究[J].河南工业大学学报(自然科学版),2020,41(6):20-25;34.
CHENG Q,CHEN D,WANG J S.Study on growth and metabolic characteristics of Lactobacillus plantarum M616[J].Journal of Henan University of Technology(Natural Science Edition),2020,41(6):20-25;34.
[27] 李静,王瑶,邓毛程.泡菜中优良乳酸菌筛选及特性的研究[J].食品工业科技,2016,37(6):229-232.
LI J,WANG Y,DENG M C.Screening and characterization of an excellent Lactobacillus isolated from pickle[J].Science and Technology of Food Industry,2016,37(6):229-232.