结肠直肠癌(carcinoma of colon and rectum,CRC)是第二大流行癌症[1],死亡率逐年上升,且发病情况日渐趋于年轻化[2],影响CRC发病的因素极为复杂,饮食、肠道菌群、个体情绪甚至生物钟均会有一定的影响,因此了解CRC的发生和发展机制对于预防及治疗CRC至关重要。摄入红肉对患结肠直肠癌有重大风险[3],红肉中的血红素铁可以解释红肉摄入与结肠直肠癌患病风险的关系,因为白肉(如鸡肉、鱼肉等)的摄入并不会加大CRC的患病风险[4-6]。膳食血红素铁主要存在于红肉中的血红蛋白和肌红蛋白,可在小肠部位被吸收[7]。血红素铁是一种广泛存在于动物红肉、肝脏、血液中的有机铁,血红素(亚铁原卟啉,Fe2+)是一个在其中心含有亚铁离子的四吡咯环,而氯化血红素(铁原卟啉,Fe3+)含有3价铁,是血红素的体外纯化形式[8-9]。含血红素的蛋白质在生物体内生物化学反应中发挥着重要的作用,如氧气运输和储存(如血红蛋白和肌红蛋白),参与药物代谢(如细胞色素P450),抗氧化能力(如乳酸盐酶,过氧化物酶)和信号传导过程(如一氧化氮合成酶)[10-12]。已有研究表明,氯化血红素对人结肠细胞具备遗传毒性和细胞毒性[13],同时,通过药物抑制或基因敲除转铁蛋白DMT1,减少结肠细胞对2价铁的吸收,可以有效减少结肠肿瘤的发生[14]。这些研究表明,铁平衡对结肠直肠癌的发生至关重要。
目前主要有3种机制可以解释肉类和结直肠癌之间的关系[15],(1)可能通过肽衍生的胺的N-亚硝化作用或在胃肠道中形成潜在的致癌性物质N-亚硝基化合物,通过亚硝化作用产生S-亚硝基硫醇和亚硝酰基铁(FeNO)[16];(2)在高温下煮熟的肉含有诱变性杂环胺(mutagenic heterocyclic amine,HCA)[17];(3)流行病学和实验数据支持红肉中存在的血红素铁可促进结直肠癌的发生发展,血红素对上皮细胞的直接细胞毒性、基因毒性效应,以及血红素铁对N-硝基化合物和脂质过氧化产物形成的催化作用[18]。然而,在采用流行病学方法统计分析时,会出现一定偏差,需要进一步的实验说明。
本研究以血红素铁为研究对象,通过建立动物模型以及细胞模型,探究血红素铁的摄入对结肠直肠癌的发生发展的影响,以及巨噬细胞在结肠直肠癌发生中的影响。研究成果提出一种血红素铁对CRC发病的新的机制解析,为结肠直肠癌的预防及治疗提供一种新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
SPF级C57BL/6 N雄性小鼠,5周龄,体重20~22 g,北京维通利华实验动物技术有限公司。
1.1.2 实验细胞
人髓系白血病单核细胞THP-1,ATCC细胞库(the global bioresource center)。
1.1.3 抗体
重组Anti-Xanthine Oxidase抗体(XOD,ab109235)、重组Anti-gamma H2A.X 抗体(p-H2AX,ab81299)、重组Anti-STAT3(phospho Y705)抗体,Abcam;F4/80抗体C-7(F4/80,sc—377009),Santa(santa cruz biotechnology);β-actin(4970),CST(cell signaling technology)。
1.1.4 实验试剂
髓过氧化物酶(myeloperoxidase,MPO)测试盒、脂质过氧化物(lipid hydroperoxide,LPO)试剂盒及组织铁测定试剂盒,南京建成生物工程研究所;黄嘌呤氧化酶(xanthine oxidase,XOD)活性检测试剂盒,北京索莱宝科技有限公司;Mouse TNF-α ELISA Kit、Mouse IL-10 ELISA Kit,南京福麦斯生物技术有限公司;小鼠脂多糖(lipopolysaccharide,LPS)ELISA试剂盒,上海酶联生物科技有限公司;免疫组化试剂盒,生工生物工程(上海)股份有限公司;氧化偶氮甲烷(azoxymethane,AOM),无锡莱弗思生物实验器材有限公司;葡聚糖硫酸钠(dextran sulfate sodium,DSS),南京百思凯科技有限公司;氯化血红素,上海阿拉丁生化科技股份有限公司;蔗糖铁,山西普德药业有限公司;polymethacrylate copolymer(PMA),西格玛奥德里奇(上海)贸易有限公司。
1.2 实验方法
1.2.1 利用AOM/DSS诱导原发结直肠癌肿瘤小鼠模型实验
5周龄SPF级C57BL/6 N雄性小鼠,饲养于江南大学实验动物中心SPF屏障环境中,在屏障环境中适应喂养1周后随机分组。在实验中设置的血红素铁剂量(50、100 mg/kg)对应医学用药中剂量。模型组、低剂量血红素铁组(50 mg/kg)以及高剂量血红素铁组(100 mg/kg)各15只接受单次AOM(10 mg/kg,200 μL)的腹腔注射,空白组及对照组(100 mg/kg)各6只接受注射同体积9 g/L的NaCl溶液。同时,对照组和干预组开始灌胃相应浓度的氯化血红素水溶液,与此同时,空白组和模型组每次每只灌胃200 μL 9 g/L的NaCl溶液,每灌胃5 d休息1 d,持续到实验结束。1周后,模型组和干预组将水壶中的饮用水替换为质量浓度为20 g/L的DSS(分子质量为35 000~50 000 Da)水溶液,2 d换1次,空白组和对照组维持普通饮用水,持续1周,将DSS水溶液换回普通饮用水,再饲养2周,视为1个循环,上述循环重复2次,总计3次循环。最后1次循环结束后,饲喂2周,随后根据动物福利原则处死小鼠,眼球采血,对结肠、脾器官等进行分离,40 g/L多聚甲醛-PBS固定及液氮冷冻保存,以备后续实验。
1.2.2 小鼠结直肠组织标本制作以及苏木精—伊红染色实验
在AOM/DSS诱导原发结直肠癌肿瘤小鼠实验中,各组小鼠经过麻醉处死后,取下结直肠,纵剖摊平,紧密卷起,依次完成脱水、透明、浸蜡、包埋及切片步骤后,完成标本的制作。标本再经过烤片、脱蜡、复水、染色、脱水、透明及封片等步骤,于扫描显微镜下观察。
1.2.3 免疫组化(immunocytochemistry,IHC)分析
标本经过烤片、脱蜡、复水后,在体积分数3%的H2O2溶液中浸泡10 min,再用清水浸泡2次洗涤,再柠檬酸钠溶液中煮沸3 min,冷却至室温,完成抗原修复后,水洗2次,再用PBS溶液浸泡(2×5 min),使用5%的BSA-PBS溶液封闭1 h,弃去封闭液,施加一抗(XOD、F4/80抗体,1∶200稀释),在湿润的水盒中4 ℃过夜孵育,再按免疫组化试剂盒说明书要求施加二抗、显影、复染,最后使用不同浓度酒精、二甲苯梯度脱水,封片,在扫描显微镜下扫描观察。
1.2.4 细胞实验
人髓系白血病单核细胞THP-1在37 ℃,体积分数5% CO2条件下,用含10%胎牛血清、1%青霉素和链霉素的高糖DMEM培养基培养。以每皿5×105接种于10 cm皿,过夜后更换培养基,再培养24 h稳定细胞代谢,之后经100 ng/mL PMA诱导24 h,再将含0.2 μg/mL LPS及蔗糖铁(75、150 μmol/L)的培养基刺激细胞,6 h后收集细胞蛋白,以备后续实验。
1.2.5 蛋白提取
对于小鼠结肠样品,每组挑选4只小鼠样品,模型组、低剂量血红素铁组和高剂量血红素铁组则按结肠肿瘤组织和瘤旁组织提取,每个样品提取30 mg,加入30倍体积含磷酸酶抑制剂、蛋白酶抑制剂和PMSF的Ripa裂解液进行裂解,组织研磨后,12 000 r/min离心10 min,弃沉淀,吸取上清液,部分上清液按照BCA蛋白浓度测定试剂盒说明书要求对蛋白浓度进行测定,剩余样品加入体积分数5%的β-巯基乙醇的5×loading buffer后,95 ℃金属浴加热变性10 min,后续备用;对于细胞样品,收集贴壁细胞及上清液,1 000 r/min离心5 min,PBS清洗3遍,以洗去多余培养基,后用含磷酸酶抑制剂、蛋白酶抑制剂和PMSF的Ripa裂解液进行裂解,经超声破碎仪充分裂解后,12 000 r/min离心10 min,弃沉淀,吸取上清液,后续按组织蛋白提取步骤提取蛋白,后续备用。
1.2.6 蛋白质印迹法(western blot)分析
30 μg蛋白样品变性后经10%SDS-PAGE分离,转移至PVDF膜上,用含有5% BSA的TBST溶液(TBS水溶液,含有1%体积分数的吐温-20)封闭1 h,施加一抗(XOD、p-stat3、H2AX、β-actin抗体,1∶1 000稀释)4 ℃过夜孵育;再施加二抗孵育1 h(1∶2 500稀释)后,再用TBST水溶液洗涤5次,每次5 min,最后加入显影液,避光显影20 s后,在扫描仪下显影扫描观察实验结果。
1.2.7 小鼠结肠部位MPO、LPO及组织铁含量测定
对于小鼠结肠样品,每组挑选4只小鼠样品,模型组、低剂量血红素铁组和高剂量血红素铁组则按结肠肿瘤组织和瘤旁组织提取,每个样品提取90 mg,加入20倍体积生理盐水,组织研磨后,弃沉淀,吸取上清液,部分上清液按照BCA蛋白浓度测定试剂盒说明书要求对蛋白浓度进行测定,其余样品按MPO测试盒、LPO试剂盒及组织铁测定试剂盒说明书分别测定结肠组织MPO酶活、LPO含量以及结肠组织铁含量,具体计算按说明书给与公式得出相应结果。
1.2.8 小鼠结肠部位TNF-α及IL-6含量测定
对于小鼠结肠样品,每组挑选4只小鼠样品,模型组、低剂量血红素铁组和高剂量血红素铁组则按结肠肿瘤组织和瘤旁组织提取,每个样品提取60 mg,加入20倍体积PBS,组织研磨后,弃沉淀,吸取上清液,按Mouse TNF-α ELISA Kit和Mouse IL-6 ELISA Kit试剂盒说明书要求测量结肠部位TNF-α及IL-6含量。
1.2.9 小鼠血浆LPS含量测定
对小鼠血浆样品,每组挑选4只小鼠样品,每个样品吸取100 μL血浆,用LPS试剂盒中稀释液2倍稀释后,按相应说明书测定血浆中LPS含量。
1.3 统计分析
采用平均值±标准差表示实验结果,用Graphpad Prism 6 软件进行数据统计分析,P<0.05,表示具有显著性差异。
2 结果与分析
2.1 血红素铁摄入增加结直肠癌发生发展进度
对于动物实验,建立AOM/DSS诱导原发结直肠癌肿瘤小鼠模型,并用不同浓度的氯化血红素灌胃干预,图1-a为实验方案设计。将小鼠分组为空白组(1)、血红素铁对照组(2)、模型组(3)、低血红素铁干预组(4)以及高血红素铁干预组(5),并在下文统一用序号1-5代替组别,其中空白组及血红素铁对照组各5只小鼠,模型组、高低剂量血红素铁干预组各10只小鼠。整个实验周期平均体重记录如图1-b所示,经过13周的灌胃干预,空白组平均体重为(31.57±1.81) g,模型组为(29.78±2.03) g,对照组为(31.65±1.94) g,低剂量血红素铁干预组为(29.31±2.04) g,高剂量血红素铁干预组为(28.50±2.11) g(与模型组比较,P<0.05,单因素方差分析t检验)。由3位具备小鼠结直肠病理分析经验的实验人员对小鼠结直肠肿瘤部位的结节数进行统计,结果表明高剂量血红素铁干预组结节数明显多余模型组(图1-d),同时观察小鼠结直肠内表面发现高剂量血红素铁干预组有较大腺瘤生成,以及发现高剂量血红素铁组小鼠脾脏质量明显较模型组偏高(图1-c),这说明血红素铁具有增加结直肠癌肿瘤发生率的作用。随后,通过对结直肠组织的病理学评估,发现高剂量血红素铁干预组小鼠结直肠病灶的结肠细胞形态发生明显变化,隐窝破坏明显,呈纤维状,有较大的腺瘤生成,而模型组小鼠结直肠病灶部位细胞形态变化较小,同时腺瘤体积较小(图1-e),说明在实验剂量下的血红素铁可以加重结直肠癌的发生发展。而对照组相对空白组则未见明显变化(P>0.05)。
2.2 血红素摄入增加组织铁含量及氧化应激水平
铁一向被认为是氧自由基和脂质过氧化生成的催化剂,在AOM/DSS诱导原发结直肠癌肿瘤小鼠模型中,通过测量小鼠不同部位结肠组织铁含量,发现血红素铁的摄入会增加结直肠组织铁含量,且跟浓度呈正相关,同时发现在结直肠癌肿瘤小鼠中,肿瘤组织较瘤旁组织铁含量更高(图2-c)。通过测定小鼠氧化应激水平发现,MPO活性(图2-b)和LPO含量(图2-a)均上升,且肿瘤组织较瘤旁组织铁含量更高,这与组织铁含量表现一致,说明小鼠氧化应激的变化可能是因为随着血红素铁的摄入,结肠部位组织铁含量的增加引起的。
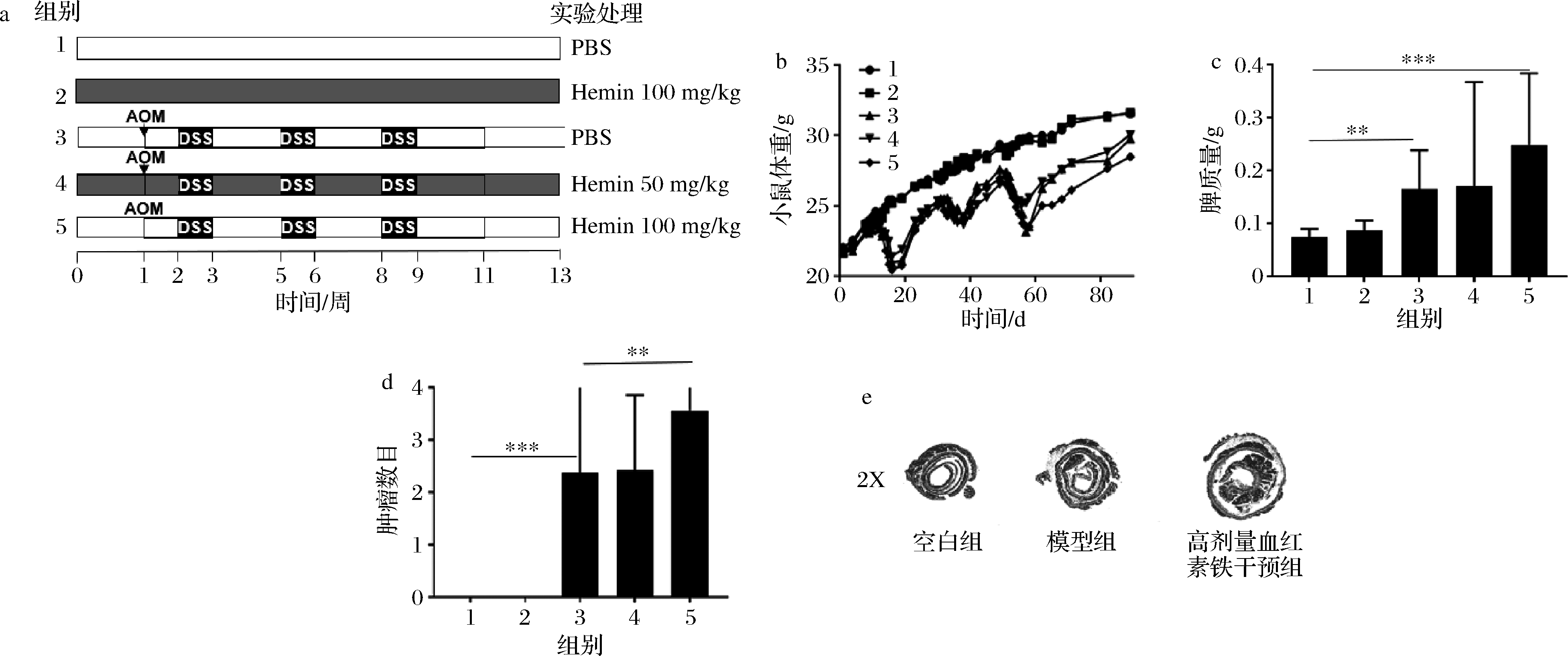
图1 血红素铁摄入对结直肠癌的影响
Fig.1 Influence of hemin intake on CRC 注:*,表示差异显著(P<0.05); **,表示差异极显著(P<0.01); ***,表示差异高度显著(P<0.001),(下同)
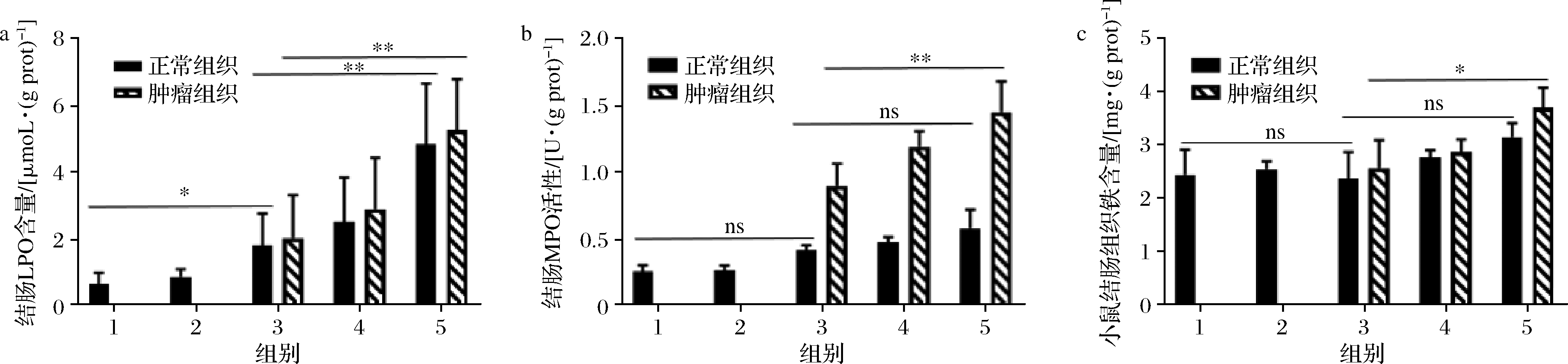
a-LPO含量;b-MPO活性;c-铁含量
图2 结肠组织铁及氧化应激水平分析
Fig.2 Analysis of iron and oxidative stress levels in colon
2.3 血红素铁摄入对结肠组织炎症因子的影响
在AOM/DSS诱导原发结直肠癌肿瘤小鼠模型中,通过测量小鼠不同部位结肠组织铁含量发现,在肿瘤组织中TNF-α表达量较瘤旁组织显著提高,但不同组别间TNF-α的含量上升幅度不大(图3-a),同时,肿瘤组织较瘤旁组织白细胞介素6的表达上调,且模型组较空白组表达上调,且经过血红素铁的干预后,干预组及对照组均有不同程度上调(图3-b)。不同组别间的小鼠炎症变化程度小,这是因为AOM/DSS模型是一种慢性炎症,炎症程度较氧化应激相对较弱。
2.4 血红素铁上调的氧化应激依赖XOD表达
研究发现血红素铁会引起氧化应激水平的提高,XOD下游产物H2O2可在小肠黏膜细胞与亚铁离子发生芬顿反应[19],能够促进铁的转运和运输,也能催化生成氧自由基。通过蛋白质印迹法分析发现,血红素铁的存在可以上调高剂量干预组结肠组织XOD的表达,同时观测到DNA损伤的标志蛋白磷酸化的H2AX上调,以及磷酸化STAT3蛋白较空白组高,高血红素铁组磷酸化STAT3蛋白较模型组表达上调(图4-a)。通过测量小鼠结肠组织XOD活性,也得到了类似结果,高、低剂量干预组XOD活性较模型组显著上升(图4-b)。
2.5 XOD表达定位
结肠细胞与巨噬细胞均在肠道产生XOD,为了进一步探究结肠组织XOD表达的具体情况,通过免疫组化实验确定XOD在结肠部位表达位置,通过XOD抗体和F4/80,发现F4/80定位的巨噬细胞与XOD表达位置高度重合(图5-a),这说明结肠部位检测到的绝大部分XOD来源于巨噬细胞。血浆LPS的含量可作为结肠屏障是否破坏的一个标志,实验首先测量了血浆中LPS含量,发现经过AOM/DSS诱导后,模型组和干预组小鼠血浆中LPS均出现上升(图5-b),这说明摄入膳食血红素铁后,肠道屏障被破坏,给巨噬细胞提供了通道,接触到铁的巨噬细胞发生一系列生物生化反应。
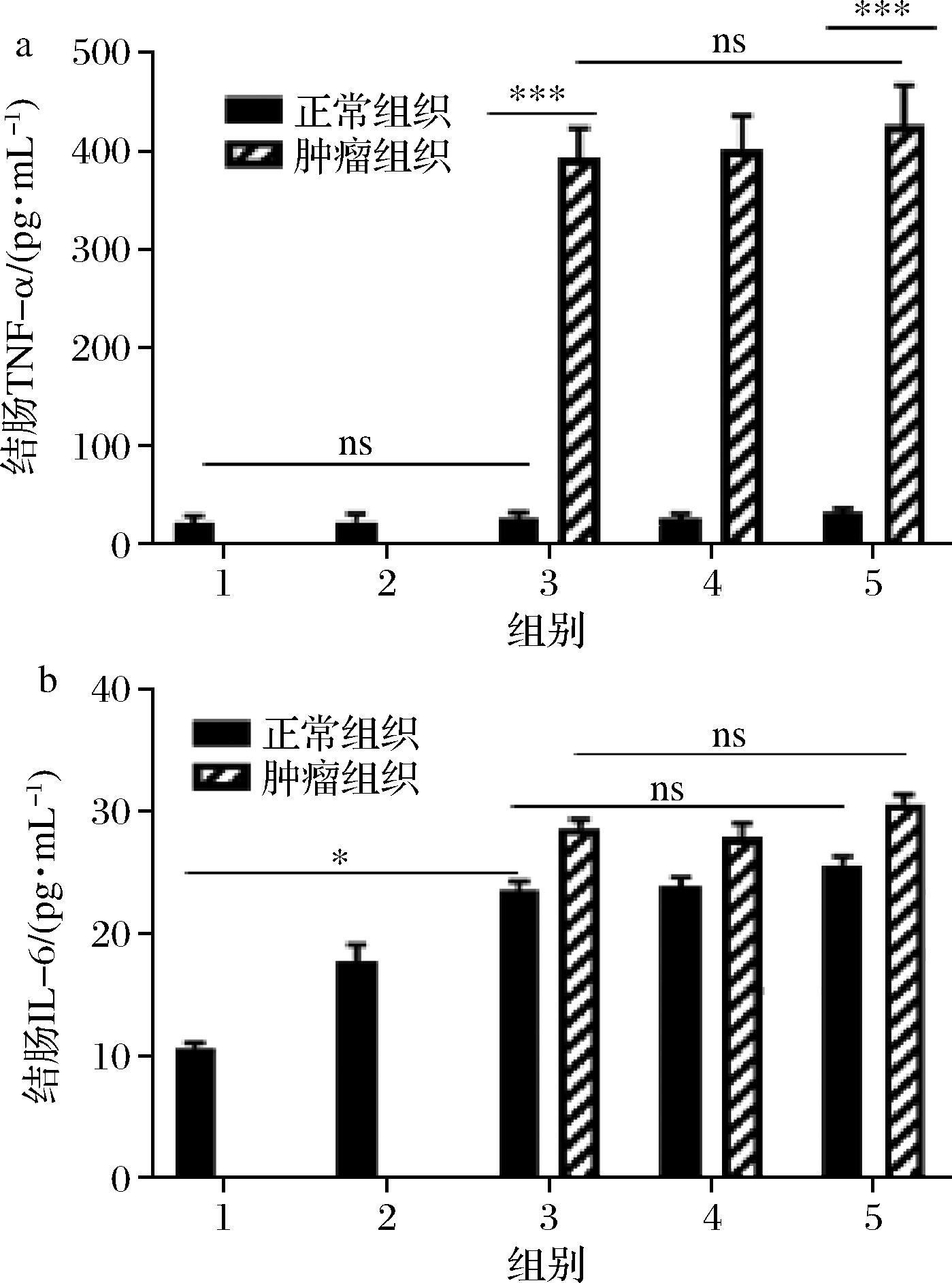
a-TNF-α;b-IL-6
图3 结肠组织炎症因子水平分析
Fig.3 Analysis of inflammatory factor levels in colon

a-Western Blot分析;b-XOD活性
图4 结肠组织Western Blot及XOD活性分析
Fig.4 Western Blot of colon tissue and XOD activity
为了验证巨噬细胞对结肠细胞的影响,建立细胞模型,通过PMA诱导THP-1细胞分化成巨噬细胞,在蔗糖铁和LPS刺激下,发现XOD表达显著提高,且有剂量依赖现象,呈正相关趋势(图5-c)。这与前文中小鼠由于肠道屏障的破坏,塑造了细菌脂多糖接触巨噬细胞的一个环境相对应,与其相互验证。

a-结肠组织显微图片;b-血浆脂多糖含量;c-细胞系Western Blot分析
图5 结肠组织免疫组化、血浆脂多糖及THP-1细胞系Western Blot分析
Fig.5 Analysis of IHC,LPS and Western Blot of THP-1 cell line
3 讨论
世界癌症研究小组认为红肉和加工肉摄入会加大患结肠直肠癌的风险[20],目前,不仅在发达国家,在中等收入及低收入国家结直肠癌的发病率也在逐年上升[21]。而有研究表明红肉中对结肠直肠癌起促进作用的不是血红蛋白而是血红素铁[22],本实验研究表明,膳食血红素铁对肠道屏障具有短期影响,对结肠黏膜中炎症、渗透性和细胞毒性增加,血红素铁可以通过诱导氧化应激增加结直肠癌肿瘤的发生发展,而氧化应激可以通过黄嘌呤氧化酶的过度表达来增加。
膳食血红素铁的摄入不仅增加了结肠炎症和氧化应激(如MPO活性和促炎性细胞因子的增加),而且还增加了DNA损伤和肠道通透性。有研究表明,炎症与某些形式的癌症发展有因果关系,其过程涉及组织巨噬细胞产生的活性氧的遗传毒性,或通过产生促炎性细胞因子(例如IL-1β)[23]。与这些研究一致的是,摄入红肉与结直肠癌发生和氧化应激增加有关,例如血浆C反应蛋白[24]和粪便水的遗传毒性[25]。黄嘌呤氧化酶衍生的氧自由基和H2O2均可导致蛋白质和脂质氧化,进而直接或间接改变信号传导途径,破坏细胞膜完整性来影响肠道稳态[26],因此本文通过测量结肠部位黄嘌呤氧化酶的表达和活性,定位到黄嘌呤氧化酶的变化来自于巨噬细胞,解释了导致结肠稳态破坏的源头是黄嘌呤氧化酶。
本研究突出了黄嘌呤氧化酶在膳食血红素铁干预下对AOM/DSS诱导原发结直肠癌肿瘤小鼠的作用。总之,红肉的摄入与结直肠癌发生的高风险有关,这是因为红肉中血红蛋白较白肉高10倍[27],血红素铁正是红肉和结直肠癌发生高风险的关联所在。
4 结论
本研究结果表明,在AOM/DSS诱导原发结直肠癌肿瘤小鼠模型实验中,经过血红素铁干预后,发现小鼠结直肠癌肿瘤的个数明显增多,同时体重下降幅度更大,肿瘤发育程度大,健康小鼠给予血红素铁干预后,体征未出现异常;在体外THP-1细胞模型中研究发现,通过PMA诱导THP-1细胞分化成巨噬细胞,在单纯蔗糖铁的刺激下,黄嘌呤氧化酶出现明显变化,但在蔗糖铁和LPS的共同刺激下,黄嘌呤酶表达量显著上升,且随蔗糖铁浓度升高表达量变多。深入研究发现,红肉摄入会引起细胞黄嘌呤氧化酶表达和活性上调,增加氧化应激水平,在动物模型中,也能观察到此种现象,血红素铁的摄入会增加机体氧化应激水平,破坏肠道屏障,铁与巨噬细胞的接触导致氧化应激增加,进而造成DNA损伤,增加结直肠癌的患病风险。本文研究成果对红肉摄入加大结直肠癌风险的机制作出了一种可能的解释,发现黄嘌呤氧化酶在结直肠癌疾病中是一个重要靶点,为红肉摄入诱导结直肠癌的发生发展提供了一些新思路。
[1] BONOVOLIAS I D,TSIFTSOGLOU A S.Hemin counteracts the repression of Bcl-2 and NrF2 genes and the cell killing induced by imatinib in human Bcr-Abl(+) CML cells[J].Oncology Research,2009,17(11-12):535-547.
[2] KANG Y P,WARD N P,DENICOLA G M.Recent advances in cancer metabolism:A technological perspective[J].Experimental & Molecular Medicine,2018,50(4):1-16.
[3] LARSSON S C,WOLK A.Meat consumption and risk of colorectal cancer:A meta-analysis of prospective studies[J].International Journal of Cancer,2006,119(11):2 657-2 664.
[4] LIPPI G,MATTIUZZI C,CERVELLIN G.Meat consumption and cancer risk:A critical review of published meta-analyses[J].Critical Reviews in Oncology/Hematology,2016,97:1-14.
[5] WILLETT W C,STAMPFER M J,COLDITZ G A,et al.Relation of meat,fat,and fiber intake to the risk of colon cancer in a prospective study among women[J].The New England Journal of Medicine,1990,323(24):1 664-1 672.
[6] GIOVANNUCCI E,RIMM E B,STAMPFER M J,et al.Intake of fat,meat,and fiber in relation to risk of colon cancer in men[J].Cancer Research,1994,54(9):2 390-2 397.
[7] WEST A R,OATES P S.Mechanisms of heme iron absorption:Current questions and controversies[J].World Journal of Gastroenterology,2008,14(26):4 101-4 110.
[8] KAGAN V E,KOZLOV A V,TYURINA Y Y,et al.Antioxidant mechanisms of nitric oxide against iron-catalyzed oxidative stress in cells[J].Antioxidants & Redox Signaling,2001,3(2):189-202.
[9] ITOH T,YAMADA T,KODERA Y,et al.Hemin(Fe3+)-and heme(Fe2+)-Smectite conjugates as a model of hemoprotein based on spectrophotometry[J].Bioconjugate Chemistry,2001,12(1):3-6.
[10] NAGABABU E,RIFKIND J M.Heme degradation by reactive oxygen species[J].Antioxidants & Redox Signaling,2004,6(6):967-978.
[11] NAGABABU E,RIFKIND J M.Heme degradation by reactive oxygen species[J].Antioxidants & Redox Signaling,2004,6(6):967-978.
[12] SHIMIZU T.Binding of cysteine thiolate to the Fe(III) heme complex is critical for the function of heme sensor proteins[J].Journal of Inorganic Biochemistry,2012,108:171-177.
[13] GEMELLI C,DONGMO B M,FERRARINI F,et al.Cytotoxic effect of hemin in colonic epithelial cell line:Involvement of 18kDa translocator protein(TSPO)[J].Life Sciences,2014,107(1-2):14-20.
[14] XUE X,RAMAKRISHNAN S K,WEISZ K,et al.Iron uptake via DMT1 integrates cell cycle with JAK-STAT3 signaling to promote colorectal tumorigenesis[J].Cell Metabolism,2016,24(3):447-461.
[15] BASTIDE N M,PIERRE F H F,CORPET D E.Heme iron from meat and risk of colorectal cancer:A meta-analysis and a review of the mechanisms involved[J].Cancer Prevention Research(Philadelphia,Pa.),2011,4(2):177-184.
[16] BINGHAM S A,HUGHES R,CROSS A J.Effect of white versus red meat on endogenous N-nitrosation in the human colon and further evidence of a dose response[J].The Journal of Nutrition,2002,132(11):3 522S-3 525S.
[17] SINHA R,KNIZE M G,SALMON C P,et al.Heterocyclic amine content of pork products cooked by different methods and to varying degrees of doneness[J].Food and Chemical Toxicology,1998,36(4):289-297.
[18] SESINK A L,TERMONT D S,KLEIBEUKER J H,et al.Red meat and colon cancer:The cytotoxic and hyperproliferative effects of dietary heme[J].Cancer Research,1999,59(22):5 704-5 709.
[19] WINTERBOURN C C.Toxicity of iron and hydrogen peroxide:The Fenton reaction[J].Toxicology Letters,1995,82-83:969-974.
[20] WISEMAN M,CANNON G,MARTIN G,et al.Food,nutrition,physical activity,and the prevention of cancer:A global perspective[M].Washington DC:World Cancer Research Fund/American Institute for Cancer Research,2007.
[21] FRANCESCANGELI F,DE ANGELIS M L,ZEUNER A.Dietary factors in the control of gut homeostasis,intestinal stem cells,and colorectal cancer[J].Nutrients,2019,11(12):E2936.
[22] CONSTANTE M,FRAGOSO G,CALVÉ A,et al.Dietaryheme induces gut dysbiosis,aggravates colitis,and potentiates the development of adenomas in mice[J].Frontiers in Microbiology,2017,8:1 809.
[23] ELINAV E,NOWARSKI R,THAISS C A,et al.Inflammation-induced cancer:Crosstalk betweentumours,immune cells and microorganisms[J].Nature Reviews Cancer,2013,13(11):759-771.
[24] DE OLIVEIRA OTTO M C C,ALONSO A,LEE D H,et al.Dietary micronutrient intakes are associated with markers of inflammation but not with markers of subclinical atherosclerosis[J].The Journal of Nutrition,2011,141(8):1 508-1 515.
[25] HEBELS D G A J,SVEJE K M,DE KOK M C,et al.Red meat intake-induced increases in fecal water genotoxicity correlate with pro-carcinogenic gene expression changes in the human colon[J].Food and Chemical Toxicology,2012,50(2):95-103.
[26] ASLAN M,RYAN T M,ADLER B,et al.Oxygen radical inhibition of nitric oxide-dependent vascular function in sickle cell disease[J].PNAS,2001,98(26):15 215-15 220.
[27] SCHWARTZ S,ELLEFSON M.Quantitative fecal recovery of ingested hemoglobin-heme in blood:Comparisons by HemoQuant assay with ingested meat and fish[J].Gastroenterology,1985,89(1):19-26.