蒲公英,菊科植物蒲公英 (Taraxacum mongolicum Hand.-Mazz.)、碱地蒲公英 (Taraxacum borealisinense Kitam.)或同属数种植物的干燥全草,性味苦、甘、寒,归肝、胃经,具有清热解毒、消肿散结、利尿通淋之功效,用于治疗疔疮肿毒、乳痈、凜病、目赤、咽痛、肺痈、肠痈、湿热黄疸和热淋涩痛等[1]。蒲公英不仅含有碳水化合物、蛋白质、脂肪、氨基酸、维生素、磷、铁、钙等营养成分[2],同时含有挥发油[3]、多糖[4]、有机酸[5]、黄酮[6]、生物碱[7]等活性成分,具有降糖[8-9]、抗菌[10-11]、抗炎[12-14]、抗氧化[15-16]、抗肿瘤[17-18]、调节肠道微生态[19]等多种生物学活性,是我国传统医学和现代医学均证实的药食同源物品之一。近年来,蒲公英也被逐渐用于饮品[20-21]、保健品[22]、兽医用[23]等方面,因此,蒲公英具有巨大的市场开发潜力。蒲公英根,作为蒲公英药用部位的一部分,其多糖含量相对较高[24],具有良好的抗氧化活性[25],但是目前鲜少有明确的报道。本研究以河南市售蒲公英根为研究对象,通过乙醇提取、大孔树脂柱分离与体外抗菌抗炎活性评价相结合,研究了蒲公英根的抗菌和抗炎活性组分。
1 材料与方法
1.1 材料与试剂
蒲公英根购于河南郑州药材市场,经河南中医药大学董诚明教授鉴定为菊科植物蒲公英(Taraxacum mongolicum)的干燥根,标本存放于河南省科学院天然产物重点实验室;标准菌株(大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 29213、肺炎链球菌ATCC 49619、化脓性链球菌ATCC19615、鼠伤寒沙门氏菌ATCC 13311),南京便诊生物科技有限公司;临床菌株(鸡大肠杆菌CVCC 1555、鸡金黄色葡萄球菌CVCC 548、鸡白痢沙门氏菌CVCC 1887、牛无乳链球菌CVCC 540),中国兽医药品监察所;小鼠巨噬细胞RAW264.7,成都理工大学提供;1640培养基,美国Hyclone公司;青霉素-链霉素,上海碧云天生物技术有限公司;胎牛血清,新西兰Newzerum公司;CCK-8试剂盒,大连美仑生物技术有限公司;ELISA试剂盒,北京达科为生物技术有限公司;培养细胞总RNA提取试剂盒,成都福际生物技术有限公司;逆转录试剂盒,南京诺唯赞生物科技有限公司;脂多糖(lipopolysaccharides,LPS),美国Sigma公司;D101大孔树脂,天津市光复精细化工研究院;蒲公英颗粒(批号18013702),江西心诚药业有限公司;胰蛋白胨,上海宝录生物科技有限公司;牛肉浸膏,北京双旋微生物培养基制品厂;亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、氢氧化钠滴定液、硫酸等均为分析纯。
1.2 仪器与设备
ME204型分析天平,美国Mettler公司;TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;wi93008麦氏比浊仪,东西仪(北京)科技有限公司;Countstar细胞计数仪,上海睿钰生物科技有限公司;Nanodrop2000核酸检测仪、CO2培养箱,美国Thermo公司;酶标仪、q-PCR仪、Gel DocTM XR+ with Image LabTM software凝胶成像系统,美国Bio-Rad公司;DHP-9082电热恒温培养箱,上海红华仪器有限公司。
1.3 实验方法
1.3.1 蒲公英根提取与分离
称取蒲公英根2份,每份200 g,分别用体积分数70%乙醇回流提取3次,每次1 h,料液比分别为1∶12、1∶10和1∶10(g∶mL),趁热抽滤,合并滤液并浓缩至无醇味,加蒸馏水稀释,离心取上清液。称取D101大孔树脂2份,每份400 g,用95%乙醇浸泡过夜后分别装柱,用95%乙醇洗涤、蒸馏水冲至无醇味。将2份上清液分别上样,其中一个树脂柱(1)用蒸馏水、30%乙醇、70%乙醇依次洗脱,另一个树脂柱(2)用蒸馏水、70%乙醇依次洗脱,洗脱液分别收集并浓缩至干,冷藏备用。
1.3.2 总黄酮质量分数测定
总黄酮质量分数按照参照文献[26]方法测定。芦丁对照品的线性回归方程为 Y=0.008 4X+0.165 9,r=0.999 0。
1.3.3 多糖质量分数测定
多糖质量分数按照硫酸-蒽酮方法测定[1]。葡萄糖线性回归方程为 Y=0.042 3X+0.024 8,r=0.999 1。
1.3.4 体外抗菌活性测定
1.3.4.1 菌悬液的制备
从活化的固体平板上挑取单菌落接种至液体培养基中,37 ℃培养16~18 h后,用培养基稀释成浓度为106~108 CFU/mL的菌悬液,备用。
1.3.4.2 最小抑菌浓度的测定
利用倍半稀释法[26-27]测定各样品的最小抑菌浓度(minimum inhibitory concentration,MIC)。先将各样品制成初始质量浓度为250 mg/mL的水溶液,阳性药物蒲公英颗粒制成初始质量浓度为500 mg/mL的水溶液,再分别用液体培养基依次倍半稀释,共稀释7个浓度。在96孔板各孔中加入100 μL供试菌液和100 μL待测溶液,每种测试菌液分别设置阴性对照(加入100 μL供试菌液和100 μL液体培养基)和空白对照(加200 μL液体培养基),于37 ℃培养18~20 h,各待测组澄清的孔所对应的最小检测质量浓度即为其MIC。
1.3.4.3 最小杀菌浓度的测定
MIC实验结束后,分别从澄清的各孔中取出少量液样涂布于固体培养基上,37 ℃培养18~24 h,完全没有细菌生长的各待测组所对应的最小检测质量浓度即为其最小杀菌浓度(minimum bactericidal concentration,MBC)[26-27]。
1.3.5 体外抗炎活性的测定
1.3.5.1 细胞复苏与传代
将冻存的小鼠巨噬细胞RAW264.7细胞于37 ℃下快速消融,然后转至已预热的2 mL含体积分数10%胎牛血清、1%青霉素-链霉素的1640培养液中,轻轻吹匀、800 r/min离心3 min,弃去上清液,再加新培养液吹匀后取适量转至细胞培养皿中,在37 ℃、体积分数5% CO2细胞培养箱中培养。
当培养皿中细胞密度达到80%~90%时,弃去培养基,用胰酶轻轻消化后加入新培养液轻轻吹打,直至细胞完全吹落,800 r/min离心3 min、弃上清液,重新加入新培养液,轻轻吹匀后取适量细胞悬液加入培养皿中,轻轻振匀后于细胞培养箱中培养。经过2~3代传代可用于正常实验操作。
1.3.5.2 药物浓度筛选
将处于对数生长期的RAW264.7细胞重悬后稀释至5×104个/mL,向96孔板内每孔加入100 μL细胞悬液,培养24 h,每孔再加入含不同浓度药物的培养液100 μL,每组设5个重复,继续培养24 h之后对各实验组进行CCK-8细胞毒性检测。在450 nm波长下测定各孔的吸光值(A),以只含培养液的孔为调零孔,以含细胞、不含药物的孔为空白对照孔,以含不同浓度药物的孔为测试孔,记录结果并计算细胞存活率。存活率计算如公式(1)所示:
存活率![]()
(1)
1.3.5.3 抗炎活性测定
向6孔板内每孔加入处于对数生长期的细胞悬液2~3 mL,每孔3×105个细胞,每组设3个重复,培养24 h之后,弃去原培养液,每孔加入含不同药物与1 μg/mL LPS的培养液2~3 mL,设置对照组及模型组,继续培养24 h后先收集上清液,再用生理盐水清洗每孔2次,再加入0.5 mL细胞裂解液收集细胞,于-80 ℃保存备用[28-29]。
根据ELISA试剂盒说明书检测细胞上清液中炎症因子IL-1β、IL-6和TNF-α的浓度;根据培养细胞总RNA提取试剂盒说明书提取RAW264.7细胞的RNA,再参照逆转录试剂盒说明书进行逆转录。Q-PCR引物合成由擎科生物公司完成,添加适量引物与模板,按照Bio-rad SsoAdvancedTM Universal SYBR® Green Supermix说明书进行q-PCR实验。
1.4 数据处理
所有实验结果均重复3次,且表示为平均值±标准差![]() 采用SPSS 22.0对抗炎活性数据进行单因素方差分析(S-N-K检验)和多重比较,并用GraphPad Prism 6.0作图,不同字母标注表示具有显著差异(P<0.05)。
采用SPSS 22.0对抗炎活性数据进行单因素方差分析(S-N-K检验)和多重比较,并用GraphPad Prism 6.0作图,不同字母标注表示具有显著差异(P<0.05)。
2 结果与分析
2.1 提取分离结果与分析
蒲公英根醇提物经大孔树脂柱层析、依次用蒸馏水、30%乙醇、70%乙醇洗脱(即柱1)后所得的3个组分依次标记为PGYG1-D0、PGYG1-D30和PGYG1-D70;醇提物经大孔吸附树脂柱层析、依次用蒸馏水、70%乙醇洗脱(即柱2)后所得的2个组分依次标记为PGYG2-D0和PGYG2-D70,结果见表1。大孔吸附树脂柱分离后水洗脱部位的得率较高,可达16%以上,而且该部位多糖质量分数相对较高,接近6%;乙醇洗脱部位(PGYG1-D30、PGYG1-D70和PGYG2-D70)得率较低,尤其是当乙醇梯度洗脱时,各部分得率更低,不超过1%;而且,乙醇洗脱部位的总黄酮质量分数相对较高,能达到45%以上。
表1 蒲公英根各组分的得率与总黄酮、多糖质量分数
Table 1 Yields and mass fractions of different components from dandelion root
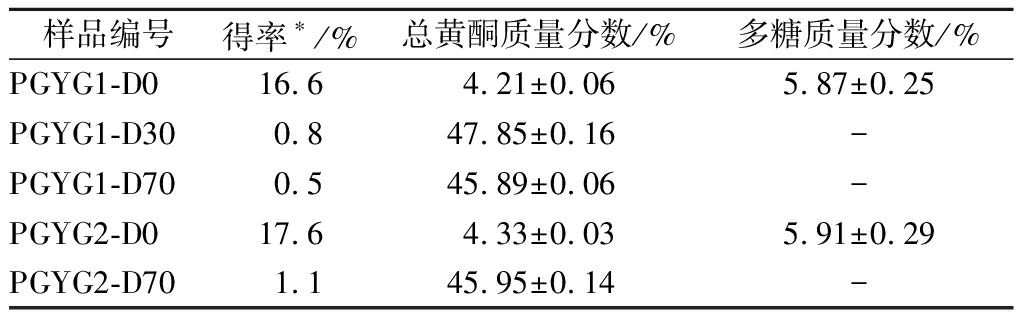
样品编号得率∗/%总黄酮质量分数/%多糖质量分数/%PGYG1-D016.64.21±0.065.87±0.25PGYG1-D300.847.85±0.16-PGYG1-D700.545.89±0.06-PGYG2-D017.64.33±0.035.91±0.29PGYG2-D701.145.95±0.14-
注:*为提取物质量占蒲公英根原材料质量的百分比,-表示未检出
2.2 体外抑菌检测结果与分析
2.2.1 MIC检测结果与分析
5种待测样品对9种供试菌(人、畜禽病原菌)的MIC检测结果见表2。5种待测样品对9种供试菌的抑菌效果均比阳性药物蒲公英颗粒的抑菌效果好,而且乙醇洗脱部位的抑菌效果普遍比水洗脱部位抑菌效果好(MIC值小),而且洗脱部位极性越小,抑菌效果越好。综合考虑各洗脱相的得率、工艺和活性,可以发现提取后用水和70%乙醇依次洗脱的工艺不仅简单,而且所得的乙醇洗脱组分(PGYG2-D70)得率高、抗菌效果好,9种供试菌中8种供试菌MIC可达1.95 mg/mL。
表2 蒲公英根各组分对9种供试菌的MIC检测结果 单位:mg/mL
Table 2 MIC results of different components against nine tested bacteria
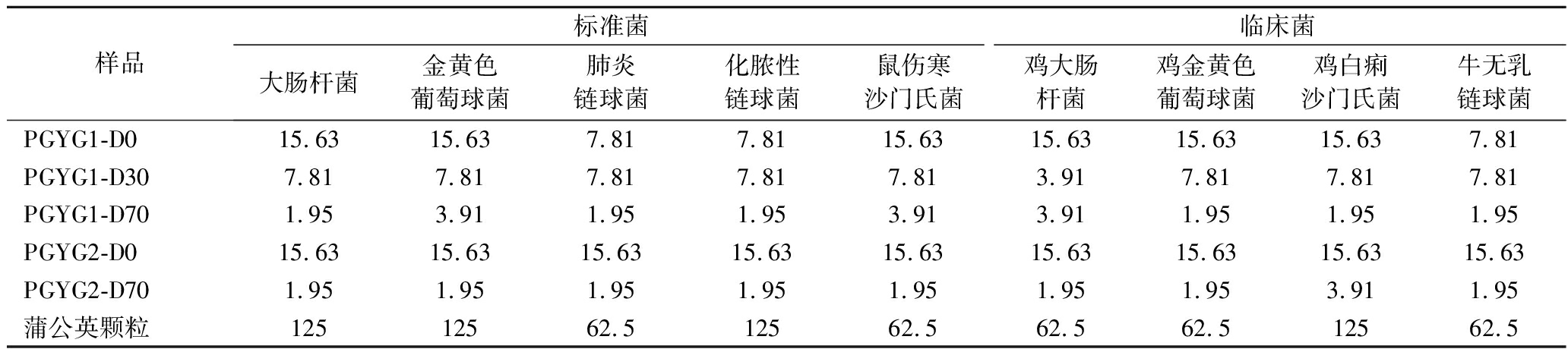
样品标准菌临床菌大肠杆菌金黄色葡萄球菌肺炎链球菌化脓性链球菌鼠伤寒沙门氏菌鸡大肠杆菌鸡金黄色葡萄球菌鸡白痢沙门氏菌牛无乳链球菌PGYG1-D015.6315.637.817.8115.6315.6315.6315.637.81PGYG1-D307.817.817.817.817.813.917.817.817.81PGYG1-D701.953.911.951.953.913.911.951.951.95PGYG2-D015.6315.6315.6315.6315.6315.6315.6315.6315.63PGYG2-D701.951.951.951.951.951.951.953.911.95蒲公英颗粒12512562.512562.562.562.512562.5
2.2.2 MBC检测结果与分析
5种待测样品对9种供试菌的MBC检测结果见表3。乙醇洗脱部位对9种供试菌的杀菌效果普遍比水洗脱部位和阳性药物蒲公英颗粒的杀菌效果好(MBC值小)。其中,水洗脱后用70%乙醇洗脱所得部位的杀菌效果最好,MBC均为31.25 mg/mL,因此可以将该部位作为蒲公英根的抗菌活性组分。
表3 蒲公英根各组分对9种供试菌的MBC检测结果 单位:mg/mL
Table 3 MBC results of different components against nine tested bacteria
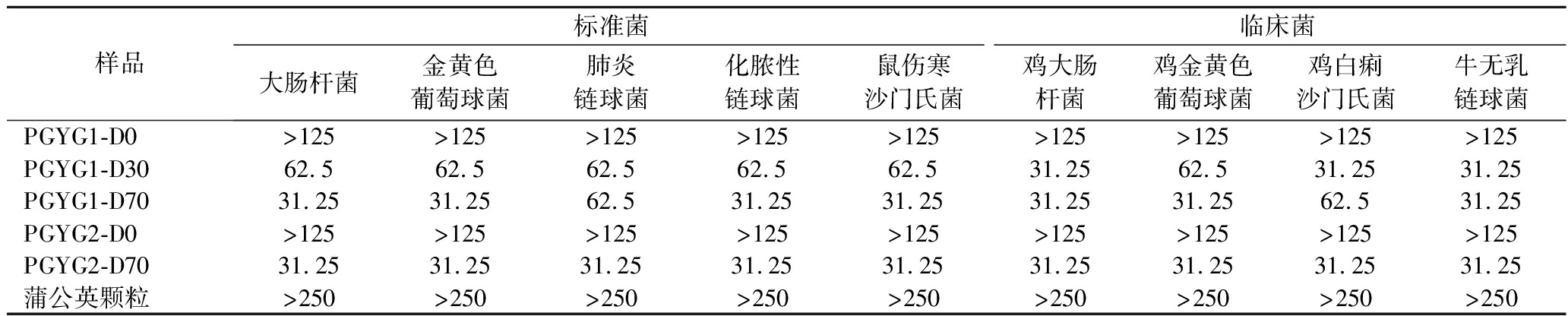
样品标准菌临床菌大肠杆菌金黄色葡萄球菌肺炎链球菌化脓性链球菌鼠伤寒沙门氏菌鸡大肠杆菌鸡金黄色葡萄球菌鸡白痢沙门氏菌牛无乳链球菌PGYG1-D0>125>125>125>125>125>125>125>125>125PGYG1-D3062.562.562.562.562.531.2562.531.2531.25PGYG1-D7031.2531.2562.531.2531.2531.2531.2562.531.25PGYG2-D0>125>125>125>125>125>125>125>125>125PGYG2-D7031.2531.2531.2531.2531.2531.2531.2531.2531.25蒲公英颗粒>250>250>250>250>250>250>250>250>250
2.3 体外抗炎检测结果与分析
2.3.1 测试浓度筛选结果与分析
参考抗菌活性结果,选取水和70%乙醇依次洗脱的2个部位(即PGYG2-D0和PGYG2-D70)作为抗炎活性评价的考察对象。分别设置不同质量浓度(0.25、0.5、1、2、4 mg/mL)同时处理小鼠巨噬细胞RAW 264.7,24 h后检测各组细胞的生长情况,如图1所示。2个组分在0.25 mg/mL时对巨噬细胞RAW 264.7的生长无影响,所以选择该浓度作为处理浓度,考察2个组分对巨噬细胞RAW264.7炎症模型的作用情况。
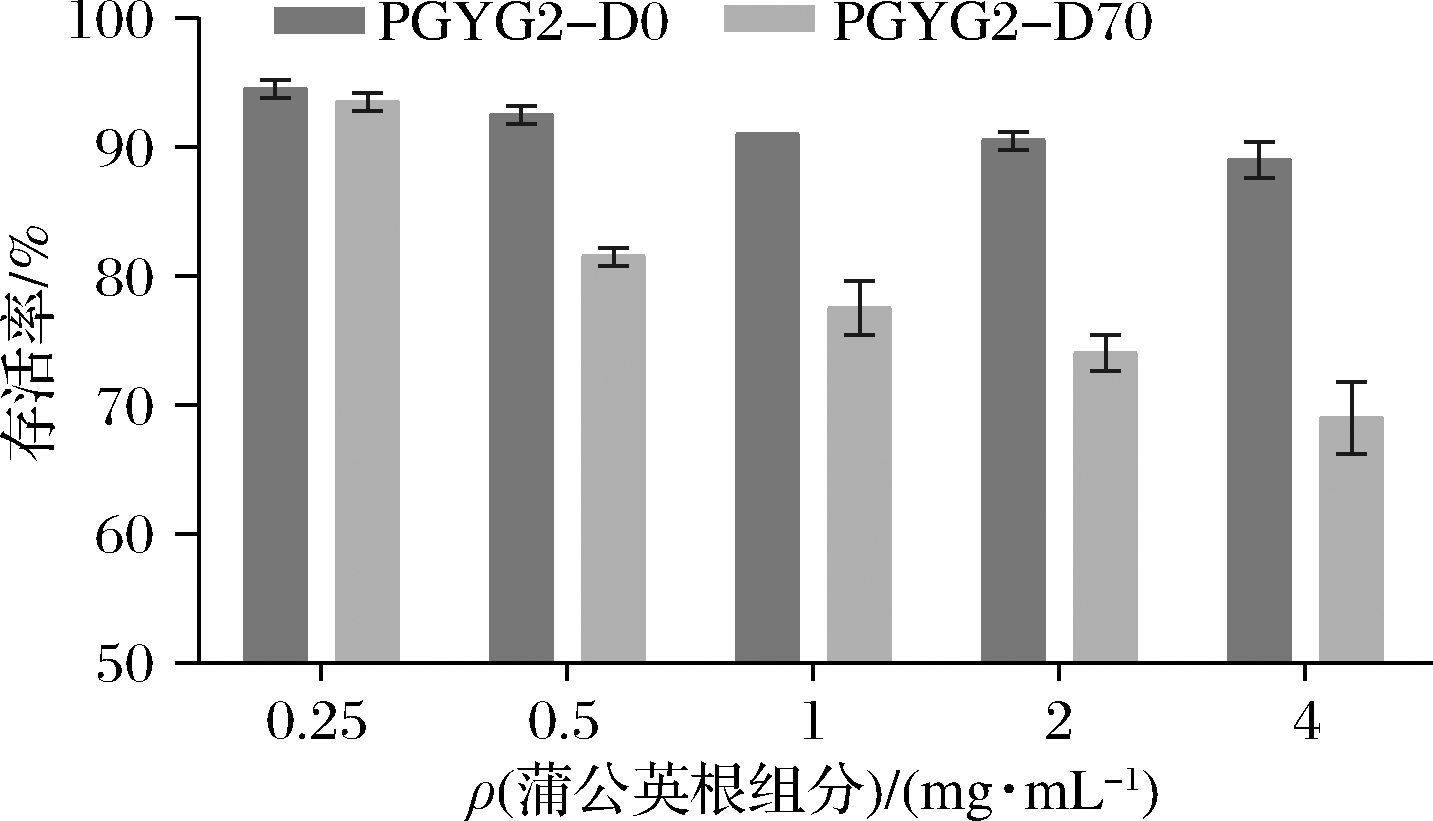
图1 不同质量浓度蒲公英根组分对细胞RAW264.7存活率的影响
Fig.1 Survival rate of RAW264.7 cells treated by the components from dandelion root at different concentrations
2.3.2 炎症因子浓度检测结果与分析
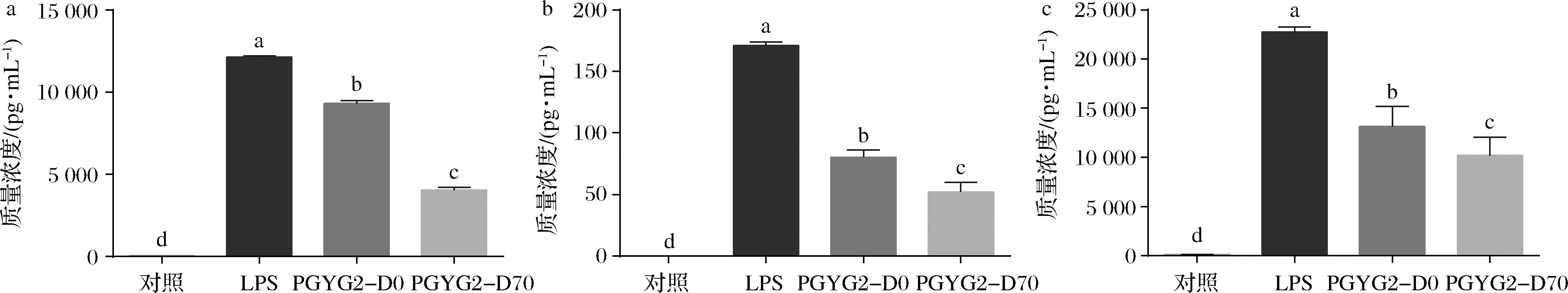
蒲公英根2个待测组分对巨噬细胞RAW264.7的炎症因子IL-6、IL-1β和TNF-α浓度的影响见图2。相对于模型组而言,蒲公英根2个待测组分对炎症因子IL-6、IL-1β和TNF-α的分泌均有显著性抑制作用(P<0.05),而且,PGYG2-D70组分的抑制作用比PGYG2-D0的抑制作用更为显著(P<0.05)。
2.3.3 炎症因子转录水平结果与分析
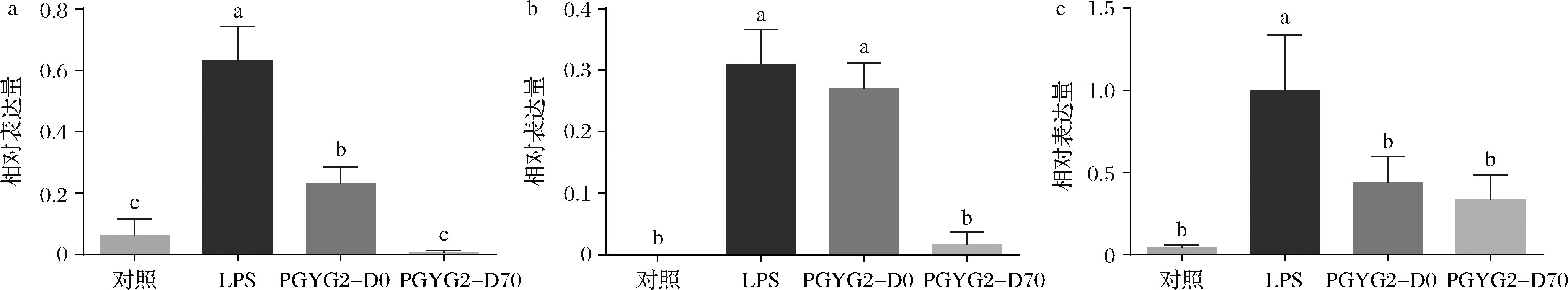
2个待测组分对巨噬细胞RAW264.7的炎症因子IL-6、IL-1β和TNF-α转录水平的影响见图3。相对于模型组而言,2个待测组分对炎症因子IL-6和TNF-α的转录水平均有显著性抑制作用(P<0.05),而且这2个组分之间对IL-6的转录水平抑制存在显著性差异(P<0.05);PGYG2-D70对炎症因子IL-1β的转录水平有显著性抑制作用(P<0.05)。因此,也可以将70%乙醇洗脱部位作为蒲公英根的抗炎活性组分。
a-IL-6;b-IL-1β;c-TNF-α
图2 蒲公英根不同组分对RAW264.7炎症因子浓度的影响
Fig.2 Concentrations of inflammatory cytokines treated by different components from dandelion root 注:不同小写字母代表差异显著(P<0.05),(下同)
a-IL-6;b-IL-1β;c-TNF-α
图3 蒲公英根不同组分对RAW264.7炎症因子转录水平的影响
Fig.3 Transcription levels of inflammatory cytokines treated by different components from dandelion root
3 结论
本研究在对蒲公英根进行醇提的基础上,通过大孔吸附树脂柱分离和活性评价得到了蒲公英根的高效抗菌抗炎活性组分。最终建立的提取分离工艺为:70%乙醇回流提取后,用D101大孔吸附树脂进行柱分离,水洗脱之后的70%乙醇洗脱部位为蒲公英根的抗菌抗炎活性组分。该组分对9种人、畜禽常见病原菌具有显著的抑菌和杀菌作用,MIC和MBC分别可达1.95和31.25 mg/mL;对LPS诱导的小鼠巨噬细胞RAW264.7炎症模型的炎症因子IL-6、IL-1β和TNF-α的浓度和转录水平均有显著抑制作用。从初步的成分分析可以发现,该组分黄酮含量相对较高,这也为蒲公英根的进一步分离纯化、生物活性及其机制研究以及开发具有潜力的功能性食品、药品等提供了依据。
[1] 国家药典委员会.中华人民共和国药典(2020年版 一部)[S].北京:中国医药科技出版社,2020.
Chinese Pharmacopoeia Commision.Pharmacopoeia of the People’s Republic of China(2020,Volume I)[S].Beijing:China Medical Science Press,2020.
[2] 康文锦,徐兴军,刘佳人,等.蒲公英多糖对小鼠体内抗氧化酶活性及相关基因表达的影响[J].动物营养学报,2020,32(12):5 910-5 915.
KANG W J,XU X J,LIU J R,et al.Effects of dandelion polysaccharide on antioxidant enzyme activity and related gene expression in mice[J].Chinese Journal of Animal Nutrition,2020,32(12):5 910-5 915.
[3] 杨超,闫庆梓,唐洁,等.蒲公英挥发油成分分析及其抗炎抗肿瘤活性研究[J].中华中医药杂志,2018,33(7):3 106-3 111.
YANG C,YAN Q Z,TANG J,et al.Study on chemical composition of volatile oil from Taraxaci herba and its antiinflammatory and anti-tumor activities[J].China Journal of Traditional Chinese Medicine and Pharmacy,2018,33(7):3 106-3 111.
[4] REN F,LI J,YUAN X,et al.Dandelion polysaccharides exert anticancer effect on Hepatocellular carcinoma by inhibiting PI3K/AKT/mTOR pathway and enhancing immune response[J].Journal of Functional Foods,2019,55:263-274.
[5] 李超,董自波,蒋金来,等.HPLC法测定蒲公英中菊苣酸、咖啡酸与绿原酸[J].中草药,2015,46(23):3 577-3 580.
LI C,DONG Z B,JIANG J L,et al.Determination of cichoric acid,caffeic acid,and chlorogenic acid in Taraxaci herba by HPLC[J].Chinese Traditional and Herbal Drugs,2015,46(23):3 577-3 580.
[6] 陶亮亮,李鹏.超声辅助提取蒲公英中总黄酮的工艺研究[J].食品与发酵科技,2011,47(4):49-51;67.
TAO L L,LI P.Studying on the extraction process of total flavonoids from Taraxacum by ultrasonic wave[J].Food and Fermentation Technology,2011,47(4):49-51;67.
[7] 李侠,牛秋云,冯建国,等.超声波辅助提取蒲公英中生物碱的工艺研究[J].吉林农业大学学报,2013,35(2):233-235;240.
LI X,NIU Q Y,FENG J G,et al.Study on ultrasound extraction alkaloids from dandelion[J].Journal of Jilin Agricultural University,2013,35(2):233-235;240.
[8] 闫爽,李光耀,戴丛书,等.蒲公英提取物对2型糖尿病大鼠降血糖的作用[J].食品与机械,2020,36(11):138-142.
YAN S,LI G Y,DAI C S,et al.Study on the hypoglycemic effect of dandelion extract on type 2 diabetic rats[J].Food & Machinery,2020,36(11):138-142.
[9] IDDRISU I,ODURO I,TANDO H M A.The effect of dandelion leaves and roots on blood glucose in type 2 diabetic patients[J].Journal of Nutritional Ecology and Food Research,2016,3(2):125-132.
[10] 钟华晨,张三粉,冯小慧,等.植物提取物对奶牛乳房炎致病菌的抑菌效果研究[J].黑龙江畜牧兽医,2020(23):117-121;126.
ZHONG H C,ZHANG S F,FENG X H,et al.Study on the antibacterial effect of plant extracts on the pathogenic bacteria of dairy cow mastitis[J].Heilongjiang Animal Science and Veterinary Medicine,2020(23):117-121;126.
[11] LIANG Y K,DUAN H B,ZHANG P,et al.Extraction and isolation of the active ingredients of dandelion and its antifungal activity against Candida albicans[J].Molecular Medicine Reports,2020,21(1):229-239.
[12] 李欢,许艳艳,高进勇,等.蒲公英根多糖的体外抗炎作用研究[J].动物医学进展,2019,40(5):75-78.
LI H,XU Y Y,GAO J Y,et al.Anti-inflammatory effect of Taraxacum root polysaccharide in vitro[J].Progress in Veterinary Medicine,2019,40(5):75-78.
[13] YANG N,DONG Z B,TIAN G,et al.Protective effects of organic acid component from Taraxacum mongolicum Hand.-Mazz.against LPS-induced inflammation:Regulating the TLR4/IKK/NF-κB signal pathway[J].Journal of Ethnopharmacology,2016,194:395-402.
[14] CHEN J F,WU W B,ZHANG M M,et al.Taraxasterol suppresses inflammation in IL-1β-induced rheumatoid arthritis fibroblast-like synoviocytes and rheumatoid arthritis progression in mice[J].International Immunopharmacology,2019,70:274-283.
[15] KENNY O,J SMYTH T,M HEWAGE C,et al.Antioxidant properties and quantitative UPLC-MS/MS analysis of phenolic compounds in dandelion(Taraxacum officinale) root extracts[J].Free Radicals and Antioxidants,2014,4(1):55-61.
[16] DUAN L,ZHANG C M,ZHAO Y,et al.Comparison of bioactive phenolic compounds and antioxidant activities of different parts of Taraxacum mongolicum[J].Molecules(Basel,Switzerland),2020,25(14):E3260.
[17] 张智慧,邸彦橙,闫本纯,等.蒲公英萜醇对膀胱癌T24细胞增殖和凋亡的影响[J].中国临床药理学杂志,2020,36(17):2 682-2 685.
ZHANG Z H,DI Y C,YAN B C,et al.Effects of taraxerol on proliferation and apoptosis of bladder cancer T24 cells[J].The Chinese Journal of Clinical Pharmacology,2020,36(17):2 682-2 685.
[18] REN F,WU K X,YANG Y,et al.Dandelion polysaccharide exerts anti-angiogenesis effect on hepatocellular carcinoma by regulating VEGF/HIF-1α expression[J].Frontiers in Pharmacology,2020,11:460.
[19] 石丹,张宇.蒲公英多糖对小鼠肠道微生态的调节作用[J].微生物学免疫学进展,2016,44(3):49-53.
SHI D,ZHANG Y.Investigation of regulation from dandelion polysaccharides on mouse intestinal microecology[J].Progress in Microbiology and Immunology,2016,44(3):49-53.
[20] 刘珊珊,刘亚琼.蒲公英根类咖啡产品工艺优化及特性分析[J].食品科技,2018,43(9):134-141.
LIU S S,LIU Y Q.Process optimization and characteristic analysis for coffee-like flavored products of dandelion root[J].Food Science and Technology,2018,43(9):134-141.
[21] 吴海婷,张心媛,崔艳艳.类大麦茶风味蒲公英饮料的研究与开发[J].农产品加工,2019(7):20-23.
WU H T,ZHANG X Y,CUI Y Y.Research and development of dandelion beverage with barley tea flavor[J].Farm Products Processing,2019(7):20-23.
[22] 刘婷,张继秀,李先哲,等.蒲公英的开发与利用[J].沈阳药科大学学报,2019,36(5):450-458.
LIU T,ZHANG J X,LI X Z,et al.The progress on development and utilization of dandelion[J].Journal of Shenyang Pharmaceutical University,2019,36(5):450-458.
[23] 李宁,穆淑琴,闫峻,等.植物提取物和酸制剂替代抗生素对断奶仔猪健康的影响[J].饲料研究,2019,42(11):22-26.
LI N,MU S Q,YAN J,et al.Effect of plant extracts and acid preparations as substitutes for antibiotics on the health of weaned piglets[J].Feed Research,2019,42(11):22-26.
[24] 张静,温暖,刘阳洋,等.蒲公英根多糖提取及蒲公英多糖饮料的研制[J].农产品加工,2018(1):13-17.
ZHANG J,WEN N,LIU Y Y,et al.Extraction of polysaccharide from the dandelion root and development of its beverage[J].Farm Products Processing,2018(1):13-17.
[25] 葛明明,缪月英,孙丽娜,等.蒲公英根多糖的抗氧化活性研究[J].黑龙江医药科学,2014,37(2):39-41.
GE M M,MIAO Y Y,SUN L N,et al.Studies on antioxidant activity of polysaccharides from dandelion root[J].Heilongjiang Medicine and Pharmacy,2014,37(2):39-41.
[26] 马艳妮,王志尧,郭展展,等.忍冬叶总黄酮的测定及其体外抗菌活性[J].中国实验方剂学杂志,2017,23(6):55-59.
MA Y N,WANG Z Y,GUO Z Z,et al.Determination of total flavonoids of Lonicera japonica leaves and their in vitro antibacterial activity[J].Chinese Journal of Experimental Traditional Medical Formulae,2017,23(6):55-59.
[27] 黄传奇,张林碧,章习哲,等.北美圆柏与侧柏挥发性成分体外抑菌活性的比较[J].湖北中医药大学学报,2013,15(2):42-44.
HUANG C Q,ZHANG L B,ZHANG X Z,et al.Vitro antibacterial activity comparasion of volatile components between Sabina virginiana and Platycladus orientalis[J].Journal of Hubei University of Chinese Medicine,2013,15(2):42-44.
[28] 张静,邵永斌,谷新利,等.紫花地丁总黄酮体外抗炎活性研究[J].中国畜牧兽医,2020,47(4):1 258-1 266.
ZHANG J,SHAO Y B,GU X L,et al.Study on anti-inflammatory activity of total flavonoids from Viola yedoensis in vitro[J].China Animal Husbandry & Veterinary Medicine,2020,47(4):1 258-1 266.
[29] 刘文强,张懿玲,熊华,等.基于LPS诱导RAW 264.7巨噬细胞炎症模型的榴莲壳多酚抗炎作用及其分子机制[J].食品与机械,2020,36(4):15-20;50.
LIU W Q,ZHANG Y L,XIONG H,et al.Anti-inflammatory effect and molecular mechanism of durian hull polyphenols on LPS-induced RAW 264.7 macrophages[J].Food & Machinery,2020,36(4):15-20;50.