白酒是世界上最古老的蒸馏酒之一,不同白酒酒体风格迥异,可分为多种香型,其中酱香型、浓香型和清香型是白酒的基本香型[1]。影响白酒香型的因素诸多,除地域环境与酿造工艺等因素外,大曲对白酒风味的形成也做出了重要贡献。白酒大曲是白酒酿造所需的发酵剂和生香剂,为白酒酿造提供了丰富的微生物、酶和风味物质及其前体,不同香型的大曲为其对应白酒的酿造过程提供了不同的功能菌群,并在产香能力与产香种类方面存在一定的差异[2]。因此有必要研究不同香型大曲中微生物群落功能和风味组成差异以及两者之间的内在联系。
近年来,随着组学技术的快速发展,对于大曲中微生物的研究已经不再局限于传统可培养技术[3]。研究者们借助扩增子测序研究了不同时期[4]、等级[5]、季节[6]的大曲,揭示了大曲微生物组成并基于关联性分析发现大曲在发酵过程中微生群落受到发酵时间、温度、湿度等影响。ZANG等[7]、XU等[8]分别通过发酵微生物群落与发酵风味的关联性分析,探索了发酵鱼和辣椒发酵过程中产香核心功能菌群。HUANG等[9]、WANG等[10]也以风味为导向探索了白酒酿造过程中的产香核心功能菌群。然而,扩增子测序缺乏功能基因的具体信息,使得进一步深入研究面临瓶颈。相比之下宏基因组测序在一定程度上弥补了这些缺陷[11],可以更系统深入地研究微生物群落结构及其功能基因,全面分析其组成、变化规律、亲缘进化并挖掘出潜力丰富的功能基因,从而进一步揭开发酵食品微生物群落的神秘面纱[12]。
本研究选取了3种香型白酒大曲,基于宏基因组学技术对3种酒曲中微生物群落结构和功能基因进行研究,采用了顶空固相微萃取气质联用(headspace solid-phase microextraction/gas chromatography-mass spectrometry)方法解析了大曲中风味物质,并对大曲核心菌群以及特征风味进行了关联性分析。以此探索微生物和风味之间的关系,以及各自的关键产香功能微生物,这对于在微观层面了解3种香型大曲的差异原因,以及稳定和改善白酒大曲风味和品质从而保证不同香型白酒主体香突出具有重要的意义。
1 材料与方法
1.1 材料和试剂
大曲样品:酱香型白酒大曲HT,四川省某酒厂;浓香型白酒大曲MT,江苏省某酒厂;清香型白酒大曲LT,山西省某酒厂。
主要试剂:磷酸氢二钠、磷酸二氢钾、氯化钠、氯化钾,均为分析纯,中国医药集团有限公司;DNeasy PowerSoil Pro Kit,QIAGEN公司。
1.2 仪器与设备
电泳仪、Gel Doc 凝胶成像系统,美国 Bio-Rad 公司;台式高速离心机,德国 Eppendorf 公司;气相色谱质谱联用仪SCIONSQ-456-GC,美国布鲁克公司;Illumina HiSeq4000测序平台,美国Illumina 公司。
1.3 DNA提取
称取5 g大曲样品,加入15 mL PBS缓冲液于50 mL 的离心管中,加入玻璃珠3颗,充分振荡5 min后以离心力150×g离心5 min,取上清液于离心管中。再向沉淀中加入5 mL PBS缓冲液重复洗两次,150×g离心5 min,收集上清液。将收集的上清液10 000×g 离心10 min,收集菌体沉淀,后参照QIAGEN公司DNeasy PowerSoil Pro Kit试剂盒说明书提取DNA。提取得到的DNA用1%琼脂糖凝胶电泳和分光光度法进行质量和浓度检测。质检合格的样本样品贮存在-20 ℃以备后续实验使用。
1.4 宏基因组测序
1.4.1 建库测序
检测合格的DNA样品用Covaris超声波破碎仪将基因组DNA随机打断成长度约300 bp左右的小片段,经末端修复、加A尾、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库至2 ng/μL,随后使用Agilent 2100对文库的插入片段进行检测,插入片段符合预期后,使用qPCR方法对文库的有效浓度进行准确定量(文库有效浓度3 nmol/L),以保证文库质量。文库质检合格后,把不同文库按照有效浓度及目标下机数据量的需求pooling后在Illumina HiSeq4000平台测序。
1.4.2 数据分析处理
对原始下机数据使用Trimmomatic软件进行质控,包括去除接头序列、低质量reads。(1) 过滤带有测序接头的reads;(2) 过滤N(不确定碱基)含量比例>1%的reads;(3) 过滤低质量碱基(Q20)含量>50%的reads。并过滤质控后片段长度仍<150 bp的reads。质控后将得到的高质量序列clean reads使用DIAMOND BLASTX算法进行比对和物种注释,使用组装软件MEGAHIT (v1.0.6) 对测序数据进行组装,并过滤掉组装结果中500 bp以下的片段。采用prodigal软件对组装得到的contig序列进行ORF (Open Reading Frame) 预测,使用CD-HIT软件对预测的结果去冗余,从而得到非冗余基因集。采用Bowtie软件将测序数据与构建的非冗余基因集进行比对,并统计单个基因在不同样本的丰度信息。将预测得到非冗余基因集与功能注释数据库NR、KEGG进行比对和注释。
1.5 HS-SPME-GC-MS解析大曲挥发性物质
1g大曲样品与内标10 μL 2-辛醇 (10 mg/L) 混合,用SPME纤维(50∶30 mm二乙烯基苯-羧基-聚二甲基硅氧烷)在60 ℃下萃取30 min。在DB-Wax色谱柱(30.0 m×0.25 mm×0.25 μm)上进行化合物的分离。氦气以0.8 mL/min的恒定流速用作载气。在40 ℃下保持3 min,以6 ℃/min到100 ℃,然后以10 ℃/min到230 ℃,并保持6 min。质谱仪以电子碰撞模式操作,电子能量设置为70 eV,扫描范围为33~400 m/z。MS源和四级杆的温度分别设置为200 ℃和230 ℃。使用美国国家标准与技术研究所 (National Institute of Standards and Technology, NIST) 和Wiley数据库鉴定每种化合物。选择正负匹配度>800的化合物。根据内标峰面积与风味物质峰面积的比值,计算出大曲挥发风味的相对浓度。
1.6 核心微生物与差异风味的关联性分析
将偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)得到的变量重要性投影 (variable Importance for the projection,VIP)值>1的风味物质和每种大曲丰度前3以及线性判别分析 (linear discriminant analysis,LDA)值>3.5的细菌属和真菌属作为变量,通过R语言批量计算变量之间的Spearman相关系数,选取微生物与风味成分之间相关性系数绝对值>0.6且相关性显著 (P<0.05) 的部分进行关联网络可视化。使用Cytoscape对大曲微生物与风味成分的相关性和微生物之间的互作关系进行可视化。
2 结果与分析
2.1 三种香型大曲微生物结构差异分析
对3种香型大曲的微生物群落进行物种注释。首先对其进行多样性差异分析,由图1-a可知,3种大曲中,清香型大曲的细菌多样性与丰富度最高,而浓香型大曲细菌群落的丰富度与多样性均显著低于其他两种曲(P<0.05)。酱香型大曲的真菌多样性与丰富度都显著高于其他两种曲(图1-b,P<0.05),清香型大曲的真菌多样性最低而浓香型大曲的真菌丰富度最低。基于主坐标分析(principal co-ordinates analysis,PCoA)可知(图1-c~图1-d),3种大曲无论在细菌群落结构还是真菌群落结构上都存在着显著的差异。
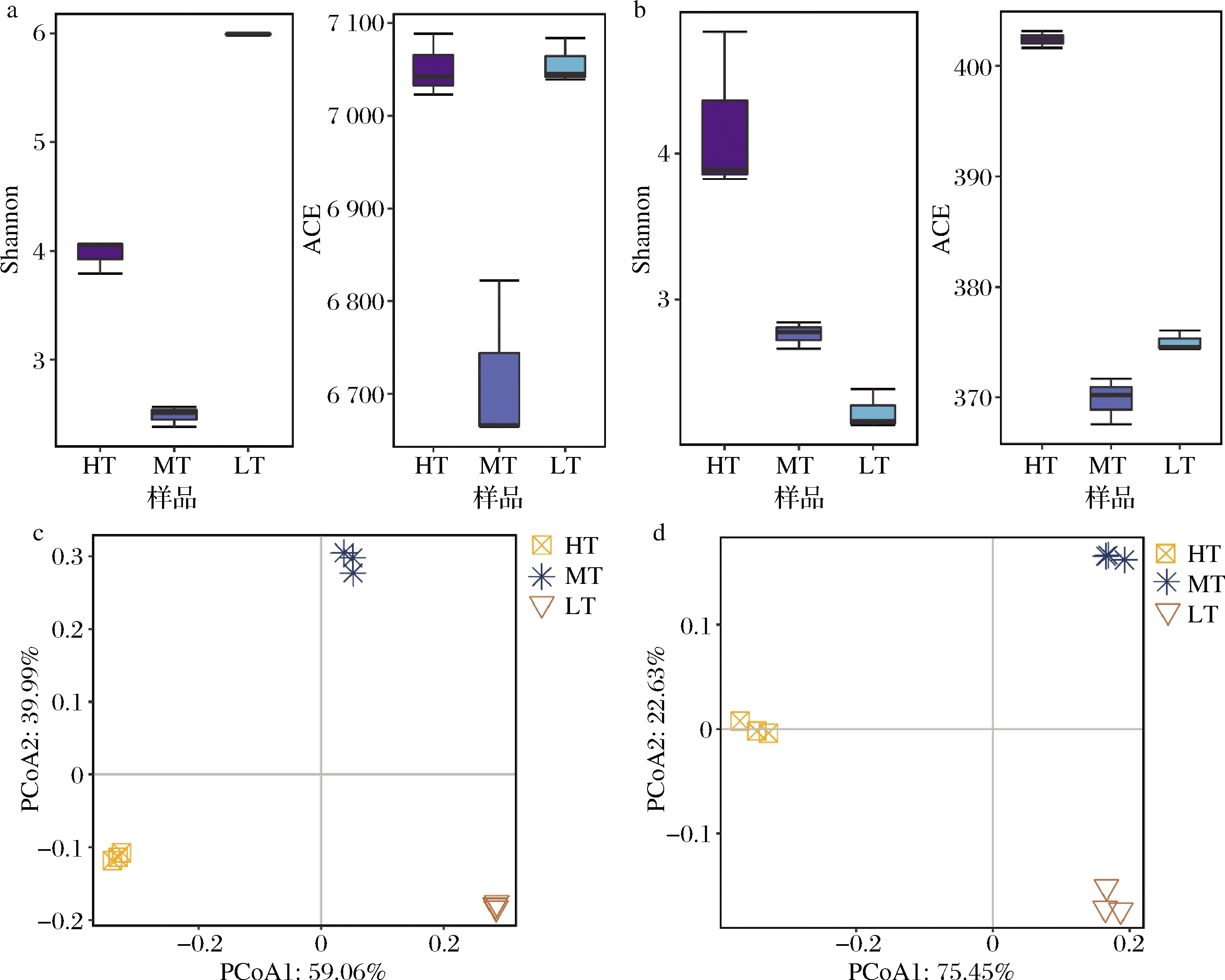
a-细菌α-多样性分析;b-真菌α-多样性分析;c-细菌β-多样性分析;d-真菌β-多样性分析
图1 三种香型大曲微生物多样性分析
Fig.1 Microbial diversity analysis of three types of Daqu
2.2 三种香型大曲微生物群落组成
3种香型大曲中主要注释到3种细菌门,分别是Firmicutes,Actinobacteria和Proteobacteria,其中Firmicutes在浓香型大曲占据主导地位,其平均相对丰度总和>97%。在清香型大曲中Firmicutes,Actinobacteria占据主导地位,其平均相对丰度总和>99%。在酱香型大曲中Firmicutes,Actinobacteria和Proteobacteria占据主导地位,其平均相对丰度总和>99%,且Proteobacteria的丰度远高于其他两种大曲。同时主要注释到两种真菌门,Ascomycota和Mucoromycota,其相对丰度总和在3种大曲中均>99%,其中Ascomycota在酱香型大曲中的相对丰度最高而Mucoromycota在浓香型大曲中的相对丰度最高。
在属水平上对3种香型大曲相对丰度前20的优势细菌与优势真菌进行分析,由图2可知,Desmospora、Saccharopolyspora和Bacillus是酱香型大曲主要优势细菌属,Byssochlamys、Aspergillus、Rasamsonia和Lichtheimia是酱香型大曲的优势真菌属,通过线性判别分析(linear discriminant analysis effect size,LEfSe)可知,细菌属Desmospora、Saccharopolyspora和真菌属Byssochlamys、Aspergillus、Rasamsonia是酱香型大曲的标记微生物属 (LDA>3.5);浓香型大曲微生物群落主要由优势细菌属Bacillus、Leuconostoc和优势真菌属Lichtheimia、Saccharomyces、Pichia组成,其标记微生物主要为Bacillus、Lichtheimia和Saccharomyces。清香型大曲的细菌群落组成较为均匀,其优势菌属的相对丰度差异较小,主要由Lactobacillus、Leuconostoc、Weissella、Streptomyces和Staphylococcus等产酸细菌属组成,且是其标记微生物,而其真菌群落则主要由Pichia和Lichtheimia组成,其中Pichia是清香型大曲的标记真菌属。
2.3 三种香型大曲微生物群落功能差异分析
基于KEGG数据库对3种大曲的基因进行功能注释,由图3-a所示的二级代谢通路信息可知,3种大曲中参与Carbohydrate metabolism(碳水化合物代谢)与Amino acid metabolism(氨基酸代谢)的功能基因最多,在所有的代谢通路中所占比例最高,说明在大曲发酵过程中微生物对碳水化合物与氨基酸等物质的代谢活动较为旺盛。大曲原料富含淀粉与蛋白质,微生物在该类大分子原料的代谢降解中发挥了巨大的作用,其代谢产物如还原糖与氨基酸在满足微生物自身生长代谢的同时,还可生成风味物质及其前体。在还原糖被微生物利用与转化过程中伴生多种酸、醇和醛类物质,而氨基酸决定了酒的风味,在酒的香型及口感形成中起着重要作用[13]。同时还原糖与氨基酸在发酵过程中会发生美拉德反应从而形成风味物质,曲温越高,该反应越易发生。3种大曲Carbohydrate metabolism(碳水化合物代谢)、Amino acid metabolism(氨基酸代谢)、Nucleotide metabolism(核苷酸代谢)、Metabolism of cofactors and vitamins(辅因子与氨基酸代谢)和Metabolism of other amino acids(其他氨基酸代谢)等与原料利用相关的代谢通路的比例均存在显著的差异 (P<0.05),其中清香型大曲微生物在碳水化合物代谢的比例显著高于其他两种大曲,酱香型大曲微生物在氨基酸代谢的比例相对最高。对代谢通路进一步分析,如图3-b所示为丰度前30的三级代谢通路,如ABC transporters(ABC 转运)、Biosynthesis of amino acids(氨基酸生物合成)和Carbon metabolism(碳代谢)等。通过单因素方差分析可知,3种大曲微生物在碳水化合物代谢中的Pyruvate metabolism(丙酮酸代谢)、Amino sugar and nucleotide sugar metabolism(氨基糖和核糖代谢)、Glycolysis/Gluconeogenesis(糖酵解/糖异生)、Starch and sucrose metabolism(淀粉和蔗糖代谢)、Citrate cycle(三羧酸循环)和Butanoate metabolism(丁酸盐代谢)通路都存在显著的差异,并且在清香型大曲中所占的比例高于其他2种大曲。3种大曲在氨基酸代谢中的Alanine, aspartate and glutamate metabolism(丙氨酸、天冬氨酸和谷氨酸代谢)和Glycine, serine and threonine metabolism(甘氨酸、丝氨酸和苏氨酸代谢)通路上同样存在显著差异,前者在清香型大曲中所占比例高于其他2种大曲,后者在酱香型大曲中所占比例最高。
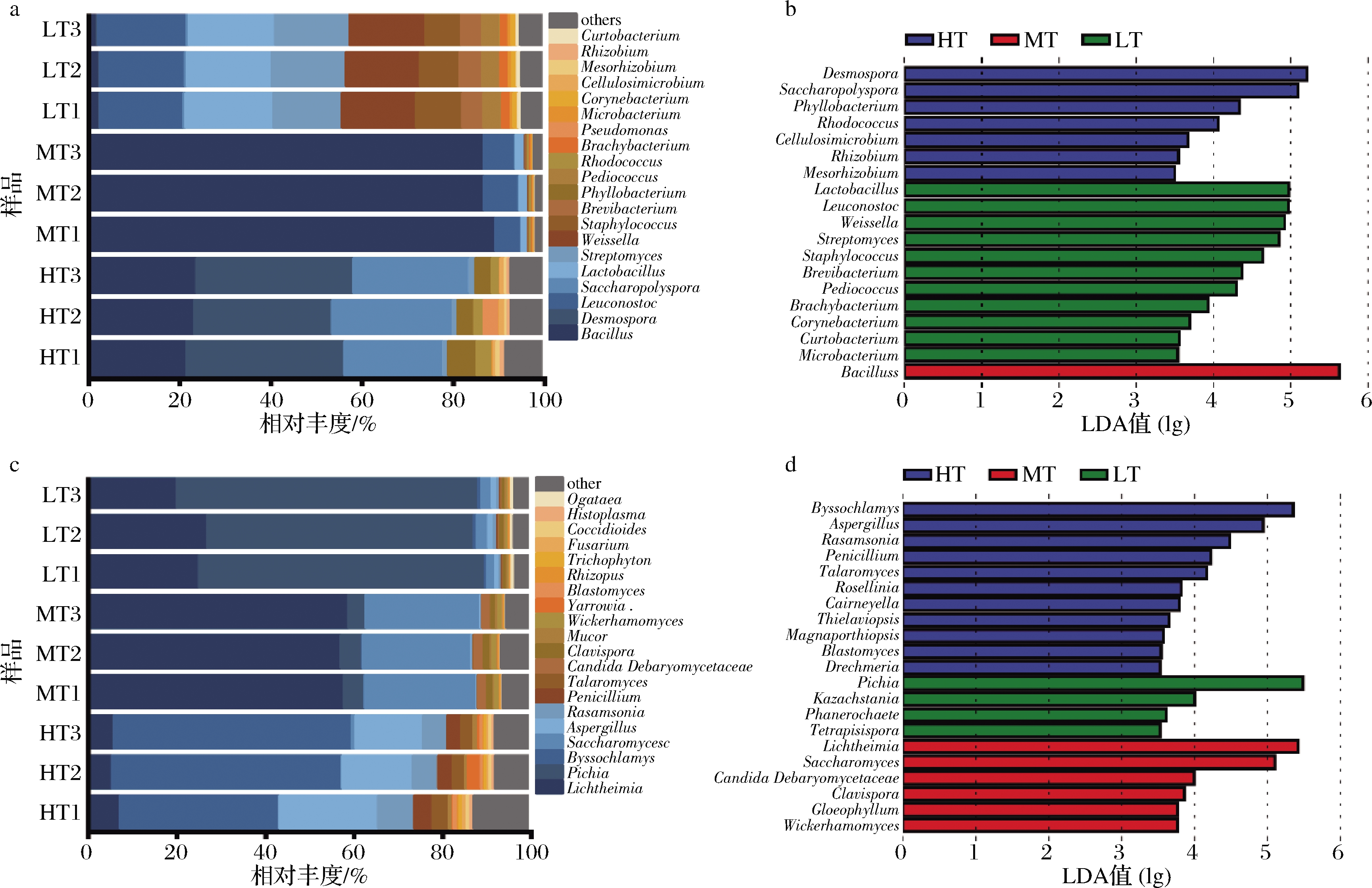
a-优势细菌属;b-细菌属LEfSe分析;c-优势真菌属;d-真菌属LEfSe分析
图2 三种香型大曲优势微生物与标记微生物
Fig.2 Dominant and marker microorganisms of three types of Daqu
2.4 三种香型大曲挥发性代谢物质组成分析
从三种大曲中总共检测出60种挥发性化合物,由图4-a可知,酱香型大曲、浓香型大曲和清香型大曲中分别检测到32、50和39种物质,其中3种大曲共有的物质有21种,浓香型特有的风味最多有10种。所有化合物主要分为六大类,包括5种酸类物质、5种酮类物质、7种醛类物质、11种吡嗪类物质、21种酯类物质和11种醇类物质(图4-c)。如图4-b所示,酯类物质、吡嗪类物质和醇类物质在大曲挥发性物质组成中均占主导地位,其中清香型大曲中的酯含量最高,浓香型大曲次之,酱香型大曲则相对最少。之前的报告中也发现清香型白酒的酯含量较高[14]。浓香型大曲中的吡嗪类物质浓度总和高于酱香型大曲和清香型大曲(图4-b),从已有报道中,同样发现了浓香型大曲中含有丰富的吡嗪类物质[15]。白酒中的四甲基吡嗪主要由Bacillus生成的乙偶姻与铵盐经化学反应而成[16],在2.2中也发现浓香型大曲中Bacillus的含量高于另外2种大曲。根据半定量得到的风味物质浓度绘制了热图,发现酱香型大曲优势风味物质种类数量最少,主要集中在酸、醇和吡嗪,这与之前在研究酱香型白酒风味时发现其有机酸总量明显高于浓香型及清香型白酒是一致的[17]。清香型大曲优势风味物质主要集中在酯类和醇类,并且只在清香型大曲中发现了乳酸乙酯,这与之前报道的乳酸乙酯是清香型白酒的特征风味相符合[18]。乳酸乙酯的关键前体是乳酸[19],乳酸是乳酸菌的重要产物,乳酸菌在大曲较为常见,因此推测清香型大曲中乳酸菌对乳酸乙酯的生成与积累具有一定的正向作用。并且,乳酸自身也可以减少白酒的刺激性气味,使白酒具有回甜感,增加白酒的风味[20]。浓香型大曲的优势风味数量最多,主要集中在吡嗪和酯类,且浓香型大曲含有的酯类和吡嗪类的种类是最为丰富的。
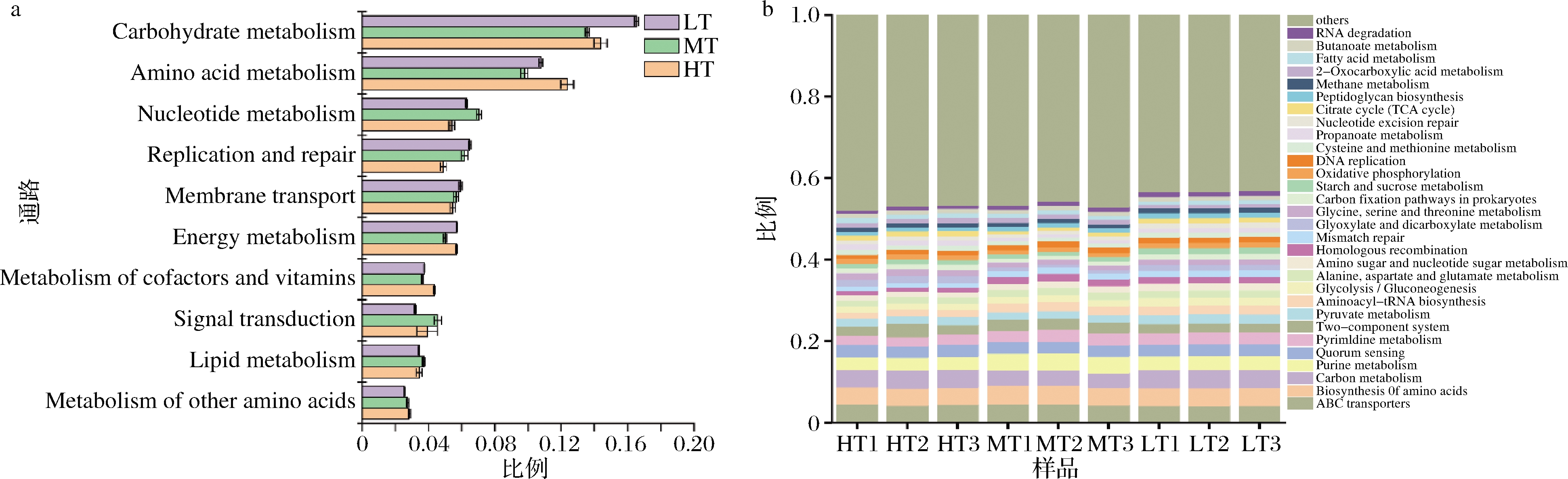
a-3种大曲优势二级代谢通路;b-3种大曲优势三级代谢通路
图3 三种香型大曲基于KEGG数据库的二级和三级代谢功能分析
Fig.3 KEGG analysis of gene expression on first and second level of three types of Daqu

a-3种大曲代谢物VENN图;b-3种大曲各类物质含量;c-3种大曲主要代谢物质热图分析
图4 三种香型大曲挥发性物质组成
Fig.4 The flavor composition of the three types of Daqu
2.5 三种香型大曲典型风味物质解析
利用PLS-DA解析3种香型大曲代谢组成差异。PLS-DA得分图(图5-a,Q2>0.95)显示,9个样品根据其香型各自聚为3类,表明不同香型大曲之间的代谢物组成具有显著差异。由VIP图可知共有11种代谢物对该模型的代谢组成差异做出了重要贡献(图5-c,VIP值>1),结果表明四甲基吡嗪、乙酸乙酯、三甲基吡嗪和2,3-丁二醇是浓香型大曲区别于其他2种香型大曲代谢组成的典型风味物质。己酸乙酯、十七酸乙酯、辛酸乙酯、庚醇和庚酸乙酯是清香型区别于其他2种香型大曲代谢组成的典型风味物质。在前面的KEGG注释中,也发现清香型大曲丁酸盐代谢通路显著高于另外2种大曲,丁酸作为己酸的前体,丁酸的积累也为己酸乙酯的合成提供了基础。尽管酱香型大曲中没有显著的代谢物,但在其中鉴定到8种特有物质,包括2-甲基丙酸、戊醇、癸醇和十三醇等风味物质。
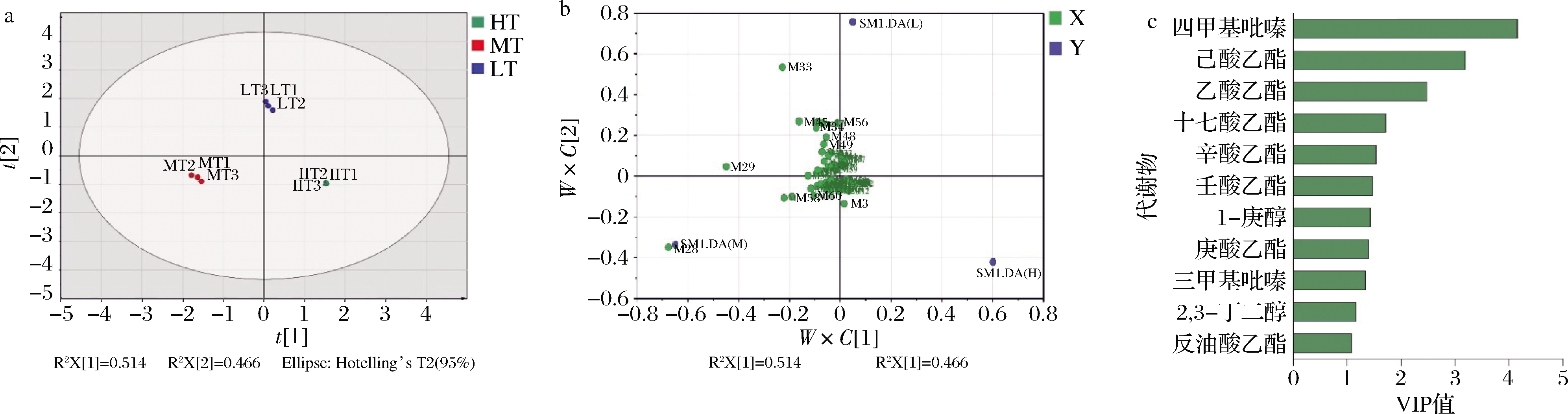
a-PLS-DA的得分图;b-PLS-DA的载荷图;c-重要代谢物的VIP图
图5 三种香型大曲代谢物差异分析
Fig.5 Difference analysis of metabolites of three types of Daqu
2.6 微生物和风味物质关联分析
在分析了3种香型大曲优势、差异微生物和差异风味的基础上,利用Spearman相关系数分析3种香型大曲优势差异菌属间与特征风味物质间的互作关系。若相关系数>0.6且P<0.05,则定义为具有显著相关性。由图6-a可知,己酸乙酯与庚酸乙酯等酯类物质主要与细菌属存在关联,如Lactobacillus、Weissella和Leuconostoc等细菌属,除此之外,酯类物质普遍与真菌属Pichia存在显著的强正相关,同时Pichia与上述细菌属均具有显著的正相关性(图6-b)。该结果表明,Pichia与Lactobacillus、Weissella和Leuconostoc为大曲中的产酯功能菌群。已有研究发现酯类主要合成途径是酸和醇在酯化酶作用下的合成的[21],两者都需要微生物的参与,且发生在白酒发酵过程中。根据之前的报道,Lactobacillus、Weissella和Leuconostoc具有产酸能力,同时Pichia具有较强的产酯能力[22],前者可通过代谢产酸为后者提供产酯前体物质。在2.2和2.4的研究中,发现上述产酯功能菌群是清香型大曲的优势标记微生物,且清香型大曲的酯类含量显著高于其他2种香型大曲(图4-b),进一步证明了该菌群具有产酯能力。由6-a图可知,在大曲发酵过程中,Bacillus与2,3-丁二醇呈显著正相关,这与之前Bacillus具有产2,3-丁二醇能力的报道一致[23]。在2.2和2.4的研究中也发现,浓香型大曲中Bacillus在菌群结构中占据绝对优势,且2,3-丁二醇在浓香型白酒中含量显著高于其他2种香型大曲。

a-微生物与重要风味物关联分析;b-微生物间的关联分析(红线为正相关,黑线为负相关)
图6 微生物和风味成分的相关性网络图
Fig.6 Correlation network between microbial genera and flavor compounds
3 结论与讨论
本研究基于宏基因组学技术与代谢组学技术探究3种不同香型大曲间微生物与挥发性代谢物质间的组成差异,并通过关联性分析解析造成3种大曲特征风味差异的内在原因。从微生物层面来看,3种大曲的微生物群落结构具有显著差异。3种大曲的发酵温度以清香、浓香到酱香呈递增趋势,因而大曲中的优势菌属随着该趋势慢慢演替至由耐高温菌属组成的优势菌群,清香型大曲的优势菌属主要为Lactobacillus、Leuconostoc、Weissella、Streptomyces和Staphylococcus以及Pichia等产酸产酯菌属,酱香型大曲的优势菌属主要为Saccharopolyspora和Bacillus等耐高温菌属[24],而浓香型大曲菌群结构则介于2种大曲之间,兼具清香与酱香2种大曲优势菌群的特色,既有耐高温的优势菌属Bacillus,又存在Pichia等优势产酯菌属[22]。该结论同样可以从图1 观察到,浓香大曲微生物PCoA1轴上,介于清香与酱香大曲之间。从宏基因组功能分析可知,3种香型大曲微生物在发酵过程中对淀粉及蛋白质等原料利用与转化的代谢活动最为强烈,而其相关功能基因的比例存在显著的差异,其中清香型大曲微生物在淀粉代谢、三羧酸循环、丙酮酸代谢和糖酵解等碳水化合物代谢活动的强烈程度均高于酱香型大曲与浓香型大曲,而酱香型大曲在总体氨基酸代谢的强烈程度则显著高于其他2种大曲。从代谢物质层面来看,Pichia与Lactobacillus、Weissella和Leuconostoc作为清香型大曲标记微生物,是其产酯互作菌群。浓香型大曲中富含Bacillus,可代谢生成2,3-丁二醇和吡嗪,使其在浓香型白酒中含量显著高于其他2种香型大曲。
本研究探究了3种香型大曲的标记微生物与典型风味物质,并通过关联性分析揭示了其内在联系,这对于寻找大曲中关键的产香微生物来强化不同香型白酒主体风味以及为后续的白酒酿造提供高质量大曲提供了理论基础。后期工作可以基于该分析方法确定功能微生物,并对其进行筛选培养以及功能验证,开发出功能型强化大曲,并将其应用于不同类型的白酒酿造中,在保证不同香型白酒特征风味的同时提高白酒整体品质。
[1] 王海燕. PCR-DGGE技术对清香型汾酒微生物群落结构演变规律的研究[D].无锡:江南大学, 2014.
WANG H Y.Analysis of microbial community in the brewing of light aroma style Fenjiu using PCR-DGGE[D].Wuxi:Jiangnan University, 2014.
[2] 李兵, 张超, 王玉霞, 等.白酒大曲功能微生物与酶系研究进展[J].中国酿造, 2019, 38(6):7-12.
LI B, ZHANG C, WANG Y X, et al.Research progress on functional microbes and enzymes in Daqu of Baijiu[J].China Brewing, 2019, 38(6):7-12.
[3] 余晶晶, 黄永光.基因组学及其在白酒酿造基础研究领域中的应用[J].食品与发酵工业, 2021, 47(7):278-284.
YU J J, HUANG Y G, Genomics and its application in basic research field of Baijiu brewing[J].Food and Fermentation Industries, 2021, 47(7):278-284.
[4] JIANG Q E, WU X Y, XU Y Q, et al.Microbial composition and dynamic succession during the Daqu production process of Northern Jiang-flavored liquor in China[J].3 Biotech, 2021, 11(5):224.
[5] 柳习月, 朱琪, 杨帆, 等.多组学解析酱香型大曲风味物质的形成[J].食品与发酵工业,2021,47(22):35-41.
LIU X Y, ZHU Q, YANG F, et.al.Multi-omics reveal the formation of flavor compounds in sauce-flavor Daqu[J].Food and Fermentation Industries,2021,47(22):35-41.
[6] FU G M, DENG M F, CHEN Y, et al.Analysis of microbial community, physiochemical indices, and volatile compounds of Chinese te-flavor Baijiu Daqu produced in different seasons[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6 525-6 532.
[7] ZANG J H, XU Y S, XIA W S, et al.Correlations between microbiota succession and flavor formation during fermentation of Chinese low-salt fermented common carp (Cyprinus carpio L.) inoculated with mixed starter cultures[J].Food Microbiology, 2020, 90:103487.
[8] XU X X, WU B B, ZHAO W T, et al.Correlation between autochthonous microbial communities and key odorants during the fermentation of red pepper (Capsicum annuum L.) [J].Food Microbiology, 2020, 91:103510.
[9] HUANG Z R, HONG J L, XU J X, et al.Exploring core functional microbiota responsible for the production of volatile flavour during the traditional brewing of Wuyi Hong Qu glutinous rice wine[J].Food Microbiology, 2018, 76:487-496.
[10] WANG S L, WU Q, NIE Y, et al.Construction of synthetic microbiota for reproducible flavor compound metabolism in Chinese light-aroma-type liquor produced by solid-state fermentation[J].Applied and Environmental Microbiology, 2019, 85(10):e03090-e03018.
[11] FRANZOSA E A, HSU T, SIROTA-MADI A, et al.Sequencing and beyond:Integrating molecular ‘omics’ for microbial community profiling[J].Nature Reviews Microbiology, 2015, 13:360-372.
[12] 雷忠华, 陈聪聪, 陈谷.基于宏基因组和宏转录组的发酵食品微生物研究进展[J].食品科学, 2018, 39(3):330-337.
LEI Z H, CHEN C C, CHEN G.Metagenomic and metatranscriptomic analysis of microbiota in fermented foods:Review of recent advances[J].Food Science, 2018, 39(3):330-337.
[13] 张巧玲, 吕锡斌, 秦兴, 等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造, 2019, 38(4):53-57.
ZHANG Q L, LYU X B, QIN X, et al.Comparative analysis of free amino acids in high temperature Daqu of Moutai-flavor Baijiu[J].China Brewing, 2019, 38(4):53-57.
[14] 王震, 叶宏, 朱婷婷, 等.清香型白酒风味成分的研究进展[J/OL].食品科学,2022.http://kns.cnki.net/kcms/detail/11.2206.TS.20210618.1918.074.html.
WANG Z, YE H, ZHU T T, et al.Research progresses on the flavor components of light flavor Baijiu[J/OL].Food Science,2022.http://kns.cnki.net/kcms/detail/11.2206.TS.20210618.1918.074.html.
[15] 吴建峰, 孙莹, 季方, 等.浓香型721型曲培养周期内风味成分变化的分析研究[J].酿酒科技, 2016, (12):43-46.
WU J F, SUN Y, JI F, et.al.Change of flavoring components of nongxiang 721 Daqu in the culture stage[J].Liquor-Making Science & Technology, 2016, (12):43-46.
[16] 吴建峰. 白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学, 2013.
WU J F.Study on the biosynthesis mechanism of tetramethylpyrazine during the Chinese liquor brewing[D].Wuxi:Jiangnan University, 2014.
[17] 沈海月. 酱香型白酒香气物质研究[D].无锡:江南大学, 2010.
SHEN H Y, Studies on aroma compounds of Chinese soy sauce aroma type liquor[D].Wuxi:Jiangnan University, 2010.
[18] 郝飞龙, 范莹, 延莎, 等.HS-SPME/LLME-GC-MS结合感官品评分析山西清香型恒酒香气成分[J].现代食品科技, 2018, 34(3):203-211.
HAO F L, FAN Y, YAN S, et al.Analysis of aroma components in fen-flavor Hengjiu from Shanxi by HS-SPME/LLME-GC-MS and sensory evaluation[J].Modern Food Science and Technology, 2018, 34(3):203-211.
[19] 沈怡方. 白酒中四大乙酯在酿造发酵中形成的探讨[J].酿酒科技, 2003(5):28-31.
SHENG Y F.Study on the formation mechanism of four main kinds of ethyl esters in the fermentation of liquors[J].Liquor-Making Science & Technology, 2003(5):28-31.
[20] 王世伟, 王卿惠, 芦利军, 等.白酒酿造微生物多样性、酶系与风味物质形成的研究进展[J].农业生物技术学报, 2017, 25(12):2 038-2 051.
WANG S W, WANG Q H, LU L J, et al.Research progress of the microbial diversity, enzyme system and formation of flavor compounds in Chinese flavor liquor[J].Journal of Agricultural Biotechnology, 2017, 25(12):2 038-2 051.
[21] PARK Y C, SHAFFER C E H, BENNETT G N.Microbial formation of esters[J].Applied Microbiology and Biotechnology, 2009, 85(1):13-25.
[22] 吴健, 何伟, 王建成, 等.酿酒酵母与产香酵母发酵特性及其相互作用规律[J].食品与发酵工业, 2020, 46(20):78-87.
WU J, HE W, WANG J C, et al.Fermentation characteristics and interaction of Saccharomyces cerevisiae and aroma-producing yeast[J].Food and Fermentation Industries, 2020, 46(20):78-87.
[23] 张帜, 李理想, 马翠卿.芽胞杆菌发酵产2,3丁二醇的研究进展及展望[J].生物加工过程, 2014, 12(3):79-86.
ZHANG Z, LI L X, MA C Q, Research advance and prospects of fermentation of 2,3-butanediol by Bacillus sp.[J].Chinese Journal of Bioprocess Engineering, 2014, 12(3):79-86.
[24] 吴群, 徐岩.高温大曲中地衣芽胞杆菌 (Bacillus licheniformis CGMCC 3963) 的耐高温特征[J].微生物学报, 2012, 52(7):910-915.
WU Q, XU Y, Thermotolerance of Bacillus licheniformis CGMCC 3963 from high-temperature Daqu[J].Acta Microbiologica Sinica, 2012, 52(7):910-915.