肉豆蔻(Myristica fragrans)别名肉蔻、玉果等,为肉豆蔻科常绿高大乔木,目前在广东、云南等地大量种植[1]。其种子呈卵珠形,在冬、夏两季果实成熟时采收,种子中含有多种活性成分,尤其挥发油含量较高。现代科学研究表明,肉豆蔻挥发油是肉豆蔻中重要的功能成分,具有抑菌、抗癌、保肝等多种功能作用[2-3]。
目前,已报道的有关肉豆蔻挥发油的提取方法有水蒸气蒸馏提取、超临界CO2萃取工艺、亚临界萃取工艺、微波辅助水蒸气蒸馏提取和超声辅助提取工艺法等[4-5]。在这些提取方法中,均存在不同程度的缺陷,如水蒸气蒸馏法提取时间较长;超临界CO2萃取和亚临界萃取所需仪器设备昂贵;微波辅助提取时温度较高,容易对挥发油产生过热反应;超声辅助提取时热效应较差,不能达到提取所需要的温度。因此,探寻操作方便,成本低廉的挥发油提取方法依然是研究热点。而采用酶法辅助水蒸气蒸馏提取肉豆蔻挥发油的工艺还未见报道,尤其酶法辅助水蒸气蒸馏提取对挥发油的品质是否产生影响值得深入研究。此外,国内外许多学者做了大量有关植物挥发油抗氧化活性的研究,而关于肉豆蔻挥发油清除亚硝酸盐作用和阻断亚硝胺合成的作用还未见报道。因此,本实验在前期研究基础上,采用纤维素酶辅助水蒸气蒸馏和传统的水蒸气蒸馏提取肉豆蔻挥发油,通过对挥发油提取率、感官特征、理化性质、化学成分、主要官能团结构、热力学性质和肉豆蔻原料的微观结构进行分析,再研究挥发油消除亚硝酸盐的作用和阻断亚硝胺合成的作用,为扩大肉豆蔻挥发油的应用范围,实现高效利用肉豆蔻挥发油提供参考。
1 材料与方法
1.1 材料与试剂
肉豆蔻购自安徽毫州福生堂中药材公司,经粉碎过20目筛后于4 ℃冰箱保存;冰乙酸、三氯甲烷、硫代硫酸钠、NaNO2,成都市科隆化学品有限公司;碘化钾,广东光华科技股份有限公司;N-1-萘乙二胺盐酸盐,上海阿拉丁生化科技有限公司;对氨基苯磺酸,成都市科龙化工试剂厂。以上试剂均为常规分析纯。
1.2 仪器与设备
XH-JSG挥发油测定器,上海臻浔金属制品有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;7890A-5975C气相色谱-质谱联用仪,安捷伦科技有限公司;NicoletIS10傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司;Q200MDSC差示扫描量热仪,美国TA仪器有限公司;Evo18扫描电子显微镜,德国卡尔·蔡司股份公司。
1.3 实验方法
1.3.1 肉豆蔻挥发油的提取
1.3.1.1 水蒸气蒸馏提取
按照《中国药典》I部(2010年)附录XD中甲法进行提取。称取20 g肉豆蔻粉末置于500 mL圆底烧瓶,按一定料液比加水,连接挥发油测定器与回流冷凝管,将烧瓶置电热套中加热至沸腾,并保持沸腾300 min,至测定器中油量不再增加。挥发油提取率计算如公式(1)所示:
(1)
式中:c为提取率,%;m1为挥发油体积,mL;ρ为挥发油密度,g/mL;m2为肉豆蔻粉末质量,g。
1.3.1.2 酶法辅助水蒸气蒸馏提取
称取20 g肉豆蔻粉末于具塞烧瓶中,加入一定体积的水,调节温度和pH,再按照肉豆蔻粉末质量加入一定量纤维素酶,盖塞,在水浴恒温振荡器中进行酶解;酶解完成后,连接挥发油测定器和冷凝管,采用电热套加热至微沸,进行水蒸气蒸馏提取。挥发油提取率按公式(1)计算。单因素和响应面试验确定的纤维素酶辅助水蒸气蒸馏提取肉豆蔻挥发油的最佳提取工艺条件为:酶添加量1.2%(质量分数),pH 4.0,酶解温度45 ℃,液料比13∶1(mL∶g),酶解时间47 min,蒸馏时间193 min,进行蒸馏提取。
1.3.2 肉豆蔻粉末的扫描电镜观察
将未提取处理、水蒸气蒸馏提取和纤维素酶辅助水蒸气蒸馏提取后的肉豆蔻粉末经真空干燥后,作喷金处理,用扫描电子显微镜观察其微观结构的变化。
1.3.3 肉豆蔻挥发油感官品质及其基本理化指标测定
1.3.3.1 感官品质评价
将2种方法提取的挥发油按照GB/T 14454.2—2008 《香料 香气评定法》第2法成对比较检验法测定。
1.3.3.2 理化指标测定
将2种方法提取的肉豆蔻挥发油按GB/T 11540—2008 《香料 相对密度的测定》、GB/T 14454.6—2008《香料 蒸发后残留物含量的评估》、GB/T 14455.5—2008 《香料 酸值或含酸量的测定》、GB/T 14455.6—2008 《香料 酯值或含酯量的测定》和GB/T 33918—2017 《香料 过氧化值的测定》分别测定相对密度、蒸发后残留物含量、酸值、酯值和过氧化值;按GB/T 14455.5测得的酸值加上按GB/T 14455.6测得的酯值计算皂化值。
1.3.4 GC-MS测定
参考李力等[6]方法稍作修改,分析条件如下:GC条件:HP-5MS弹性石英毛细管柱(柱长30 m,膜厚0.25 μm,内径0.25 mm);载气为高纯氦气,流速为1 mL/min。进样量1 μL,进样口温度250 ℃,分流比20∶1;升温程序:起始温度50 ℃,保持5 min,以5 ℃/min 速率升至230 ℃,保持10 min。MS条件:电子轰击(electron impact,EI)离子源,电子能量70 eV,GC与MS接口温度280 ℃;离子源温度230 ℃;电子检测器检测电压350 V;质量扫描范围50~550 amu。
1.3.5 红外光谱测定
采用溴化钾片涂布法:取2 μL肉豆蔻挥发油均匀涂布在KBr窗片上,放入样品槽。扫描范围400~4 000 cm-1,分辨率为4 cm-1,扫描次数32次,用KBr盐窗作背景采集。
1.3.6 差示扫描量热法(differential scanning calorimetry,DSC)测定
将肉豆蔻挥发油样品10 μL装入微型液体铝坩埚中,加上坩埚盖,将其密封后放入样品室内,用空坩埚作空白对照,DSC分析在高纯氮气气氛保护下进行。温度在-50~300 ℃,升温速率为10 ℃/min,流速为50 mL/min,记录其吸热和放热曲线。
1.3.7 肉豆蔻挥发油对亚硝酸盐清除率的测定
参考廖晓峰等[7]的方法:将0.5 mol/L的柠檬酸钠-盐酸缓冲液(pH 3.0)5 mL置于10 mL容量瓶中,加入100 mg/L的NaNO2溶液1 mL,分别加入提取液(0、100、200、300、400、500、600、700、800 μg,下同),定容至刻度,37 ℃下反应1 h。取1 mL反应液于50 mL容量瓶,加入0.4%对氨基苯磺酸溶液2 mL,0.2%盐酸萘乙胺溶液1 mL,摇匀放置15 min后,于540 nm处测吸光度值Ax,同时测定保温反应时不加挥发油的空白试验的吸光值A0。所有样品平行测定3次,取平均值。测定结果以清除率(E)表示,清除率计算如公式(2)所示:
(2)
1.3.8 肉豆蔻挥发油对亚硝胺阻断率的测定
参考廖晓峰等[7]的方法,分别取不同用量肉豆蔻挥发油于25 mL比色管中,加入pH 3.0柠檬酸—磷酸氢二钠缓冲液10 mL,1 mmol/L NaNO2溶液和二甲胺溶液各1.0 mL,稀释至刻度并于37 ℃恒温水浴1 h。然后吸取1.0 mL上述反应液至50 mL烧杯,加入0.5%Na2CO3溶液0.5 mL,于紫外分析仪上照15 min;取出后加入1%对氨基苯磺酸1.5 mL、0.1% α-萘胺1.5 mL和蒸馏水0.5 mL,静置15 min,525 nm 下测吸光度A1,同时测定以去离子水代替NaNO2标液的空白试验吸光度A2,及以去离子水代VOMF的空白试验吸光度A0。所有样品平行测定3次,取平均值。测定结果以阻断率(B)表示,阻断率计算如公式(3)所示:
(3)
2 结果与分析
2.1 两种方法肉豆蔻挥发油提取率的比较
由表1可知,水蒸气蒸馏耗时300 min的提取率为9.15%,纤维素酶辅助水蒸气蒸馏耗时240 min的提取率为10.69%,比水蒸气蒸馏法提高了16.83%,说明此方法不仅能明显缩短水蒸气蒸馏的时间、节约能耗,还显著提高了肉豆蔻挥发油的提取率。
表1 两种方法提取率的比较
Table 1 Comparison of extraction rate of two methods

提取方法时间/min提取率/%水蒸气蒸馏法3009.15±0.06纤维素酶辅助水蒸气蒸馏法24010.69±0.05
2.2 两种提取方法对肉豆蔻原料微观结构的影响
由图1可知,提取前后肉豆蔻原料微观结构存在明显差异,未提取处理样品(图1-a)的整体外部形状相对完整,结构紧密没有明显破坏;水蒸气蒸馏提取后(图1-b)肉豆蔻的表面结构被明显破坏,出现部分孔洞。相比水蒸气蒸馏,纤维素酶处理后(图1-c)肉豆蔻的表面结构被严重破坏,变得杂乱无序和松散,出现更多孔洞、碎块和不规则的腔。CHANDRAN等[8]在研究酶预处理对从香料(即黑胡椒和豆蔻)中提取活性化合物的影响时,通过微观结构观察证实了酶的作用能破坏细胞壁结构,促进释放细胞内物质。BABY等[9]在研究酶前处理对茴香挥发油提取率的影响时观察了酶对茴香种子细胞壁的影响,也发现了经酶处理过的茴香种子微观结构明显发生破裂。尤其纤维素酶辅助水蒸气蒸馏提取的耗时明显短于水蒸气蒸馏提取,但是其原料微观结构的破裂程度却比水蒸气蒸馏更加严重。因此,肉豆蔻挥发油提取率增加和提取时间缩短的主要原因是纤维素酶对原料细胞壁进行了降解,使被束缚在细胞内的有效成分充分溶出,从而使得挥发油得到快速提取。

a-未经处理组;b-水蒸气蒸馏处理组;c-酶法辅助水蒸气蒸馏处理组
图1 未经处理、水蒸气蒸馏处理、酶法辅助水蒸气蒸馏 处理提取后的肉豆蔻原料的电镜扫描观察
Fig.1 Scanning electron microscope observation of nutmeg powder extracted by untreated, steam distillation and enzyme assisted steam distillation
2.3 两种方法提取肉豆蔻挥发油的感官品质及其基本理化指标比较
由表2可知,2种方法提取的肉豆蔻挥发油都具有较好的感官品质,为无色透明、拥有纯正肉豆蔻香味的油状液体。其他的理化指标也非常相近,表明纤维素酶辅助水蒸气蒸馏提取对肉豆蔻挥发油的理化性质没有任何决定性影响。GIBBINS等[10]在做响应面法优化酶辅助水提取红花油时也有同样的结论。肉豆蔻挥发油比水轻,2种方法提取的挥发油相对密度均在0.850~1.065 g/mL正常区间内。蒸发后残留物含量均在1.30%左右,说明肉豆蔻挥发油的挥发性较好,且提取的挥发油纯度较高。酸值和过氧化值均较低,说明肉豆蔻挥发油的抗氧化性好,品质纯正[11]。
表2 两种方法提取的挥发油感官品质和基本理化指标比较
Table 2 Comparison of sensory quality and basic physical and chemical indexes of volatile oil extracted by two methods
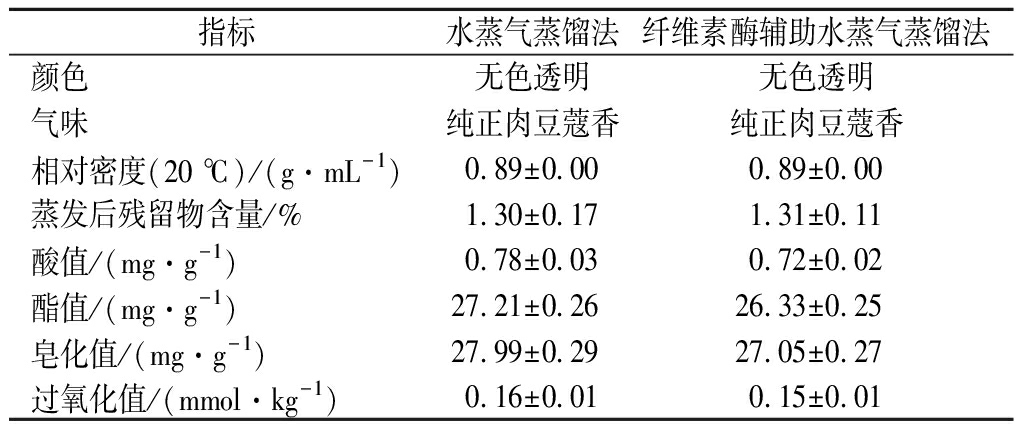
指标水蒸气蒸馏法纤维素酶辅助水蒸气蒸馏法颜色无色透明无色透明气味纯正肉豆蔻香纯正肉豆蔻香相对密度(20 ℃)/(g·mL-1)0.89±0.000.89±0.00蒸发后残留物含量/%1.30±0.171.31±0.11酸值/(mg·g-1)0.78±0.030.72±0.02酯值/(mg·g-1)27.21±0.2626.33±0.25皂化值/(mg·g-1)27.99±0.2927.05±0.27过氧化值/(mmol·kg-1)0.16±0.010.15±0.01
2.4 两种方法提取肉豆蔻挥发油的化学成分比较
利用NIST11质谱数据检索标准谱库解析成分,以相似度>85%作为结果确认依据,小于该值即定义为未知,以峰面积归一法计算各组分相对质量分数。成分解析结果见表3。
由表3可知,两种方法提取的肉豆蔻挥发油中组成成分种类和含量基本相同。水蒸气蒸馏提取的挥发油总共鉴定出占挥发油含量94.85%的38种化合物,纤维素酶辅助提取的挥发油共鉴定出占挥发油含量94.31%的42种化合物。2种方法提取得肉豆蔻挥发油的主要成分均是萜烯类、醇类、醚类、酯类、酚类化合物,其中β-松油烯和肉豆蔻醚含量最高。王莹等[12]在分析商品肉豆蔻挥发油的化学成分时得出肉豆蔻醚和萜类化合物是其主要成分的结论,DUPUY等[13]在分析肉豆蔻精油成分也得出了类似结论,与本实验的结论相符。GC-MS结果表明,纤维素酶处理后对肉豆蔻挥发油的化学成分和含量并没有显著影响,可以为酶法辅助水蒸气蒸馏提取提供参考。
表3 两种方法提取肉豆蔻挥发油的化学成分分析
Table 3 Chemical composition analysis of volatile oil from nutmeg extracted by two methods
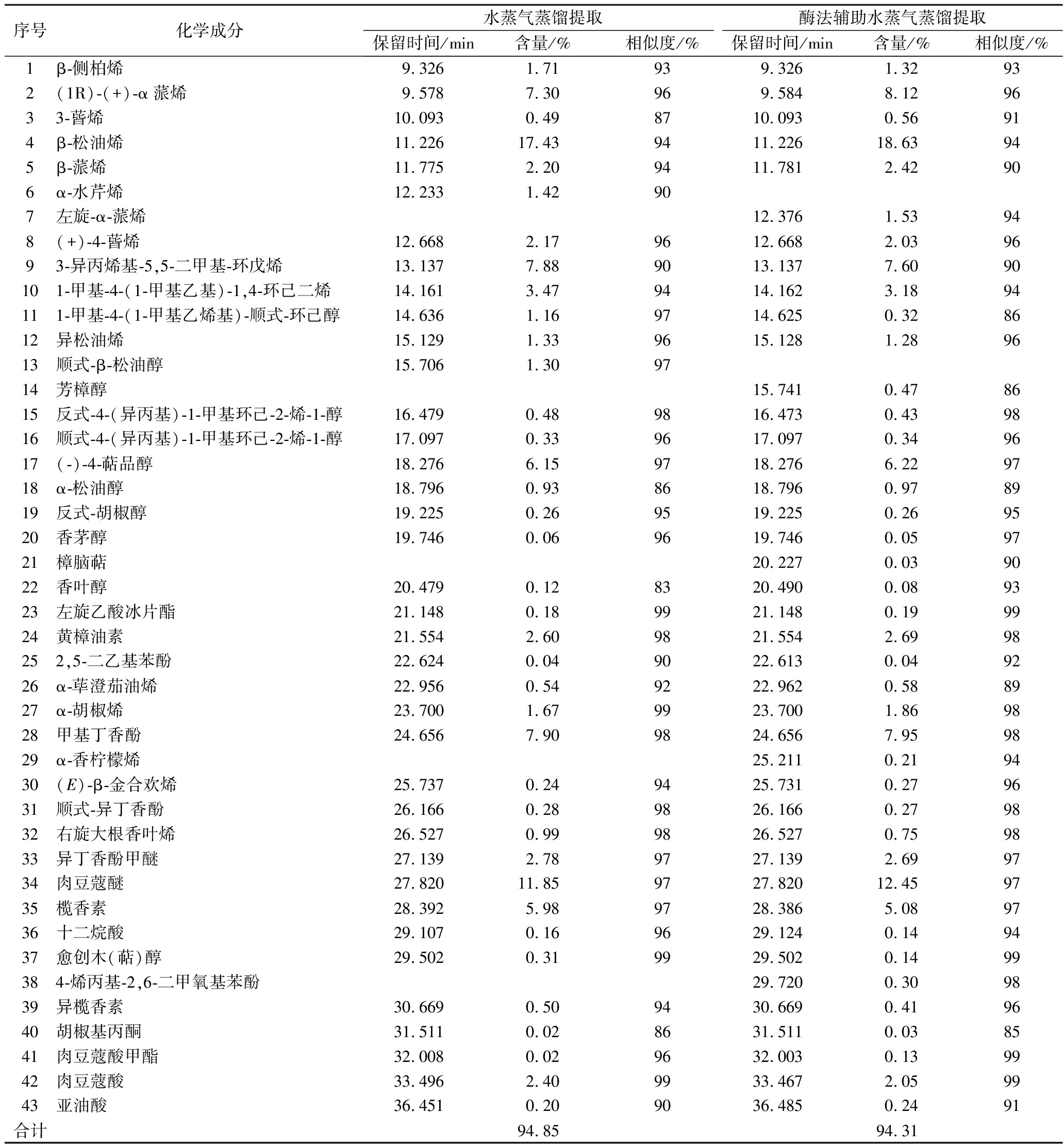
序号化学成分水蒸气蒸馏提取酶法辅助水蒸气蒸馏提取保留时间/min含量/%相似度/%保留时间/min含量/%相似度/%1β-侧柏烯9.3261.71939.3261.32932(1R)-(+)-α蒎烯9.5787.30969.5848.129633-蒈烯10.0930.498710.0930.56914β-松油烯11.22617.439411.22618.63945β-蒎烯11.7752.209411.7812.42906α-水芹烯12.2331.42907左旋-α-蒎烯12.3761.53948(+)-4-蒈烯12.6682.179612.6682.039693-异丙烯基-5,5-二甲基-环戊烯13.1377.889013.1377.6090101-甲基-4-(1-甲基乙基)-1,4-环己二烯14.1613.479414.1623.1894111-甲基-4-(1-甲基乙烯基)-顺式-环己醇14.6361.169714.6250.328612异松油烯15.1291.339615.1281.289613顺式-β-松油醇15.7061.309714芳樟醇15.7410.478615反式-4-(异丙基)-1-甲基环己-2-烯-1-醇16.4790.489816.4730.439816顺式-4-(异丙基)-1-甲基环己-2-烯-1-醇17.0970.339617.0970.349617(-)-4-萜品醇18.2766.159718.2766.229718α-松油醇18.7960.938618.7960.978919反式-胡椒醇19.2250.269519.2250.269520香茅醇19.7460.069619.7460.059721樟脑萜20.2270.039022香叶醇20.4790.128320.4900.089323左旋乙酸冰片酯21.1480.189921.1480.199924黄樟油素21.5542.609821.5542.6998252,5-二乙基苯酚22.6240.049022.6130.049226α-荜澄茄油烯22.9560.549222.9620.588927α-胡椒烯23.7001.679923.7001.869828甲基丁香酚24.6567.909824.6567.959829α-香柠檬烯25.2110.219430(E)-β-金合欢烯25.7370.249425.7310.279631顺式-异丁香酚26.1660.289826.1660.279832右旋大根香叶烯26.5270.999826.5270.759833异丁香酚甲醚27.1392.789727.1392.699734肉豆蔻醚27.82011.859727.82012.459735榄香素28.3925.989728.3865.089736十二烷酸29.1070.169629.1240.149437愈创木(萜)醇29.5020.319929.5020.1499384-烯丙基-2,6-二甲氧基苯酚29.7200.309839异榄香素30.6690.509430.6690.419640胡椒基丙酮31.5110.028631.5110.038541肉豆蔻酸甲酯32.0080.029632.0030.139942肉豆蔻酸33.4962.409933.4672.059943亚油酸36.4510.209036.4850.2491合计94.8594.31
2.5 两种方法提取肉豆蔻挥发油的红外光谱比较
由图2可知,两种方法提取的肉豆蔻挥发油均有较多吸收峰,且峰形和峰位基本吻合。二者均在1 700~800 cm-1有多个明显的吸收峰,依据刘艳等[14]和DONG等[15]文献报道,其中1 633、1 652 cm-1附近是C![]() C伸缩振动引起的,1 510、1 464、1 451 cm-1附近为芳香族C
C伸缩振动引起的,1 510、1 464、1 451 cm-1附近为芳香族C![]() C伸缩振动吸收峰;在3 500~2 500 cm-1的官能团区二者均有几个明显的特征蜂,其中3 076 cm-1附近为烯烃的C—H伸缩振动,2 958、2 931 cm-1附近为C—H反对称伸缩振动吸收峰,2 871 cm-1附近为C—H对称伸缩振动吸收峰。由此可知,纤维素酶辅助水蒸气蒸馏提取对肉豆蔻挥发油主要官能团结构没有产生影响。
C伸缩振动吸收峰;在3 500~2 500 cm-1的官能团区二者均有几个明显的特征蜂,其中3 076 cm-1附近为烯烃的C—H伸缩振动,2 958、2 931 cm-1附近为C—H反对称伸缩振动吸收峰,2 871 cm-1附近为C—H对称伸缩振动吸收峰。由此可知,纤维素酶辅助水蒸气蒸馏提取对肉豆蔻挥发油主要官能团结构没有产生影响。
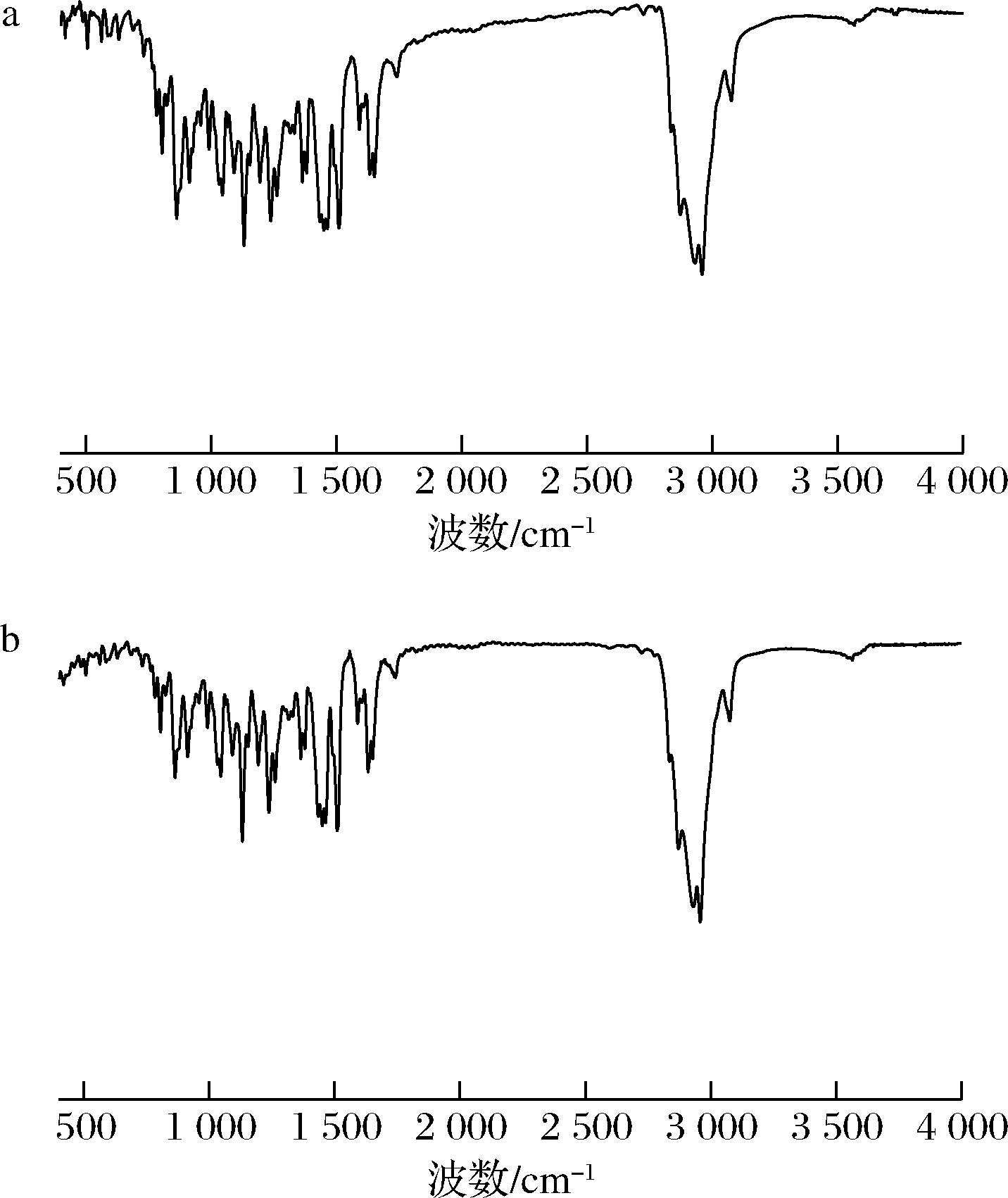
a-水蒸气蒸馏法;b-纤维素酶辅助水蒸气蒸馏法
图2 两种方法提取的肉豆蔻挥发油红外光谱图
Fig.2 Infrared spectrum of volatile oil extracted from nutmeg by two methods
2.6 两种方法提取肉豆蔻挥发油的热力学性质比较
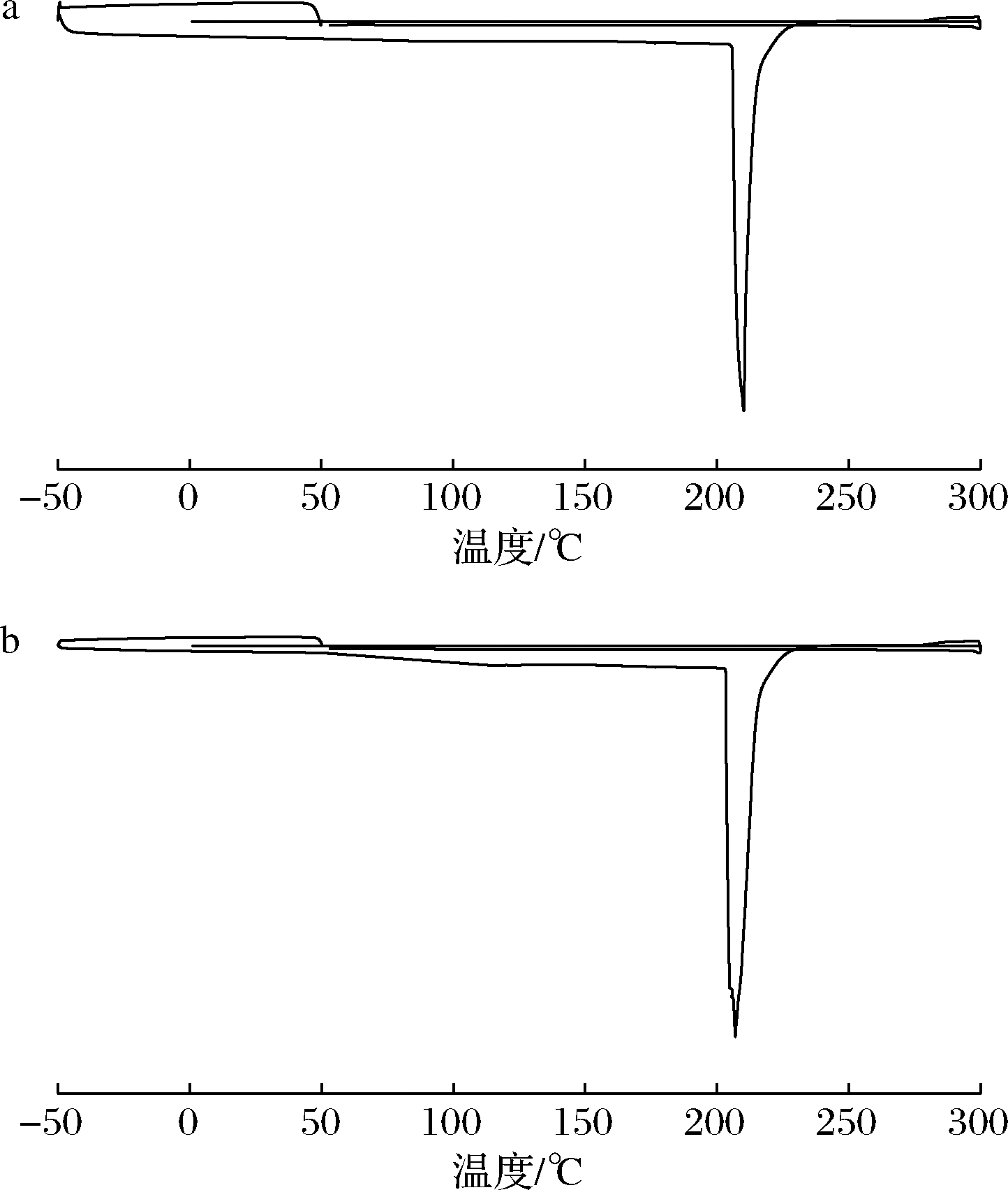
DSC是一种消耗更少的时间和样本,可以快速表征物质热力学特性的热分析方法[16]。由图3可知,在升温过程中,两种方法提取的油样均只出现了1个吸热峰,峰值温度均在210 ℃左右,油样在高温作用下吸热汽化,形成了明显的吸热峰。在降温过程中,2个油样均无放热峰,原因是肉豆蔻挥发油已经挥发完全,无法形成放热峰。由于两种方法提取的肉豆蔻挥发油的吸热和放热曲线整体形状、峰型均相似,表明纤维素酶处理对肉豆蔻挥发油的热力学性质没有影响。
2.7 肉豆蔻挥发油对亚硝酸盐清除作用的影响
由图4可知,两种方法提取肉豆蔻挥发油均对NaNO2有明显清除作用,且随着浓度增大清除率逐渐增大,在一定浓度范围内具有量效关系。整体上来看,酶法辅助提取挥发油对NaNO2的清除能力略大于水蒸气蒸馏提取挥发油对NaNO2的清除能力,差异不显著(P>0.05)。当肉豆蔻挥发油用量为800 μg时,两种方法提取的肉豆蔻挥发油的清除率分别达到69.34%和73.89%。郑立辉等[17]在研究白芷精油对NaNO2的清除作用时认为不饱和双键在清除NaNO2时起到了重要作用。而肉豆蔻挥发油的组成成分复杂,又含较多萜烯类、烯醇类和酚类等化合物,具有一定还原能力,所以肉豆蔻挥发油具有清除亚硝酸盐的能力。
a-水蒸气蒸馏法;b-纤维素酶辅助水蒸气蒸馏法
图3 两种方法提取肉豆蔻挥发油的DSC曲线
Fig.3 DSC diagram of nutmeg volatile oil extracted by two methods
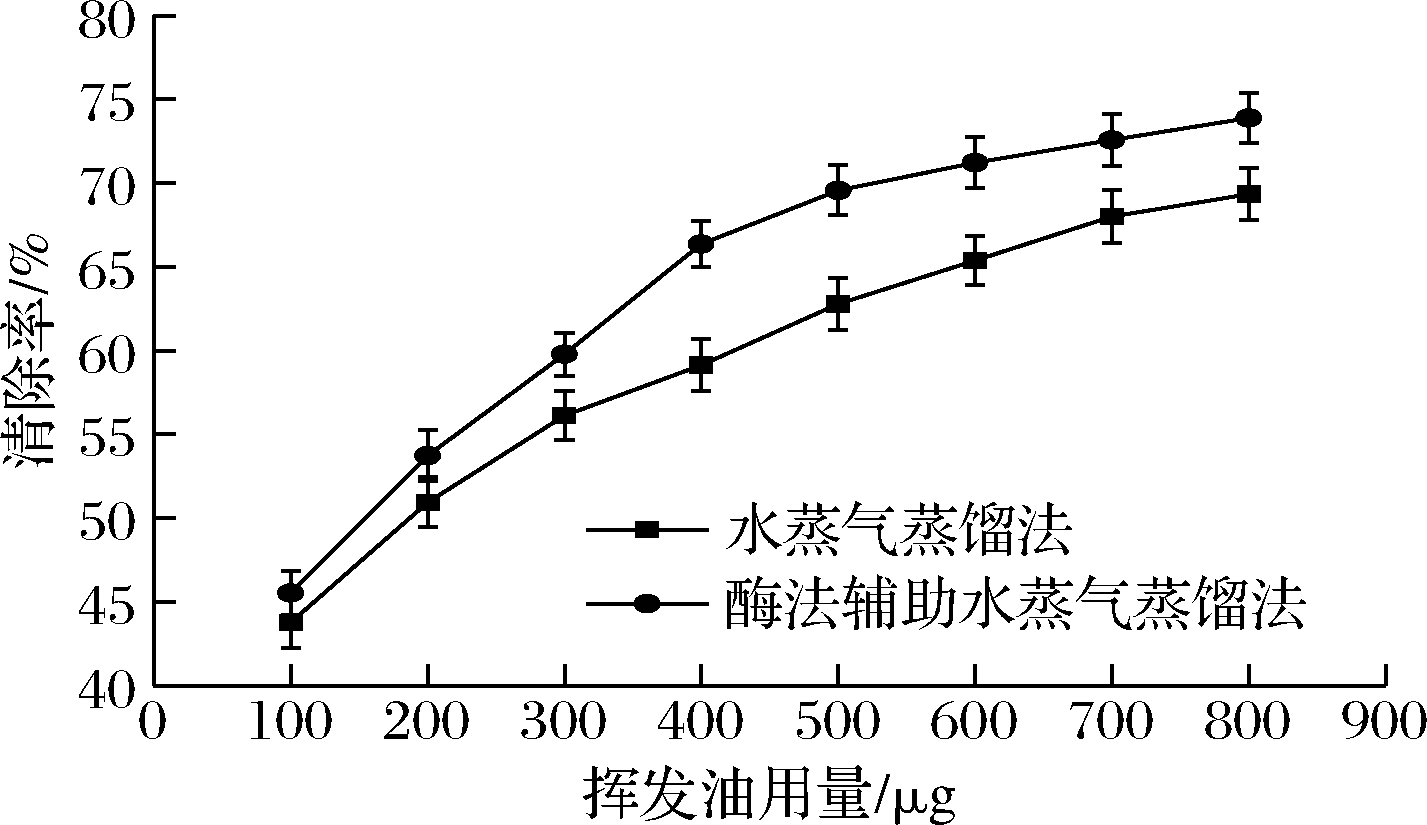
图4 两种方法提取挥发油对NaNO2的清除作用
Fig.4 Scavenging effect of volatile oil extracted by two methods on sodium nitrite
2.8 肉豆蔻挥发油对阻断亚硝胺合成作用的影响
由图5可知,随着肉豆蔻挥发油用量的增加,挥发油对亚硝胺合成的阻断率增加,当用量从100 μg增加至500 μg时,阻断率随用量的增加明显提高,之后随着挥发油用量的增加,阻断率趋于平稳。当挥发油用量为800 μg时,两种方法提取的肉豆蔻精油的阻断率分别达到74.80%和76.92%,两者差异不明显,整体上来看,后者略大于前者。与清除率相比,阻断率随浓度而增加的趋势更陡峭,但在相同用量下,阻断率与清除率比较相近。姚新成等[18]报道了新疆两色金鸡菊挥发油具有很强抑制亚硝胺形成的能力,其原因是具有抗氧化功能的挥发油能够阻断亚硝酸盐与次级胺结合的过程。而现代研究表明,肉豆蔻挥发油具有一定抗氧化能力[19-20]。由此可知,肉豆蔻挥发油对亚硝胺的合成具有明显阻断作用。
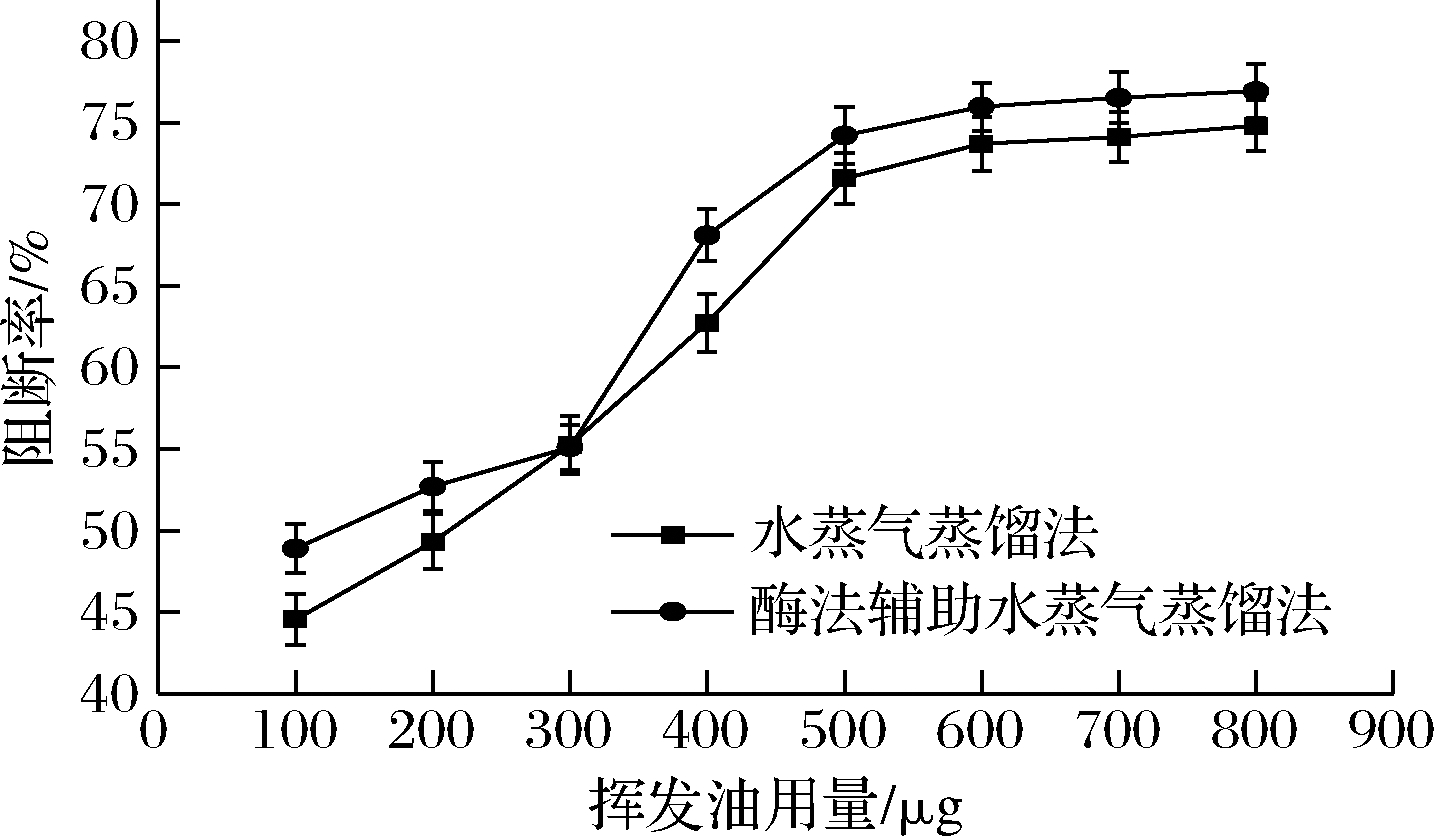
图5 两种方法提取挥发油阻断亚硝胺合成的能力
Fig.5 The ability of volatile oil extracted by two methods to block the synthesis of nitrosamine
3 结论
(1)肉豆蔻挥发油的酶法辅助水蒸气蒸馏提取与水蒸气蒸馏提取相比,不仅提取率高,而且还明显节约提取时间,降低了能耗。通过对原料微观结构观察表明,纤维素酶对原料细胞壁的水解是促进酶法辅助水蒸气蒸馏快速提取的主要原因。
(2)通过对肉豆蔻挥发油的感官品质、理化性质、GC-MS、红外光谱分析和DSC分析表明,酶法辅助水蒸气蒸馏提取没有对肉豆蔻挥发油的感官品质、基本理化性质、化学组成、主要官能团结构和热力学性质产生影响。
(3)两种方法提取的肉豆蔻挥发油均有较好的清除NaNO2能力和阻断亚硝胺合成的作用,且酶法辅助水蒸气蒸馏法提取的肉豆蔻挥发油对亚硝酸盐的清除作用稍强。肉豆蔻挥发油清除NaNO2能力和对亚硝胺合成的阻断能力随着挥发油用量增加而增强。
因此,酶法辅助水蒸气蒸馏是提取肉豆蔻挥发油的有效方法。
[1] AL-TANNAK N F, KHADRA I, IGOLI N P, et al.LC-MS analysis of oils of Monodora myristica and Monodora tenuifolia and isolation of a novel cyclopropane fatty acid[J].Natural Product Research, 2020, 34(9):1 227-1 232.
[2] 弓宝, 黄立标, 冯锦东, 等.正交实验法优化提取肉豆蔻挥发油的最佳工艺研究[J].时珍国医国药, 2011, 22(8):1 957-1 959.
GONG B, HUANG L B, FENG J D, et al.Optimization of extraction conditions for nutmeg oil by orthogonal test[J].Lishizhen Medicine and Materia Medica Research, 2011, 22(8):1 957-1 959.
[3] CHEN F L, DU X Q, ZU Y G, et al.Microwave-assisted method for distillation and dual extraction in obtaining essential oil, proanthocyanidins and polysaccharides by one-pot process from Cinnamomi cortex[J].Separation and Purification Technology, 2016, 164:1-11.
[4] 屠雄彪, 黄一平.超临界CO2萃取肉豆蔻中挥发油工艺研究[J].中国医药导刊, 2012, 14(1):171-172.
TU X B, HUANG Y P.Study on extraction technology of volatile oil in nutmeg by supercritical carbon dioxide fluid extraction[J].Chinese Journal of Medicinal Guide, 2012, 14(1):171-172.
[5] 李荣, 姜子涛.微波辅助水蒸气蒸馏调味香料肉豆蔻挥发油化学成分的研究[J].中国调味品, 2011, 36(3):102-104;108.
LI R, JIANG Z T.Chemical composition analysis of spice grown in Yunnan, Myristica fragrans Houtt volatile oil obtained using microwave-assisted hydrodistillation[J].China Condiment, 2011, 36(3):102-104;108.
[6] 李力, 潘倩雯, 郭偲, 等.不同方法提取肉豆蔻挥发油成分的气相色谱-质谱法分析[J].医药导报, 2019, 38(12):1 630-1 634.
LI L, PAN Q W, GUO S, et al.GC-MS analysis of components of nutmeg volatile oil extracted by different methods[J].Herald of Medicine, 2019, 38(12):1 630-1 634.
[7] 廖晓峰, 于荣.超声波提取芫荽(香菜)茎叶挥发油及其对NaNO2的清除作用的研究[J].食品研究与开发, 2013,34(24):47-51.
LIAO X F, YU R.Ultrasonic extraction of coriander (cilantro) leaf essential oil and its NaNO2 scavenging activity[J].Food Research and Development, 2013,34(24):47-51.
[8] CHANDRAN J, AMMA K P P, MENON N, et al.Effect of enzyme assisted extraction on quality and yield of volatile oil from black pepper and cardamom[J].Food Science and Biotechnology, 2012, 21(6):1 611-1 617.
[9] BABY K C, RANGANATHAN T V.Effect of enzyme pre-treatment on extraction yield and quality of fennel (Foeniculum vulgare) volatile oil[J].Biocatalysis and Agricultural Biotechnology, 2016, 8:248-256.
[10] GIBBINS R D, AKSOY H A, USTUN G.Enzyme-assisted aqueous extraction of safflower oil:Optimisation by response surface methodology[J].International Journal of Food Science & Technology, 2012, 47(5):1 055-1 062.
[11] 刘文盈. 紫丁香精油的开发及其评价[J].内蒙古农业科技, 2004,32(5):32-34.
LIU W Y.The development and evaluation of lilac oil[J].Inner Mongolia Agricultural Science and Technology, 2004,34(5):32-34.
[12] 王莹, 杨秀伟, 陶海燕, 等.商品肉豆蔻挥发油成分的GC-MS分析[J].中国中药杂志, 2004, 29(4):339-342.
WANF Y, YANG X W, TAO H Y, et al.GC-MS analysis of essential oils from seeds of Myristica fragrans in Chinese market[J].China Journal of Chinese Materia Medica, 2004, 29(4):339-342.
[13] DUPUY N, MOLINET J, MEHL F, et al.Chemometric analysis of mid infrared and gas chromatography data of Indonesian nutmeg essential oils[J].Industrial Crops & Products, 2013, 43:596-601.
[14] 刘艳, 司民真, 李家旺, 等.草豆蔻、红豆蔻、宽丝豆蔻的傅里叶变换红外光谱研究[J].激光生物学报, 2015, 24(5):416-422.
LIU Y, SI M Z, LI J W, et al.A study of A.Galanga (L.) willd, A.katsumadae Hayata and A.Petaloideum by FTIR[J].Acta Laser Biology Sinica, 2015, 24(5):416-422.
[15] DONG X Y, WU B F, DENG Q C, et al.Microencapsulation of nutmeg essential oil by spray-drying with different wall materials[J].Oil Crop Science, 2018, 3(4):258-269.
[16] PARDAUIL J J R, SOUZA L K C, MOLFETTA F A, et al.Determination of the oxidative stability by DSC of vegetable oils from the Amazonian area[J].Bioresource Technology, 2011, 102(10):5 874-5 877.
[17] 郑立辉, 王鹏君, 李伟, 等.白芷精油GC/MS解析及清除亚硝酸钠作用研究[J].中国粮油学报, 2014, 29(11):60-64.
ZHENG L H, WANG P J, LI W, et al.GC/MS composition analysis of essential oil of Angelica dahurica and its effects on scavenging sodium nitrite[J].Journal of the Chinese Cereals and Oils Association, 2014, 29(11):60-64.
[18] 姚新成, 李雪梅, 张婷, 等.新疆两色金鸡菊挥发油清除亚硝酸盐、抑制亚硝胺形成及抑菌活性[J].中成药, 2016, 38(8):1 824-1 827.
YAO X C, LI X M, ZHANG T, et al.Removal of nitrite, inhibition of nitrosamine formation and antibacterial activity of volatile oil from chrysanthemum cinerea[J].Chinese Traditional Patent Medicine, 2016, 38(8):1 824-1 827.
[19] ADIANI V, GUPTA S, CHATTERJEE S, et al.Activity guided characterization of antioxidant components from essential oil of Nutmeg (Myristica fragrans)[J].Journal of Food Science and Technology, 2015, 52(1):221-230.
[20] 付敏东, 黄启, 李成欢.肉豆蔻有效成分的提取及抗菌、抗氧化性研究[J].中国药师, 2012, 15(1):50-53.
FU M D, HUANG Q, LI C H.Study on extraction process, antimicrobial and antioxidant activities of active ingredients from Myristica fragrans houtt[J].China Pharmacist, 2012, 15(1):50-53.