植物乳杆菌是目前研究最广泛的乳酸菌之一,是一种革兰氏阳性乳杆菌,为兼性异型发酵,最适生长温度为30~35 ℃,最适pH为6.5,必须从外界获取营养物质来满足自身的生长和新陈代谢的需要,部分菌株能够还原硝酸盐,具有抑制假过氧化氢酶活性的能力[1],常用于食品的发酵,安全性较高,益生作用明显。研究表明,植物乳杆菌可以抑制肠道致病菌,HUANG等[2]研究表明,添加植物乳杆菌LDY 2013通过增加小鼠肠道中双歧杆菌和乳酸杆菌的数量,降低肠杆菌等致病菌数量。万婧倞等[3]从柏式中喙鲸内脏中筛选出1株植物乳杆菌HJ-S2,能够有效降低胆固醇,降解率可达48.82%。LIU等[4]从植物乳杆菌TWK 10发酵的豆奶水提物中分离出具有生物活性的血管紧张肽转化酶抑制剂,并鉴定出尿嘧啶和甘油组合为血管紧张肽转化酶抑制剂之一,这表明植物乳杆菌在开发抗高血压产品中有巨大潜力。FREDIANSYAH等[5]利用植物乳杆菌FNCC 0027发酵牙买加樱桃汁,检测发酵底物中多种活性物质,结果表明发酵后总酚含量、抗氧化活性和对糖尿病相关酶的抑制作用均有所增强。联合国粮食及农业组织/世界卫生组织发表的《食品益生菌评价指南》指出,对胃酸的耐受性试验、黏附试验、对致病菌的抑制试验等体外试验是评价益生性微生物安全性的必需试验[6]。
本课题组前期从健康动物肠道、粪便和土壤中筛选出乳酸菌,经16S rRNA鉴定为植物乳杆菌。本研究通过对实验室保存的这6株植物乳杆菌的耐酸耐胆盐能力、模拟胃肠道环境的耐受性、抑菌活性和黏附性能等益生性能进行评价,以期为其作为益生菌株后期的工业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞
菌株来源于课题组自健康仔猪肠道食糜中分离并保存的植物乳杆菌(LP15-1、LP15-2、LC16-1、LP17-1、LP17-3、RS048)。金黄色葡萄球菌、大肠杆菌K88、大肠杆菌K99、鼠伤寒沙门氏菌由国家粮食和物资储备局科学研究院菌种库保存。Caco-2、IPEC-1细胞株由中国农业大学武振龙教授课题组馈赠。
1.1.2 试剂
胰蛋白酶、胃蛋白酶、20×磷酸缓冲盐溶液、台盼蓝染色液、异硫氰酸荧光素酯(fluorescein isothiocyanate isomer I,FITC),北京索莱宝科技有限公司;MRS肉汤培养基、MRS培养基、LB肉汤培养基、猪胆盐,北京奥博星生物技术有限责任公司;琼脂粉,北京博奥拓达科技有限公司;DMEM培养基、DMEM/F12培养基、胎牛血清、青霉素链霉素双抗溶液、0.25%胰蛋白酶消化液、非必需氨基酸(nonessential amino acid,NEAA),美国Gibco公司;二甲基亚砜,美国Sigma公司。
1.2 仪器与设备
HZQ-X100振荡培养箱,哈尔滨市东联电子技术开发有限公司;SynergyH1酶标仪,美国伯腾仪器有限公司;CO2培养箱、BPH-9272精密恒温培养箱,上海一恒科学仪器有限公司;MLS-3781L-PC高压蒸汽灭菌器,松下健康医疗器械株式会社;超净工作台,北京东联哈尔仪器制造有限公司;微型台式真空泵,海门市其林贝尔仪器制造有限公司;OLYMPUS CKX41倒置显微镜,日本OLYMPUS公司;水浴锅,上海森信实验仪器有限公司;5810R台式高速冷冻离心机,艾本德中国有限公司。
1.3 试验方法
1.3.1 植物乳杆菌耐酸能力的测定
参考王祎然等[7]的方法用盐酸配制pH分别为2.0和3.0的MRS液体培养基,将植物乳杆菌落从冻存管中按照1%接种量接于MRS液体培养基中,活化2次后,再按照1%接种量接种于不同pH(2.0、3.0)的MRS培养基中,置于37 ℃,150 r/min振荡培养,在第0、3 h进行活菌平板计数,存活率按公式(1)计算:
存活率![]()
(1)
式中:n1为3 h活菌数,n2为0 h活菌数。
1.3.2 植物乳杆菌耐胆盐能力的测定
参考王祎然等[7]的方法用猪胆盐配制含0.1%、0.3%(质量分数)胆盐的MRS液体培养基,将活化后的植物乳杆菌按照1%接种量接种于不同胆盐浓度的MRS培养基中,置于37 ℃振荡培养,在第0、3 h进行活菌平板计数,存活率计算同1.3.1。
1.3.3 植物乳杆菌耐模拟胃肠道能力的测定
模拟胃液配制[8]:取1 mol/L盐酸溶液20 mL,加入胃蛋白酶10 g,加水定容至1 000 mL,使其终质量浓度为0.01 g/mL,0.22 μm微孔滤膜除菌,4 ℃保存待用。
模拟肠液配制[9]:取KH2PO4 6.8 g,加水溶解,用NaOH溶液将其pH调至6.8;另取胰蛋白酶10 g,加水溶解后将两液混合,加水至1 000 mL,并用0.22 μm微孔滤膜除菌,4 ℃保存待用。
将活化好的菌液按10%接种量接种到模拟胃液,混匀后,置于37 ℃培养箱中培养,在第0、3 h分别取样,进行活菌平板计数。在模拟胃液中培养3 h后,按照10%接种量接种到模拟肠液,混匀后,置于37 ℃培养箱中培养,在第0、3、6 h分别取样,进行活菌平板计数。存活率计算同1.3.1。
1.3.4 植物乳杆菌致病菌抑制能力的测定
采用牛津杯法[10]测定植物乳杆菌的抑菌能力,分别取4种致病菌(金黄色葡萄球菌、鼠伤寒沙门氏菌、大肠杆菌K88、大肠杆菌K99)菌液涂布在LB培养基上,每个平皿中等距放置4个牛津杯,其中3个牛津杯中加入200 μL植物乳杆菌,其余1个作为对照加入200 μL的MRS液体培养基,将平皿正置于37 ℃培养箱,培养24 h,结束后观察并用游标卡尺测量抑菌圈直径。
1.3.5 植物乳杆菌黏附性能的测定
细胞培养:Caco-2细胞使用含有双抗(青霉素100 U/mL和链霉素100 g/mL)、10%胎牛血清(fetal bovine serum,FBS)和1%NEAA的DMEM培养基;IPEC-1细胞使用含有双抗(青霉素 100 U/mL和链霉素 100 g/mL)、10%FBS的DMEM/F12培养基置于37 ℃、5% CO2的培养箱中培养,每2 d换液,细胞生长至融合率85%左右,用0.25%胰酶溶液消化后传代培养,传代3次后用DMEM完全培养基调整到5×104个/mL接种到24孔板,备用。
植物乳杆菌准备:将活化2次的植物乳杆菌在室温条件下离心后,收集菌体,用PBS重悬菌体,并调整浓度为1×109 CFU/mL,然后加入终质量浓度为100 μg/mL的FITC溶液,37 ℃避光孵育2 h,室温下离心,弃上清液,用PBS调整植物乳杆菌浓度到1×108 CFU/mL,备用。
植物乳杆菌的体外黏附特性测定:参考冯军厂[11]的方法,24孔板中的细胞长至单层后吸出培养基,用PBS洗涤,并加入无抗培养基,培养2 h后,每孔加入标记的植物乳杆菌菌悬液,避光培养2 h。培养结束后,吸出培养基和菌悬液,用PBS洗涤未黏附的植物乳杆菌,再加胰酶待细胞消化后,加入PBS。将24孔板中的细胞吹打混匀,并加入黑色96孔板,测其荧光值为A1;再取相同量的植物乳杆菌菌悬液,加入胰酶和PBS溶液,混匀后加入黑色96孔板,测其荧光值为A2;取等量胰酶和PBS溶液混匀后加入黑色96孔板,测其荧光值为A0,作为空白对照,各株植物乳杆菌对细胞的黏附率按照公式(2)计算:
黏附率![]()
(2)
1.4 数据统计
所有试验均重复3次,结果以平均值±标准差表示,采用SAS 9.0软件中单因素方差分析(one-way ANOVA)进行数据统计分析,P<0.05表示差异显著。若各组间差异显著,则采用Student-Newman-Keuls多重比较方法检验组间差异。
2 结果与分析
2.1 植物乳杆菌耐酸能力
植物乳杆菌经过胃肠道,只有抵过胃肠道的强酸和高胆盐胁迫,在肠道中存活下来,才能在体内发挥益生作用[12]。人胃液中胃酸的主要成分为盐酸,其pH通常在3.0,空腹时可达到2.0左右,甚至更低。因此,只有少数耐酸能力较好的植物乳杆菌能够通过胃酸屏障,以活菌形式到达肠道并发挥作用。本试验用不同盐酸对6株植物乳杆菌生长环境的pH进行调节,观察其在pH 2.0和pH 3.0环境下培养3 h后的存活情况,结果如表1所示。
表1 植物乳杆菌在不同pH下的活菌数和存活率(n=3)
Table 1 Viable count and survival rate of Lactobacillus plantarum under different pH condition(n=3)
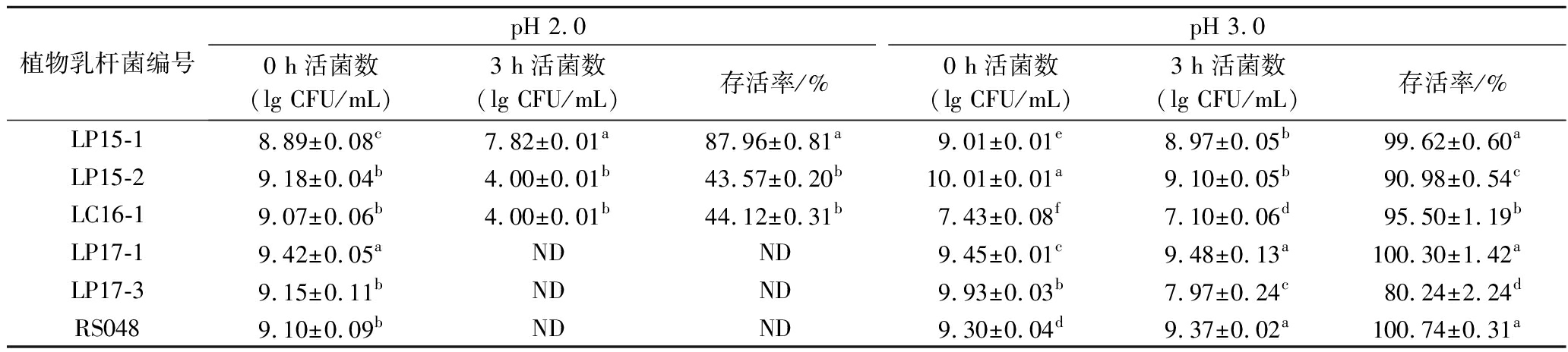
植物乳杆菌编号pH 2.0pH 3.00 h活菌数(lg CFU/mL)3 h活菌数(lg CFU/mL)存活率/%0 h活菌数(lg CFU/mL)3 h活菌数(lg CFU/mL)存活率/%LP15-18.89±0.08c7.82±0.01a87.96±0.81a9.01±0.01e8.97±0.05b99.62±0.60aLP15-29.18±0.04b4.00±0.01b43.57±0.20b10.01±0.01a9.10±0.05b90.98±0.54cLC16-19.07±0.06b4.00±0.01b44.12±0.31b7.43±0.08f7.10±0.06d95.50±1.19bLP17-19.42±0.05aNDND9.45±0.01c9.48±0.13a100.30±1.42aLP17-39.15±0.11bNDND9.93±0.03b7.97±0.24c80.24±2.24dRS0489.10±0.09bNDND9.30±0.04d9.37±0.02a100.74±0.31a
注:ND表示活菌数<3 lgCFU/mL;数值表示平均值±标准差(n=3);同列数值肩标字母不同表示显著差异(P<0.05)(下同)
如表1所示,pH 3.0条件培养3 h后,6株植物乳杆菌的存活率为80.24%~100.74%,活菌数均高于1×107 CFU/mL,这表明这6株植物乳杆菌都具有一定的耐酸能力。其中LP17-1和RS048两株菌的存活率高于100%表明该菌能在pH 3.0的环境中继续生长,导致其活菌数增加。除此之外的4株菌活菌数均下降,则表明低pH值能抑制植物乳杆菌的生长。pH 2.0条件培养3 h后,6株植物乳杆菌的活菌数均下降,其中3株菌的活菌数<1×103 CFU/mL,表明pH 2.0对植物乳杆菌生长抑制能力更强,另外3株菌中LP15-1的存活率为87.96%,显著高于LP15-2和LC16-1(P<0.05)。
2.2 植物乳杆菌耐胆盐能力
植物乳杆菌在人体中发挥益生功能的重要前提是适应小肠中的胆盐胁迫,人体小肠中胆盐含量为0.03%~0.3%[13]。本试验研究了6株植物乳杆菌在胆盐质量分数为0.1%和0.3%的培养基中培养,观察其培养3 h后的存活情况,结果如表2所示。
表2 植物乳杆菌在不同浓度胆盐下的活菌数和存活率(n=3)
Table 2 Viable count and survival rate of Lactobacillus plantarum under culture condition with different concentration of bile salt(n=3)

植物乳杆菌编号0 h活菌数(lgCFU/mL)0.3%胆盐0.1%胆盐3 h活菌数(lgCFU/mL)存活率/%3 h活菌数(lgCFU/mL)存活率/%LP15-18.80±0.03d8.80±0.02a100.03±0.30a9.02±0.02c102.47±0.23aLP15-29.16±0.05c7.29±0.10b79.54±0.73b8.83±0.01d96.36±0.66cLC16-18.89±0.05dNDND6.15±0.17e69.17±2.05dLP17-19.56±0.04aNDND9.44±0.01a98.76±0.44bLP17-39.16±0.05c7.08±0.05c79.02±1.62a9.00±0.13c98.29±0.84bRS0489.33±0.11b6.97±0.05c72.38±2.00c9.30±0.03b99.66±0.99b
如表2所示,6株植物乳杆菌在0.1%胆盐培养3 h后,活菌数都在6lgCFU/mL以上,除LC16-1外,其余5株菌的存活率为96.36%~102.47%,说明6株菌都具有较好的胆盐耐受性。在胆盐质量分数为0.3%的条件下培养3 h后,6株菌的存活率均有所下降,但LP15-1的存活率为100.03%,显著高于其他5株,LC16-1和LP17-1活菌数<3lgCFU/mL。由此可知,LP15-1、LP15-2、LP17-3、RS048对胆盐的耐受能力比较优良,其中,LP15-1在胆盐质量分数为0.1%和0.3%的条件下,存活率分别为102.47%、100.03%,可能是因为该菌耐受胆盐能力较强,在强胆盐条件下仍然可以生长。
2.3 植物乳杆菌耐受模拟胃肠液能力
胃肠道中的液体,除了较低的pH值和较高浓度的胆盐外,还含有胃蛋白酶和胰蛋白酶[14]。《中国药典》将人工胃液配制定为取9.5%~10.5%的稀盐酸16.4 mL,加水稀释再加入胃蛋白酶10 g,摇匀后,加水至1 000 mL即可。人工肠液配制定为取磷酸二氢钾6.8 g,加水溶解,用氢氧化钠溶液调节pH为6.8,取胰蛋白酶10 g,加水溶解,将两液混合后加水定容至1 000 mL即可。研究表明,大多数乳酸菌在pH 1.5 的环境中,1 h后将会死亡,而在pH 2.5~4.0的环境中,培养3 h仍有较高的存活率[15-16]。本研究将分离得到的6株植物乳杆菌接种于含有消化酶、pH分别为2.0和3.0的模拟胃液中,进一步考察其存活率。
表3 植物乳杆菌在不同模拟胃肠液中的存活率(n=3) 单位:%
Table 3 Survival rate of Lactobacillus plantarum under different simulated gastrointestinal fluid(n=3)
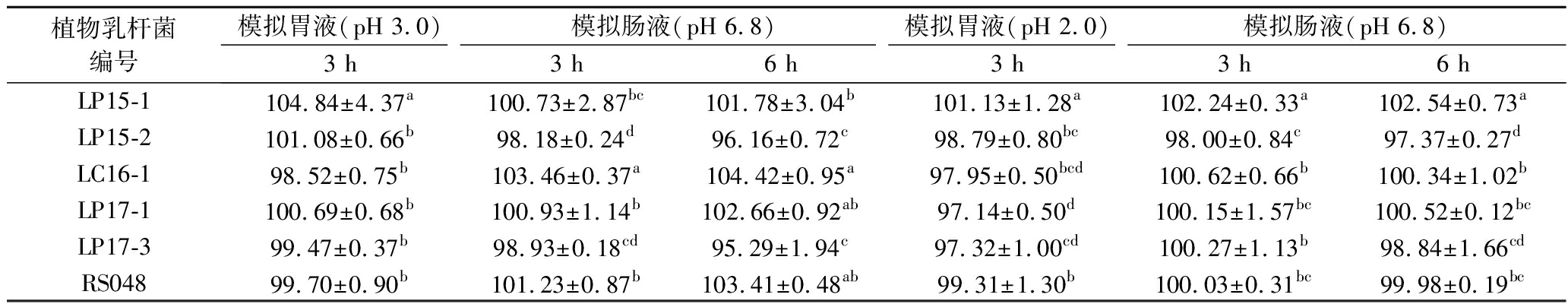
植物乳杆菌编号模拟胃液(pH 3.0)模拟肠液(pH 6.8)模拟胃液(pH 2.0)模拟肠液(pH 6.8)3 h3 h6 h3 h 3 h6 hLP15-1104.84±4.37a100.73±2.87bc101.78±3.04b101.13±1.28a102.24±0.33a102.54±0.73aLP15-2101.08±0.66b98.18±0.24d96.16±0.72c98.79±0.80bc98.00±0.84c97.37±0.27dLC16-198.52±0.75b103.46±0.37a104.42±0.95a97.95±0.50bcd100.62±0.66b100.34±1.02bLP17-1100.69±0.68b100.93±1.14b102.66±0.92ab97.14±0.50d100.15±1.57bc100.52±0.12bcLP17-399.47±0.37b98.93±0.18cd95.29±1.94c97.32±1.00cd100.27±1.13b98.84±1.66cdRS04899.70±0.90b101.23±0.87b103.41±0.48ab99.31±1.30b100.03±0.31bc99.98±0.19bc
由表3可知,本次实验的6株植物乳杆菌在不同pH的模拟胃液中,3 h存活率均高于97%。其中LP15-1存活率最高,在pH 3.0和pH 2.0的模拟胃液中的存活率分别为104.84%和101.13%。
乳酸菌经过胃部的消化后,还需要在肠道中定殖,才能有效发挥其益生作用[17]。在模拟肠液中,6株植物乳杆菌都表现出较好的耐受肠液能力。除LP15-2和LP17-3以外,3 h内菌株LP15-1、LC16-1、LP17-1、RS048的存活率均能达到100%以上。郝露露等[18]对植物乳杆菌B14、C24、32E在模拟肠道的存活率的研究中,也发现培养3 h后其存活率能够达到100%以上,可能是因为试验菌株为处在对数生长期的旺盛菌株。在模拟肠液中培养6 h,植物乳杆菌的存活率稍有降低,但除LP15-2、LP17-3和RS048外,仍都能够达到100%以上。因此,本试验所用的6株植物乳杆菌都具有较强的耐受模拟胃肠液的能力,能够在胃肠道中有效的发挥益生作用。
2.4 植物乳杆菌抑菌能力
大量研究表明,乳酸菌在增殖过程中产生的如乳酸、乙酸、细菌素等代谢产物对肠道病原菌具有抑制作用[19]。CIZEIKIENE等[20]发现乳酸乳杆菌属和双歧杆菌属菌株对大肠杆菌均有抑菌作用,但不同的菌株抑菌能力有差别。YANG等[21]的研究表明乳酸乳球菌能够有效抑制金黄色葡萄球菌。本研究发现植物乳杆菌LP15-1、LP15-2、LC16-1、LP17-1、LP17-3、RS048对指示菌金黄色葡萄球菌、鼠伤寒沙门氏菌、大肠杆菌K88、大肠杆菌K99均有抑制作用。由表4可知,6株植物乳杆菌对鼠伤寒沙门氏菌的抑制能力比其他3株指示菌强,其中LC16-1对鼠伤寒沙门氏菌的抑制效果最好,抑菌圈直径达29.97 mm。植物乳杆菌LP15-1、LC16-1、LP17-1对大肠杆菌的抑制能力显著高于LP15-2、LP17-3和RS048(P<0.05),但是6株植物乳杆菌对金黄色葡萄球菌和大肠杆菌K99的抑制效果的差异不显著(P>0.05)。
表4 植物乳杆菌对4种指示菌的抑菌圈平均直径(n=3) 单位:mm
Table 4 Average diameter of inhibition zone of Lactobacillus plantarum to four indicator pernicious bacteria(n=3)

致病菌LP15-1LP15-2LC16-1LP17-1LP17-3RS048金黄色葡萄球菌22.80±0.1423.00±2.1622.00±0.8222.60±0.1022.70±0.3623.65±2.19鼠伤寒沙门氏菌27.13±0.28ab25.95±1.20ab27.97±0.92a27.40±0.26ab25.87±1.12b27.40±2.26ab大肠杆菌K88 21.83±0.95a18.00±1.91b21.33±0.75a21.47±0.85a17.40±0.62b19.10±1.00b大肠杆菌K99 22.27±2.5420.43±1.5021.37±3.6220.60±2.1421.60±3.5021.23±1.79
注:同行数据肩标字母不同表示差异显著(P<0.05)
2.5 植物乳杆菌黏附能力
乳酸菌想要在宿主肠道中持久发挥生理功能的条件之一是能够在宿主肠道黏膜上皮细胞中黏附并定殖,在肠道某个部位形成稳定的菌群后才能发挥作用[22],而黏附则被认为是定殖的关键一步[23]。目前,体外细胞黏附模型作为评价乳酸菌黏附性的一种最广泛的手段,被研究者们普遍使用[24]。Caco-2为结肠癌细胞,其优点是它们在体外能够表现出与成熟肠道上皮细胞相似的形态和功能,因此经常作为评价益生菌黏附能力的体外模型。IPEC-1为猪空肠上皮细胞,用IPEC-1作为模型,能够模拟乳酸菌对小肠上皮的黏附特性。荧光标记法类似于放射性同位素,该方法常用FITC作为标志物,操作较为简便,因此,被较多研究者广泛用于测定乳酸菌的黏附性。
如图1-A所示,试验中的植物乳杆菌基本都能够黏附于Caco-2细胞表面,但表现出的黏附能力有较大差异。LP15-2的黏附率最高,其次是LP15-1,这两株植物乳杆菌的黏附效果显著高于其他几株(P<0.05)。LP17-1黏附率最低。与其他研究[11]相似,本试验的不同植物乳杆菌对Caco-2细胞的黏附能力具有较大差异,这种现象可能和菌株的表面特征相关,因此,对黏附能力较好的菌株值得进一步的研究。
从图1-B可以看出,试验中的几株植物乳杆菌对IPEC-1的黏附能力均低于对Caco-2的黏附能力。类似的是,不同菌株对IPEC-1的黏附能力也表现出较大的差异,其中LP15-2的黏附率最高,显著高于其他5株(P<0.05)。对Caco-2细胞表现出较好的黏附能力的LP15-1对IPEC-1细胞表现出明显的下降,其黏附率显著低于LP15-2(P<0.05),而LP17-1、LP17-3和RS048的黏附率较低,均<0.5%,黏附能力较弱。

A-植物乳杆菌对Caco-2细胞的黏附能力;B-植物乳杆菌对 IPEC-1细胞的黏附能力
图1 植物乳杆菌对肠道上皮细胞的黏附能力(n=3)
Fig.1 Adhesion ability of Lactobacillus plantarum to intestinal epithelial cells(n=3) 注:数值表示平均值±标准差(n=3);不同字母表示差异显著(P<0.05)
本试验采用体外细胞模型模拟肠道上皮细胞,用荧光染料标记来检测植物乳杆菌的黏附效果。乳酸菌能黏附在黏膜表面过程较为复杂,可能与菌株的胞外多糖、表面蛋白和脂肪酸等有关。从本研究结果可以看出不同菌株在Caco-2细胞表现出较高的黏附性能,可能是乳酸菌主要在后肠段起黏附作用。YU等[25]研究表明,瘤胃乳杆菌菌株GRL1172几乎无法黏附IPEC-1细胞,对Caco-2细胞有较弱的黏附能力,这与我们得到的结论相似。同时乳酸菌的黏附率也与外界环境有关,GREENE等[26]研究显示,低pH值能够显著提升乳酸杆菌对Caco-2的黏附能力,刘东方等[27]通过研究菌株的表面疏水性发现,表面疏水性较高其黏附性能也相对较高,另外蒋建军等[28]研究发现Ca2+浓度增加,可以明显增加乳酸菌的黏附和定殖能力。
3 结论
从不同来源中分离得到的6株植物乳杆菌在耐酸耐胆盐能力中有所不同,其中植物乳杆菌LP15-1、LP15-2、LC16-1的耐酸能力较强,在pH 2.0的酸环境中孵育3 h存活率均在43%以上;植物乳杆菌LP15-1、LP15-2、LP17-3和RS048的耐胆盐能力较好,在0.3%胆盐培养基中孵育3 h存活率均在72%以上;6株植物乳杆菌均表现出较好的模拟胃肠道耐受性,存活率均高于95%。在抑菌试验中,6株植物乳杆菌对4种常见的致病菌的抑制能力较好。对Caco-2和IPEC-1细胞的黏附能力差异较大。
对研究结果比较发现,植物乳杆菌LP15-1具有良好的耐强酸和耐胆盐能力,在pH 2.0的酸环境中孵育3 h存活率87.96%,在0.3%胆盐培养基中孵育3 h 存活率100.03%;且具有较好的模拟胃肠道耐受能力和抑菌能力,对最常用体外细胞模型Caco-2细胞的黏附效果较好,其潜在益生特性有待进一步研究,同时植物乳杆菌LP15-1可作为益生菌在实际生产、功能性食品的开发、动物饲料中有进一步的应用。其他5株植物乳杆菌的益生特性也各有侧重,可根据实际应用中的不同需求对益生特性的优势方面更深一步的探究,以求发挥其最大作用。
[1] 陈卫. 乳酸菌科学与技术[M].北京:科学出版社, 2019.
CHEN W.Science and Technology of Lactic Acid Bacteria[M].Beijing:Science Press, 2019.
[2] HUANG R H, TAO X Y, WAN C X, et al.In vitro probiotic characteristics of Lactobacillus plantarum ZDY 2013 and its modulatory effect on gut microbiota of mice[J].Journal of Dairy Science, 2015, 98(9):5 850-5 861.
[3] 万婧倞, 罗曼, 吴鹏, 等.具降胆固醇功能的海洋源乳酸菌的筛选及发酵条件工艺优化[J].应用海洋学学报, 2021, 40(2):220-230.
WAN J L, LUO M, WU P, et al.Study on screening of cholesterol-lowering marine Lactobacillus and optimization of fermentation conditions[J].Journal of Applied Oceanography, 2021, 40(2):220-230.
[4] LIU Y Y, ZENG S Y, LEU Y L, et al.Antihypertensive effect of a combination of uracil and glycerol derived from Lactobacillus plantarum strain TWK10-fermented soy milk[J].Journal of Agricultural and Food Chemistry, 2015, 63(33):7 333-7 342.
[5] FREDIANSYAH A, ROMADHONI F, SURYANI, et al.Fermentation of jamaican cherries juice using Lactobacillus plantarum elevates antioxidant potential and inhibitory activity against type II diabetes-related enzymes[J].Molecules, 2021, 26(10):2 868.
[6] Food and Agriculture Organization/World Health Organization. Guidelines for the evaluation of probiotics in food[R]. London Ontario,FAO/WHO, 2002.
[7] 王祎然, 韦明明, 张涵, 等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技, 2020, 41(16):121-126;139.
WANG Y R, WEI M M, ZHANG H, et al.Identification, acid and bile salt tolerance, and antioxidant ability of lactic acid bacteria isolated from sour soup[J].Science and Technology of Food Industry, 2020, 41(16):121-126;139.
[8] 国家药典委员会. 中华人民共和国药典2010年版(二部)[M].北京:中国医药科技出版社, 2010:附录S.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China 2010 Edition (Part Two) [M].Beijing:China Medical Science Press, 2010:Appendix S.
[9] 国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社, 2015.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China (Part One) [M].Beijing:China Medical Science Press, 2015.
[10] 万金敏, 杨丽娜, 葛武鹏, 等.西藏牦牛奶渣中优势乳酸菌产胞外多糖及其耐受性[J].食品科学, 2017, 38(10):98-103.
WAN J M, YANG L N, GE W P, et al.Exopolysaccharide (EPS)-producing ability and tolerance of dominant lactic acid bacteria (LAB) strains from yak milk dreg in Tibet[J].Food Science, 2017, 38(10):98-103.
[11] 冯军厂. 免疫活性乳酸菌的筛选及其抗肉鸡沙门氏菌感染的研究[D].杨凌:西北农林科技大学, 2016.
FENG J C.Using in vitro immunomodulatory properties of lactic acid bacteria for selection of probiotics against salmonella infection in broiler chicks[D].Yangling:Northwest A&F University, 2016.
[12] 张会生, 熊涛.三株乳酸菌的鉴定及益生性能[J].南昌大学学报(理科版), 2019, 43(4):336-341.
ZHANG H S, XIONG T.Identification and probiotic properties of three strains of lactic acid bacteria[J].Journal of lactic Nanchang University (Natural Science), 2019, 43(4):336-341.
[13] 王记成, 郭壮, 闫丽雅, 等.益生菌Lactobacillus casei Zhang与商业益生菌对胃肠转运耐受性及发酵特性的比较[J].中国食品学报, 2009, 9(5):14-23.
WANG J C, GUO Z, YAN L Y, et al.Comparison of transit tolerance and fermentation of probiotic Lactobacillus casei Zhang with commercial probiotic strains[J].Journal of Chinese Institute of Food Science and Technology, 2009, 9(5):14-23.
[14] 卢承蓉, 叶美芝, 上官文丹, 等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业, 2020, 46(12):14-20.
LU C R, YE M Z, SHANGGUAN W D, et al.Mutation breeding for high-yield exopolysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries, 2020, 46(12):14-20.
[15] 范颖, 陈思涵, 党芳芳, 等.一株降胆固醇乳酸菌的筛选及其在模拟消化环境活性的研究[J].中国乳品工业, 2018, 46(9):4-7.
FAN Y, CHEN S H, DANG F F, et al.Screening and study on activity in the simulated gastrointestinal conditions of a cholesterol-lowering lactic acid bacteria[J].China Dairy Industry, 2018, 46(9):4-7.
[16] 云月英, 徐娟, 张小利.4株乳酸菌对模拟胃肠环境的耐受性及生长特性研究[J].中国酿造, 2018, 37(3):53-56.
YUN Y Y, XU J, ZHANG X L.Tolerance to simulated gastrointestinal environment and growth characteristics of four strains of lactic acid bacteria[J].China Brewing, 2018, 37(3):53-56.
[17] 王彦萍, 熊涛, 黄涛, 等.优良饲用乳酸菌的筛选及在模拟消化环境中的耐受性[J].食品与发酵工业, 2016, 42(10):56-60.
WANG Y P, XIONG T, HUANG T, et al.Screening of forage lactic acid bacteria with good tolerance to stimulated animal digestive environments[J].Food and Fermentation Industries, 2016, 42(10):56-60.
[18] 郝露露, 雷文平, 刘成国, 等.具有益生特性植物乳杆菌的筛选及其发酵特性的研究[J].食品工业科技, 2020, 41(17):109-113;120.
HAO L L, LEI W P, LIU C G, et al.Screening of Lactobacillus plantarum with probiotic properties and its fermentation characteristics[J].Science and Technology of Food Industry, 2020, 41(17):109-113;120.
[19] 田宗民. 抑致病菌益生菌菌株及其胞外多糖抗TGEV作用的比较分析[D].哈尔滨:东北农业大学, 2015.
TIAN Z M.Analysis and compare of probiotic strains with antibacterial properties and EPS in the role of anti-TGEV[D].Harbin:Northeast Agricultural University, 2015.
[20] CIZEIKIENE D, JAGELAVICIUTE J.Investigation of antibacterial activity and probiotic properties of strains belonging to Lactobacillus and Bifidobacterium genera for their potential application in functional food and feed products[J].Probiotics and Antimicrobial Proteins, 2021, 13(5):1 387-1 403.
[21] YANG J M, MOON G S.Isolation of a Lactococcus lactis strain producing anti-staphylococcal bacteriocin[J].Korean Journal for Food Science of Animal Resources, 2018, 38(6):1 315-1 321.
[22] 秦文飞, 宋馨, 夏永军, 等. 乳酸菌在肠道定植的影响因素及研究方法[J]. 食品科学, 2021, 42(23):275-283.
QIN W F, SONG X, XIA Y J, et al. Factors affecting intestinal colonization of lactic acid bacteria and research methods for it[J]. Food Science, 2021, 42(23):275-283.
[23] ABRAHAM S N, SHARON N, OFEK I, et al. Adhesion and Colonization[M]//Molecular Medical Microbiology, Amsterdam: Elsevier, 2015:409-421.
[24] 费苏, 夏永军, 艾连中, 等.乳酸菌在肠道内黏附定殖的研究进展[J].工业微生物, 2020, 50(2):58-62.
FEI S, XIA Y J, AI L Z, et al.Research progress of lactic acid bacteria colonization in intestine[J].Industrial Microbiology, 2020, 50(2):58-62.
[25] YU X, ÅVALL-J
 SKEL
SKEL INEN S, KOORT J, et al.A comparative characterization of different host-sourced Lactobacillus ruminis strains and their adhesive, inhibitory, and immunomodulating functions[J].Frontiers in Microbiology, 2017, 8:657.
INEN S, KOORT J, et al.A comparative characterization of different host-sourced Lactobacillus ruminis strains and their adhesive, inhibitory, and immunomodulating functions[J].Frontiers in Microbiology, 2017, 8:657.
[26] GREENE J D, KLAENHAMMER T R.Factors involved in adherence of Lactobacilli to human Caco-2 cells[J].Applied and Environmental Microbiology, 1994, 60(12):4 487-4 494.
[27] 刘东方, 薛梅, 桑建, 等.高黏附性乳酸菌的筛选及其对免疫细胞活性影响的研究[J].中国微生态学杂志, 2016, 28(8):869-874.
LIU D F, XUE M, SANG J, et al.Screening of lactic acid bacteria with high adhesion and its effect on the activity of immune cells[J].Chinese Journal of Microecology, 2016, 28(8):869-874.
[28] 蒋建军, 宋毅, 但江, 等.不同培养条件对乳酸菌黏附猪小肠黏膜上皮细胞的影响[J].黑龙江畜牧兽医, 2015(5):33-36.
JIANG J J, SONG Y, DAN J, et al.Effects of different culture conditions on Lactobacillus adhesion to the epithelial cells in porcine small intestinal mucosa[J].Heilongjiang Animal Science and Veterinary Medicine, 2015(5):33-36.