Pickering乳液由于具有高度环境相容性、稳定性、控制释放、抗聚集和脂质氧化等优势,在食品、药品及功能物质递送体系被广泛应用,成为当前食品胶体领域的研究热点和挑战[1-3]。植物化学成分[β-胡萝卜素(β-carotene,BC)、维生素E、维生素A、姜黄素、白藜芦醇、花青素等]在健康食品工业中具有非常重要的作用,但由于植物提取物大都容易受到空气、温度、光、pH值等的影响,而存在挥发性高、稳定性差、水中溶解性低等缺点,使其应用受到限制[4-6]。包埋可将生物活性物质包覆到具有保护作用的壁材中,有助于活性物质的延长释放、稳定性提高、保护或改善生物活性[7-8]。
MAREFATI等[9]利用疏水改性藜麦淀粉稳定的Pickering乳状液能以较高的包封率(80%)包封姜黄素。ABBAS等[10]利用超声辅助制备单一改性辛烯基琥珀酸(octenyl succinic acid,OSA)淀粉稳定纳米乳液,并将其用于姜黄素的荷载,发现超声辅助处理有利于姜黄素的稳定。陈金凤等[11]研究了玉米淀粉纳米颗粒稳定的Pickering乳液对活性成分的负载,制备得到BC荷载率稳定在45.17%的乳液。钱鑫[12]以ε-聚赖氨酸与淀粉纳米晶复配作为固体乳化剂成功制备了包埋辅酶Q10的Pickering乳液。MARKU等[13]制备高含油量的淀粉基Pickering乳液,并将其用于水杨酸甲酯的运载。Pickering乳液在封装生物活性分子,提高活性物质稳定性和生物利用度方面具有巨大的潜力。
本文采用OSA疏水改性协同球磨处理制备复合改性小米淀粉,以其为颗粒乳化剂构建负载BC的Pickering乳液,研究负载BC的Pickering乳液的盐离子稳定性、pH稳定性、温度及光照稳定性,并通过贮存实验、被动释放、体外模拟消化实验研究BC在乳液中的负载率和保留率。
1 材料与方法
1.1 材料与试剂
BC,上海阿拉丁生化科技股份有限公司;透析袋(3 500 Da)、胃蛋白酶、脂肪酶、胆盐、磷酸盐缓冲液(pH 7.0),上海源叶生物科技股份有限公司;氢氧化钠、盐酸,国药集团化学试剂有限公司。
1.2 仪器与设备
Malvern3000激光粒度仪,英国 MALWERN 公司;DS-Fi2多功能生物显微镜,日本Nikon仪器有限公司;BSG-250 型光照培养箱,上海博讯实业有限公司医疗设备厂;IKA T18高速分散机,德国IKA仪器设备有限公司。
1.3 实验方法
1.3.1 复合改性小米淀粉的制备
以小米淀粉为原料,参考MAREFATI 等[9]的方法制备OSA小米淀粉(OSA millet starch,OSS),测定取代度为0.021 8。
取5.0 g OSA小米淀粉和25 mL蒸馏水于球磨罐中,球磨转速400 r/min,钢珠150 g,温度25~32 ℃,球磨处理2 h。球磨完毕后样品于4 000 r/min离心15 min,冷冻干燥24 h,过100目筛即得复合改性小米淀粉(ball-milled compound modified millet starch,BMS)。
1.3.2 负载BC的Pickering乳液的制备
将BC以1 mg/mL的质量浓度添加到油相中链甘油三酯(medium chain triglycerides,MCT)中磁力搅拌过夜,以保证BC在油中进行最大程度溶解,将混合物以14 000 r/min离心10 min去除未溶解的不溶物。通过紫外可见分光光度法测量油相中的BC浓度。
将合适比例的溶有BC的油相和改性淀粉水溶液的水相进行混合,涡旋搅拌30 s至混合均匀,室温条件下,用高速剪切均质机以20 000 r/min的转速,乳化2 min(分4次进行,每次处理30 s,间隔60 s),制备负载BC的Pickering乳液。
1.3.3 BC的含量测定
标准曲线的绘制:称取10 mg BC,用氯仿定容至100 mL,得标准溶液(0.1 mg/mL)。吸取标准溶液0.5、1、1.5、2、2.5、3 mL分别置于50 mL容量瓶中,用氯仿定容,得1、2、3、4、5、6 μg/mL的系列标准溶液,以氯仿做空白,在466 nm测吸光值A,以ρ为横坐标,A为纵坐标,得标准曲线。
油相中BC含量测定:通过向100 mL氯仿中添加1 mL的油相,使用分光光度计在466 nm下测定吸光度,计算BC在MCT中的初始浓度。
乳液中BC含量测定:取200 μL乳液样品加入1.6 mL氯仿溶剂使用涡旋仪涡旋5 min,使活性成分被充分萃取。混合物以14 000 r/min离心10 min以去除淀粉颗粒,取1 mL上清液稀释至10 mL,以氯仿为空白,测定466 nm处吸光度,使用标准曲线将吸光度测量值转换为BC的浓度。
BC的负载率计算如公式(1)所示:
BC负载率![]()
(1)
1.3.4 Pickering乳液的稳定性分析
(1)盐离子稳定性:通过在制备后向乳液中加入不同体积的NaCl来检查盐离子对乳液稳定性的影响,乳液中NaCl浓度依次设置为0、50、100、150、200 mmol/L,分别在贮存1、24 h观察乳液外观和显微结构,测定乳液粒径及电位的变化。
(2)pH稳定性:通过调节乳液pH值来检查pH对乳液稳定性的影响,乳液pH依次设置为2、4、6、8、10,分别在贮存1、24 h观察乳液外观和显微结构,测定乳液粒径及电位的变化。
(3)温度及光照稳定性:将乳液在4、25、37、60 ℃ 避光以及25 ℃光照条件下贮存,期间分别测定多次乳液的粒径及乳液中BC含量。
1.3.5 Pickering乳液的粒径及电位测定
乳液的粒径大小通过马尔文3000激光粒度仪测量,电位通过马尔文Nano zs90 Zeta 电位仪测量,粒径分布以及Zeta电位分别测量3次。
1.3.6 Pickering乳液的显微结构观察
将乳液滴于载玻片上,盖上盖玻片,用DS-Fi2多功能生物显微镜观测乳液,在放大100倍数下拍照。
1.3.7 BC在乳液中的释放
在透析袋(3 500 Da)中加入10 mL Pickering乳液,将该透析袋悬浮在1 L蒸馏水中,25 ℃下进行透析释放。每间隔6 h从按照1.3.3建立的方法测量1次乳液中BC的浓度。每次测量后,透析过程中的水需要重新更换。
1.3.8 体外模拟胃肠消化
模拟胃液(simulated gastric fluid,SGF)的配制:2 mg/mL NaCl、7 mL/L HCl、3.2 mg/mL胃蛋白酶,所有组分用超纯水配制。
模拟肠液(simulated intestinal fluid,SIF)的配制:盐溶液(36.7 mg/mL CaCl2、218.7 mg/mL NaCl,下同)、24 mg/mL脂肪酶(下同)、54 mg/mL胆盐(下同)、其中盐溶液用超纯水配制,脂肪酶和胆盐用5 mmol/L 磷酸盐缓冲液(pH 7.0)配制。
模拟SGF消化:取7.5 mL SGF于37 ℃保温5 min,加入相同体积的乳液,调整体系pH至2.5,于37 ℃、100 r/min恒温摇床消化2 h。期间每30 min对乳液进行取样(200 μL),并使用前述方法测量乳液中的BC浓度。
模拟SIF消化:将37 ℃预热好的1.5 mL盐溶液、3.5 mL胆盐溶液和2.5 mL脂肪酶液加入到pH调整为7.0的SGF消化液中,在37 ℃、100 r/min消化2 h,期间用0.1 mol/L NaOH维持消化体系pH为7.0。每30 min对乳液进行取样(200 μL),并使用前述方法测量乳液中的BC浓度[9, 15]。
1.3.9 数据分析
采用Excel 2019、SPSS 22对数据进行统计及处理,采用OriginPro 9.0绘制图,图表中误差均为标准误差,所有实验均进行3次重复实验。
2 结果与分析
2.1 Pickering乳液的光学显微结构
BMS和OSS稳定的负载及未负载BC的Pickering乳液的微观结构如图1所示,乳液液滴外观均呈现球形,在负载BC之后呈现出黄色。OSS稳定的乳液液滴大小不一,且在负载BC之后乳液液滴明显增大,说明OSS的乳化能力不足,在负载BC后存在一定程度的破乳现象。BMS稳定的乳液液滴粒径较小且大小分布均一,负载BC之后液滴仍保持较为均匀的大小分布。球磨处理使OSA淀粉的乳化能力得到改善,且乳液界面结构稳定,在BC的负载能力上表现出更为优良的特性[16]。这可能得益于球磨使OSA淀粉糊化,改变了淀粉形态结构及柔韧性,更有利于界面覆盖和构象变化以形成致密的界面网络结构,增强静电和空间排斥的稳定性,从而表现出更加优良的乳化性和界面吸附性[16-17]。

A-BMS稳定的负载BC的Pickering乳液;B-OSS稳定的负载BC的 Pickering乳液;C-BMS稳定的未负载BC的Pickering乳液; D-OSS稳定的未负载BC的Pickering乳液
图1 不同颗粒稳定的乳液光学显微镜图
Fig.1 Optical microscope image of emulsions stabilized by different particles
2.2 负载BC的Pickering乳液的稳定性分析
2.2.1 pH稳定性
不同pH条件下乳液的粒径及电位如图2所示。乳液在不同pH环境下无相分离现象,pH 2的乳液粒径为38.9 μm,随pH增大,粒径急剧减小,并在pH 4~10基本维持稳定。BMS颗粒与阿拉伯胶、环糊精、纤维素等生物高聚物稳定的Pickering乳液的pH稳定性具有相似的结果[18-19]。不同pH的乳液在放置24 h后粒径仅出现较小程度变化,表明乳液在不同pH环境下均具有较好的贮存稳定性。
不同乳液的电位值均为负值,因为BMS颗粒上的羧基带负电荷。pH2~6,电位随pH的增大而显著减小,可能是由于BMS在碱性条件下制备,淀粉颗粒表面连接了羧基而带有负电荷,pH在2~6变化,BMS颗粒表面的羧基基团发生去质子化,增加了油水界面的负电荷数,表现出更低的电位值[20]。
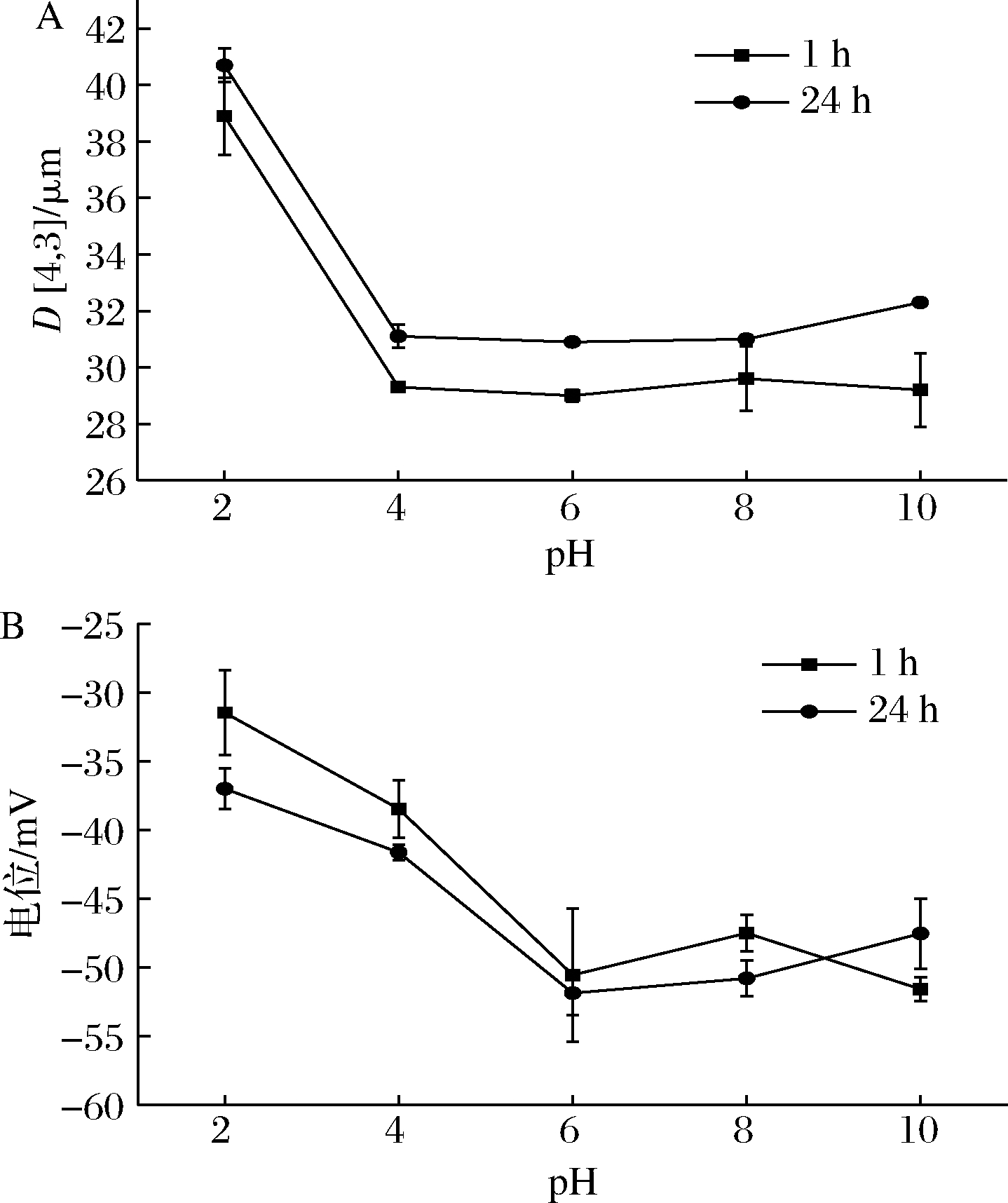
A-粒径;B-电位
图2 不同pH对乳液粒径及电位的影响
Fig.2 Effect of different pH on emulsion particle size and potential
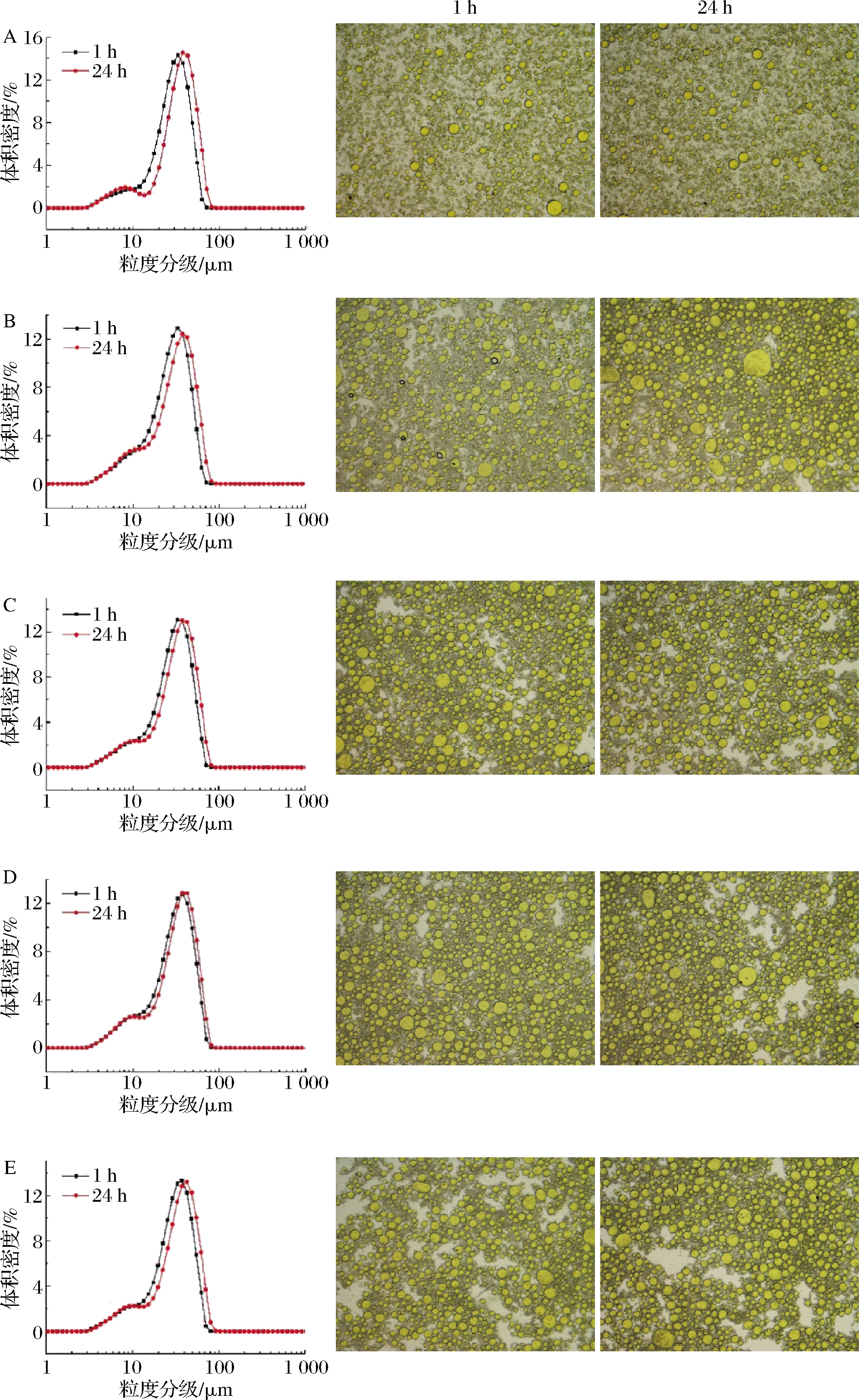
由图3乳液的光学显微镜图可以看出,pH 2时,乳液中出现了数量较多的大液滴,这可能来源于该pH值下乳液负电荷数最少,影响了BMS颗粒的疏水性,导致其在油水界面的静电相互作用降低,表现出乳液稳定性不足,油滴之间发生聚结形成紧密堆积的聚合物,乳液粒径尺寸相对更大[21]。pH 4~10,体系负电荷数明显增多,导致它们之间更强的静电排斥,颗粒更容易吸附到油水界面而增加乳液的稳定性,从而表现出分布更加均一的乳液光学显微结构和良好的聚集稳定性[2]。

A-pH 2;B-pH 4;C-pH 6;D-pH 8;E-pH 10
图3 pH对乳液光学显微结构及粒径分布的影响
Fig.3 Effect of pH on the optical microstructure and particle size distribution of emulsion
2.2.2 盐离子稳定性
递送体系可用于不同水平盐浓度的商业产品,因此对乳液的盐离子稳定性进行表征具有重要的实际意义。图4显示了乳液粒径及电位的变化,当不存在盐离子时,乳液粒径为29.1 μm,随盐离子浓度增大,粒径仅呈现出较小幅度的增大,表明了乳液具备高度的盐离子稳定性。乳液的光学显微结构如图5所示,在较高浓度盐离子的存在下乳液液滴之间出现了一定程度的聚集,表现为乳液粒径的增大。乳液在24 h后粒径均较1 h时表现出一定程度的增大,这表明在油相比例为30%时,乳液中存在较多的水相,使得乳液液滴之间相互碰撞的概率较大,在短时间内表现出粒径的增大。
随盐离子的加入乳液电位呈现增大的趋势,这表明乳液体系负电荷数显著下降,放置不同时间后电位值基本保持不变,电位增大可能是盐离子对淀粉酯表面的负电荷产生了静电屏蔽。乳液在盐离子存在下出现了轻微的析水现象,可能与电位的变化有关,Na+和带负电的—COO-互相吸引,使得净电荷降低,乳液的稳定状态发生了改变,从而出现分层[22]。
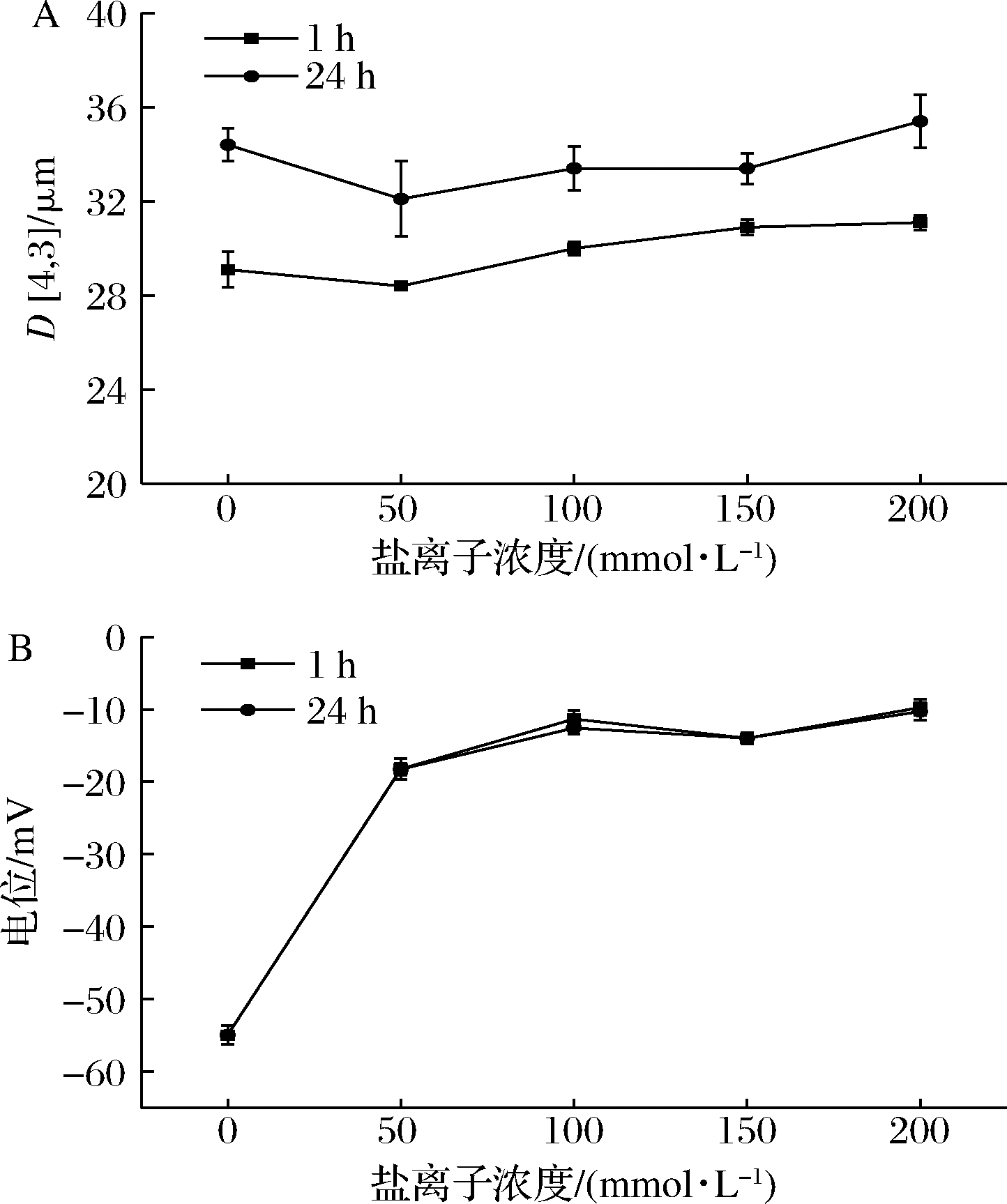
A-粒径;B-电位
图4 盐离子浓度对乳液粒径及电位的影响
Fig.4 Influence of salt ion concentration on emulsion particle size and potential
2.2.3 贮藏稳定性
不同贮存温度和光照条件下Pickering乳液在15 d 内粒径的变化,如图6所示。贮存在4~37 ℃避光条件下,各组乳液在放置后粒径仅呈现较小程度的波动。60 ℃避光条件下乳液粒径在7 d内急剧增大,表明负载BC Pickering乳液在37 ℃以内具有较高的温度稳定性,而温度继续升高至60 ℃,BMS丧失维持界面稳定的作用。E组25 ℃光照和B组25 ℃避光贮存,乳液在粒径上未呈现明显的差异,说明贮存的光照环境对乳液的粒径影响不大。对照组F代表的OSS稳定的负载BC Pickering乳液,初始粒径93.7 μm,在贮存后15 d后粒径增大到206.0 μm,说明单一改性的淀粉颗粒稳定的乳液在荷载BC后贮存过程中容易发生聚集、絮凝等现象,相比BMS而言不具备优良的贮存稳定性。
A-盐离子浓度0 mmol/L;B-盐离子浓度50 mmol/L;C-盐离子浓度 100 mmol/L;D-盐离子浓度150 mmol/L;E-盐离子浓度220 mmol/L
图5 盐离子浓度对乳液光学显微结构及粒径分布的影响
Fig.5 Influence of salt ion concentration on the optical microstructure and particle size distribution of emulsion
2.3 BC在Pickering中的稳定性
乳液在不同条件贮存后BC负载率的变化如图7所示,BC在BMS和OSS稳定的Pickering乳液中的初始负载率分别为92.92%和82.44%,且各组乳液随放置时间的延长,BC负载率均发生了不同程度的下降。60 ℃避光贮存24 h,BC负载率急剧降低到36.72%,降解率达到50%(半衰期)以上。避光环境下4、25、37 ℃贮存15 d后BC负载率71.71%(4 ℃避光)>62.60%(25 ℃避光)>51.97%(37 ℃避光),说明低温环境更有利于BC的活性保留。贮存相同时间,光照环境下BC的负载率始终低于避光环境下的负载率。在25 ℃光照环境下贮存,OSS稳定的Pickering乳液15 d后BC降解率达72%,表明OSS仅对BC的降解起到轻微的保护作用。而BMS稳定的Pickering乳液相同贮存条件下BC降解率仅23%,保留率提升了约49%。
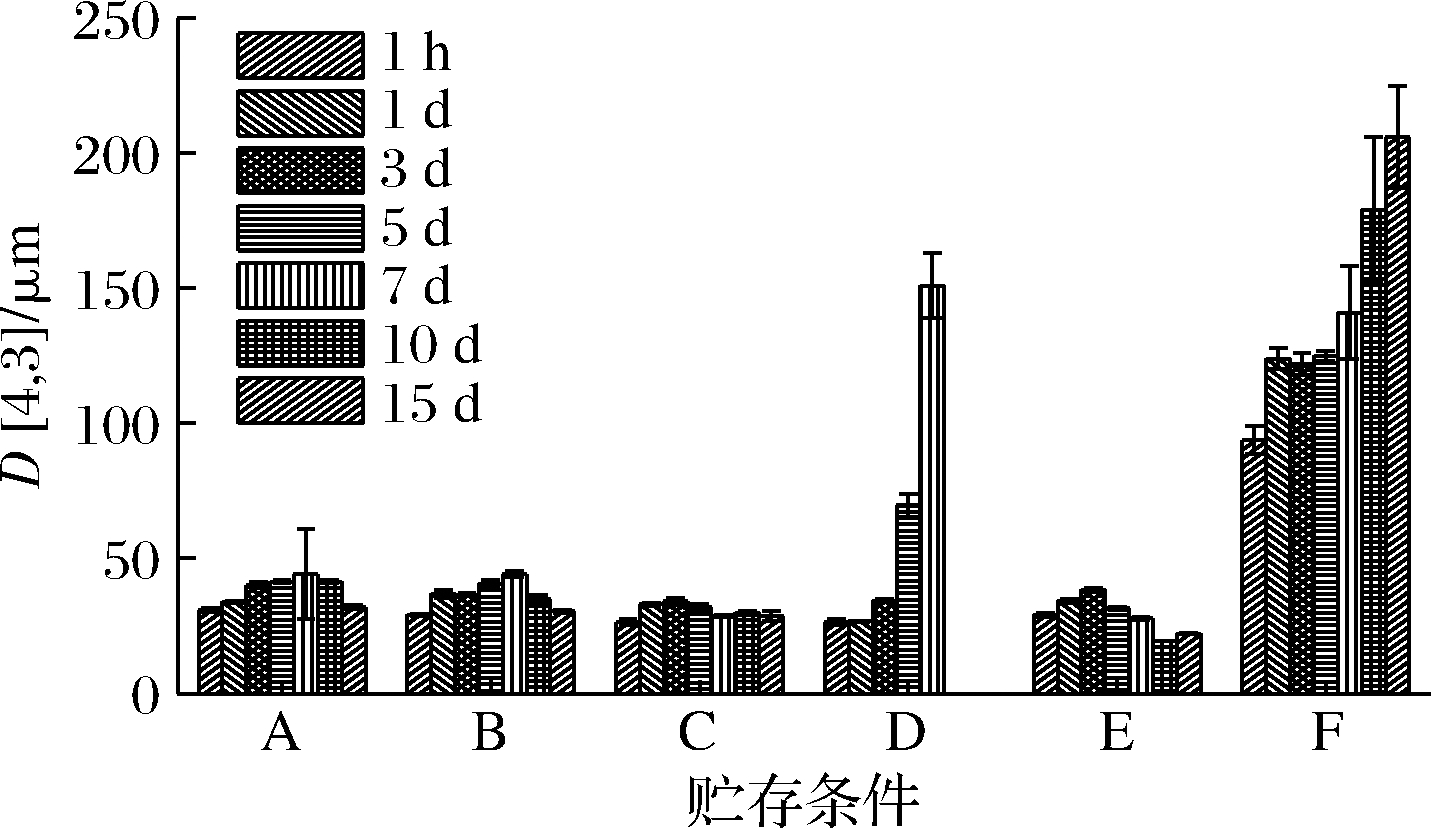
A-负载BC的BMS稳定Pickering乳液4 ℃避光贮存; B-负载BC的BMS稳定Pickering乳液25 ℃避光贮存; C-负载BC的BMS稳定Pickering乳液37 ℃避光贮存; D-负载BC的BMS稳定Pickering乳液60 ℃避光贮存; E-负载BC的BMS稳定Pickering乳液25 ℃光照贮存; F-负载BC的OSS稳定Pickering乳液25 ℃光照贮存
图6 负载BC Pickering乳液的粒径
Fig.6 Particle size of Pickering emulsion loaded with β-carotene
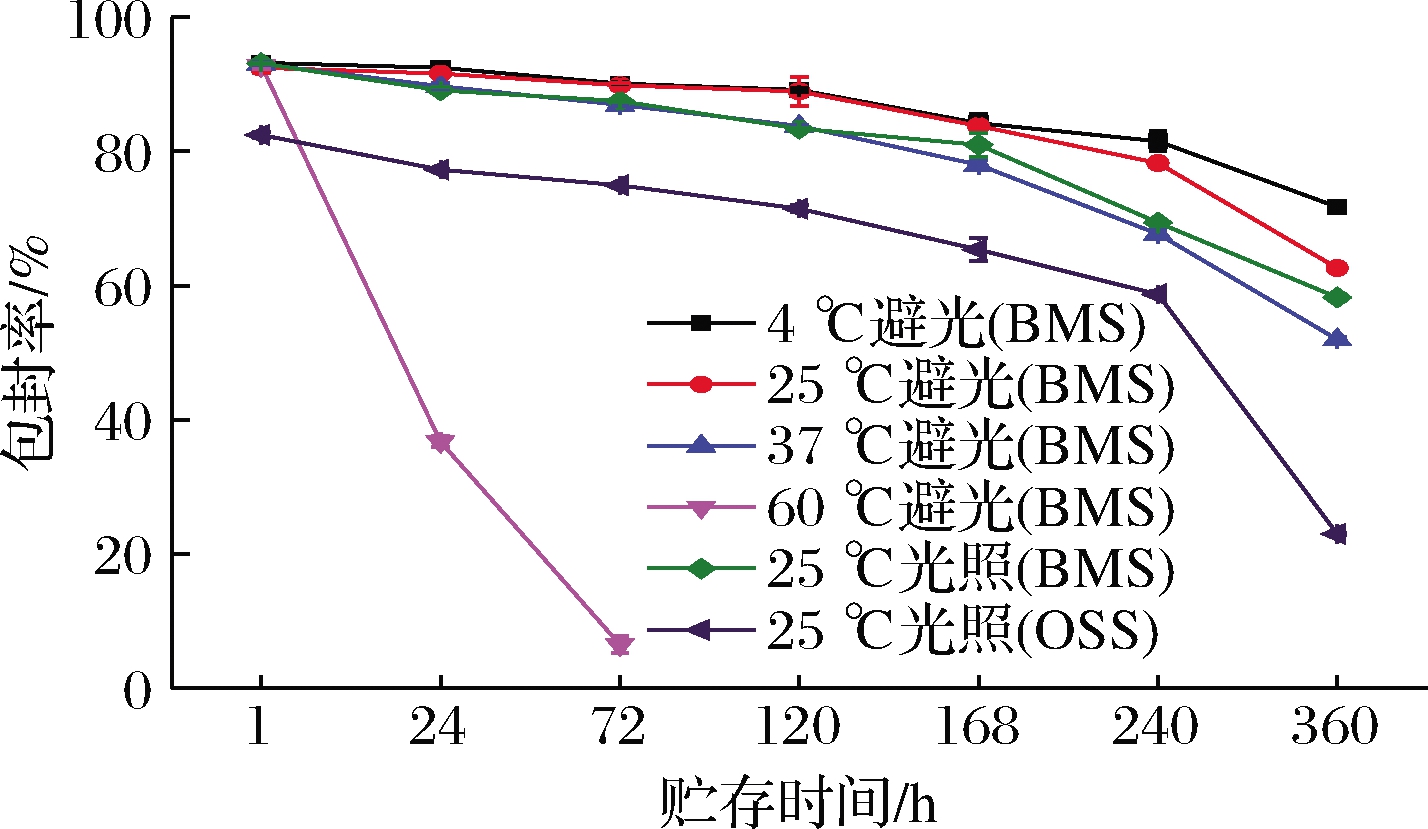
图7 不同贮存条件下乳液中BC的含量变化
Fig.7 Changes of β-carotene content in emulsion under different storage conditions
综上所述,高温和光照环境对乳液BC的荷载是不利的,BMS表现出较为优良的负载BC的性能,其原理可能是由于BMS可在油滴外部形成更加致密和更厚的界面层,对氧、促氧化剂、自由基等的扩散提供了空间屏蔽作用,在提升乳液贮存稳定性的同时,减缓活性物质发生降解[7, 23]。
2.4 Pickering乳液中BC的释放
图8显示了Pickering乳液在过量水透析过程中BC随时间变化的累计释放。在最初的12 h内,BMS稳定的乳液中BC释放量为16.07%,累计释放长达80 h后,约42.53%的BC从乳液中释放。作为对照组的OSS稳定的Pickering乳液中,BC不同时间释放量均显著高于BMS,说明BMS Pickering乳液相较单一改性OSA淀粉Pickering乳液而言,可有效减缓BC释放速率。
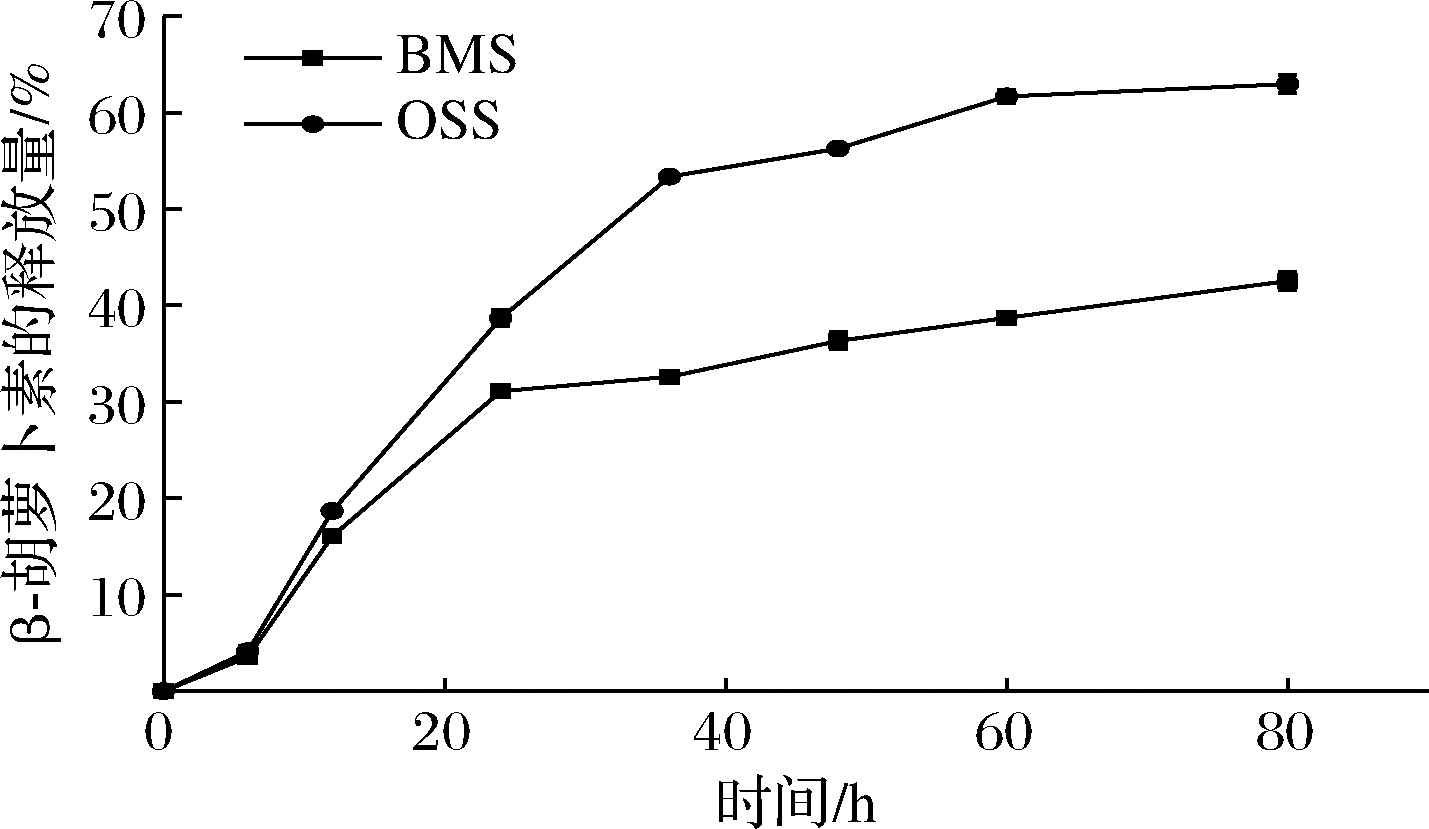
图8 Pickering乳液中BC的释放
Fig.8 Release of β-carotene in Pickering emulsion
不同的包封系统对活性物质的封装效果存在差异,因此也会表现出不同的活性物质释放速率。王麒[15]的研究中以糖基化蛋白-多酚纳米复合物稳定Pickering乳液包埋BC和姜黄素,在54 h内2种活性物质释放量分别达40%和46%。SHMARAKOV等[23]的研究中显示,约50%姜黄素在8 h内快速地从二氧化硅纳米颗粒Pickering乳液中释放,36 h后释放量超过80%。综上,将BMS稳定的Pickering乳液与其他包封系统相比,在负载活性物质、降低活性物质释放速率方面有较为优良的潜力。
2.5 模拟体外胃肠消化
BC由于其抗氧化活性,在降低患癌症和心脏病的风险方面发挥着重要作用[23-24]。由于BC的水溶性有限、化学不稳定性和在人体内的生物利用度低,因此将其纳入商业食品中存在一些挑战[7]。为了克服这些缺陷,已经开发了多种类型的递送系统,研究表明当膳食类胡萝卜素与脂质一起食用或与脂质赋形剂共同摄入时,可以增强对其吸收[25-26]。因此,确定BC包封对其在模拟消化期间的稳定性和保留率是重要的。表1显示了乳液在模拟消化过程中粒径的变化,乳液初始D[4,3]和D[3,2]分别为29.0和19.3 μm,在经过SGF后粒径略微增大,这是由于SGF过程中,较低的pH值和高离子强度导致乳液液滴出现了一定程度的絮凝和聚合等失稳现象。SIF是油脂和淀粉消化的主要场所,也是脂溶性功能因子被吸收利用的场所[27],乳液经SIF后粒径显著减小。
乳液在消化过程中,BC从乳液中释放并与消化液中的胆盐、游离脂肪酸和甘油单酯等自组装形成混合胶束或囊泡,继而被小肠上皮细胞吸收转运[15,28]。图9显示了BC在SGF和SIF中的释放情况。图9-A中随消化时间的延长,BC的释放量逐渐增大,模拟胃消化2 h后,BC的释放量增加到35.91%,相较于其在水中的被动释放而言,释放速率和释放量显著升高。图9-B反应了BC在SIF阶段释放量的变化,在最初的30 min,约40.0%的BC快速地从乳液中释放,随消化延长至2 h后累计释放量达70.1%,SIF阶段的释放量显著高于SGF阶段。综合乳液在SGF和SIF阶段的粒径及BC的释放情况,复合改性小米淀粉Pickering乳液在胃环境中能较好地包封和保护BC,并且在肠液消化阶段有效破坏乳液结构,使BC有效溶出,以促进其在小肠的吸收。
表1 乳液在模拟消化期间粒径的变化
Table 1 Changes in particle size of emulsion during simulated digestion
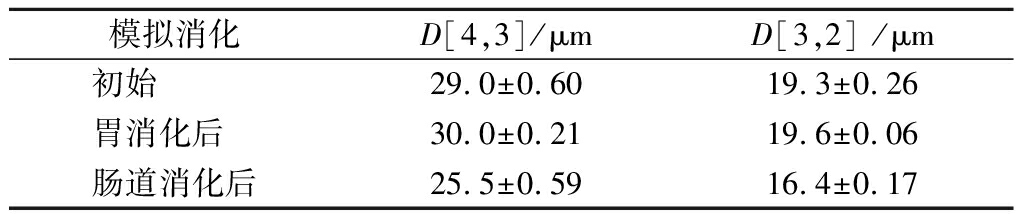
模拟消化D[4,3]/μmD[3,2] /μm初始 29.0±0.6019.3±0.26胃消化后 30.0±0.2119.6±0.06肠道消化后25.5±0.5916.4±0.17
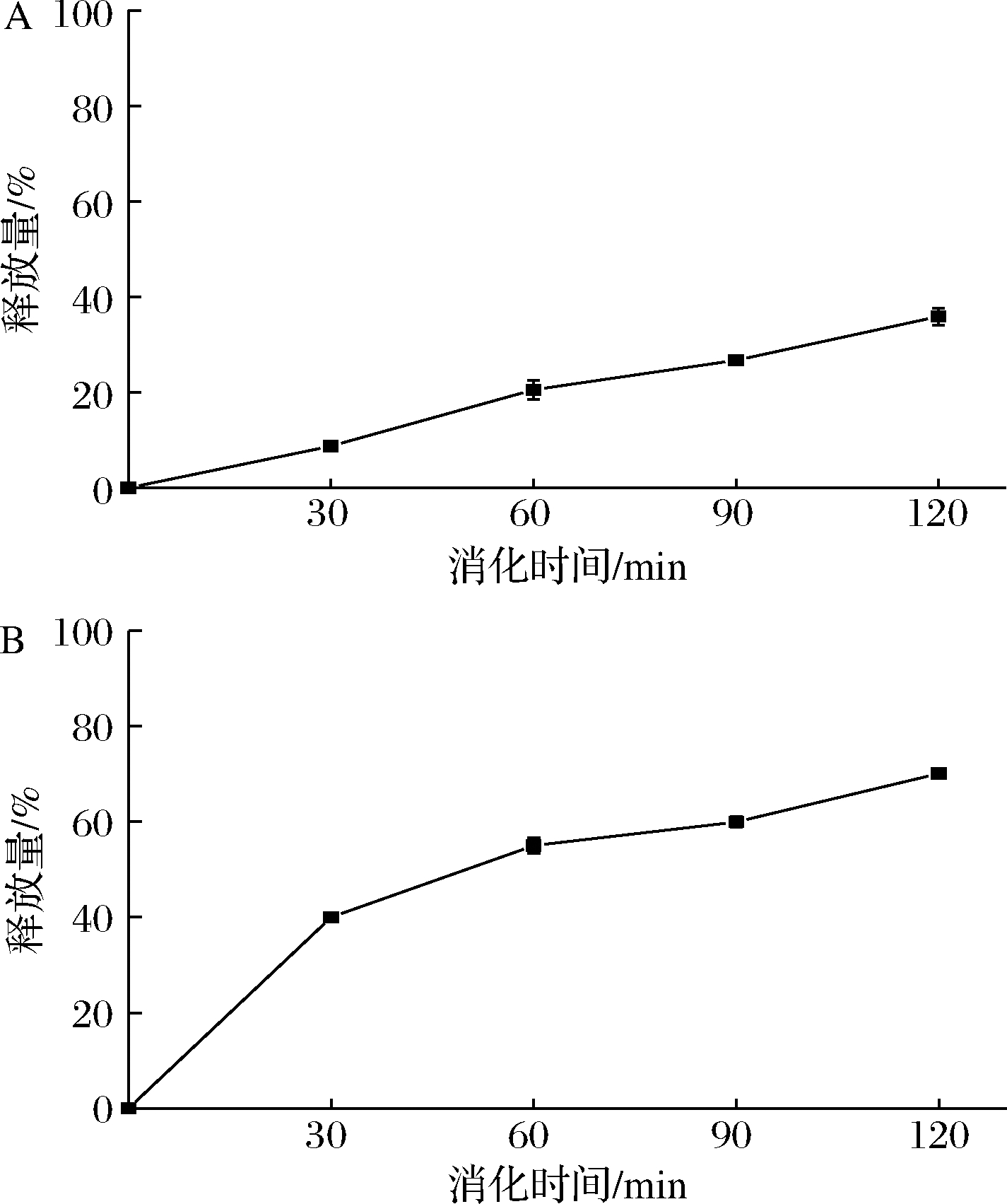
A-模拟胃消化;B-模拟肠道消化
图9 Pickering乳液中BC在模拟胃消化和 模拟肠道消化中的释放
Fig.9 Release of β-carotene in Pickering emulsion in simulated gastric digestion and simulated intestinal digestion
3 结论
本研究主要对负载BC的淀粉基Pickering乳液pH稳定性、盐离子稳定性、贮存稳定性进行分析,并探究了功能性Pickering乳液在水、模拟胃肠环境的释放和保留率。与OSS稳定的Pickering乳液相比,疏水改性协同球磨处理的BMS制备的Pickering乳液具有更加优良的pH、盐离子、贮存稳定性。BC在BMS Pickering的初始负载率为92.92%,光照、温度等不良环境会导致负载率下降;其最佳贮存条件为4 ℃避光贮存,15 d后可维持71.71%的负载率。相比于,BMS Pickering乳液对BC的负载能力更强,保护效果更好。与其他包封系统相比,BMS在负载活性物质、降低活性物质释放速率方面有较为优良的潜力。
[1] XU T, YANG J, HUA S X, et al.Characteristics of starch-based Pickering emulsions from the interface perspective[J].Trends in Food Science & Technology, 2020, 105:334-346.
[2] ZHU F.Starch based Pickering emulsions:Fabrication, properties, and applications[J].Trends in Food Science & Technology, 2019, 85:129-137.
[3] CHEVALIER Y, BOLZINGER M A.Emulsions stabilized with solid nanoparticles:Pickering emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 439:23-34.
[4] LIANG R, SHOEMAKER C F, YANG X Q, et al.Stability and bioaccessibility of β-carotene in nanoemulsions stabilized by modified starches[J].Journal of Agricultural and Food Chemistry, 2013, 61(6):1 249-1 257.
[5] WANG S S, CHEN X D, SHI M X, et al.Absorption of whey protein isolated (WPI)-stabilized β-carotene emulsions by oppositely charged oxidized starch microgels[J].Food Research International, 2015, 67:315-322.
[6] KFOUDY M, AUEZOVA L, GREIGE-GERGES H, et al.Encapsulation in cyclodextrins to widen the applications of essential oils[J].Environmental Chemistry Letters, 2019, 17(1):129-143.
[7] LIN Q Q, LIANG R, ZHONG F, et al.Effect of degree of octenyl succinic anhydride (OSA) substitution on the digestion of emulsions and the bioaccessibility of β-carotene in OSA-modified-starch-stabilized-emulsions[J].Food Hydrocolloids, 2018, 84:303-312.
[8] NIKMARAM N, BUDARAJU S, BARBA F J, et al.Application of plant extracts to improve the shelf-life, nutritional and health-related properties of ready-to-eat meat products[J].Meat Science, 2018, 145:245-255.
[9] MAREFATI A, BERTRAND M, SJÖÖ M, et al.Storage and digestion stability of encapsulated curcumin in emulsions based on starch granule Pickering stabilization[J].Food Hydrocolloids, 2017, 63:309-320.
[10] ABBAS S, BASHARI M, AKHTAR W, et al.Process optimization of ultrasound-assisted curcumin nanoemulsions stabilized by OSA-modified starch[J].Ultrasonics Sonochemistry, 2014, 21(4):1 265-1 274.
[11] 陈金凤, 蒲东艳, 颉萍, 等.微细化玉米淀粉Pickering乳液的制备及其对β-胡萝卜素的荷载作用[J].食品与发酵科技, 2019, 55(3):1-8;14.
CHEN J F, PU D Y, XIE P, et al.Preparation of corn starch Pickering emulsion for β-carotene encapsulation[J].Sichuan Food and Fermentation, 2019, 55(3):1-8;14.
[12] 钱鑫. 运载辅酶Q10的Pickering乳液的制备及皮肤渗透的研究[D].无锡:江南大学, 2018.
QIAN X.Preparation and transdermal delivery of Pickering emulsion encapsulated coenzyme Q10[D].Wuxi:Jiangnan University, 2018.
[13] MARKU D, WAHLGREN M, RAYNER M, et al.Characterization of starch Pickering emulsions for potential applications in topical formulations[J].International Journal of Pharmaceutics, 2012, 428(1-2):1-7.
[14] LIU W, LI Y, CHEN M S, et al.Stabilizing oil-in-water emulsion with amorphous and granular octenyl succinic anhydride modified starches[J].Journal of Agricultural and Food Chemistry, 2018, 66(35):9 301-9 308.
[15] 王麒. 负载天然活性物质的糖基化蛋白-多酚Pickering乳液递送体系的构建及稳定性研究[D].武汉:武汉轻工大学, 2019.
WANG Q.Construction and stability of glycosylated protein-polyphenol Pickering emulsion delivery system loaded with natural active substance[D].Wuhan:Wuhan Polytechnic University, 2019.
[16] LIU C C, AN F P, HE H, et al.Pickering emulsions stabilized by compound modified Areca taro (Colocasia esculenta (L.) Schott) starch with ball-milling and OSA[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 556:185-194.
[17] LIU W, LI Y, GOFF H D, et al.Interfacial activity and self-assembly behavior of dissolved and granular octenyl succinate anhydride starches[J].Langmuir, 2019, 35(13):4 702-4 709.
[18] MU OZ-SHUGUL
OZ-SHUGUL C, VIDAL C P, CANTERO-L
C, VIDAL C P, CANTERO-L PEZ P, et al.Encapsulation of plant extract compounds using cyclodextrin inclusion complexes, liposomes, electrospinning and their combinations for food purposes[J].Trends in Food Science & Technology, 2021, 108:177-186.
PEZ P, et al.Encapsulation of plant extract compounds using cyclodextrin inclusion complexes, liposomes, electrospinning and their combinations for food purposes[J].Trends in Food Science & Technology, 2021, 108:177-186.
[19] 胡艳娜. 辛烯基琥珀酸环糊精酯/姜黄素包合物的制备及其在Pickering乳液中的应用研究[D].广州:华南理工大学, 2017.
HU Y N.Study on preparation of OS-β-CD/curcumin inclusion complex and its application in Pickering emulsion[D].Guangzhou:South China University of Technology, 2017.
[20] LIN Q Q, LIANG R, ZHONG F, et al.Physical properties and biological fate of OSA-modified-starch-stabilized emulsions containing β-carotene:Effect of calcium and pH[J].Food Hydrocolloids, 2018, 77:549-556.
[21] ZHAO Y G, KHALID N, SHU G F, et al.Formulation and characterization of O/W emulsions stabilized using octenyl succinic anhydride modified kudzu starch[J].Carbohydrate Polymers, 2017, 176:91-98.
[22] ZHANG X Y, QI B K, XIE F Y, et al.Emulsion stability and dilatational rheological properties of soy/whey protein isolate complexes at the oil-water interface:Influence of pH[J].Food Hydrocolloids, 2021, 113:106391.
[23] SHMARAKOV I O, YUEN J J, BLANER W S.Carotenoid Metabolism and Enzymology[M].Clifton:Humana Press, 2013:29-56.
[24] MAIANI G, CAST N M J P, CATASTA G, et al.Carotenoids:Actual knowledge on food sources, intakes, stability and bioavailability and their protective role in humans[J].Molecular Nutrition and Food Research, 2009, 53(Suppl 2):S194-S218.
N M J P, CATASTA G, et al.Carotenoids:Actual knowledge on food sources, intakes, stability and bioavailability and their protective role in humans[J].Molecular Nutrition and Food Research, 2009, 53(Suppl 2):S194-S218.
[25] ZHANG R J, MCCLEMENTS D J.Enhancing nutraceutical bioavailability by controlling the composition and structure of gastrointestinal contents:Emulsion-based delivery and excipient systems[J].Food Structure, 2016, 10:21-36.
[26] SALVIA-TRUJILLO L, MCCLEMENTS D J.Enhancement of lycopene bioaccessibility from tomato juice using excipient emulsions:Influence of lipid droplet size[J].Food Chemistry, 2016, 210:295-304.
[27] PAN Y, XIE Q T, ZHU J, et al.Study on the fabrication and in vitro digestion behavior of curcumin-loaded emulsions stabilized by succinylated whey protein hydrolysates[J].Food Chemistry, 2019, 287:76-84.
[28] 骆正哲. W/O/W型Pickering乳液的制备及其对生物活性物的包裹研究[D].无锡:江南大学, 2019.
LUO Z Z.Preparation of W/O/W Pickering emulsion and its encapsulation for bioactives[D].Wuxi:Jiangnan University, 2019.