牡蛎肉质鲜美,营养丰富,富含39.1%~53.1%(干基)的蛋白质[1],同时还含有维生素D,维生素B12,烟酸,核黄素,硫胺素等多种营养素[2],是一种营养价值很高的海洋蛋白资源。目前,牡蛎主要以鲜食为主,精深加工产品少,发展空间大。牡蛎肽是以牡蛎肉为原料,经酶解、精制而得的小分子低聚肽,大量研究表明,牡蛎肽具有抗癌活性[3]、抗皱纹恢复光老化[4]、抗氧化[5]等生物活性功能。
来源于海洋的牡蛎肽具有特殊的腥味,导致消费者直接摄入口服的可接受程度较低;并且流动性较好的牡蛎肽基料具有极强的吸湿性,这限制了牡蛎肽相关产品的开发与商品化利用。此外,肽类对胃肠道消化的高度敏感性严重影响其生物利用度[6],生物活性肽的适用性会因其在口服过程中的低生物稳定性而受到限制,导致其在达到人体预期目标之前降解并丧失结构和功能[7]。因此,构建合适的递送体系,保护牡蛎肽生物活性[8],靶向运输递送以提高牡蛎肽的生物利用度,同时掩蔽海洋源物质特殊腥味,扩大其应用领域具有实际应用价值和意义。
乳液是通过将一种液体以细小液滴(通常约为0.1~10 μm)的形式分散到另一种不混溶的液体中而形成的热力学不稳定[9]体系。乳液系统是用于封装,保护,输送食品活性成分以及药物的最优选输送系统[10]。近年来,稳定的油包水(water/oil,W/O)乳剂的配方因其在封装和保护敏感的水溶性生物活性营养素和药物(例如维生素和矿物质)方面的潜在优势而受到了许多研究者的关注[11]。因此本研究选择W/O乳液体系包封亲水性的牡蛎肽,并探究乳液的理化性质及对抗不同环境条件变化的稳定性。研究结果可为改善牡蛎肽相关产品性能,扩大牡蛎肽的应用范围,促进牡蛎肽乳剂类相关功能保健产品的开发提供参考。
1 材料与方法
1.1 原料与试剂
牡蛎肽,北京盛美诺生物技术有限公司;非转基因一级大豆油(酸值为0.06 mg KOH/g,过氧化物值为0.026 g/kg),中粮佳悦(天津)有限公司;食品级聚甘油蓖麻醇酸酯,上海源叶生物科技有限公司;超纯水由实验室制备。
1.2 仪器与设备
ULTRA-TURRAX-T18型高速剪切机,德国IKA公司;OLYMPUS-CX43型光学显微镜,日本奥林巴斯光学公司;JIDI-UP-Basic型超纯水机,广州吉迪仪器有限公司;SPX-150B-Z型生化培养箱,上海博讯医疗生物仪器股份有限公司;DK-98-II型电热恒温水浴锅,天津市泰斯特仪器有限公司;PEN3型电子鼻,德国AIRSENSE公司;NMI20-060H-I型核磁共振分析成像分析仪,苏州纽迈分析仪器股份有限公司。
1.3 实验方法
1.3.1 牡蛎肽基料的粉体学性质表征
1.3.1.1 休止角
根据文献[12]提供的方法并稍加改动,将玻璃漏斗垂直固定于铁架台上,使漏斗下端距离水平桌面的高度(H)为2.0 cm。将牡蛎肽粉末缓慢地倒入漏斗中,粉末自然下落直至堆积的粉末圆锥体顶端刚好接触到漏斗下端停止,读取粉末圆锥体直径2R (cm),并按公式(1)计算休止角:
休止角![]()
(1)
1.3.1.2 滑动角
根据文献[12]提供的方法并稍加改动,将长为L=50 cm的玻璃板水平放置,将其一端固定。准确称取6.00 g的牡蛎肽粉置于玻璃板的非固定端,缓慢抬升非固定端至粉体开始滑动,记录此时玻璃板非固定端抬升高度(H)cm,并按式(2)计算滑动角:
滑动角![]()
(2)
1.3.1.3 堆积密度与振实密度
堆积密度的测定[13]:取已称重的10 mL量筒,质量记为m,用漏斗将适量牡蛎肽粉匀速注入量筒中,精密称定质量,记为M,同时记录粉末体积V1,堆积密度ρ1根据公式(3)计算:
(3)
振实密度的测定[14]:将上述装有牡蛎肽粉的量筒从距离水平桌面大概2 cm处自由下落,重复25次,记录粉末体积V2,根据公式(4)计算振实密度ρ2:
(4)
1.3.1.4 吸湿率
根据文献[14]的方法,配制氯化钠过饱和溶液(相对湿度75%)于干燥器中,室温条件下饱和24 h。称取3份牡蛎肽基料(1.456 7±0.582 6) g平铺在称量瓶中恒重48 h,然后转移到过饱和氯化钠溶液的干燥器中,12 d连续取样称重,根据公式(5)计算吸湿率:
吸湿率![]()
(5)
1.3.2 W/O乳液的制备
采用超纯水将牡蛎肽配制成质量浓度为200 g/L的溶液作为水相,以含5%(质量分数)聚甘油蓖麻醇酸酯的大豆油为油相。将水相缓慢加入到油相中以12 000 r/min的速度剪切分散3 min制备得到W/O型乳液。
1.3.3 乳液相关指标测定
1.3.3.1 乳化指数的测定
乳液的稳定性可通过乳化层的高度随时间的变化来定量[15],通过乳化指数反应乳液稳定性,乳化指数计算如公式(6)所示:
乳化指数![]()
(6)
式中:He为乳液乳化层的高度,mm;H为油水相混合液的总高度,mm。
1.3.3.2 乳液显微镜观察
新鲜制备的乳液样品取5 μL均匀涂于载玻片上,用盖玻片轻缓覆盖,以最大程度地减少乳液被破坏[16]。显微镜在100倍香柏油浸没的明场模式条件下对乳液外观形态进行观察并使用软件CapStudio配套的相机定标拍照,获得液滴的形态照片[17]。
1.3.3.3 乳液液滴尺寸大小及分布
根据参考文献[18]提供的方法,选乳液的显微形态照片,随机选择3个视野图像,每个图像用CapStudio Bioiogy 3.2.16软件计数不少于100个液滴来分析乳液的平均粒径和液滴粒径分布。
1.3.4 电子鼻分析乳液掩蔽牡蛎肽气味效果
取10 mL新鲜乳液样品于50 mL顶空瓶中,立即加盖密封,在室温下静置平衡30 min后测样[19]。电子鼻进样针连接的活性炭过滤器经烘干冷却后进行测样,活性炭过滤的空气作为载气清洗传感器阵列[20],冲洗时间为120 s,进样流量为300 mL/min,载气流速为300 mL/min;样品测样时间为60 s,取10个气味传感器响应值稳定后的数据做雷达图分析乳液对牡蛎肽气味包封效果。
1.3.5 乳液黏度
取新鲜乳液2 mL,采用35 mm不锈钢平行板及配套的P35探头,间隙为1 mm,在25 ℃条件下,剪切速率范围为10~500 1/s,选择连续剪切模式测定新鲜乳液的表观黏度。
1.3.6 低场核磁成像
用标准样品放入磁体箱内进行参数校正设置,然后将盛有2 mL乳液样品的塑料皿置于成像线圈样品台中心,成像软件选用NiuSE序列自旋回波成像。
1.3.7 乳液稳定性分析
1.3.7.1 不同贮藏温度条件下乳液稳定性分析
选取最佳工艺参数制备新鲜乳液,将制备的乳液转移到透明玻璃瓶中,分别在4、25、35 ℃条件下静置贮藏15 d,每天测定乳液的乳化指数,拍照记录宏观相行为,观察乳液液滴显微形态并测量粒径,分析贮藏环境温度对乳液的影响。
1.3.7.2 乳液离心稳定性
新鲜乳液在室温条件下4 000 r/min离心30 min以及8 000 r/min离心30 min,根据离心保留率评价乳液样品的离心稳定性。离心保留率根据公式(7)计算:
离心保留率![]()
(7)
1.3.7.3 乳液热稳定性
制备新鲜乳后,立即对乳液进行水浴加热处理[21],选择的加热条件包括高温短时处理(90 ℃、3 min)、低温长时处理(70 ℃、30 min)和极端热处理工艺(90 ℃、45 min),然后立即用流动的自来水快速冷却加热的乳液[22],观察乳液表观相行为测定乳化指数。
1.3.7.4 乳液循环冻融稳定性
将制备的新鲜乳液转移到50 mL带盖样品瓶中,在-18 ℃冷冻贮存24 h后,在室温条件解冻1 h,观察乳液表观相行为变化,循环冻融操作3次[23],观察乳液表观相行为测定乳化指数。
1.4 数据统计分析
实验数据结果以平均值±标准差表示,使用Orgin 9.1做图。使用SPSS 26.0进行统计分析,用单因素方差分析,采用Duncan法测定各变量平均值之间的显著性差异,显著性水平设为P<0.05。
2 结果与分析
2.1 牡蛎肽基料性质测定结果
牡蛎肽基料体外观及显微观察如图1-a所示,外观均匀无杂质呈黄褐色粉末状。休止角也称安息角或自然坡度角,是粉体自然堆积斜面与底部水平面所夹锐角[24];休止角表示物料颗粒之间的集聚或团聚能力;滑动角表示物料颗粒在接触面上的附着能力[12]。其大小直接反映粉体的流动性,休止角越小流动性越好[24]。对于食品粉体,通常认为休止角小于30 °时流动性好[12]。牡蛎肽粉的休止角为(22.29±0.49)°,滑动角为(29.19±0.46)°,表明牡蛎肽粉具有极佳的流动性。堆积密度与粉体粒径大小、微观结构有关,堆积密度越小,表示粉体越疏松[25],牡蛎肽基料的堆积密度为(0.469 7±0.007 6) g/mL,振实密度为(0.585 7±0.006 9) g/mL,表明牡蛎肽基较疏松,这有利用与其他原料混合复配。虽然牡蛎肽具有较好的流动性,但是其吸湿能力也较强(图1-b),严重限制了其在食品商业化生产中的应用。
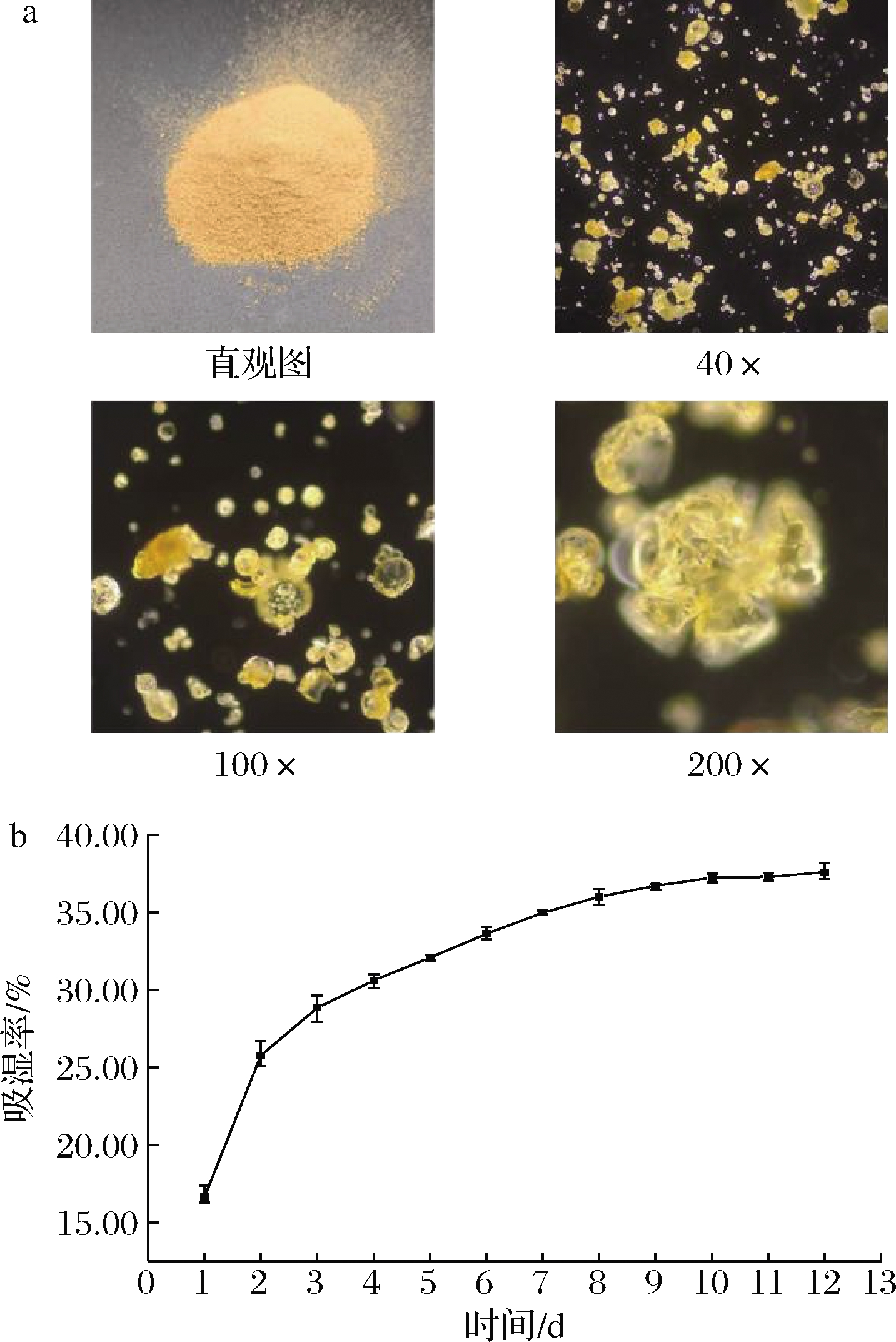
a-牡蛎肽基料的直观图及显微观察图; b-牡蛎肽粉吸湿率变化曲线
图1 牡蛎肽粉显微观察图和吸湿曲线
Fig.1 Microscopic observation and moisture absorption curve of oyster peptide powder
对牡蛎肽粉的吸湿率曲线进行二项式回归拟合,得吸湿方程为:y=-0.002 2d2+0.044 3d+0.155 9,其中R2为0.947 2,表明拟合性较好。对吸湿方程一阶求导,得吸湿速率方程为v=-0.004 4d+0.044 3,当吸湿速率为0时,说明牡蛎肽粉吸湿达平衡状态,计算可知平衡时吸湿率为37.89%,这与12 d连续测定结果接近。与其他肽类的吸湿性结果相比,牡蛎肽平衡时吸湿率均高于文献中[26]的不同动物来源(猪皮、牛皮、驴皮、鳕鱼皮、牛骨)胶原肽的吸湿性,这样的结果推测与肽的来源、种类及肽段氨基酸序列中不同的亲水基团有关。
2.2 W/O乳液部分理化性质表征分析
2.2.1 乳液黏度及核磁成像结果
由图2-a可知,乳液黏度随剪切速率的增加而逐渐降低,到一定剪切速率后黏度趋于平缓,表明乳液在外力剪切时,分子结构被破坏,分子间结合力变差,黏度降低[27],呈现剪切稀化现象,表明该乳液是假塑性流体。
在伪彩色图像中,水分含量较高的区域显示为红色,否则显示为蓝色[28]。如图2-b所示,图像显示均匀的蓝色,说明油相作为连续相较好地覆盖了分散水相,同时蓝色在形成的图像上均匀分布表明乳液分布,证实了油相对含有牡蛎肽水相的良好包裹。YANG等[29]通过低场核磁(low-field nuclear magnetic resonance,LF-NMR)成像测量了双乳状液的质子密度,通过这种简单且无损的方法进一步解释乳液中水分布与稳定性之间的关系。基于低场核磁共振成像(magnetic resonance imaging,MRI)的快速无损表征方法,被认为是最有吸引力的非侵入性技术之一,适用于追踪食品原料中的物理化学变化[28],也是不透明样品(乳液)分析的理想选择,提供了有利的方法表征样品相关特性[30]。
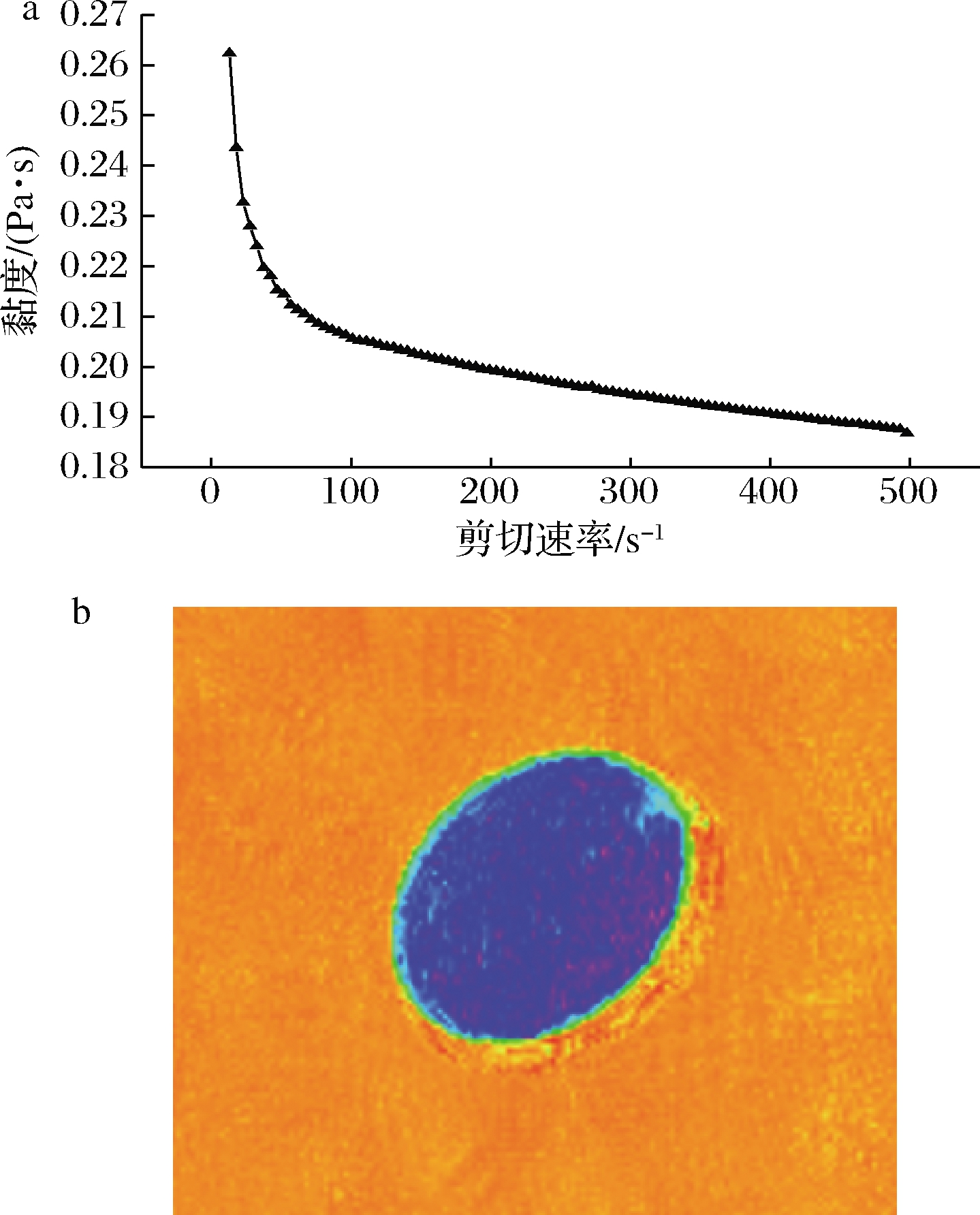
a-乳液剪切黏度变化特性曲线;b-乳液核磁成像图
图2 乳液流变及核磁成像结果图
Fig.2 Emulsion rheological and NMR imaging results
2.2.2 乳液掩蔽牡蛎肽腥味效果
PEN3型电子鼻传感器阵列及其主要特性见表1。
表1 电子鼻传感器性能描述
Table 1 Performance description of electronic nose sensor

传感器阵列名称性能描述W1C芳香成分,苯类W5S灵敏度大,对氮氧化物很敏感W3C芳香成分灵敏,氨类W6S主要对氢化合物有选择性W5C短链烷烃芳香成分W1S对甲基类灵敏W1W对无机硫化物灵敏W2S对醇类、醛酮类灵敏W2W对芳香成分、有机硫化物灵敏W3S对长链烷烃类灵敏
海洋产品的牡蛎肽具有不愉悦腥味,严重限制了消费者对牡蛎肽等一系列海洋产品的接受程度。电子鼻感官分析的结果可以提高感官评价的判别效率和准确性,是一种方便有效的气味评价感官方法[31]。表1和图3结果表明,W1W表示的无机硫化物是牡蛎肽腥味物质的主要来源[32],乳液与牡蛎肽溶液的电子鼻分析结果对比显示,乳液对牡蛎肽的不愉快腥味具有明显的掩蔽效果。因此,通过乳化技术制备乳液体系掩蔽不良腥味来实现改善牡蛎肽相关产品的利用性能具有可行性。
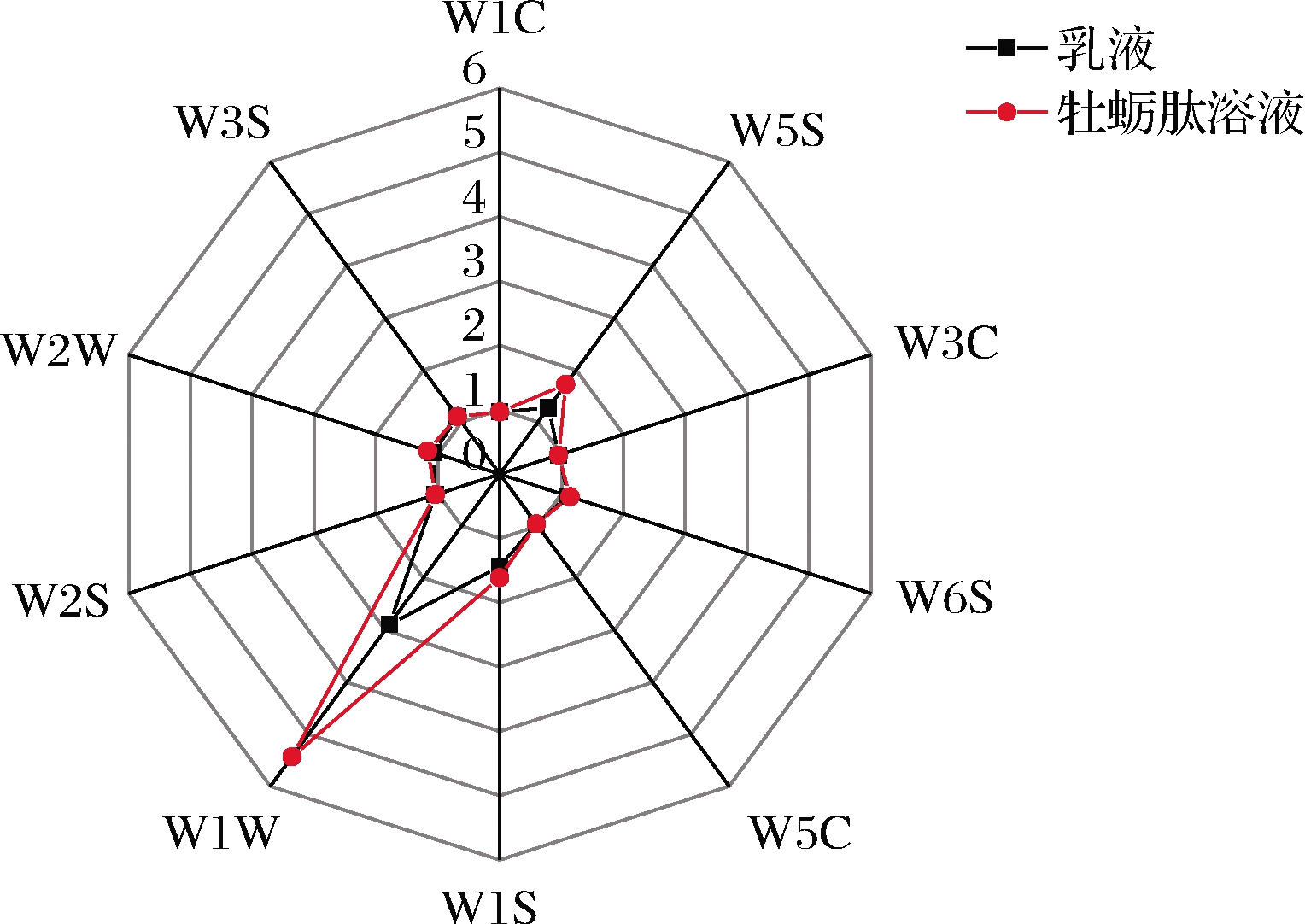
图3 乳液对牡蛎肽腥味掩蔽效果雷达图
Fig.3 Effect of emulsion masking oyster peptide fishy smell
2.3 不同贮藏温度条件下乳液的稳定性
为模拟乳液产品在不同季节环境中的贮存情况,将最佳条件下制备的乳液置于不同温度环境中恒温贮藏,直观效果如图4所示。新鲜乳液平均粒径为(0.64±0.05) μm,4 ℃贮藏15 d后平均粒径为(0.71±0.06) μm,25 ℃贮藏15 d后平均粒径为(0.82±0.11) μm,35 ℃贮藏15 d后平均粒径为(0.88±0.13) μm,在35 ℃贮藏15 d后平均粒径显著高于25 ℃和4 ℃组。图5结果表明,在35 ℃环境中贮藏的乳液会出现絮凝结块现象,不利于乳液的贮藏。这与茅娟芝等[33]的高温条件不利于乳液稳定结果一致。

a-乳液在不同温度贮藏15 d的直观效果图; b-新鲜乳液在不同温度环境贮藏15 d前后的显微图
图4 乳液在不同温度条件下贮藏15 d直观效果和显微结构图
Fig.4 Visual effect and microstructure diagram of emulsion stored for 15 days under different temperature
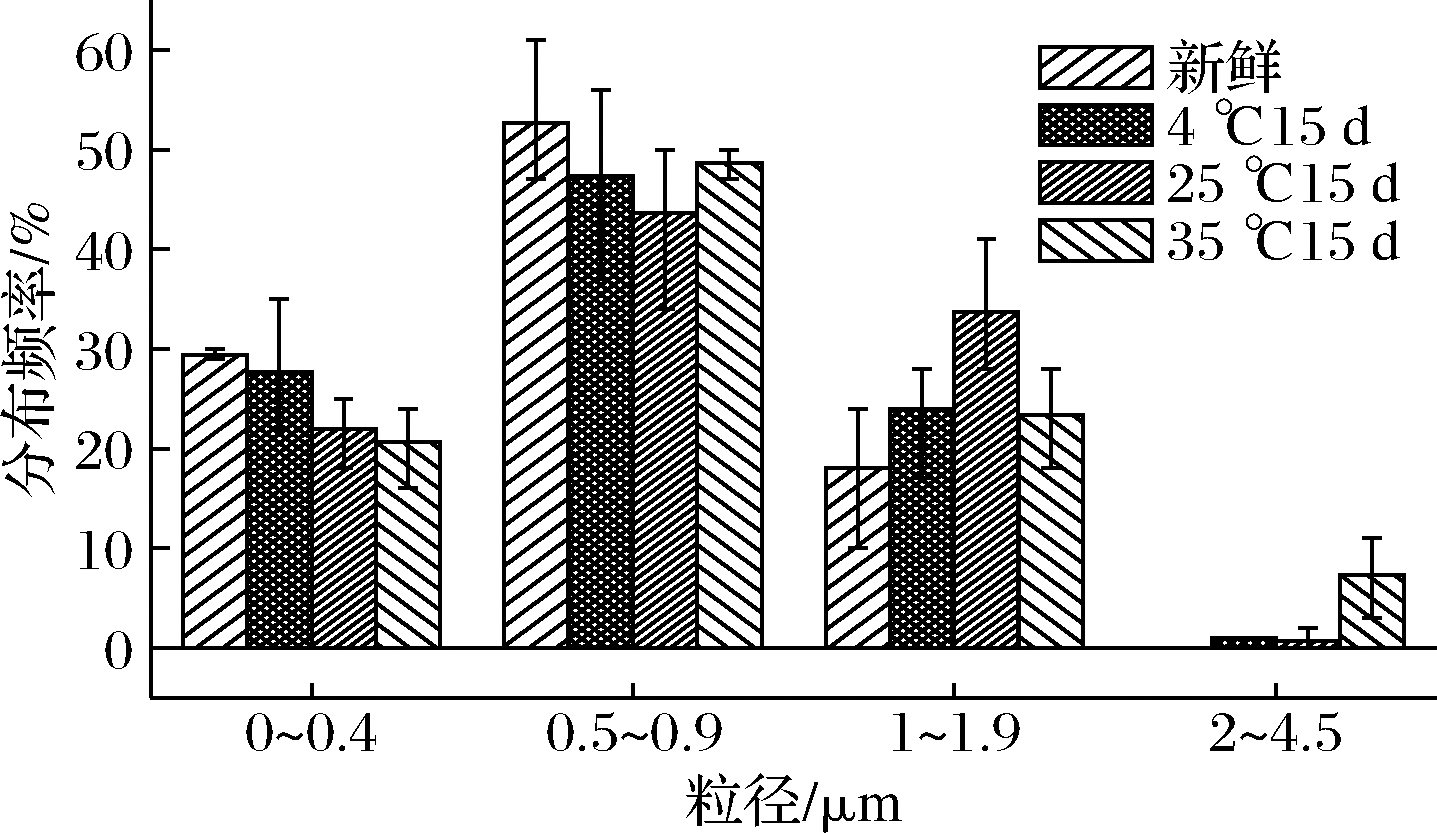
图5 乳液在不同温度条件贮藏粒径分布及变化
Fig.5 Size distribution and variation of emulsion storage at different temperatures conditions
图4和图5表明,较高的贮藏温度条件下导致液滴与液滴之间的碰撞频率增加,这会导致液滴之间在没有强烈排斥力的条件下促进聚集[34],也是35 ℃条件出现大液滴,平均液滴粒径较大的原因。乳液在4 ℃环境下贮藏时不结晶,仍具有较好的流动性。与同类型乳液产品比较,朱加进等[35]制备的W/O乳液常温条件下保藏稳定,也不适合高温贮藏。因此,乳液在4 ℃低温和室温25 ℃条件下均有较好的贮藏稳定性。
2.4 乳液离心稳定性结果
乳液在4 000 r/min离心30 min时无相分离现象,乳化指数和离心保留率均为100%。此时乳液无任何相分离现象,图6所示。因为连续油相的高黏度阻碍液滴相对运动,使得乳液液滴相互碰撞接触的程度减少,也证明油相对分散相的良好包裹效果,因此表现出极佳的稳定性。进一步提高转速在8 000 r/min 离心30 min时,随着离心力强度的增加,仅有少量油相上浮,无水相析出,乳化指数为(92.11±0.19)%,离心保留率为(91.66±0.62)%。朱加进等[35]制备的南极磷虾油W/O型微乳液在3 000 r/min离心30 min后依然不分层,说明微乳的稳定性良好。试验结果与同类型乳液相比,经历高转速二次离心时仍然具有一定的稳定性。因此,乳液对抗离心作用时具有极好的稳定性。

图6 乳液在不同离心条件下的直观效果图
Fig.6 Visual effect diagram of emulsion under different centrifugal conditions
2.5 乳液热稳定性结果
加热是食品常见加工方法,主要用于确保食品的微生物安全,加热条件是模拟制造商对相似类型产品应用的处理条件进行[36]。加热会引起吸附到液滴表面乳化剂分子的构象变化,从而改变其稳定液滴抵抗聚集的能力[34],同时加剧了液滴运动碰撞进一步导致不稳定。图7结果表明,在70 ℃加热30 min和90 ℃加热3 min条件下不会对样品的稳定性产生明显影响,说明该乳液体系对抗常规热巴氏灭菌处理具有良好的稳定性。在极端热处理90 ℃加热45 min后有少部分水相析出,乳液分层,其乳化指数为(82.6±1.3)%,表明乳液对抗加热应力具有稳定性。

a-乳化指数;b-直观效果
图7 乳液不同热处理的乳化指数及直观效果
Fig.7 Emulsification index and visual effects of different heat treatments of emulsion
2.6 乳液反复冻融结果
冷冻是保持食品营养和感官特性、抑制化学和微生物引起的腐败以及延长食品货架期的有效方式[37]。乳状液在冷冻、贮藏及解冻过程中,稳定性受多种因素的影响,极易出现不稳定现象,造成食品感官、营养价值下降或缩短食品货架期等[37]。如图8所示,乳液经3次反复冻融后,仍具极好的稳定性,无任何相分离现象,乳化指数均为100%,说明该乳液对抗反复冻融体现出极好的稳定性。钟明明等[23]制备的乳液产品经过1次冻融循环部分乳液能保持相对较好的稳定性,而经过2次冻融循环后乳液会出现不同程度的分层现象,这可能与制备乳液的类型及使用的乳化剂有关。

图8 乳液经过3次冻融的直观效果
Fig.8 The visual effect of the emulsion after three freeze-thaw cycles
3 结论与讨论
具有多种活性功能的牡蛎肽基料具有较好的流动性,但是极强的吸湿能力限制了其在食品工业化生产中的应用,同时由于特殊的海洋来源方式使其具有不愉悦的腥味,严重限制了消费者对牡蛎肽相关产品的接受程度。剪切乳化技术制备的牡蛎肽W/O型乳液,可以明显掩蔽不愉快腥味,为相关产品的开发提供了除腥新思路。同时乳液在对抗不同环境应力时均表现出良好的稳定性,表明其在乳剂相关产品的开发利用具有一定潜力。综上,试验结果将为牡蛎肽在乳剂类功能保健食品行业中的更广泛应用提供可能性,为牡蛎肽的稳态化递送体系开发设计提供参考。
[1] 郑惠娜, 张晶晶, 周春霞, 等.pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析 [J].中国食品学报, 2014, 14(7):230-235.
ZHENG H N, ZHANG J J, ZHOU C X, et al.Extraction of oyster protein by alkali solution acid precipitation and its amino acid and protein composition analysis [J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):230-235.
[2] CORREIA-DA-SILVA M, SOUSA E, PINTO M M M, et al.Anticancer and cancer preventive compounds from edible marine organisms [J].Seminars in Cancer Biology, 2017, 46:55-64.
[3] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al.Antioxidant activity and anticancer effect of bioactive peptide from enzymatic hydrolysate of oyster (Saccostrea cucullata) [J].Biomedicine & Preventive Nutrition, 2014, 4(3):343-353.
[4] BANG J S, JIN Y J, CHOUNG S Y.Low molecular polypeptide from oyster hydrolysate recovers photoaging in SKH-1 hairless mice [J].Toxicology and Applied Pharmacology, 2020, 386:114844.
[5] WANG Q K, LI W, HE Y H, et al.Novel antioxidative peptides from the protein hydrolysate of oysters (Crassostrea talienwhanensis) [J].Food Chemistry, 2014, 145:991-996.
[6] MOHAN A, RAJENDRAN S, HE Q S R C K, et al.Encapsulation of food protein hydrolysates and peptides:A review [J].RSC Advances, 2015, 5(97):79 270-79 278.
[7] MOHAN A, MCCLEMENTS D J, UDENIGWE C C.Encapsulation of bioactive whey peptides in soy lecithin-derived nanoliposomes:Influence of peptide molecular weight [J].Food Chemistry, 2016, 213:143-148.
[8] JO Y J, VAN DER SCHAAF U S.Fabrication and characterization of double (W1/O/W2) emulsions loaded with bioactive peptide/polysaccharide complexes in the internal water (W1) phase for controllable release of bioactive peptide [J].Food Chemistry, 2021, 128619.
[9] ZHENG L, CAO C, CHEN Z, et al.Evaluation of emulsion stability by monitoring the interaction between droplets [J].LWT, 2020, 132:109804.
[10] NIKMARAM N, ROOHINEJAD S, HASHEMI S, et al.Emulsion-based systems for fabrication of electrospun nanofibers:Food, pharmaceutical and biomedical applications[J].RSC Advances, 2017, 7(46):28 951-28 964.
[11] TIAN H Y, XIANG D, WANG B, et al.Using hydrogels in dispersed phase of water-in-oil emulsion for encapsulating tea polyphenols to sustain their release [J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 612:125999.
[12] 王阳, 颜才植, 叶发银, 等.膳食纤维粉体流动性与其颗粒结构的关系 [J].食品科学, 2018, 39(10):84-88.
WANG Y, YAN C Z, YE F Y, et al.Relationship between flowability and particle structure of dietary fiber powders [J].Food Science, 2018, 39(10):84-88.
[13] 刘雨曦, 薛佳, 傅宝尚, 等.超声波喷雾-冷冻干燥与传统干燥技术制备高汤粉体的比较 [J].食品科学, 2020, 41(11):128-134.
LIU Y X, XUE J, FU B S, et al.Comparative study on preparation of broth powder by ultrasonic spraying-freeze drying and traditional drying techniques [J].Food Science, 2020, 41(11):128-134.
[14] 赵甜甜, 李小芳, 马祖兵, 等.黄芩总黄酮纳米混悬剂冻干粉的表征及辅料对其粉体学性质和吸湿性的影响 [J].中成药, 2019, 41(7):1 485-1 490.
ZHAO T T, LI X F, MA Z B, et al.Characterization of nanosuspension lyophilized powder of Scutellariae baicalensis total flavonoids and effects of excipients on the powder properties and hygroscopicity [J].Chinese Traditional Patent Medicine, 2019, 41(7):1 485-1 490.
[15] ZHANG X Y, QI B K, XIE F Y, et al.Emulsion stability and dilatational rheological properties of soy/whey protein isolate complexes at the oil-water interface:Influence of pH [J].Food Hydrocolloids, 2021, 113:106391.
[16] COSTA C, ROSA P, FILIPE A, et al.Cellulose-stabilized oil-in-water emulsions:Structural features, microrheology, and stability [J].Carbohydrate Polymers, 2021, 252:117092.
[17] LAMOTHE S, GUÉRETTE C, BRITTEN M.Nutrient release and oxidative stability during in vitro digestion of linseed oil emulsions produced from cow milk, soy drink, and green tea extract [J].LWT, 2020, 134:110137.
[18] CETINKAYA T, ALTAY F, CEYLAN Z.A new application with characterized oil-in-water-in-oil double emulsions:Gelatin-xanthan gum complexes for the edible oil industry [J].LWT, 2021, 138:110773.
[19] ZHU D, REN X, WEI L, et al.Collaborative analysis on difference of apple fruits flavour using electronic nose and electronic tongue [J].Scientia Horticulturae, 2020, 260:108879.
[20] YIN X Y, LYU Y C, WEN R X, et al.Characterization of selected Harbin red sausages on the basis of their flavour profiles using HS-SPME-GC/MS combined with electronic nose and electronic tongue [J].Meat Science, 2021, 172:108345.
[21] YOUNG S, BASIANA E, NITIN N.Effects of interfacial composition on the stability of emulsion and encapsulated bioactives after thermal and high pressure processing [J].Journal of Food Engineering, 2018, 231:22-29.
[22] LING Z T, AI M M, ZHOU Q, et al.Fabrication egg white gel hydrolysates-stabilized oil-in-water emulsion and characterization of its stability and digestibility [J].Food Hydrocolloids, 2020, 102:e05621.
[23] 钟明明, 廖一, 齐宝坤, 等.超声改性大豆亲脂蛋白-羟丙基甲基纤维素乳液的冻融稳定性 [J].食品科学, 2020, 41(5):73-79.
ZHONG M M, LIAO Y, QI B K, et al.Freeze-thaw stability of sonicated soybean lipophilic protein-hydroxypropyl methylcellulose stabilized emulsions [J].Food Science, 2020, 41(5):73-79.
[24] 郑博妍, 范丽影, 郝佳, 等.红曲色素粉体干法制粒工艺研究 [J].食品与发酵工业, 2021,47(17):148-155.
ZHENG B Y, FAN L Y, HAO J, et al.Study on dry granulation technology of monascus pigment powder[J/OL].Food and Fermentation Industries, 2021, 2021,47(17):148-155.
[25] ZHANG Z P, SONG H G, PENG Z, et al.Characterization of stipe and cap powders of mushroom (Lentinus edodes) prepared by different grinding methods [J].Journal of Food Engineering, 2012, 109(3):406-413.
[26] 贾建萍, 鲁健章, 周彦钢, 等.不同来源胶原肽的抗氧化活性及吸湿保湿性能[J].食品科学,2010, 31(21):169-172.
JIA J P, LU J Z, ZHOU Y G, et al. Antioxidant activity, moisture-absorbing and moisture-retention properties of collagen peptides from different sources [J].Food Science, 2010, 31(21):169-172.
[27] 周启萍, 张兆云, 袁翔, 等.啤特果果汁流变学特性研究 [J].食品与发酵工业, 2021, 47(8):76-81.
ZHOU Q P, ZHANG Z Y, YUAN X, et al, Study on rheological properties of Piteguo fruit juice[J].Food and Fermentation Industries, 2021, 47(8):76-81.
[28] LI M, LI B, ZHANG W J.Rapid and non-invasive detection and imaging of the hydrocolloid-injected prawns with low-field NMR and MRI [J].Food Chemistry, 2018, 242:16-21.
[29] YANG J, GU Z, CHENG L, et al.Preparation and stability mechanisms of double emulsions stabilized by gelatinized native starch [J].Carbohydrate Polymers, 2021, 262:117926.
[30] WANG C, WANG X, LIU C Y, et al.Application of LF-NMR to the characterization of Camellia oil-loaded Pickering emulsion fabricated by soy protein isolate[J].Food Hydrocolloids, 2021, 112:106329.
[31] YANG Y, ZHAO C Y, TIAN G F, et al.Characterization of physical properties and electronic sensory analyses of Citrus oil-based nanoemulsions [J].Food Research International, 2018, 109:149-158.
[32] 欧阳伟虹, 胡伟, 周旭静, 等.酵母抽提物对小黄鱼边角料腥味脱除研究 [J].食品与生物技术学报, 2020, 39(6):76-83.
OUYANG W H, HU W, ZHOU X J, et al. Removal of fishy smell of Polyactis scraps by yeast extract [J].Journal of Food Science and Biotechnology, 2020, 39(6):76-83.
[33] 茅芝娟, 张昆明, 黄永春, 等.壳聚糖W/O型乳状液的超声辅助制备及其稳定性 [J].食品科学, 2021, 42(2):8-16.
MAO Z J, ZHANG K M, HUANG Y C, et al.Ultrasonic-assisted preparation and stability evaluation of W/O emulsion containing chitosan [J].Food Science, 2021, 42(2):8-16.
[34] DAVIDOV-PARDO G, GUMUS C E, MCCLEMENTS D J.Lutein-enriched emulsion-based delivery systems:Influence of pH and temperature on physical and chemical stability [J].Food Chemistry, 2016, 196:821-827.
[35] 朱加进, 叶璐, 常成, 等.南极磷虾油W/O型微乳液制备及稳定性研究[J].中国食品学报, 2017, 17(10):80-87.
ZHU J J, YE L, CHANG C, et al. Preparation and stability study of krill oil microemulsion [J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(10):80-87.
[36] RAIKOS V.Encapsulation of vitamin E in edible orange oil-in-water emulsion beverages:Influence of heating temperature on physicochemical stability during chilled storage [J].Food Hydrocolloids, 2017, 72:155-162.
[37] 简俊丽, 毛丽娟, 刘夫国, 等.食品乳状液冻融稳定性的研究进展 [J].食品与发酵工业, 2015, 41(4):236-240.
JIAN J L, MAO L J, LIU F G, et al.Advances in freeze-thaw stability of food emulsion research [J].Food and Fermentation Industries, 2015, 41(4):236-240.