随着包装技术的不断发展,人们愈发注意到塑料包装所带来的危害。传统的塑料包装难于降解,容易造成白色污染,且塑料包装在一定条件下还容易分解出有害物质,影响人体健康。因此,开发以天然聚合物为基础的环保型包装材料以代替传统的塑料包装已经成为当下的研究热点。在众多的天然聚合物之中,玉米淀粉(corn starch, CS)资源丰富,造价低廉,经糊化后具有成膜性,且无毒无害,易于降解,具备开发可降解包装的潜力。然而,玉米淀粉单一膜在机械性能等方面有所欠缺,耐水性较差,因此,可以混入增强剂来改善玉米淀粉膜的机械性能。
卡拉胶(carrageenan, CA)主要来源于藻类,是一种由部分硫化半乳聚糖组成的线性链的水溶性聚合物,在食品胶凝、乳化和增稠等方面具有广泛应用。此外,卡拉胶还具有优良的凝胶性和高黏度特性,具有良好的成膜性能,与淀粉共混,可改善淀粉膜的机械性能[1]。SANDHU等[2]将珍珠米淀粉和卡拉胶共混制备复合膜,发现卡拉胶的加入可提高薄膜的抗拉强度,降低水蒸气透过率,对薄膜的物理学性能有所改善。然而,淀粉卡拉胶复合膜在生物活性方面有所欠缺,因此,可以引入天然活性剂来改善复合膜的抗氧化及抑菌性能,以便扩大复合膜的应用范围。
黑豆为一年生草本豆科植物,富含多种营养物质。相比其他豆类植物,黑豆具有更多的酚类化合物,而这些酚类化合物主要集中在黑豆的表皮中。YUAN等[3]以虾壳废蛋白为基材,与黑豆皮提取物共混制备复合膜,发现黑豆皮提取物可改善薄膜的抗氧化活性。WANG等[4]将黑豆皮提取物添加到壳聚糖薄膜中,发现制备出的复合膜具有pH响应作用,且改善了复合膜的抗氧化活性。然而,目前对于将黑豆皮提取物与玉米淀粉和卡拉胶共混,制备复合膜的研究还鲜有报道。
因此,本文以玉米淀粉为基材,卡拉胶为增强剂,与黑豆皮乙醇提取物(ethanol extract of black soybean coat, EBSC)共混,制备复合膜,从物化性质及生物活性2个方面探讨EBSC对CS/CA复合膜的影响,为玉米淀粉膜的生产及应用提供理论基础。
1 材料与方法
1.1 材料与试剂
黑豆、猪板油,齐齐哈尔市浏园市场;食品级卡拉胶,青岛德慧海洋生物技术有限公司;玉米淀粉,黑龙江玉凤玉米开发有限公司;牛肉膏、胰蛋白胨(生化试剂),北京奥博星生物技术有限公司;金黄色葡萄球菌(ATCC29213)、大肠杆菌(ATCC25922),齐齐哈尔大学食品与生物工程学院;其他化学试剂(分析纯),天津凯通化学试剂有限公司。
1.2 仪器与设备
2.5 L freezePrysystem型真空冷冻干燥机,美国Labconco公司;Gemini 300型扫描电子显微镜,德国Carl Zeiss公司;Spectrum-100型红外光谱仪,美国PerkinElmer公司;Ultima IV型X-射线衍射仪,日本理学株式会社;UPG-722可见分光光度计,北京优谱通用科技有限公司;TA.XT plus型质构仪,英国Stable Micro System公司;Q20型差示扫描量热仪,美国TA公司。
1.3 实验方法
1.3.1 EBSC的制备
将黑豆置于清水中浸泡24 h后,去皮。将剥好的黑豆皮放置于通风处自然晾干。取处理好的黑豆皮100 g进行粉碎,加入70%的(体积分数)乙醇200 mL,在25 ℃下浸提12 h。将浸提液在6 000 r/min 下离心10 min,取上清液备用。将沉淀物重复浸提、离心操作,合并2次离心上清液。将上清液转移到旋转蒸发器中,置于50 ℃下进行浓缩,再将浓缩液冷冻干燥得到黑豆皮乙醇提取物(得率为9.24%),贮藏于4 ℃冰箱中备用。
1.3.2 EBSC/CS/CA复合膜的制备
取一定质量的玉米淀粉,加入蒸馏水配制成质量分数为3%的玉米淀粉悬浊液,在90 ℃下糊化30 min。加入30%的卡拉胶(质量分数,卡拉胶/淀粉干基),继续在90 ℃下加热搅拌30 min。分别加入1%、3%、5%的黑豆皮提取物(质量分数,提取物/淀粉干基),继续搅拌30 min,加入25%的甘油(质量分数,甘油/淀粉干基),继续在90 ℃下加热搅拌30 min,并用热水补足蒸发掉的水分。将溶液在80 ℃下超声30 min以除去气泡,制得复合膜液。将直径为120 mm的聚乙烯环固定在铺有离型纸的玻璃板上,将25 g膜液倾倒在聚乙烯环内,在40 ℃下烘干12 h,揭膜,置于25 ℃ 相对湿度为56.8%(NaBr饱和溶液)的干燥器中,平衡72 h后测定薄膜的各项指标。
1.3.3 厚度的测定
参照GB/T 6672—2001的方法略作修改,用螺旋测微计(测量精度为0.001 mm)在薄膜上随机选取10个点测其厚度,计算平均值作为膜的厚度。在计算膜透明度、机械性能、水蒸气透过率时,均采用厚度平均值。
1.3.4 色泽的测定
采用色差计测定薄膜样品的L*值(亮度)、a*值(红/绿)和b*值(黄/蓝)。测量前,采用标准板校准(L*=103.98,a*=-5.80,b*=9.25),每种样品测量3次,结果取平均值。
1.3.5 不透明度的测定
参照SUKHIJA等[5]方法略作修改,将薄膜样品剪切成10 mm×45 mm的矩形,紧贴于空比色皿内壁,空比色皿作为参比,在600 nm处测定样品吸光度值,每种样品测量3次,结果取平均值。不透明度的计算如公式(1)所示:
不透明度![]()
(1)
式中:A600,600 nm下吸光度值;X,薄膜厚度,mm。
1.3.6 扫描电子显微镜
将复合膜样品剪裁成4 cm×6 cm的长方形,利用液氮脆断。采用Gemini 300型扫描电子显微镜进行显微扫描,扫描电压2.00 kV,电流64.0 μA。观察并拍照薄膜的表面和截面。
1.3.7 傅里叶变换红外光谱的测定
将平衡干燥后的薄膜置于ATR附件上,测试温度为25 ℃,波数4 000~650 cm-1,分辨率为4 cm-1,扫描次数为32次。
1.3.8 X射线衍射分析
采用Cu靶,石墨单色器,测试参数为:电压为45 kV、电流为20 mA,扫描范围为5°~80°(2θ),扫描速率为2 °/min。
1.3.9 力学性能的测定
薄膜的力学性能参考MU等[6]方法略作修改。将薄膜裁剪成6 cm×2 cm的矩形,测试速度2 mm/s,初始夹距20 mm。测量薄膜样品的拉伸强度(MPa)及断裂伸长率(%),每种样品测量3次,结果取平均值。卡拉胶薄膜的力学性能的计算如公式(2)、公式(3)所示:
(2)
式中:Ts,拉伸强度,MPa;Fmax,膜断裂时最大负载,N;S,膜横截面积,mm2。
断裂伸长率![]()
(3)
式中:l1,膜拉伸后长度,mm;l0,膜初始长度,20 mm。
1.3.10 水蒸气透过率的测定
参照郭开红等[7]的拟杯子法,并略作修改。将10 g无水CaCl2置于鼓风干燥箱中,在110 ℃下烘干2 h,并放置在35 mm×90 mm的称量瓶中,将制备好的薄膜样品覆盖在称量瓶口,密封,放入底部装有蒸馏水的干燥器中。每隔24 h称取称量瓶的质量,连续测量10 d。每种样品测量3次,结果取平均值。薄膜的水蒸气透过率的计算如按公式(4)所示:
水蒸气透过率![]()
(4)
式中:W,薄膜密封后称量瓶总质量,g;t,时间,d;A,薄膜透水面积,m2;X,薄膜厚度,mm;ΔP,薄膜两侧水蒸气压力差,1.583 kPa。
1.3.11 热力学性质
热稳定性分析采用差示扫描量热法,参照徐晶[8]的方法,并略作修改。称取4 mg经干燥器干燥后的薄膜样品,密封于铝坩埚中,以空铝坩埚为参比,以氮气为保护气,保护气流量为20 mL/min。升温速率为10 ℃/min,在温度20~250 ℃进行差式扫描量热分析。
1.3.12 总酚含量
复合膜的总酚含量测定采用福林酚比色法,参考王丽岩[9]的方法并略作修改。将125 mg的薄膜样品放入15 mL的蒸馏水中浸泡24 h,获得薄膜浸泡液。向50 mL锥形瓶中依次加入0.1 mL薄膜浸泡液、7 mL 蒸馏水和0.5 mL福林酚并轻轻摇晃,静置8 min后,再依次加入1.5 mL 10%(质量分数)的碳酸钠溶液和0.9 mL蒸馏水,将复合液放入暗室中避光2 h,然后用紫外分光光度计在765 nm处测定混合液的吸光度。配制一系列质量浓度在0~15 μg/mL的没食子酸(gallic acid equivalents,GAE)水溶液,并按上述步骤测定其在765 nm处的吸光度,以没食子酸水溶液的质量浓度为横坐标,以其在765 nm处的吸光度为纵坐标,绘制标准曲线,得到y=0.117x+0.017 1的方程(R2=0.999 5)。依照此方程,利用测得的复合膜浸泡液在765 nm处的吸光度计算总酚含量。样品的总酚含量表示成毫克GAE当量每克干物质(dry weight,DW),即mg GAE/g DW。每种样品测量3次,结果取平均值。
1.3.13 体外抗氧化性能的测定
将10 mg薄膜样品与甲醇DPPH溶液(0.2 mmol/L,1.5 mL)混合。将混合液放入暗室反应在室温下避光30 min,然后用紫外分光光度计在517 nm处测定混合液的吸光度,甲醇DPPH溶液作为对照[10]。每种样品测量3次,结果取平均值。自由基清除率的计算如公式(5)所示:
(5)
式中:k,自由基清除能力,%;Ac,对照组的吸光度;As,样品的吸光度。
将10 mg薄膜样品与ABTS阳离子自由基工作液混合,室温下避光6 min,用紫外分光光度计在734 nm 处测定混合液的吸光度,以醋酸缓冲溶液代替提取物样品溶液作为空白对照[11]。每种样品测量3次,结果取平均值。自由基清除率的计算如公式(5)所示。
1.3.14 油脂抗氧化性能的测定
将5 g固体猪油包裹于薄膜上,将薄膜进行热封,置于60 ℃的鼓风干燥箱中加速氧化。每隔24 h定时取样,按GB 5009.227—2016中的方法测定其过氧化值(peroxide value, POV)值,连续测定7 d。每种样品测量3次,结果取平均值。
1.3.15 抑菌性的测定
参照PELISSARI等[12]方法,并略作修改。将扩培好的大肠杆菌和金黄色葡萄球菌用无菌生理盐水稀释10倍,作为初始菌液。用取样器将薄膜样品剪裁成直径为7 mm的圆片,紫外线灭菌后,分别放入含有0.1 mL目标菌液的培养基中,置于(37±1) ℃的恒温培养箱中培养24 h。用游标卡尺测量薄膜抑菌圈的直径,根据抑菌圈的大小来判定薄膜的抑菌活性。每种样品测量3次,结果取平均值。
1.4 数据处理
实验结果用均值±标准差表示,通过软件SPSS 25 系统中的Duncan′s进行差异显著性分析,采用Origin 8.0软件进行绘图。
2 结果与分析
2.1 光学性质
天然聚合物包装材料的光学性质对消费者的可接受程度具有很大的影响。EBSC/CS/CA复合膜的光学性质如表1所示。未添加EBSC的CS/CA复合膜无色透明,而随着EBSC添加量的增加,复合膜的a*值、b*值和不透明度逐渐增大,而复合膜的L*值逐渐降低,表明复合膜的颜色逐渐加深,亮度逐渐降低。黑豆皮中富含花色苷等活性成分,这些成分使得EBSC呈现出紫红色。而当EBSC的添加量逐渐增大,含有花青素等活性成分的复合膜颜色也逐渐加深,亮度降低。
研究表明,薄膜不透明度的增大可使食品减少或免受紫外线及可见光的照射,从而抑制氧化,提高食品品质[13]。未添加EBSC的复合膜的光学性能较差,对可见光的阻隔性能较弱。当添加了EBSC后,复合膜的光学性能得到显著改善,且不透明度随着EBSC添加量的增加而逐渐增大,表明复合膜对可见光的阻隔性能不断提高。
表1 EBSC/CS/CA复合膜的光学性质
Table 1 Optical properties of the EBSC/CS/CA composite films

提取物添加量(质量分数)/%a∗b∗L∗不透明度/%图像0-1.22±0.04d-0.18±0.08d90.24±0.33a1.06±0.13d15.16±0.65c8.12±1.01c78.64±0.47b3.23±0.18c310.30±0.51b13.54±0.86b69.46±0.60c4.20±0.13b515.24±0.59a20.00±0.91a63.20±1.08d5.07±0.22a
注:不同字母表示差异显著(P<0.05)(下同)
2.2 微观结构分析
利用扫描电子显微镜可进一步观察探究膜的微观结构以及与添加物之间的相互作用影响。EBSC/CS/CA复合膜表面和截面的扫描电镜如图1所示。CS/CA复合膜的表面和截面结构较为光滑,这是由于淀粉分子之间存在相互作用,所形成的薄膜结构较为致密,且玉米淀粉与卡拉胶之间具有较好的相容性。当添加了EBSC后,薄膜的表面开始变得粗糙,出现不溶性颗粒,且随着添加量的增加,粗糙程度逐渐增加;与表面结构类似,薄膜的截面结构也随着EBSC的出现而逐渐变得粗糙,表明EBSC与玉米淀粉及卡拉胶之间发生了相互作用,使得薄膜变得粗糙。这种现象的出现可能归因于花青素在复合膜中的聚集[14]。

a~d依次为0%、1%、3%、5%(质量分数)EBSC/CS/CA复合膜表面;e~h依次为0%、1%、3%、5%(质量分数)EBSC/CS/CA复合膜截面
图1 EBSC/CS/CA复合膜的扫描电子显微镜图像
Fig.1 SEM images of the EBSC/CS/CA composite films
2.3 傅里叶变换红外光谱分析
红外光谱是指分子在红外线照射下选择性地吸收某些频率后所形成的吸收谱带。使用傅里叶红外光谱进一步分析了EBSC与CS/CA复合膜之间的相互作用。图2为EBSC/CS/CA复合膜在4 000~520 cm-1内的红外光谱图。对于CS/CA复合膜,3 304 cm-1处出现的峰为O—H的振动伸缩峰,在2 926 cm-1处出现的肩峰为C—H的伸缩振动峰;在1 645 cm-1附近有因淀粉无定形区域中吸附水的弯曲振动而引起的吸收峰出现。薄膜在1 150和1 104 cm-1处均出现吸收峰,此为淀粉C—O—C吡喃糖环骨架振动和C—C键吸收峰[15-16]。当添加EBSC后,复合膜的红外光谱曲线并没有发生较大的变化,这可能和EBSC的添加量有关。红外光谱分析可以鉴别体系的氢键作用大小,其吸收峰的波数越大,说明氢键相互作用越弱[17]。而O—H的振动伸缩峰略向高波段移动,这可能是由于EBSC的加入在一定程度上抑制了淀粉分子间的重结晶现象,使得氢键的作用力变弱。
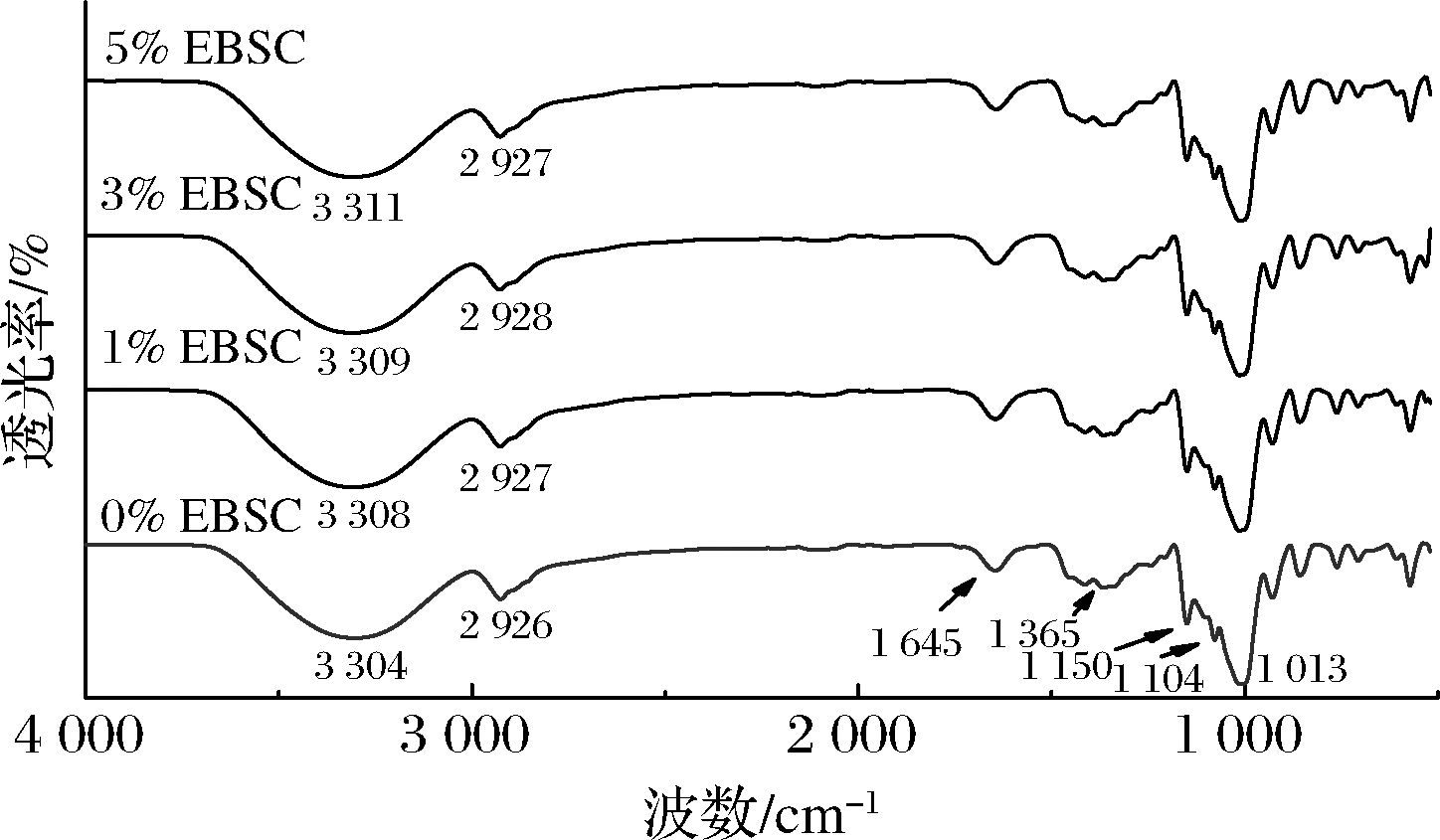
图2 EBSC/CS/CA复合膜的傅里叶变换红外光谱图
Fig.2 FTIR spectra of the EBSC/CS/CA composite films
2.4 X射线衍射分析
利用X-射线衍射可分析聚合物的结晶度。EBSC/CS/CA复合膜的X-射线衍射图谱如图3所示。其中,CS/CA复合膜在10.5°、17.7°、19.9°以及22.4°处出现衍射峰。淀粉复合膜在贮藏过程中,直链淀粉和支链淀粉会发生重结晶现象,而17.7°和19.9°的衍射峰和重结晶现象有关[18]。当加入了EBSC后,复合膜在10.5°处的衍射峰消失;随着EBSC 添加量的增加,17.7°和22.4°处的衍射峰逐渐减小直至消失;当EBSC的添加量达到5%时,复合膜只在19.9°处显示出了1个尖峰。这一结果表明EBSC的加入影响了复合膜的晶体结构,这归因于EBSC中含有的多酚类物质与淀粉分子之间形成了氢键,影响了淀粉分子结构的有序性,抑制了重结晶的发生。淀粉的重结晶现象会使得淀粉制品在贮藏过程中逐渐变硬、发脆[19],而EBSC的加入在一定程度上抑制了淀粉重结晶的发生,这对复合膜在贮藏过程中保持良好的机械性能具有积极作用。这与KOWALCZYK等[20]的研究结果相似。
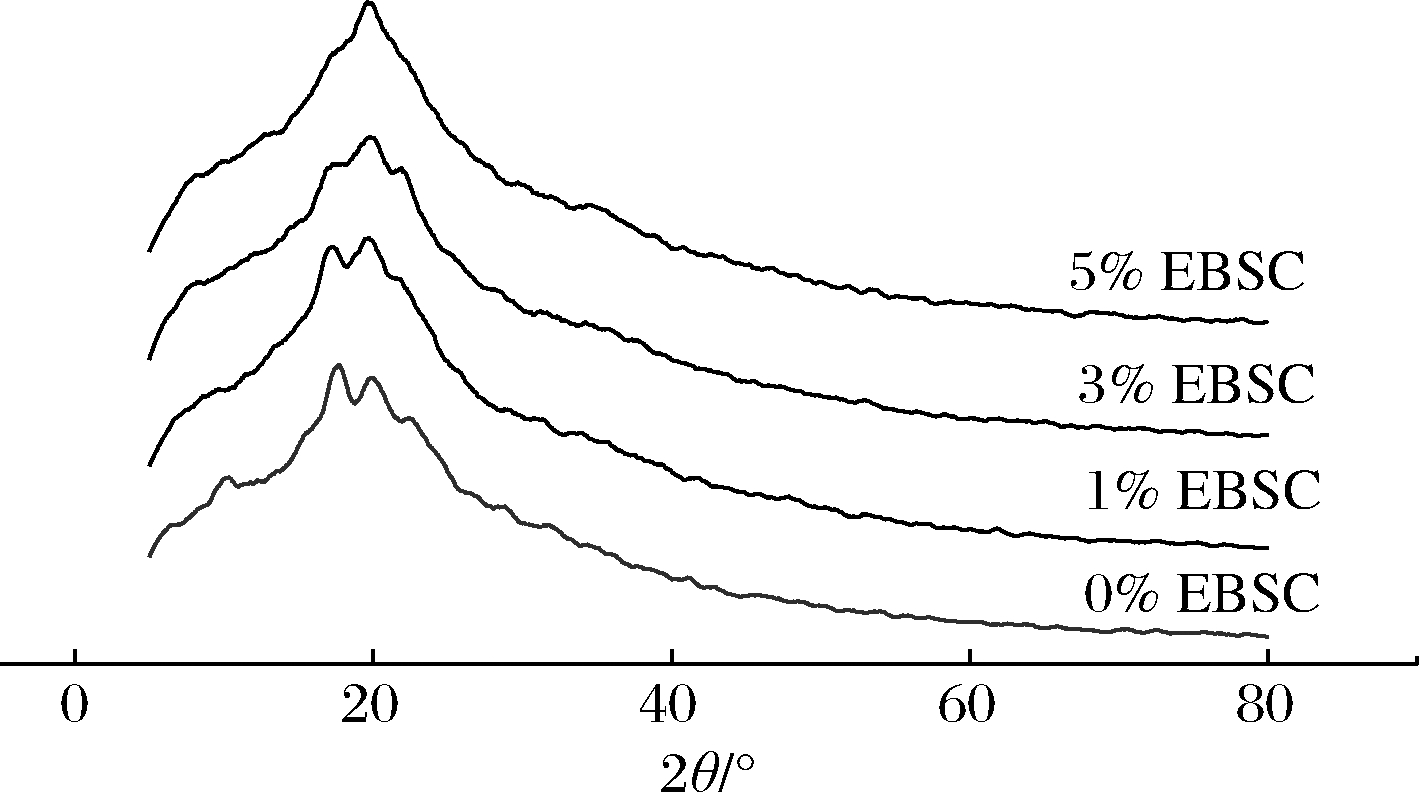
图3 EBSC/CS/CA复合膜的X-射线衍射光谱图
Fig.3 XRD spectra of the EBSC/CS/CA composite films
2.5 力学性能
机械性能是复合膜的一个重要属性,通常由抗拉强度和断裂伸长率2个指标来评定,其反映了复合膜的强度和柔韧性。在包装、运输及贮藏过程中,机械性能的优劣对于复合膜的完整性具有重要影响。EBSC/CS/CA复合膜的机械性能如图4所示。当添加了EBSC后,复合膜的抗拉强度呈现出下降趋势;当EBSC添加量为5%时,抗拉强度从原有的9.07下降为4.59 MPa。这表明EBSC的加入影响了原有淀粉的网络结构。并且在前文中所提到的,在SEM的观察中发现,随着EBSC添加量的增加,复合膜表面会有少量的不溶性颗粒出现,从而影响了复合膜的致密性,使得抗拉强度下降。而当提取物添加量为1%和3%时,复合膜的抗拉强度变化并不显著,这可能和EBSC的添加量有关。而复合膜的断裂伸长率随着EBSC添加量的增加而逐渐增加,这可能是由于黑豆皮中所富含的花色苷和槲皮素等化合物具有一定的增塑作用,使得复合膜的断裂伸长率在一定的范围内有所提高。

图4 EBSC/CS/CA复合膜的力学性能
Fig.4 Mechanical properties of the EBSC/CS/CA composite films
2.6 水蒸气透过率
EBSC/CS/CA复合膜的水蒸气透过率如图5所示。当EBSC添加量为1%,复合膜的水蒸气透过率最低,为0.697 g·mm/(m2·d·kPa);当添加量为3%时,复合膜的水蒸气透过率略有上升,但仍小于CS/CA复合膜;当添加量为5%时,复合膜的水蒸气透过率继续上升,达到1.198 g·mm/(m2·d·kPa),结果大于CS/CA复合膜。这可能由于EBSC的强吸水性使得复合膜更容易吸附水分子,但EBSC的强吸水性不容易释放水分子,从而导致水蒸气透过率降低。然而,EBSC的加入也影响了复合膜结构的致密性,这又使得复合膜的水蒸气透过率逐渐上升,当EBSC的添加量达到5%时,复合膜的水蒸气透过率大于CS/CA复合膜。而OTHMAN等[21]的研究表明,添加了百里香酚的纳米纤维素/玉米淀粉复合膜的水蒸气透过率显著增加,这种差异可能由于提取物的来源不同。
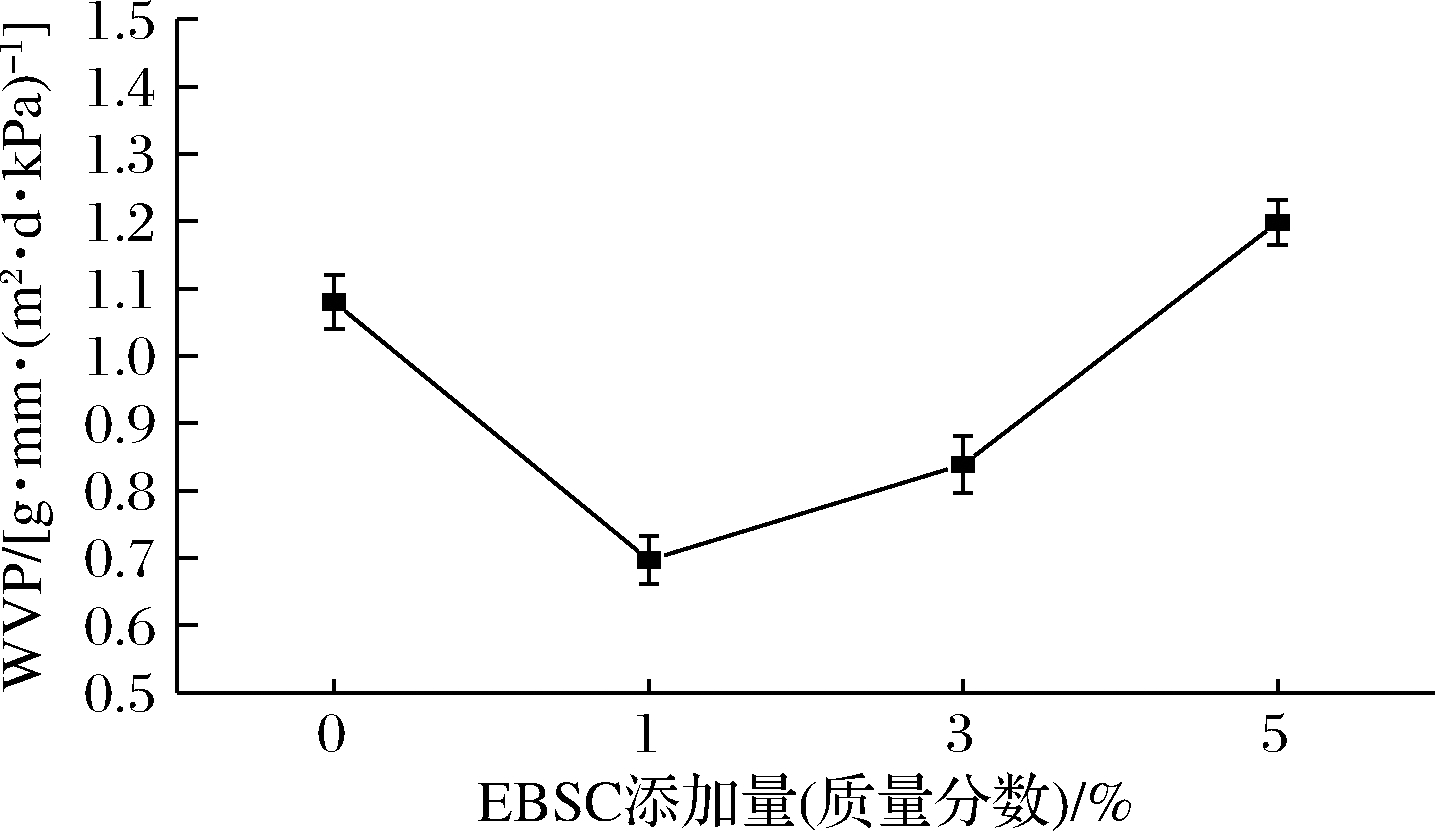
图5 EBSC/CS/CA复合膜的水蒸气透过率
Fig.5 Water vapour permeability of the EBSC/CS/CA composite films
2.7 热力学性质
差示扫描量热法是通过测量物质与参比物之间的能量差随温度的变化关系来研究聚合物分子间的相互作用的1种技术。而复合膜的玻璃化转变温度能反映膜组分中分子运动的情况,其与复合膜组分分子结构有密切关系[8]。当聚合物分子运动受到束缚时,聚合物玻璃化转变温度上升,反之下降。并且,在1个二元复合膜体系中,差示扫描量热曲线若只出现1个峰,且位于2个主体之间,则表明两者之间具有良好的相容性[22]。
EBSC/CS/CA复合膜的差示扫描量热如图6所示。复合膜在20~250 ℃均出现1个峰,表明复合膜具有良好的相容性。添加了EBSC的复合膜的玻璃化转变温度低于CS/CA复合膜,且随着EBSC添加量的增加,复合膜的玻璃化转变温度逐渐降低。添加了EBSC后,复合膜的分子链结构受到了影响,复合膜的玻璃化转变温度降低,表明复合膜中分子链的柔韧性变强。这一结果与断裂伸长率所显示出的结论一致。
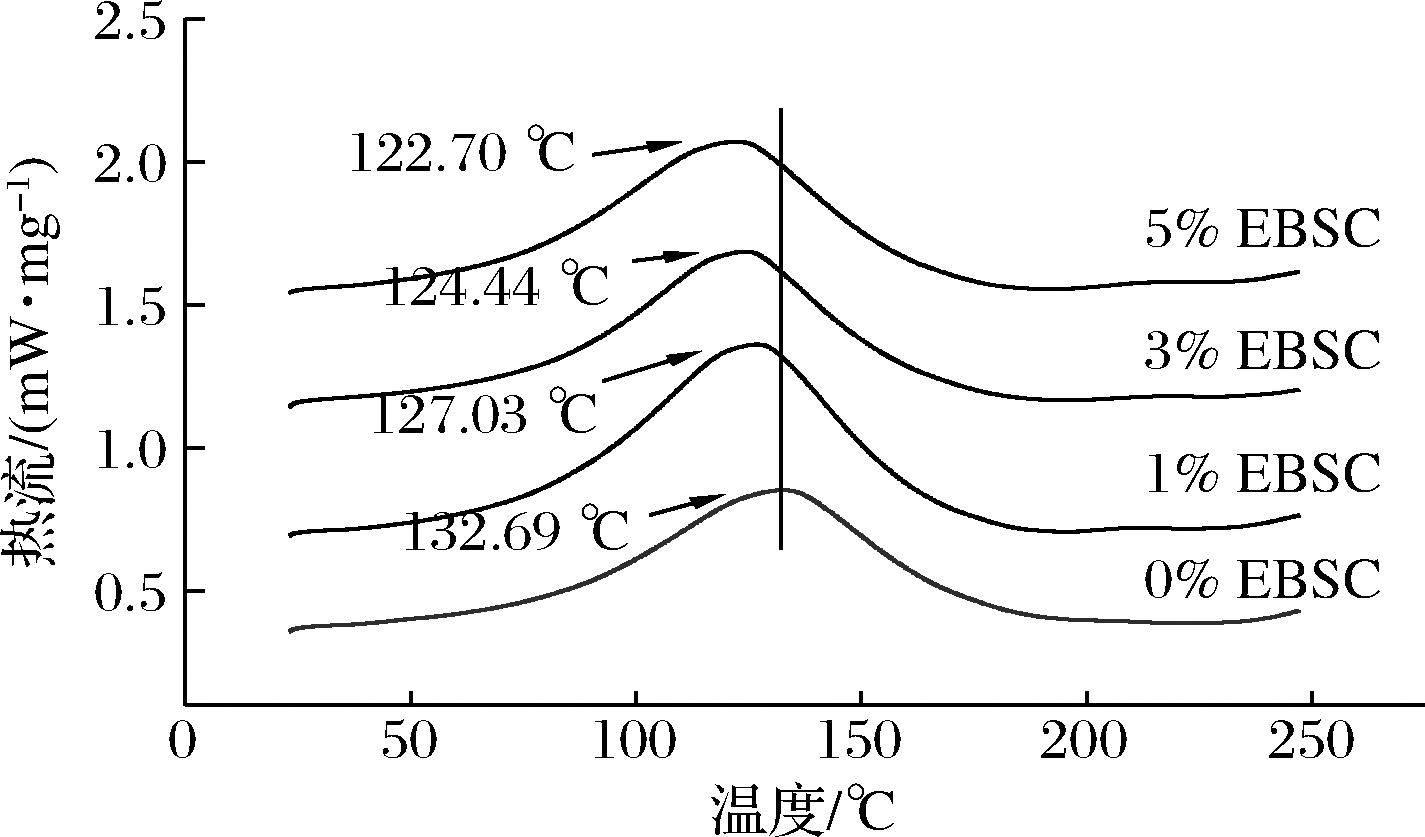
图6 EBSC/CS/CA复合膜的热力学性质
Fig.6 Thermodynamic properties of the EBSC/CS/CA composite films
2.8 总酚含量
黑豆皮中富含花色苷等酚类化合物,而多酚化合物的含量和抗氧化活性密切相关,因此,可通过总酚含量的测定来判断物质的抗氧化性能,而福林酚试剂在碱性条件下可被酚类化合物还原呈现出蓝色,因此福林酚比色法是测定总酚含量最常见的方法[23]。EBSC/CS/CA复合膜的总酚含量如图7所示。当添加了EBSC后,复合膜的总酚含量显著提高,当添加量为5%时,复合膜的总酚含量达到8.09 mg GAE/g DW。由此可见黑豆皮中富含酚类化合物,使得复合膜的总酚含量显著提高,从而提高了复合膜的生物活性。
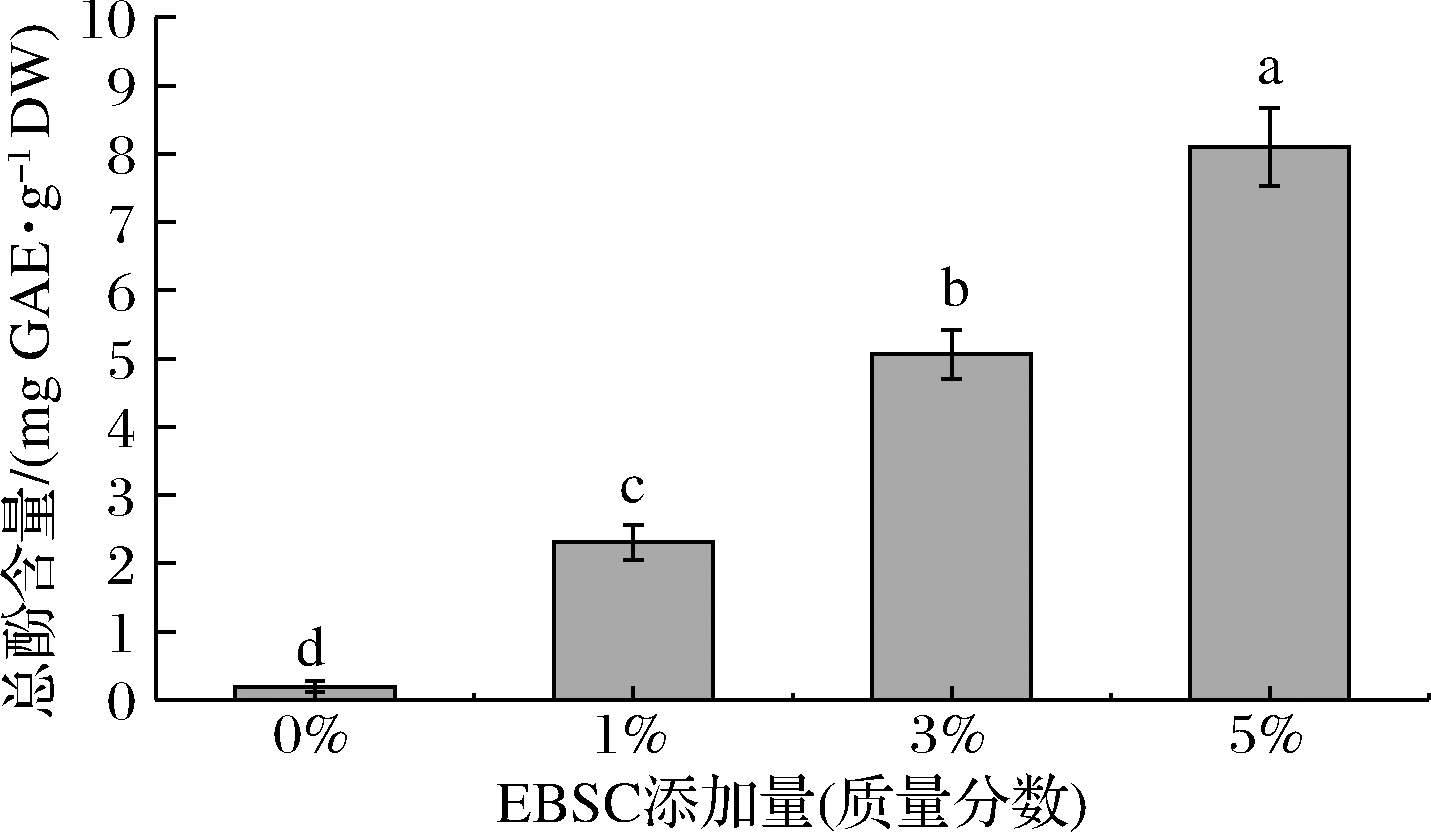
图7 EBSC/CS/CA复合膜的总酚含量
Fig.7 Total phenol content of the EBSC/CS/CA composite films
2.9 体外抗氧化性能分析
EBSC/CS/CA复合膜的自由基清除能力如图8所示。加入了EBSC后,复合膜的自由基清除能力显著提高,但EBSC的添加量为1%和3%的复合膜DPPH自由基清除率差异并不显著,而复合膜的ABTS阳离子自由基清除率随着EBSC添加量的增加而逐渐增加。当EBSC添加量达到5%时,复合膜的DPPH自由基清除率达到30.50%,而ABTS阳离子自由基清除率达到51.61%。EBSC中的多酚以花青素为主,其多羟基结构使花青素具有很强的供氢能力[24]。而EBSC中所富含的花青素可提供酚羟基来捕获自由基,从而弥补了CS/CA复合膜在这方面的缺陷,提高了薄膜的生物活性。因此,将EBSC添加到复合膜中制备活性食品包装膜可保护食品免受氧化损伤,延长食品货架期。
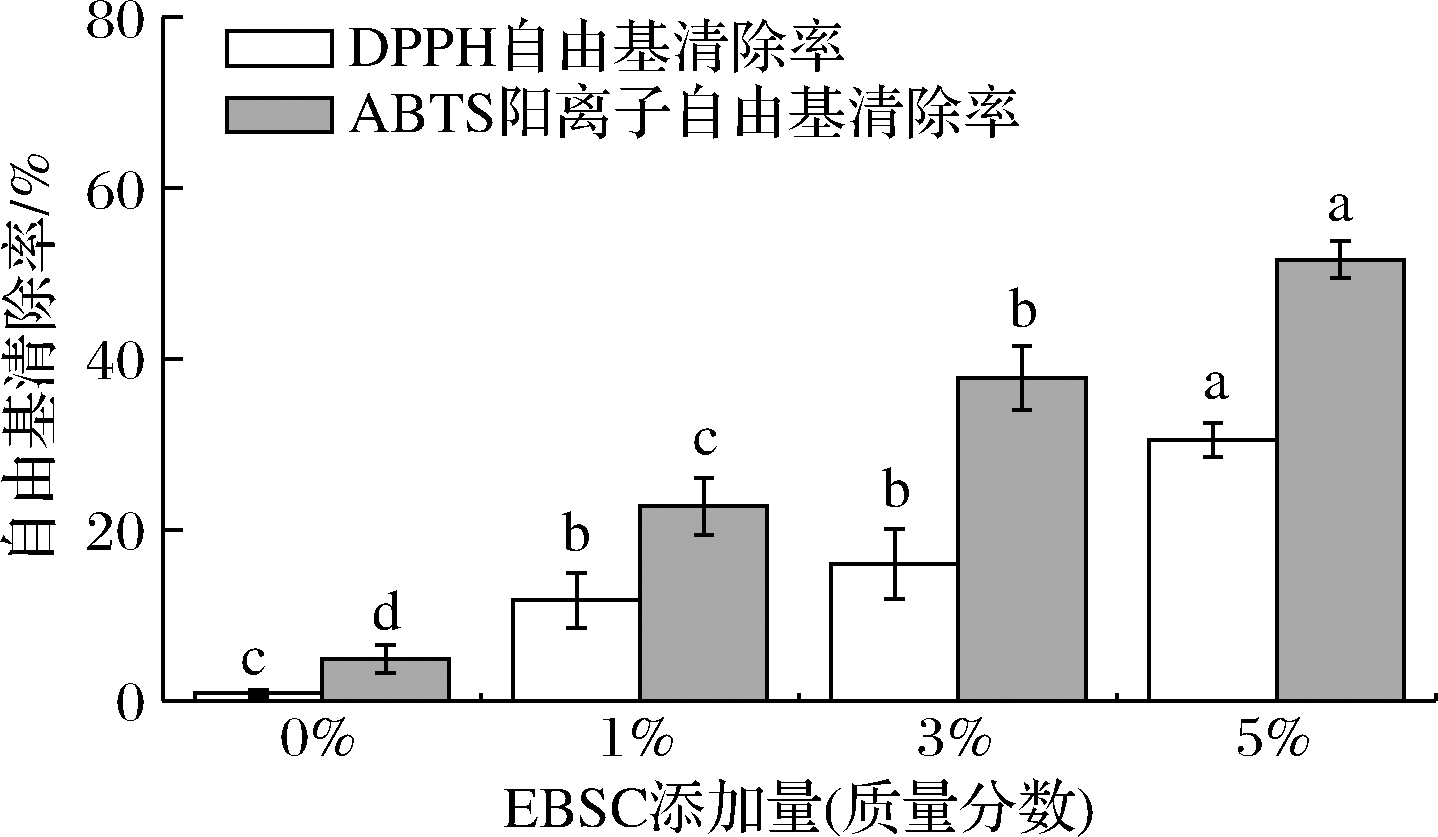
图8 EBSC/CS/CA复合膜的体外抗氧化性能
Fig.8 Antioxidant properties in vitro of the EBSC/CS/CA composite films
2.10 油脂抗氧化分析
EBSC/CS/CA复合膜的抗油脂氧化性能如图9所示。未经包裹的猪油在7 d内的氧化成度最为明显,在第7天时,POV值达到2.61 g/100g。经复合膜包裹后,猪油样品在7 d内的氧化程度明显降低。其中,未添加EBSC的复合膜所包裹的猪油样品在第7天时的POV值达到0.608 g/100g,高于添加了EBSC的复合膜;而随着EBSC添加量的增加,猪油的氧化程度逐渐得到抑制,在第7天时,含有5% EBSC的复合膜所包裹的猪油的POV值最低,为0.306 g/100g。一方面复合膜对于氧气起到了阻隔效果,降低了样品与氧气之间的接触,另一方面,黑豆皮中所富含的花色苷可释放出氢质子,清除链引发阶段产生的自由基,达到抑制油脂氧化的效果。由此可见,EBSC的加入提高了复合膜抑制油脂氧化的能力,起到了一定的协同效果。
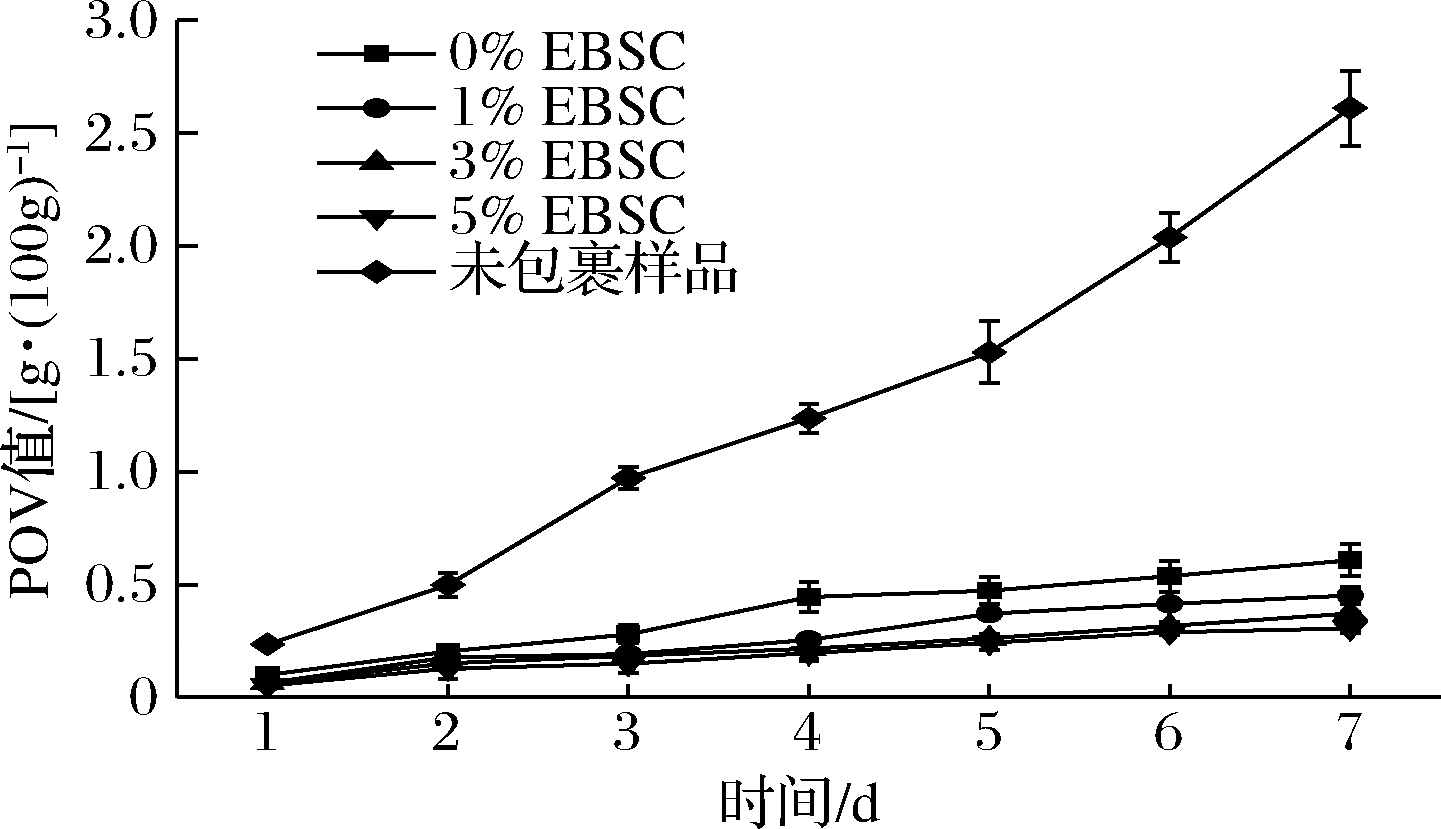
图9 EBSC/CS/CA复合膜的油脂抗氧化性能
Fig.9 Antioxidant Properties in axunge of the EBSC/CS/CA composite films
2.11 抑菌性分析
食源性病原体严重影响着食品品质安全和人体健康,因此,活性包装薄膜应具备抑菌活性来保证食品不被微生物侵害。EBSC/CS/CA复合膜对大肠杆菌和金黄葡萄球菌的抑菌圈直径如表2所示。CS/CA复合膜对大肠杆菌和金黄葡萄球菌几乎不显示抑制作用,当添加了EBSC后,复合膜的抑菌圈直径显著提高,并且随着EBSC添加量的增加,抑菌圈的直径逐渐增大,表明复合膜的抑菌活性得到了明显改善。而复合膜对金黄葡萄球菌的抑菌圈直径大于大肠杆菌,表明复合膜对革兰氏阳性菌的抑菌效果优于革兰氏阴性菌。这是由于2种受试菌的细胞结构不同,革兰氏阳性菌的细胞壁结构更为简单,而革兰氏阴性菌的细胞壁除了肽聚糖和磷壁酸以外还具有1层脂多糖,因此革兰氏阳性菌更容易受到抑菌剂的抑制作用。这与卢俊宇等[25]的研究结果一致。研究表明,EBSC中酚类化合物存在的不仅可以增加细胞膜的通透性,还可干扰微生物遗传物质的合成,从而抑制微生物的生长改善CS/CA复合膜的抑菌性能[26]。
表2 EBSC/CS/CA复合膜对微生物的抑菌圈直径
Table 2 Diameter of bacteriostasis circle of the EBSC/CS/CA composite films
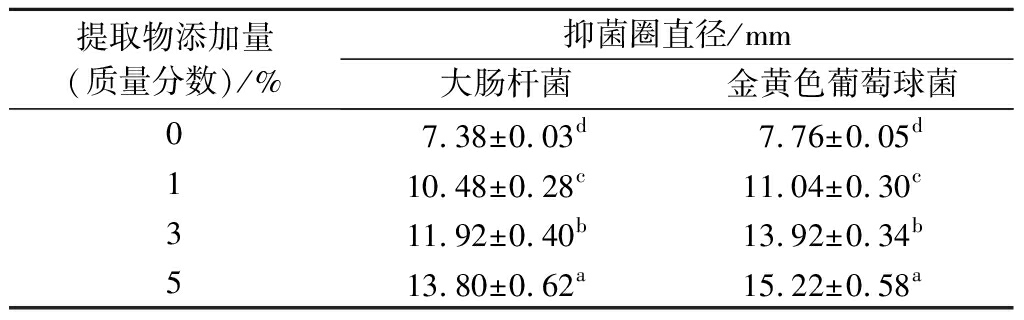
提取物添加量(质量分数)/%抑菌圈直径/mm大肠杆菌金黄色葡萄球菌07.38±0.03d7.76±0.05d110.48±0.28c11.04±0.30c311.92±0.40b13.92±0.34b513.80±0.62a15.22±0.58a
3 结论
本文探讨了EBSC作为天然生物活性剂混入玉米淀粉/卡拉胶复合膜,对其物化性质及生物活性的影响。研究表明,EBSC的加入使得复合膜的颜色加深,不透明度增大;扫描电子显微镜显示,EBSC的加入使得复合膜的表面及截面变得粗糙;红外光谱和X-射线衍射结果表明,EBSC的加入可在一定程度上抑制淀粉的重结晶现象;随着EBSC添加量的增加,复合膜的抗拉强度逐渐减小,断裂伸长率逐渐增大,并影响了复合膜的水蒸气透过率;差示扫描量热法结果显示,EBSC的加入降低了复合膜的玻璃化转变温度;生物活性方面,EBSC的加入提高了复合膜的抗氧化性能及抑菌性能,并对猪油的氧化起到了抑制作用。综合来看,当EBSC添加量为5%时,虽然抗拉强度较弱,但断裂伸长率较高,此时的复合膜具有较好的柔韧性,并且在生物活性方面表现较好。因此,EBSC的最佳添加量为5%,所制备的复合膜在食品包装领域具有潜在的应用价值。
[1] HAMDAN M A, RAMLI N A, OTHMAN N A, et al.Characterization and property investigation of microcrystalline cellulose (MCC) and carboxymethyl cellulose (CMC) filler on the carrageenan-based biocomposite film[J].Materials Today:Proceedings, 2021, 42:56-62.
[2] SANDHU K S, SHARMA L, KAUR M, et al.Physical, structural and thermal properties of composite edible films prepared from pearl millet starch and carrageenan gum:Process optimization using response surface methodology[J].International Journal of Biological Macromolecules, 2020, 143:704-713.
[3] YUAN G Q, JIA Y N, PAN Y X, et al.Preparation and characterization of shrimp shell waste protein-based films modified with oolong tea, corn silk and black soybean seed coat extracts[J].Polymer Testing, 2020, 81:106235.
[4] WANG X C, YONG H M, GAO L, et al.Preparation and characterization of antioxidant and pH-sensitive films based on chitosan and black soybean seed coat extract[J].Food Hydrocolloids, 2019, 89:56-66.
[5] SUKHIJA S, SINGH S, RIAR C S.Analyzing the effect of whey protein concentrate and Psyllium husk on various characteristics of biodegradable film from Lotus(Nelumbo nucifera) rhizome starch[J].Food Hydrocolloids, 2016, 60:128-137.
[6] MU C D, GUO J M, LI X Y, et al.Preparation and properties of dialdehyde carboxymethyl cellulose crosslinked gelatin edible films[J].Food Hydrocolloids, 2012, 27(1):22-29.
[7] 郭开红, 张蕾蕾, 吴晓翠, 等.鲢鱼皮明胶-海藻酸钠复合膜的制备与性能[J].食品科学, 2018, 39(7):243-248.
GUO K H, ZHANG L L, WU X C, et al.Preparation and properties of silver carp skin gelatin-sodium alginate composite films[J].Food Science, 2018, 39(7):243-248.
[8] 徐晶. 多酚改性胶原纤维-淀粉复合膜的制备及性能研究[D].福州:福建农林大学, 2019.
XU J.Preparation and properties of collagen fiber-starch composite films incorporated with polyphenol[D].Fuzhou:Fujian Agriculture and Forestry University, 2019.
[9] 王丽岩. 壳聚糖基活性包装膜的性能及其在食品贮藏中应用的研究[D].长春:吉林大学, 2013.
WANG L Y.Studies on performance of chitosan based activity packaging films and applications in food storage[D].Changchun:Jilin University, 2013.
[10] MAR AM ADILAH Z, NUE HANANI Z R.Storage stability of soy protein isolate films incorporated with mango kernel extract at different temperature[J].Food Hydrocolloids, 2019, 87:541-549.
[11] 王存堂, 高增明, 姜辰昊, 等.黄色洋葱皮不同溶剂多酚提取物的总酚、总黄酮含量及抗氧化活性[J].食品工业科技, 2019, 40(20):325-328;339.
WANG C T, GAO Z M, JIANG C H, et al.Content of total phenols, flavonoids and its antioxidant activities of various solvent polyphenol extracts from yellow onion peel[J].Science and Technology of Food Industry, 2019, 40(20):325-328;339.
[12] PELISSARI F M, GROSSMANN M V E, YAMASHITA F, et al.Antimicrobial, mechanical, and barrier properties of cassava starch-chitosan films incorporated with oregano essential oil[J].Journal of Agricultural and Food Chemistry, 2009, 57(16):7 499-7 504.
[13] YANG N, SUN Z X, FENG L S, et al.Plastic film mulching for water-efficient agricultural applications and degradable films materials development research[J].Materials and Manufacturing Processes, 2015, 30(2):143-154.
[14] QIN Y, LIU Y P, YUAN L M, et al.Preparation and characterization of antioxidant, antimicrobial and pH-sensitive films based on chitosan, silver nanoparticles and purple corn extract[J].Food Hydrocolloids,2019, 96:102-111.
[15] SPIRIDON I, TEAC C A, BOD
C A, BOD RL
RL U R, et al.Behavior of cellulose reinforced cross-linked starch composite films made with tartaric acid modified starch microparticles[J].Journal of Polymers and the Environment, 2013, 21(2):431-440.
U R, et al.Behavior of cellulose reinforced cross-linked starch composite films made with tartaric acid modified starch microparticles[J].Journal of Polymers and the Environment, 2013, 21(2):431-440.
[16] WANG K, WANG W H, YE R, et al.Mechanical properties and solubility in water of corn starch-collagen composite films:Effect of starch type and concentrations[J].Food Chemistry, 2017, 216:209-216.
[17] PAWLAK A, MUCHA M.Thermogravimetric and FTIR studies of chitosan blends[J].Thermochimica Acta, 2003, 396(1-2):153-166.
[18] MEDINA-JARAMILLO C, BERNAL C, FAMá L.Influence of green tea and basil extracts on cassava starch based films as assessed by thermal degradation, crystalline structure, and mechanical properties[J].Starch-Stärke, 2020, 72(3-4):1900155.
[19] 冯健, 刘文秀, 林亚玲, 等.淀粉抗回生的研究进展[J].食品科学, 2011, 32(9):335-339.
FENG J, LIU W X, LIN Y L, et al.Advance and application prospect in starch anti-retrogradation[J].Food Science, 2011, 32(9):335-339.
[20] KOWALCZYK D, SZYMANOWSKA U, SKRZYPEK T, et al.Corn starch and methylcellulose edible films incorporated with fireweed (Chamaenerion angustifolium L.) extract:Comparison of physicochemical and antioxidant properties[J].International Journal of Biological Macromolecules, 2021, 190:969-977.
[21] OTHMAN S H, NORDIN N, AZMAN N A A, et al.Effects of nanocellulose fiber and thymol on mechanical, thermal, and barrier properties of corn starch films[J].International Journal of Biological Macromolecules, 2021, 183:1 352-1 361.
[22] 曹亚飞, 凌健斌, 黄强.明胶/淀粉可食性复合膜研究进展[J].粮食与饲料工业, 2015,(1):20-22;27.
CAO Y F, LING J B, HUANG Q.Edible composite films based on gelatin and starch[J].Cereal & Feed Industry, 2015,(1):20-22;27.
[23] PAN Y M, WANG K, HUANG S Q, et al.Antioxidant activity of microwave-assisted extract of longan (Dimocarpus Longan Lour.) peel[J].Food Chemistry, 2008, 106(3):1 264-1 270.
[24] WANG C, XIE Y L.Interaction of protein isolate with anthocyanin extracted from black soybean and its effect on the anthocyanin stability[J].Journal of Food Science, 2019, 84(11):3 140-3 146.
[25] 卢俊宇, 朱芮, 吴贺君, 等.茶多酚对可食性马铃薯淀粉/海藻酸钠复合膜性能影响及表征[J].核农学报, 2020, 34(10):2 226-2 234.
LU J Y, ZHU R, WU H J, et al.Effect of tea polyphenols on the properties of edible potato starch/sodium alginate composite films[J].Journal of Nuclear Agricultural Sciences, 2020, 34(10):2 226-2 234.
[26] ZHANG X, LIU J, YONG H M, et al.Development of antioxidant and antimicrobial packaging films based on chitosan and mangosteen (Garcinia mangostana L.) rind powde[J].International Journal of Biological Macromolecules, 2020, 145:1 129-1 139.