海带,又名昆布、江白菜,福建、山东、辽宁等沿海省份是我国海带的主要产地,我国海带产量居全球首位[1]。海带富含膳食纤维(dietary fiber, DF)[2]。DF虽然本身没有营养价值,但其表现出极强的水合性质和吸附性质,具有促进肠道收缩蠕动、降低餐后血糖值、调节血脂以及降低心血管和胃肠道疾病发病机率等功效[3]。研究发现,通过适当的改性手段处理DF,可改变聚合物的分子结构、形态与含量等[4],有助于提高DF功能,是当前食品工业研究热点之一[5]。
超高压技术(ultra-high pressure, UHP)是近年来出现的食品冷杀菌新技术,是指用液体或气体作为介质,对软包装食品等物料物理加压到100~1 000 MPa的压力处理技术。目前UHP在食品的应用主要集中在食品杀菌[6]。鉴于UHP可对生物大分子立体结构的非共价键(氢键、离子键和疏水键)产生影响,UHP在食品改性方面的作用也逐渐受到重视。研究发现,改性后的大豆DF有更致密、均匀的结构[7],小麦DF经UHP处理后持水率和膨胀率都有较大的提高[8]。由于不同来源DF的化学组成和结构特性不同,UHP对其改性后的理化性质也值得进一步研究,而目前有关UHP在海带类原料的改性应用还未见报道。
本文采用UHP处理海带,研究高压前后以及不同压力、时间对海带的持水力(water holding capacity, WHC)、持油力(oil holding capacity,OHC)、葡萄糖吸附能力(glucose adsorption capacity,GAC)和胆固醇吸附能力(cholesterol adsorption capacity,CAC)的影响,并初步从微观结构和DF含量两方面对其机理进行探讨,从而为UHP工艺在海带产品的开发以及功能性食品的生产研究方面提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜海带,本地菜市场购买;碱性蛋白酶,上海阿拉丁生化科技股份有限公司;淀粉酶,西格玛奥德里奇(上海)贸易有限公司;其他试剂均为分析纯。
1.2 仪器与设备
SCIENTZ-18 N 冷冻干燥机,宁波生物科技股份有限公司;CQC2L-600型全液相超高压食品灭菌机,北京速原中天科技股份有限公司;EVO-MA15扫描电子显微镜,德国ZEISS公司;ST 16R高速冷冻离心机,广州源起生物科技有限公司;HH-2恒温水浴锅,金坛市宏华仪器厂;LE104E/02电子天平,梅特勒-托利多(上海)仪器有限公司。
1.3 实验方法
1.3.1 海带预处理
新鲜片状海带(slice-kelp, S-K),清洗干净,切成3 cm×8 cm长方形,等量放入塑料袋,真空密封包装;另取新鲜海带冷冻干燥,再打粉得到海带粉末(powder-kelp, P-K)样品,等量放入塑料袋,真空密封包装。
1.3.2 UHP处理
将密封的S-K和P-K样品放入UHP内腔,分别在300、450、600 MPa下处理5、10 min,泄压后取出置干燥器中保存待测定。
1.3.3 WHC 测定方法
参考CHAU等[9]的方法适当改进。
精确称取0.2 g S-K、P-K样品置于离心管,加入10 mL纯水,室温下振荡均匀后静置过夜,取S-K置于滤纸上沥干。P-K样品于10 000 r/min条件下离心10 min,小心清除上清液,残渣置于滤纸上沥干。沥干后样品称重,WHC计算如公式(1)所示:
![]()
(1)
1.3.4 OHC测定方法
按照SANGNARK等[10]的方法进行改进。
精确称取0.2 g S-K、P-K样品置于离心管,加入5 g 玉米油,并将其混合均匀,在常温下静置过夜。取P-K样品于10 000 r/min条件下离心10 min,小心除去上油层,残渣置于滤纸上沥干。取S-K置于滤纸上,吸干残渣中的油,然后称重,OHC计算如公式(2)所示:
(2)
1.3.5 GAC测定
按照NSOR-ATINDANA等[11]的方法进行改进。
分别称取0.2 g样品与20 mL 500 mmol/L葡萄糖溶液,混匀,常温下静置过夜,10 000 r/min条件下离心10 min取上清液,按GB 5009.7—2016《食品中还原糖的测定》方法测定葡萄糖含量。CAC计算如公式(3)所示:
(3)
式中:m0为样品质量,g;m1为吸糖前溶液的葡萄糖含量,g;m2为吸糖后溶液的葡萄糖含量,g。
1.3.6 CAC测定
1.3.6.1 胆固醇标准曲线
分别取0.1、0.2、0.3、0.5、0.6 mL胆固醇乙酸标准溶液(3 mg/mL,45 mg胆固醇标准品溶于15 mL乙酸)于试管中,加入乙酸至总体积为1 mL。摇匀后加入3 mL 邻苯二甲醛溶液(10 mg邻苯二甲酸溶于100 mL乙酸)和2 mL硫酸(98%,体积分数),在室温下静置 10 min 后,于550 nm处测定吸光值[12]。建立胆固醇质量浓度(X,mg/mL) 与吸光值(Y) 之间线性方程:y = 0.175 7x + 0.137 3,R2=0.990 9。
1.3.6.2 CAC测定
将新鲜蛋黄与水按4∶1的质量比混合制成蛋黄液。分别取0.3 g海带样品于离心管中,加入15 mL蛋黄乳液,摇晃混匀并调节pH至7.0,37 ℃恒温水浴振荡2 h,4 000×g条件下离心4 min,取上清液,采用邻苯二甲醛法在550 nm下测定吸光度,CAC计算如公式(4)所示[13]:
(4)
式中:M1,吸附前蛋黄乳液的胆固醇质量,mg;M2,吸附后上清液中胆固醇质量,mg;MK,海带样品的质量,g。
1.3.7 膳食纤维含量测定方法
采用GB 5009.88—2014《食品中膳食纤维的测定》 6.3.1测定总DF含量;采用GB 5009.88—2014 《食品中膳食纤维的测定》 6.3.2测定不溶性膳食纤维(insoluble dietary fiber, IDF)含量;采用GB 5009.88—2014 《食品中膳食纤维的测定》6.3.3测定可溶性膳食纤维(soluble dietary fiber, SDF)含量。
1.3.8 扫描电子显微镜观察
将干燥的样品散落在金属样品平台上并用双面胶带固定,通过阴极喷涂系统涂覆金属离子层(约30 nm厚)。在高真空条件(10~40 Pa)下以5 kV的加速电压使用扫描电镜观察。
1.4 数据统计分析
所有实验均进行3次平行,结果用平均数±标准差表示。采用Excel软件进行数据统计,并用Minitab 19软件进行ANOVA方差分析(P<0.05)。
2 结果与分析
2.1 UHP处理对海带吸附性质的影响
2.1.1 UHP对WHC的影响
未处理的海带WHC为22~26 g/g,经UHP处理后S-K的WHC未见显著差别,而P-K显著提高为原来的1.61~2.31倍(P<0.05)(图1),最高值达到(63.40±1.29)g/g,说明UHP能显著提高海带吸水性。经UHP改性后的DF,如小麦麸皮、梨渣和沙果渣, 其WHC分别为未处理原料的1.28[14]、1.24[15]和1.17倍[16]。样品WHC的提高可能与UHP处理后分子结构改变带来的亲水基团的裸露和组织疏松带来的组织滞留水分的能力增强有关[8]。同时,P-K的WHC随着UHP压力的增加也有显著提高,而只有在300 MPa 时处理时间会造成WHC显著差异(P<0.05),这一结论与朱丹等[16]处理小麦麸皮的结果相似。
虽然未处理的S-K和P-K在WHC没有显著差异,但经UHP处理后,P-K的WHC得到显著提高,说明原料的物理性状会对吸附性产生影响。经打粉后P-K的分散性、比表面积增加,更容易受到高压的影响,而S-K自身结构排列致密,UHP处理对其比表面积和孔隙率影响不大,亲水基团难以暴露[16],因此,UHP未对S-K的WHC产生影响。
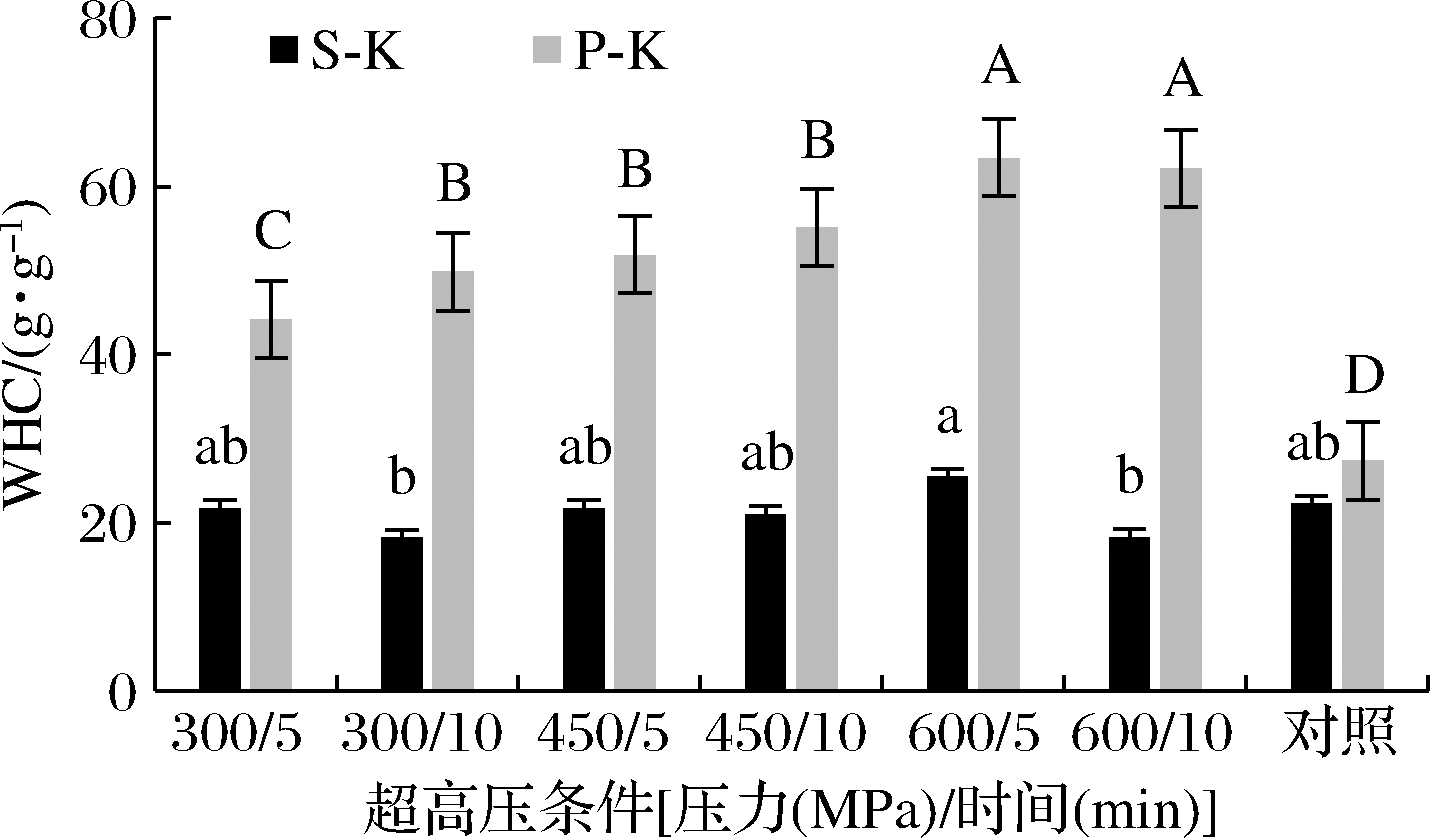
图1 UHP处理对海带WHC的影响
Fig.1 Effect of UHP treatment on the WHC of kelp 注:不同大写字母表示P-K组间数据显著差异(P<0.05) 小写字母表示S-K组间数据显著差异(P<0.05)(下同)
2.1.2 UHP对OHC的影响
未处理的P-K的OHC(4 g/g)显著高于S-K(P<0.05)(图2),相对于豆渣(1.5 g/g)、梨渣(1.65 g/g)、红薯(1.6 g/g)等,其OHC也较高。与WHC结果相似,经UHP处理后,P-K的OHC也显著高于S-K,其中经UHP 600 MPa处理10 min后P-K的OHC显著提升到(9.94±2.13) g/g(P<0.05)(图2),为未处理样品的2.33倍,而其余UHP样品的OHC并无明显变化,这一结论与苗字叶等[17]采用UHP处理麦麸20 min发现OHC随压强增大而增加的结果不同,推测可能是由于处理时间过短,海带内部的亲油性基团未能完全暴露。
2.1.3 UHP对GAC的影响
由WHC和OHC数据可见,粉末状P-K的吸附力都要高于S-K,且容易受到UHP处理的影响。因此,后续只选择P-K为原料探讨其他性质。
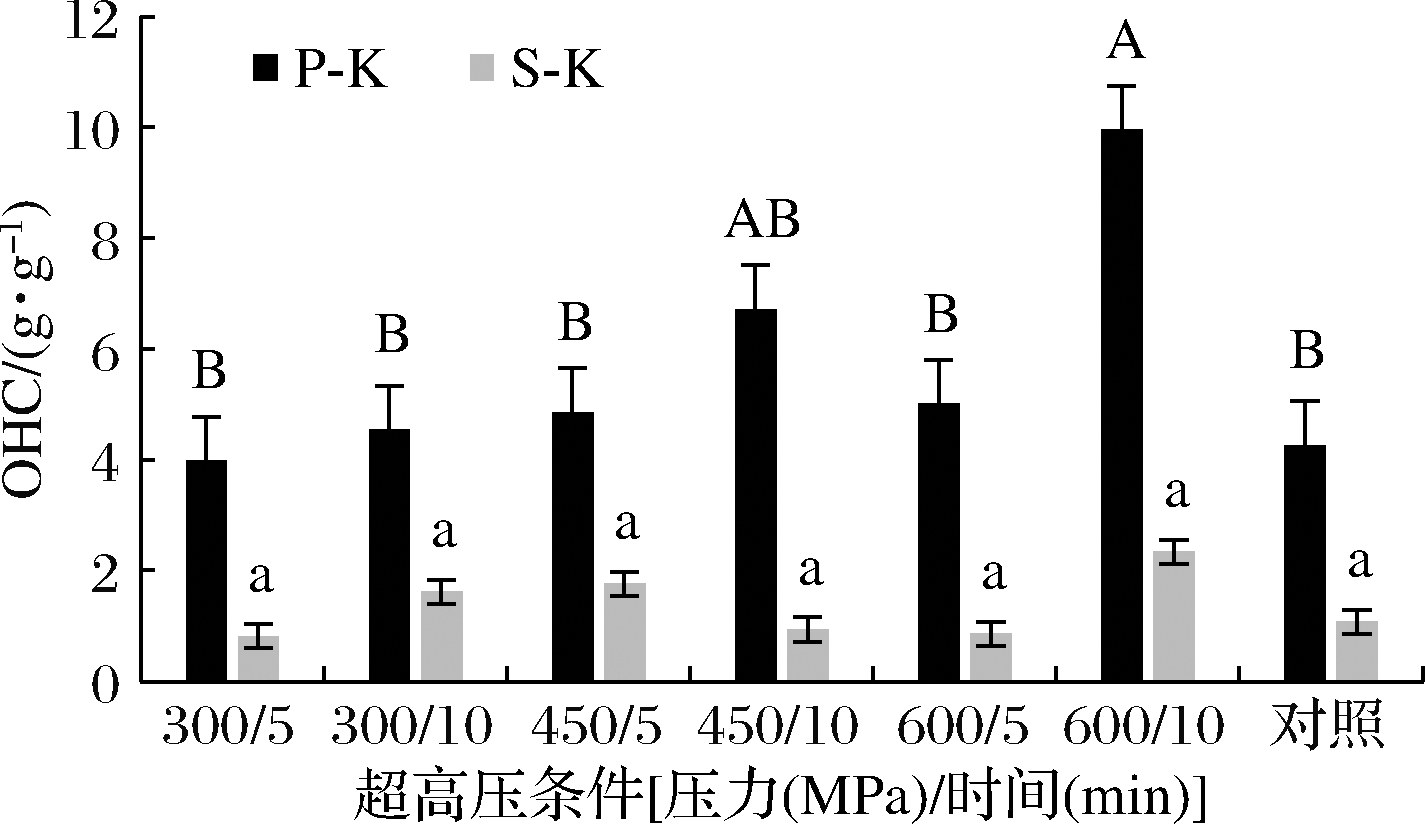
图2 UHP对海带OHC的影响
Fig.2 Effect of UHP treatment on the OHC of kelp
UHP处理后P-K的GAC都有所提高,其中450 MPa处理10 min样品的GAC最高为(2.74±0.95) g/g,为未处理样品的11.33倍(P<0.05)(图3),且随着压力的增大呈现先增加再减少的趋势。赵健等[6]采用UHP处理红薯渣膳食纤维后GAC也有提高。UHP处理使大分子上更多的功能基团,比如侧链上一些醛酸基等亲水的基团暴露出来,提供更多结合位点,使葡萄糖分子与DF之间的范德华力以及氢键作用增大[18]。饮食中的纤维颗粒可能作为葡萄糖扩散的物理障碍,UHP处理增加了纤维网络对葡萄糖分子的束缚和捕获能力[19],在控制葡萄糖扩散率方面起着至关重要的作用。因此,通过UHP处理的海带粉末可以在肠道内形成屏障捕获葡萄糖分子,可以延缓葡萄糖的扩散,推迟肠胃中的葡萄糖吸收,从而有效控制餐后血糖的升高[20]。
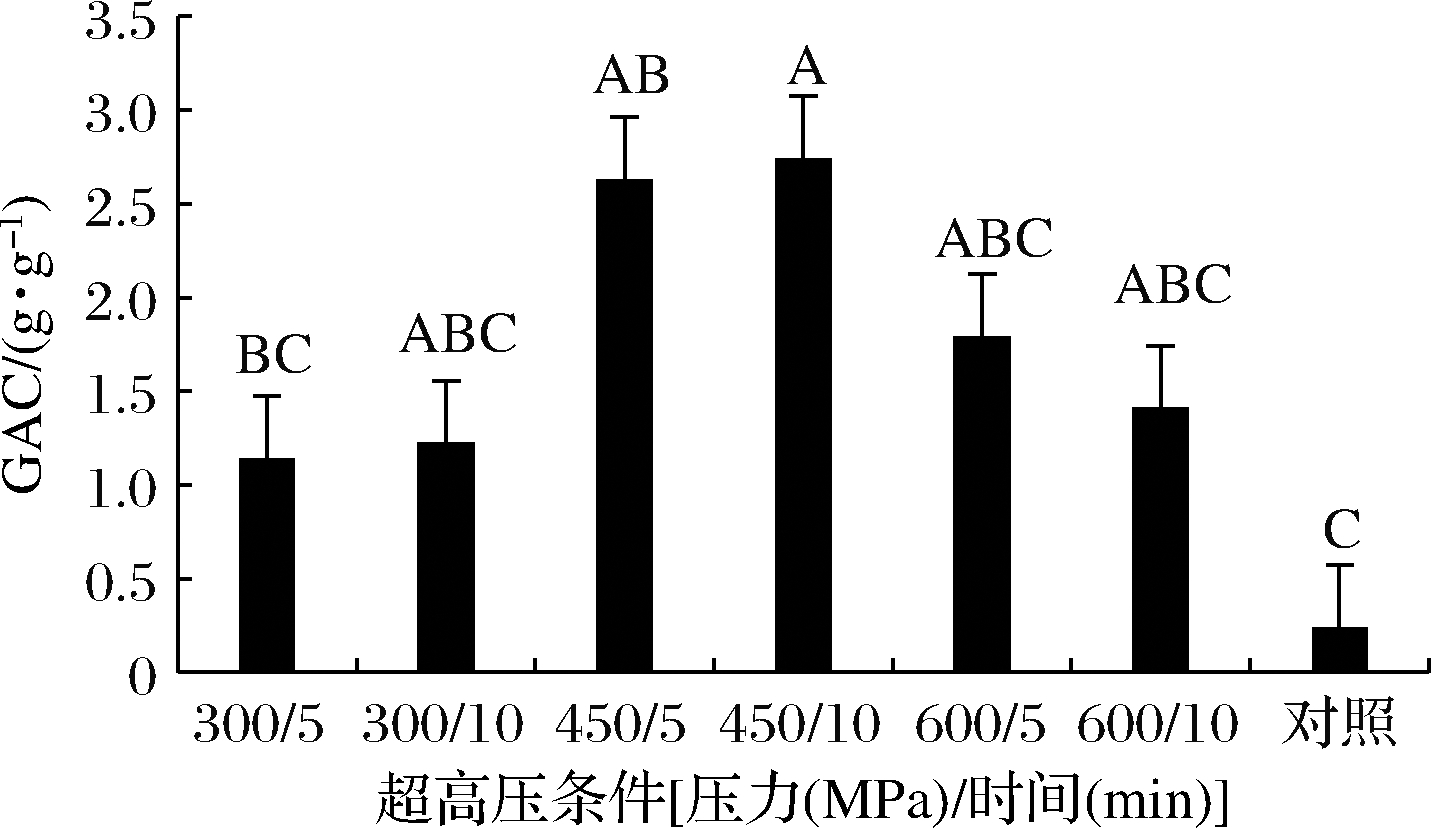
图3 UHP处理对P-K的GAC的影响
Fig.3 Effect of UHP treatment on the GAC of P-K
2.1.4 UHP对CAC的影响
高胆固醇是心血管疾病的高危因素,直接影响肝肾功能及动脉粥样硬化发展[21]。未处理的海带CAC为133.9 mg/g,经UHP处理未造成其显著变化(图4),其中经450 MPa处理10 min后样品的CAC增加为未处理样品的1.22倍,这一结论与吴长玲等[22]采用空化射流处理豆渣膳食纤维所得的结果相似。随着UHP处理压力的增加,样品的孔隙度增加,比表面积增大,可暴露更多的亲脂基团与胆固醇结合。但压力过大时,其毛细管力受损致使胆固醇吸附力降低[23]。
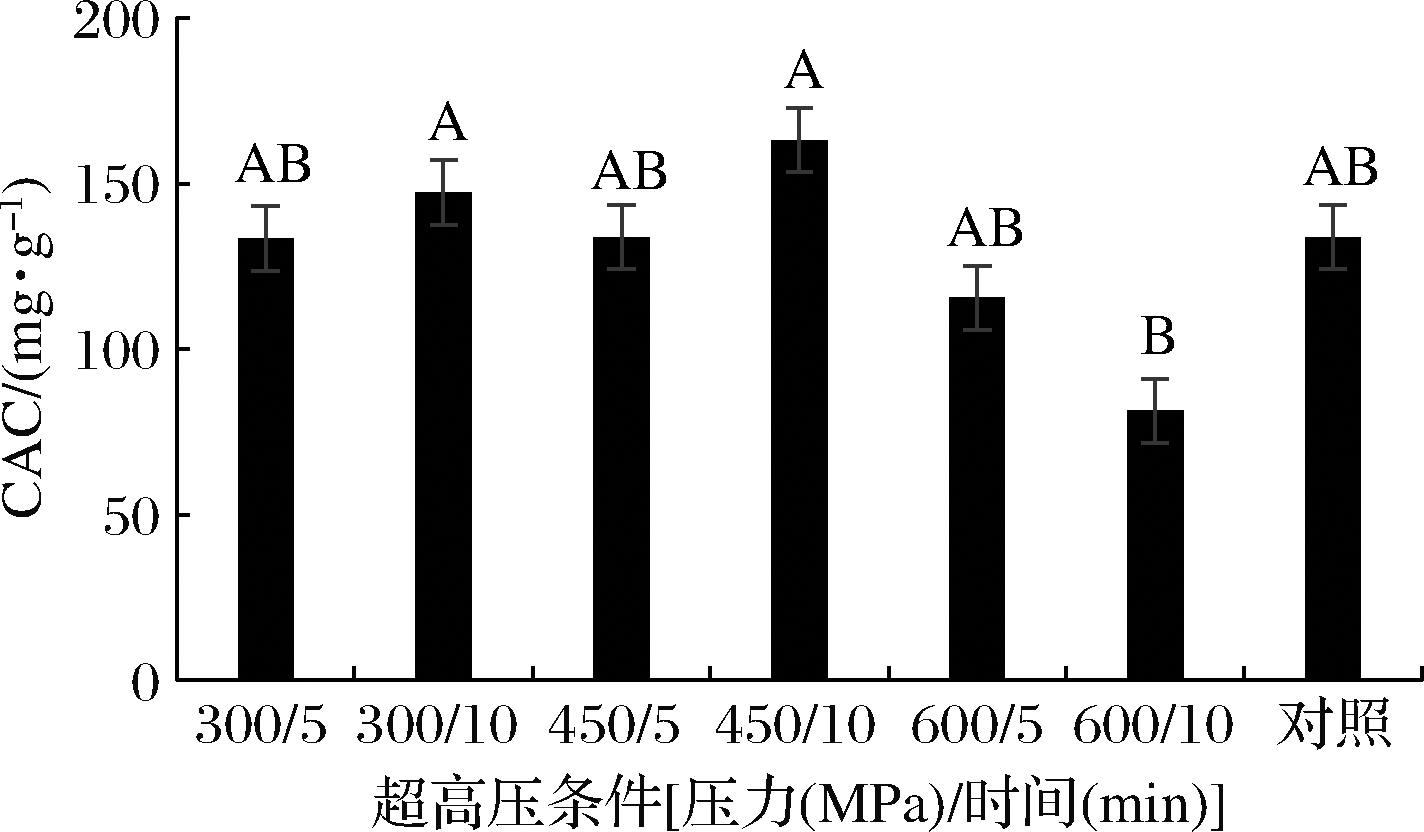
图4 UHP处理对P-K的CAC的影响
Fig.4 Effect of UHP treatment on the cholesterol-adsorption capacity of P-K
2.2 UHP处理对海带吸附性影响机理的初步探讨
以上结果表明,UHP处理后的P-K的WHC、OHC和GAC都有了显著提高,但CAC的变化并不明显;而S-K的各种吸附性能都较差,UHP对其影响也并不明显。为探讨UHP处理影响P-K吸附性的机理,现从其DF含量、表观特征等方面来探讨其相关性。
2.2.1 UHP处理对海带DF含量的影响
DF包括SDF和IDF,SDF在防治心血管疾病、糖尿病、动脉硬化等方面具有良好的作用且优于IDF[4]。本文对UHP处理前后总DF、IDF和SDF含量的变化进行了分析。结果表明,未处理样品的总DF含量为(61.91±0.98)g/100g,经UHP处理后的样品总DF含量显著增加(P<0.05),最高值达到(74.82±0.99)g/100g,为原来的1.21倍(图5-a)。不同压力下,处理5 min的样品中IDF含量显著升高为未处理样品的1.07~1.10倍(图5-b),而处理10 min 后的样品SDF含量显著增加为原来的1.47~1.63倍(图5-c)(P<0.05)。赵健等[6]采用UHP处理红薯渣DF后也发现总DF增加。UHP处理后,海带的空间结构发生变化,IDF的含量首先增加,使得总DF的含量增加。随着处理时间的增长,DF的空间结构再次发生变化,大分子组分的链接键断裂转变为小分子,使得IDF转化为SDF,从而使SDF含量增加[24],这与苗字叶等[17]采用UHP处理梨渣膳食纤维结果相似。XIE等[25]认为UHP可以降解纤维素,将IDF转化为SDF,使得IDF和SDF再分配,有效地提高了SDF含量。
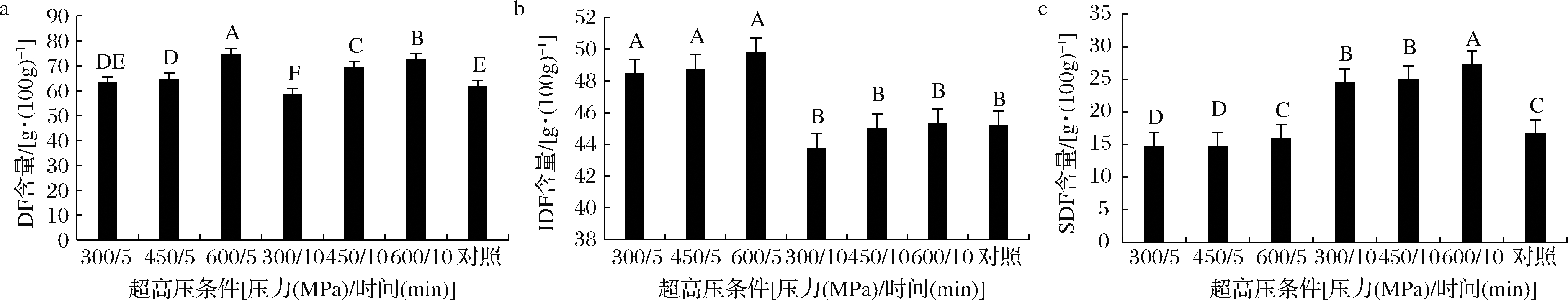
a-总DF;b-IDF;c-SDF
图5 UHP处理对海带DF含量的影响
Fig.5 Effect of UHP treatment on the content of DF in kelp
2.2.2 UHP对海带微观结构的影响
UHP处理后海带经扫描电镜研究其微观结构(图6)。未处理的P-K颗粒较大,成不规则片状结构,表面较为光滑(图6-g);经UHP处理后P-K的表面开始变得粗糙,且出现破碎和断裂,颗粒变小(图6-a~图6-f), 当压力为 450 MPa 时颗粒尺寸最小。文献表明,随着UHP压力和处理时间的增加,P-K比表面积和表面孔隙率增加,可能是由于UHP处理过程中P-K的空间结构遭到破坏而变得疏松,颗粒尺寸减小,但当尺寸减小到一定程度,表面活性及吸附性的增加导致部分颗粒开始聚集。总体而言,UHP处理改变了P-K的微观结构,从而对其吸附性产生了影响,这与之前吸附性数据结果相符。

a-300 MPa,10 min;b-450 MPa,10 min;c-600 MPa,10 min; d-300 MPa,5 min;e-450 MPa,5 min;f-600 MPa,5 min;g-对照
图6 P-K电镜图(600×)
Fig.6 Scanning electron microscope (SEM) images of P-K(600×)
3 结论
本文研究了不同压力(300、450、600 MPa)及时间(5、10 min)的UHP处理对P-K以及S-K吸附性质的影响。结果发现,UHP处理后的P-K的WHC、OHC、GAC均显著提高(P<0.05),CAC能力虽无显著变化但略有增加;而S-K的各种吸附性能都较差,UHP对其影响也并不明显。P-K的WHC、OHC和GAC分别显著提高为原来的1.61~2.31、2.33和11.33倍。随着处理压力和时间的增加,WHC及OHC逐渐增强,而GAC及CAC随处理压强的增加呈现先增加后减小的趋势。经进一步对海带DF含量、种类和微观结构分析,发现处理5 min的样品中IDF含量显著增加,处理10 min后SDF含量显著增加,所有UHP样品总DF含量显著增加(P<0.05)。扫描电镜分析的结果显示,UHP处理后P-K的比表面积和孔隙率增加,表面结构由致密变得疏松,但颗粒尺寸减小到一定程度后会发生聚集现象。综上所述,UHP处理能够影响海带中DF的组成和含量,改变其微观结构,从而影响其吸附性。本研究为进一步推动海带资源的高效、高值化、可持续开发利用提供新思路,也为UHP工艺在生产功能性食品方面提供理论依据。
[1] 姚海芹,王飞久,刘福利, 等.食用海带品系营养成分分析与评价[J]. 食品科学, 2016, 37(12): 95-98.
YAO H Q, WANG F J, LIU F L, et al. Chemical analysis and nutritional assessment of new varieties of Saccharina japonica[J]. Food Science, 2016, 37(12):95-98.
[2] 万仁口,李功景,贺杨正, 等.竹笋膳食纤维的结构特性及其功能性质[J]. 中国食品学报, 2021, 21(5):75-82.
WAN R K, LI G J, HE Y Z, et al. Structural and functional properties of dietary fiber from bamboo shoots[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(5):75-82.
[3] SPERONI C S, BENDER A B B, STIEBE J, et al. Granulometric fractionation and micronization: A process for increasing soluble dietary fiber content and improving technological and functional properties of olive pomace[J]. LWT,2020,130:109526.
[4] 胡筱,潘浪,朱平平, 等.超声波改性对葵花粕膳食纤维性质与结构的影响[J]. 中国食品学报, 2019, 19(11):88-99.
HU X, PAN L, ZHU P P, et al. Effects of ultrasonic modification on the properties and structure of dietary fiber in sunflower meal[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(11):88-99.
[5] 王娟,魏春红,王维浩, 等.物理改性对小米水溶性膳食纤维的结构表征及硒化能力的影响[J]. 中国粮油学报, 2021, 36(5):35-42.
WANG J, WEI C H, WANG W H, et al. Effects of physical modification on structural characterization and selenization ability of millet water-soluble dietary fiber[J]. Journal of the Chinese Cereals and Oils Association, 2021, 36(5):35-42.
[6] 赵健,郑刚,赵国华.超高压处理对红薯渣膳食纤维理化性质的影响[J]. 食品科学, 2009,30(17):109-112.
ZHAO J, ZHENG G, ZHAO G H. Effects of ultra high pressure treatment on physico-chemical properties of dietary fiber prepared from residue of sweet potato after starch extraction[J]. Food Science, 2009, 30(17):109-112.
[7] 刘成梅,万婕,李资玲, 等.瞬时高压处理后膳食纤维对面包品质的影响[J]. 食品工业科技, 2006(8):54-55;59.
LIU C M, WAN J, LI Z L, et al. The effect of dietary fiber treated by instantaneous high pressure treacment on the texture of bread[J]. Science and Technology of Food Industry, 2006, 27(8):54-55; 59.
[8] 李凤.UHP处理对小麦膳食纤维的改性研究[J]. 食品科学, 2007,28(9):96-98.
LI F. Study on modifying wheat dietary fiber by ultra high pressure treatment[J]. Food Science, 2007,28(9):96-98.
[9] CHAU C F, HUANG Y L. Comparison of the chemical composition and physicochemical properties of different fibers prepared from the peel of Citrus sinensis L. Cv. Liucheng[J]. Journal of Agricultural & Food Chemistry, 2003, 51(9):2 615-2 618.
[10] SANGNARK A, NOOMHORM A. Effect of particle sizes on functional properties of dietary fiber prepared from sugarcane bagasse[J]. Food Chemistry, 2003, 80(2):221-229.
[11] NSOR-ATINDANA J, ZHONG F, MOTHIBE K J. In vitro hypoglycemic and cholesterol lowering effects of dietary fiber prepared from cocoa (Theobroma cacao L.) shells[J]. Food Function, 2012,3(10):1 044-1 050.
[12] HUA M, LU J X, QU D, et al. Structure, physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue: A potential functional ingredient[J]. Food Chemistry, 2019, 286:522-529.
[13] QIAO H Z, SHAO H M, ZHENG X J, et al. Modification of sweet potato (Ipomoea batatas Lam.) residues soluble dietary fiber following twin-screw extrusion[J]. Food Chemistry, 2021, 335:127522.
[14] 王跃,刘延奇,姜春鹏, 等.不同超高压处理时间对小麦麸皮性质的影响[J].粮食与饲料工业, 2011(1):28-29;33.
WANG Y, LIU Y Q, JIANG C P, et al. Influence of different UHP processing times on properties of wheat bran[J]. Cereal & Feed Industry, 2011(1):28-29;33.
[15] 李天,颜玲,李沛军, 等.超高压和超微粉碎改性对梨渣膳食纤维的影响[J].食品研究与开发, 2018, 39(23):18-23.
LI T, YAN L, LI P J, et al. Effects of high hydrostatic pressure and superfine grinding on the physicochemical and functional properties of pear pomace[J]. Food Research and Development, 2018, 39(23):18-23.
[16] 朱丹,朱立斌,牛广财, 等.沙果渣膳食纤维超高压处理条件优化及其微观结构表征[J].天然产物研究与开发, 2020, 32(1):118-126.
ZHU D, ZHU L B, NIU G C, et al. Optimization on ultra high pressure processing conditions and microstructural characteristics of the dietary fiber from Malus asiatica Nakai residue[J]. Natural Product Research and Development, 2020, 32(1):118-126.
[17] 苗字叶,姚亚亚,刘阳星月, 等.超高静压改性麦麸对其功能性质的影响[J].食品科学, 2019, 40(19): 164-171.
MIAO Z Y, YAO Y Y, LIU Y, et al. Functional properties of high hydrostatic pressure modified wheat bran[J]. Food Science, 2019, 40(19):164-171.
[18] 游玉明,王昱圭,张洁, 等.高压均质处理对竹笋膳食纤维理化性质及结构的影响[J].食品与发酵工业, 2021, 47(10):30-36.
YOU Y M, WANG Y G, ZHANG J, et al. The effcit of high-pressure homogenization on physicochemical and structural properties of bamboo shoots dietary fiber[J]. Food and Fermentation Industries, 2021, 47(10):30-36.
[19] MA M M, MU T H. Modification of deoiled cumin dietary fiber with laccase and cellulase under high hydrostatic pressure[J]. Carbohydrate Polymers, 2016, 136:87-94.
[20] QI J, LI Y, KINGSLEY G M, et al. The effect of chemical treatment on the in vitro hypoglycemic properties of rice bran insoluble dietary fiber[J]. Food Hydrocolloids, 2016, 52:699-706.
[21] 于周艳.高胆固醇与心血管危险因素相关性分析[J].世界最新医学信息文摘, 2019, 19(29):68;73.
YU Z Y. Correlation analysis of high cholesterol and cardiovascular risk factors[J]. World Latest Medicine Information, 2019, 19(29):68;73.
[22] 吴长玲,陈鹏,李顺秀, 等.空化射流条件下豆渣不溶性膳食纤维结构与功能性研究[J].农业机械学报, 2021, 52(3):350-356.
WU C L, CHEN P, LI S X, et al. Effect of cavitation jets on structure and function of okara insoluble dietary fiber[J]. Transactions of the Chinese Society for Agricultural Machinery, 2021, 52(3):350-356.
[23] ROSA-SIBAKOV N,SIBAKOV J,LAHTINEN P, et al. Wet grinding and microfluidization of wheat bran preparations: Improvement of dispersion stability by structural disintegration[J]. Journal of Cereal Science, 2015, 64:1-10.
[24] LYU J S, LIU X Y, ZHANG X P, et al. Chemical composition and functional characteristics of dietary fiber-rich powder obtained from core of maize straw[J]. Food Chemistry, 2017, 227:383-389.
[25] XIE F, LI M, LAN X H, et al. Modification of dietary fibers from purple-fleshed potatoes (Heimeiren) with high hydrostatic pressure and high pressure homogenization processing: A comparative study[J]. Innovative Food Science & Emerging Technologies, 2017, 42:157-164.