鲜切蔬菜是指以新鲜蔬菜为原料,经清洗、切分、杀菌、拼盘等工艺加工后,再经过冷链运送至消费者处的一种拆封即食食品[1]。由于其新鲜、方便、卫生等特点,目前在市场大受重视,是蔬菜消费的新趋势,同时也是延长蔬菜产业链的新的突破口。生菜,是一类重要的绿叶蔬菜,因口感甜脆,营养价值高,富含多种维生素、膳食纤维、蛋白质、碳水化合物和无机盐等,有抗衰老、加强肠胃道功能和排毒利尿的功能而深受消费者的青睐[2],同时也是最常见的鲜切蔬菜之一。鲜切生菜的外观和口感尤为重要,但是由于切面损伤,加上不适宜的温度和气调比等非生物因素,使得鲜切生菜在加工以及贮藏期间容易发生品质劣变[3]。褐变和腐败菌是造成鲜切生菜品质劣变的两大重要原因。由于机械损伤,鲜切生菜极易褐变,尤其以酶促褐变最为常见,对果蔬的外观、口感等感官品质和营养价值等方面有较大影响,降低消费者的接受度。假单胞菌为专性需氧的革兰氏阴性菌,广泛地分布于空气、土壤、水,以及人体皮肤、消化道和呼吸道中[4],可导致动物和植物产品腐败。假单胞菌在生菜等很多绿叶蔬菜上都是优势腐败菌,产生水解酶,致使蔬菜软腐烂。在鲜切生菜中假单胞菌的污染问题更为严重。
目前关于鲜切生菜保鲜的物理和化学方法有很多,气调贮藏、电解水和臭氧等方法已被证实能有效抑制生菜褐变和腐败[5]。然而,这些方法存在有害化学物质残留、成本高、处理量有限、可能造成细菌耐药性增强等问题。近年来,研究者用天然产物进行鲜切菜的保鲜,提高农业废弃物的利用效率,并提供了更加安全的保鲜方法。桑树在我国分布广泛,桑叶中含有很多活性成分,目前并未被充分利用。其中的桑叶多酚是具有生物活性的酚类次生代谢产物,是构成桑叶抗氧化能力的重要物质基础。我们过去的研究已经证实,桑叶多酚可以作为一种天然的生物保鲜剂,用于鲜切的果蔬保鲜[6]。
桑叶多酚的抗氧化性一直是食品果蔬保鲜领域应用的难题,不同浓度桑叶多酚对鲜切生菜抗褐变程度以及对优势腐败菌的抑制作用尚不清楚。因此,有必要通过从桑叶中提取多酚,以鲜切生菜为原料,通过稀释得到不同浓度梯度桑叶多酚进行实验,从而更好地了解桑叶多酚在抗褐变和抑制荧光假单胞菌中的作用。本研究旨在对比褐变度以及多酚氧化酶(polyphenol oxidase,PPO),过氧化物酶(peroxidase,POD),苯丙氨酸酶(phenylalanine ammonia,PAL)这3种主要酶活性来确定不同浓度桑叶多酚的抗褐变能力。同时,本研究通过绘制荧光假单胞菌生长曲线以及测定生物膜量来探究其对荧光假单胞菌的生长抑制作用。
1 材料与方法
1.1 材料与试剂
桑叶,采摘自西南大学桑叶园,品种为纳溪族;生菜,购自重庆市北碚区永辉超市;大孔树脂,范德(北京)生物科技有限公司;无水乙醇、聚乙烯吡咯烷酮、邻苯二酚、愈木创酚、过氧化氢、硼酸盐缓冲液、苯丙氨酸、丙酮,所有试剂均为分析纯,重庆市钛兴化工试剂厂;假单胞菌,实验室从腐败生菜中分离培养所得。
1.2 仪器与设备
SQP,电子天平,Sartorius;5810R冷冻高速离心机、测色仪,Eppendorf;721 N型可见分光光度计,上海生工生物科技有限公司;1510型酶标仪,赛默飞世尔仪器有限公司。
1.3 实验方法
1.3.1 不同浓度桑叶多酚的制备
取12 g桑叶粉与400 mL乙醇(70%,体积分数)混合于锥形瓶中,在超声功率为400 W的条件下进行超声处理60 min。提取液经103号定性滤纸过滤,在40 ℃真空条件下用旋转蒸发器浓缩得到200 mL桑叶粗多酚提取液。粗多酚在8 000×g离心10 min,取40 g 经预处理大孔吸附树脂,装入3 cm×30 cm的层析柱中,将离心后上清液缓慢加入层析柱中,用大孔树脂吸附酚类物质。用蒸馏水对大孔树脂中的水溶性化合物进行2次洗涤,用60%乙醇(pH 4.0±0.1)洗脱树脂中酚类物质。用旋转蒸发器在40 ℃下浓缩多酚溶液以获得纯净的桑叶多酚提取液,放置在低温暗处保存。用无菌蒸馏水将初始质量浓度为100 g/L的桑叶多酚溶液分别稀释为0.1、0.5、1、10 g/L。
1.3.2 生菜预处理
将鲜切生菜纯水冲洗,洗去表面泥土,摘去外层叶片和不健康的叶片,用灭菌后的剪刀将健康的生菜切成2.0 cm×2.0 cm,再用200 mg/L次氯酸钠溶液浸泡10 min,用无菌纯水冲洗后将其放入生物安全柜中晾干。晾干后,各处理组准确称量10 g样品于一次性果蔬托盘中,装入灭菌后的保险密封袋并做好标记,置于4 ℃下贮藏,在第0、1、3、5、7天观测鲜切生菜的贮藏品质变化并测量特性。
1.3.3 不同浓度桑叶多酚对生菜褐变的抑制作用
1.3.3.1 褐变测定
5种浓度梯度生菜样品在第0、1、3、5、7天分别称取2 g,加入95%乙醇6 mL,研磨均匀,8 000 r/min离心10 min,取上清液于420 nm处测定吸光度A,即为样品褐变度。
1.3.3.2 色差测定
5种浓度梯度生菜样品在第0、1、3、5、7天分别使用全自动色差计(TCP2-B)测量样品色泽,在每片生菜两侧和中心位置进行3次测量,记录下L*、a*、b*值。
1.3.3.3 叶绿素含量测定
5种浓度梯度生菜样品在第0、1、3、5、7天分别称取0.5 g,加入2.0 mL丙酮研磨,收集研磨液后再加入2.0 mL丙酮反复冲洗研钵并收集冲洗液,汇总后再加入离心管中,8 000 r/min离心10 min。取上清液,以丙酮作为空白对照,分别在645、663 nm测定吸光度值,叶绿素浓度计算如公式(1)~公式(4)所示:
Ca=12.72A663-2.59A645
(1)
Cb=22.88A645-4.67A645
(2)
C总=Ca+Cb
(3)
叶绿素含量![]()
(4)
式中:Ca为叶绿素a浓度;Cb为叶绿素b浓度;C总为叶绿素总浓度;V为提取液总体积,mL;W为取样质量,g。
1.3.3.4 PPO活性测定
粗酶液的提取:分别在第0、1、3、5、7天取经过5种浓度梯度桑叶多酚处理生菜样品1.0 g,加入4 mL 聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)溶液(0.1 g PVP溶于20 mL磷酸缓冲液)研磨成匀浆,于4 ℃下8 000 r/min离心10 min,取上清液备用。
PPO活性采用邻苯二酚法测定:将上述酶液稀释10倍,取0.5 mL稀释后的酶液,再加2.5 mL的0.2 mol/L邻苯二酚溶液,空白组以蒸馏水代替酶液,在480 nm处测定3 min内吸光度变化。以1 min吸光值增加0.1个吸光度值为1个酶活力单位(U)。
1.3.3.5 POD活性测定
粗酶液的提取:5种浓度梯度生菜样品在第0、1、3、5、7天分别取样1.0 g,加入4 mL PVP溶液研磨成匀浆,于4 ℃下8 000 r /min离心10 min,取上清液备用。
POD活性采用消光值法测定:取2 mL 0.05%愈创木酚溶液,随即加入0.5 mL酶液并快速摇匀,空白组以蒸馏水代替酶液,30 ℃孵育5 min,最后加入1 mL 0.08%过氧化氢溶液,混匀,在420 nm处测定3 min 内吸光度变化。以1 min吸光值增加0.1个吸光度值为1个酶活力单位(U)。
1.3.3.6 PAL活性测定
5种浓度梯度生菜样品在第0、1、3、5、7天分别用5.0 mL pH 8.5硼酸盐缓冲液研磨1 g样品,在10 000 r/min 离心10 min后,将1.0 mL酶液与1.0 mL 0.02 mol/L苯丙氨酸和2.0 ml蒸馏水混合,空白对照以1.0 mL上述硼酸缓冲液代替酶液。在37 ℃下,利用酶标仪测定30 min前后290 nm处的吸光度,以吸光度A 1 h增加0.01为1个酶活力单位(U)。
1.3.4 不同浓度桑叶多酚对假单胞菌的抑制作用
1.3.4.1 不同浓度桑叶多酚对假单胞菌生长的抑制作用
从-80 ℃冰箱中挑取并培养实验室贮存的从腐败生菜中筛选的荧光假单胞菌,在LB培养液中37 ℃ 下培养16 h。取菌悬液,分别加入9 mL各浓度的桑叶多酚溶液,用无菌生理盐水代替桑叶多酚溶液作为对照。每隔2 h测吸光值OD600,连续测量24 h。以培养时间为横坐标,以OD600值为纵坐标,绘制生长曲线。
1.3.4.2 不同浓度桑叶多酚对假单胞菌在生菜上形成生物被膜的抑制作用
采用结晶紫染色法进行生物膜的测定。取5 mL菌悬液于装有5 g鲜切生菜的无菌袋中,分别加入1 mL 各浓度的桑叶多酚溶液,用无菌生理盐水代替桑叶多酚溶液作为对照,37 ℃培养24 h。移除培养液后,取鲜切生菜于无菌烧杯中,用0.85%(质量分数) NaCl溶液洗涤鲜切生菜3次并去除所有洗涤液。向烧杯内加入1 mL质量浓度为1 g/L结晶紫染色剂染色15 min。用0.85% NaCl溶液洗涤鲜切生菜2次,自然晾干。随后,用1 mL 95%乙醇溶解鲜切生菜上的生物膜,并测定OD570值。
1.4 数据处理
利用Excel 2019对试验数据进行统计与整理。使用Origin 2019和SigmaPlot 14.0软件作误差图并分析结果。使用 SPSS 26.0统计软件对数据进行单因素ANOVA分析,用Duncan氏法进行多重差异显著性比较(P<0.05为显著差异)。所有试验均进行3次重复。
2 结果与分析
2.1 褐变度
酶促褐变是酚酶催化酚类物质形成醌及其聚合物的反应过程。当生菜被切分后,机械伤害使生菜的细胞结构被破坏,导致底物和酶的结合,形成了酶促褐变[7]。由图1可知,鲜切生菜随着贮藏时间延长,褐变度显著上升(P<0.05)。这是因为鲜切处理后,生菜细胞壁受到破坏,酚类物质不断流出并与酶结合。而经过0.1~1 g/L桑叶多酚处理,鲜切生菜褐变度的上升减缓,0.5 g/L桑叶多酚处理的褐变抑制效果最好。10 g/L桑叶多酚处理反而有促进褐变的作用,可能由于浓度太高,为褐变提供了酚类物质,增加了底物浓度,促进了酶促褐变。
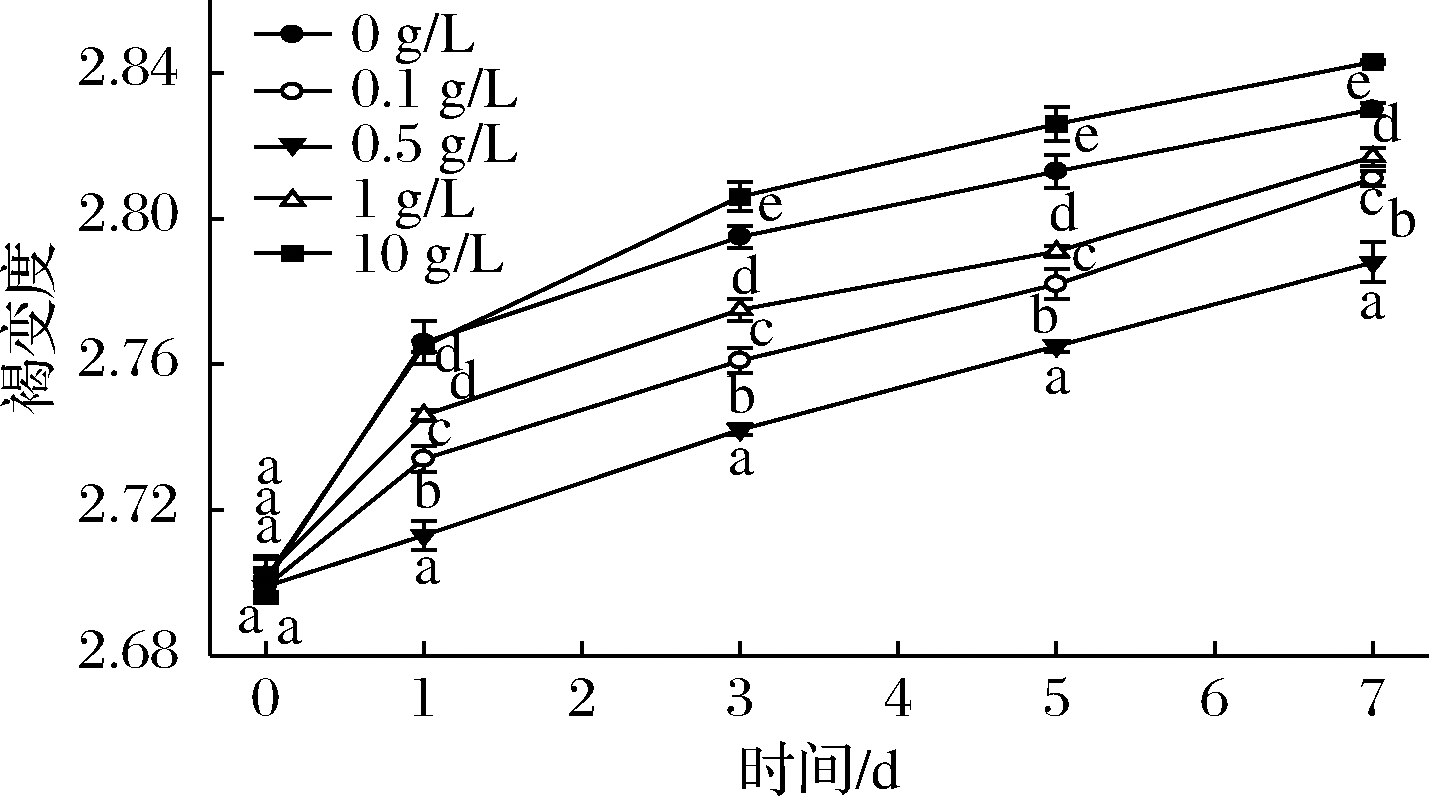
图1 不同浓度桑叶多酚对鲜切生菜褐变度的影响
Fig.1 Effects of different concentrations of mulberry polyphenol on the browning of fresh-cut lettuce 注:同列标有不同小写字母者表示组间差异显著(P<0.05); 标有相同小写字母者表示组间差异不显著(P>0.05)(下同)
2.2 色差
颜色是研究加工果蔬品质的一个重要指标[8],生菜鲜切后的颜色变化影响其感官品质,因此研究其颜色表征对产品价值判断有重要意义[9]。由图2可知,在贮藏过程中,L*值曲线整体逐渐下降,a*值和b*值曲线整体逐渐上升。L*值代表明暗度,a*值代表红色度,b*值代表黄色度。经0.1~1 g/L桑叶多酚处理的鲜切生菜在7 d里相较对照组亮度更高,红色度和黄色度更低,褐变程度受到抑制,其中0.5 g/L桑叶多酚处理效果最佳。而经10 g/L桑叶多酚处理的鲜切生菜相较对照组亮色度更低,红色度和黄色度更高,褐变程度受到促进。
2.3 叶绿素含量
叶绿素含量是维持鲜切生菜贮存品质的重要指标之一。由图3可知,随着时间推移,鲜切生菜叶绿素含量显著降低(P<0.05)。叶绿素酶是迄今为止了解最多的叶绿素酶促降解途径的重要组成酶之一[10]。叶绿素含量越低表明生菜叶表面绿色褪色越严重,与叶片褐变程度息息相关[11]。贮藏期间,0.1~1 g/L桑叶多酚处理能有效减缓叶绿素含量减少,抑制其褐变速率,其中0.5 g/L桑叶多酚处理效果最佳。而10 g/L桑叶多酚处理促进叶绿素含量下降,有促进褐变作用。

A-L*;B-a*;C-b*
图2 不同浓度桑叶多酚对鲜切生菜色差的影响
Fig.2 Effects of different concentrations of mulberry polyphenol on the color difference of fresh-cut lettuce
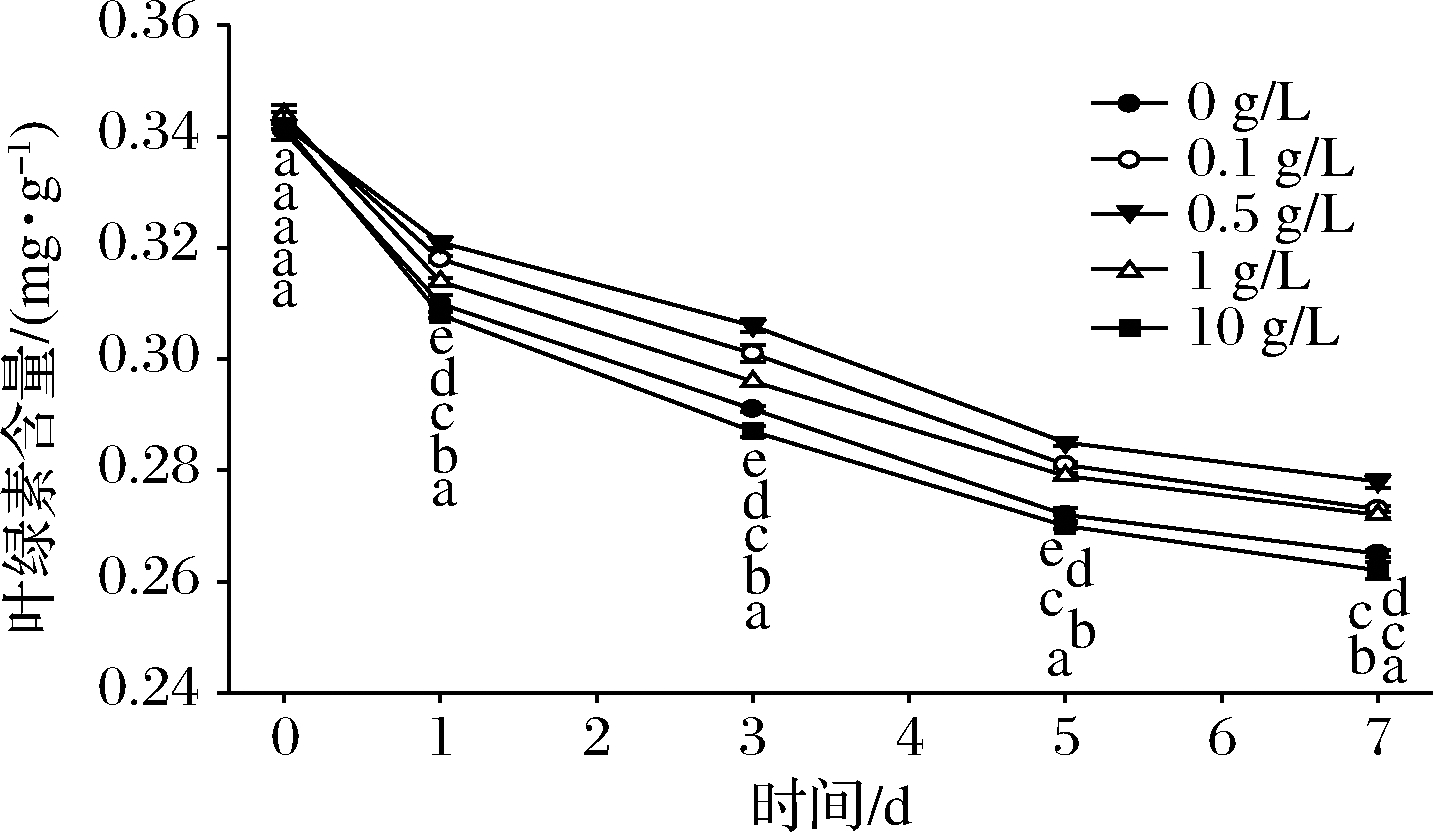
图3 不同浓度桑叶多酚对鲜切生菜叶绿素含量的影响
Fig.3 Effects of different concentrations of mulberry polyphenol on the chlorophyll content of fresh-cut lettuce
2.4 酶活性测定
2.4.1 PPO活性变化
PPO是参与果蔬组织酶促褐变的关键性酶[12]。果蔬中多酚类物质在PPO的催化作用下氧化而显现褐色。这些多酚类物质包括邻苯二酚、绿原酸、咖啡酸、没食子酸等,它们在完整的细胞中作为呼吸传递物质[13]。由图4可知,在贮藏过程中,0~3 d,PPO活性不断增强。当生菜在被切分后受到机械损伤,细胞组织被破坏后,原本在细胞液泡中的酚类物质外溢,在酚酶的作用下形成醌及其褐色聚合物[14-15],同时PPO被激活。在第3~7天,PPO活性降低,可能是因为随着酚类物质流失,反应底物减少,酶活性降低。0.1~1 g/L桑叶多酚处理可以抑制PPO活性,0.5 g/L桑叶多酚处理抑制效果最好。而10 g/L桑叶多酚处理促进PPO活性,可能是浓度过高反而提供了酚类物质底物促进PPO反应。
2.4.2 POD活性变化
在过氧化氢存在的情况下,POD能将酚类和类黄酮催化氧化、聚合而形成醌类化合物,进而形成黑色素,与鲜切果蔬组织褐变密切相关[16]。由图5可知,贮藏过程中POD活性呈现先上升后下降的趋势,第3天达到活性的峰值。一是因为生菜鲜切处理后细胞结构受到机械损伤,大量过氧化氢流出,促进POD反应;二是因为虽然果蔬中过氧化氢含量较低,但是PPO不断生成的过氧化氢和醌类物质能为POD反应继续提供底物[17]。在第3~7天,POD活性降低。可能因为生菜本身营养物质流失,反应底物减少;另外,PPO反应减缓后,无法提供更多的过氧化氢和醌类物质。这些使得POD活性降低。0.1~1 g/L桑叶多酚处理可以抑制POD活性,0.5 g/L桑叶多酚处理抑制效果最好。而10 g/L桑叶多酚处理反而促进了POD活性。
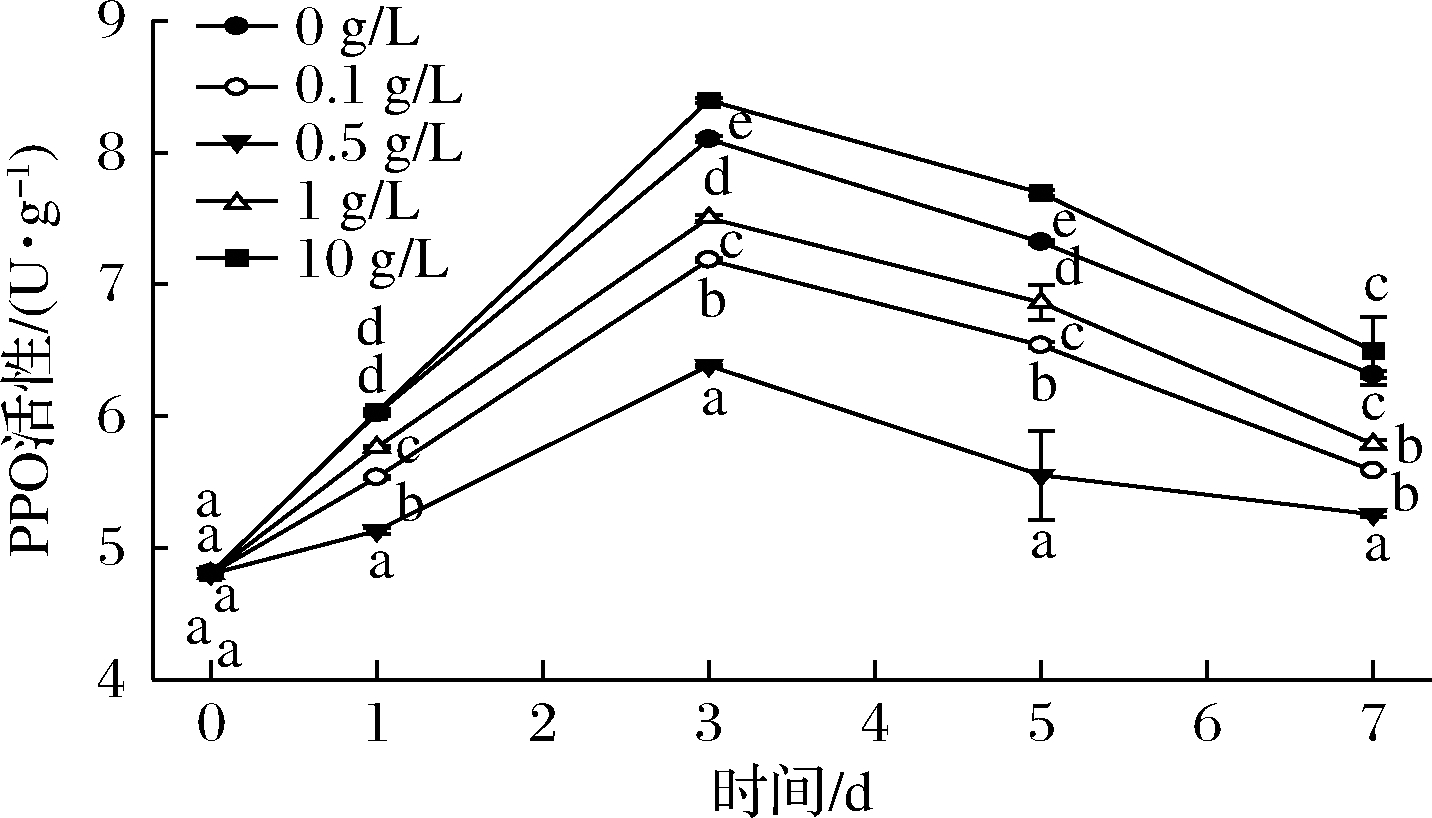
图4 不同浓度桑叶多酚对鲜切生菜PPO活性的影响
Fig.4 Effects of different concentrations of mulberry polyphenol on PPO activity of fresh-cut lettuce
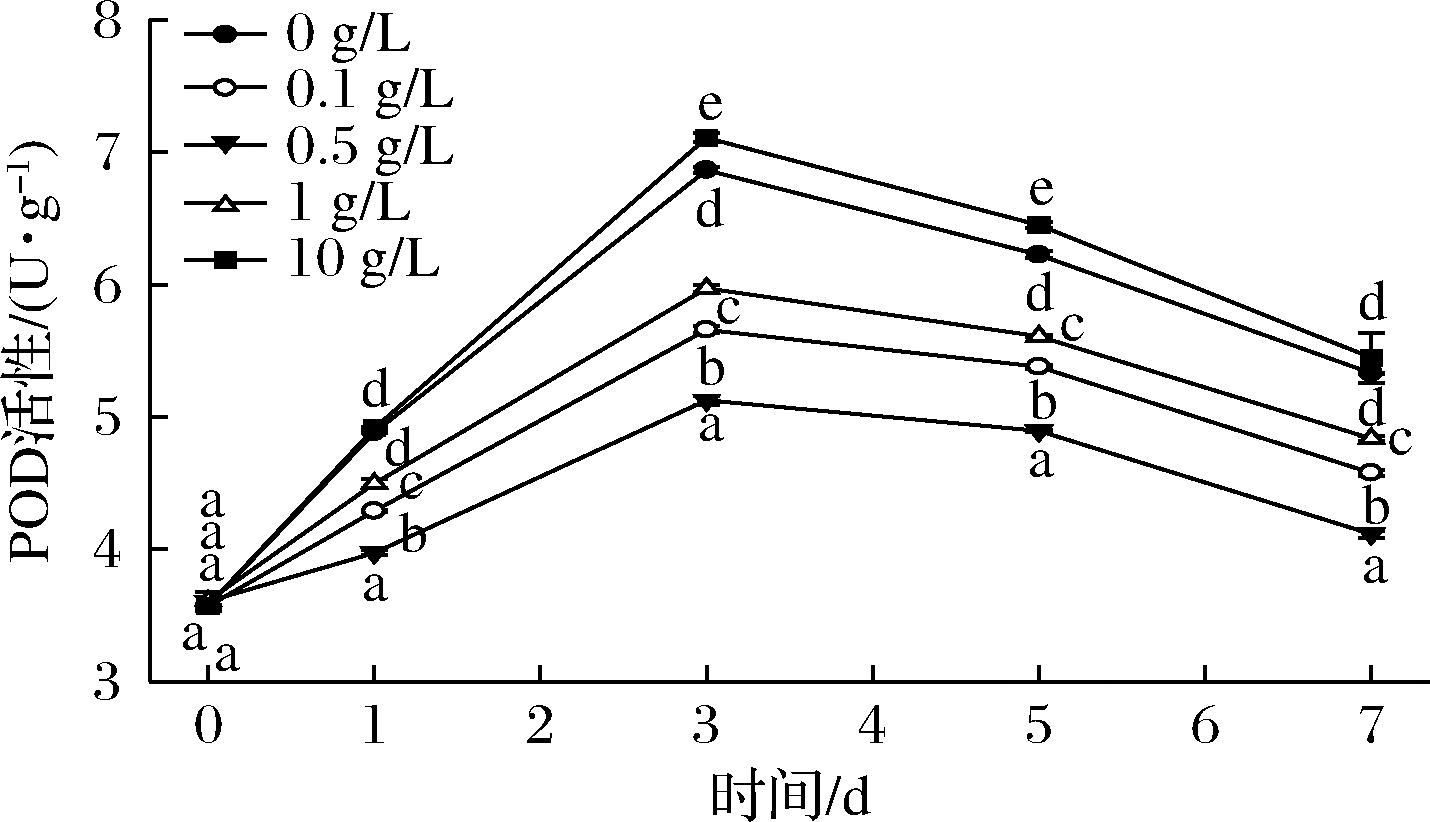
图5 不同浓度桑叶多酚对鲜切生菜POD活性的影响
Fig.5 Effects of different concentrations of mulberry polyphenol on POD activity of fresh-cut lettuce
2.4.3 PAL活性变化
PAL是酚类物质代谢网络最上游的关键限速酶,催化苯丙烷类代谢,不断形成酚类物质[18]。酚类物质不仅是酶促褐变的底物,同时也是PAL催化反应的产物。由图6可知,贮藏过程中PAL活性呈现先上升后下降的趋势,第3天达到活性的峰值。生菜受到机械损伤后,PAL被大量诱导合成积累[19],与大量暴露的苯丙氨酸反应。同时,新合成的乙烯也加速苯丙氨酸的分解,生成大量的酚类物质。此时酚类物质与因机械损伤而被激活的PPO相结合导致了褐变的发生[13,20]。在第3~7天,PAL活性降低,因为PAL合成速率降低和反应底物的减少。0.1~1 g/L桑叶多酚处理可以抑制PAL活性,0.5 g/L桑叶多酚处理抑制效果最好,是理想桑叶多酚浓度。而10 g/L桑叶多酚处理反而促进PAL活性。
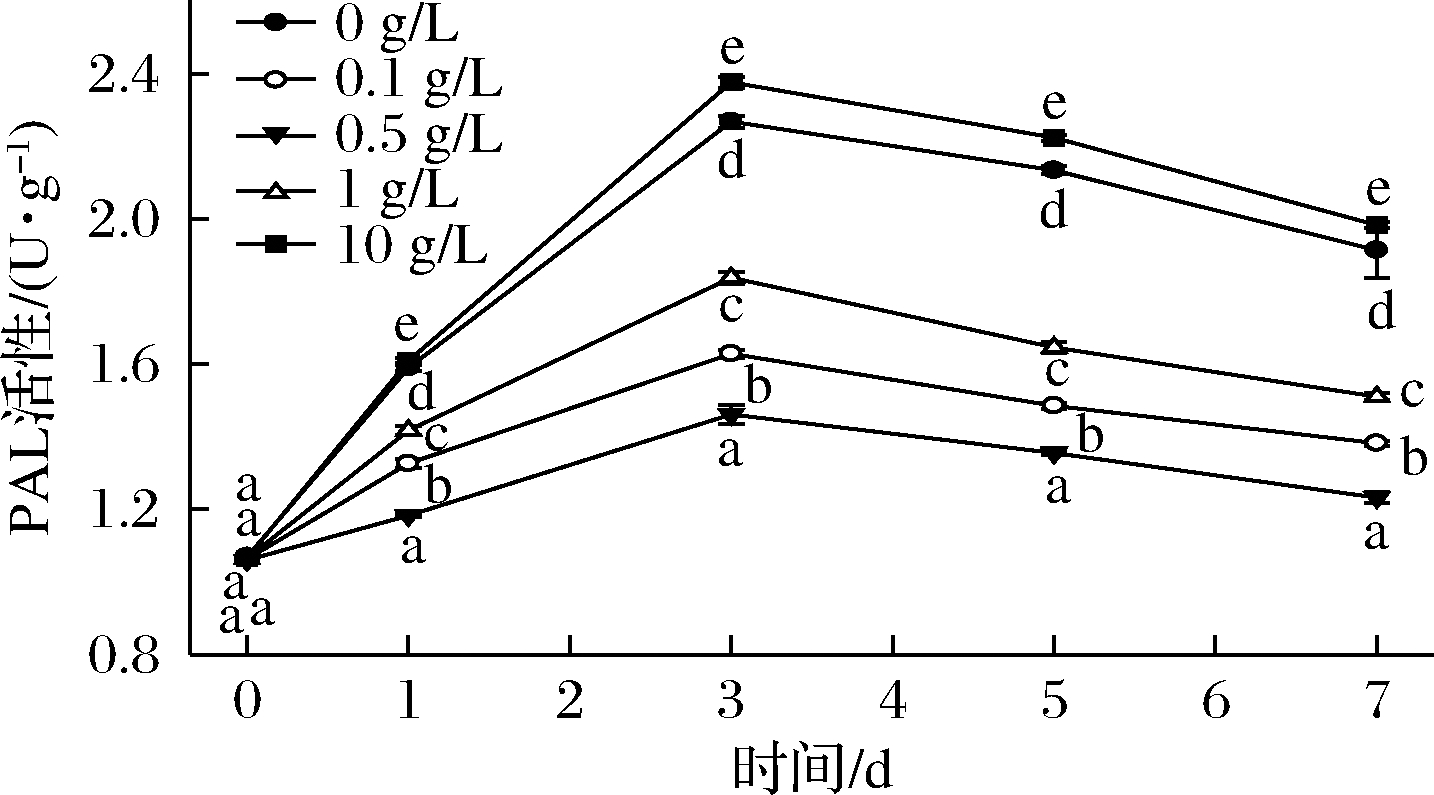
图6 不同浓度桑叶多酚对鲜切生菜PAL活性的影响
Fig.6 Effects of different concentrations of mulberry polyphenol on PAL activity of fresh-cut lettuce
2.5 不同浓度桑叶多酚对假单胞菌生长的抑制作用
由图7可知,各处理组的假单胞菌生长呈典型的S型曲线,有典型的延滞期、对数期和稳定期。在整个生长过程中,各浓度桑叶多酚处理均抑制了假单胞菌的生长,且桑叶多酚浓度越大抑制效果越强;在14~22 h差异性逐渐减小;在22~24 h,除10 g/L桑叶多酚处理与对照组有显著性差异(P<0.05)以外,其他处理组均无显著性差异。

图7 不同浓度桑叶多酚对假单胞菌生长的抑制作用
Fig.7 Inhibitory effects of different concentrations of mulberry polyphenol on the growth of Pseudomonas spp.
2.6 不同浓度桑叶多酚对假单胞菌在生菜上形成生物被膜的抑制作用
生物膜是紧密黏附于生物体表面并且难以去除的细菌团块与细胞外基质的复合体,该复合体通过细胞之间的相互作用紧密结合,稳定且难以除去[21]。生物膜抗逆性强,对外界环境及宿主免疫系统的耐受能力强且稳定,黏附于果蔬表面会使得果蔬易腐烂变质,所以生物膜是导致腐败菌持续污染食品的重要因素之一[22]。由图8可知,与对照组相比,各浓度桑叶多酚处理下假单胞菌生物膜量均低于对照组,其中0.5、1、10 g/L桑叶多酚处理假单胞菌生物膜量有显著性差异(P<0.05)。因此,桑叶多酚溶液处理可以有效抑制假单胞菌生物膜量,从而抑制其致腐能力,而且浓度越高,抑制效果越显著。
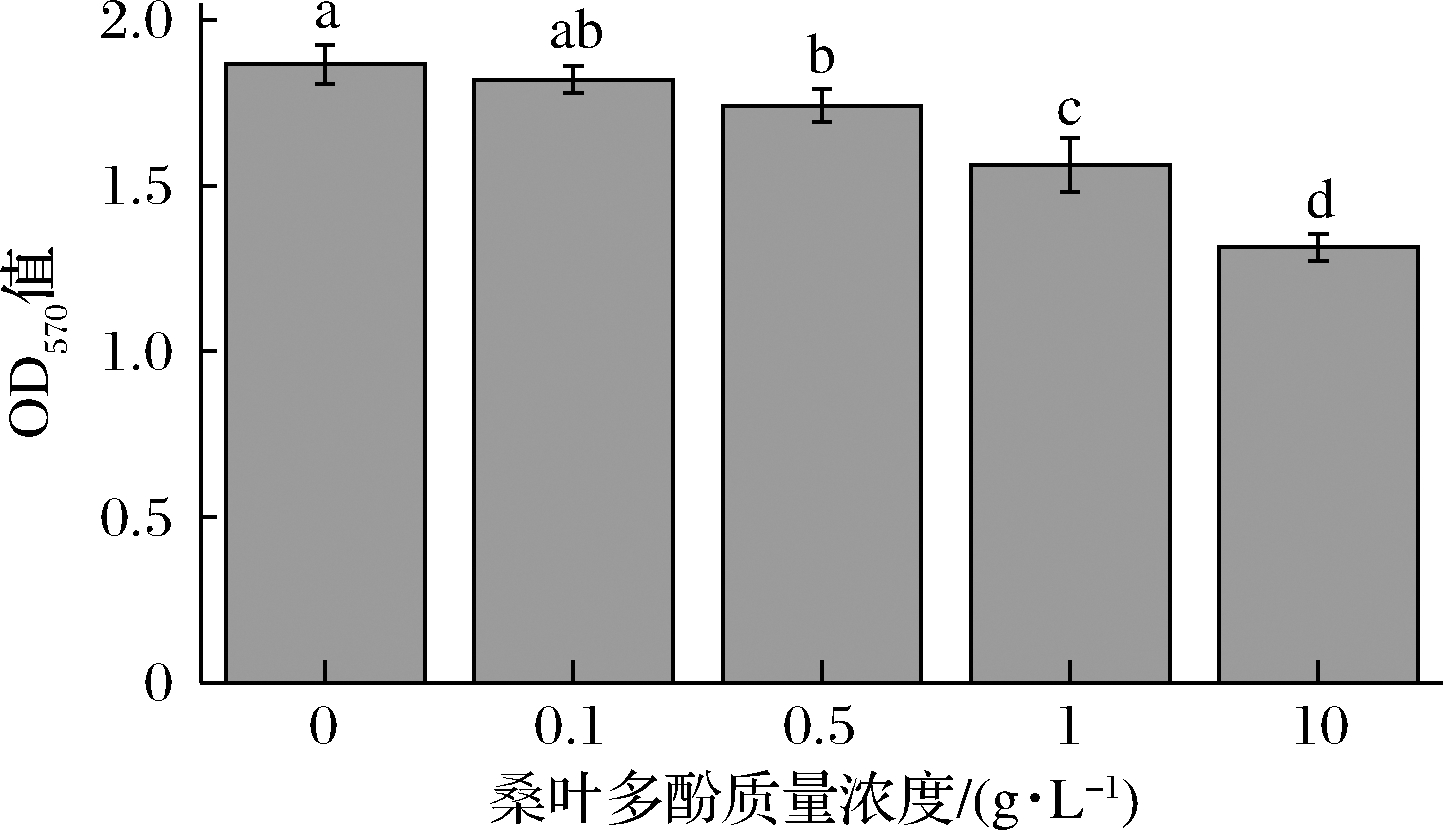
图8 不同浓度桑叶多酚对假单胞菌在生菜上形成生物 被膜的抑制作用
Fig.8 Inhibitory effects of different concentrations of mulberry polyphenol on biofilm formation of Pseudomonas spp.on lettuce
3 结论
本研究证明,桑叶多酚可以抑制鲜切生菜的褐变以及优势腐败菌的生长,进而有良好的保鲜效果。其中0.5 g/L桑叶多酚处理对鲜切生菜褐变抑制效果最佳,10 g/L桑叶多酚处理对假单胞菌抑制作用最佳。因此本研究进一步明确了桑叶多酚这种天然生物保鲜剂的适宜作用浓度,有望更好地根据实际需求加以运用。
[1] 胡叶静, 李保国, 张敏, 等.鲜切果蔬保鲜技术及方法研究进展[J].食品与发酵工业,2020, 46(22):276-281.
HU Y J, LI B G, ZHANG M, et al.Progresses on fresh-keeping techniques and methods of fresh-cut fruits and vegetables[J].Food and Fermentation Industries, 2020, 46(22):276-281.
[2] 何秉青, 祝宁, 齐长红, 等.生菜品种筛选试验[J].蔬菜, 2021(6):79-81.
HE B Q, ZHU N, QI C H, et al.Screening test of lettuce cultivars[J].Vegetables, 2021(6):79-81.
[3] LI L, YI P,LI C B, et al.Influence of polysaccharide-based edible coatings on enzymatic browning and oxidative senescence of fresh-cut lettuce[J].Food Science & Nutrition, 2021, 9(2):888-899.
[4] 王智荣. 荧光假单胞菌ZX生物防治采后锦橙青霉病和绿霉病研究[D].重庆:西南大学, 2019.
WANG Z R.Study on Biocontrol of blue and green mold decay in postharvest jincheng Citrus fruits by Pseudomonas fluorescens ZX[D].Chongqing:Southwest University, 2019.
[5] 李凤君, 刘娟, 单幼霞, 等.鲜切蔬菜保鲜技术的研究进展[J].食品安全质量检测学报,2019,10(20):6 909-6 920.
LI F J, LIU J, SHAN Y X, et al.Advances in postharvest technology of fresh-cut vegetables[J].Journal of Food Safety & Quality,2019,10(20):6 909-6 920.
[6] YU L, SHI H.Effect of two mulberry (Morus alba L.) leaf polyphenols on improving the quality of fresh-cut cantaloupe during storage[J].Food Control, 2021, 121:107624.
[7] 李彩云, 李洁, 严守雷, 等.果蔬酶促褐变机理的研究进展[J].食品科学, 2021, 42(9):283-292.
LI C Y, LI J, YAN S L, et al.Progress in research on the mechanism of enzymatic browning in fruits and vegetables[J].Food Science, 2021,42(9):283-292.
[8] 王超. 冰温下LED红蓝组合光照射对果蔬采后保鲜的研究[D].天津:天津商业大学, 2016.
WANG C.Study on postharvest preservation with red and blue LED light irradiation in hyo-on storage[D].Tianjin:University oh Commerce, 2016.
[9] PAN Y M, ZHU J C,WANG H S, et al.Antioxidant activity of ethanolic extract of cortex fraxini and use in peanut oil[J].Food Chemistry, 2007, 103(3):913-918.
[10] 甘志军, 王晓云.叶绿素酶的研究进展[J].生命科学研究, 2002,6(S1):21-24.
GAN Z J, WANG X Y.Advances in the studies on chlase[J].Life Science Research,2002,6(S1):21-24.
[11] 程哲,郭洪,胡俊君, 等.甜荞米中叶绿素、总酚、PPO与褐变的关系[J].中国粮油学报, 2020, 35(4):19-25.
CHENG Z, GUO H, HU J J, et al.Relationship between chlorophyll, total phenol, PPO and browning of dehulled common Buckwheat Seeds[J].Journal of the Chinese Cereals and Oils Association,2020 35(4):19-25.
[12] YORUK R, MARSHALL M R.Physicochemical properties and function of plant polyphenol oxidase:A review[J].Journal of Food Biochemistry, 2003, 27(5):361-422.
[13] 沈金玉, 黄家音, 李晓莉.果蔬酶促褐变机理及其抑制方法研究进展[J].食品研究与开发, 2005,26(6):150-156.
SHEN J Y, HUANG J Y, LI X L.Advances in research on mechanism of enzymatic browning and inhibition methods for fruits and vegetables[J].Food Research and Development, 2005(6):150-156.
[14] 谭谊谈, 曾凯芳.鲜切果蔬酶促褐变关键酶研究进展[J].食品科学, 2011,32(17):376-379.
TAN Y T, ZENG K F.Research progress in key enzymes for enzymatic browning of fresh-cut fruits and vegetables[J].Food Science, 2011, 32(17):376-379.
[15] 郁志芳. 鲜切芦蒿的品质和酶促褐变机理研究[D].南京:南京农业大学, 2005.
YU Z F.Studies on the quality and enzymatic browning mechanism of fresh-cut Artemisia selengensis[D].Nanjing:Nanjing Agricultural University, 2005.
[16] 高红豆, 胡文忠, 管玉格, 等.鲜切果蔬酚类物质的产生及其调控研究进展[J].食品工业, 2020, 41(4):212-216.
GAO H D, HU W Z, GUAN Y G, et al.The advances of the production and regulation in phenols of fresh-cut fruits and vegetables[J].The Food Industry,2020,41(4):212-216.
[17] AQUINO-BOLA OS E N,MERCADO-SILVA E.Effects of polyphenol oxidase and peroxidase activity, phenolics and lignin content on the browning of cut jicama[J].Postharvest Biology and Technology, 2004, 33(3):275-283.
OS E N,MERCADO-SILVA E.Effects of polyphenol oxidase and peroxidase activity, phenolics and lignin content on the browning of cut jicama[J].Postharvest Biology and Technology, 2004, 33(3):275-283.
[18] BARMNA K,SIDDIQUI M W,PATEL V B,et al.Nitric oxide reduces pericarp browning and preserves bioactive antioxidants in Litchi[J].Scientia Horticulturae.2014, 171:71-77.
[19] 寇莉萍, 刘兴华, 李金龙, 等.富士苹果果肉褐变对相关酶活性和膜质过氧化的影响[J].食品科学, 2004,25(5):179-182.
KOU L P, LIU X H, LI J L, et al.Changes of superoxidation and cell membrane permeability of “Fuji” flesh during browning development[J].Food Science, 2004,25(5):179-182.
[20] BANERJEE A, SUPRASANNA P,VARIYAR P S,et al.Gamma irradiation inhibits wound induced browning in shredded cabbage[J].Food Chemistry, 2015, 173:38-44.
[21] 杜宏, 吕欣然, 崔晓玲, 等.融合魏斯氏菌对单增李斯特菌生物膜形成的影响[J].食品研究与开发,2021,42(13):180-187.
DU H, LYU X R, CUI X L, et al.Effect of Weissella confusa on biofilm formation by Listeria monocytogenes[J].Food Research and Development, 2021, 42(13):180-187.
[22] 张玉华, 孟一, 王顺意, 等.外源AHLs信号分子对假单胞菌(Pseudomonas)致腐能力的影响[J].食品与发酵工业, 2020, 46(18):78-84.
ZHANG Y H, MENG Y, WANG S Y, et al.Effect of exogenous AHLs signal molecules on the spoilage ability of Pseudomonas[J].Food and Fermentation Industries, 2020, 46(18):78-84.