黄曲霉毒素M1(aflatoxin M1,AFM1)是哺乳类动物摄入被黄曲霉毒素 B1(aflatoxin B1,AFB1)污染的粮食或饲料后在动物体内产生的代谢产物,具有剧毒性和强致癌性[1],被认定为I类致癌物[2],是乳及乳制品中重点监控的真菌毒素,在乳及乳制品中的污染情况时有发生。MIN等[3]对我国十个省份的原料奶进行抽样调查,发现江苏地区部分原料奶中AFM1的污染浓度接近国家限量标准,对婴幼儿有较大危害。郭耀东等[4]调查发现陕西地区2~4岁的儿童对AFM1有很高的摄入量。而在南亚及非洲地区AFM1在牛奶中有较高的污染量,常高于0.5 μg/L[5]。国内外对乳及乳制品中AFM1的限量制定了严格的标准。欧盟规定鲜奶、高温消毒奶及奶制品中 AFM1的含量不能超过0.05 μg/kg,婴幼儿配方乳品中 AFM1限量标准为 0.025 μg/kg[1],我国规定牛奶和婴幼儿奶粉中 AFM1的最大限量标准为0.5 μg/kg[6]。因此,高灵敏度、高准确性的AFM1检测技术的研究与完善对保障乳品安全具有重要意义。
目前AFM1快速检测方法主要有免疫亲和层析法 (immunoaffinity chromatography,IAC)[7-8]、酶联免疫吸附法(enzyme linked immunesorbent assay,ELISA)[9]等,这些方法操作简单、快速,但是抗体的制备成本高,而且稳定性较差[3]。相比于抗体,适配体制备成本低,周期短,且具有很好的灵敏度,对目标物也有良好的特异性,在食品安全检测、环境监测等领域得到迅速发展。近年来,越来越多的科研工作者关注基于适配体构建的传感器[10-13]。BEN-AISSA等[14]以二茂铁(ferrocence,Fc)为信标物质,当AFM1的适配体识别测定AFM1时会引起适配体构象的改变,从而导致Fc探针电信号发生变化,以阻抗值为测定指标可灵敏检测牛奶样品中的AFM1。JALALIAN等[15]以亚甲基蓝为电流信号物质,AFM1可使AFM1适配体的发夹结构解体,此时AFM1适配体互补链修饰的金纳米颗粒因两段适配体的互补配对接近电极表面,使得亚甲基蓝的电流信号发生变化,实现对AFM1的检测。KULIKOVA等[16]在玻碳电极上沉积聚苯胺,固定AFM1适配体之后,存在AFM1时引起适配体构象的变化从而使聚苯胺活性发生变化,并通过电信号表现出来。然而,已有研究表明,适配体的构象不稳定,很可能折叠成一些非特异性的二级结构,这将极大地阻碍适配体与靶标物的特异性识别,从而产生假阳性或非特异性信号[17]。
现有研究发现,完整的适配体劈裂成2个或2个以上片段以后,仍然可以在靶标物的作用下形成特定构象实现对靶标物的识别[18-23],能够有效解决适配体动态柔性结构造成的假阳性问题。因此,本研究以AFM1为目标物,采用劈裂适配体的方式解决假阳性问题,同时利用双信号提高传感器的灵敏度,构建基于劈裂适配体的双信号电化学传感器,实现牛奶中AFM1准确高灵敏度检测。
1 材料与方法
1.1 材料与试剂
铁氰化钾、亚铁氰化钾、氯化钾,上海麦克林生化科技有限公司;适配体序列(S1:5′-SH C6-ACTGCTAGAGA-3′;CS1:5′-Fc-TCTCTAACAGT-3′;S2:5′-MB-TTTTCCACAT-3′)、PBS缓冲液(pH=7.4),上海生工生物工程有限公司;磷酸三氯乙酯(trichloroethyl phosphate, TCEP),上海阿拉丁有限公司;6-巯基乙醇(6-mercaptoethanol, MCH),上海阿达玛斯试剂有限公司;纯牛奶(250 mL)、脱脂牛奶(1 L),购于重庆本地超市。所用试剂均为分析纯,试验用水为超纯水。
1.2 仪器与设备
电化学工作站CHI600E、三电极系统(参比电极:CHI111银/氯化银,对电极:CHI115铂丝电极,工作电极:CHI101金电极),上海辰华仪器有限公司;氮吹仪,常州朗越仪器制造有限公司;离心机,赛默飞世尔科技公司;超微量分光光度计,德国凯傲集团。
1.3 实验方法
1.3.1 金电极的预处理
先后用直径为0.3、0.05 μm氧化铝颗粒的水浆打磨金电极至表面光滑,然后依次用乙醇和水进行超声清洗。然后将电极浸入食人鱼溶液V(H2SO4)∶V(H2O2)=3∶1中浸泡10 min,用水冲洗,氮吹干燥。最后在0.5 mol/L H2SO4中,以0.1 V/s的扫描速度,扫描电位为-0.2~1.6 V,进行扫描,循环40次,对金电极进行电化学抛光。将清洗好的金电极用水洗净,氮气吹干,待用。
1.3.2 基于劈裂适配体的电化学传感器的构建
10 μL S1 (10 μmol/L)溶液在10 μL TCEP(1 mmol/L)溶液中孵育1 h,用PBS(pH=7.4)稀释至200 μL,得到终浓度为0.5 μmol/L的S1溶液。将上述溶液置于2.5 mL的离心管中,然后将金电极浸入该溶液16 h,使得S1通过Au-S键固定在电极表面。使用上述电极前用氮气吹干,将电极浸没在1 mmol/L MCH溶液中。然后用PBS(pH=7.4)洗涤,氮气吹干后,将电极浸没在0.5 μmol/L的CS1溶液中,进行1 h杂交反应。传感器平台建立完成。取10 μL适配体S2(10 μmol/L)溶液,用PBS(pH=7.4)稀释至200 μL,向适配体溶液加入一定浓度的AFM1,然后将建立的传感器浸入上述溶液1.5 h。将每一步修饰过的电极放在含有 5.0 mmol/L 铁氰化钾{[Fe(CN)6]3-/4-}、0.1 mol/L KCl 的溶液中,采用循环伏安法(cyclic voltammetry, CV)和电化学阻抗法(elecctrochemical impedance spectroscopy, EIS)扫描表征。最后使用方波伏安法(square wave voltammetry, SWV)记录Fc与亚甲基蓝(methylene blue, MB)的电信号变化,在PBS(pH=7.4)中进行检测,扫描速率为0.1 V/s,扫描电位为-0.6~0.8 V。
1.3.3 实际样品的检测
将不同浓度的AFM1标准品添加到空白样品,将牛奶样品用PBS(pH=7.4)稀释,斡旋混匀后,高速离心并收集上清液,通过建立的 AFM1 电化学适配体传感器进行检测。
1.3.4 数据统计与分析
相关数据,使用Microsoft Office Excel 2019进行统计,并计算平均值和标准偏差,使用SPSS 22.0对数据进行方差分析(ANOVA),使用Duncan′s 多重比较进行显著性分析,P<0.05表示差异显著。使用Origin 2021进行绘图。
2 结果与分析
2.1 传感器的检测原理
本研究以AFM1为目标物,构建基于劈裂适配体的双信号电化学传感器,其检测原理如图1所示。将AFM1适配体劈裂成两段(S1和S2),S1修饰巯基,S2修饰MB作为传感信号,S1的互补链CS1修饰Fc作为另一传感信号。试验中首先通过Au-S键将S1固定在电极表面。为了避免其他物质的非特异性吸附,用MCH溶液封闭电极表面多余的电位。体系中不存在AFM1时,S1与CS1形成双链结构,只产生Fc的信号值(曲线a)。当体系中加入AFM1后,S1与CS1形成的双链解开,CS1被释放,S1与S2共同作用识别AFM1,此时Fc信号减弱,MB信号增强(曲线b)。
2.1.1 AFM1双信号电化学适配体传感器的构建
以 5.0 mmol/L [Fe(CN)6]3-/4-(含 0.1 mol/L KCl)为电解液,采用CV及EIS监测AFM1双信号电化学传感器的构建(图2)。从图2-A中可以看出,与裸金电极(曲线a)相比,当S1固定在电极表面后,S1阻碍了电子在电极表面的传递,氧化还原电流峰值降低(曲线b);传感器的表面孵育MCH溶液后,金电极表面多余的电位被封闭,阻碍电子的传递,氧化还原电流峰值继续降低(曲线c);在体系中加入CS1后, CS1与S1结合,固定在电极表面之后,氧化还原电流峰值继续降低(曲线d)。最后加入S2与AFM1,CS1被释放,S1与S2形成一定构象识别AFM1,AFM1覆盖在电极表面,电极表面的电子传递进一步被阻碍,氧化还原电流的峰值进一步降低(曲线e)。由CV表征结果可知,电化学传感器成功制备,并且可以有效识别AFM1。

图1 传感器的传感机理
Fig.1 Illustration of sensor
EIS表征(图2-B)进一步验证双信号电化学传感器的成功构建。裸金电极(曲线a)的奈奎斯特曲线高频区半圆的直径较小,表明在裸电极表面电子转移的速度很快;修饰S1后,由于电子传递被S1阻碍,直径增加(曲线b);加入MCH后,直径进一步增加(曲线c);之后加入CS1,CS1与S1结合形成双链,阻碍电子传递,直径增加(曲线d)。最后加入S2与AFM1,AFM1被识别覆盖在电极表面,进一步阻碍电子传递,直径进一步增加(曲线e)。这个结果与CV结果相一致,都证明了双信号电化学传感器已成功制备。
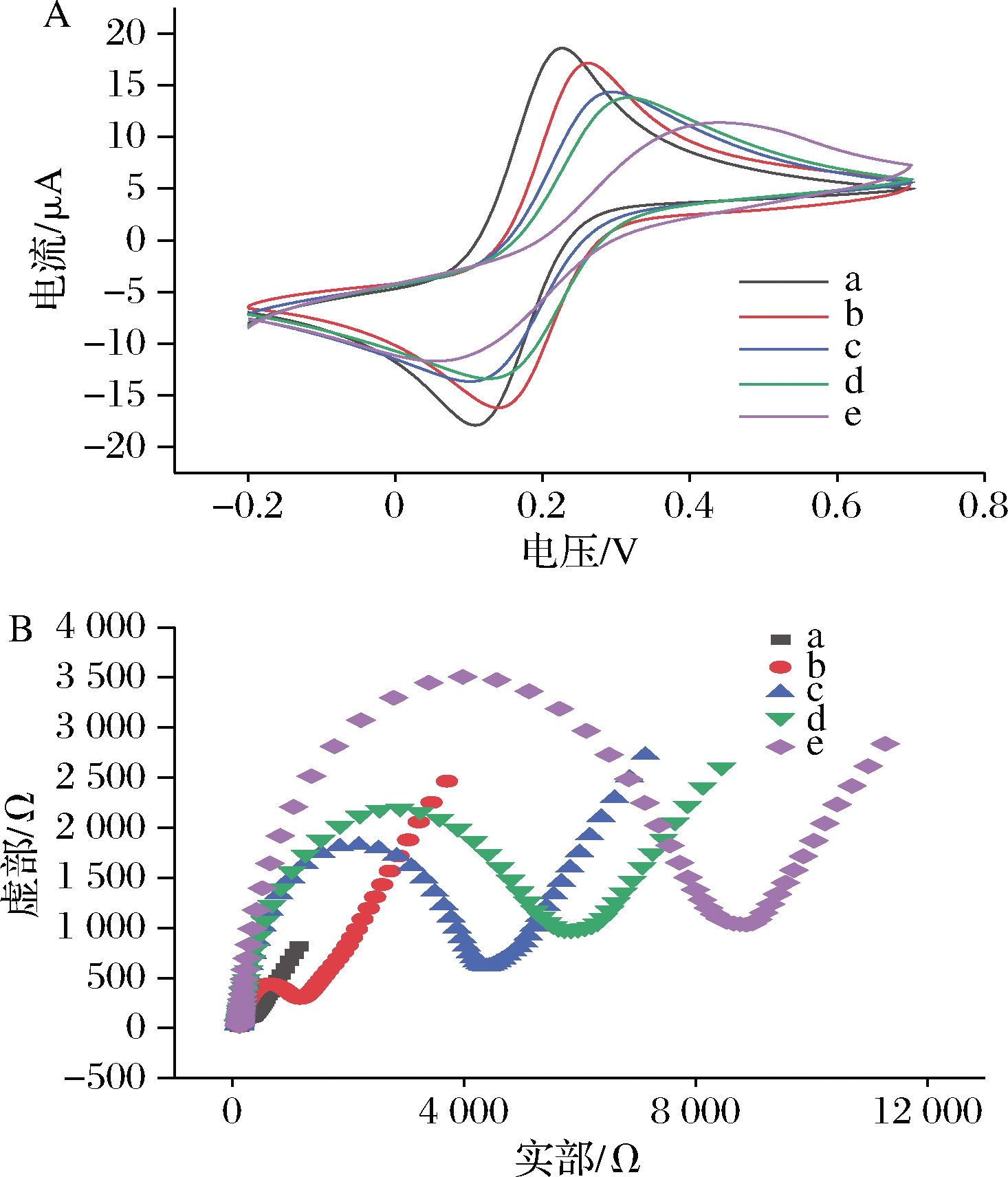
a-裸金电极;b-裸金电极/S1;c-裸金电极/S1/MCH; d-裸金电极/S1/MCH/CS1;e-裸金电极/S1/MCH/CS1/S2+AFM1 A-CV表征;B-EIS表征
图2 电化学适配体传感器构建过程的CV和EIS表征
Fig.2 Cyclic voltammetric characterization and electrochemical impedance spectroscopy of constructing electrochemical aptamer sensor
2.2 构建传感器的条件优化
为了获得性能优异的电化学传感器,本研究以Fc与MB电流信号的比值(IMB/IFc)为评价指标研究适配体片段S1浓度和孵育时间对传感器的影响。固定在金电极表面的S1浓度会严重影响传感器的性能,较低的浓度可能导致传感器对目标的检测灵敏度不高,而高浓度S1会引起空间位阻和静电斥力,同样会导致灵敏度降低。固定孵育时间为1.5 h,探究不同S1浓度对传感器检测性能的影响。由图3-A可知,S1的浓度在0.5 μmol/L时,IMB / IFc达到最大值,表明此浓度下的检测效果最好。对数据进行统计发现,0.1、0.3、0.5 μmol/L存在显著差异,浓度>0.5 μmol/L之后并不存在显著性差异。因此,后续试验选择0.5 μmol/L。另外,传感体系与目标物的孵育时间也是一个重要的影响因素。若孵育时间较短,劈裂适配体不能完全识别AFM1,影响检测灵敏度。因此固定S1的浓度为0.5 μmol/L,探究不同孵育时间对传感器检测性能的影响。由图3-B可知,S1的浓度为0.5 μmol/L时,随着孵育时间的增加,IMB/IFc逐渐增大,孵育1.5 h后, IMB/IFc达到最大值。对图中组数据进行统计分析发现,0.5、1、1.5 h存在显著差异,1.5 h之后的结果不存在显著性差异。因此,选择1.5 h孵育时间进行后续实验。
2.3 传感器性能
2.3.1 线性范围和检测限
在上述最优实验条件下,研究双信号电化学传感器的传感性能。由图4-A可以看出,随着AFM1质量浓度的增大,MB信号逐渐增加,而Fc信号逐渐降低。这是因为S1与CS1形成的双链解开,CS1释放在溶液中,而S1与S2共同识别AFM1,S2被固定在电极表面,游离的S2减少。图4-B表明,AFM1质量浓度为0.050~0.800 μg/L时,IMB/IFc值与AFM1质量浓度呈线性关系,符合线性方程IMB/IFc=7.734×C-0.064,C为AFM1浓度,决定系数R2=0.994,其检测限为0.015 μg/L。图4-C显示了Fc或MB信号的变化图,可以看到以MB或Fc单信号进行检测,只有在AFM1质量浓度为0.050~0.200 μg/L时,IMB值才与AFM1的浓度才有较好的线性关系。IFc值也是如此。由此可以看出采用双信号策略对AFM1检测得到的线性范围好于单信号策略。
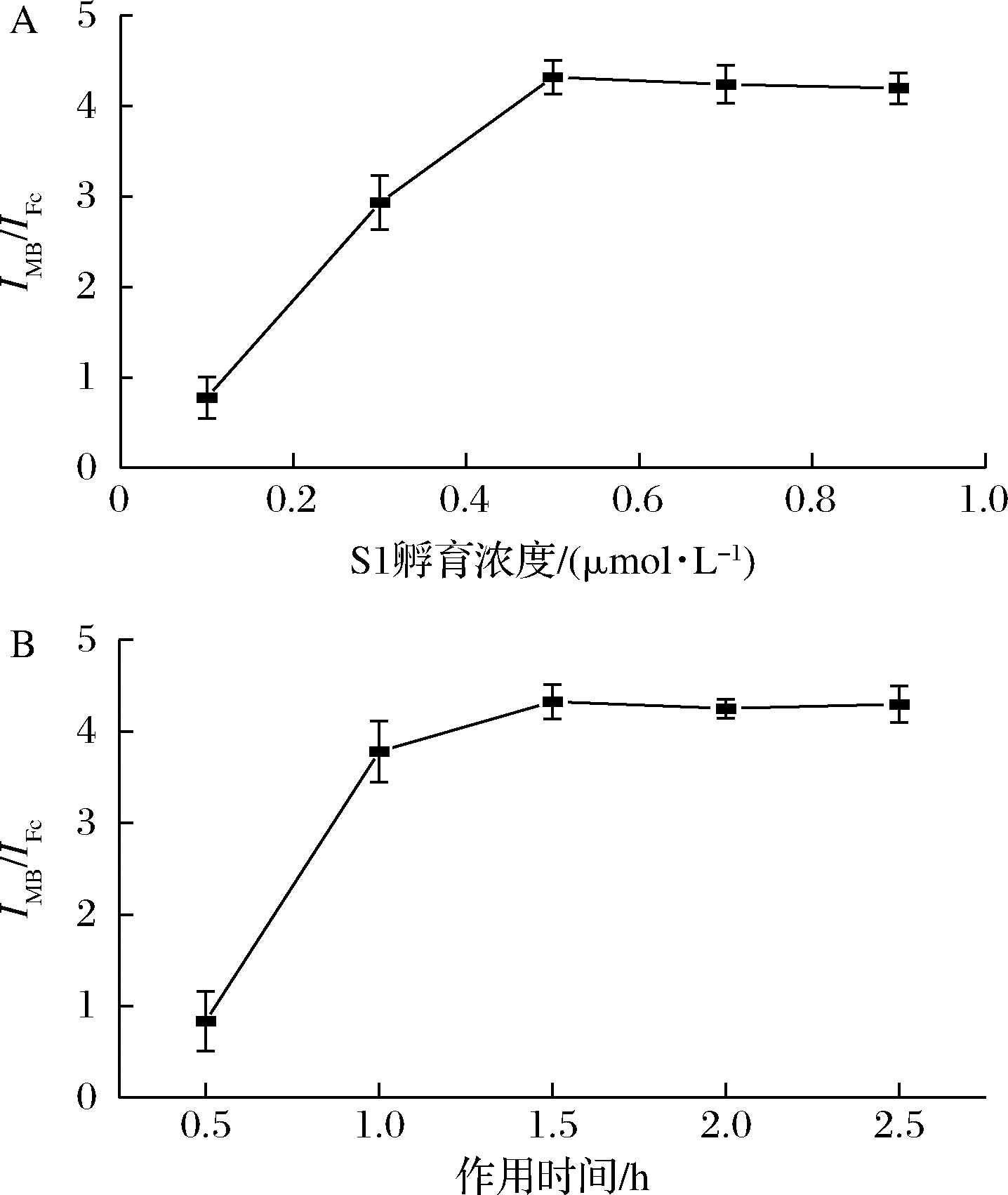
A-S1孵育浓度;B-作用时间
图3 不同修饰条件下的IMB/IFc值的
Fig.3 Values of IMB/IFcunder different modification conditions
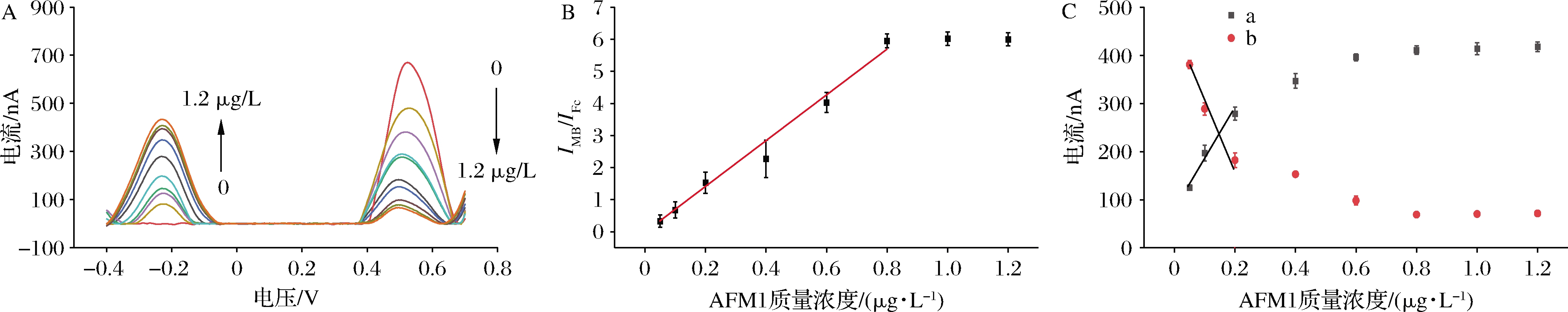
A-AFM1浓度与SWV电流峰值的关系(AFM1质量浓度为0、0.05、0.1、0.2、0.4、0.6、0.8、1.0、1.2 μg/L);B-不同AFM1浓度下 IFc/IMB的变化;C-不同AFM1浓度下MB与Fc电流峰值的变化
图4 AFM1浓度对电流信号的影响
Fig.4 Influence of AFM1 concentration on current signal
2.3.2 选择性
为了研究传感器的选择性,本研究以AFM1、AFM2、AFB1、AFG1、AFG2以及以上几种毒素的混合液(AFM1、AFM2、AFB1、AFG1、AFG2)为对象考察该传感器的选择性。结果如图5 所示,当加入0.2 μg/L AFM1时,IMB/IFc显著增加。加入同等浓度的对照毒素时IMB/IFc远远低于AFM1存在时的比值。结果表明本研究所构建的传感器对 AFM1有较好的选择性。
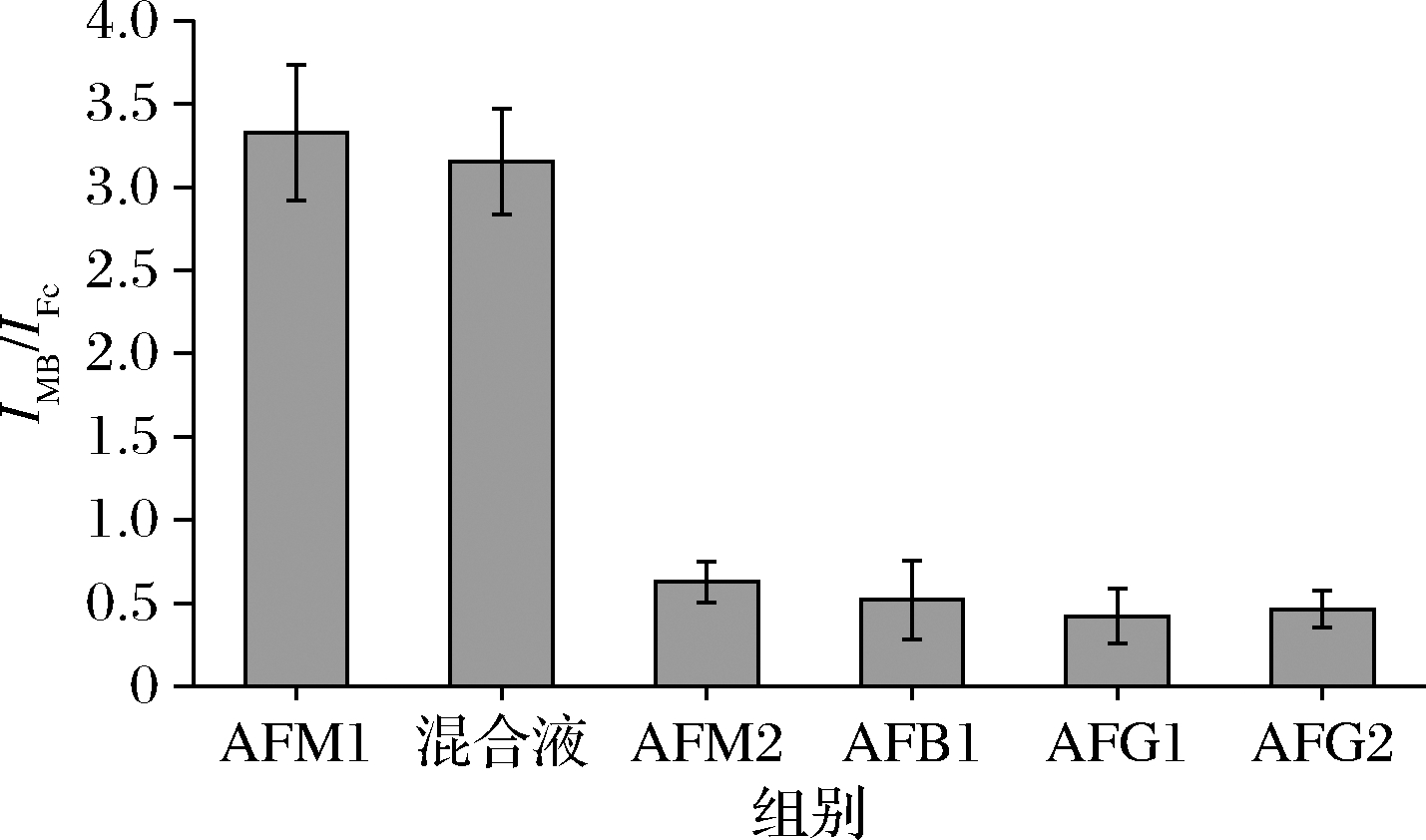
图5 不同毒素的电化学响应情况对比
Fig.5 Comparison of electrochemical response values of different toxins
2.3.3 实际样品检测
选取纯牛奶和脱脂牛奶为实际样品进行加标回收研究,并与单信号电化学传感器的检测结果进行对比。在两种样品中分别加入3种不同浓度的 AFM1,经过样品处理后,使用单信号电化学传感器的加标回收率在76.28%~121.78%,而该双信号电化序传感器检测的加标回收率在87.18%~105.32%,相对标准偏差(relative standard deviation, RSD)均在10%以下,检测效果优于单信号电化学传感器,结果如表1 所示。这说明该双信号电化学传感器可用于真实复杂样品中AFM1的测定。
表1 样品加标回收试验
Table 1 Recovery test of AFM1 added to different samples
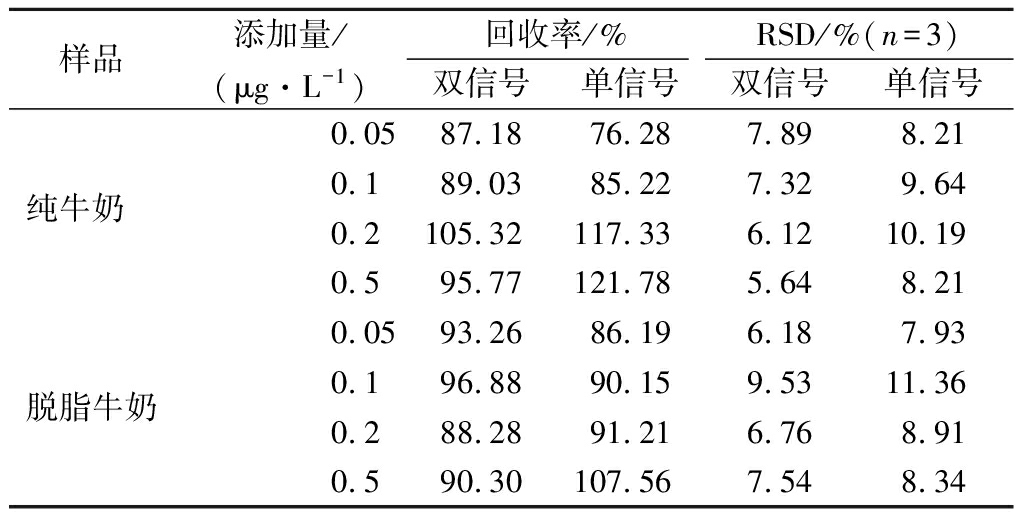
样品添加量/回收率/%RSD/%(n=3)(μg·L-1)双信号单信号双信号单信号0.0587.1876.287.898.21纯牛奶 0.189.0385.227.329.640.2105.32117.336.1210.190.595.77121.785.648.210.0593.2686.196.187.93脱脂牛奶0.196.8890.159.5311.360.288.2891.216.768.910.590.30107.567.548.34
3 结果与讨论
适配体结构的动态柔性特点限制了适配体在传感技术中的应用,针对这个问题,本研究将完整的一段AFM1适配体劈裂成较短的两段,分别修饰两种不同的信号物质,通过两种信号物质产生的信号反应AFM1的浓度,成功建立检测AFM1的单信号和双信号电化学传感器,而且发现双信号电化学传感器的检测性能明显优于单信号电化学传感器。在最优条件下,双信号电化学传感器的线性范围为0.050~0.800 μg/L,检测限为0.015 μg/L。且在实际样品检测中同样表现出较好的效果,说明本检测方法在食品安全检测中具有较强的实用性,同时,为解决适配体的稳定性提供了一种方法。
[1] MOLLAYUSEFIAN I, RANAEI V, PILEVAR Z, et al.The concentration of aflatoxin M1 in raw and pasteurized milk:A worldwide systematic review and meta-analysis [J].Trends in Food Science & Technology, 2021, 115:22-30.
[2] ROOHI R, HASHEMI S M B, MOUSAVI KHANEGHAH A, et al.Kinetics and thermodynamic modelling of the aflatoxins decontamination:A review[J].International Journal of Food Science and Technology, 2020, 55(12):3 525-3 532.
[3] MIN L, TONG X, SUN H, et al.Aflatoxin M1 contamination in raw milk and its association with herd types in the ten provinces of Southern China[J].Italian Journal of Animal Science, 2021, 20(1):1 562-1 567.
[4] 郭耀东,韩晓江,彭诗媛,等.陕西市售液态牛奶中黄曲霉毒素M1污染水平分析及风险评估[J].西北农林科技大学学报(自然科学版),2020, 48(5):131-137.
GUO Y D, HAN X J, PENG S Y, et al.Occurrence and risk assessment of aflatoxin M1 in commercial milk in Shaanxi[J].Journal of Northwest A & F University(Natural Science Edition), 2020, 48(5):131-137.
[5] SAHA TURNA N, WU F.Aflatoxin M1 in milk:A global occurrence, intake, & exposure assessment[J].Trends in Food Science & Technology, 2021, 110:183-192.
[6] 中华人民共和国国家卫生和计划生育委员会;国家食品药品监督管理总局.GB 2761—2017 食品安全国家标准 食品中真菌毒素限量[S].北京:中国标准出版社,2017.
[7] WU C H, LIU D F, PENG T, et al.Development of a one-step immunochromatographic assay with two cutoff values of aflatoxin M1[J].Food Control, 2016, 63:11-14.
[8] WOOD J E, GILL B D, INDYK H E, et al.Determination of aflatoxin M1 in liquid milk, cheese, and selected milk proteins by automated online immunoaffinity cleanup with liquid chromatography-fluorescence detection[J].Journal of Aoac International, 2021, 104(3):719-724.
[9] LIU B H, CHU K C,YU F Y, et al.Novel monoclonal antibody-based sensitive enzyme-linked immunosorbent assay and rapid immunochromatographic strip for detecting aflatoxin M1 in milk[J].Food Control, 2016, 66:1-7.
[10] ZHANG K, LI H Y, WANG W J, et al.Application of multiplexed aptasensors in food contaminants detection[J].ACS sensor, 2020, 5(12):3 721-3 738.
[11] DIAZ-FEMANDEZ A, LORENZO-GOMEZ R, RMIRANDA-CASTRO R, et al.Electrochemical aptasensors for cancer diagnosis in biological fluids-A review[J].Analytica Chimica Acta, 2020, 1 124:1-19.
[12] YOUSEFI M, DEHGHANI S, NOSRATI R, et al.Aptasensors as a new sensing technology developed for the detection of MUC1 mucin:A review[J].Biosensors & Bioelectronics, 2019, 130:1-19.
[13] LI F Q, YU Z G, HAN X D, et al.Electrochemical aptamer-based sensors for food and water analysis:A review [J].Analytica Chimica Acta, 2019, 1 051:1-23.
[14] BEN-AISSA S, MARS A, N RAOUAFI N, et al.Design of a redox-active surface for ultrasensitive redox capacitive aptasensing of aflatoxin M1 in milk [J].Talanta, 2019, 195:525-532.
[15] JALALIAN S H, RAMEZANI M, DANESH N M, et al.A novel electrochemical aptasensor for detection of aflatoxin M1 based on target-induced immobilization of gold nanoparticles on the surface of electrode[J].Biosensors & Bioelectronics, 2018, 117:487-492.
[16] KULIKOVA T N, PORFIREVA A V, EVTUGYN G A, et al.Electrochemical aptasensor with layer-by-layer deposited polyaniline for aflatoxin M1 voltammetric determination[J].Electroanalysis,2019, 10(31):1 931-1 924.
[17] DEBIAIS M, LELIEVRE A, SMIETANA M, et al.Splitting aptamers and nucleic acid enzymes for the development of advanced biosensors[J].Nucleic Acids Research, 2020, 48(7):3 400-3 422.
[18] YUAN B, GUO L, YIN K, X, et al.Highly sensitive and specific detection of tumor cells based on a split aptamer-triggered dual hybridization chain reaction[J].Analyst, 2020, 145:2 676-2 681.
[19] CHANG C C, YEH C Y, Using simple-structured split aptamer for gold nanoparticle based colorimetric detection of estradiol[J].Analytical Sciences, 2021,37:479-484.
[20] CORIA-ORIUNDO L L, CERETTI H, ROUNPIOZ Y, F, et al.Redox polyelectrolyte modified gold nanoparticles enhance the detection of adenosine in an electrochemical split-aptamer assay[J].Chemistryselect, 2020, 5:11 391-11 398.
[21] LUO Y P, YU H X, LIU Y Z, et al.Label-free, visual detection of small molecules using highly target-responsive multimodule split aptamer constructs[J].Analytical Chemistry, 2019, 19(11):7 199-7 207.
[22] ZHANG H, QIAO B, GUO Q Q, J.et al.A facile and label-free electrochemical aptasensor for tumour-derived extracellular vesicle detection based on the target-induced proximity hybridization of split aptamers[J].Analyst, 2020, 145:3 557-3 563.
[23] WANG R Y, WU X Q, ZHU X Y, et al.A photoregulated split aptaswitch for small molecules with improved sensitivity[J].Chemical Communication, 2019, 55(64):9 555-9 558.