糖含量高低是决定果汁品质重要指标之一,也是果汁中重要的营养成分和风味成分[1-2],糖类分子不但负担着能源和结构支架的职能,而且作为信息分子,在细胞黏着、细胞信号转导、发育分化、免疫细胞成熟活化、生殖受精,以及共生寄生等一系列维持生命所需的重要生理过程中,起着介导和调节作用[3]。果汁中主要的糖类包括果糖、葡萄糖和蔗糖[4]。GB/T 21731—2008《橙汁及橙汁饮料》等果汁质量标准中均对果糖、葡萄糖、蔗糖含量做了明确规定。所以准确测定果汁中的果糖、葡萄糖、蔗糖的含量对于研究果汁的品质具有重要的意义。
通常总糖的测定方法均是先利用酸水解法使没有还原的双糖和多糖彻底水解成有还原性的单糖,再利用还原糖的测定方法来测总糖的含量[5-7]。但总糖的测定方法无法对单糖含量准确测定,且前处理步骤繁琐,测试耗时长。高效液相色谱法、高效毛细管电泳法虽然可对葡萄糖、果糖、蔗糖单项含量进行准确测定,但涉及的条件多,操作复杂,耗时也较长[8-10]。而且,这些常规技术一般无法实现对同一样品中多种成分的同时测定,检出限和定量限也相对较高。
目前核磁共振(nuclear magnetic resonance,NMR)在饮料及其他食品方面的定性定量应用越来越广泛[11-15],此种方法前处理简单测试用时少,可提供复杂基质体系中多种物质的结构信息,并能够同时实现多种物质的定量测定。除定性定量检测外,NMR谱还可用于非目标指纹谱图检测技术[16],如用于食品类别、非法掺假、产地检测等。但定性定量的目标性检测目前还是NMR的主要应用,2017年ACKERMANN等[17]通过使用基于PULCON原理的外标定量法,同时定量分析了糖、调味料、甜味剂、有机酸、乙醇、维生素和氨基酸等11种化合物,回收率在80%~106%,样品制备和分析仅需25 min,相比常规方法有非常明显的优势。基于此,本研究旨在开发水峰压制的1H NMR内标法及外标法定量检测技术,实现果汁中主要糖类物质(葡萄糖、果糖、蔗糖)快速、同步、准确定性定量测定,同时为建立果汁NMR指纹图谱真实性鉴别技术奠定良好基础。
1 材料与方法
1.1 材料与试剂
柠檬酸(99%)、蔗糖(99%),Vetec公司;果糖(99%)、葡萄糖(99.5%),Sigma公司;邻苯二甲酸氢钾(99%),北京百灵威科技有限公司;3-(三甲基硅基)氘代丙酸钠[2,2,3,3-d(4)-3-(trimethylsilyl)propionic acid sodium salt, TSP,98%]、KH2PO4(98%),CIL公司;叠氮化钠(NaN3,高纯),Biotopped公司;D2O(99.9%),青岛腾龙微波科技有限公司;各类水果及果汁样品,部分由国投中鲁果汁股份有限公司提供,部分购自某电商平台(包括各类桃、苹果、梨、橙子及其果汁)。
1.2 仪器与设备
Bruker Avance III HD 400 MHz波谱仪、Bruker pH自动调节装置BTpH、Bruker SampleJet 5 mm高通量核磁管,Bruker Biospin,Rheinstetten公司;Bruker 579位自动进样器,SampleJet;AB204-N天平,METTLER TOLEDO公司;KH19A离心机,北京雷勃尔离心机有限公司。
1.3 实验方法
1.3.1 缓冲溶液、外标、内标溶液及标准工作液的配制
缓冲溶液配制:用天平准确称取0.13 g NaN3和1.0 g TSP于10 mL容量瓶中,用D2O将其溶解并准确定容至10 mL,得到100 g/L TSP溶液和13 g/L NaN3溶液。准确称取8.0 g KH2PO4,转移至200 mL容量瓶中,加入100 mL D2O将其溶解,然后加入5 mL 磷酸以及2 mL 100 g/L TSP溶液和13 g/L NaN3溶液,最后再加入50 mL D2O。24 h后,准确测定该缓冲溶液pH值,若pH>2.0,则加入少量磷酸调整,若pH<2.0,则加入KH2PO4固体粉末,直至pH稳定在2.0±0.02。
内标液配制:称取100 mg(精确至0.1 mg)邻苯二甲酸氢钾于10 mL容量瓶中,用重水定容,混匀。0~4 ℃密封保存。
外标液配制:称取20.0 mg(精确至0.1 mg)柠檬酸至10 mL容量瓶,用蒸馏水定容,混匀。0~4 ℃密封保存。取800 μL柠檬酸溶液,再加入200 μL缓冲液,取600 μL于核磁管中待测。
果糖标准溶液配制:准确称取400 mg果糖标准品于烧杯中,加入适量蒸馏水,待其完全溶解后,转移至10 mL容量瓶中并用蒸馏水定容,摇匀后得到质量浓度为40 g/L的果糖标准溶储备溶液。再用蒸馏水逐级稀释,配制成质量浓度分别为40.0、20.0、10.0、5.0、2.5、1.25、0.625 g/L的果糖标准溶液。移液枪取800 μL标准溶液,加入100 μL缓冲溶液和100 μL邻苯二甲酸氢钾内标液,移取600 μL与核磁管中测定。
葡萄糖标准溶液配制:准确称取400.0 mg葡萄糖标准品于烧杯中,加入适量蒸馏水,待其完全溶解后,转移至10 mL容量瓶中并用蒸馏水定容,摇匀后得到质量浓度为40 g/L的葡萄糖标准储备溶液。再用蒸馏水逐级稀释,依次配制成质量浓度分别为40.0、20.0、10.0、5.0、2.5、1.25、0.625 g/L的葡萄糖标准溶液。移液枪取800 μL标准溶液,加入100 μL缓冲溶液和100 μL邻苯二甲酸氢钾内标液,移取600 μL于核磁管中测定。
蔗糖标准溶液配制:准确称取400.0 mg蔗糖标准品于烧杯中,加入适量蒸馏水,待其完全溶解后,转移至10 mL容量瓶中并用蒸馏水定容,摇匀后得到质量浓度为40.0 g/L的葡萄糖标准储备液溶。再用蒸馏水逐级稀释,依次配制成质量浓度分别为40.0、20.0、10.0、5.0、2.5、1.25、0.625 g/L的葡萄糖标准溶液。用移液枪取800 μL标准溶液,再加入100 μL缓冲溶液和100 μL邻苯二甲酸氢钾内标液,移取600 μL于核磁管中测定。
1.3.2 水果、澄清果汁、不澄清果汁及浓缩果汁上机样品制备
水果样品:选取新鲜、饱满、无病斑、无划痕的水果(包括各类桃、苹果、梨、橙子),去除果皮和果核后榨汁,经3层纱布过滤后,保留滤液。取3 mL滤液于5 mL 离心管中,8 000 r/min离心10 min,保留上清液待用,用0.45 μm水系微孔滤膜过滤至样品瓶中,取800 μL,再加入100 μL缓冲溶液和100 μL邻苯二甲酸氢钾内标液,充分摇匀,取600 μL于核磁管中待测。
澄清果汁样品:取800 μL果汁样品,再加入100 μL 缓冲溶液和100 μL邻苯二甲酸氢钾内标液,充分摇匀,取600 μL于核磁管中待测。
不澄清果汁样品:取果汁样品于离心管中,6 000 r/min 离心10 min,取上清液,再用0.45 μm水系微孔过滤膜过滤至样品瓶,再取800 μL,加入100 μL 缓冲溶液和100 μL邻苯二甲酸氢钾内标液,充分摇匀,取600 μL于核磁管中待测。
浓缩果汁样品:稀释浓缩果汁样品使其浓度为原浓度0.5倍。取稀释后的果汁样品800 μL,再加入100 μL缓冲溶液和100 μL邻苯二甲酸氢钾内标液,充分摇匀,取600 μL于核磁管中待测。
1.3.3 测定参数
核磁管不旋转;检测温度:(300±0.1) K;空扫次数:4次;扫描次数:16次;谱宽:20.00 ppm;采样点数:64 k;接收增益:16;弛豫延迟:4 s;以TSP(δ = 0)作为化学位移的零点;采用布鲁克标准脉冲序列noesygppr1 d用于水峰信号抑制的氢谱测试。
1.4 数据处理
采用MestReNova 12.0软件(Mestrelab Research S.L.,MestReNova(Mnova)NMR,美国)对1H NMR谱图进行傅里叶变换、基线校正、相位调整。线宽因子为0.3。相位校正选择metabonomics算法,先自动优化,后针对特定区域进行手动校正,使尽可能多的积分值为正值。基线校正选择polynomial fit拟合方式。
2 结果与分析
2.1 样品配制方法讨论
如果果汁样品不澄清,会影响测试时的匀场效果,从而影响谱图的分辨率。所以如果果汁不澄清,需要过滤,从而保证谱图的质量。
pH值会影响水峰位置,如果每个样品水峰位置相差大,那么就不能用相同的水峰压制位置来压制水峰,不利于批量测试,所以在样品配制时加了缓冲溶液以稳定pH值。
为使定量结果准确,样品测试时需要统一增益值,浓缩果汁和普通果汁相比微量物质浓度大,如果和普通果汁用同样的增益值,信号就会溢出,谱图会发生畸变,从而影响定量结果的准确性。所以对浓缩果汁样品需要进行稀释,但稀释的倍数太大,又会影响定量的检测限和定量限,研究发现对于大部分浓缩果汁,只需要稀释一倍,同普通果汁使用相同的增益值,信号就不会发生溢出的现象。
2.2 果汁中水峰的压制
由于样品中主要是水,水的强共振信号会对样品信号产生掩盖作用,故需对溶剂信号进行压制[18-19],使果汁中微量成分的信号强度明显提高。经过溶剂峰压制之后,果汁中糖物质的信号显著提高,水峰的信号对定量结果也不造成干扰。
2.3 定量方法的选择
常用的定量方法有外标法[17,20-21]和内标法[22-23],二者各有其优缺点。内标法定量不确定度优于外标法,内标物和待测样品只需经过一次检测即可,但需仔细选择内标物质避免内标物质和待测物之间的相互作用,避免信号重叠,内标物质和待测物必须可溶于所选的NMR溶剂中。外标法无需考虑分析物和参考物质之间的相互作用和信号重叠,但需要分别测定外标物质和待测样品的谱图和脉冲宽度。所以本研究采用外标法和内标法同时对样品中的果糖、蔗糖、葡萄糖进行检测。
PULCON外标法定量使用外部参考样品,将外部参考样品的校准转移到实际样品中,因此无需考虑分析物和参考样品之间的相互作用和信号重叠。此外,采用PULCON外标法成本相对较低,可重复多次利用,进一步降低了NMR的检测成本,简化了前处理操作。柠檬酸结构简单,以水做溶剂的1H NMR谱中仅在δ 2.65和δ 2.52处有柠檬酸2个亚甲基的4个氢的2组双峰,用于定量分析结果准确,因此选择柠檬酸作为外部参考物,用公式(1)计算待测物的含量:
(1)
式中:C,分析物质量浓度,mg/L;A,绝对积分面积;M,相对分子质量;nH,质子数;NS,扫描次数;P1,1H 90°脉冲宽度;T,检测温度;CF,校正因子;Quantref(Q),外部参考样品;Sample(S),待测分析物。
内标法定量需在样品溶液中直接加入一定量的内部参考物,在充分弛豫的条件下,核磁共振信号强度(峰面积)与产生该信号的原子的数目成正比,而与其化学性质和所处的化学环境无关。邻苯二甲酸氢钾,化学性质稳定,在水中有良好的溶解性,其水溶液的1H NMR谱只有2组峰,每组峰代表2个氢原子,由图1可知其δ 7.780 处的信号不与果汁中化合物信号峰发生重叠,所以选用邻苯二甲酸氢钾作为内标物。以内标物的相对峰面积作为参考,根据样品指定质子共振峰的相对峰面积计算含量,根据公式(2)计算分析物浓度:
(2)
式中:C,分析物浓度,mg/L;M,相对分子质量;nH,质子数;A,信号积分面积;CF,校正因子;Sample(S),待测分析物;Std,内标物。
2.4 校正因子
公式(1)和公式(2)中都有校正因子,校正因子是在NMR波谱仪和测量条件等因素相互影响的情况下对样品定量结果的校正,如校正水信号的压制及弛豫不充分对定量结果准确性的影响等。标准品质量与溶液体积之比为纵坐标,外标法或内标法所得的浓度为横坐标,得线性回归y=ɑx+β,ɑ即校正因子。
2.5 定量峰和定量区域选择
2.5.1 果糖定量峰和定量区域选择
果糖在水中可以归属出3种构型,根据果糖的1H NMR、13C NMR及二维谱1H-1H位移相关谱(correlation spectroscopy,COSY)、1H-13C 异核单量子相干(heteronuclear single-quantum coherence,HSQC)、1H-13C异核多健相关(heteronuclear multiple-bond correlation,HMBC)、J-分辨谱等,果糖主要以β-D-吡喃果糖、α-D-呋喃果糖和β-D-呋喃果糖3种主要构型存在。在3种构型中,β-D-吡喃果糖含量最高,其次为β-D-呋喃果糖,α-D-呋喃果糖含量最低。δ 4.100~4.092为α-D-呋喃果糖 3-H和β-D-呋喃果糖 3-H、4-H,δ 4.018~3.993归属为β-D-吡喃果糖6-H上一个质子两重峰与α-D-呋喃果糖4-H 两个峰中一个峰。δ 3.984~3.976 归属为β-D-吡喃果糖5-H与α-D-呋喃果糖4-H两个峰中另一个峰。这3个区间正好包含了果糖3种构型中每种构型2个质子。而β-D-吡喃果糖6-H上一个质子两重峰中一个峰与蔗糖的5′-H上三重峰中一个峰重叠[1]。由图1可知,在果汁中δ 4.100~4.092的信号与果汁中其他物质信号没有重叠,所以可将δ 4.100~4.092所包含的质子数定为1,使用校正因子来校正定量的质子数不准确的因素。
2.5.2 蔗糖定量峰和定量区域选择
根据蔗糖的1H NMR、13C NMR及二维谱1H-1H COSY、1H-13C HSQC、1H-13C HMBC、J-分辨谱等,蔗糖在水中只有一种构型[1],定量峰为δ:5.39(d, J = 3.8 Hz),定量区域为δ 5.436~5.349,包含的质子数为1;也可以选δ 4.20(d, J = 8.7 Hz)处峰作为定量峰,定量区域为δ 4.250~4.159,包含的质子数为1。由图1可知定量峰为δ 5.39(d, J=3.8 Hz)和δ 4.20(d, J=8.7 Hz)处的定量峰均不与果汁中其他的信号重叠。
2.5.3 葡萄糖定量峰和定量区域选择
根据葡萄糖的1H NMR、13C NMR及二维谱1H-1H COSY、1H-13C HSQC、1H-13C HMBC、J-分辨谱等,葡萄糖在水中有2种结构[1],ɑ-D-吡喃葡萄糖和β-D-吡喃葡萄糖。ɑ-D-吡喃葡萄糖定量峰为δ 5.23 (d,J=3.7 Hz),定量区域为δ 5.260~5.0204,包含的质子数为1;β-D-吡喃葡萄糖定量峰为δ 4.64(d,J=8.0 Hz),包含的质子数为1,定量区域为δ 4.677~4.609;δ 5.260~5.0204和δ 4.677~4.609的积分面积之和可作为葡萄糖的积分面积,由图1可知此两处的定量区域与果汁中其他信号不重叠。
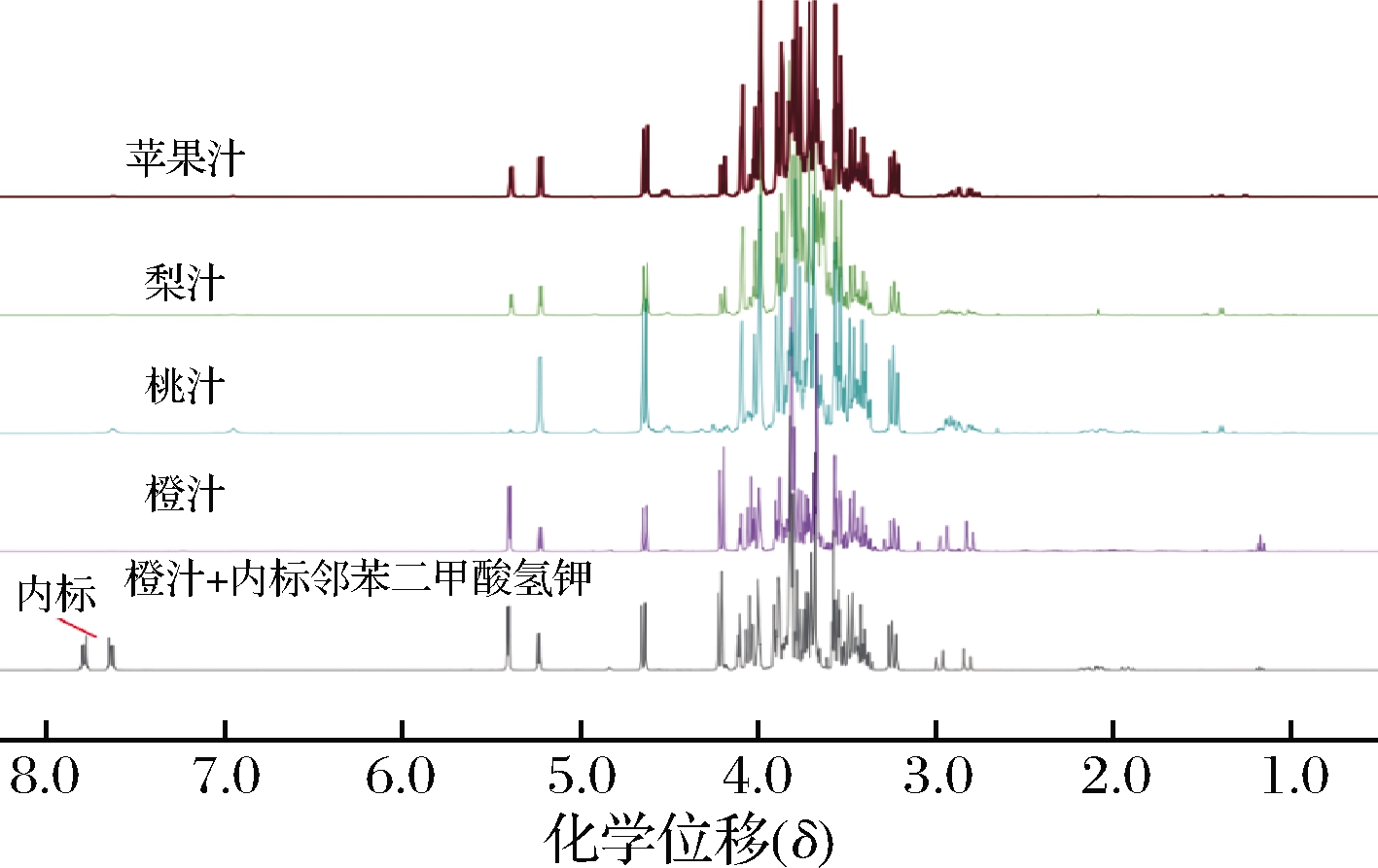
图1 果汁的核磁共振氢谱图
Fig.1 1H NMR spectra of juice
2.6 方法学考察结果
2.6.1 线性考察
以标准品质量与溶液体积之比为纵坐标,测定浓度为横坐标做线性回归。葡萄糖、果糖和蔗糖标准品在0.025~6.40 g/L质量浓度内作线性回归图。
柠檬酸作为定量外标,果糖回归方程为y=1.665 6x-0.118 5,R2=1;蔗糖定量峰为δ 5.40时,回归方程为y=1.152 1x-0.089 2,R2=1;蔗糖定量峰为δ 4.20时,回归方程为y=1.015 4x-0.077 3,R2=1;葡萄糖回归方程为y=1.114x+0.057 3,R2=0.999 8。结果表明该方法线性关系非常好。
邻苯二甲酸氢钾作为定量内标,果糖回归方程为y=2.027x-0.196 8,R2=0.999 5;蔗糖定量峰为5.39 ppm时,回归方程为y=1.492 2x+0.012 6,R2=0.999 9;蔗糖定量峰为4.20 ppm时,回归方程为y=1.309 7x-0.011,R2=0.999 9;葡萄糖回归方程为y=1.411 9x-0.011 8,R2=0.999 7。结果表明该方法线性关系非常好。
2.6.2 精密度考察
取其中1个果汁样品,平行配制5份,每份用外标法和内标法分别测定6次,得到果糖、葡萄糖和蔗糖的测定结果,计算精密度。从表1~表4可见同一份样品测实多次检测精密度均非常高,相对标准偏差(relative standard deviation,RSD)均小于1%。因为样品配制方法简单,所以平行配制样品间的精密度也非常高,RSD<0.47%。
表1 果糖测定精密度(n=6)
Table 1 Precision of fructose determination method (n=6)
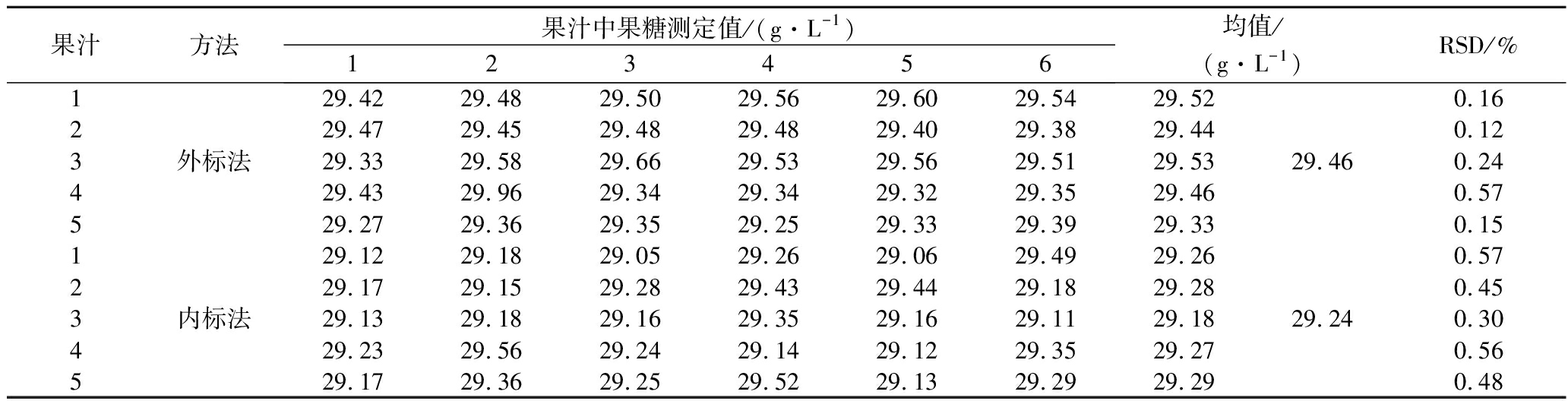
果汁方法果汁中果糖测定值/(g·L-1)123456均值/(g·L-1)RSD/%129.4229.4829.5029.5629.6029.5429.520.16229.4729.4529.4829.4829.4029.3829.440.123外标法29.3329.5829.6629.5329.5629.5129.5329.460.24429.4329.9629.3429.3429.3229.3529.460.57529.2729.3629.3529.2529.3329.3929.330.15129.1229.1829.0529.2629.0629.4929.260.57229.1729.1529.2829.4329.4429.1829.280.453内标法29.1329.1829.1629.3529.1629.1129.1829.240.30429.2329.5629.2429.1429.1229.3529.270.56529.1729.3629.2529.5229.1329.2929.290.48
表2 葡萄糖测定精密度(n=6)
Table 2 Precision of glucose determination method (n=6)
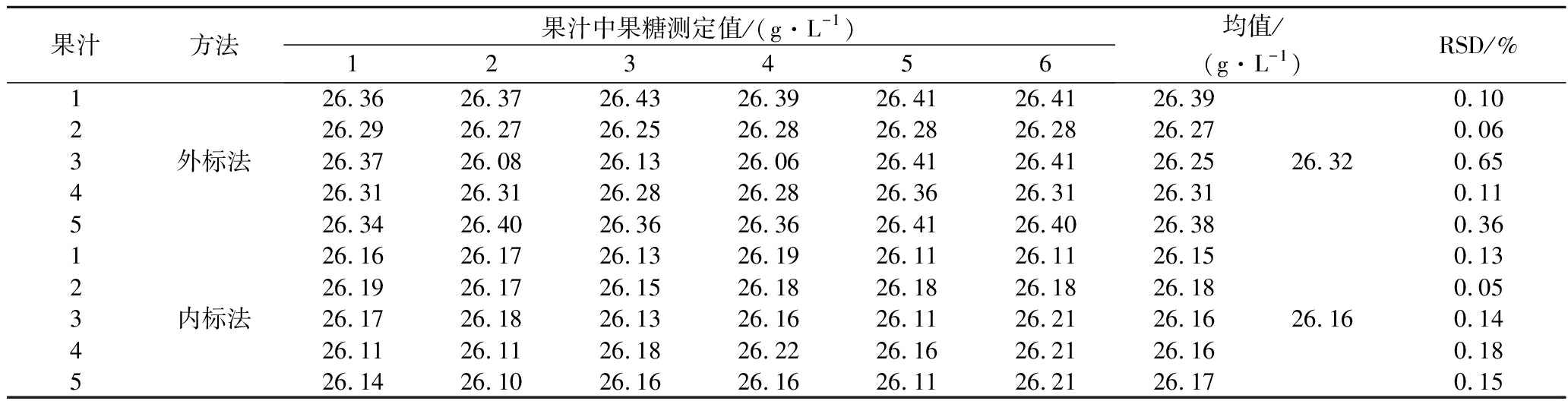
果汁方法果汁中果糖测定值/(g·L-1)123456均值/(g·L-1)RSD/%126.3626.3726.4326.3926.4126.4126.390.10226.2926.2726.2526.2826.2826.2826.270.063外标法26.3726.0826.1326.0626.4126.4126.2526.320.65426.3126.3126.2826.2826.3626.3126.310.11526.3426.4026.3626.3626.4126.4026.380.36126.1626.1726.1326.1926.1126.1126.150.13226.1926.1726.1526.1826.1826.1826.180.053内标法26.1726.1826.1326.1626.1126.2126.1626.160.14426.1126.1126.1826.2226.1626.2126.160.18526.1426.1026.1626.1626.1126.2126.170.15
表3 蔗糖测定精密度(n=6,定量峰δ 5.40)
Table 3 Precision of sucrose determination method (n=6, quantitative peak δ 5.40)

果汁方法果汁中果糖测定值/(g·L-1)123456均值/(g·L-1)RSD/%148.4948.4548.5048.3648.3948.3448.420.14248.2448.1048.0448.1148.0448.0648.100.163外标法48.3548.2048.1548.0848.2648.2048.2148.150.19448.1747.9847.9548.9547.9948.9347.990.18548.0948.0848.0048.0048.0447.9648.030.11148.3948.3548.3048.3648.3548.3848.360.07248.2648.1548.1448.1548.1448.1648.170.103内标法48.2548.2248.2548.1848.2248.2348.2348.240.05448.2748.0047.9648.9748.0047.9848.360.82548.1948.1848.0448.0248.1447.9648.090.20
表4 蔗糖测定精密度(n=6,定量峰δ 4.20)
Table 4 Precision of sucrose determination method (n=6, quantitative peak δ 4.20)
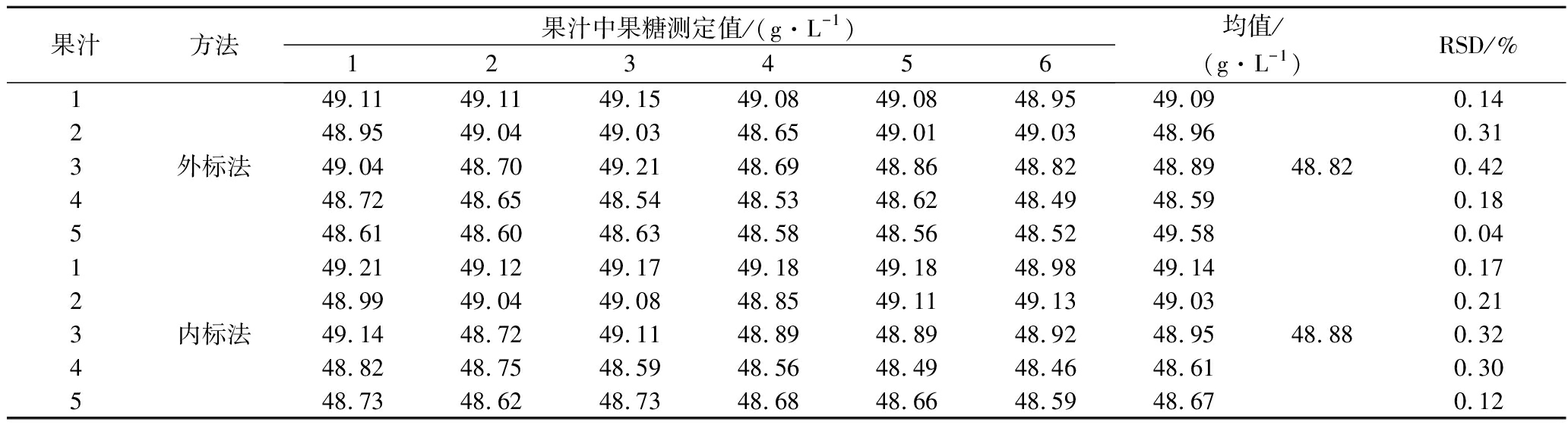
果汁方法果汁中果糖测定值/(g·L-1)123456均值/(g·L-1)RSD/%149.1149.1149.1549.0849.0848.9549.090.14248.9549.0449.0348.6549.0149.0348.960.313外标法49.0448.7049.2148.6948.8648.8248.8948.820.42448.7248.6548.5448.5348.6248.4948.590.18548.6148.6048.6348.5848.5648.5249.580.04149.2149.1249.1749.1849.1848.9849.140.17248.9949.0449.0848.8549.1149.1349.030.213内标法49.1448.7249.1148.8948.8948.9248.9548.880.32448.8248.7548.5948.5648.4948.4648.610.30548.7348.6248.7348.6848.6648.5948.670.12
2.6.3 加标回收率考察
配制样品20 份,其中5 份作为对照组,其余15份由低至高,分别添加11.11、22.22、33.33 g/L 3个质量浓度水平的果糖、葡萄糖、蔗糖,分别采用外标法和内标法对果糖、葡萄糖、蔗糖定量,计算回收率,结果见表5和表6,外标法回收率为100.9%~104.7%,内标法回收率为102.1%~108.6%,均能满足测定准确性要求。
表5 外标法加标回收率
Table 5 Recovery rate of external standard method
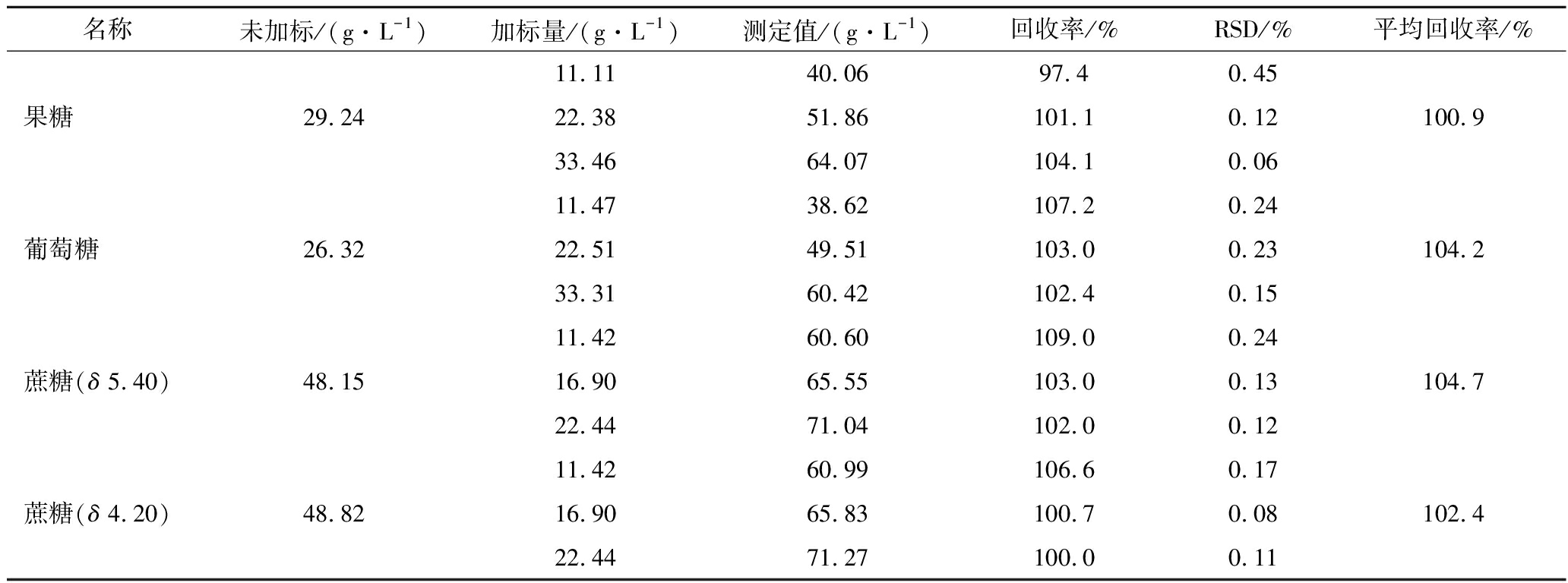
名称未加标/(g·L-1)加标量/(g·L-1)测定值/(g·L-1)回收率/%RSD/%平均回收率/%11.1140.0697.40.45果糖29.2422.3851.86101.10.12100.933.4664.07104.10.0611.4738.62107.20.24葡萄糖26.3222.5149.51103.00.23104.233.3160.42102.40.1511.4260.60109.00.24蔗糖(δ 5.40)48.1516.9065.55103.00.13104.722.4471.04102.00.1211.4260.99106.60.17蔗糖(δ 4.20)48.8216.9065.83100.70.08102.422.4471.27100.00.11
表6 内标法加标回收率
Table 6 Recovery rate of internal standard method
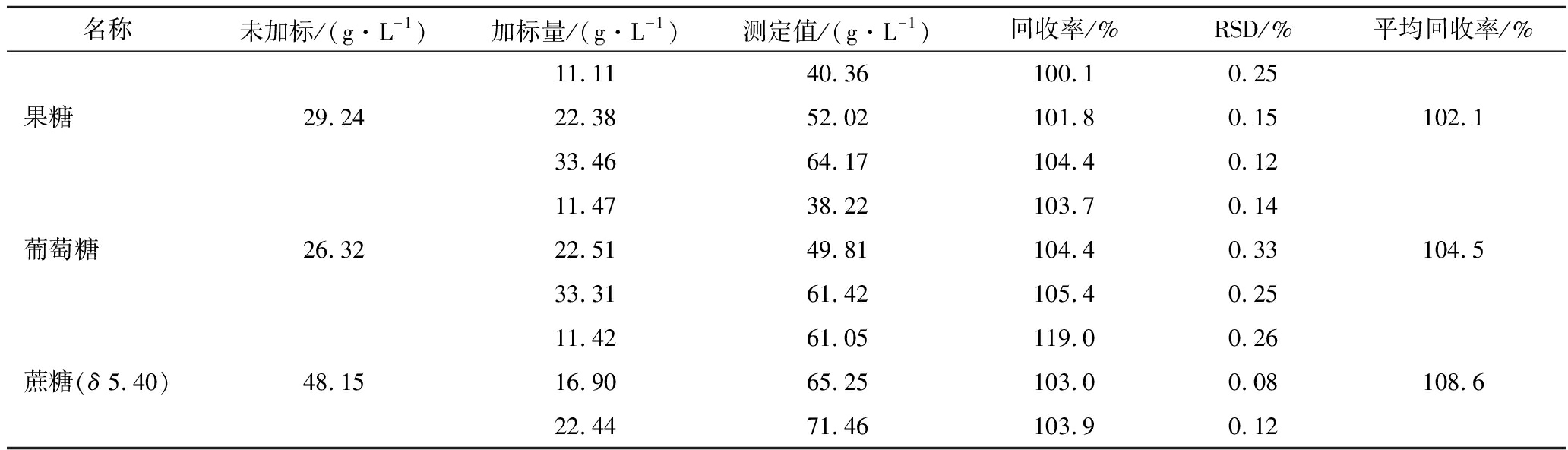
名称未加标/(g·L-1)加标量/(g·L-1)测定值/(g·L-1)回收率/%RSD/%平均回收率/%11.1140.36100.10.25果糖29.2422.3852.02101.80.15102.133.4664.17104.40.1211.4738.22103.70.14葡萄糖26.3222.5149.81104.40.33104.533.3161.42105.40.2511.4261.05119.00.26蔗糖(δ 5.40)48.1516.9065.25103.00.08108.622.4471.46103.90.12
2.6.4 检出限和定量限
将果糖、葡萄糖、蔗糖的标准品谱图信噪比为3时的浓度作为检出限,信噪比为10时的浓度作为定量限[15,24]。在1.3.3及1.4的测试参数及数据处理条件下,果糖的检出限为0.005 g/L,定量限为0.018 g/L;葡萄糖的检出限为0.007 g/L,定量限为0.022 g/L;蔗糖的检出限为0.009 g/L,定量限为0.031 g/L。GB 5009.8—2016高效液相色谱法果糖、葡萄糖、蔗糖、麦芽糖和乳糖检出限为 0.2 g/100g,可见上述已经建立的1H NMR定量方法检测限要远低于国标方法,即灵敏度要远高于国标方法。
2.6.5 方法精确性分析
应用上述已经建立的1H NMR内标和外标定量方法和GB 5009.8—2016高效液相色谱法分别对市售4种果汁样品进行检测,每个样品平行前处理2次,重复测定2次,结果取平均值,如表7所示,进一步统计分析1H NMR法与国标法检测结果的差异。以1H NMR内标法、1H NMR外标法结果和国标方法比较,求RSD,除个别的结果如橙汁1中的果糖、苹果汁3中的葡萄糖、梨汁3中的蔗糖测定结果为5%
表7 核磁共振波谱法与高效液相色谱法对果汁中主要糖测定结果 单位:g/L
Table 7 Determination results of main sugar content in juice by NMR and high performance liquid chromatography
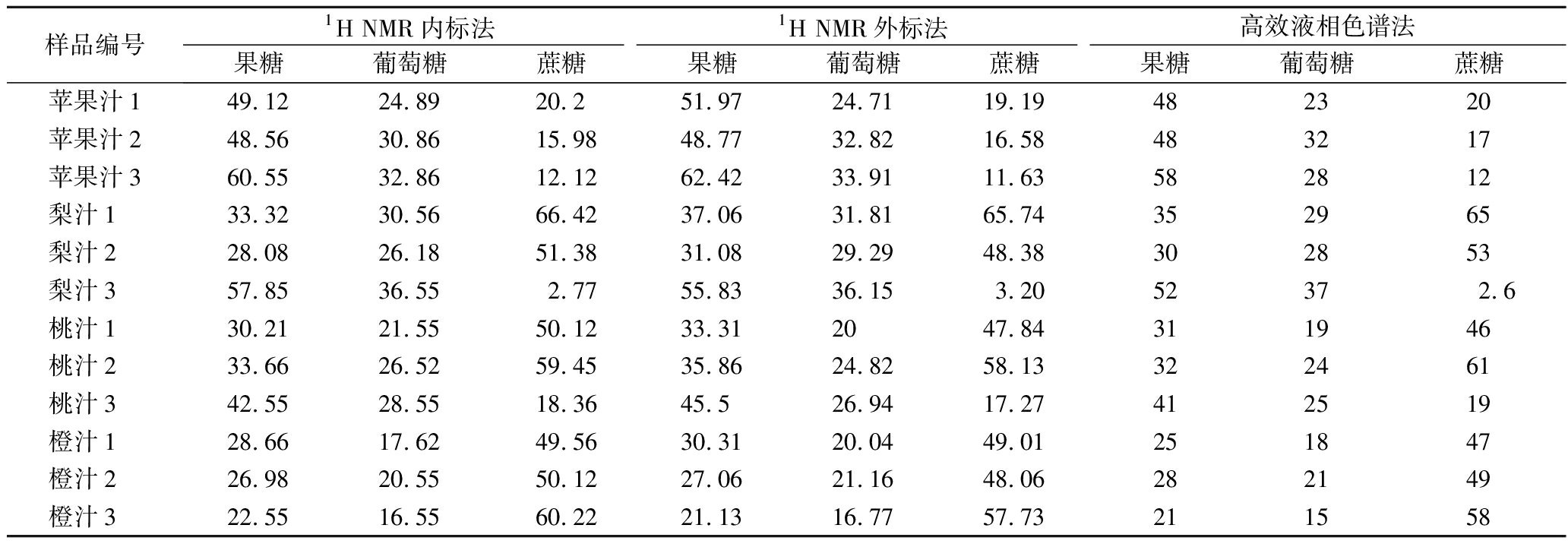
样品编号1H NMR内标法1H NMR外标法高效液相色谱法果糖葡萄糖蔗糖果糖葡萄糖蔗糖果糖葡萄糖蔗糖苹果汁149.1224.8920.251.9724.7119.19482320苹果汁248.5630.8615.9848.7732.8216.58483217苹果汁360.5532.8612.1262.4233.9111.63582812梨汁1 33.3230.5666.4237.0631.8165.74352965梨汁2 28.0826.1851.3831.0829.2948.38302853梨汁3 57.8536.552.7755.8336.153.2052372.6桃汁1 30.2121.5550.1233.312047.84311946桃汁2 33.6626.5259.4535.8624.8258.13322461桃汁3 42.5528.5518.3645.526.9417.27412519橙汁1 28.6617.6249.5630.3120.0449.01251847橙汁2 26.9820.5550.1227.0621.1648.06282149橙汁3 22.5516.5560.2221.1316.7757.73211558
3 结论
本研究建立了一种采用核磁共振技术对果汁中果糖、葡萄糖和蔗糖含量进行快速准确定量的方法。果糖的检出限为0.005 g/L,定量限为0.018 g/L;葡萄糖的检出限为0.007 g/L,定量限为0.022 g/L;蔗糖的检出限为0.009 g/L,定量限为0.031 g/L。该方法在0.025~6.40 g/L线性关系良好(R2>0.999);外标法加标回收率为100.9%~104.7%,内标法加标回收率为102.1%~108.6%,同一份样品测多次检测及平行配制样品间的精密度均非常高,RSD均小于1%,可见测定方法重复性好,GB 5009.8—2016高效液相色谱法测定结果误差在±5%以内,满足方法的可行性验证要求。该方法简化了样品的前处理操作,无需预先将样品中待测物分离便可直接进行测定,极大地缩短了待测样品的前处理时间。在确保重复性和测定结果准确性的基础上,该方法极大节约了时间与人力,在大批量样品检测时成本较低,可广泛应用于果汁质量控制,同时为建立果汁核磁共振指纹图谱真实性鉴别技术奠定了基础。
[1] 阎政礼, 杨明生, 冯志明.苹果原汁中葡萄糖、果糖和蔗糖NMR定量分析[J].湖南师范大学学报(医学版), 2011, 8(1):86-89.
YAN Z L, YANG M S, FENG Z M.Quantitative analysis of glucose,fructose and sucrose in the raw juice of apple by nuclear magnetic resonance[J].Journal of Hunan Normal University(Medical Science), 2011, 8(1):86-89.
[2] 陈俊伟, 张良诚, 张上隆.果实中的糖分积累机理[J].植物生理学通讯, 2000, 36(6):497-503.
CHEN J W, ZHANG L C, ZHANG S L.Sugar accumulation mechanism in fruits[J].Plant Physiology Communications, 2000, 36(6):497-503.
[3] 张惟杰. 糖类研究漫谈[J].生命的化学, 2005, 25 (5):432-433.
ZHANG W J.The challenge in carbohydrate research[J].Chemistry of Life, 2005, 25 (5):432-433.
[4] 张宏利, 简利茹, 高保卫.利用NMR技术同时测定几种果汁中的葡萄糖、果糖和蔗糖[J].西北林学院学报, 2014, 29(6):217-220.
ZHANG H L, JIAN L R, GAO B W.Simultaneous determination of glucose, fructose and sucrose in several kinds of fruit juice by using NMR technology[J].Journal of Northwest Forestry University, 2014, 29(6):217-220.
[5] 魏晓明, 符红, 万幼平.硫酸蒽酮比色法测定鹿龟酒中多糖的含量[J].中成药, 2000, 22(5):380-382.
WEI X M, FU H, WAN Y P.Content determination of polysaccharides in Lu Gui tincture by colorimetry of sulfuric acid anthrone[J].Chinese Traditional Patent Medicine, 2000, 22(5):380-382.
[6] 李凤玉. 用铁氰化钾法测定王浆中总糖的含量[J].养蜂科技, 2005(3):5-6.
LI F Y.Determination of total sugar in royal pulp by potassium ferricyanide method[J].Apicultural Science and Technology, 2005(3):5-6.
[7] 陈齐英, 孙雪奇, 徐晓霞.3,5-二硝基水杨酸比色法测定亮菌口服液中多糖的含量[J].华西药学杂志, 2000, 15(3):193-194.
CHEN Q Y, SUN X Q, XU X X.Quantitative determination of polysaccharide in armillarisin oral liquid by 3,5-dinitrosalicylic acid colorimetry[J].West China Journal of Pharmaceutcal Sciences, 2000, 15(3):193-194.
[8] 师源, 何强, 李莹, 等.高效液相色谱法测定浓缩果汁中5种可溶性糖[J].化学分析计量, 2019, 28(1):91-94.
SHI Y, HE Q, LI Y, et al.Determination of 5 kinds of soluble sugars in concentrated juice by HPLC[J].Chemical Analysis and Meterage, 2019, 28(1):91-94.
[9] 唐根源, 郭士雄, 吴红京, 等.高效液相色谱法测定木奈果中的山梨醇和糖类[J].色谱, 2000, 18(5):459-461.
TANG G Y, GUO S X, WU H J, et al.The determination sorbitol and carbohydrates in nane fruit by high performance liquid chromatography[J].Chinese Journal of Chromatography, 2000, 18(5):459-461.
[10] 郭建敏, 田长平, 王超, 等.高效毛细管电泳法在果汁糖类测定上的应用[J].山东农业科学, 2009, 41(4):109-110.
GUO J M, TIAN C P, WANG C, et al.Application of high performance capillary electrophoresis to determination of carbohydrate in fruit juice[J].Shandong Agricultural Sciences, 2009, 41(4):109-110.
[11] MONAKHOVA Y B., KUBALLA T, LACHENMEIER D W.Nontargeted NMR analysis to rapidly detect hazardous substances in alcoholic beverages[J].Applied Magnetic Resonance, 2012, 42(3):343-352.
[12] KOBLER H, MONAKHOVA Y B, KUBALLA T, et al.Nuclear magnetic resonance spectroscopy and chemometrics to identify pine nuts that cause taste disturbance[J].Journal of Agricultural and Food Chemistry, 2011, 59(13):6 877-6 881.
[13] MONAKHOVA Y B, KUBALLA T, LEITZ J, et al.NMR spectroscopy as a screening tool to validate nutrition labeling of milk, lactose-free milk, and milk substitutes based on soy and grains[J].Dairy Science & Technology, 2012, 92(2):109-120.
[14] MAES P, MONAKHOVA Y B, KUBALLA T, et al.Qualitative and quantitative control of carbonated cola beverages using 1H NMR spectroscopy[J].Journal of Agricultural and Food Chemistry, 2012, 60(11):2 778-2 784.
[15] 冯翠萍, 刘一诺, 樊双喜, 等.核磁共振磷谱法测定乳制品中的酪蛋白含量[J].食品科学, 2021, 42(4):221-226.
FENG C P, LIU Y N, FAN S X, et al.Determination of casein content in dairy products by 31P nuclear magnetic resonance[J].Food Science, 2021, 42(4):221-226.
[16] LACHENMEIER D W, HUMPFER E, FANG F, et al.NMR-spectroscopy for nontargeted screening and simultaneous quantification of health-relevant compounds in foods:The example of melamine[J].Journal of Agricultural and Food Chemistry, 2009, 57(16):7 194-7 199.
[17] ACKERMANN S M, DOLSOPHON K, MONAKHOVA Y B, et al.Automated multicomponent analysis of soft drinks using 1D 1H and 2D 1H-1H J-resolved NMR spectroscopy[J].Food Analytical Methods, 2017, 10(3):827-836.
[18] KEW W, BELL N G A, GOODALL I, et al.Advanced solvent signal suppression for the acquisition of 1D and 2D NMR spectra of Scotch Whisky[J].Magnetic Resonance in Chemistry, 2017, 55(9):785-796.
[19] ZHENG G, PRICE W S.Solvent signal suppression in NMR[J].Progress in Nuclear Magnetic Resonance Spectroscopy, 2010, 56(3):267-288.
[20] 姜洁, 李玮, 路勇, 等.核磁共振脉冲宽度法测定婴幼儿乳粉中乳糖、蔗糖含量[J].食品工业科技, 2015, 36(8):68-71;77.
JIANG J, LI W, LU Y, et al.Determination of lactose and sucrose in infant formula milk powder by PULCON 1H-NMR method[J].Science and Technology of Food Industry, 2015, 36(8):68-71;77.
[21] WIDER G, DREIER L.Measuring protein concentrations by NMR spectroscopy[J].Journal of the American Chemical Society, 2006, 128(8):2 571-2 576.
[22] 吉鑫, 樊双喜, 杨彤晖, 等.核磁共振法测定食品中水苏糖的含量[J].食品与发酵工业, 2019, 45(19):251-257.
JI X, FAN S X, YANG T H, et al.Quantitative determination of stachyose in food by NMR[J].Food and Fermentation Industries, 2019, 45(19):251-257.
[23] MÜLLER-MAATSCH J, CALIGIANI A, TEDESCHI T, et al.Simple and validated quantitative 1H NMR method for the determination of methylation, acetylation, and feruloylation degree of pectin[J].Journal of Agricultural and Food Chemistry, 2014, 62(37):9 081-9 087.
[24] SCHÖNBERGER T, MONAKHOVA Y B, LACHENMEIER D W, et al.Guide to NMR method development and validation-part I:Identification and quantification[C].Technical Report.Brussels Belginm:EUROLAB General Secretariat, 2014.