螺虫乙酯是德国拜耳公司开发的一种新型螺环季酮酸类杀虫杀螨剂,它通过抑制乙酰辅酶A羧化酶活性,干扰脂肪生物合成,阻断害虫正常的能量代谢,最终致其死亡[1]。由于其作用高效,被广泛应用于防治果蔬中的刺吸口器类害虫和害螨,如蚜虫(甘蓝蚜虫和苹果树棉蚜)、木虱(梨树梨木虱)、粉虱(番茄烟粉虱)和全爪螨(柑橘树红蜘蛛)等[2-3]。然而,螺虫乙酯对人的皮肤有轻微致敏性[3],对其他动物有毒性,如螺虫乙酯对蚯蚓有潜在遗传毒性[4],它能够诱导斑马鱼肌肉组织的氧化应激效应,进而引起氧化损伤[5],也会对斑马鱼产生内分泌干扰效应[6],此外,螺虫乙酯对两栖类生物如蟾蜍也有潜在毒性[7]。螺虫乙酯在施用后主要产生4种代谢物,分别为B-enol,B-glu,B-keto和B-mono[8],其中B-enol的毒性与螺虫乙酯相当,对雄性大鼠有生殖毒性[3]。因此,螺虫乙酯及其代谢物的残留检测对人类健康和环境保护具有重要意义。
目前,植物中螺虫乙酯及其代谢物的残留检测方法主要包括HPLC[9],LC-MS/MS[1, 10]和GC-MS[11],尽管这些方法灵敏度和准确性高,但它们受限于熟练的操作人员和昂贵的仪器,而免疫分析方法具有检测迅速、操作简便和成本低廉等优点[12]。CEVALLOS-CEDE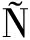 O等[13-14]设计合成了多种螺虫乙酯的半抗原,得到了特异性识别螺虫乙酯及B-enol的多克隆抗体和单克隆抗体,基于单克隆抗体建立了直接竞争酶联免疫分析方法,对葡萄、葡萄汁和葡萄酒基质进行加标回收实验,并且该课题组还以免疫原BSA-SPh为检测线,羊抗鼠多克隆抗体为控制线,金纳米颗粒标记的单克隆抗体SPm#23为流动相,建立螺虫乙酯胶体金免疫层析分析方法,对葡萄酒样品中螺虫乙酯及B-enol残留进行半定量测定,其可视化最低检测限为1 000 μg/L,满足欧洲对葡萄酒中螺虫乙酯残留的半定量快速分析的要求。虽然国外已经建立了螺虫乙酯的免疫分析方法,但这种方法在蔬菜、水果和环境样品中的应用还尚待研究,同时我国在这方面的研究也比较匮乏。因此,本研究设计合成了一种新型的螺虫乙酯半抗原,筛选出特异性识别螺虫乙酯及B-enol的单克隆抗体,并对蔬菜、水果及环境基质进行螺虫乙酯加标回收实验,同时测定了柑橘实际样品中的螺虫乙酯残留,旨在提供一种快速检测果蔬中螺虫乙酯残留的新方法,并为螺虫乙酯免疫试纸条的开发提供基础。
O等[13-14]设计合成了多种螺虫乙酯的半抗原,得到了特异性识别螺虫乙酯及B-enol的多克隆抗体和单克隆抗体,基于单克隆抗体建立了直接竞争酶联免疫分析方法,对葡萄、葡萄汁和葡萄酒基质进行加标回收实验,并且该课题组还以免疫原BSA-SPh为检测线,羊抗鼠多克隆抗体为控制线,金纳米颗粒标记的单克隆抗体SPm#23为流动相,建立螺虫乙酯胶体金免疫层析分析方法,对葡萄酒样品中螺虫乙酯及B-enol残留进行半定量测定,其可视化最低检测限为1 000 μg/L,满足欧洲对葡萄酒中螺虫乙酯残留的半定量快速分析的要求。虽然国外已经建立了螺虫乙酯的免疫分析方法,但这种方法在蔬菜、水果和环境样品中的应用还尚待研究,同时我国在这方面的研究也比较匮乏。因此,本研究设计合成了一种新型的螺虫乙酯半抗原,筛选出特异性识别螺虫乙酯及B-enol的单克隆抗体,并对蔬菜、水果及环境基质进行螺虫乙酯加标回收实验,同时测定了柑橘实际样品中的螺虫乙酯残留,旨在提供一种快速检测果蔬中螺虫乙酯残留的新方法,并为螺虫乙酯免疫试纸条的开发提供基础。
1 材料与方法
1.1 材料与试剂
供试品种:本研究中所用的土壤、河水、番茄和柑橘(温州蜜柑)在重庆市北碚区收集,其中番茄和柑橘为市售。
药剂与试剂:螺虫乙酯、B-enol、B-glu、B-keto、B-mono、螺螨酯、乙螨唑、唑螨酯、哒螨灵标准品,上海安谱实验科技股份有限公司;次黄嘌呤-氨基蝶呤-胸腺嘧啶核苷(hypoxanthine-aminopterin-thymine nucleoside,HAT)培养基添加剂、弗氏完全佐剂、弗氏不完全佐剂和辣根过氧化物酶(horseradish peroxidase, HRP)标记羊抗鼠IgG、聚氧乙烯失水山梨醇单月桂酸酯(Tween-20),美国Sigma-Aldrich公司;卵清蛋白(ovalbumin,OVA)、牛血清白蛋白(bovine serum albumin,BSA)、溴乙酸乙酯、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、N, N′-二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)、N, N-二甲基甲酰胺(N, N-dimethylformamide,DMF)、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)显色液,上海Aladdin公司;DMEM培养基和胎牛血清(fetal calf serum,FBS),苏格兰Gibco BRL公司;蛋白胶、2×考马斯亮蓝R-250缓冲液、Real Band 3-color High range protein Marker,上海BBI生命科学有限公司。
电泳脱色液(30%的无水乙醇和10%的冰醋酸混合液);包被缓冲液[碳酸盐缓冲液(carbonate buffer solution,CBS),pH 9.6,0.05 mol/L]:称取2.93 g NaHCO3,1.5 g Na2CO3,用去离子水溶解并定容至1 000 mL;磷酸盐缓冲液[(phosphate buffer solution,PBS),pH 7.4,0.01 mol/L]:称取0.2 g KH2PO4,2.96 g Na2HPO4·12H2O,8.0 g NaCl,用去离子水溶解并定容至1 000 mL;洗涤缓冲液(PBST,含体积分数0.1% Tween-20的PBS,pH 7.4);封闭液(含质量分数3%脱脂奶粉的PBS);样品稀释缓冲液(PBSTG,含质量分数0.1%明胶的PBST,pH 7.4);终止液(2 mol/L H2SO4)。
1.2 仪器与设备
细胞培养板和96孔酶标板,美国Corning Costar公司;Varioskan LUX型多功能微孔板检测仪、IEC CL31R型台式冷冻离心机,芬兰赛默飞世尔科技公司;INC153型二氧化碳细胞培养箱,德国Memmert公司;电热恒温培养箱,天津市中环实验电炉有限公司;Milli-Q型超纯水器,美国Millipore公司;XS204型电子天平、PB8001-S/FACT型分析天平,瑞士METTLER TOLEDO公司;SB-5200D型超声波清洗器,宁波新芝公司;0.22 μm有机相针式滤器,上海安谱实验科技股份有限公司;核磁共振波谱仪,德国Bruker公司;X500R QTOF高分辨质谱仪(用于半抗原鉴定),美国AB SCIEX公司;Agilent 1290-6495液相色谱串联质谱仪(用于方法确证),美国Agilent公司。
1.3 螺虫乙酯人工抗原的合成及单克隆抗体的制备
1.3.1 螺虫乙酯半抗原的合成
螺虫乙酯半抗原的合成路线如图1所示。准确称取226 mg B-enol、200 mg NaOH和250 mg溴乙酸乙酯于圆底烧瓶中,加入5 mL DCC溶解,回流12 h,期间通过薄层色谱法(thin layer chromatography,TLC)监测反应进度,待原料点消失,将反应的混合物倒入25 g冰中,搅拌4 h,并用2 mol/L的盐酸调节pH至2~3,随即用25 mL的乙酸乙酯萃取3次,并用饱和食盐水进行洗涤,收集上清液置于具塞锥形瓶中,加入适量的无水硫酸镁干燥过夜。将干燥后的溶液过滤,旋转蒸发浓缩后柱层析梯度洗脱纯化产物。之后通过核磁共振波谱仪和X500R QTOF高分辨质谱仪对产物进行鉴定。
图1 螺虫乙酯半抗原的合成路线
Fig.1 The synthetic route of spirotetramat hapten
1.3.2 螺虫乙酯人工抗原的制备
螺虫乙酯人工抗原的制备过程参照文献[15],合成路线如附图1所示(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)。将纯化后的螺虫乙酯人工抗原通过SDS-PAGE鉴定,并置于-20 ℃保存。
1.3.3 动物免疫及血清效价测定
本研究采用的动物免疫方案参考文献[16],具体操作见附表1(https://kns.cnki.net/kcms/detail/911.1802.TS.20211011.1812.006.html)。选取6只6~7 周龄的雌性Balb/c小鼠,将免疫原螺虫乙酯-BSA与等体积弗氏佐剂乳化后进行免疫,4次免疫后1周,眼眶取血,室温静置1 h,4 ℃放置2 h,4 000 r/min 离心10 min,收集血清,进行血清效价测定。
血清效价的测定采用间接竞争酶联免疫分析方法(indirect homologous competitive enzyme-linked immunosorbent assay,icELISA),通过棋盘格法进行。具体操作步骤参考文献[15, 17]:(1)包被:用CBS将1 g/L 的螺虫乙酯-OVA稀释至1∶1 000,1∶2 000,1∶4 000,1∶8 000,酶标板每孔加入100 μL,37 ℃孵育3 h,弃包被液,用PBST洗板4次;(2)封闭:每孔加入200 μL封闭液,37 ℃封闭孵育1 h,弃封闭液,用PBST洗板4次;(3)加标准品和血清:将血清用PBSTG稀释至1∶1 000,1∶2 000,1∶4 000,1∶8 000,每孔先加入50 μL螺虫乙酯标准品(1 000 μg/L和0),再加入50 μL稀释后的血清,37 ℃孵育30 min,洗板4次;(4)加二抗:将HRP标记的羊抗鼠IgG用PBSTG 稀释至1∶10 000,每孔加入100 μL,37 ℃孵育30 min,洗板4次;(5)显色:每孔加入100 μL TMB单组分显色液,室温下避光显色10 min;(6)终止与检测:每孔加入50 μL终止液,终止反应,在450 nm处检测吸光度OD450nm值;(7)效价确定[18]:取吸光度为1.0时的血清的最大稀释倍数为血清效价;(8)特异性确定:根据抑制率来判断血清的特异性,抑制率计算如公式(1)所示:
抑制率![]()
(1)
1.3.4 抗螺虫乙酯单克隆抗体的制备
第4次免疫后,选择血清效价高,特异性好的小鼠进行加强免疫用于细胞融合。使用促融剂PEG-2000将脾细胞和骨髓瘤细胞SP2/0按10∶1质量比进行融合,融合后每天观察细胞生长,在第9天采用icELISA筛选特异性强,效价高的杂交瘤细胞株。将筛选到的细胞株采用有限稀释法进行克隆化,最终得到单克隆细胞株(mAb 3D11G7)。制备腹水前,向5只6~7周的Balb/c雌性健康小鼠中注射液体石蜡(0.4 mL/只)。1周后,向小鼠腹腔中注射细胞株(mAb 3D11G7)进行扩繁,7~10 d后收集腹水于4 ℃下静置约3~4 h后,10 000 r/min离心10 min,弃去脂肪层和细胞层,吸取中间澄清部分保存在-20 ℃用于后续实验。
1.4 螺虫乙酯人工抗原的合成及单克隆抗体的制备
1.4.1 抗螺虫乙酯单克隆抗体与包被抗原的最佳工作浓度
利用icELISA和棋盘格法确定抗螺虫乙酯单克隆抗体与包被抗原的最佳工作浓度,具体操作步骤参考文献[15, 17],其中,抗螺虫乙酯单克隆抗体为腹水,选择对照孔吸光度>1.0,抑制率较高的包被抗原和单克隆抗体的最大稀释倍数为最佳工作浓度。
1.4.2 螺虫乙酯icELISA标准曲线的绘制
以螺虫乙酯-OVA的最佳工作浓度进行包被,37 ℃孵育3 h,洗板4次,接着每孔加入200 μL封闭液,37 ℃ 孵育封闭1 h,弃封闭液,用PBST洗板4次,然后将螺虫乙酯标准品倍比稀释,每孔加入50 μL标准品和50 μL最佳工作浓度下的抗螺虫乙酯单克隆抗体,37 ℃孵育30 min,洗板4次,之后加入100 μL稀释至1∶10 000的HRP标记的羊抗鼠IgG,37 ℃孵育30 min,洗板4次。随即进行显色,每孔加入100 μL TMB单组分显色液,室温下避光显色10 min后加入50 μL终止液,终止反应,在450 nm处检测吸光度OD450nm值。以螺虫乙酯标准品的浓度为横坐标,对应浓度下的吸光度为纵坐标,绘制间接竞争抑制曲线如图2所示。根据公式(2)[19]计算抗螺虫乙酯单克隆抗体的灵敏度即半数抑制质量浓度(half maximal inhibitory concentration,IC50)和最佳工作浓度范围(IC20~IC80)。
抑制率![]()
(2)
式中:B0为未加标准品溶液组的OD450nm值,B为加入梯度浓度标准品溶液组OD450nm值。
1.4.3 抗螺虫乙酯单克隆抗体特异性分析
通过icELISA测定螺虫乙酯单克隆抗体的特异性,选择与螺虫乙酯结构类似的8种化合物(B-enol,B-glu,B-keto,B-mono,螺螨酯,乙螨唑,唑螨酯和哒螨灵),梯度稀释后进行酶联免疫分析测定,使用酶标仪读出其OD450nm值,并使用Origin2019b计算其![]() 交叉反应率(cross reactivity,CR)计算如公式(3)所示:
交叉反应率(cross reactivity,CR)计算如公式(3)所示:
(3)
1.4.4 缓冲液中有机溶剂对icELISA的影响
为了评估缓冲液中有机溶剂对icELISA的影响,选择农药前处理过程中常用的有机溶剂甲醇和乙腈,并配制含不同体积分数的有机溶剂(5%、10%、20%和40%)的样品稀释液PBSTG,随后通过icELISA测定不同浓度溶剂条件下的B0值和IC50值。
1.4.5 缓冲液的pH对icELISA的影响
为了评估缓冲液的pH对icELISA的影响,配制含不同pH值(4.5、5.5、6.5、7.4和8.5)的样品稀释液PBSTG,随后通过icELISA测定不同pH条件下的B0值和IC50值。
1.4.6 加标回收及实际样品检测
将采集到的温州蜜柑和番茄用纱布擦拭干净,按四分法取全果进行匀浆,土壤样品剔除其中的碎石等杂物,将处理好的样品置于-20 ℃的冰箱保存。
样品的提取方法为:称取2.0 g的样品于15 mL的离心管中,加入2 mL的甲醇超声辅助提取20 min(25 ℃,200 W),随后于6 000×g离心10 min,提取3次,合并3次的上清液,于40 ℃条件下氮吹干燥,用2 mL的PBSTG复溶,稀释至适当浓度后通过icELISA进行测定。
向河水中添加不同水平的螺虫乙酯(20、50、100、500 μg/L),用PBSTG稀释至适当浓度后通过icELISA进行测定,并计算加标回收率。向空白基质土壤、番茄和温州蜜柑中添加不同水平的螺虫乙酯(50、100、500、1 000 μg/L),4 ℃条件下,静置吸附1 h,然后按照样品的提取方法进行提取,通过icELISA进行测定,加标回收率计算如公式(4)所示:
加标回收率/%
(4)
本研究选用的实际样品1~3号为未喷洒螺虫乙酯的样品,4~9号为随机浸泡不同浓度的柑橘盲样。
1.4.7 超高效液相色谱-串联质谱(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法验证
UPLC-MS/MS法的检测条件参考文献[20],具体条件如下:
色谱条件:色谱柱为Agilent eclipse plus C18column(50 mm×2.1 mm,1.8 μm);流动相A为0.1%甲酸-水溶液,B为甲醇。柱温为40 ℃,进样量为3 μL,流速为0.3 mL/min,洗脱梯度见附表2(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)。
质谱条件:电喷雾离子源;正离子扫描模式,毛细管电压3 kV,离子源温度120 ℃,鞘气温度300 ℃;通过动态多反应监测模式检测。
2 结果与分析
2.1 螺虫乙酯半抗原鉴定结果
从附图2(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)半抗原的氢谱中可以看到,δ 12.86 (s, 1H, COOH) 和4.29 (dd, 2H, CH2COOH)两处峰为引入的CH2COOH基团的氢谱信息。碳谱中δ 12.86 (s, 1H, COOH)和66.87 (CH2COOH)2处峰也表明CH2COOH基团被成功引入。螺虫乙酯半抗原的分子式为C20H25NO5,相对分子质量为359.173 3,其在质谱中的母离子[M+H]+质荷比(为360.180 5)与X500R QTOF高分辨质谱仪测得质荷比(为360.181 0)相吻合[附图3(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)]。核磁图谱和质谱结果表明,成功合成了螺虫乙酯的半抗原。
1H NMR [600 MHz, 二甲基亚砜(dimethyl sulfoxide,DMSO)] δ 12.86 (s, 1H, COOH), 8.41 (s, 1H, NH), 7.07 (d, 1H, J=7.5 Hz, H-5 Ph), 7.04 (d, 1H, J=18.4, 7.5 Hz, H-6 Ph), 6.85 (s, 1H, H-2 Ph), 4.29 (dd, 2H, J=45.1, 16.3 Hz, CH2COOH), 3.26 (s, 3H, OCH3), 3.15 (m, 1H, H-8’), 2.24 (s, 3H, OCH3), 2.05 (s, 3H, OCH3), 1.99 (m, 2H, H-7’/H-9’), 1.89 (m, 2H, H-6’/H-10’), 1.53 (m, 4H, H-6’/H-7’/H-9’/H-10’)。
13C NMR (151 MHz, DMSO) δ 171.19 (COOH), 171.12 (C-2’), 169.02 (C-4’), 135.05 (C-1 Ph), 134.46 (C-3 Ph), 131.97 (C-4 Ph), 131.27 (C-5 Ph), 129.72 (C-6 Ph), 128.89 (C-2 Ph), 106.95 (C-3’), 77.93 (C-8’), 66.87 (CH2COOH), 60.15 (C-5’), 55.36 (OCH3), 33.31and 32.63 (C-6’和C-10’), 27.89 (C-7’和C-9’), 20.89 (CH3-Ph), 19.47 (CH3-Ph)。
2.2 螺虫乙酯人工抗原鉴定结果
SDS-PAGE中相对分子质量小的化合物的电泳速度大于相对分子质量大的化合物,故由附图4(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)可以看出,OVA和BSA的电泳速度大于螺虫乙酯偶联物,表明螺虫乙酯偶联物的相对分子质量大于OVA和BSA的相对分子质量,OVA和BSA的相对分子质量分别约为44、66 kDa,螺虫乙酯偶联物的条带也在44、66 kDa附近,证明螺虫乙酯半抗原与OVA或BSA偶联成功。
2.3 融合小鼠血清效价
融合前3 d对免疫的小鼠血清效价进行检测,选择血清效价和抑制率高的小鼠加强免疫以备后续融合。其中,附表3(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)显示的是融合小鼠的血清效价,筛选出抗原抗体的组合为:包被抗原螺虫乙酯-OVA 1∶16 000,血清1:8 000,此时该融合小鼠血清对1 000 μg/L螺虫乙酯的抑制效率最高(92.7%),该组合用于筛选细胞。以对照孔OD值与抑制孔之间的差值至少>1.0为标准,当包被原稀释1∶8 000时,融合小鼠的血清效价为16 000。
2.4 最佳抗原抗体工作浓度的确定
由附表4(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)可知,当包被原螺虫乙酯-OVA稀释16 000 倍(0.062 5 mg/L)、腹水(mAb 3D11G7)稀释16 000倍时,对照孔的OD450nm值在1.00左右,且抑制孔的抑制率>90%,故该组合为建立标准曲线的最佳抗原抗体工作浓度组合。
2.5 icELISA检测螺虫乙酯的标准曲线
在最佳抗原抗体的工作浓度下,以一定浓度梯度的螺虫乙酯为横坐标,其在450 nm处的OD值为纵坐标,通过Logistic函数进行拟合得到标准曲线,如图2所示,抗体mAb 3D11G7的IC50值为2.1 μg/L,检测范围IC20~IC80为0.5~8.6 μg/L,相关系数R2=0.999 7。这表明,利用本研究设计合成的螺虫乙酯半抗原偶联大分子蛋白进行免疫能够制备出特异性识别螺虫乙酯的单克隆抗体。

图2 icELISA检测螺虫乙酯的标准曲线
Fig.2 Inhibition curve of the icELISA for spirotetramat
2.6 抗螺虫乙酯单克隆抗体特异性分析
为了评估抗螺虫乙酯单克隆抗体mAb 3D11G7的特异性,选择与螺虫乙酯结构类似的化合物进行交叉反应实验,结果如表1所示。单克隆抗体mAb 3D11G7与螺虫乙酯的代谢物B-enol、B-glu的CR分别为72.4%和15.2%,与B-keto和B-mono几乎没有交叉反应(CR< 0.01%)。螺虫乙酯的完全抗原是通过B-enol的羟基与载体蛋白进行偶联的,与羟基相对的B-enol另一部分暴露在载体蛋白表面,这就导致抗体mAb 3D11G7可以区分B-mono和B-keto中的吡咯烷环,但不能区分螺虫乙酯中的碳酸乙酯基团和B-glu中的糖苷基团。由于螺虫乙酯与其他的杀螨剂螺螨酯、乙螨唑、唑螨酯和哒螨灵的结构差异相对较大,mAb 3D11G7与它们几乎没有交叉反应(CR<0.01%)。
表1 螺虫乙酯单克隆抗体的交叉反应率
Table 1 Cross-reactivity of the monoclonal antibodies against spirotetramat structural analogs
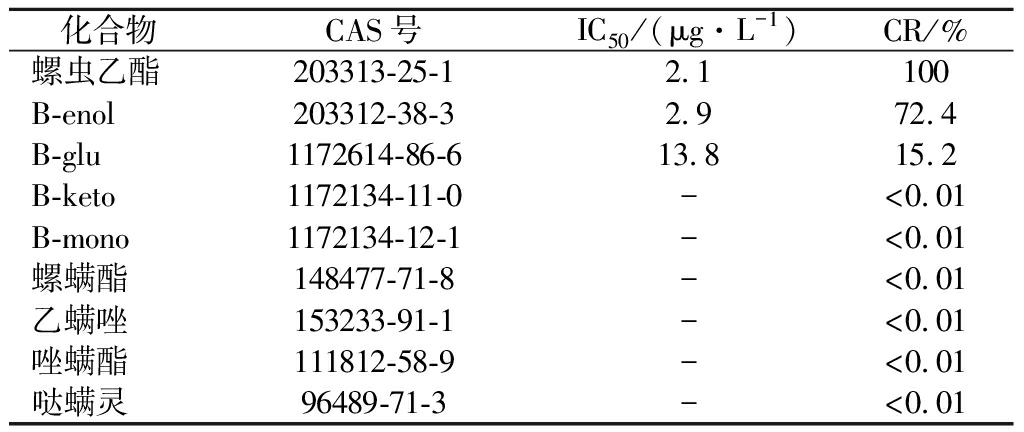
化合物CAS号IC50 /(μg·L-1)CR/%螺虫乙酯203313-25-12.1100B-enol203312-38-32.972.4B-glu1172614-86-613.815.2B-keto1172134-11-0-<0.01B-mono1172134-12-1-<0.01螺螨酯148477-71-8-<0.01乙螨唑153233-91-1-<0.01唑螨酯111812-58-9-<0.01哒螨灵96489-71-3-<0.01
2.7 缓冲液中有机溶剂对icELISA的影响
为了评估缓冲液中的有机溶剂对icELISA的影响,选择农药提取过程中最常用的两种有机溶剂甲醇和乙腈,配制含不同浓度有机溶剂的PBSTG溶液,通过icELISA测定抗原抗体结合情况并计算IC50。如附图5-A(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)所示,当甲醇的体积分数为5%时,测得的IC50值为2.88 μg/L大于不含有机溶剂测得的IC50(2.1 μg/L),且随着甲醇浓度的增加,B0值变化不大,但IC50值逐渐增大,当甲醇体积分数为40%时,IC50为55.12 μg/L,这表明甲醇对mAb 3D11G7与包被原的结合能力有影响,且高浓度的甲醇使icELISA的灵敏度下降。如附图5-B(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)所示,当乙腈体积分数为5%时,测得的IC50值为3.75 μg/L大于不含有机溶剂测得的IC50值(2.1 μg/L),当乙腈体积分数由5%升高至10%,B0值变化不大,但IC50值由3.75 μg/L上升至6.84 μg/L,当乙腈体积分数由5%升高至20%,B0值由1.08降至0.55,IC50值由3.75 μg/L上升至14.73 μg/L,这表明乙腈对mAb 3D11G7与包被原的结合能力有影响,且高浓度的乙腈使icELISA的灵敏度下降。因此在使用icELISA测定样品中的螺虫乙酯时,应将样品提取液中的有机溶剂除去,再使用样品稀释液PBSTG复溶。
2.8 缓冲液的pH对icELISA的影响
为了评估缓冲液的pH对icELISA的影响,配制不同pH值的PBSTG溶液,通过icELISA测定抗原抗体结合情况并计算IC50值。如附图6(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)所示,不同pH值条件下的IC50值差异不大,但pH值为7.4时的B0值最大,即在该pH值条件下mAb 3D11G7与包被原的结合能力最强且灵敏度最高,故在测定实际样品时,直接使用PBSTG溶液进行复溶而无需调节稀释液的pH值。
2.9 加标回收率
采用加标回收的方法评估基于抗螺虫乙酯单克隆抗体建立的icELISA的准确性和重现性。根据GB 2763—2021《食品安全国家标准 食品中农药最大残留限量》可知,我国蔬菜和水果中螺虫乙酯的最大残留限量(maximum residues limits,MRLs)为100~10 000 μg/L,猕猴桃除外(20 μg/L)。在河水中添加的螺虫乙酯的水平分别为20、50、100、500 μg/L,用PBSTG稀释后直接通过icELISA测定,结果如表2所示。在土壤、番茄和柑橘样品中添加的螺虫乙酯的水平分别为50、100、500、1 000 μg/L。由于有机溶剂对icELISA有影响,故使用甲醇提取后,需氮吹干燥以除去甲醇再进行测定。在河水、土壤、番茄和柑橘基质中,螺虫乙酯的平均加标回收率变幅为72.9%~110.1%,相对标准偏差(relative standard deviation,RSD)的变幅为0.7%~12.6%,符合NY/T 788—2018《农作物中农药残留试验准则》中不同添加水平对回收率和RSD的要求(表3)。
表2 icELISA 测定样品中螺虫乙酯的平均加标回收率(n=3)
Table 2 Recovery of spirotetramat determined by icELISA in spiked different samples (n=3)
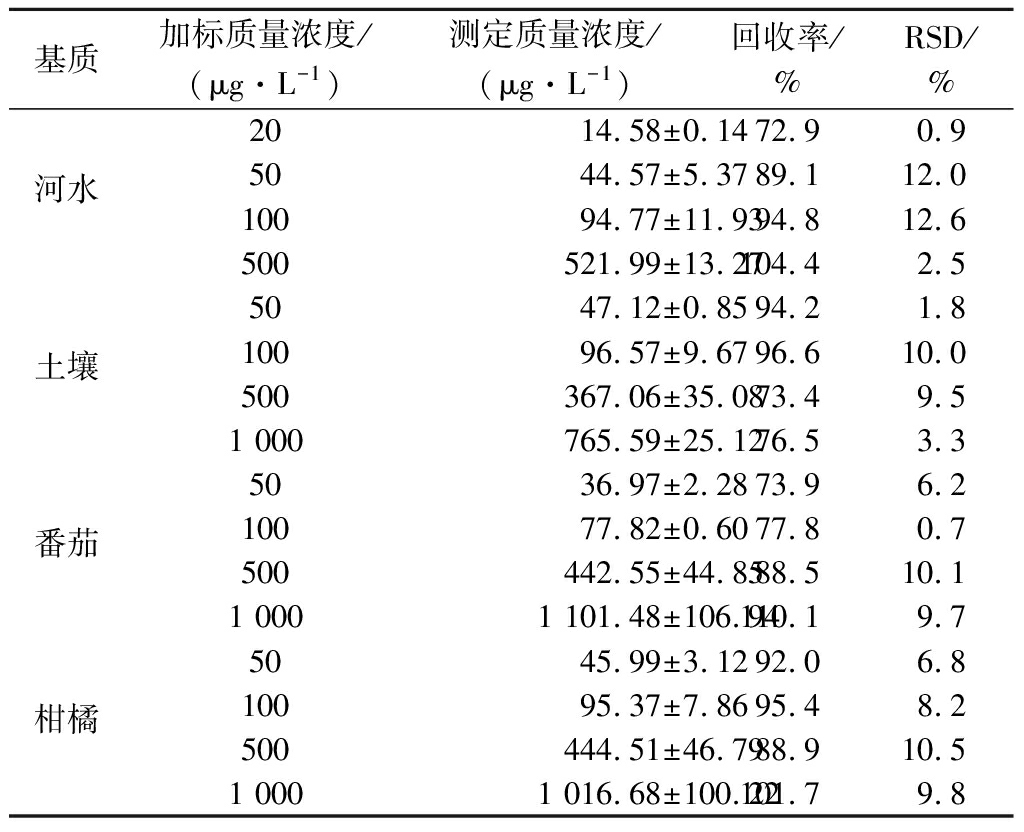
基质加标质量浓度/(μg·L-1)测定质量浓度/(μg·L-1)回收率/%RSD/%2014.58±0.1472.90.9河水5044.57±5.3789.112.010094.77±11.9394.812.6500521.99±13.27104.42.55047.12±0.8594.21.8土壤10096.57±9.6796.610.0500367.06±35.0873.49.51 000765.59±25.1276.53.35036.97±2.2873.96.2番茄10077.82±0.6077.80.7500442.55±44.8588.510.11 0001 101.48±106.94110.19.75045.99±3.1292.06.8柑橘10095.37±7.8695.48.2500444.51±46.7988.910.51 0001 016.68±100.22101.79.8
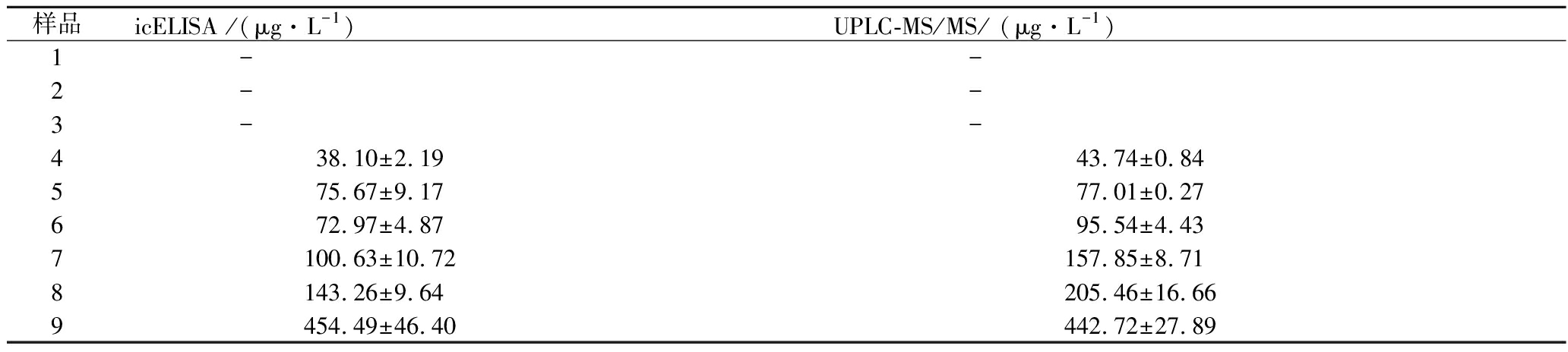
2.10 实际样品检测结果
为了进一步验证基于抗螺虫乙酯单克隆抗体开发的icELISA的可靠性,选择UPLC-MS/MS进行验证。使用icELISA和UPLC-MS/MS同时测定阴性柑橘样品(不含螺虫乙酯)和阳性柑橘样品(随机浸泡的盲样)。如附图7(https://kns.cnki.net/kcms/detail/11.1802.TS.20211011.1812.006.html)所示,icELISA与UPLC-MS/MS测定柑橘样品结果的相关性R2=0.965 2,表明两种方法的检测结果具有一致性。如表3所示,icELISA和UPLC-MS/MS在3个阴性柑橘样品中均未检出螺虫乙酯残留。而icELISA测得柑橘阳性样品中螺虫乙酯的残留量为38.10~454.49 μg/L。除猕猴桃外,我国蔬菜和水果中螺虫乙酯的MRLs为100~10 000 μg/L(GB 2763—2021),本研究开发的icELISA检测范围为0.5~8.6 μg/L,能够满足蔬菜和水果中螺虫乙酯检测的要求。
表3 icELISA和UPLC-MS/MS测定柑桔样品中的螺虫乙酯
Table 3 Analysis of spirotetramat in different citrus samples by icELISA and UPLC-MS/MS
样品icELISA /(μg·L-1)UPLC-MS/MS/ (μg·L-1)1--2--3--438.10±2.1943.74±0.84575.67±9.1777.01±0.27672.97±4.8795.54±4.437100.63±10.72157.85±8.718143.26±9.64205.46±16.669454.49±46.40442.72±27.89
3 结论与讨论
在我国,螺虫乙酯的残留定义是螺虫乙酯和B-enol的总和,以螺虫乙酯表示(GB/T 2763—2021)。因此,为了开发检测螺虫乙酯残留的免疫方法,抗体应该同时识别螺虫乙酯和B-enol。CEVALLOS-CEDE O等[13-14]从螺虫乙酯不同位点引入相似的连接臂,设计合成了2种半抗原,筛选出主要识别B-enol的单克隆抗体,建立相应的免疫分析方法,但其仅测定了葡萄、葡萄汁和葡萄酒中的螺虫乙酯,未测定其他基质。在本研究中,半抗原是通过B-enol的羟基进行衍生,合成步骤简单。虽然半抗原的结构在酯基部分与螺虫乙酯不同,但在与BSA或OVA偶联后,螺虫乙酯和B-enol的共同结构暴露在载体蛋白表面,故筛选出的抗体mAb 3D11G7能够同时识别螺虫乙酯和B-enol。基于筛选到的单克隆抗体,建立了icELISA,其IC50值为2.1 μg/L,最佳工作范围为0.5~8.6 μg/L。在河水、土壤、番茄和柑橘样品基质中的平均加标回收率为72.9%~110.1%。此外,icELISA还成功应用于检测阳性柑橘样品中的螺虫乙酯残留,其结果与UPLC-MS/MS方法的检测结果具有一致性。因此,本研究基于抗螺虫乙酯单克隆抗体建立的icELISA是快速检测蔬菜、水果和环境基质中螺虫乙酯残留的良好选择。
O等[13-14]从螺虫乙酯不同位点引入相似的连接臂,设计合成了2种半抗原,筛选出主要识别B-enol的单克隆抗体,建立相应的免疫分析方法,但其仅测定了葡萄、葡萄汁和葡萄酒中的螺虫乙酯,未测定其他基质。在本研究中,半抗原是通过B-enol的羟基进行衍生,合成步骤简单。虽然半抗原的结构在酯基部分与螺虫乙酯不同,但在与BSA或OVA偶联后,螺虫乙酯和B-enol的共同结构暴露在载体蛋白表面,故筛选出的抗体mAb 3D11G7能够同时识别螺虫乙酯和B-enol。基于筛选到的单克隆抗体,建立了icELISA,其IC50值为2.1 μg/L,最佳工作范围为0.5~8.6 μg/L。在河水、土壤、番茄和柑橘样品基质中的平均加标回收率为72.9%~110.1%。此外,icELISA还成功应用于检测阳性柑橘样品中的螺虫乙酯残留,其结果与UPLC-MS/MS方法的检测结果具有一致性。因此,本研究基于抗螺虫乙酯单克隆抗体建立的icELISA是快速检测蔬菜、水果和环境基质中螺虫乙酯残留的良好选择。
[1] TIAN F J, QIAO C K, WANG C X, et al.Simultaneous determination of spirodiclofen, spiromesifen, and spirotetramat and their relevant metabolites in edible fungi using ultra-performance liquid chromatography/tandem mass spectrometry[J].Scientific Reports, 2021, 11(1):1 547.
[2] CHEN X J, MENG Z Y, ZHANG Y Y, et al.Degradation kinetics and pathways of spirotetramat in different parts of spinach plant and in the soil[J].Environmental Science and Pollution Research International, 2016, 23(15):15 053-15 062.
[3] 叶玉凤. 螺虫乙酯在柑橘和土壤中的残留规律和降解动态研究[D].重庆:西南大学, 2018.
YE Y F.Study on residues rule and degradation dynamics of spirotetramat in citrus and soil[D].Chongqing:Southwest University, 2018.
[4] ZHANG Q M, ZHANG G L, YIN P J, et al.Toxicological effects of soil contaminated with spirotetramat to the earthworm Eisenia fetida[J].Chemosphere, 2015, 139:138-145.
[5] WU H M, RAO Q, ZHENG J Y, et al.Biochemical and histological alterations in adult zebrafish (Danio rerio) ovary following exposure to the tetronic acid insecticide spirotetramat[J].Ecotoxicology and Environmental Safety, 2018, 164:149-154.
[6] ZHANG J, QIAN L, WANG C, et al.Dysregulation of endocrine disruption, apoptosis and the transgenerational toxicity induced by spirotetramat[J].Chemosphere, 2020, 240:124900.
[7] YIN X H, JIANG S J, YU J, et al.Effects of spirotetramat on the acute toxicity, oxidative stress, and lipid peroxidation in Chinese toad (Bufo bufo gargarizans) tadpoles[J].Environmental Toxicology and Pharmacology, 2014, 37(3):1 229-1 235.
[8] ANASTASSIADOU M, BELLISAI G, BERNASCONI G, et al.Modification of the existing maximum residue levels for spirotetramat in leeks, spring onions and honey[J].EFSA Journal European Food Safety Authority, 2021, 19(3):6 517.
[9] 张蕊, 杨石有, 张贺, 等.高效液相色谱法测定螺虫乙酯在黄瓜幼苗中的内吸传导特性[J].农药, 2019, 58(2):99-102.
ZHANG R, YANG S Y, ZHANG H, et al.The intake transportation function of spirotetramat in cucumber using high performance liquid chromatography[J].Agrochemicals, 2019, 58(2):99-102.
[10] ZHANG J, QIAN L, WANG C, et al.UPLC-TOF-MS/MS metabolomics analysis of zebrafish metabolism by spirotetramat[J].Environmental Pollution, 2020, 266:115310.
[11] 杨松, 王瑶, 禾丽菲, 等.QuEChERS-气相色谱-串联质谱法分析鲜茶叶中6种杀虫剂的残留及消解动态[J].分析试验室, 2019, 38(12):1 459-1 464.
YANG S, WANG Y, HE L F, et al.Residue and dissipation dynamics of six insecticides in fresh tea by QuEChERS-gas chromatography tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2019, 38(12):1 459-1 464.
[12] LAN J Q, ZHAO H W, JIN X T, et al.Development of a monoclonal antibody-based immunoaffinity chromatography and a sensitive immunoassay for detection of spinosyn A in milk, fruits, and vegetables[J].Food Control, 2019, 95:196-205.
[13] CEVALLOS-CEDE O R E, AGULL
O R E, AGULL C, ABAD-SOMOVILLA A, et al.Hapten design and antibody generation for immunoanalysis of spirotetramat and spirotetramat-enol[J].ACS Omega, 2018, 3(9):11 950-11 957.
C, ABAD-SOMOVILLA A, et al.Hapten design and antibody generation for immunoanalysis of spirotetramat and spirotetramat-enol[J].ACS Omega, 2018, 3(9):11 950-11 957.
[14] CEVALLOS-CEDE O R E, AGULLO C, ABAD-FUENTES A, et al.Enzyme and lateral flow monoclonal antibody-based immunoassays to simultaneously determine spirotetramat and spirotetramat-enol in foodstuffs[J].Scientific Reports, 2021, 11(1):1 809.
O R E, AGULLO C, ABAD-FUENTES A, et al.Enzyme and lateral flow monoclonal antibody-based immunoassays to simultaneously determine spirotetramat and spirotetramat-enol in foodstuffs[J].Scientific Reports, 2021, 11(1):1 809.
[15] CUI Y L, ZHAO J, ZHOU J, et al.Development of a sensitive monoclonal antibody-based indirect competitive enzyme-linked immunosorbent assay for analysing nobiletin in citrus and herb samples[J].Food Chemistry, 2019, 293:144-150.
[16] 郭素琴. 青蒿素类药物特异性单克隆抗体的制备及快速免疫检测方法的建立与应用[D].北京:中国农业大学, 2016.
GUO S Q.Development and application of specific monoclonal antibodies and immunoassay techniques for artemisinin and its derivatives[D].Beijing:China Agricultural University, 2016.
[17] ZHAO J, ZHANG Y H, ZHAO Q Y, et al.A sensitive and practical ELISA for analyzing naringenin in pummelo and herb samples[J].Food Chemistry, 2021, 362:130223.
[18] 李壮, 张维库, 张越, 等.梓醇人工抗原的合成、鉴定及免疫原性的初步研究[J].中国中药杂志, 2015, 40(7):1 287-1 290.
LI Z, ZHANG W K, ZHANG Y, et al.Synthesis, identification of artificial antigen of catalpol and preliminary study of immunogenicity[J].China Journal of Chinese Materia Medica, 2015, 40(7):1 287-1 290.
[19] ZHANG B, NAN T G, ZHAN Z L, et al.A monoclonal antibody-based enzyme-linked immunosorbent assay for the determination of chlorogenic acid in honeysuckle[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 148:1-5.
[20] LIU Y Y, SU X S, JIAN Q, et al.Behaviour of spirotetramat residues and its four metabolites in citrus marmalade during home processing[J].Food Additives and Contaminants Part A:Chemistry, Analysis, Control, Exposure & Risk Assessment, 2016, 33(3):452-459.