有机酸是存在于食品中的一类重要风味物质,是构成食品酸味的主要成分,其种类和含量对食品酸度和风味都有重要影响[1-2]。食品中有机酸的种类很多,主要来源于原材料和生产发酵过程中,同时由于保存或者风味的需要,会添加山梨酸、苯甲酸、柠檬酸等功能性添加剂,这些功能性添加剂也是食品中有机酸的重要来源之一[3-4]。因此,检测食品中有机酸的种类及含量,可对食品的风味和品质进行监控,有利于提升产品的质量。
目前国内外关于有机酸定性定量的方法主要有离子色谱法[5]、毛细管电泳法[6]、液相色谱法[7]、气相色谱法等[8]。离子色谱、毛细管电泳、液相色谱法主要用于含量高的多元酸和多羟基酸的分析。其中只有衍生化前处理-GC-MS方法可以实现挥发性和非挥发性有机酸的同时检测。然而,传统的衍生化过程操作繁琐且耗时,因此发展了缩短衍生反应时间的方法如微波辅助衍生[9]、超声辅助衍生化[10]和固相载体衍生[11]等。其中微波衍生法较传统的加热衍生方法能够提高衍生反应效率,明显加快反应速率[12-15]。AMENDOLA等[16]运用微波辅助衍生结合气相色谱质谱联用技术测定了人尿中的利尿剂,结果利尿剂衍生从传统加热法的3 h大幅度缩短至10 min,并改善了方法的检出限。LIEBEKE等[17]运用微波辅助甲氧胺和N-甲基-N-三甲基硅基氟乙酰胺硅烷化衍生法结合气相色谱-质谱联用法对细菌代谢产物进行了代谢组学研究,衍生反应时间由加热法的2 h减少到6 min,且不会丢失衍生代谢组样品的定性或定量信息。但目前已报道的微波衍生反应器[18-19]多为微波萃取合成反应器或家用微波炉改装的传统谐振腔反应系统,需使用较高的微波功率以保证谐振腔内的微波能量密度,同时由于谐振腔中微波多次反射产生不可预测的多模态,很难对衍生反应的升温过程进行平稳、精准的控制,常因升温速度过高导致样品过热等问题,造成衍生副反应、热敏成分分解、溶液过热蒸发将挥发性衍生产物带出反应器等问题,影响了分析结果的的准确性和精密度。由于传统谐振腔反应系统通常采用开口烧瓶为反应容器,瓶口需设置冷凝装置,整个反应器结构复杂、体积大、操作繁琐,亦制约了其在分析中的应用。
聚焦式微波系统[20-21],如CEM公司的环形聚集微波反应系统,具有明显的单模态微波辐射特征,改善了微波处理过程样品的升温稳定性和温度分布均匀性,克服了传统谐振腔微波反应器的不足,在合成、萃取及分析样品前处理等领域的应用受到广泛关注[22-23]。本文针对食品风味成分色谱柱前快速衍生处理的需要,对已有聚焦式微波反应系统进行了改进,提出了一种新型微腔体微波反应器,结合已有的低温微波色谱柱前系统,建立了有机酸的微波辅助衍生-气相色谱质谱法(microwave-assisted derivatization-gas chromatography mass spectrometry,MAD-GC-MS)分析方法,并用于水果中琥珀酸和柠檬酸2种有机酸的分析。本文的研究旨在改善传统谐振腔微波反应器在色谱柱前处理中存在的诸多问题,为微波技术在食品分析中的实际应用提供新的技术手段。
1 材料与方法
1.1 材料与试剂
柠檬、猕猴桃、番木瓜,当地农贸市场;琥珀酸、柠檬酸(纯度大于99.5%)、正己烷、三氯甲烷、乙酸乙酯、甲醇(均为色谱纯)、浓硫酸(优级纯),阿拉丁试剂(上海)有限公司;实验用水为二次蒸馏水。
琥珀酸和柠檬酸标准溶液:均为1.0 mg/mL甲醇溶液,于4 ℃避光保存;H2SO4-CH3OH混合衍生试剂:取80 mL冷冻后的甲醇于200 mL烧杯中,于冰水浴中边搅拌边缓慢加入20%浓硫酸(体积分数),充分混匀后4 ℃保存。
1.2 仪器与设备
THERMOF I SHER ISQ气相色谱-质联用仪,赛默飞世尔科技有限公司;GC-2014C气相色谱仪,日本岛津公司;KQ-250DA数控超声波清洗器,昆山市超声仪器有限公司;TEST0 865红外热像仪,德国德图公司;轻舟低温微波色谱柱前系统及多模式PC控制软件,功率200 W,同轴输出,内设光纤温度控制模块,直径1 mm荧光光纤温度传感器,云南民族大学研制。
1.3 实验方法
1.3.1 微腔体微波反应器及系统
本文研制的微腔体微波反应器结构如图1-a所示,该反应器由小型反应管、微波辐射器和微型腔体三部分组成。反应管是一圆底钳口高硼玻璃小管(10.0 mL),配有内设组合式密封垫的铝压盖,组合式密封垫由聚四氟乙烯层、硅胶层和屏蔽微波的铝箔层构成。而微波辐射器为一小型微带微波天线,微型腔体为金属材质,具有与反应管相匹配内径的微波辐射器通过法兰连接盘连接。
使用时,取待处理溶液于反应管中,在组合式密封垫中设一小孔,使用压盖钳将组合式密封垫和铝压盖压紧于反应管管口,密封后的反应管置于微型腔体中,将光纤温度传感器穿过密封垫片小孔浸入反应管内的溶液中,使用同轴电缆将其同轴输入接口与微波色谱柱前系统主机的同轴输出接口连接(图1-b),光纤温度传感器与光纤温度传感接口连接,设置微波功率为30 W,控制温度为85 ℃, 处理时间为4 min,开启微波系统,对反应管中的样品溶液进行处理,反应完成后取出反应管,放置至冷却。

a-微波反应器结构图;b-系统实物图
图1 微腔体微波反应器结构图和系统实物图
Fig.1 The structure drawing of microcavity microwave reactor and the physical map of system
1.3.2 色谱分析条件
气相色谱分析条件:色谱柱SH-Rtx-1毛细管柱(30 m×0.25 mm,ID 0.25 μm);进样口230 ℃;FID检测器250 ℃;分流进样,分流比10∶1;柱流速1.0 mL/min;溶剂延迟3 min;进样量1.0 μL;升温程序:初始温度80 ℃,保持2.0 min,以10 ℃/min的速率升温至170 ℃,保持2.0 min,再以15 ℃/min的速率升温至200 ℃;载气(N2)流速0.8 mL/min,空气流速400 mL/min,氢气流速40 mL/min。
GC-MS分析条件:TR-1MS色谱柱(30 m×0.25 mm,ID 0.25 μm),分析条件同上。MS条件:EI电离源;电子能量70 eV;离子源温度300 ℃;传输线温度250 ℃;质量扫描范围35~650 amu。
1.3.3 样品处理和测定
分别移取1.00 mL待处理有机酸分析溶液至2只10 mL反应管中,分别加入2.00 mL分数为20%的H2SO4-CH3OH衍生试剂,摇匀,设置微波功率为30 W,控制温度为85 ℃,微波处理时间为4 min,待反应完成后,取出反应管放置至冷却,5 000 r/min离心5 min,取上清液1.00 mL于5 mL离心管中,再加入1.00 mL蒸馏水和500 μL三氯甲烷,超声萃取5 min,5 000 r/min离心2 min,用带有0.45 μm微孔滤膜的进样枪取250 μL三氯甲烷层液至进样瓶中,进行气相色谱或GC-MS分析。
1.3.4 样品处理和测定
取新鲜柠檬、猕猴桃或番木瓜样品洗净,去皮除芯,切成小块,称取1.0 g于10 mL离心管,用手持式电动组织研磨器磨细,加入10 mL甲醇,超声提取10 min,5 000 r/min离心5 min,取上清液1.0 mL,按照1.3.3衍生后进行分析,记录峰面积,采用外标法计算有机酸的含量。
2 结果与分析
2.1 微腔体微波反应器及性能研究
与传统谐振腔微波反应器采用的设有冷凝装置的开口烧管反应容器不同,本研究所设计的微型化微腔体微波衍生反应器(图1-a),反应容器采用密封的小型反应管,待处理样品溶液量明显减少(3 mL)。用红外成像法研究了微波处理过程反应管内样品溶液的温度分布及变化,图2-a为30 W小功率微波处理4 min后反应管内的红外成像图。由图2可知,反应管内样品溶液的温度呈现明显的均匀分布状态,这可归因于微腔体微波反应器微波能从底部定向馈入,靠近底部的溶液被迅速加热形成向上的快速热对流即“微波搅拌”作用所致。图2-b是30 W小功率微波处理过程样品溶液时中心部位的升温曲线。由图2-b可知,处理时间从1 min增加至5 min,升温曲线呈现了良好的线性,样品温度从25 ℃匀速上升至90 ℃,且多次测量结果具有较高的精密度。

a-红外热成像图;b-升温曲线
图2 微波预处理后样品的红外热成像图及升温曲线
Fig.2 The infrared thermal image of sample after microwave pretreatment and the heating curve
传统的谐振腔微波反应器由于微波的谐振作用,存在多个相互叠加的多模态微波辐射,通常需要使用较大的微波功率以保证大体积谐振腔内的功率密度,因此极性样品在谐振腔内升温非常迅速,适于快速干燥、灰化、热解或消解等需较高温度的“强”处理过程,但对于需要“低温”(低于液体沸点)的衍生等“弱”处理过程,谐振腔中多模态微波具有不可预测性,升温过程难于进行精准控制,极性液体样品强吸收微波迅速升温导致水分过热蒸发,造成大量挥发性衍生产物被水蒸气带出反应器,或热敏目标物质的热分解,难以保证分析结果的准确性和可靠性。本文设计的微腔体微波反应器,由于腔体体积明显小于传统谐振腔不会产生谐振作用,其导波作用可将微波从底部完全定向馈入样品中,使用小功率微波就能保证样品内的微波密度,具有单模态微波可控性好的的特征。由图2的实验结果可知,采用小功率微波对小量样品进行处理,在保证了微波过程快速高效的同时,实现了处理过程升温的匀速平稳、均匀可控,结合精准的光纤温度传感控温模块,可有效将衍生反应温度控制在所需的温度范围内,弥补了谐振腔微波反应器在色谱柱前衍生处理应用中的不足,对于改善微波衍生色谱方法的准确性、可靠性具有重要意义。
2.2 衍生物GC-MS鉴定及气相色谱分析
将质量浓度为1.0 mg/mL的琥珀酸和柠檬酸2种有机酸标准混合液置于反应管中,根据1.3.3微波甲酯化衍生操作步骤进行微波衍生,采用全波长扫描模式对2种有机酸混合标准溶液衍生物进行GC-MS分析,衍生物的质谱图如图3所示,图3-a和图3-b分别对应的琥珀酸和柠檬酸的甲酯化衍生产物琥珀酸二甲酯和柠檬酸三甲酯。进一步用气相色谱法对琥珀酸和柠檬酸2种有机酸标准混合液的微波衍生产物进行分析,结果如图4所示。由图4-a可知,气相色谱流出峰中,琥珀酸和柠檬酸衍生产物琥珀酸二甲酯和柠檬酸三甲酯的保留时间分别为5.29 min和11.25 min。在上述基础上,根据1.3.4的操作,对柠檬、猕猴桃和番木瓜3种样品进行微波辅助衍生,衍生产物进行气相色谱分析,结果分别见图4-b、图4-c和图4-d,结果表明,3种样品均在保留时间5.29 min和11.25 min处分别出现了明显的琥珀酸二甲酯和柠檬酸三甲酯峰,表明该方法可适用于新鲜水果中琥珀酸和柠檬酸的测定。
2.3 微波辅助衍生条件优化
2.3.1 硫酸体积分数及衍生剂用量的选择
本文采用H2SO4-CH3OH混合衍生剂对柠檬酸和琥珀酸2种有机酸进行微波衍生化处理,测定色谱峰面积。首先考察了混合衍生剂中硫酸体积分数对有机酸衍生物色谱峰面积的影响,结果如图5所示。由图5可知,随着硫酸体积分数的不断增大,柠檬酸的色谱峰面积先增加后减小,当体积分数为20%时,色谱峰面积达到最高,但当体积分数大于20%时,色谱峰面积随之降低;对于琥珀酸,硫酸体积分数从5%增加至20%,色谱峰面积呈缓慢增长趋势,超过20%则随之下降。由图5可以看出,硫酸体积分数对柠檬酸色谱峰面积的影响明显高于琥珀酸,但硫酸体积分数为20%时,2种有机酸色谱峰面积均达到最大,因此,可选择20%的硫酸体积分数进行后续研究。图6为衍生剂用量对色谱峰面积的影响,当衍生剂用量低于1.0 mL时,2种有机酸衍生物的色谱峰面积均呈增加趋势,且均在衍生剂用量为1.0 mL时达最大,衍生剂用量超过1.0 mL时2种有机酸衍生物的色谱峰面积均呈下降趋势,本文选择1.0 mL进行后续的研究。
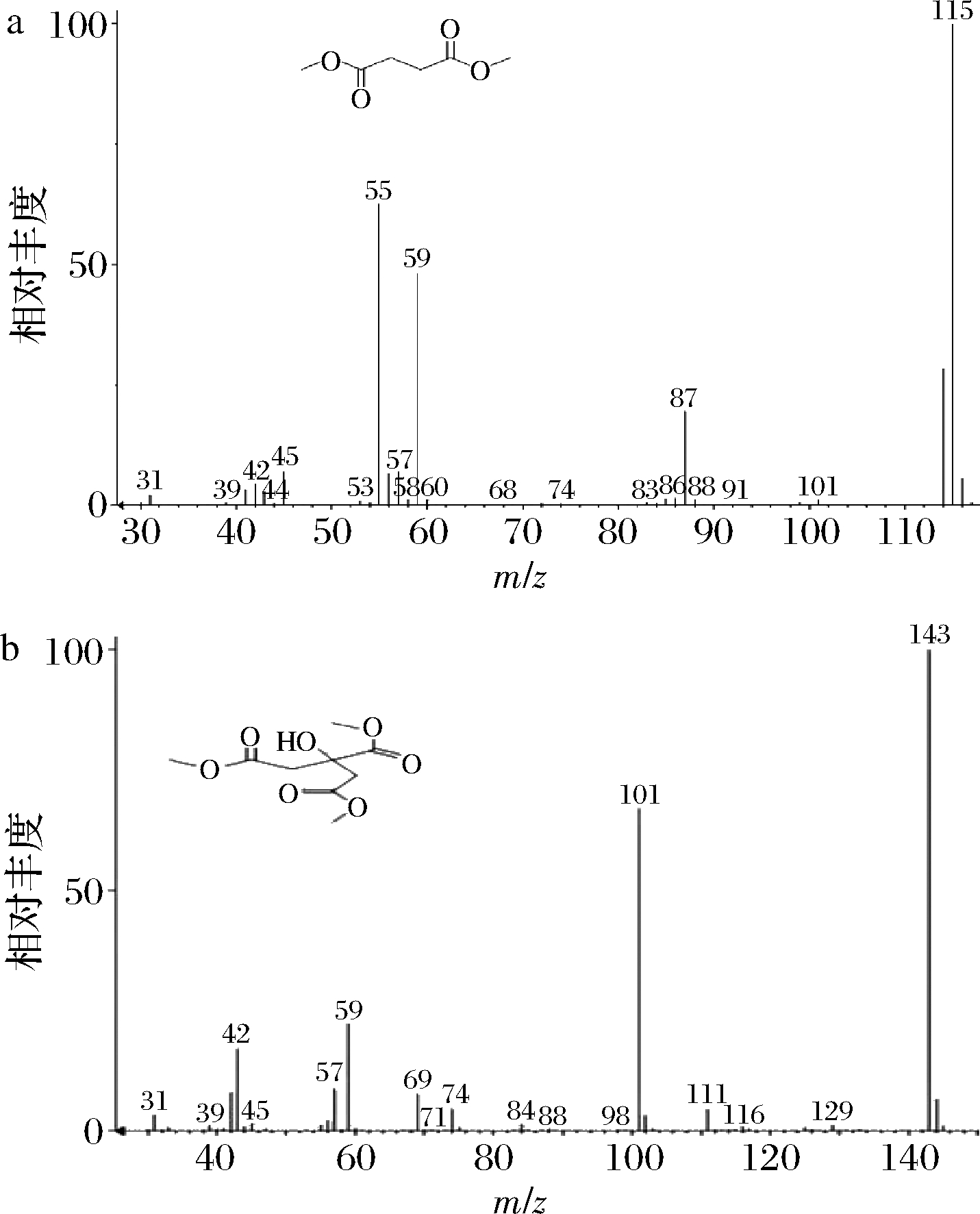
a-琥珀酸衍生物;b-柠檬酸衍生物
图3 琥珀酸衍生物和柠檬酸衍生物的质谱图
Fig.3 The mass spectrograms of succinic acid derivatives and citric acid derivatives
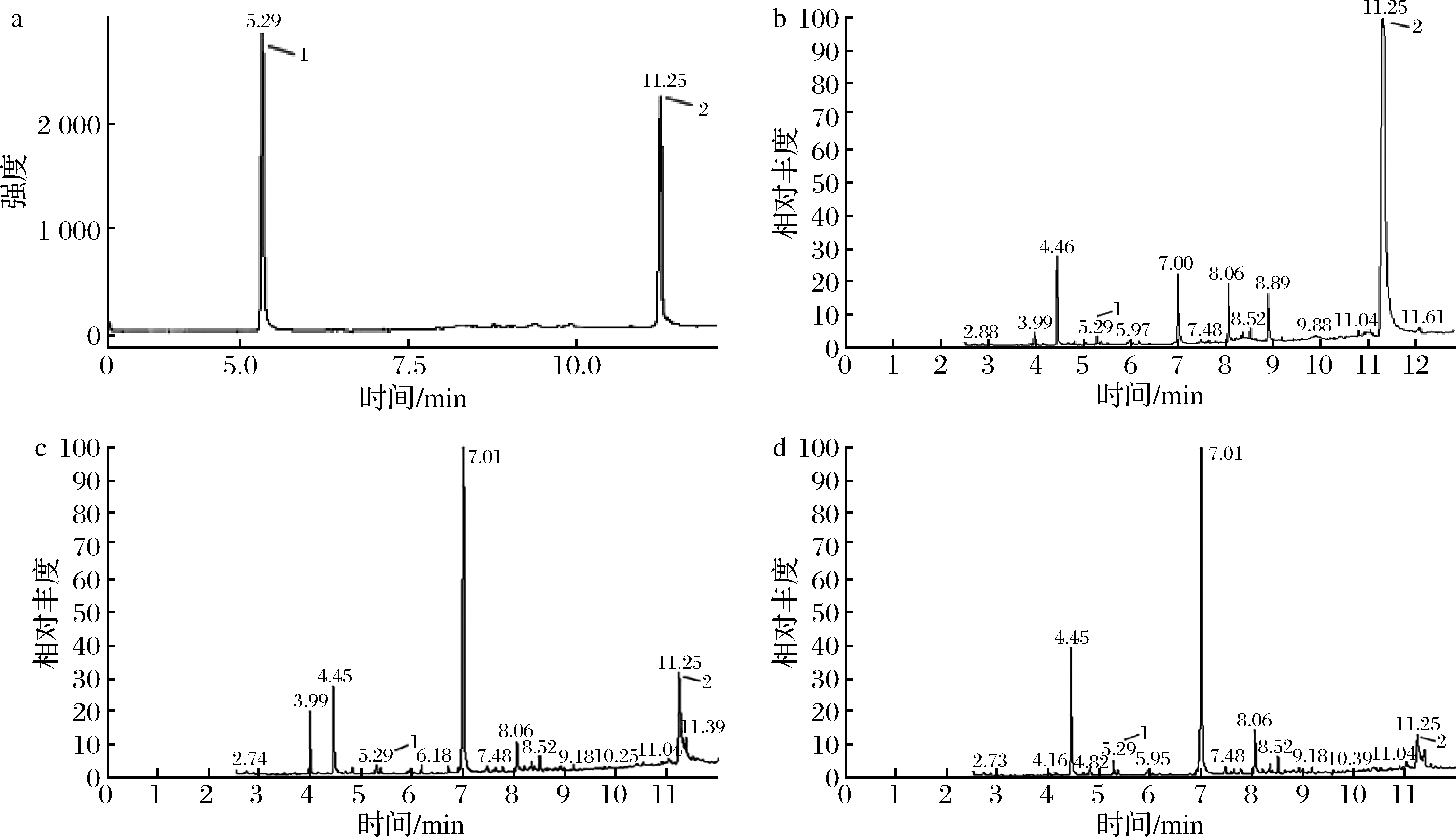
a-混合标液;b-柠檬;c-猕猴桃;d-番木瓜;1-琥珀酸二甲酯;2-柠檬酸二甲酯
图4 琥珀酸和柠檬酸混合标液、柠檬、猕猴桃和番木瓜中有机酸衍生物的气相色谱图
Fig.4 The gas chromatograms of organic acid derivatives in standard solutions, lemon sample, kiwi sample and papaya sample
2.3.2 微波衍生功率和时间对衍生效果的影响
图7和图8分别为微波功率和微波衍生时间对2种有机酸衍生物色谱峰面积的影响。图7结果表明,随着微波功率从10 W增加到30 W,2种有机酸衍生物色谱峰面积随着微波功率增加而增加,30 W时达到最大,其后开始下降。进一步由图8可知,在30 W微波功率条件下,随着微波衍生时间延长至4 min时,2种有机酸衍生物色谱峰面积均趋于最大,据此本文选择30 W微波功率和4 min衍生处理进行后续实验。
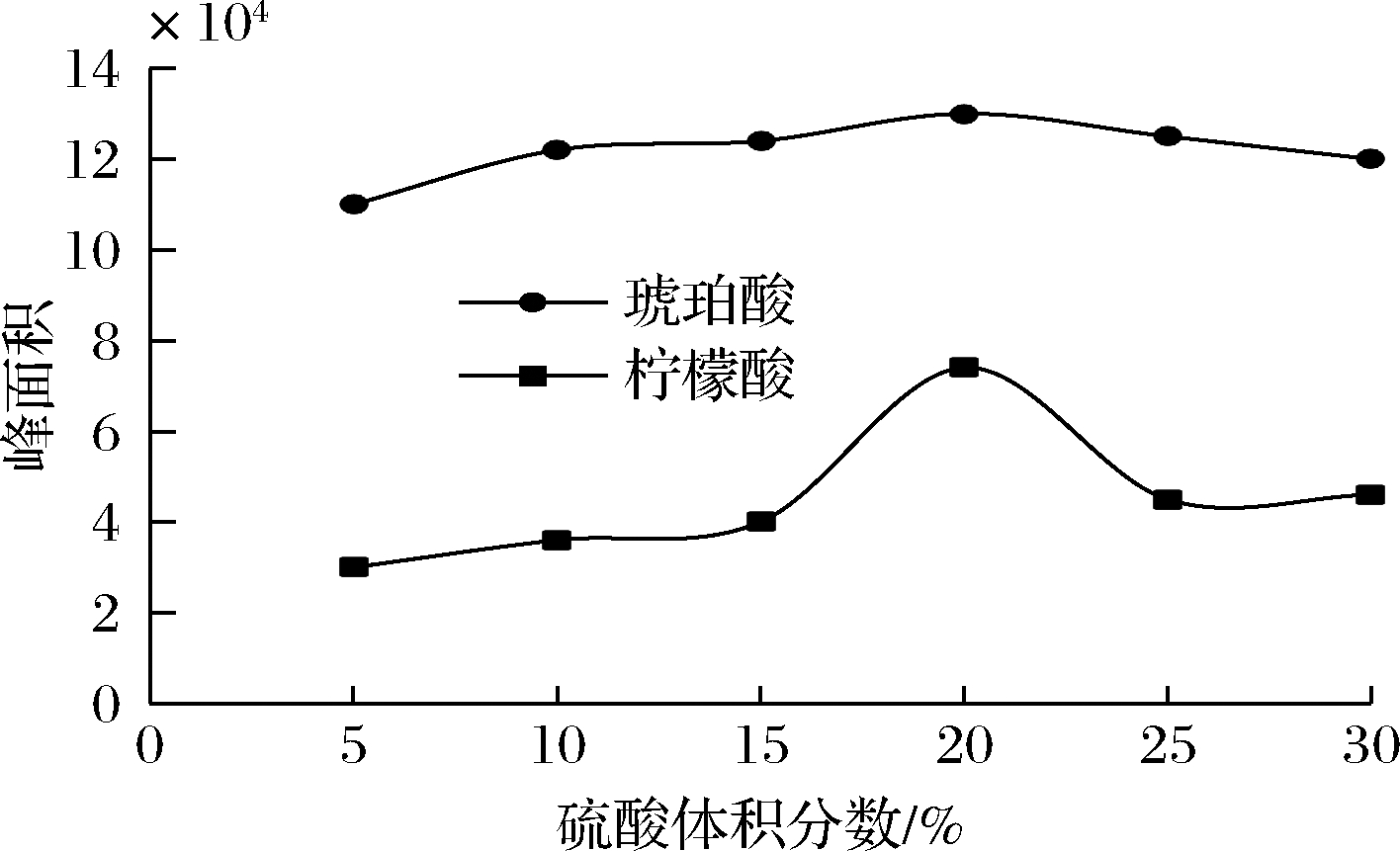
图5 硫酸体积分数对衍生物峰面积的影响
Fig.5 The effect of volume fraction of H2SO4 on peak areas of two derivatives
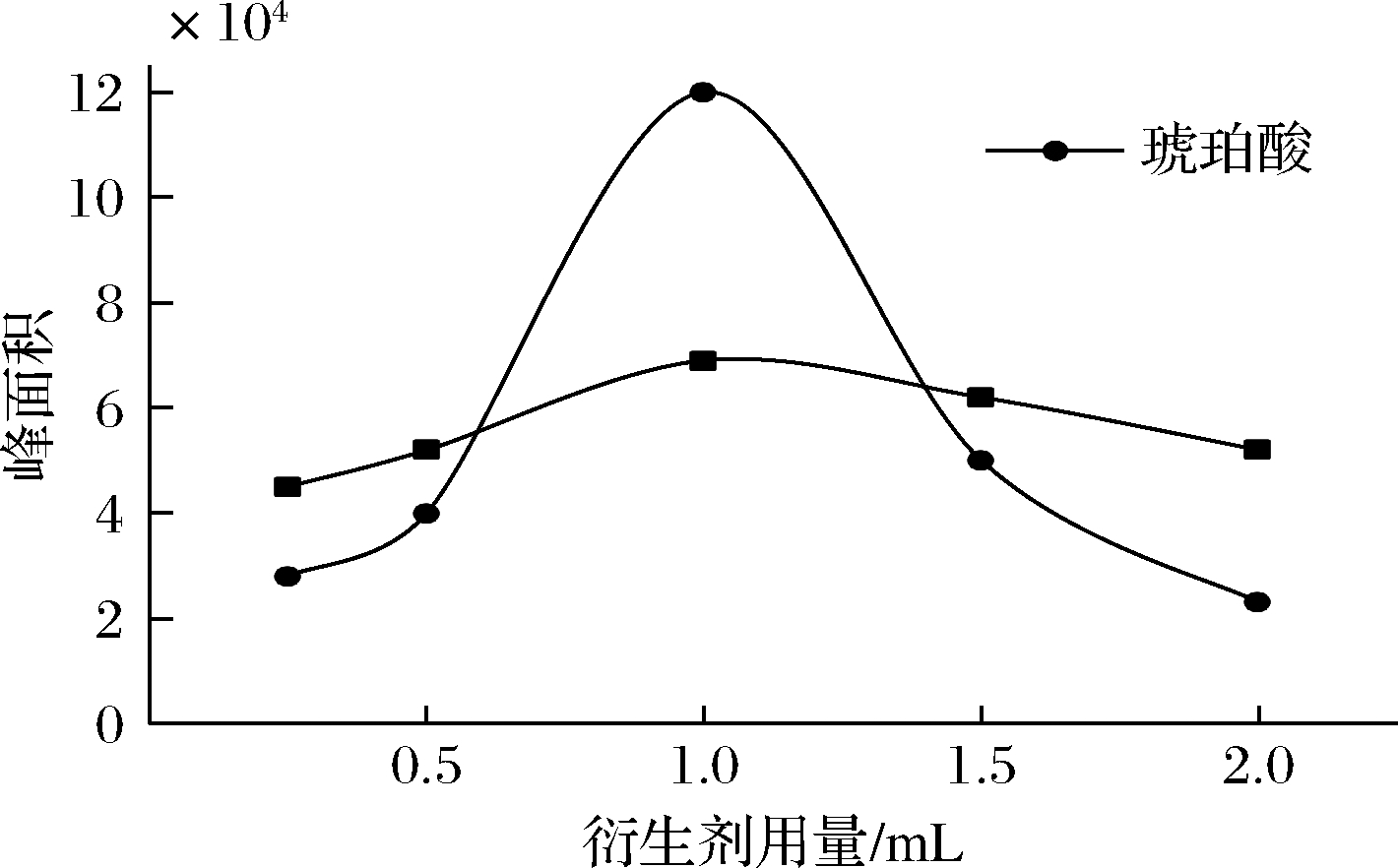
图6 衍生剂用量对衍生物峰面积的影响
Fig.6 The effect of amount of derivation agent on peak areas of two derivatives
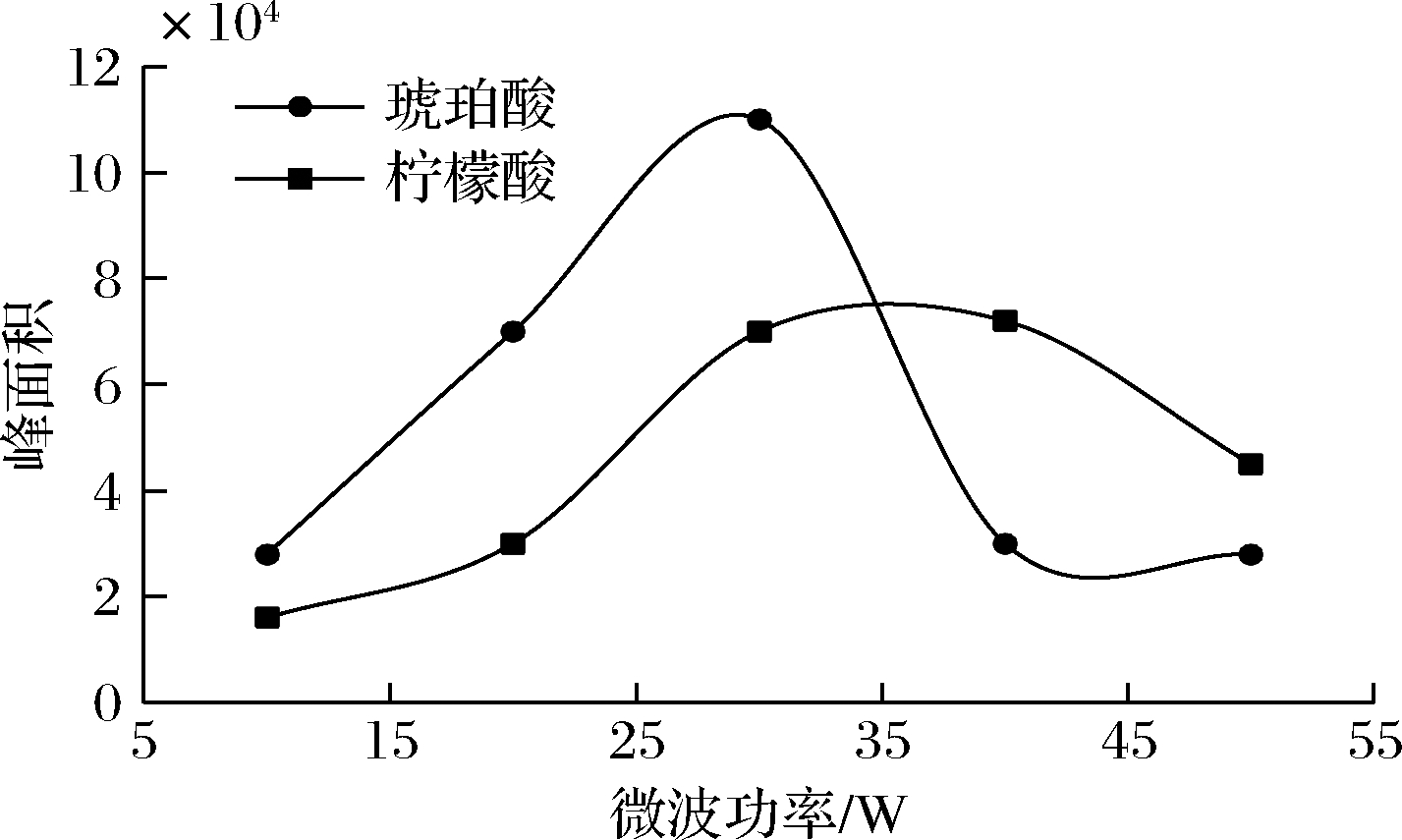
图7 微波功率对衍生物峰面积的影响
Fig.7 The effect of microwave powers on peak areas of two derivatives
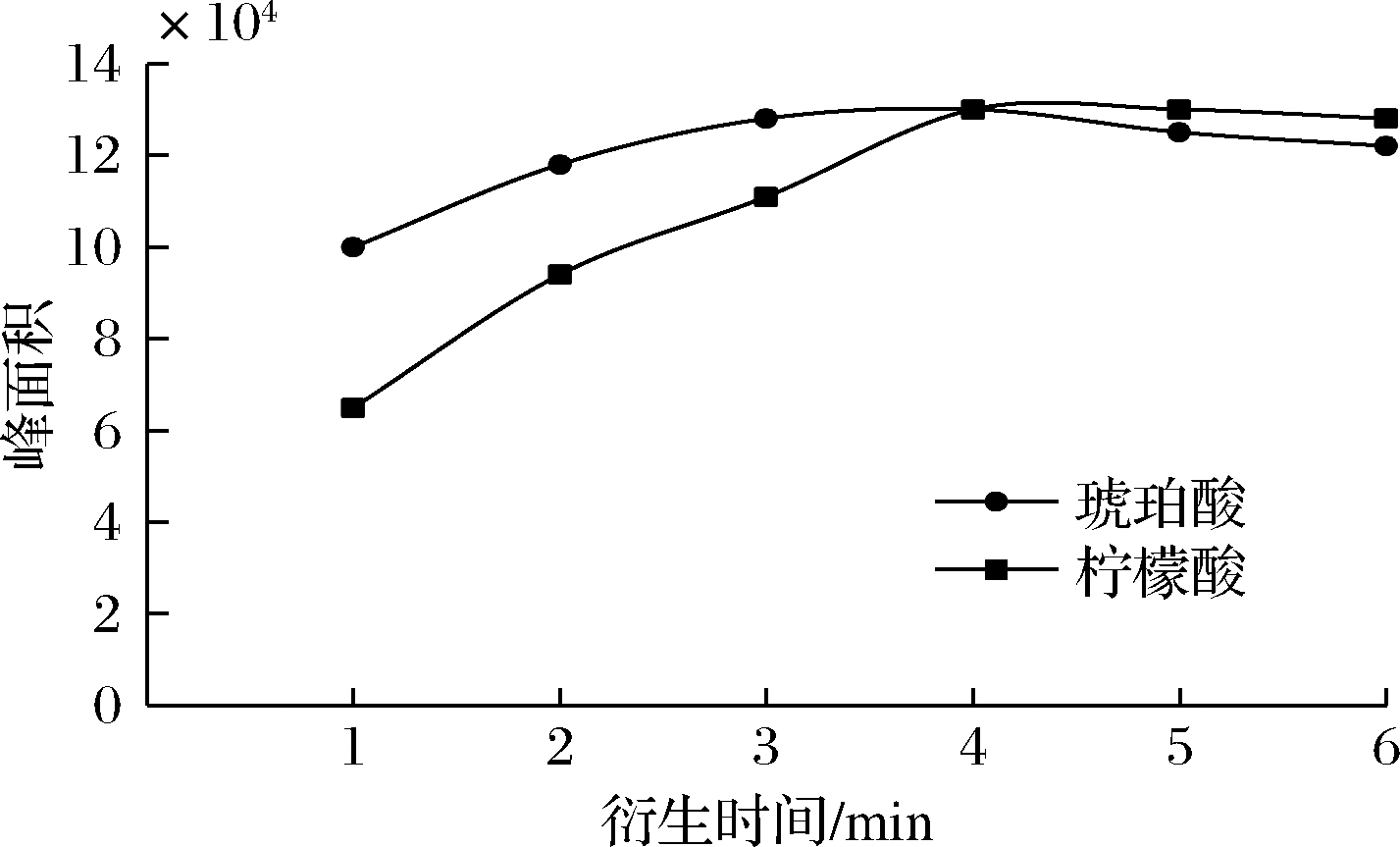
图8 微波衍生时间对衍生物峰面积的影响
Fig.8 The effect of microwave derivatization time on peak areas of two derivatives
图7中值得注意的是,微波功率对2种有机酸衍生的衍生效率有较大影响,当微波功率分别超过30 W或40 W时,琥珀酸和柠檬酸衍生物色谱峰面积分别开始迅速下降,同时观察到反应管上部外壁出现水珠凝结,这说明微波功率过大可导致样品溶液升温过快产生过热蒸发,管内压力增加影响其密闭性,造成衍生物被水蒸汽带出反应管,导致衍生物损失所致。结合图5和图6的结果,当硫酸体积分数或衍生剂用量分别超过20%或1.0 mL时,色谱峰面积均现呈明显减少趋势,同时也可观察到此时反应管外壁出现水珠凝结,说明样品溶液中硫酸增加到一定浓度,同样可导致样品溶液过热蒸发造成衍生物逸出损失的问题。
2.4 本法与其他方法对照
取2种有机酸标准混合溶液,在衍生剂用量为1.0 mL、微波功率为30 W、反应时间为4 min最佳衍生条件下,测定了2种有机酸衍生物的气相色谱峰面积。与相同浓度有机酸的超声辅助衍生、常规水浴加热衍生的测定结果进行比较,结果如表1所示。由表1可知本文的微波衍生法测定的2种有机酸衍生物的峰面积最大,明显高于超声辅助衍生和传统加热衍生。表明该方法不仅可以显著加快有机酸的甲酯化衍生反应速率,提高前处理的效率,且衍生效果明显优于常规衍生方法,可提高分析的灵敏度,有效改善方法的准确性和精密度。本文设计的微腔体微波反应器能够显著改善衍生反应速率、提高衍生效率的结果与已有谐振腔微波反应器微波衍生的研究相符[12-15]。
表1 不同衍生方式的峰面积测定结果比较
Table 1 The peak areas of three different derivatization methods

衍生方法时间/min温度/℃峰面积琥珀酸柠檬酸常规加热衍生法 1208583 96657 756超声辅助衍生法 12085107 91265 875本文的微波衍生法425~85124 76071 782
2.5 方法性能指标
2.5.1 线性关系
采用本文的微波衍生方法,在优化条件下测定两种有机酸的混合标准溶液,以目标物质量浓度为横坐标,峰面积为纵坐标,进行线性回归,得到各目标物线性关系,以R2≥ 0.99为判断指标,确定各目标物的线性范围,具体参数见表2。由表2可知,在质量浓度为0.10~5.0 mg/mL时,2种目标物的R2均达到0.999以上,表明2种有机酸浓度与峰面积具有良好的线性关系,能够满足分析要求。
表2 线性回归方程及检出限
Table 2 The equation of linear regression and detection limits

有机酸线性范围/(mg·mL-1)线性回归方程相关系数R2检出限/(mg·mL-1)琥珀酸0.10~5.0y=271.078x-18.0020.999 10.019柠檬酸0.10~5.0y=162.837x+2.3820.999 10.026
2.5.2 加标回收和精密度实验
分别取柠檬、猕猴桃和番木瓜样品,按照1.3.4方法处理后测定其含量,并如表3所示进行加标回收试验。结果表明,柠檬,猕猴桃和番木瓜不同加标量下,2种有机酸的回收率为98.34%~102.52%,相对标准差(relative standard deviation,RSD)为1.63%~3.25%(n=6),表明方法具有良好的可靠性和重现性,保证了分析结果的准确性和精密度。
表3 方法的加标回收率和相对标准偏差(n=6)
Table 3 The recovery and RSD of the method (n=6)
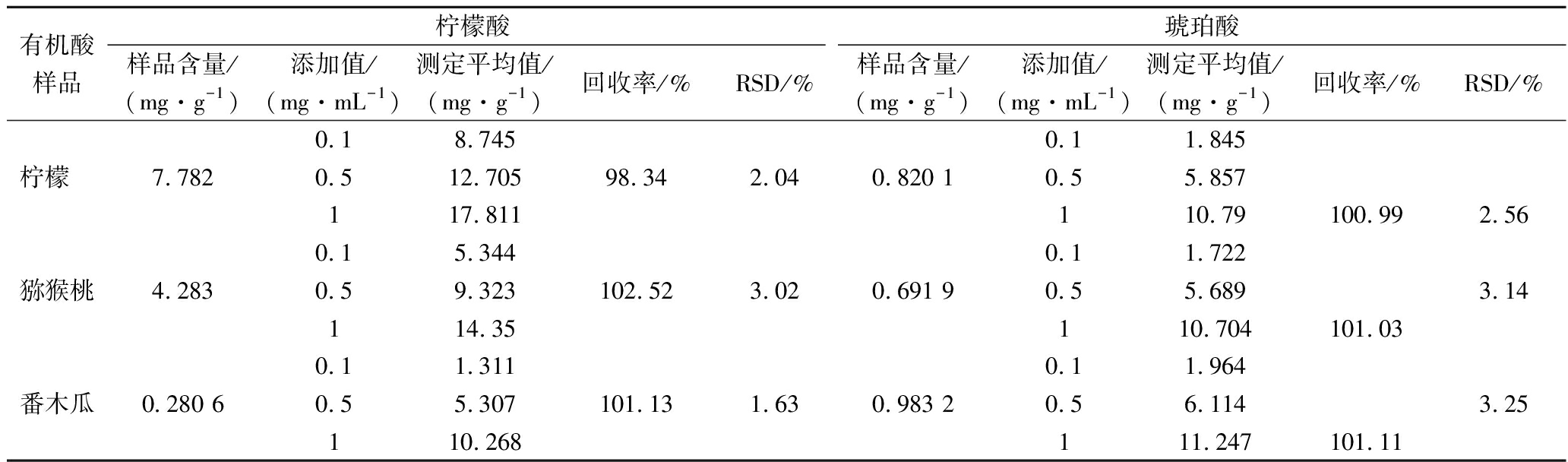
有机酸柠檬酸琥珀酸样品样品含量/(mg·g-1)添加值/(mg·mL-1)测定平均值/(mg·g-1)回收率/%RSD/%样品含量/(mg·g-1)添加值/(mg·mL-1)测定平均值/(mg·g-1)回收率/%RSD/%0.18.7450.11.845柠檬 7.7820.512.70598.342.040.820 10.55.857117.811110.79100.992.560.15.3440.11.722猕猴桃4.2830.59.323102.523.020.691 90.55.6893.14114.35110.704101.030.11.3110.11.964番木瓜0.280 60.55.307101.131.630.983 20.56.1143.25110.268111.247101.11
2.6 样品分析
分别取3种样品溶液,在最佳衍生条件下衍生后进测定,每组制备3个平行样,计算各待测组分的含量,结果如表4所示。由表4可知,3种水果中有机酸含量相差较大,琥珀酸在3种水果中的含量较低,均小于1 mg/g,柠檬和猕猴桃中的柠檬酸含量较高,番木瓜中柠檬酸含量较低,柠檬中的柠檬酸含量最高。
表4 水果样品中的琥珀酸和柠檬酸含量的测定结果
Table 4 The result of determination of succinic acid and citric acid in fruit samples
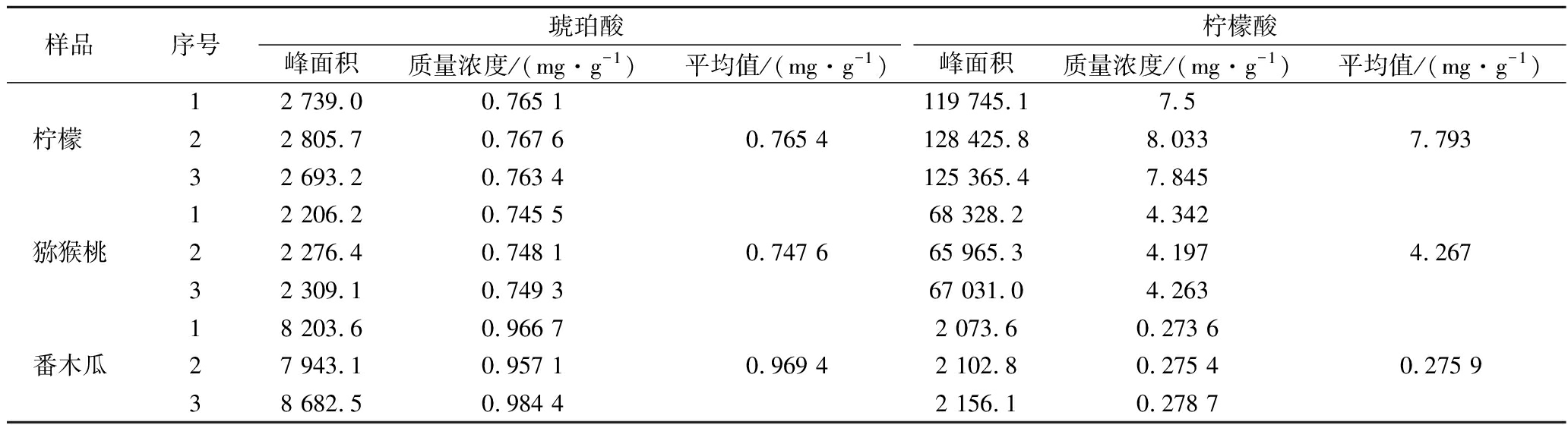
样品序号琥珀酸柠檬酸峰面积质量浓度/(mg·g-1)平均值/(mg·g-1)峰面积质量浓度/(mg·g-1)平均值/(mg·g-1)12 739.00.765 1119 745.17.5柠檬 22 805.70.767 60.765 4128 425.88.0337.79332 693.20.763 4125 365.47.84512 206.20.745 568 328.24.342猕猴桃22 276.40.748 10.747 665 965.34.1974.26732 309.10.749 367 031.04.26318 203.60.966 72 073.60.273 6番木瓜27 943.10.957 10.969 42 102.80.275 40.275 938 682.50.984 42 156.10.278 7
3 结论
衍生反应在分析样品色谱柱前处理中具有较好的应用价值,微波辅助衍生可明显提高衍生效率,将衍生反应时间从数小时大幅度缩短至数分钟。本文针对传统谐振腔微波反应器应用于色谱柱前衍生时存在的升温可控性和样品温度均匀性较差,影响分析结果准确性和可靠性等问题,在已有聚焦式微波系统的基础上,设计制作了一种新型微腔体微波衍生反应器。结果表明,设计的微腔体微波衍生反应器具有优于传统谐振腔微波反应器的体积小巧、操作简单、样品升温匀速平稳、均匀易控等特点,通过小功率微波对样品溶液进行处理,避免了微波衍生过程升温速度过快导致的溶液易于过热蒸发使挥发性衍生产物逸出等问题。在此基础上建立的快速测定食品中有机酸的MAD-GC-MS分析方法,微波衍生反应快速稳定,衍生效率高,大幅度缩短了样品前处理时间,改善了方法的准确性和精密度。本文所设计的微腔体微波反应器适于色谱分析前对有机酸等成分进行精确、平稳可控地快速微波衍生处理,在食品分析领域具有良好的应用前景。
[1] 郝俊光, 柯锋, 梁振荣, 等.液相法测定米香型白酒发酵液中18种有机酸[J].食品工业科技, 2021, 42(19):283-290.
HAO J G, KE F, LIANG Z R, et al.Determination of 18 organic acids in rice flavored liquor fermentation broth by high pressure liquid chromatography[J].Science and Technology of Food Industry, 2021, 42(19):283-290.
[2] 周宇飞, 徐帅, 杨益欢, 等.茶叶中有机酸对茶品质的影响及其检测方法研究进展[J].食品科技, 2021, 46(5):254-259.
ZHOU Y F, XU S, YANG Y H, et al.Research progress on the effect of organic acids on tea quality and their detection methods in tea[J].Food Science and Technology, 2021, 46(5):254-259.
[3] 方晟, 陈犇, 沙如意, 等.百合酵素自然发酵过程中有机酸及其体外抗氧化活性的变化[J].食品与发酵工业, 2019, 45(22):39-46.
FANG S, CHEN B, SHA R Y, et al.Changes in organic acids and in vitro antioxidant activity of lilium jiaosu during natural fermentation process[J].Food and Fermentation Industries, 2019, 45(22):39-46.
[4] 李佳秀, 张春岭, 刘慧, 等.基于有机酸HPLC指纹图谱的甜樱桃果汁掺假鉴定[J].食品科学, 2019, 40(16):327-334.
LI J X, ZHANG C L, LIU H, et al.Fingerprinting of organic acids by high performance liquid chromatography for authentication of sweet cherry juice[J].Food Science, 2019, 40(16):327-334.
[5] AMORISCO A, LOCAPUTO V, PASTORE C, et al.Identification of low molecular weight organic acids by ion chromatography/hybrid quadrupole time-of-flight mass spectrometry during Uniblu—A ozonation[J].Rapid Communications in Mass Spectrometry, 2013, 27(1):187-199.
[6] IVANOVA-PETROPULOS V, NACEVA Z, S NDOR V, et al.Fast determination of lactic, succinic, malic, tartaric, Shikimic, and citric acids in red Vranec wines by CZE-ESI-QTOF-MS[J].Electrophoresis, 2018, 39(13):1 597-1 605.
NDOR V, et al.Fast determination of lactic, succinic, malic, tartaric, Shikimic, and citric acids in red Vranec wines by CZE-ESI-QTOF-MS[J].Electrophoresis, 2018, 39(13):1 597-1 605.
[7] BERNARDES A N, GODOI L A G,CAMILOTI P R, et al.Organic acids and alcohols quantification by HPLC/RID in sugarcane vinasse:Analytical method validation and matrix effect assessment[J].International Journal of Environmental Analytical Chemistry, 2021, 101(3):325-336.
[8] ZHANG M J, CHOU J, SUN Z W, et al.Gas chromatography/mass spectrometry analysis of organic acid profiles in human serum:A protocol of direct ultrasound-assisted derivatization[J].Rapid Communications in Mass Spectrometry, 2021, 35(17):e9149.
[9] AHMED S, ATIA N N.Controlled microwave derivatization reaction for reproducible trace analysis of budesonide in human plasma[J].Analytica Chimica Acta, 2019, 1 048:132-142.
[10] LIU J J, LIU M G, LI X, et al.Development of ultrasonic-assisted closed in-syringe extraction and derivatization for the determination of labile abietic acid and dehydroabietic acid in cosmetics[J].Journal of Chromatography A, 2014, 1 371:20-29.
[11] LIN Y, CHEN J, YAN L, et al.Determination of nerve agent metabolites in human urine by isotope-dilution gas chromatography-tandem mass spectrometry after solid phase supported derivatization[J].Analytical and Bioanalytical Chemistry, 2014,406(21):5 213-5 220.
[12] LUO X Z, YU Y X, KONG X J, et al.Rapid microwave assisted derivatization of nitrofuran metabolites for analysis in shrimp by high performance liquid chromatography-fluorescence detector[J].Microchemical Journal, 2019, 150:104189.
[13] SILVEIRA A, DE OLIVEIRA M L G, ROCHA D G, et al. Multiresidue determination of the anabolic-agent residues steroids, stilbenes, and resorcylic acid lactones in bovine urine by GC-MS/MS with microwave-assisted derivatization[J]. Journal of Agricultural and Food Chemistry, 2018, 66(32): 8 630-8 638.
[14] LI J, QI H Y, WANG Y B, et al.Hollow fiber-stir bar sorptive extraction and microwave assisted derivatization of amino acids in biological matrices[J].Journal of Chromatography A, 2016, 1 474:32-39.
[15] ZHOU T, ZENG J, ZHAO T,et al.Enantioselective analysis of bambuterol in human plasma using microwave-assisted chiral derivatization coupled with ultra-high performance liquid chromatography and tandem mass spectrometry[J].Journal of Separation Science, 2017, 40(13):2 779-2 790.
[16] AMENDOLA L, COLAMONICI C, MAZZARINO M, et al.Rapid determination of diuretics in human urine by gas chromatography-mass spectrometry following microwave assisted derivatization[J].Analytica Chimica Acta, 2003, 475(1-2):125-136.
[17] LIEBEKE M, WUNDER A, LALK M.A rapid microwave-assisted derivatization of bacterial metabolome samples for gas chromatography/mass spectrometry analysis[J].Analytical Biochemistry, 2010, 401(2):312-314.
[18] KAIEMI M, KHODAIYAN F,LABBAFI M, et al.Pistachio green hull pectin:Optimization of microwave-assisted extraction and evaluation of its physicochemical, structural and functional properties[J].Food Chemistry, 2019, 271:663-672.
[19] CAO D, XU X, FENG X, et al.Designed multifunctional visual observation of magnetic ionic liquid coupling with microwave-assisted derivatization for determination of biogenic amines[J].Food Chemistry, 2020, 333:127518.
[20] BULHÖES BEZERRA CAVALCANTE T A, SANTOS FUNCIA E D, WILHELMS GUT J A, et al.Inactivation of polyphenol oxidase by microwave and conventional heating:Investigation of thermal and non-thermal effects of focused microwaves[J].Food Chemistry, 2021, 340:127911.
[21] JANG J H, MUMTAZ S, LEE S W, et al.Focus of high-power microwaves with positive and negative zone plate to increase the receiving power in axial virtual cathode oscillator[J].Current Applied Physics, 2021, 29:89-96.
[22] GONZ LEZ-NU
LEZ-NU EZ L N,CA
EZ L N,CA IZARES-MAC
IZARES-MAC AS M P.Focused microwaves-assisted extraction of theobromine and caffeine from cacao[J].Food Chemistry, 2011, 129(4):1 819-1 824.
AS M P.Focused microwaves-assisted extraction of theobromine and caffeine from cacao[J].Food Chemistry, 2011, 129(4):1 819-1 824.
[23] PENG W X, LI S N, ZHANG H Q, et al.A focused microwave power transmission scheme based on phase adjustable microwave source[J].Journal of Physics:Conference Series, 2021, 187(1):012035.