矮壮素(chlormequat,CCC)是一种季铵盐类植物生长调节剂,分子式为C5H13Cl2 N,可用于小麦、西红柿、玉米等作物。近年来,矮壮素在谷物、蔬菜水果、饲料中的残留时有报道,而通过食物链富集等方式进入动物体内的矮壮素残留也成为影响动物源性食品安全的潜在因素。我国食品安全国家标准GB 2763—2021已规定动物源性食品中矮壮素残留的临时限量值,包括猪肉及内脏、牛肉及内脏、羊肉及内脏、禽肉类及内脏、蛋类和生乳,但标准并未指定相应的检测方法。
目前,国内外关于食品中矮壮素的检测主要采用液相色谱-串联质谱法[1-14],常用的前处理方法有直接萃取法[1-2]、固相萃取(solid-phase extraction,SPE)法[3-6]、QuEChERS法[7-14]等。直接萃取法适用于基质较为单一的样品;SPE法净化效果好,但存在操作繁琐、消耗时间长等不足;QuEChERS法具有快速、高效等优点,被广泛运用于果蔬类样品,但应用于动物源性食品中矮壮素检测的研究很少。本文以动物源性食品为研究对象,采用内标法定量,优化了质谱条件、QuEChERS前处理条件等,建立了QuEChERS-超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法快速测定动物源性食品中矮壮素残留的分析方法,并利用该方法分析了市场上流通的动物源性食品。
1 材料与方法
1.1 仪器、试剂与材料
Vanquish-TSQ Quantis超高效液相色谱-串联质谱仪,美国Thermo Fisher Scientific公司;Millipore Elix® Essential 3超纯水仪,法国默克密理博公司;Auto HG-24 Plus全自动均质器,深圳市新锐科技发展有限公司;ST16高速离心机,美国Thermo Fisher Scientific公司;GM200刀式研磨仪,德国Retsch公司;电子天平(精度0.1 mg),德国赛多利斯公司;Venusil MP C18(2)色谱柱(150 mm×2.1 mm,3 μm),天津博纳艾杰尔科技有限公司。
矮壮素标准品(纯度99.0%)、矮壮素-D4标准品(纯度99.3%),德国Dr.Ehrenstorfer公司;乙腈(色谱纯)、甲酸(色谱纯)、乙酸(色谱纯)、C18吸附剂、N-丙基乙二胺(primary secondary amine,PSA)吸附剂、石墨化碳黑(graphitized carbon black,GCB)吸附剂,上海安谱实验科技股份有限公司;无水硫酸镁(分析纯)、氯化钠(分析纯),国药集团有限公司。
1.2 标准溶液的配制
准确称取适量矮壮素-D4标准品,用乙腈配制成1.0 mg/mL的内标储备液,冷藏贮存。取矮壮素-D4内标储备液适量,用乙腈稀释成500 ng/mL的内标工作液,冷藏贮存,备用。
准确称取适量矮壮素标准品,用乙腈配制成1.0 mg/mL的标准储备液,冷藏贮存。取矮壮素标准储备液适量,加入适量内标工作液,用V(乙腈)∶V(水溶液)=1∶1配制成质量浓度为0.05、0.1、0.5、1、5、10、50、100、200 μg/L的系列标准工作溶液(含内标5 μg/L),现配现用。
1.3 实验方法
1.3.1 样品前处理
称取5.00 g(精确至0.01 g)制备均匀的试样于50 mL离心管中,加入5 mL水,准确加入200 μL内标标准工作溶液(500 ng/mL),混匀;加入10 mL乙腈,13 000 r/min 均质2 min,加入2 g氯化钠、2 g无水硫酸镁,涡旋1 min,7 000 r/min离心5 min;取2 mL上清液加入QuEChERS净化管(含100 mg无水硫酸镁、100 mg C18、100 mg PSA)中,涡旋1 min,3 000 r/min离心3 min,取1 mL上清液加入1 mL水,混匀,过0.22 μm 有机滤膜后供UPLC-MS/MS测定。
1.3.2 色谱和质谱条件
色谱柱:Venusil MP C18(2) 柱(150 mm×2.1 mm,3 μm);柱温:40 ℃;进样体积:10 μL;流动相:A为乙腈,B为0.1%(体积分数)甲酸水溶液,具体梯度洗脱程序见表1。
表1 矮壮素梯度洗脱程序
Table 1 Gradient elution program of the CCC
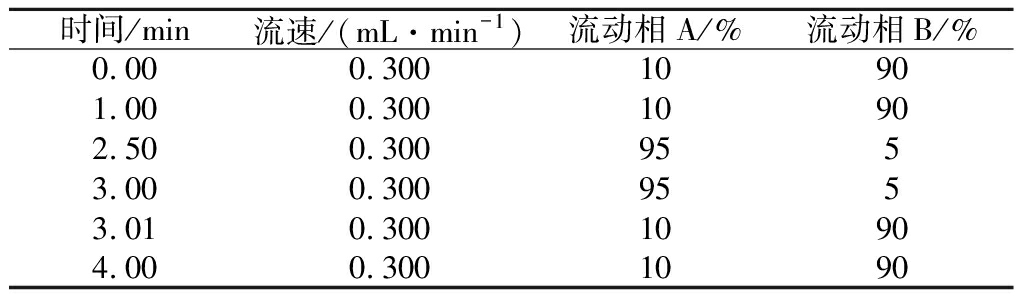
时间/min流速/(mL·min-1)流动相A/%流动相B/%0.000.30010901.000.30010902.500.3009553.000.3009553.010.30010904.000.3001090
电喷雾电离源,正离子模式,多反应监测扫描;喷雾电压:3 500 V;离子传输管温度:325 ℃;蒸发温度:300 ℃;鞘气压力:40.0 Arb;辅助气压力:10.0 Arb;其他质谱条件见表2。
表2 矮壮素和矮壮素-D4的质谱参数
Table 2 MS parameters of the CCC and CCC-D4
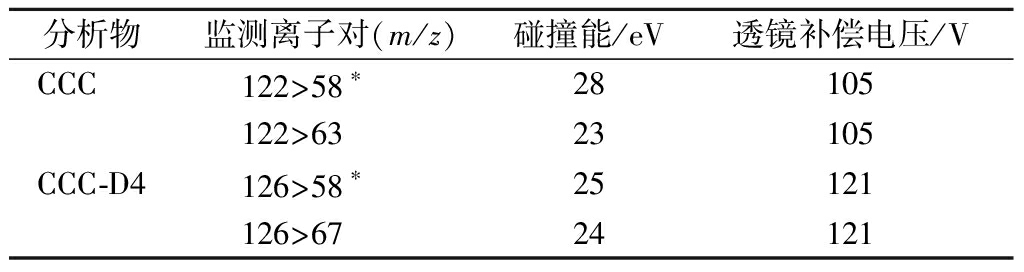
分析物监测离子对(m/z)碰撞能/eV透镜补偿电压/VCCC 122>58∗28105122>6323105CCC-D4126>58∗25121126>6724121
注:*表示定量离子
2 结果与分析
2.1 质谱条件的优化
采用电喷雾电离源正离子模式,通过蠕动泵将质量浓度为1.0 mg/L的标准溶液和内标溶液以10 μL/min流速分别注入离子源,优化母离子、透镜补偿电压、子离子、碰撞能等参数。矮壮素和矮壮素-D4在进入一级质谱后能产生稳定的[M-Cl]离子,由于氯元素在自然界中有35Cl和37Cl两种同位素,其一级质谱图含2个碎片离子峰(如图1-a、图1-b所示);选取其中丰度高且稳定的离子作为母离子进入二级质谱,产生的二级离子碎片质谱图如图1-c、图1-d所示。
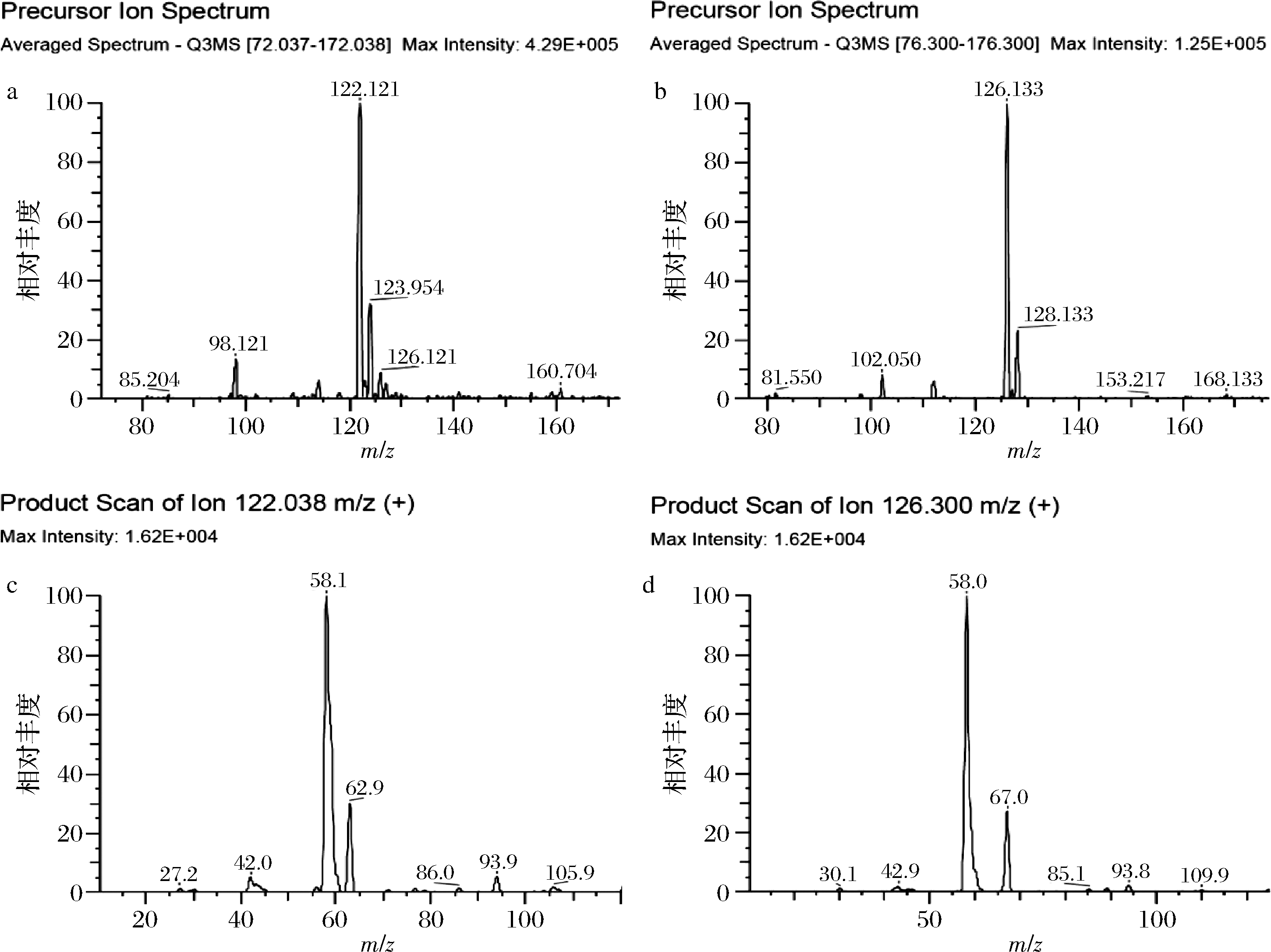
a-矮壮素一级质谱图;b-矮壮素-D4一级质谱图;c-矮壮素二级质谱图;d-矮壮素-D4二级质谱图
图1 矮壮素和矮壮素-D4离子碎片质谱图
Fig.1 Ion fragment mass spectrum of CCC and CCC-D4
2.2 提取溶剂的选择
矮壮素是一种强极性农药,常采用乙腈、酸化乙腈等溶剂提取。LI等[9]研究采用乙腈提取肉中的矮壮素,再经分散固相萃取法净化,内标法定量,方法回收率可以达到86.4%~94.7%;肖泳等[6]研究采用1%(体积分数,下同)乙酸乙腈提取动物源性食品中的矮壮素,再经SPE法净化,内标法定量,方法回收率可以达到93.4%~101%。本研究选取牛肝、羊肉、鸡蛋、奶粉4种阴性样品作为研究对象,比较了乙腈、1%乙酸乙腈、5%乙酸乙腈作为提取溶剂时的提取效果。结果显示,采用这3种溶剂提取样品中的矮壮素,再经QuEChERS法净化,内标法定量,方法回收率均能达到80%以上,同位素内标矮壮素-D4的加入可以修正样品前处理过程产生的误差,提高方法的准确度;试验发现,随着提取溶剂中酸的加入,提取液中色素等干扰物越来越多,不利于后期的净化。为尽可能提高方法的灵敏度,试验从基质效应的角度对提取溶剂作出进一步的选择。
试验按照MATUSZEWSKI等[15]报道的方法进行基质效应评估,选择牛肝、羊肉、鸡蛋、奶粉4种阴性样品,分别配制相同浓度的基质标准溶液和纯溶剂标准溶液,按照公式(1)计算基质效应:
基质效应![]()
(1)
结果如图2所示,矮壮素均存在不同程度的基质抑制效应,且随着提取溶剂中酸浓度的增加,牛肝、羊肉、奶粉的基质抑制效应明显增强。因此,试验选择乙腈作为提取溶剂。
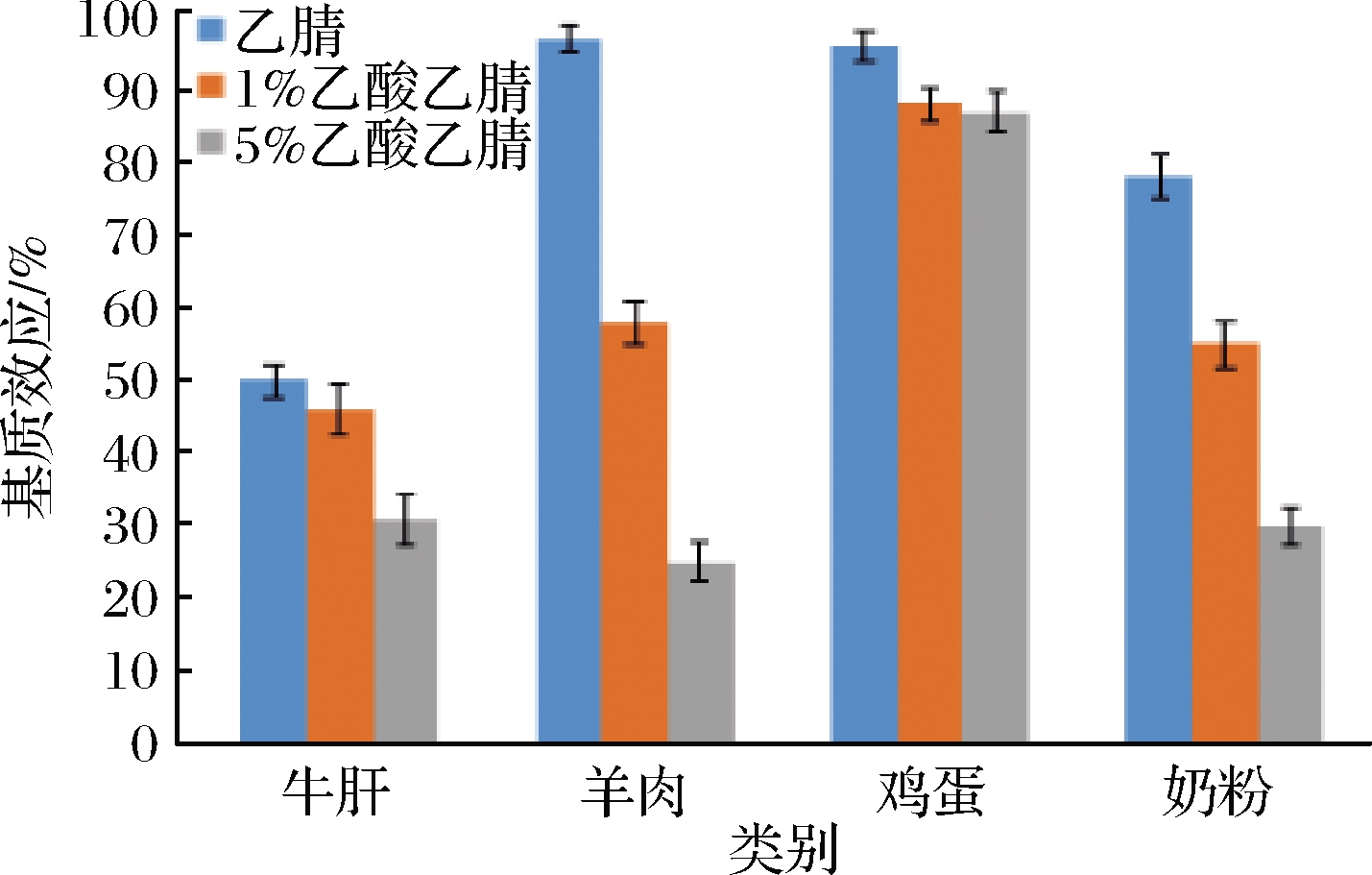
图2 提取溶剂对矮壮素基质效应的影响(n=3)
Fig.2 Effect of extraction solvent on matrix effect of CCC(n=3)
2.3 QuEChERS净化条件的优化
QuEChERS方法中常用的吸附剂主要有C18、PSA、GCB等。LI等[9]研究比较了C18、PSA、GCB对肉中矮壮素净化效率的影响,最终得出采用C18净化回收率最高(94.7%),采用GCB净化回收率只有43.5%,采用PSA净化回收率则只有32.6%。本研究选取牛肝、羊肉、鸡蛋、奶粉4种阴性样品作为研究对象,比较了C18、PSA、GCB作为净化吸附剂时(均含100 mg无水硫酸镁)对样品中矮壮素净化效率和回收率的影响。结果显示,采用这3种吸附剂净化提取液,方法回收率能达到80%以上,这与LI等[9]的研究不太一致。试验发现,采用C18作为吸附剂,提取液较为澄清但含有部分色素;采用PSA、GCB作为吸附剂,提取液中色素明显较C18少,但较为浑浊。动物源性样品中蛋白、脂肪含量较高,且肝脏类样品中还存在色素、甾醇等杂质,采用乙腈作为提取溶剂可以沉淀样品中蛋白,但也会将样品中的脂肪、色素等杂质提取出来,造成提取液浑浊、色素杂质较多等。C18属于非极性吸附剂,可以从极性样品中吸附长链脂肪类化合物、甾醇类和其他非极性干扰物质,而使提取液澄清;PSA的有效成分为其表面键合的氨基,它对于提取液中的一些强极性杂质、色素和金属离子等具有良好的净化效果,可吸附多种色素、糖和脂肪酸等;GCB可以除去具有平面结构的叶绿素、类胡萝卜素等色素、类固醇和多酚类等。结合这3种吸附剂的作用机理,且考虑到GCB的价格明显高于C18和PSA,试验进一步研究了C18+PSA组合(含100 mg无水硫酸镁)的净化效果,并结合基质效应对吸附剂含量进行了优化。
试验结果如图3所示,C18+PSA组合净化效果要优于单个吸附剂时的效果,对于牛肝、羊肉、鸡蛋基质样品,当C18+PSA的含量达到(100 mg+100 mg)时,净化效果已达到最佳,再增加 C18、PSA的含量,其基质抑制效应并没有明显的变化;对于奶粉基质样品,当C18+PSA的含量达到(50 mg+100 mg)时,净化效果已达到最佳,再增加 C18、PSA的含量,其基质抑制效应并没有明显的变化。结果表明,C18+PSA组合能有效去除提取液中脂肪、色素等杂质,最大程度的降低基质效应的影响,综合上述试验结果,选择100 mg C18+100 mg PSA(含100 mg无水硫酸镁)的组合作为QuEChERS的净化吸附剂。
2.4 方法学评价
2.4.1 基质效应
试验选择猪肉、牛肉、羊肉、鸡肉、猪肝、牛肝、羊肝、鸡肝、鸡蛋、奶粉10种阴性样品,分别配制质量浓度为10 μg/L的基质标准溶液和纯溶剂标准溶液(均含内标5 μg/L),其基质效应如表3所示。

图3 吸附剂对矮壮素基质效应的影响(n=3)
Fig.3 Effect of adsorbent on matrix effect of CCC(n=3)
表3 不同基质中矮壮素的基质效应
Table 3 Matrix effect of CCC in the different matrices

基质基质标准溶液浓度-外标法/(μg·L-1)基质效应值-外标法/%基质标准溶液浓度-内标法/(μg·L-1)基质效应值-内标法/%猪肉9.3593.59.8598.5牛肉9.5795.79.9399.3羊肉9.8598.59.9899.8鸡肉9.9399.39.8798.7猪肝4.6246.29.3693.6牛肝5.0150.19.8998.9羊肝4.2342.39.7795.7鸡肝5.0850.89.9399.3鸡蛋9.8098.09.8898.8奶粉7.8078.09.6996.9
结果表明,采用外标法计算时,肉类、鸡蛋样品表现为弱基质抑制效应,奶粉样品表现为中等基质抑制效应,而肝脏类样品表现为强基质抑制效应;采用内标法计算时,这10种基质的基质效应值为93.6%~99.8%,均为弱基质抑制效应,主要是同位素内标矮壮素-D4的加入可以有效去除基质效应的影响。因此,方法无需配制基质标准曲线。
2.4.2 线性范围和定量限
以矮壮素的质量浓度(μg/L)为横坐标(x),矮壮素和矮壮素-D4定量离子的峰面积之比为纵坐标(y),绘制标准曲线,其线性方程为y=0.315 3 x-0.007 507,相关系数R2为0.999 9。结果表明,矮壮素在0.05 ~200 μg/L范围内线性关系良好,且满足GB/T 27404—2008附录F中相关系数不应低于0.99的要求。
通过加标回收试验,以最低添加浓度(S/N≥10)作为定量限(limit of quantitation,LOQ),得到矮壮素的方法定量限如表4所示。结果显示,方法定量限完全满足各国限量标准要求,且与李春梅等[3]报道的SPE法检测小鼠肌肉中矮壮素的方法相比具有更高的灵敏度,与肖泳等[6]报道的SPE法检测动物源性食品中矮壮素、LI等[9]报道的分散固相萃取法检测肉中矮壮素的方法灵敏度相近。
2.4.3 准确度和精密度
选取猪肉、牛肉、羊肉、鸡肉、猪肝、牛肝、羊肝、鸡肝、鸡蛋和奶粉10种阴性样品进行加标回收试验,加标量分别为1.0、20.0、500.0 μg/kg,每个加标水平做6个平行,试验结果见表4。
表4 不同基质中矮壮素的定量限、加标回收率和精密度(n=6)
Table 4 LOQ, spiked recoveries and precisions of CCC in the different matrices(n=6)
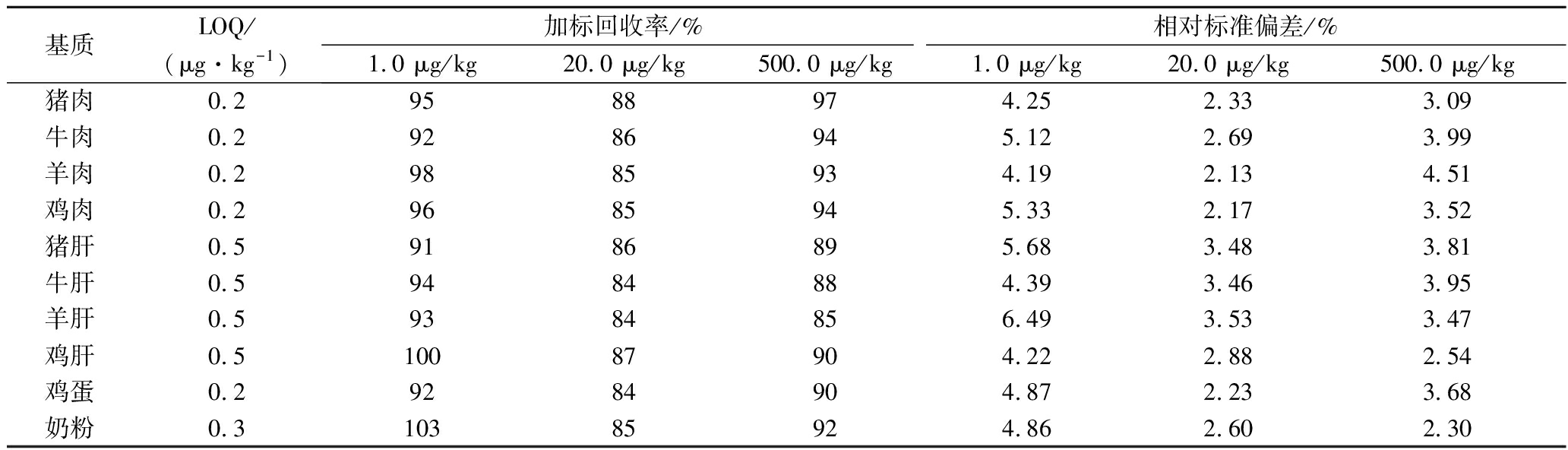
基质LOQ/(μg·kg-1)加标回收率/%相对标准偏差/%1.0 μg/kg20.0 μg/kg500.0 μg/kg1.0 μg/kg20.0 μg/kg500.0 μg/kg猪肉0.29588974.252.333.09牛肉0.29286945.122.693.99羊肉0.29885934.192.134.51鸡肉0.29685945.332.173.52猪肝0.59186895.683.483.81牛肝0.59484884.393.463.95羊肝0.59384856.493.533.47鸡肝0.510087904.222.882.54鸡蛋0.29284904.872.233.68奶粉0.310385924.862.602.30
结果显示,在3个加标水平下,各基质中矮壮素的平均回收率在84%~103%,相对标准偏差在2.13%~6.49%。说明方法的准确度高,通用性好,且方法的回收率明显优于李春梅等[3]方法的回收率,与肖泳等[6]、LI等[9]报道的方法回收率相近,完全满足GB/T 27404—2008附录F中回收率和精密度要求。
2.5 实际样品的测定
运用本文建立的方法,对市售的116份畜禽肉、53份内脏、48份蛋、24份牛奶、30份奶粉样品进行矮壮素的残留检测。结果表明,271份动物源性样品中,检出阳性样品26份(部分阳性样品图谱见图4),含量为1.06~14.5 μg/kg。其中,1份羊肉检出矮壮素,含量为1.77 μg/kg;1份羊肝检出矮壮素,含量为14.5 μg/kg;2份牛肾检出矮壮素,含量分别为2.41、2.23 μg/kg;1份鸡蛋检出矮壮素,含量为3.95 μg/kg;8份牛奶检出矮壮素,含量范围为1.06~4.56 μg/kg;13份奶粉检出矮壮素,含量范围为1.16~10.8 μg/kg,所检出样品中矮壮素的含量均低于国家标准对其规定的最大残留限量。对于阳性样品,研究进一步采用肖泳等[6]建立的SPE法进行检测,结果显示,2个方法的检测结果相差不大(偏差在10%以内)。
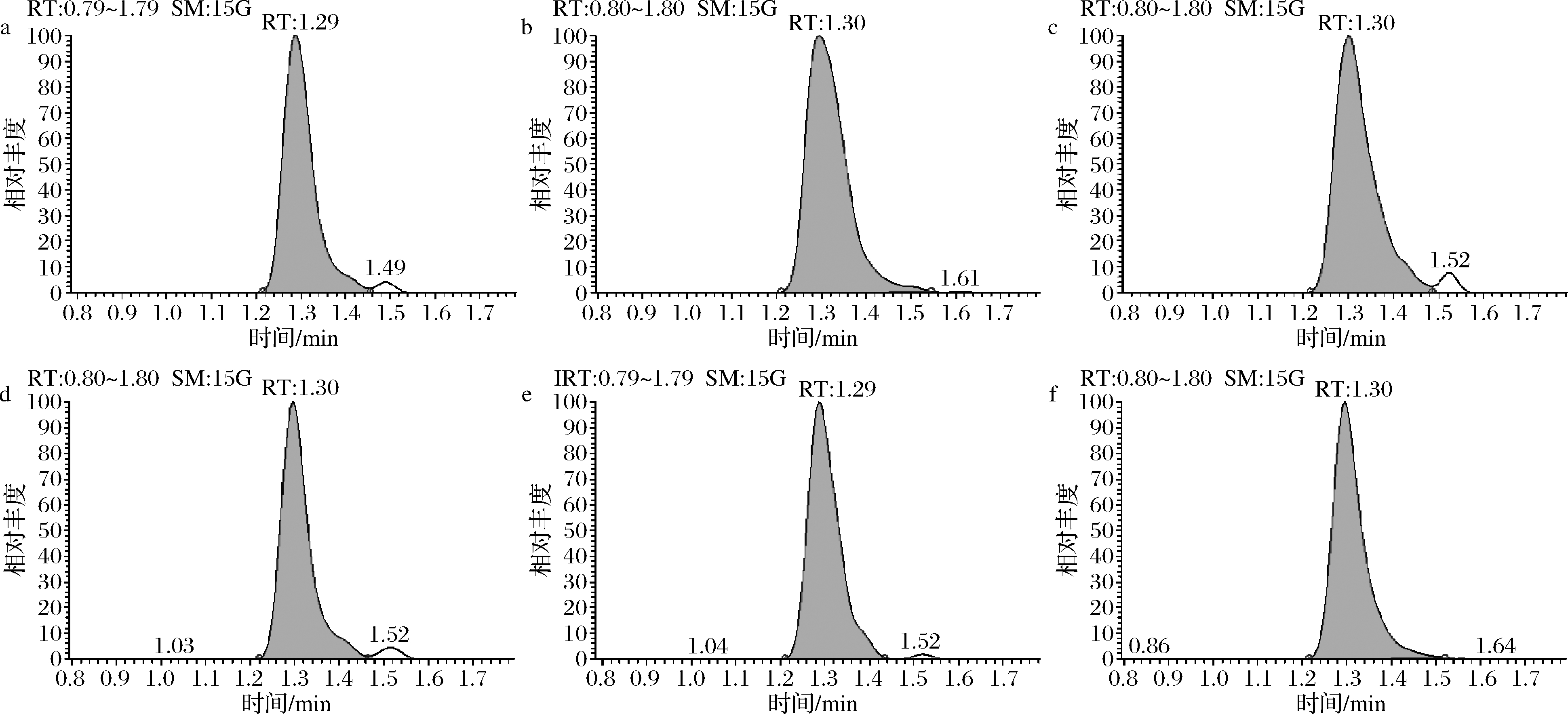
a-羊肉;b-羊肝;c-牛肾;d-鸡蛋;e-牛奶;f-奶粉
图4 实际样品中矮壮素的定量离子色谱图
Fig.4 The quantitative ion chromatograms of CCC in the actual samples
3 结论
本文建立了QuEChERS-UPLC-MS/MS法快速测定动物源性食品中矮壮素残留的分析方法,方法简便、高效、快速、准确、灵敏度高,线性关系、准确度和精密度均满足方法学指标,方法定量限完全满足各国限量标准要求,可为动物源性食品中矮壮素残留的快速检测提供技术手段。
[1] BAUER A, LUETJOHANN J, ROHN S, et al.Development of an LC-MS/MS method for simultaneous determination of the quaternary ammonium herbicides paraquat, diquat, chlormequat, and mepiquat in plant-derived commodities[J].Food Analytical Methods, 2018, 11(8):2 237-2 243.
[2] 邱世婷, 韩梅, 侯雪, 等.超高效液相色谱-串联质谱法快速检测蔬菜中23种植物生长调节剂[J].分析测试学报, 2018, 37(6):33-41.
QIU S T, HAN M, HOU X, et al.Rapid detection of 23 plant growth regulators in vegetables by ultra high performance liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis, 2018, 37(6):33-41.
[3] 李春梅, 金芬, 徐思远, 等.固相萃取-液相色谱-串联质谱法检测小鼠肌肉组织中矮壮素[J].分析化学, 2012, 40(12):1 924-1 928.
LI C M, JIN F, XU S Y, et al.Determination of chlormequat in muscles of mice by solid phase extraction-liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2012, 40(12):1 924-1 928.
[4] ESPARZA X, MOYANO E, GALCERAN M T.Analysis of chlormequat and mepiquat by hydrophilic interaction chromatography coupled to tandem mass spectrometry in food samples[J].Journal of Chromatography A, 2009, 1 216(20):4 402-4 406.
[5] ZHANG H X, MA Z F, YANG H Y, et al.Determination of chlormequat and mepiquat residues and their dissipation rates in tomato cultivation matrices by ultra-performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B, 2017, 1 064:75-84.
[6] 肖泳, 吴海智, 袁列江, 等.高效液相色谱-串联质谱法测定动物源性食品中矮壮素残留[J].色谱, 2020, 38(2):218-223.XIAO Y, WU H Z, YUAN L J, et al.Determination of chlormequat chloride residues in animal derived food by high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Chromatography, 2020, 38(2):218-223.
[7] 覃国新, 劳水兵, 李慧玲, 等.一步式提取净化/超高效液相色谱-串联质谱法测定水生蔬菜中矮壮素和灭蝇胺[J].食品安全质量检测学报, 2020, 11(11):3 619-3 624.
QIN G X, LAO S B, LI H L, et al.Determination of chlormequat and cyromazine residues in aquatic vegetables by ultra performance liquid chromatography-tandem mass spectrometry with extraction and purification on one step[J].Journal of Food Safety&Quality, 2020, 11(11):3 619-3 624.
[8] FRANCESQUETT J Z, RIZZETTI T M, CADAVAL T R S, et al.Simultaneous determination of the quaternary ammonium pesticides paraquat, diquat, chlormequat, and mepiquat in barley and wheat using a modified quick polar pesticides method, diluted standard addition calibration and hydrophilic interaction liquid chromatography coupled to tandem mass spectrometry[J].Journal of Chromatography A, 2019, 1 592:101-111.
[9] LI C M, JIN F, YU Z Y, et al.Rapid determination of chlormequat in meat by dispersive solid-phase extraction and hydrophilic interaction liquid chromatography (HILIC)-electrospray tandem mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2012, 60(27):6 816-6 822.
[10] 周纯洁, 刘欢, 赵博, 等.QuEChERS-HILIC-MS/MS法快速测定蔬菜中3种强极性植物生长延缓剂[J].现代农业科技, 2016(6):268-271.
ZHOU C J, LIU H, ZHAO B, et al.Determination of three extremely polar plant growth retardators in vegetables by QuEChERS-HILIC-MS/MS[J].Modern Agricultural Science and Technology, 2016(6):268-271.
[11] 任水英, 封顺, 鹿毅, 等.QuEChERS-液相色谱-串联质谱法同时测定果蔬中10种微量植物生长延缓剂[J].分析试验室, 2016, 35(12):1 457-1 462.
REN S Y, FENG S, LU Y, et al.Simultaneous determination of trace bioinhibitors in fruits and vegetables by QuEChERS technique coupled with high performance liquid chromatography-tandem mass spectrometry[J].Chinese Journal of Analysis Laboratory, 2016, 35(12):1 457-1 462.
[12] 叶倩, 黄健祥, 骆冲, 等.QuEChERS-超高效液相色谱-串联质谱法快速测定3种叶菜中矮壮素和丙环唑残留[J].分析科学学报, 2017, 33(3):342-346.
YE Q, HUANG J X, LUO C, et al.Fast determination of chlormequat and propiconazole residues in three leafy vegetables by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Analytical Science, 2017, 33(3):342-346.
[13] 吴学进, 刘春华, 罗金辉, 等.QuEChERS净化—超高效液相色谱—串联质谱法同步测定荔枝中10种植物生长调节剂残留[J].南方农业学报, 2020, 51(10):2 532-2 539.
WU X J, LIU C H, LUO J H, et al.Simultaneous determination of ten plant growth regulators residues in litchi by QuEChERS clean up-ultra high performance liquid chromatography-tandem mass spectrometry[J].Journal of Southern Agriculture, 2020, 51(10):2 532-2 539.
[14] SHREOSI B, TIRTHANKAR B,TALAVIYA H, et al.Development of a QuEChERS-LCMS/MS method for simultaneous estimation of tebuconazole and chlormequat chloride in wheat crop[J].Journal of Environmental Science and Health, Part B, 2021, 56(3):1-10.
[15] MATUSZEWSKI B K, CONSTANZER M L, CHAVEZ-ENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Analytical Chemistry, 2003, 75(13):3 019-3 030.