生物活性肽是由天然氨基酸以不同排列方式(线性、环形)构成的二肽及多肽的总称,分子质量一般<6 000 Da,含有3~20个氨基酸残基。除提供能量和必需氨基酸外,还具有多种生物活性,如抗氧化、降压、抗炎、抗菌、免疫调节、镇痛等[1]。抗氧化肽(antioxidant peptides, AOPs)是一类重要的生物活性肽,由5~16个氨基酸残基组成[2],其抗氧化作用主要表现在:直接猝灭自由基,如超氧阴离子![]() 羟自由基(·OH)、烷过氧基(ROO·)、烷氧基(RO·)和过氧化氢分子(H2O2)等;调节内源性氧化还原酶活性;保护细胞膜脂质。作为天然抗氧化剂,抗氧化肽比化学抗氧化剂例如丁基羟基茴香醚(butyl hydroxyanisole,BHA)、二丁基羟基甲苯(butylated hydroxytoluene,BHT)、特丁基对苯二酚( tert-butylhydroquinone,TBHQ)等具有更高的生物安全性,在功能食品、生物医药等行业具有广阔的应用前景[3]。用于制备抗氧化肽的食物蛋白原料非常丰富,主要来源于海产品、藻类、畜禽产品、蛋奶、谷物等。目前抗氧化肽的研究多集中于海洋生物来源的抗氧化肽,但植物源抗氧化肽的来源更具多样性[4]。
羟自由基(·OH)、烷过氧基(ROO·)、烷氧基(RO·)和过氧化氢分子(H2O2)等;调节内源性氧化还原酶活性;保护细胞膜脂质。作为天然抗氧化剂,抗氧化肽比化学抗氧化剂例如丁基羟基茴香醚(butyl hydroxyanisole,BHA)、二丁基羟基甲苯(butylated hydroxytoluene,BHT)、特丁基对苯二酚( tert-butylhydroquinone,TBHQ)等具有更高的生物安全性,在功能食品、生物医药等行业具有广阔的应用前景[3]。用于制备抗氧化肽的食物蛋白原料非常丰富,主要来源于海产品、藻类、畜禽产品、蛋奶、谷物等。目前抗氧化肽的研究多集中于海洋生物来源的抗氧化肽,但植物源抗氧化肽的来源更具多样性[4]。
全球范围内,谷物作为人类主食及牲畜饲料,约占人类能源需求的一半以上。谷物原料产量高,氨基酸含量丰富,且谷物蛋白价格低廉、安全性高,可作为抗氧化活性肽的主要来源。如米糠蛋白中的酸性氨基酸、碱性氨基酸及疏水性氨基酸,玉米蛋白中的疏水性氨基酸(亮氨酸、丙氨酸、缬氨酸),均是抗氧化肽的良好来源[5]。因此,低价、安全的谷物源抗氧化肽的开发已成为研究热点。
本文综述了谷物源抗氧化肽的制备方法、构效关系及其在食品、日化等领域的应用,以期为开发谷物源抗氧化功能产品提供参考。
1 谷物源抗氧化肽的来源与制备
1.1 谷物源抗氧化肽的来源
根据原料来源不同,谷物源抗氧化肽可以分为大米抗氧化肽、玉米抗氧化肽、大豆抗氧化肽、燕麦抗氧化肽、黑豆抗氧化肽等。豆类中含有相对较高的蛋白质,因此,从豆类中鉴定出的抗氧化肽比从其他谷物中鉴定出的抗氧化肽更多;玉米蛋白中含有丰富的亮氨酸、异亮氨酸、缬氨酸和丙氨酸等疏水性氨基酸以及脯氨酸和谷氨酸,被认为是抗氧化肽的良好蛋白来源;大米米糠蛋白含有丰富的赖氨酸、丙氨酸、谷氨酸和丝氨酸,也常用于抗氧化肽制备;小麦麦胚蛋白中含有丰富的具有抗氧化活性的氨基酸序列。由谷物蛋白获得的抗氧化活性肽被认为是安全抗氧化剂的天然来源,相对其他蛋白来源(如畜禽、海洋生物),谷物蛋白具有来源广泛、成本低的特点。
1.2 谷物源抗氧化肽的制备
生物活性肽的制备有两种方式(图1),一种是通过传统的方法(包括酶解法、微生物发酵法)将原料蛋白中的生物活性肽释放出来,然后通过分离纯化获得具有某种特定活性的肽段;另一种是通过计算机辅助模拟水解,借助生物信息学工具(数据库)筛选合适蛋白酶类型,通过合成验证活性获得生物活性肽。目前涉及到抗氧化肽的数据库仅有BIOPEP,且仅有少数序列,因而采用计算机辅助模拟水解制备抗氧化肽的方法受到限制[6]。
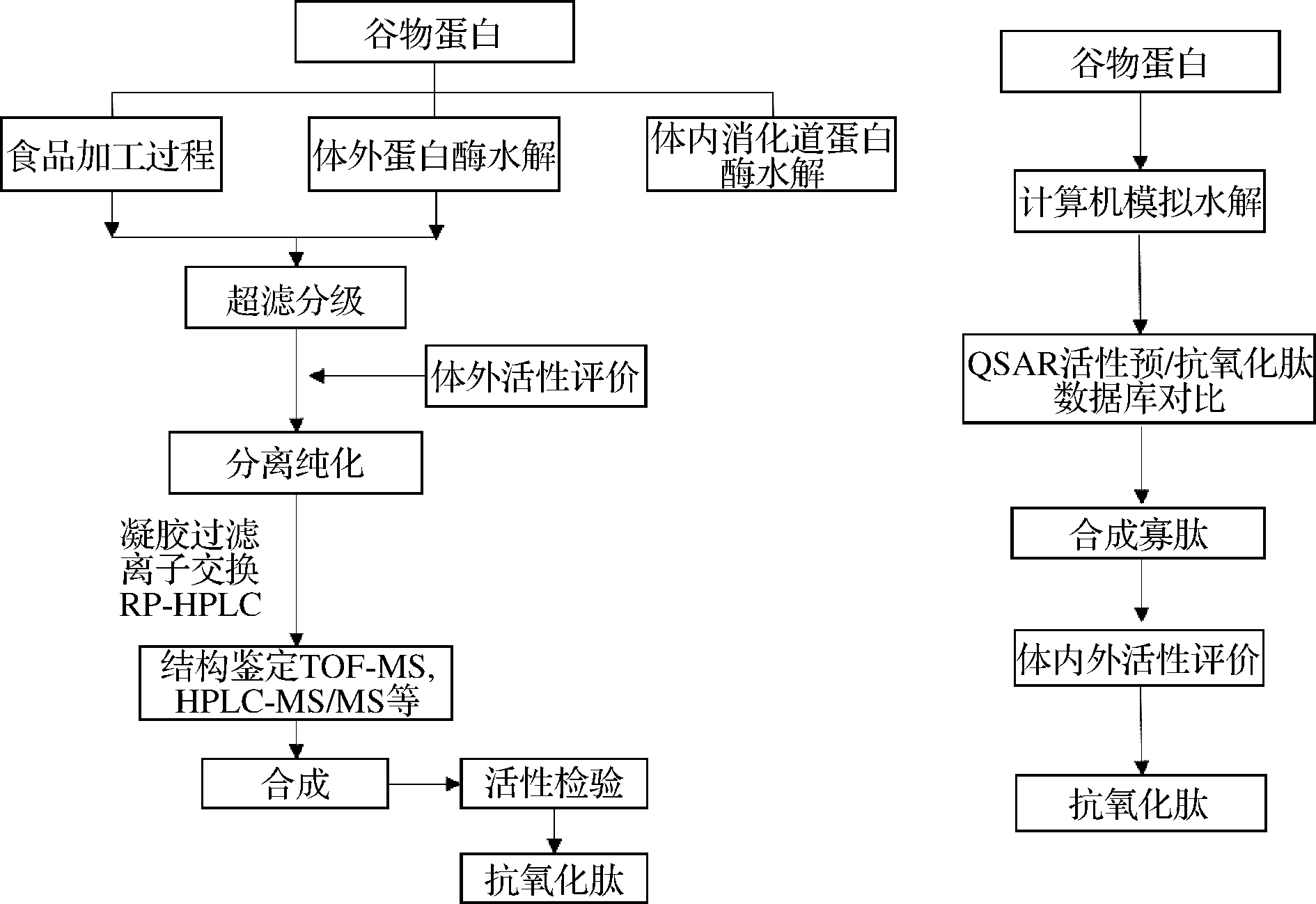
图1 传统抗氧化肽制备技术路线与计算机模拟制备 抗氧化肽技术路线的比较[7]
Fig.1 Comparison of traditional antioxidant peptides preparation technology route and computer simulation of enzymatic hydrolysis to prepare antioxidant peptides[7]
1.2.1 酶水解法
抗氧化肽在母体蛋白结构中以无活性肽段存在,需要通过酶解才能释放其活性。酶水解法是制备抗氧化肽最常用的方法,该方法具有以下特点:(1)条件温和,易控制;(2)蛋白酶水解具有选择性,产生副产物少;(3)安全性高,无有毒化学物质残留。
制备抗氧化肽的蛋白酶至关重要,不同的蛋白酶可以释放出不同分子质量及氨基酸序列的肽。蛋白酶主要有胃肠道消化酶、植物蛋白酶、微生物蛋白酶等。微生物蛋白酶因具有较高酶活性和较低价格,被认为是较理想的工业用酶源。根据水解环境不同,蛋白酶还可分为酸性、中性和碱性蛋白酶。碱性蛋白酶对疏水性氨基酸有较强的专一性,因此常采用碱性蛋白酶制备抗氧化肽(表1)。研究发现玉米蛋白粉的碱性蛋白酶水解产物具有体外清除自由基的活性及Caco-2细胞的活性氧自由基(reactive oxygen species,ROS)清除活性[8]。高粱蛋白水解可以产生具有高抗氧化活性的活性肽段,这主要是因为碱性蛋白酶能够水解Glu、Met、Leu、Tyr、Lys及Gln的羧基端,使其释放出更多具有抗氧化活性的产物[9]。中性蛋白酶则在大米及米糠蛋白水解中应用较多。反应温度、pH、底物浓度、酶浓度及水解条件等都会影响酶解效率,进而影响水解产物的抗氧化活性。由于酶具有专一性且酶切位点有限,通常需要选择适当的复合酶进行酶解。利用碱性蛋白酶和风味蛋白酶共同水解玉米蛋白,结果发现两种蛋白酶共同酶解的效果比单一蛋白酶好,表现出更高的抗氧化活性[10]。
目前,酶水解法为制备抗氧化肽的最常用方法,但该方法仍存在收率低,工业化生产成本较高的问题。因此,近年来研究者们开始将一些新兴加工技术例如微波、高压、脉冲电场等与酶水解方法结合,以克服传统方法的局限性。研究发现,微波加热可以促进酶水解,减少水解时间,提高水解产物品质[11]。高压联合酶水解处理可以影响花生蛋白的酶水解和部分蛋白质结构特性,提高花生蛋白水解物的抗氧化活性[12]。脉冲电场辅助酶水解可以提高谷物源抗氧化肽的抗氧化活性,LIN等[13]实验发现在电场强度为5 kV/cm、脉冲频率为2 400 Hz、保留时间为2 h的条件下,大豆源肽段Ser-His-Cys-Met-Asn的DPPH自由基抑制率达到(94.35±0.03)%。有研究证实,通过超声波辅助酶解制备玉米抗氧化剂水解物,在最佳超声预处理下,DPPH自由基和·OH清除能力显著提高[14]。
表1 谷物源抗氧化肽的来源及氨基酸序列
Table 1 Origin and amino acid sequence of antioxidant peptides from cereals

蛋白来源选用的酶肽的氨基酸序列文献小麦面筋蛋白pepsinLQPGQGQQG, AQIPQQ[15]米糠蛋白trypsinVAGAEDKK, AAVQGQVEK[16]玉米蛋白alcalaseQQPQPW[17]黑麦碱蛋白proteaseKCQV, QCV, QVC, QCA[18]黑豆alcalase, neutrase, flavorenzymeYNI, YNP[19]麦胚alcalase, trypsinAREGETVVPG[20]膨化全脂大豆片alcalaseVVFVDRL, VIYVVDLR, IYVVDLR, IYVVDLR[21]大豆分离蛋白PTN6.0 sTTYY, IY, LY[22]小米蛋白trypsin, pepsinTSSSLNMAVRGGLTR, STTVGLGISMRSASVR[23]
1.2.2 微生物发酵法
微生物发酵法是通过微生物代谢过程中产生的复合酶系,将底物蛋白酶解进而释放出具有活性肽类物质的方法。发酵过程中,蛋白质来源、菌种选择、发酵温度和时间、pH等条件都会影响酶解程度。目前,可用于制备抗氧化肽的微生物主要有枯草芽孢杆菌、地衣芽孢杆菌、曲霉菌及乳酸菌等[24]。利用枯草芽孢杆菌发酵制备的米糠活性肽包含6种人体必需氨基酸,具有较强的清除DPPH自由基![]() 能力[25]。利用巴氏乳杆菌Fn032发酵小米获得的抗氧化肽SGYYMH、LGTFQN、LHALLL,具有较强的清除DPPH自由基能力[26]。
能力[25]。利用巴氏乳杆菌Fn032发酵小米获得的抗氧化肽SGYYMH、LGTFQN、LHALLL,具有较强的清除DPPH自由基能力[26]。
微生物发酵法具有以下优点:利用微生物发酵法所生产的抗氧化肽能够直接进入消化系统,易被人体吸收利用,安全性高;微生物具有来源广泛、价格低廉的特点;相比蛋白酶水解法,微生物发酵代谢过程中产生的肽酶可以减少苦味物质。目前存在的问题:微生物发酵法生产技术不完善;可用于抗氧化肽的无毒无害产酶菌种受限;发酵法产生复合酶体系的作用机理尚未阐明等。
1.2.3 其他方法
除上述两种方法外,用于制备抗氧化肽的方法还有化学水解法、化学合成法、分离提取法、基因工程法及物理提取法等。化学水解法是指加入化学试剂使蛋白质水解得到水解产物的方法,包括酸水解和碱水解,这种方法具有成本低、操作简单和应用方便等特点,但缺乏灵敏度和特异性,且易造成肽失活、残留有害物质和污染环境。例如传统的酸水解通常是基于高温条件下在过酸溶液中处理样品,处理过程中易破坏一些必需氨基酸,如色氨酸、蛋氨酸、胱氨酸和半胱氨酸[27]。化学合成法是按照已知的氨基酸序列定向形成目标肽键,具有操作简便、产率高、可定向合成目的多肽等特点,但由于其合成过程中使用的部分溶剂如N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)、二氯甲烷(dichloromethane,DCM)等具有较大的毒性,残留物可能对人体产生有害影响,在实际应用中受到了限制。分离提取法指直接从动植物体内分离纯化抗氧化肽,具有成本高、操作难度大、产量低等缺点,更适用于特定药物的生产和开发。基因工程法是利用DNA重组技术,通过合适的DNA模板来控制抗氧化肽的序列合成,具有安全性高、成本低、原料来源广等特点,但由于表达效率低、产品提取及回收难度大,导致其在短链肽合成方面存在较大弊端[28]。物理提取法是通过超高压连续流细胞破碎仪来制备多肽,可以破坏动植物组织的细胞壁、细胞膜,最大程度的保护多肽的生物活性。该方法是近几年提出的新概念,技术不够成熟,对仪器要求高、得率低。
2 谷物源抗氧化肽构效关系
2.1 影响抗氧化肽构效关系的主要因素
抗氧化肽的活性除受蛋白来源、蛋白酶、水解度、水解条件等影响外,还与氨基酸组成、氨基酸序列、肽段分子质量大小、肽构象等因素有关。其中,多肽序列中的氨基酸残基被认为是影响多肽抗氧化活性的最重要因素。深入研究抗氧化肽的构效关系,可以在生产中通过控制底物的水解度来调节抗氧化肽的产率和活性,从而提高生产效率和降低成本。
2.1.1 氨基酸组成
氨基酸组成是影响抗氧化肽活性的重要因素。一些活性较高的抗氧化肽中His、Cys、Pro、Trp、Arg含量较高,且肽的N端氨基酸多为疏水性氨基酸。疏水氨基酸残基有利于肽和脂质中自由基的相互作用,从而有助于清除脂相产生的自由基[29]。研究证实,细胞抗氧化活性与肽的N端或C端存在Tyr、Trp残基有关,Tyr的酚羟基、Trp的吲哚基、Cys的巯基及His的咪唑基等可以作为氢的电子供体捕获自由基,达到清除自由基的作用[30]。疏水性氨基酸如Leu、Val、Ala、Phe及Pro等可以用作芳香残基侧链上自由基过氧化的供氢体,提高肽的抗氧化性[31]。此外,含硫氨基酸中Met上的S原子及Cys的巯基使其具有清除自由基的能力,可以减少亚油酸氢过氧化物的生成[32]。
有研究表明,含有His的肽具有较高抗氧化活性,这可能与位于His侧链上的咪唑基团具有猝灭自由基、螯合金属离子及抑制脂质过氧化作用有关[33]。大米肽FRDEHKK和DHHQ主要是通过螯合作用抑制亚油酸的过氧化作用,这两种肽中均含有His和Asp,说明这两种氨基酸有助于其抗氧化活性提升[34]。研究发现,Val可能有助于多肽与膜脂双层的相互作用,促进其进入细胞,从而起到提高抗氧化活性的作用;也可能是通过促进抗氧化肽与脂溶性自由基的相互作用,减弱脂质过氧化,进而提高抗氧化活性[35]。许多学者还发现,在一些蛋白水解产物中分离鉴定的抗氧化肽含有丰富的Gly和Pro,这两个氨基酸对于抑制亚油酸过氧化有一定的贡献,且具有一定的自由基清除能力[36]。
2.1.2 氨基酸序列
研究发现,抗氧化肽中相同的氨基酸残基处于肽段不同位置时会影响其抗氧化活性。NAOHIKO等[37]研究了不同二肽对亚油酸抗氧化活性的影响,结果表明Ala、Tyr和Trp位于N端时二肽的抗氧化能力更强。含有His残基N端的肽比含有His残基C端的肽具有更高的螯合能力和自由基清除能力,若将Pro-His-His中C端的His残基替换成其他氨基酸残基,活性没有显著性变化;但若将中间的His残基替换成Trp,活性大大下降,这说明肽段Pro-His-His中间的His残基对其抗氧化活性非常重要,而C端的His残基则没有那么重要[38]。Leu残基位于玉米抗氧化肽N端时,可以增强抗氧化肽与脂肪酸的相互作用,提高其对脂质自由基的捕捉能力,从而提高抗氧化活性[39]。氨基酸残基之间存在协同和拮抗作用,并非简单将抗氧化活性高的氨基酸残基组合就可得到抗氧化活性高的肽段,因此对于氨基酸序列与抗氧化作用之间的关系值得持续关注。
2.1.3 肽段分子质量
研究证实,肽段分子质量大小会影响其抗氧化活性,低分子质量肽段具有更高的抗氧化活性,2~10个氨基酸残基的短肽要比10~50个氨基酸残基的多肽抗氧化活性高。相比分子质量大的肽段,分子质量小的肽段更能有效地通过生物膜,靶向清除脂质自由基,表现出较好的抗氧化能力。HERN NDEZ-LEDESMA等[7]利用抗氧化肽WYSLAMAASDI设计合成了WY、WYS、WYSL、WYSLA、WYSLAM及WYSLAMA这6条肽段,通过抗氧化活性测定发现WY的氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)活性最强,推测可能与肽段分子质量大小有关。SHEN等[40]研究发现肽段LGFEY和LGFYY的抗氧化活性是由于Phe及Tyr的存在,在C端添加一个Tyr残基,ORAC活性有所下降,说明分子质量大小会影响肽段的抗氧化活性。
NDEZ-LEDESMA等[7]利用抗氧化肽WYSLAMAASDI设计合成了WY、WYS、WYSL、WYSLA、WYSLAM及WYSLAMA这6条肽段,通过抗氧化活性测定发现WY的氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC)活性最强,推测可能与肽段分子质量大小有关。SHEN等[40]研究发现肽段LGFEY和LGFYY的抗氧化活性是由于Phe及Tyr的存在,在C端添加一个Tyr残基,ORAC活性有所下降,说明分子质量大小会影响肽段的抗氧化活性。
2.1.4 肽的构象
肽的构象是指肽二级及以上的空间结构,其也会影响肽的抗氧化活性。LIANG等[41]研究发现细胞抗氧化活性与肽构象,特别是α-螺旋和无规则卷曲含量呈负相关。通过比较玉米面筋蛋白中的AGLPM、AGIPM、HALGA和HIGA四种多肽,发现亮氨酸多肽AGLPM和HALGA在HepG2氧化应激反应中显示出更强的保护作用,表明细胞抗氧化活性与肽的二级结构相关;此外,还发现AGLPM、HALGA清除自由基能力高于AGIPM、HAIGA,表明Leu因具有较低的α-螺旋及无规则卷曲含量,而使得其比Ile的抗氧化活性更大,说明肽的抗氧化活性会受到氨基酸相互作用及构象的影响[42]。
2.2 定量构效关系
定量构效关系(quantitative structure-activity relationship,QSAR)模型是一种通过建模研究结构与活性之间关系的数学表达方法。QSAR研究最早出现在药物、农学、有机化学等领域,现已成功用于抗菌剂、ACE抑制剂和苦味肽的研究中。近年来,QSAR模型在研究肽的生物活性和构效关系方面取得了很大的进步。LI等[43]使用QSAR模型,通过完全交叉验证和外部验证发现,氨基酸C末端和N末端的理化性质与抗氧化活性之间存在一定的关系;在预测抗氧化活性时,C末端氨基酸的性质比N末端氨基酸更重要。
抗氧化肽的QSAR研究关键步骤为:数据准备、数据分析和模型验证(图2)。其中结构定量表征是QSAR研究的关键环节,包括物理化学、分子拓扑和理论计算等参数。由于多肽结构具有多样性、构效关系复杂性,需要借助一些分析方法使得数据更为可靠,其中偏最小二乘(partial least-square method,PLS)和支持向量机(support vector machine,SVM)分别是用于建立线性和非线性模型最常用的回归方法,多元线性回归法可以为抗氧化活性与结构之间的机理阐述提供方便[44]。
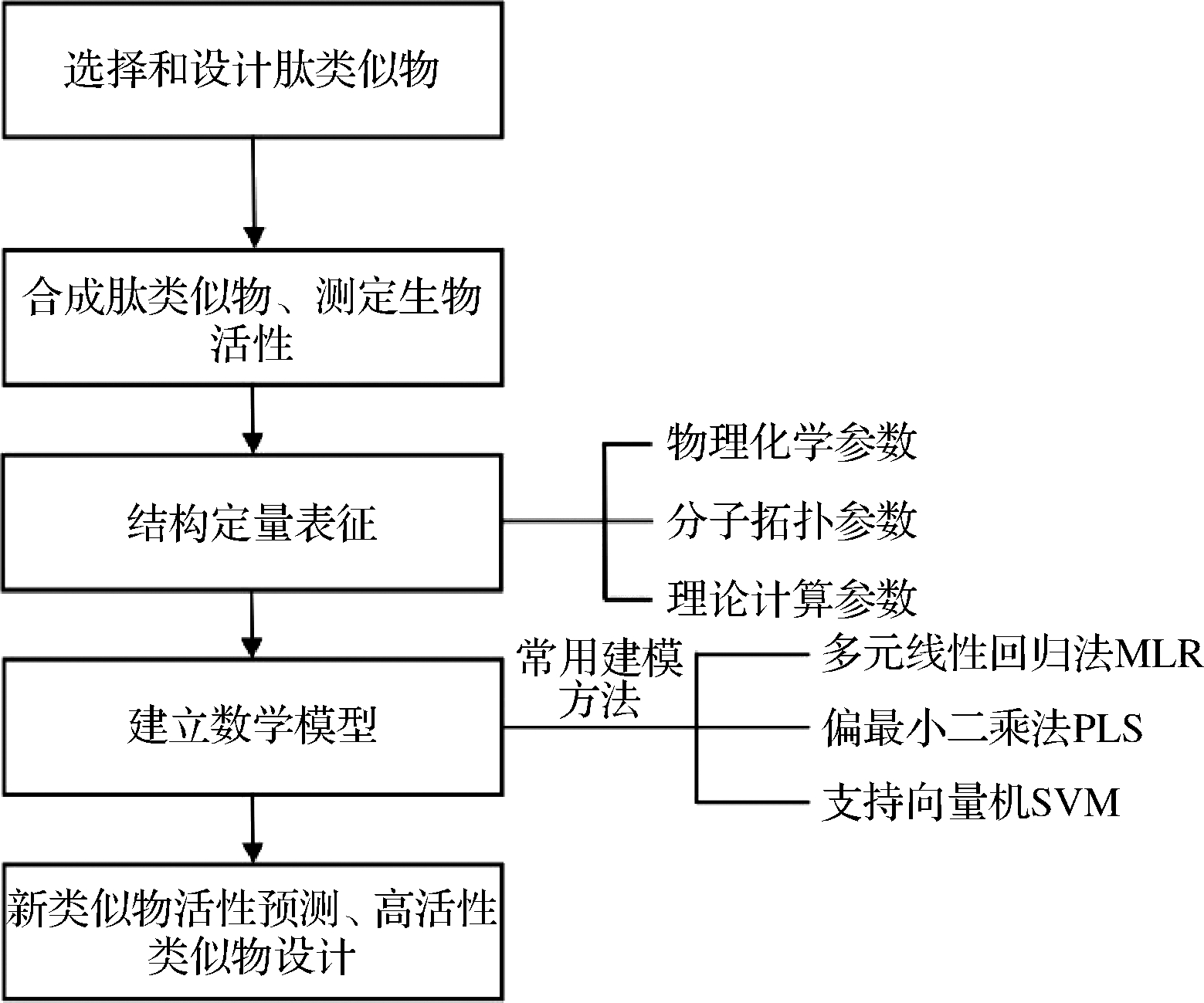
图2 多肽的QSAR模型研究过程
Fig.2 Study on the process of polypeptides in QSAR model
通过建立QSAR模型,可以评估谷物蛋白作为抗氧化肽的潜在前体,预测蛋白质在不同蛋白酶的水解下可能释放的抗氧化活性肽,还可以定向合成高抗氧化活性的肽类。QSAR模型可以从理论上推测抗氧化肽的活性位点,进一步明确肽的构效关系,深入了解其抗氧化作用机制。
3 谷物源抗氧化肽的应用
3.1 在食品工业中的应用
脂质氧化会导致食品营养价值损失、色泽破坏,还会产生异味和有害物质。因此,为防止或延缓食品在生产及贮运过程中的氧化作用,通常会在食品中添加化学合成抗氧化剂,这可能会危害消费者健康。相比化学合成抗氧化剂而言,天然食源性抗氧化肽安全性更高,且不会对食品风味和色泽产生影响,成为食品添加剂行业的研究热点。研究表明,谷物源抗氧化肽具有较好的抗氧化活性,可以替代化学合成抗氧化剂加入到食品中发挥作用。如在肉制品中加入谷物源抗氧化肽可以有效延长其货架寿命[45];在散装油及乳状液中掺入米糠蛋白水解产物可以改善其氧化稳定性[46]。
虽有研究证明了蛋白活性肽的抗氧化潜力,但迄今为止投入应用的抗氧化肽仍较少,主要是存在产品风味差(如具有苦味)、食品加工过程中活性易丧失等问题,因此,对于谷物源抗氧化肽在食品中应用的研究仍是具有挑战性工作。
3.2 在日化工业中的应用
经紫外线辐射产生的ROS会引起皮肤胶原蛋白及皮肤细胞的氧化,通过促进角质细胞和纤维细胞中的基质金属蛋白酶-1(matrix metalloproteinase,MMP-1)活性而引起皮肤光老化,造成皮肤干燥、粗糙和皮肤松弛等问题[47]。具有抗氧化活性的物质(如抗氧化肽)可有效防止ROS引起的皮肤氧化应激损伤。因此,在化妆品中加入抗氧化肽不仅可以增加化妆品稳定性,还能赋予其抗皮肤氧化功效。
消费者对于天然的具有保护皮肤功能作用产品的需求,使得具有生物活性的新型化妆品发展迅速。研究表明,谷物蛋白(如米糠蛋白、玉米蛋白)水解产物中含有的氨基酸(如脯氨酸、组氨酸、半胱氨酸、苯丙氨酸、酪氨酸等)生物活性肽起着重要的抗氧化作用[48],谷物源抗氧化肽具有较强的DPPH自由基清除能力、·OH清除能力,能有效修复皮肤的氧化应激损伤。
3.3 其他方面的应用
抗氧化肽不仅具有丰富的营养价值,还具有多种生理功能。ROS引起氧化应激会诱发多种代谢性疾病,因此需要维持体内氧化平衡。目前,谷物源抗氧化肽已应用于药物开发[49]。此外,抗氧化肽还可以像蛋白、氨基酸一样添加到饲料中。谷物源抗氧化肽已被证实可作为饲料添加剂,如在鹅饲料中添加玉米抗氧化肽,可以提高鹅的抗氧化能力,减少氧化损伤[50]。通过酵母菌发酵玉米蛋白,得到的抗氧化肽可用于乳仔猪饲料中以缓解氧化应激反应[51]。
4 结语
谷物蛋白作为抗氧化肽的底物蛋白,具有来源广泛、安全性高、成本低的特点,在功能食品、日化产品、生物医药等领域中的市场价值非常巨大。随着科技的发展,各种新技术带来的谷物源抗氧化肽的功能活性的研究更加深入,部分谷物源抗氧化肽的生物学效应已经确定,谷物源抗氧化肽的开发和利用表现出更开阔的应用前景。谷物源抗氧化肽的制备方法对其生物利用度的影响,以及抗氧化肽的生物有效性、安全性和致敏性仍需要进一步深入开展研究。
但目前对谷物源抗氧化活性肽的研究依然不足,阻碍了其开发利用及发展。首先,用于制备谷物源抗氧化肽的方法以酶水解法为主,这种方法存在操作复杂、效率低、产生苦味等缺点,利用酶水解法水解谷物蛋白得到的活性肽存在氨基酸组成相似,但活性相差较大的问题,为后续的分离纯化增加了难度;其次,对谷物源抗氧化肽的研究多处于试验阶段,并未投入实际生产;最后,对谷物源抗氧化肽的构效关系研究仍存在难点,包括抗氧化肽可能的活性位点预测、肽中氨基酸组成、排列顺序、分子质量大小与抗氧化活性的影响机制等仍有待于探索。
[1] GONG X X, AN Q, LE L Q, et al.Prospects of cereal protein-derived bioactive peptides:Sources, bioactivities diversity, and production[J].Critical Reviews in Food Science and Nutrition, 2022, 62(11):2 855-2 871.
[2] 杨保军, 梁琪.干酪源生物活性肽的构效关系研究进展[J].食品与发酵工业,2021,47(16):288-293
YANG B J, LIANG Q.Advances in research on structure-activity relationship of bioactive peptides in cheese[J].Food and Fermentation Industries,2021,47(16):288-293
[3] SILA A, BOUGATEF A.Antioxidant peptides from marine by-products:Isolation, identification and application in food systems.A review[J].Journal of Functional Foods, 2016, 21:10-26.
[4] 林端权, 郭泽镔, 张怡, 等.海洋生物活性肽的研究进展[J].食品工业科技, 2016, 37(18):367-373.
LIN D Q, GUO Z B, ZHANG Y, et al.Research progress on the marine bioactive peptides[J].Science and Technology of Food Industry, 2016, 37(18):367-373.
[5] GARC A, M C, PUCHALSKA P, ESTEVE C, et al.Vegetable foods:A cheap source of proteins and peptides with antihypertensive, antioxidant, and other less occurrence bioactivities[J].Talanta, 2013, 106:328-349.
A, M C, PUCHALSKA P, ESTEVE C, et al.Vegetable foods:A cheap source of proteins and peptides with antihypertensive, antioxidant, and other less occurrence bioactivities[J].Talanta, 2013, 106:328-349.
[6] 頡宇, 胡锦灵, 赵宏飞, 等.基于生物信息学定向制备柠条籽蛋白抗氧化肽的工艺优化[J].食品科学, 2020, 41(20):278-284.
JIE Y, HU J L, ZHAO H F, et al.Optimization of bioinformatics-based directional preparation of antioxidant peptide from caragana seed protein[J].Food Science, 2020, 41(20):278-284.
[7] HERN NDEZ-LEDESMA B, DEL MAR CONTRERAS M, RECIO I.Antihypertensive peptides:Production, bioavailability and incorporation into foods[J].Advances in Colloid and Interface Science, 2011, 165(1):23-35.
NDEZ-LEDESMA B, DEL MAR CONTRERAS M, RECIO I.Antihypertensive peptides:Production, bioavailability and incorporation into foods[J].Advances in Colloid and Interface Science, 2011, 165(1):23-35.
[8] WANG L Y, DING L, WANG Y, et al.Isolation and characterisation of in vitro and cellular free radical scavenging peptides from corn peptide fractions[J].Molecules, 2015, 20(2):3 221-3 237.
[9] XU S W, SHEN Y T, LI Y H.Antioxidant activities of sorghum kafirin alcalase hydrolysates and membrane/gel filtrated fractions[J].Antioxidants, 2019, 8(5):131.
[10] JIN D X, LIU X L, ZHENG X Q, et al.Preparation of antioxidative corn protein hydrolysates, purification and evaluation of three novel corn antioxidant peptides[J].Food Chemistry, 2016, 204:427-436.
[11] ZHANG M, HUANG T S, MU T H.Production and in vitro gastrointestinal digestion of antioxidant peptides from enzymatic hydrolysates of sweet potato protein affected by pretreatment[J].Plant Foods for Human Nutrition (Dordrecht, Netherlands), 2019, 74(2):227-230.
[12] DONG X H, LI J, JIANG G X, et al.Effects of combined high pressure and enzymatic treatments on physicochemical and antioxidant properties of peanut proteins[J].Food Science & Nutrition,2019,7(4):1 419-1 423.
[13] LIN S Y, LIANG R, LI X F, et, al.Effect of pulsed electric field (PEF) on structures and antioxidant activity of soybean source peptides-SHCMN[J].Food Chemistry, 2016, 213:588-594.
[14] LIANG Q F, REN X F, MA H L, et al.Effect of low-frequency ultrasonic-assisted enzymolysis on the physicochemical and antioxidant properties of corn protein hydrolysates[J].Journal of Food Quality, 2017, 2017:2784146.
[15] SUETSUNA K, CHEN J R.Isolation and characterization of peptides with antioxidant activity derived from wheat gluten[J].Food Science and Technology Research, 2002, 8(3):227-230.
[16] WATTANASIRITHAM L, THEERAKULKAIT C, WICKRAMASEKARA S, et al.Isolation and identification of antioxidant peptides from enzymatically hydrolyzed rice bran protein[J].Food Chemistry, 2016, 192:156-162.
[17] WANG X J, ZHENG X Q, KOPPARAPU N K, et al.Purification and evaluation of a novel antioxidant peptide from corn protein hydrolysate[J].Process Biochemistry, 2014, 49(9):1 562-1 569.
[18] LEUNG R, VENUS C, ZENG T, et al.Structure-function relationships of hydroxyl radical scavenging and chromium-VI reducing cysteine-tripeptides derived from rye secalin[J].Food Chemistry, 2018, 254:165-169.
[19] 刘恩岐, 巫永华, 高兆建, 等.抗氧化黑豆肽的分离纯化与结构鉴定[J].中国粮油学报, 2016, 31(2):33-37;43.
LIU E Q, WU Y H, GAO Z J, et al.Isolation, purification and structure identification of antioxidant peptides derived from black soybean protein[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(2):33-37;43.
[20] 陈思远, 刘永祥, 曹小舟, 等.从麦胚清蛋白分离制备高活性抗氧化肽[J].中国农业科学, 2016, 49(12):2 379-2 388.
CHEN S Y, LIU Y X, CAO X Z, et al.The preparation process for isolation of a highly active antioxidant peptide derived from wheat germ albumin[J].Scientia Agricultura Sinica, 2016, 49(12):2 379-2 388.
[21] BEERMANN C, EULER M, HERZBERG J, et al.Anti-oxidative capacity of enzymatically released peptides from soybean protein isolate[J].European Food Research and Technology, 2009, 229(4):637-644.
[22] ZHANG Q Z, TONG X H, LI Y, et al.Purification and characterization of antioxidant peptides from alcalase-hydrolyzed soybean (Glycine max L.) hydrolysate and their cytoprotective effects in human intestinal Caco-2 cells[J].Journal of Agricultural and Food Chemistry, 2019, 67(20):5 772-5 781.
[23] AGRAWAL H, JOSHI R, GUPTA M.Purification, identification and characterization of two novel antioxidant peptides from finger millet (Eleusine coracana) protein hydrolysate[J].Food Research International, 2019, 120(6):697-707.
[24] CHAKRABARTI S, GUHA S, MAJUMDER K, et al.Food-derived bioactive peptides in human health:Challenges and opportunities[J].Nutrients, 2018, 10(11):1 738.
[25] 罗斌, 邱波, 谢作桦.枯草芽孢杆菌发酵米糠制备活性肽及其抗氧化性评价[J].安徽农业科学, 2017, 45(2):122-124.
LUO B, QIU B, XIE Z H.Preparation and antioxidant properties of bioactive peptide from rice bran fermented with Bacillus subtilis[J].Journal of Anhui Agricultural Sciences, 2017, 45(2):122-124.
[26] AMADOU I, LE G W, AMZA T, et al.Purification and characterization of foxtail millet-derived peptides with antioxidant and antimicrobial activities[J].Food Research International, 2013, 51(1):422-428.
[27] VILLAMIL O, V QUIRO H, SOLANILLA J F.Fish viscera protein hydrolysates:Production, potential applications and functional and bioactive properties[J].Food Chemistry, 2017, 224:160-171.
QUIRO H, SOLANILLA J F.Fish viscera protein hydrolysates:Production, potential applications and functional and bioactive properties[J].Food Chemistry, 2017, 224:160-171.
[28] KORHONEN H, PIHLANTO A.Food-derived bioactive peptides-opportunities for designing future foods[J].Current Pharmaceutical Design, 2003, 9(16):1 297-1 308.
[29] RANATHUNGA S, RAJAPAKSE N, KIM S K.Purification and characterization of antioxidative peptide derived from muscle of conger eel (Conger myriaster)[J].European Food Research & Technology, 2006, 222(3-4):310-315.
[30] 陈楠. 抗氧化三肽的定量构效关系及抗氧化作用分子机理研究[D].重庆:重庆大学, 2018.
CHEN N.Research on the quantitative structure-activity relationship and antioxidant molecular mechanism of antioxidant tripeptide[D].Chongqing:Chongqing University, 2018.
[31] PHONGTHAI S, RAWDKUEN S.Fractionation and characterization of antioxidant peptides from rice bran protein hydrolysates stimulated by in vitro gastrointestinal digestion[J].Cereal Chemistry, 2020, 97(2):316-325.
[32] HERN NDEZ-LEDESMA B, D
NDEZ-LEDESMA B, D VALOS A, BARTOLOMÉ B, et al.Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin.Identification of active peptides by HPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2005, 53(3):588-593.
VALOS A, BARTOLOMÉ B, et al.Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin.Identification of active peptides by HPLC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2005, 53(3):588-593.
[33] CHEN H M, MURAMOTO K, YAMAUCHI F.Structural analysis of antioxidative peptides from soybean β-conglycinin[J].Journal of Agricultural and Food Chemistry, 1995, 43(3):574-578.
[34] WEI C H, NGUYEN S D, KIM M R, et al.Rice albumin N-terminal (Asp-His-His-Gln) prevents against copper ion-catalyzed oxidations[J].Journal of Agricultural and Food Chemistry, 2007, 55(6):2 149-2 154.
[35] CHAI T T, LAW Y C, WONG F C, et al.Enzyme-assisted discovery of antioxidant peptides from edible marine invertebrates:A review[J].Marine Drugs, 2017, 15(2):42.
[36] NGO D H, QIAN Z J, RYU B, et al.In vitro antioxidant activity of a peptide isolated from Nile tilapia (Oreochromis niloticus) scale gelatin in free radical-mediated oxidative systems[J].Journal of Functional Foods, 2010, 2(2):107-117.
[37] NAOHIKO N, YOKOO Y,FOJIMAKI M, et al.Studies on antioxidative activities of amino compounds on fats and oils part ii.antioxidative activities of dispeptides and their synergistic effects on tocopherol[J].Nippon Shokuhin Kogyo Gakkaishi, 1975, 22(9):425-430.
[38] SAITO K, JIN D H, OGAWA T, et al.Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry[J].Journal of Agricultural and Food Chemistry, 2003, 51(12):3 668-3 674.
[39] 徐力, 李相鲁, 吴晓霞, 等.一种新的玉米抗氧化肽的制备与结构表征[J].高等学校化学学报, 2004, 25(3):466-469.
XU L, LI X L, WU X X, et al.Preparation and structural characterization of a new corn anti-oxidant peptide[J].Chemical Research in Chinese Universities, 2004, 25(3):466-469.
[40] SHEN S, CHAHAL B, MAJUMDER K, et al.Identification of novel antioxidative peptides derived from a thermolytic hydrolysate of ovotransferrin by LC-MS/MS[J].Journal of Agricultural and Food Chemistry, 2010, 58(13):7 664-7 672.
[41] LIANG R, ZHANG Z M, LIN S Y.Effects of pulsed electric field on intracellular antioxidant activity and antioxidant enzyme regulating capacities of pine nut (Pinus koraiensis) peptide QDHCH in HepG2 cells[J].Food Chemistry, 2017, 237:793-802.
[42] JIANG Y, ZHANG M D, LIN S Y, et al.Contribution of specific amino acid and secondary structure to the antioxidant property of corn gluten proteins[J].Food Research International, 2018, 105:836-844.
[43] LI Y W, LI B.Characterization of structure-antioxidant activity relationship of peptides in free radical systems using QSAR models:Key sequence positions and their amino acid properties[J].Journal of Theoretical Biology, 2013, 318:29-43.
[44] ZHOU P, YANG C, REN Y R, et al.What are the ideal properties for functional food peptides with antihypertensive effect? A computational peptidology approach[J].Food Chemistry, 2013, 141(3):2 967-2 973.
[45] ZHOU K Q, CANNING C, SUN S.Effects of rice protein hydrolysates prepared by microbial proteases and ultrafiltration on free radicals and meat lipid oxidation[J].LWT-Food Science and Technology, 2013, 50(1):331-335.
[46] CHEETANGDEE N, BENJAKUL S.Antioxidant activities of rice bran protein hydrolysates in bulk oil and oil-in-water emulsion[J].Journal of the Science of Food and Agriculture, 2015, 95(7):1 461-1 468.
[47] KIM J M, KIM S Y, NOH E M, et al.Reversine inhibits MMP-1 and MMP-3 expressions by suppressing of ROS/MAPK/AP-1 activation in UV-stimulated human keratinocytes and dermal fibroblasts[J].Experimental Dermatology, 2018, 27(3):298-301.
[48] HAN J H, BANG J S, CHOI Y J, et al.Oral administration of oyster (Crassostrea gigas) hydrolysates protects against wrinkle formation by regulating the MAPK pathway in UVB-irradiated hairless mice[J].Photochemical and Photobiological Sciences, 2019, 18(6):1 436-1 446.
[49] ZAKY A A, ABD EL-ATY A M,MA A J,et al.An overview on antioxidant peptides from rice bran proteins:Extraction, Identification, and Applications[J].Critical Reviews in Food Science and Nutrition, 2020,62(5):1 350-1 362.
[50] 栾新红, 曹中赞, 孙长勉, 等.添加玉米蛋白多肽对豁眼鹅血清酶及抗氧化指标的影响[J].中国畜牧杂志, 2012, 48(1):42-45.
LUAN X H, CAO Z Z, SUN C M, et al.Effects of adding zein polypeptide on serum enzymes and antioxidant indexes of huoyan goose [J].Chinese Journal of Animal Science, 2012, 48(1):42-45.
[51] 刘骥, 易春霞, 韩业东, 等.微生物发酵玉米蛋白粉生产富肽饲料的研究[J].饲料工业, 2018, 39(17):36-39.
LIU J, YI C X, HAN Y D, et al.Study on the production of peptide-rich feed by microbial fermentation of corn protein meal[J].Feed Industry, 2018, 39(17):36-39.