β-丙氨酸(β-alanine,C3H7NO2),易溶于水,是自然界中唯一存在的β型氨基酸。与组成人体蛋白质20种氨基酸之一的α-丙氨酸互为同分异构体。β-丙氨酸作为一种非蛋白氨基酸,可以在微生物、植物和昆虫体内合成,而哺乳动物需从外界环境中摄取[1-2]。β-丙氨酸广泛被应用在医药、食品、化工和环境等领域。首先,工业上很多重要化合物如:3-羟基丙酸(3-hydroxypropionic acid)、聚3-羟基丙酸酯(poly 3-hydroxypropionate)、泛酸(pantothenic acid)、肌肽(carnosine)、帕米膦酸钠(pamidronate)和巴柳氮(balasalazide)等是以β-丙氨酸为重要前体或中间体合成的[3-7]。其次,在食品行业中,β-丙氨酸既是一种食品添加剂改善食品味道,还被作为运动员营养补充剂,改善身体机能[8-9]。此外,它还可以直接用于生产聚β-丙氨酸,广泛应用于化妆品、水净化和建筑等领域[10-11]。
近年来β-丙氨酸系列产品的全球需求量约为5万t,且仍在不断增加,预计到2023年全球市场需求可达8.1万t,被称为未来全球12种最具开发潜力的三碳化工产品之一[12]。世界上β-丙氨酸主要通过化学法、生物酶转化法以及微生物发酵法进行生产。其中反应条件温和,对环境友好的微生物发酵法受到越来越广泛的关注,目前已经报道的最高产量为43.12 g/L[13]。但是该水平还达不到工业化水平。值得注意的是,L-天冬氨酸-α-脱羧酶(L-asparatate-α-decarboxylase,EC4.1.1.11 PanD)是酶法与微生物发酵法合成β-丙氨酸的关键,该酶通过催化一分子L-天冬氨酸脱去α位羧基释放一分子CO2,生成β-丙氨酸,是影响β-丙氨酸产量的关键。近年来对PanD的蛋白晶体结构、酶学性质以及催化机制也有了深入的研究,对其过表达和改造也是催化法提高β-丙氨酸产量的关键。
近年来,随着β-丙氨酸市场需求量逐年增加,对β-丙氨酸产量方面的研究也越来越多。本文将通过对近几年β-丙氨酸的合成方法及过程、代谢工程、调控机制和关键酶的研究进展进行全面综述,为β-丙氨酸合成产量的进一步提高提供基础。
1 β-丙氨酸的合成方法
目前,β-丙氨酸的生产主要包括化学合成法、生物酶转化法和微生物发酵法。不同的方法具有不同的优势及劣势,具体如表1所示。
表1 不同方法的优缺点比较
Table 1 Comparison of the advantages and disadvantages of different methods

合成方法优点缺点化学合成法反应选择性高;产物收率高工艺流程长;能耗大;污染严重;副产物多;产物纯化复杂生物酶催化法工艺条件温和;安全;污染少;工艺简单;易纯化;副产物少需要大量酶及前体;存在高浓度底物抑制微生物发酵法绿色、环保、可持续发展;条件温和;原料成本低;副产物少产量较低,短期内达不到工业生产需求;生产周期长
1.1 化学合成法
化学合成法是现在β-丙氨酸大规模生产的主要方法。按照合成原料的不同,合成β-丙氨酸的方法主要有丙烯酸法、丙烯腈法、β-氨基丙腈法、琥珀酰亚胺法等。其中丙烯酸法和丙烯腈法为国内厂家使用最广泛的方法。
丙烯酸法是以丙烯酸、丙烯酸酯或丙烯酸盐为底物,与氨水氨化反应,得到产物β-丙氨酸(图1-a),是理想的工业化方法[7],但此方法需要较高的温度和压力。裘娟萍等[14]通过将底物丙烯酸加入种子培养基或者发酵培养基中,在酶催化的作用下生成β-丙氨酸,经过脱氨、纯化,最终β-丙氨酸的转化率分别为60%和54%。氨化助剂的使用及生产方式的选择直接影响β-丙氨酸产物的转化率。马铭泽等[15]通过加氨化助剂(CO2)+连续生产的生产方式,将产物β-丙氨酸的转化率提高到96%。除此之外,以丙烯酸和氨水为底物,利用高分子化合物载体(氨基树脂)对天冬氨酸酶进行固定化,经过转化、脱色、蒸发浓缩以及脱水干燥步骤,最终丙烯酸合成β-丙氨酸的转化率为95.66%,纯度达到99.61%[16]。
丙烯腈法是以丙烯腈为底物通过直接氨化或氨化水解合成β-丙氨酸的方法,其中直接氨化法是高温、高压的条件下,丙烯腈与氨水发生氨化反应生成β-丙氨酸(图1-b)。氨化水解法是丙烯腈与氨水通过氨化反应生成中间物质β-氨基丙腈,后者在酸性(碱性)的条件下水解生成β-丙氨酸(图1-c)[7]。
另外,在减压条件下通过碱性溶液(氢氧化钠)与β-氨基丙腈反应生成中间产物β-氨基丙氨酸钠,再向反应罐中加入酸性溶液(盐酸)调节反应体系的pH(7~7.5),最终生成β-丙氨酸,反应液经吸附、干燥等一系列操作得到纯度为99.5%的β-丙氨酸成品[17]。随后,采用相同的底物(氢氧化钠与β-氨基丙腈),通过微通道反应器在高温、高压条件下底物发生瞬时水解反应,得到含有β-丙氨酸的粗料液,后续通过脱氨系统、离子交换系统去除氨气和钠离子,再经过浓缩结晶,最终β-丙氨酸纯度达到99.5%以上,收率达到95%以上;此方法可减少能量的消耗,提高资源的利用率[18]。另一种琥珀酰亚胺法,相较于丙烯酸氨化法工艺路线复杂且反应条件苛刻,原料成本更高,一般不采取该方法。
综上所述,化学合成法生产β-丙氨酸的转化率及纯度均达到了95%以上,是β-丙氨酸合成方法中最具有竞争力的合成方法。但化学合成法需要在高温高压强酸强碱等条件下进行,反应条件比较极端。因此,寻求绿色环保、可持续发展的生产工艺越来越受到研究者们的关注。
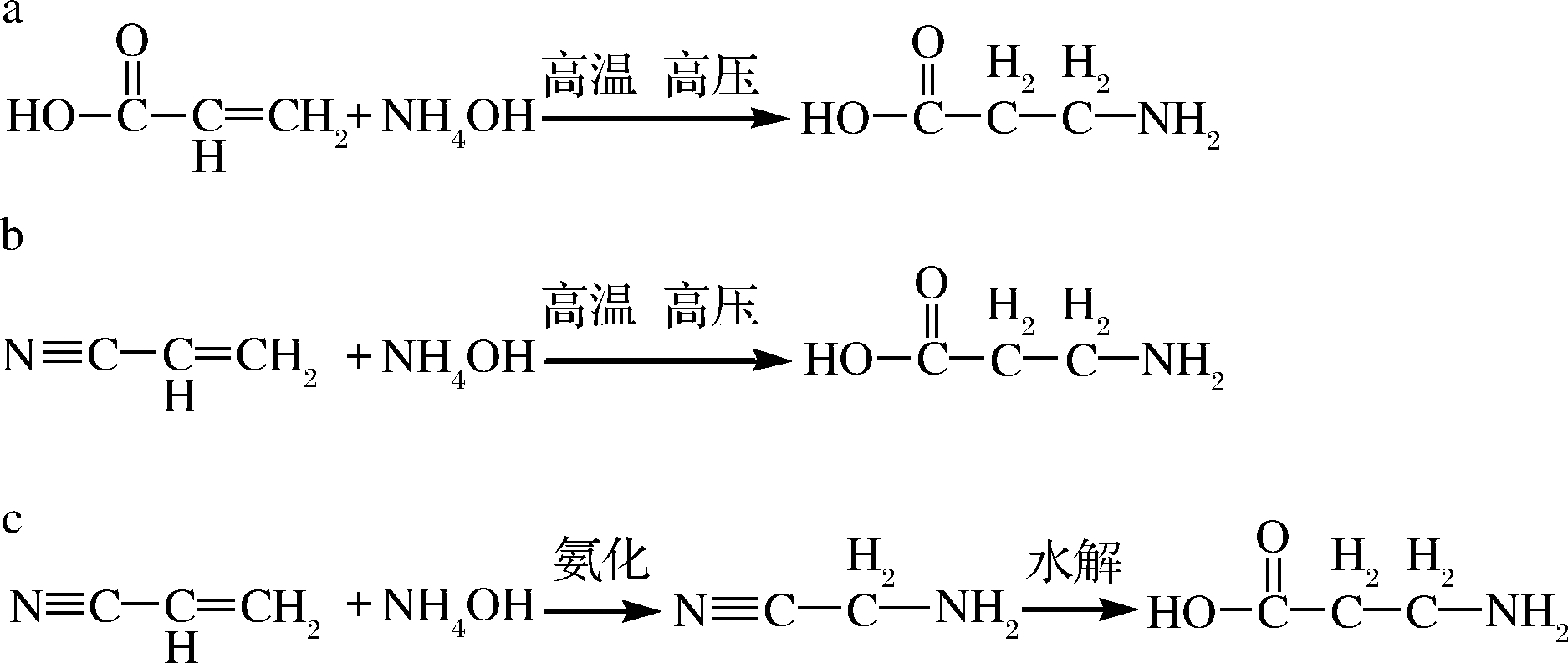
a-丙烯酸氨化反应;b-丙烯腈的氨化反应; c-丙烯腈的氨化水解法
图1 β-丙氨酸化学合成法
Fig.1 β-alanine chemical synthesis
1.2 生物酶转化法
近几十年来,随着对绿色、可持续发展需求的增加,酶已经成为传统化学催化的一种很有前途的替代品,通过微生物细胞的胞内酶与底物进行反应制备β-丙氨酸亦成为近年来研究的热点。它克服了传统化学合成法的一些难题,如成本低、生产时间短、绿色可持续等。根据底物的不同,生产β-丙氨酸的生物酶转化法可以分为腈水解酶转化法(以β-氨基丙腈为底物)和PanD转化法(以L-天冬氨酸为底物)。
1.2.1 腈水解酶转化法
腈水解酶转化法是以β-氨基丙腈为底物,该研究使用了一种可生产有机腈降解酶的微生物Alcaligenes sp. OMT-MY14,其以β-氨基丙腈为底物进行水解反应合成产物β-丙氨酸,使得β-丙氨酸最终产量达4.18 g/L[7]。梁璐怡等[19]从土壤中分离出1株能转化β-氨基丙腈生产β-丙氨酸的菌株Rhodococcus erythropolis G20。亦有专利表明,来自Bradyrhizobium japonicum USDA110的blr3397基因所编码的腈水解酶可催化β-氨基丙腈水解生成β-丙氨酸,产率达到76%[20]。
1.2.2 PanD转化法
PanD是生物体合成β-丙氨酸的关键酶,该酶可高效催化底物L-天冬氨酸脱去α位置的羧基生成β-丙氨酸(图2),是β-丙氨酸生物酶转化法的关键酶。近年来,大部分关于PanD的研究主要集中在原核生物,如大肠杆菌[10](Escherichia coli)、谷氨酸棒状杆菌[21](Corynebacterium glutamicum)、枯草芽孢杆菌[22](Bacillus subtilis)和结核分枝杆菌[23](Mycobacterium tuberculosis)。ROCK等[24]首次利用E.coli中panD基因进行突变,得到β-丙氨酸缺陷型突变菌株,证明PanD具有高效催化底物L-天冬氨酸生成产物β-丙氨酸的功能。KÖNST等[25]使用PanD全细胞催化L-天冬氨酸转化为β-丙氨酸,发现PanD具有非常高的耐热性且没有底物抑制。张潇潇[26]通过在宿主E.coli BL21(DE3)菌株中异源过表达顿齿棒杆菌(Corynebacterium crenatum)来源的panD基因,使β-丙氨酸的最终质量浓度达到76.47 mg/L。SHEN等[21]则将C.glutamicum来源的panD基因在E.coli中进行重组表达,纯酶后催化L-天冬氨酸合成β-丙氨酸,最终β-丙氨酸产量为12.85 g/L。随后,陈夏林[27]选择了不同来源的44个panD基因,对酶学性质进行研究,结果表明杰氏棒杆菌(Corynebacterium jeikeium)来源的PanD的比酶活力为11.8 U/mg,是相关报道的最高水平。之后,范雪萍等[28]直接将特基拉芽孢杆菌(Bacillus tequilensis)来源的panD基因在E.coli BL21(DE3)中重组表达,以200 g/L L-天冬氨酸作为底物,底物β-丙氨酸的最终产量达66.4 g/L。WANG等[29]共表达B.Subtilis和昆虫赤拟谷道(Tribolium castaneum)中的panD基因,利用全细胞生物催化剂从L-天冬氨酸获得271.5 g/L的β-丙氨酸,转化率为92.4%。
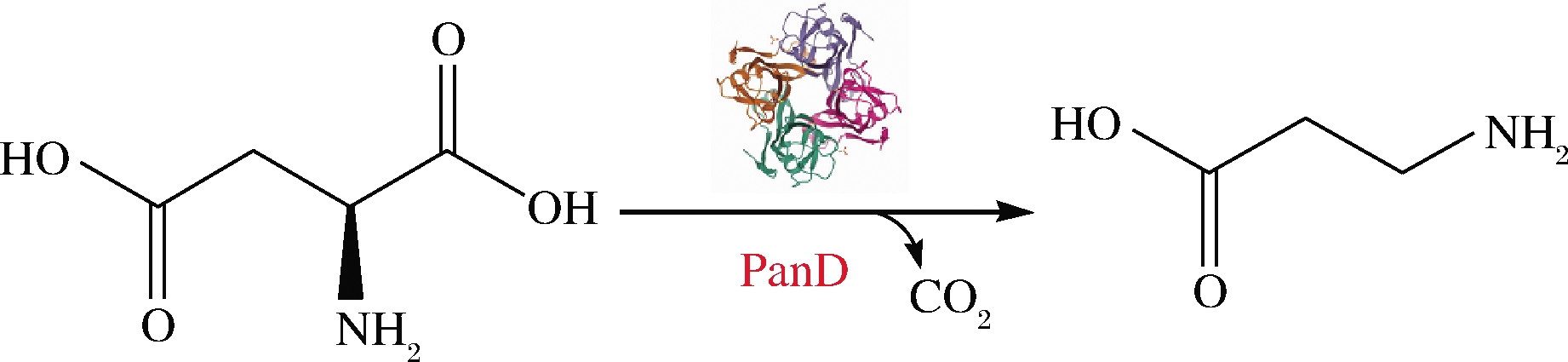
图2 PanD催化反应方程式[26]
Fig.2 PanD catalytic reaction equation[26]
1.2.2.1 PanD的自剪切催化裂解机理
PanD在生物体内主要包括2种形式:一类是T.castaneum、果蝇(Drosophila melanogaster)等真核生物来源的磷酸吡哆醛依赖型,目前其蛋白结构和催化机理尚无明确报道[30-31];另一类是广泛存在于原核生物如E.coli、幽门螺杆菌(Helicobacter pylori)及嗜热菌(Thermus thermophiles)中的PanD,以丙酮酰基团作为活性中心,这类酶晶体结构和催化机理已经完成解析,且在β-丙氨酸的合成中被广泛应用,下面将重点介绍该类PanD。
原核生物中的PanD在细胞内首先以无活性的酶原形式表达,再进一步通过自剪切形成亚基,其形成的亚基即活性基团。以E.coli中的PanD(PanDEc)为例,PanDEc编码蛋白会先形成一个非活性前体(通常叫做π蛋白),随后,π蛋白在Gly24-Ser25位置通过非水解丝氨酸作用分子内发生自裂解,导致丙酮酰基的形成,该反应也称为N到O的酰基转移,而PanD的催化作用就取决于G24和S25残基之间的裂解所形成的丙酮酰基。这一过程产生了一条具有催化活性的α链(11 kDa)和一条β链(2.8 kDa)。进一步研究显示,大肠杆菌中的PanD蛋白主要以非活性π蛋白形式存在,这可能是由于大肠杆菌中π蛋白的激活需要激活剂PanZ的存在,PanZ-AcCoA 通过反应构象的选择来促进PanD自剪切活化,而PanZ含量的不足将直接影响PanD蛋白裂解的不足,进而影响其催化效果[32]。
但是,有研究者发现,不同来源的PanD的自剪切活性有显著差异,其中C.glutamicum和B.Subtilis的PanD蛋白几乎完全裂解。研究者进一步通过定点突变方法对PanD的自我加工进行验证,结果发现突变体Val23Glu、Ile26Cys、Thr27Ala和Glu56Ser与炭疽芽孢杆菌(Bacillus anthracis)野生型(96.4%)相比,自剪切效率分别降低至90.5%,83.6%、74.4%和81.2%,即Val23Glu、Ile26Cys、Thr27Ala和Glu56Ser这4个位点的残基对于PanD的自切割过程至关重要[33]。本实验室前期的研究,通过对panD基因家族的分子进化和自然选择压力分析,结果检测到9个位点受到显著的正选择(A13、T14、V23、L32、V44、N49、L55、L78、L85)。进一步通过定向进化研究发现,其中T14K、V44I和L85V位点的变化影响了PanDBs自剪切力,而A13V、N49V、L32F、L55F、E23V和L78C等位点突变均未影响其自剪切力(数据未发表)。因此,T14、V44和L85这3个位点直接影响PanDBs的自剪切力,进而影响β-丙氨酸的产量,而其他位点仅仅影响了酶活性。这一项研究对于后续PanD蛋白的工程改造具有重要的意义。
1.2.2.2 PanD的分子改造与催化效率
除了自剪切位点外,PanD的分子改造也取得了很多进展。比如:通过不同来源的PanD的序列比对结果显示,严格保守的位点有17个,位于活性中心附近的有11个(Lys9、His11、Tyr22、Gly24、Ser25、Arg54、Thr58、Gly72、Ala73、Ala74和Ile85)[32],位点均为活性中心附近的保守或半保守位点,对PanD的自剪切和催化功能起着关键作用。PEI等[34]通过表征来自大肠杆菌(PanDEc),谷氨酸棒杆菌(PanDCg)和枯草芽孢杆菌(PanDBs)的3种PanD,通过它们的特性,包括比活度,热稳定性,发现在酶活性方面PanDEc
尽管生物酶催化合成β-丙氨酸已经取得了很多的进展,但是考虑到生物催化底物,催化酶在价格和反应条件等的限制,更绿色、有效的微生物发酵法被进一步探究。
1.3 微生物发酵法
微生物发酵法是利用代谢工程、合成生物学、蛋白工程等手段改造物质合成的代谢流,理性对代谢途径进行修改和设计,使目标产物大量积累的方法。利用微生物发酵生产氨基酸,底物便宜且来源广泛(如甘油、半乳糖、葡萄糖),可为大规模工业化生产带来巨大的商业化效益。相较于化学合成法和酶法合成β-丙氨酸,微生物发酵法具备反应条件相对温和、环境污染小等优点。其中最常用的β-丙氨酸生产菌株为E.coil[13]和C.glutamicum[37]。
1.3.1 β-丙氨酸的合成途径
β-丙氨酸的微生物发酵法主要依赖于生物体内β-丙氨酸的合成途径,具体过程如下:首先,微生物通过半乳糖转移酶(galactose symporter,Galp)将葡萄糖从体外转运到细胞内,经过葡萄糖激酶形成葡萄糖-6-磷酸(glucose-6-phosphate,G-6-P),后续生成磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP);PEP一方面被磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PPC)催化形成草酰乙酸(oxaloacetate, OAA),后者被天冬氨酸转氨酶(aspartate aminotransferase,AspC)催化成L-天冬氨酸(L-Asp);另一方面生成丙酮酸(pyruvate,PYR),在丙酮酸羧化酶(pyruvate carboxylase,Pyc)的作用下生成OAA,在丙酮酸氧化酶(pyruvic oxidase,PoxB),丙酮酸甲酸裂解酶(lactate dehydrogenase,PflB)和NAD依赖型发酵型D-乳酸脱氢酶(pyruvate formate-lyase,LdhA)催化下分别生成:乙酰辅酶A、乙酸和乳酸,乙酰辅酶A进一步在乙醇脱氢酶(alcohol dehydrogenase,AdhE)的作用下生成乙醇。OAA进入三羧酸循环后,中间产物延胡索酸可以在天冬氨酸裂解酶(aspartate lyase,AspA)的催化下胺化生成L-天冬氨酸,之后,L-天冬氨酸在天冬氨酸-α-脱羧酶(Aspartate-α-decarboxylase,PanD)的作用下生成β-丙氨酸。在E.coli中,碳源主要通过磷酸转移酶系统(the phosphotransferase system,PTS)运输到胞内,但其中1/2的PEP用于葡萄糖胞外向胞内的转运以及葡萄糖的磷酸化,PTS系统的活性降低是提高PEP前体物质的重要策略[38]。具体合成途径如图3所示。
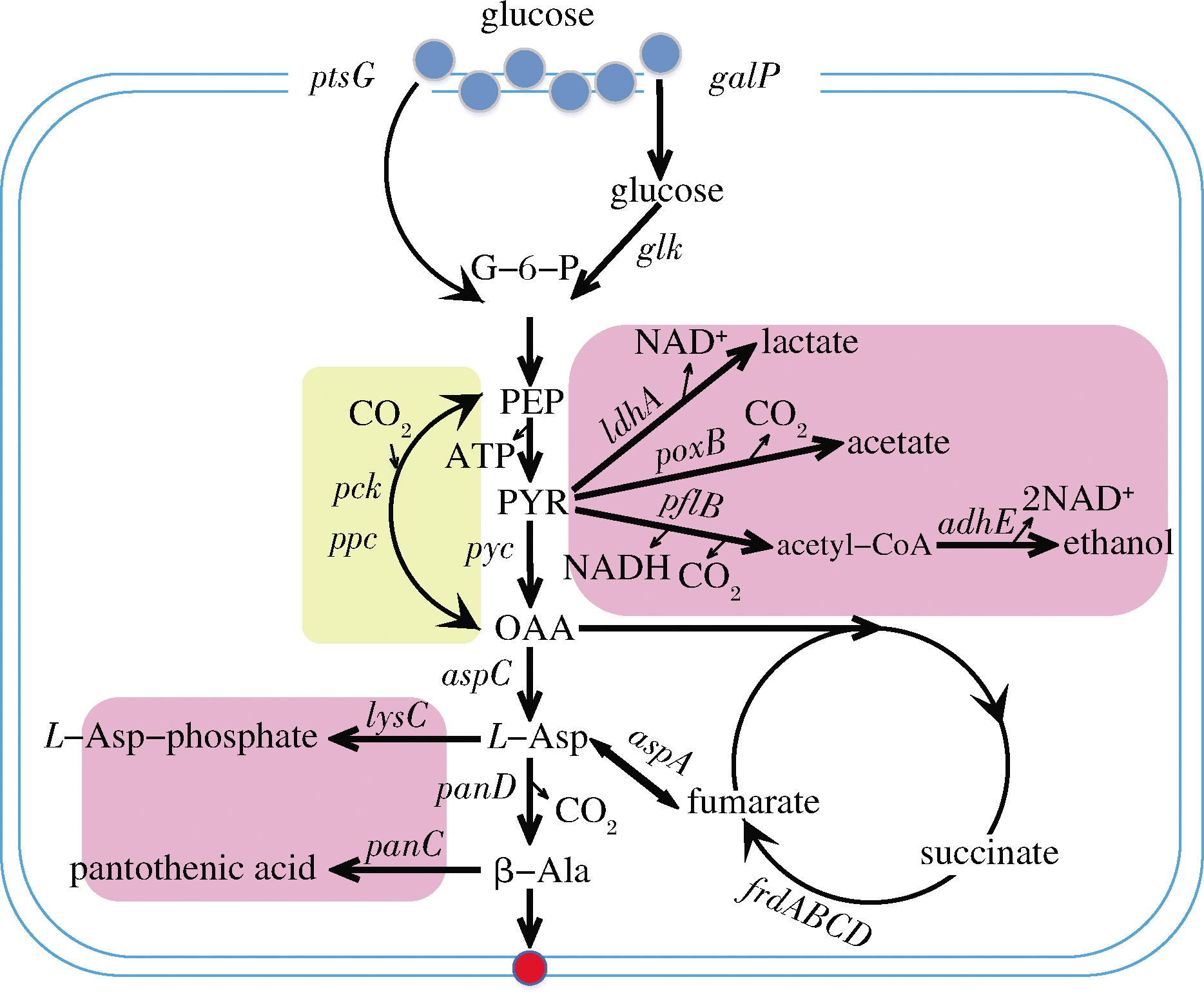
图3 β-丙氨酸生物合成相关代谢途径
Fig.3 β-Alanine biosynthesis metabolic pathways
1.3.2 β-丙氨酸微生物发酵法合成
β-丙氨酸微生物发酵法主要集中在大肠杆菌中。SONG等[10]利用可生产延胡索酸的大肠杆菌为宿主,通过aspA、C.glutamicum来源的panD等基因增加前体物质生成,通过ΔiclR ΔfumC ΔfumA ΔfumB ΔptsG ΔlacI切断副产物生成,摇瓶发酵可得3.92 g/L β-丙氨酸。之后,梁珊珊[39]以敲除相关副产物合成途径的菌株为基础菌,叠加敲除天门冬氨酸激酶(aspartate kinase,LysC)和泛酸合成酶(pantothenate synthase,PanC)和ptsG和aspA基因,过表达铜绿假单胞菌(Pseudomonas aeruginosa)来源的aspC、C.glutamicum来源的panD、放线杆菌(Actinobacillus)来源的pck和乳杆菌(Lactobacillus)来源的pyc基因,β-丙氨酸产量达到18.4 g/L。随后,ZOU等[13]采用增加前体物质和切断副产物的综合策略,通过分批补料发酵获得了43.12 g/L的β-丙氨酸,为目前微生物发酵生产β-丙氨酸的最高产量,但是该水平还远达不到工业化水平。此外,很多研究也在微生物中进行理性改造代谢途径生产β-丙氨酸,具体如表2所示。
表2 β-丙氨酸产生菌构建的典型实例
Table 2 Typical examples of construction of β-alanine producing strains
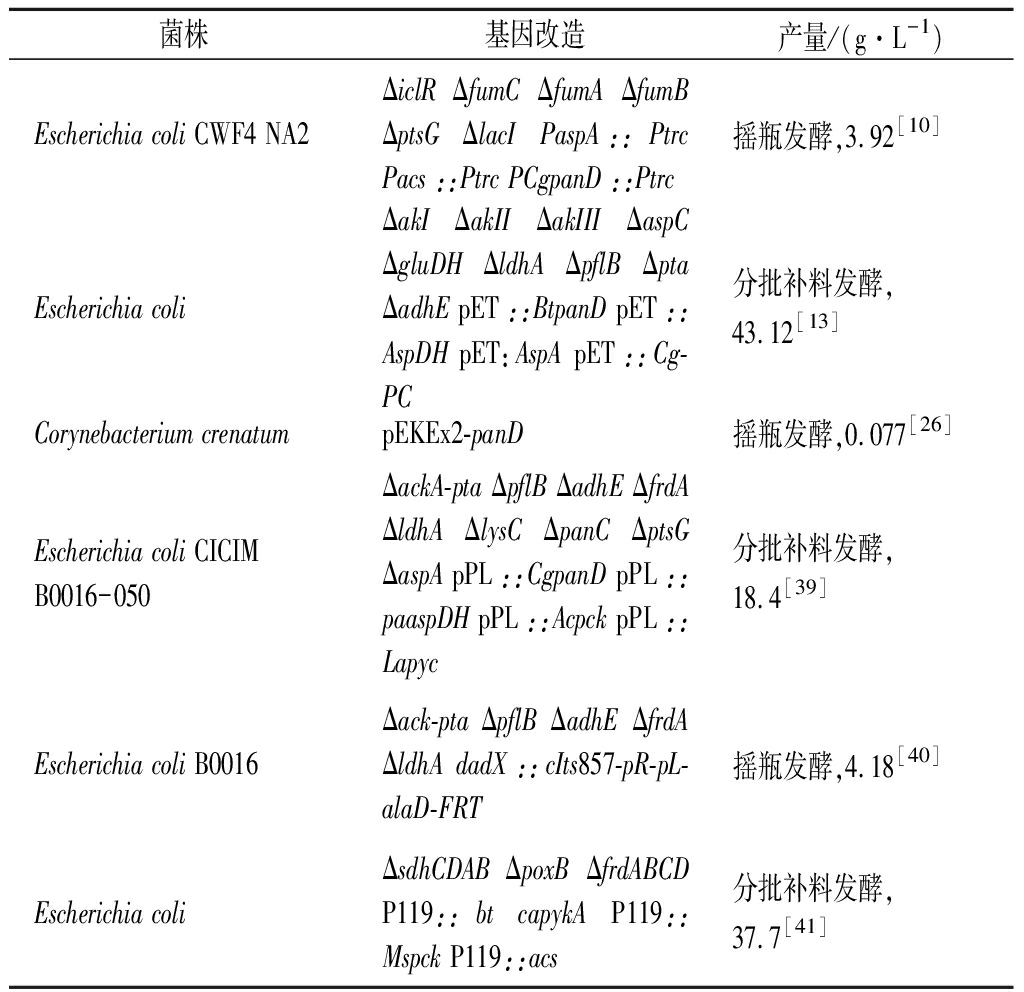
菌株基因改造产量/(g·L-1)Escherichia coli CWF4 NA2ΔiclR ΔfumC ΔfumA ΔfumB ΔptsG ΔlacI PaspA::Ptrc Pacs::Ptrc PCgpanD::Ptrc摇瓶发酵,3.92[10]Escherichia coliΔakI ΔakII ΔakIII ΔaspC ΔgluDH ΔldhA ΔpflB Δpta ΔadhE pET::BtpanD pET::AspDH pET:AspA pET::Cg-PC分批补料发酵,43.12[13]Corynebacterium crenatumpEKEx2-panD摇瓶发酵,0.077[26]Escherichia coli CICIM B0016-050ΔackA-pta ΔpflB ΔadhE ΔfrdA ΔldhA ΔlysC ΔpanC ΔptsG ΔaspA pPL::CgpanD pPL::paaspDH pPL::Acpck pPL::Lapyc分批补料发酵,18.4[39]Escherichia coli B0016Δack-pta ΔpflB ΔadhE ΔfrdA ΔldhA dadX::cIts857-pR-pL-alaD-FRT摇瓶发酵,4.18[40]Escherichia coliΔsdhCDAB ΔpoxB ΔfrdABCD P119::bt capykA P119::Mspck P119::acs分批补料发酵,37.7[41]
2 β-丙氨酸代谢工程的调控机制
β-丙氨酸生产的代谢工程策略可归纳如下:增加前体物质的合成,辅因子ATP、CO2和NADH/NAD+的平衡,减弱竞争途径。
2.1 增加前体物质的合成
过表达生物合成途径中关键酶的编码基因,通常是增加前体物质最有效的策略,该策略在代谢工程中的应用使β-丙氨酸的产量得到了大幅度提高。
在大肠杆菌β-丙氨酸的合成代谢途径中,L-天冬氨酸是其直接前体物质。当增加L-天冬氨酸浓度,PanD与底物的亲和力协同性增大,从而能够抵消抑制剂的影响,显著增加β-丙氨酸的产量。L-天冬氨酸是在PPC作用下由草酰乙酸合成,异源过表达谷氨酸棒状杆菌ppc基因显著提高L-天冬氨酸的生成,进而增加β-丙氨酸的产量,达0.36 g/L[41]。当以葡萄糖作为碳源时,敲除编码葡萄糖特异性PTS酶(glucose-specific PTS enzyme,PtsG),PtsG可调节菌体碳氮代谢,显著增强PPC的活性,从而提高了下游产物草酰乙酸的积累量,使β-丙氨酸的产量增加两倍,达到1.45 g/L[10]。在敲除PtsG系统的同时,葡萄糖的摄取途径可以使用葡萄糖激酶(glucokinase,Glk)进行取代,这些改造用于维持氧化还原平衡的PEP,以及通过消除需要从丙酮酸产生额外的PEP来提高能源效率,使β-丙氨酸产量提高了1.33 g/L[41]。由于草酰乙酸除了通过PPC催化磷酸烯醇式丙酮酸羧化而来,还可以以丙酮酸为底物,通过丙酮酸羧化酶催化生成。pyc的高水平表达可以主导CO2固定并可以增加ATP产率(每1分子草酰乙酸产生1个ATP)。梁姗姗[39]在E.coli中过表达Lactobacillus来源的pyc基因增加丙酮酸到草酰乙酸的代谢流,可使β-丙氨酸产量提高到5.4 mg/L。
在菌株代谢中,L-天冬氨酸合成的另一途径是延胡索酸在天冬氨酸裂解酶的催化下生成L-天冬氨酸,此反应为可逆反应,L-天冬氨酸在一定程度上亦可以生成延胡索酸,通过敲除此途径,避免L-天冬氨酸外泄,可少量增加β-丙氨酸含量(0.61 g/L)[41]。在随后的研究中,为了进一步增加L-天冬氨酸的生物合成,弥补AspA活性的不足,增强aspA表达,使TCA循环的中间代谢物β-丙氨酸产量提高0.51 g/L[13,42]。
2.2 增加拷贝数及调节启动子
除此之外,还可以在转录和翻译水平上调节酶表达,以解决β-丙氨酸的生产问题。转录水平的高低主要取决于启动子的强弱以及启动子与RNA聚合酶的亲和力,翻译水平高低主要取决于RBS序列强弱、RBS序列的发卡结构和SD序列与ATG之间特异性的序列[43]。粱珊珊[39]采用 PL 启动子温度调控两阶段发酵转换,敲除或过表达相关基因后,发酵后产量达到18.4 g/L。SONG等[10]通过使用合成启动子和RBS序列优化ppc的表达水平,使β-丙氨酸产量增加到3.94 g/L。QIAN[44]则通过调节aspC基因表达的RBS以及panD基因的拷贝数,优化2种基因在E.coli中的表达,最终在5 L生物反应器中得到了80.4 g/L产物,转化率达到95.3%。
本实验室发现panD拷贝数的变化也是影响β-丙氨酸产量的关键。当增加EcopanD基因拷贝数,WpTrc-3ED上清液中β-丙氨酸质量浓度(0.56 g/L)显著高于WpTrc-2ED中(0.21 g/L),且菌株生长量在发酵48 h时显著高于WpTrc-2ED菌株生长量。而对于BsupanD,WpTrc-BD菌株的β-丙氨酸产量为1.61 g/L,WpTrc-2BD菌株的β-丙氨酸合成量达到1.68 g/L,而WpTrc-3BD菌株中β-丙氨酸合成量为2.10 g/L,显著高于WpTrc-2BD菌株的β-丙氨酸浓度。因此,通过增加panD基因拷贝数可以显著提高β-丙氨酸的产量。
2.3 辅因子ATP、CO2和NADH/NAD+的平衡
NADPH是代谢网络的关键辅因子之一,在氨基酸产生株的生化反应和生理功能中起着重要作用。对NADPH的可用性和形式的操作是在工业菌株中将碳通量转向氨基酸生物合成的一种有效和简单的方法[45]。从葡萄糖合成β-丙氨酸的代谢过程中伴随着NAD+/NADH的相互转化,葡萄糖进入体内,经过糖酵解途径中3-磷酸甘油醛生成NADH,接着丙酮酸合成乙酰辅酶A过程也释放NADH,后续草酰乙酸合成L-天冬氨酸过程中则需要消耗NADH。过表达碳酸氢盐转运体基因(BT)和碳酸酐酶基因(CA)增强CO2/碳酸氢盐同化的同时,引入一个辅因子自给系统-天冬氨酸脱氢酶(aaspartate dehydrogenase,AspDH),该系统可以分别同时再生NAD+和L-谷氨酸用于糖酵解和AspC,更有效地驱动L-天冬氨酸生成反应,将β-丙氨酸产量提高到3.54 g/L[39]。敲除ldhA基因以平衡NADH辅酶代谢的不平衡,可以有效提高β-丙氨酸产量至2.37 g/L[40]。同时在异源过表达pyc基因时,期间会消耗1分子CO2,而由L-天冬氨酸通过PanD合成β-丙氨酸途径时产生1分子CO2,因此,增加pyc基因的表达将有助于CO2的平衡。
2.4 减弱竞争途径
在整个细胞的代谢工程中,通过敲除对竞争代谢途径关键的基因,将碳通量重新分配到目标产品,被广泛应用于代谢重新设计策略。大肠杆菌的基因敲除方法主要是通过CRISPR/Cas9技术,将竞争途径的关键基因进行敲除或是弱化,此策略已经成功应用于生产各种氨基酸的生产菌株,可成功减少副产物的生成。
大肠杆菌的ldhA、poxB和pflB编码的酶共同竞争底物丙酮酸,使代谢通路流向乳酸、甲酸、乙醇等副产物。在野生型大肠杆菌B0016[40]中删除醋酸盐、甲酸盐、乙醇和乳酸盐的副产品路线,可使L-天冬氨酸产量增加,进而增加目标产物。除此之外,大肠杆菌LysC和AspA的共同底物为L-天冬氨酸,使途径流向L-赖氨酸和L-甲硫氨酸等副产物。ZOU等[13]淘汰了3个原生的天冬氨酸激酶基因,通过防止天冬氨酸旁路的丢失,促进β-丙氨酸的产量提高了1.67 g/L。此外,敲除panC基因并适当添加泛酸也是一种增加β-丙氨酸浓度的策略。另一个典型案例是梁珊珊[39]构建的重组大肠杆菌菌株B0016-092B (ackA-pta pflB adhE frdA ldhA lysC panC aspA ptsG)经厌氧摇瓶发酵,使β-丙氨酸产量达到0.9 mg/L。
3 前景与展望
β-丙氨酸在各个领域均被广泛应用,具有广阔的市场前景。在国内,各大厂商合成β-丙氨酸的方法主要为化学合成法,但其污染严重且成本较高,不符合绿色、可持续发展的要求。近年来,随着微生物发酵工程的不断发展,研究者逐渐将目光放在使用基因工程菌生产的β-丙氨酸的研究上,但是目前的研究进展还不能达到工业化生产的水平。基因工程菌中β-丙氨酸合成途径的相关调控多数已被解析。但是在前体物质合成和辅因子NADPH和ATP的提供等方面需进一步探究。
随着基因编辑等分子生物学技术的发展,以及系统生物学,合成生物学的多种平台的利用,将不同生物中的优势途径进行改造和组合是β-丙氨酸产量提高的一个关键。对于β-丙氨酸的优势途径主要有:前体物质的增加、辅因子的平衡和副产物的减少,单独采取优势途径或是对优势途径进行整合改造均可提高β-丙氨酸的产量。ZOU等[13]采用前体物质和副产物的综合策略,通过分批补料发酵获得了43.12 g/L的β-丙氨酸。PIAO等[41]采取3个优势途径均进行优化改造的方式,过表达ppc、glk、aspC和panD基因,敲除posB、ldhA、pflB和aspA等副产物生成基因,将前体物质的碳通量最大限度的转移到β-丙氨酸代谢途径,同时过表达BT和CA增强CO2/碳酸氢盐同化,增加辅因子自给自足系统,构建菌株将β-丙氨酸质量浓度提高到37.7 g/L。其中,PanD作为关键酶,已做了广泛的研究。PanD需要自剪切才能完成激活,其中V23,I26,T27和E56这4个位点的残基对于PanD的自切割过程尤其重要[33],且来自枯草芽孢杆菌(PanDBs)的酶具有更高的比活度和热稳定性[34],经过后续研究,已获得各种突变体提高其酶活力和稳定性,为后续研究打下了基础。
目前,微生物发酵法生产β-丙氨酸的产量仍然处于较低水平,在后续的相关研究中,可以采取以下策略增加β-丙氨酸产量:(1)调节3个辅因子NADH、ATP以及CO2的相互平衡,使更多的碳通量流向β-丙氨酸生物合成,从而增加β-丙氨酸的产量。(2)持续增加前体物质的合成和副产物途径的阻断。(3)采取并优化两阶段发酵方法,有氧生长和厌氧生长协同作用,提高β-丙氨酸产量。(4)自动化算法。通过以上几个方面的改良有希望将微生物工程改造到更高效的平台以生产β-丙氨酸。
[1] 马军. 补喂β-丙氨酸对伊犁马血浆氨基酸和肌肽含量及运动水平的影响[D].乌鲁木齐:新疆农业大学, 2016.
MA J.The effects of β-alanine supplementation on content of amino acids and carnosinein plasma, and sport performance of YiLi horse[D].Urumqi:Xinjiang Agricultural University, 2016.
[2] 王春月, 潘晨, 廖智, 等.β-丙氨酸补充对厚壳贻贝代谢组的影响[J].水产学报, 2021, 45(1):55-67.
WANG C Y, PAN C, LIAO Z, et al. Effects of β-alanine supplementation on the metabolomics of Mytilus coruscus[J]. Journal of Fisheries of China, 2021, 45(1):55-67.
[3] 苏丽, 王娟, 陈小立, 等. 巴柳氮的合成改进[J]. 化学工业与工程, 2005, 22(4): 313-315.
SU L, WANG J, CHEN X L, et al. Improvement on synthesis of balsalazide[J]. Chemical Industry and Engineering, 2005, 22(4): 313-315.
[4] DALWADI M P, KING J R, MINTON N P.Multi-timescale analysis of a metabolic network in synthetic biology:A kinetic model for 3-hydroxypropionic acid production via β-alanine[J].Journal of Mathematical Biology, 2018, 77(1):165-199.
[5] LACMATA S T, KUIATE J R, DING Y M, et al.Enhanced poly(3-hydroxypropionate) production via β-alanine pathway in recombinant Escherichia coli[J].PLoS One, 2017, 12(3):e0173150.
[6] ZHANG B, ZHANG X M, WANG W, et al.Metabolic engineering of Escherichia coli for D-pantothenic acid production[J].Food Chemistry, 2019, 294(322):267-275.
[7] 罗积杏, 薛建萍, 沈寅初. β-氨基丙酸的合成与应用[J]. 氨基酸和生物资源, 2005, 27(1):52-55.
LUO J X, XUE J P, SHEN Y C. Synthesis and application of β-alanine[J]. Amino Acids & Biotic Resources, 2005, 27(1):52-55.
[8] ARTIOLI G G, GUALANO B, SMITH A, et al.Role of β-alanine supplementation on muscle carnosine and exercise performance[J].Medicine and Science in Sports and Exercise, 2010, 42(6):1 162-1 173.
[9] BLANCQUAERT L, EVERAERT I, DERAVE W.β-alanine supplementation, muscle carnosine and exercise performance[J].Current Opinion in Clinical Nutrition and Metabolic Care, 2015, 18(1):63-70.
[10] SONG C W, LEE J,KO Y S, et al.Metabolic engineering of Escherichia coli for the production of 3-aminopropionic acid[J].Metabolic Engineering, 2015, 30(3):121-129.
[11] 张腾辉. L-天冬氨酸-α-脱羧酶的表达、改造及全细胞制备β-丙氨酸[D].无锡:江南大学, 2018.
ZHANG T H.Expression and modification of L-aspartate-α-decarboxylase for the whole-cell transformation of β-alanine[D].Wuxi:Jiangnan University, 2018.
[12] STEUNENBERG P, KÖNST P M, SCOTT E L, et al.Polymerisation of β-alanine through catalytic ester-amide exchange[J].European Polymer Journal, 2013, 49(7):1 773-1 781.
[13] ZOU X Y, GUO L X, HUANG L L, et al.Pathway construction and metabolic engineering for fermentative production of β-alanine in Escherichia coli[J].Applied Microbiology and Biotechnology, 2020, 104(6):2 545-2 559.
[14] 裘娟萍, 沈寅初, 姚燕来, 等.β-丙氨酸的生物合成方法:中国, CN1285730C[P].2006-11-22.
QUE J P, SHEN Y C, YAO Y L, et al.Biosynthesis method of β-alanine:China, CN1285730C[P].2006-11-22.
[15] 马铭泽, 马云峰.β-丙氨酸的生产方法:中国, CN108383742A[P].2018-08-10.
MA M Z, MA Y F.Production method of β-alanine:China, CN108383742A[P].2018-08-10.
[16] 刘志成, 刘洋, 李瑞峰, 等.一种利用固定化酶制备β-丙氨酸的方法:中国, CN112195171[P].2019-07-08.
LIU Z H, LIU Y, LI R F, et al.A method of preparing β-alanine using immobilized enzymes:China, CN112195171[P].2019-07-08.
[17] 李海, 王夏燕, 沈泽璇, 等.一种β-丙氨酸的制备方法:中国, CN110343052A[P].2019-08-13.
LI H, WANG X Y, SHEN Z X, et al.A method for the preparation of β-alanine:China, CN110343052A[P].2019-08-13.
[18] 曾伟, 滕坤, 杜大鹏, 等.一种β-丙氨酸的连续化生产工艺:中国, CN111333525A[P].2020-04-15.
ZENG W, TENG K, DU D P, et al.A continuous production process of β-alanine:China, CN111333525A[P].2020-04-15.
[19] 梁璐怡, 金少军, 徐建妙, 等. 一株能转化β-氨基丙腈生产β-氨基丙酸的菌株G20的分离与鉴定[J]. 食品与发酵工业, 2008, 34(4):11-15, 20.
LIANG L Y, JIN S J, XU J M, et al. Isolation and identification of a bacterial strain G20 capable of β-aminopropionitrile bioconversion into β-alanine[J]. Food and Fermentation Industries, 2008, 34(4):11-15, 20.
[20] 姚培圆, 吴洽庆, 袁京, 等.酶催化高浓度β-氨基丙腈水解制备β-丙氨酸的方法:中国, CN104195193A[P].2014-09-10.
YAO P Y, WU Q Q, YUAN J, et al.Method for preparing β-alanine by enzymatically catalyzing high-concentration β-aminopropionitrile hydrolysis:China, CN104195193A.2014-09-10.
[21] SHEN Y, ZHAO L Z, LI Y R, et al.Synthesis of β-alanine from L-aspartate using L-aspartate-α-decarboxylase from Corynebacterium glutamicum[J].Biotechnology Letters, 2014, 36(8):1 681-1 686.
[22] ZHANG T H, ZHANG R Z, XU M J, et al.Glu56Ser mutation improves the enzymatic activity and catalytic stability of Bacillus subtilis L-aspartate-α-decarboxylase for an efficient β-alanine production[J].Process Biochemistry, 2018, 70:117-123.
[23] 伊星昊, 张德峰, 付玉荣.结核分枝杆菌panD蛋白功能预测及生物信息学分析[J].中国病原生物学杂志, 2017, 12(6):500-504.
YI X H, ZHANG D F, FU Y R.Bioinformatic analysis and prediction of the structure and function of the panD protein from Mycobacterium tuberculosis[J].Journal of Pathogen Biology, 2017, 12(6):500-504.
[24] ROCK C O, CRONAN J E Jr.Improved purification of acyl carrier protein[J].Analytical Biochemistry, 1980, 102(2):362-364.
[25] KÖNST P M, FRANSSEN M C, SCOTT E L, et al.A study on the applicability of L-aspartate-α-decarboxylase in the biobased production of nitrogen containing chemicals[J].Green Chemistry, 2019, 11(10):1 646.
[26] 张潇潇. 钝齿棒杆菌L-天冬氨酸-α-脱羧酶基因的克隆与表达[D].杭州:浙江工业大学, 2008.
ZHANG X X.Cloning and expression of L-aspartate-α-decarboxylase gene in Corynebacterium Crenatum[D].Hangzhou:Zhejiang University of Technology, 2008.
[27] 陈夏林. L-天冬氨酸-α-脱羧酶基因的功能鉴定及酶学性质研究[D].无锡:江南大学, 2017.
CHEN X L.Identification of L-aspertate-α-decarboxylase encoding genes and analysis of enzyme function[D].Wuxi:Jiangnan University, 2017.
[28] 范雪萍, 冯志彬, 房美芳, 等.特基拉芽孢杆菌L-天冬氨酸-α-脱羧酶的异源表达及高密度发酵[J].食品科学, 2018, 39(2):144-150.
FAN X P, FENG Z B, FANG M F,et al.Heterologous expression of the Bacillus tequilensis L-aspartate-α-decarboxylase in Escherichia coli and its high cell density fermentation[J].Food Science, 2018, 39(2):144-150.
[29] WANG L, PIAO X Y, CUI S M, et al.Enhanced production of β-alanine through co-expressing two different subtypes of L-aspartate-α-decarboxylase[J].Journal of Industrial Microbiology and Biotechnology, 2020, 47(6):465-474.
[30] YU X J, HUANG C Y, XU X D, et al.Protein engineering of a pyridoxaL-5′-phosphate-dependent L-aspartate-α-decarboxylase from Tribolium castaneum for β-alanine production[J].Molecules, 2020, 25(6):1 280.
[31] 莫芹, 李由然, 石贵阳.细菌L-天冬氨酸-α-脱羧酶的分子机制及分子改造研究进展[J].微生物学通报, 2018, 45(7):1 546-1 554.
MO Q, LI Y R, SHI G Y.Advances in molecular mechanism and modification of bacterial L-aspartate-α-decarboxylase[J].Microbiology China, 2018, 45(7):1 546-1 554.
[32] KWON A R, LEE B I, HAN B W, et al. Crystallization and preliminary X-ray crystallographic analysis of aspartate L-decarboxylase from Helicobacter pylori[J]. Acta Crystallographica. Section D, Biological Crystallography, 2002, 58(Pt 5):861-863.
[33] MO Q,LI Y R, WANG J H, et al.Identification of mutations restricting autocatalytic activation of bacterial L-aspartate-α-decarboxylase[J].Amino Acids, 2018, 50(10):1 433-1 440.
[34] PEI W L, ZHANG J L, DENG S Y, et al.Molecular engineering of L-aspartate-α-decarboxylase for improved activity and catalytic stability[J].Applied Microbiology and Biotechnology, 2017, 101(15):6 015-6 021.
[35] MO Q, MAO A, LI Y R, et al.Substrate inactivation of bacterial L-aspartate-α-decarboxylase from Corynebacterium jeikeium K411 and improvement of molecular stability by saturation mutagenesis[J].World Journal of Microbiology and Biotechnology, 2019, 35(4):62-68.
[36] 陈虹. L-天冬氨酸-α-脱羧酶的蛋白质工程改造及其在β-丙氨酸生产中的应用[D].杭州:浙江工业大学, 2019.
CHEN H.Protein engineering of a L-aspartate-α-decarboxylase and its application in the β-alanine production[D].Hangzhou:Zhejiang University of Technology, 2019.
[37] ZIERT C Z.Metabolic engineering of Corynebacterium glutamicum for the production of L-aspartate and its derivatives β-alanine and derivatives[J].Bioresource Technology, 2014, 32(5):79-83.DOI:http://pub.uni-bielefeld.de/publication/2691217.
[38] 孟娇. 大肠杆菌高得率合成琥珀酸的系统代谢工程研究[D].天津:天津大学, 2016.
MENG J.The research of high-yield succinate production by systematically regulating multiple metabolic pathways in Escherichia coli[D].Tianjin:Tianjin University, 2016.
[39] 梁姗姗. 代谢工程改造大肠杆菌合成β-丙氨酸[D].无锡:江南大学, 2017.
LIANG S S.Metabolic engineering of Escherichia coli for the production of β-alanine[D].Wuxi:Jiangnan University, 2017.
[40] ZHOU L, DENG C, CUI W J, et al.Efficient L-alanine production by a thermo-regulated switch in Escherichia coli[J].Applied Biochemistry & Biotechnology, 2016, 178(2):234-337.
[41] PIAO X Y,WANG L,LIN B X, et al.Metabolic engineering of Escherichia coli for production of L-aspartate and its derivative β-alanine with high stoichiometric yield[J].Metabolic Engineering, 2019, 54(4):244-254.
[42] KO Y S,KIM J W,CHAE T U, et al.A novel biosynthetic pathway for the production of acrylic acid through β-alanine route in Escherichia coli[J].ACS Synthetic Biology, 2020, 9(5):1 150-1 159.
[43] 饶德明. 谷氨酸棒杆菌碳四途径合成5-氨基乙酰丙酸研究[D].天津:天津科技大学, 2016.
RAO D M.Study on Corynebacterium glutamicum producing 5-aminolevulinic acid via C4 pathway[D].Tianjin:Tianjin University of Science and Technology, 2016.
[44] QIAN Y Y, LIU J, SONG W, et al.Production of β-Alanine from fumaric acid using a dual-enzyme cascade[J].ChemCatChem, 2018, 10(21):4 984-4 991.
[45] XU J Z, YANG H K, ZHANG W G.NADPH metabolism:A survey of its theoretical characteristics and manipulation strategies in amino acid biosynthesis[J].Critical Reviews In Biotechnology, 2018, 38(7):1 061-1 076.