发酵乳是以生牛(羊)乳或乳粉为原料,经杀菌、发酵后制成的pH值降低的产品。与传统发酵不同,发酵乳通过添加嗜热链球菌、德氏乳杆菌保加利亚亚种等乳酸菌作为发酵剂加快发酵乳的发酵过程[1]。乳酸菌对人体的健康有很多益处,有助于增加肠道微生物的定植,治疗和预防腹泻、缓解便秘、增强人体的的免疫力等[2-3],但是乳酸菌需要达到一定数量才能起到保健作用,因此发酵乳中的活菌数尤其重要。为保证足够数量活的益生菌到达肠道中,GB 19302、ISO 27205等国内外相关机构规定,发酵乳中益生菌的数量不得少于106CFU/mL[4]。近年来发酵乳产业快速发展,为提升发酵乳的品质,乳杆菌、双歧杆菌等益生菌加入发酵乳中以增加产品的芳香味道和保健功能等[1],因此需要简单、可靠的方法来确保商业发酵乳中发酵剂微生物和功能性微生物的含量,以保证产品的质量。
目前对于发酵乳中乳酸菌活菌数的检测主要包括分子生物学定量分析方法、丙二醇甲醚醋酸酯/叠氮溴化乙锭结合实时定量等非培养方法,以及传统可培养方法。非培养方法是以乳酸菌的基因组核酸序列或细胞中的活菌数为基础的鉴别方法,往往对仪器设备具有较高的要求[5]。传统培养方法是基于乳酸菌的理化特性,实现对乳酸菌的选择性分离,操作简便、设备依赖度低,适于广泛推广应用[3-6]。但是目前传统培养方法,往往存在培养基选择性差、计数结果不准确等问题。因此根据不同乳酸菌的特性优化选择性培养基,结合菌种鉴定技术,实现发酵乳中乳酸菌的种水平活菌计数具有重要意义。
本文主要聚焦市售发酵乳中常用的乳酸菌组合,通过验证和比较国内外标准、文献中选择性培养基的选择性,并采用快速鉴定、形态学特征、生理生化和分子生物学特征等方法确定复合菌发酵乳中的不同种类乳酸菌的活菌数,为复合菌发酵乳产品的质量控制提供技术参考。同时为政府监管、行业标准法规制定提供技术支撑,对乳酸菌在乳品行业更加安全和广泛的应用具有重要意义。
1 材料与方法
1.1 发酵乳产品
3种代表性的不同品牌发酵乳产品A、B、C购于北京大型超市,产品中标识菌株类别及活菌数如下:
样品1:品牌A(标识:保加利亚乳杆菌,嗜热链球菌,干酪乳杆菌,乳酸菌活菌数≥1×106CFU/g);
样品2:品牌B (标识:动物双歧杆菌BB-12,嗜热链球菌,德氏乳杆菌保加利亚亚种,保加利亚乳杆菌和嗜热链球菌总数1×106CFU/g);
样品3:品牌C(标识:乳双歧杆菌BL99,嗜热链球菌,保加利亚乳杆菌,乳双歧杆菌的≥1×106CFU/g)。
1.2 试剂与仪器
M17培养基,青岛海博生物技术股份有限公司;Chalmers(MC)培养基、De Man Rogosa Sharpe(MRS)培养基(BD)、莫匹罗星锂盐和半胱氨酸盐酸盐,北京陆桥技术股份有限公司;万古霉素盐酸盐,国药集团。
拍击式均质器,法国 interscience 公司;pH计,梅特勒托利多仪器有限公司;厌氧产气袋,日本三菱 MGC。
1.3 实验方法
1.3.1 选择性培养基活菌计数
无菌操作称取25 g样品,置于225 mL生理盐水中,充分振荡混匀,制成1∶10(g∶mL)样品匀液。用微量移液器吸取1∶10样品匀液1 mL,沿管壁缓慢注于装有9 mL生理盐水的无菌试管,振摇试管使其混合均匀,制成1∶100的样品匀液。按上述操作顺序,依次重复。选择2~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿内,将冷却至48 ℃的培养基倾注入平皿内。
参照GB 4789.35—2016对3种样品中的乳酸菌进行计数,每种样品分别采用MC培养基、改良MRS培养基和MRS培养基进行计数。同时,根据样品标识中的菌种类别选用适宜的培养基进行菌种的选择性分离培养和计数,选择性培养基和培养条件如表1所示。
表1 选择性培养基及培养条件
Table 1 Selective medium and culture conditions
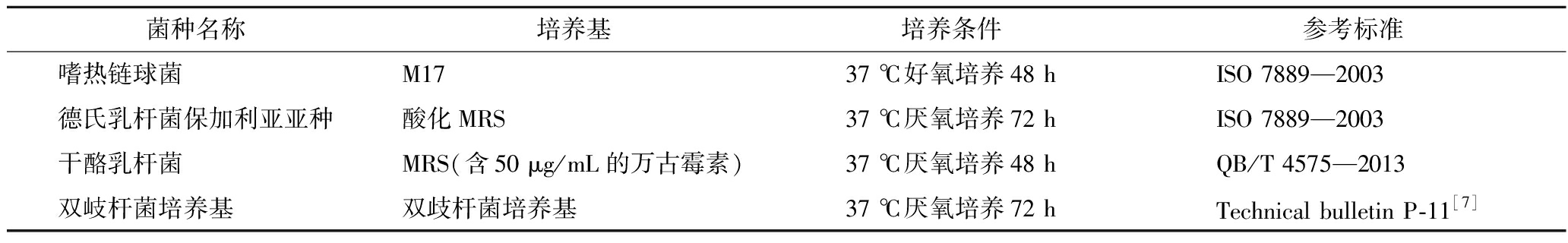
菌种名称培养基培养条件参考标准嗜热链球菌M1737 ℃好氧培养48 hISO 7889—2003德氏乳杆菌保加利亚亚种酸化MRS37 ℃厌氧培养72 hISO 7889—2003干酪乳杆菌MRS(含50 μg/mL的万古霉素)37 ℃厌氧培养48 hQB/T 4575—2013双岐杆菌培养基双歧杆菌培养基37 ℃厌氧培养72 hTechnical bulletin P-11[7]
注:酸化MRS是指将MRS培养基通过乙酸调节至pH 5.4;MRS(含50 μg/mL的万古霉素)是指在200 mL的MRS培养基中加入1 mL质量分数为1%的万古霉素,使万古霉素的终质量浓度为50 μg/mL;双歧杆菌培养基是指含25 μg/mL莫匹罗星锂盐和500 μg/mL半胱氨酸盐酸盐的MRS培养基
1.3.2 菌株分离鉴定
从选择性培养基上随机选取5个单菌落,通过平板划线法进行分离纯化,获得纯菌株。
1.3.2.1 基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)快速鉴定
选取新鲜培养的分离株到装有300 μL超纯水的离心管中,形成菌悬液;加入无水乙醇,涡旋离心取沉淀;加入50 μL 70%(体积分数)的甲酸水溶液,涡旋混合均匀;加入50 μL乙腈,通过移液器反复吹打使其混合均匀;离心取上清液加入到靶板孔中,室温下晾干;滴加 α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,HCCA)基质溶液室温下晾干,形成结晶;将点好样品的靶板放入仪器内,微生物鉴定标配方法MBT_FC,上机测试,并采集质谱数据。
1.3.2.2 多相鉴定
利用细菌基因组DNA提取试剂盒(OMEGA公司)提取分离株的基因组DNA。以基因组DNA为模板,利用通用引物27F和1492R对菌株的16S rRNA基因进行PCR扩增。反应体系按照PCR Mixture使用说明进行配制(Tiangen公司)。反应程序为:94 ℃预变性2 min,94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min 30 s,30个循环后72 ℃延伸10 min。利用特异性引物对groEL基因和groEL基因序列进行扩增[8],PCR反应体系同上。扩增产物测序后,将序列结果递交到EzBioCloud和NCBI数据库进行比对分析[9]。采用MEGA 4软件中的Clustal功能对分离株与近缘种菌株的16S rRNA基因、pheS基因或groEL基因进行多序列比对,并使用邻接法进行系统发育及分子进化分析[10]。
将分离得到9个分离株接种到适宜培养基上,培养一定时间后,收集新鲜菌体,加入2.5% 戊二醛4 ℃固定过夜。离心收集菌体,100 mmol/L磷酸盐缓冲液(pH 7.2)漂洗3次。30%、50%、70%、85%、95%乙醇梯度脱水后100%乙醇脱水3次。干燥后用喷金—离子溅射仪BAL-TEC SCD005进行喷金,使用扫描电镜Hitachi SU8010进行菌体形态观察[11]。使用VITEK 2 Compact鉴定系统对分离株的底物利用特征进行测定。
2 结果与分析
2.1 选择性培养基和GB 4789.35的活菌计数
根据发酵乳上的标识,依据表1中选择性培养基和GB 4789.35对3种品牌的发酵乳进行选择性计数,结果如表2所示。GB 4789.35对3个样品的乳酸菌总数的计数结果均高于选择性培养基。其中选择性培养基M17对嗜热链球菌的计数结果均高于GB 4789.35中的MC培养基。
在样品1中,选择性培养基MRS(含50 μg/mL的万古霉素)和酸化MRS的计数结果之和为样品中的乳杆菌总数,GB 4789.35中MRS培养基的计数结果为乳杆菌总数。MRS培养基的计数结果远高于选择性培养基。在样品2和样品3中,GB 4789.35的MRS培养基主要用于乳杆菌和双歧杆菌总数的计数。本文采用的选择性培养基酸化MRS和双歧杆菌培养基同样用于上述两种菌种的计数,MRS培养基的计数结果均高于选择性培养基。
表2 选择性培养基和GB 4789.35—2016的活菌计数及快速鉴定结果
Table 2 The viable counting and rapid identification result of selective medium and GB 4789.35—2016
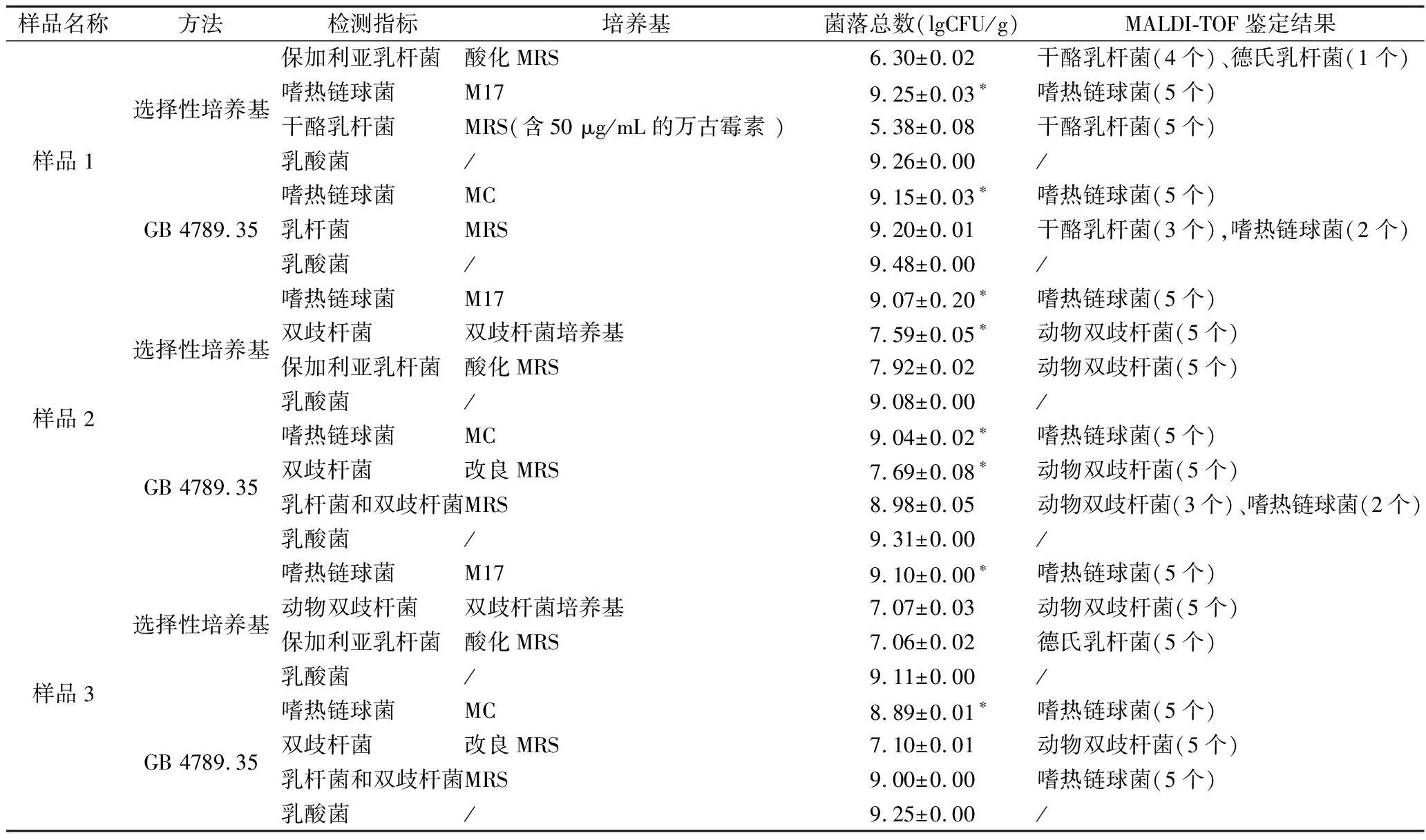
样品名称方法检测指标培养基菌落总数(lgCFU/g)MALDI-TOF鉴定结果保加利亚乳杆菌酸化MRS6.30±0.02干酪乳杆菌(4个)、德氏乳杆菌(1个)选择性培养基嗜热链球菌M179.25±0.03∗嗜热链球菌(5个)干酪乳杆菌MRS(含50 μg/mL的万古霉素 )5.38±0.08干酪乳杆菌(5个)样品1乳酸菌/9.26±0.00/嗜热链球菌MC9.15±0.03∗嗜热链球菌(5个)GB 4789.35乳杆菌MRS9.20±0.01干酪乳杆菌(3个),嗜热链球菌(2个)乳酸菌/9.48±0.00/嗜热链球菌M179.07±0.20∗嗜热链球菌(5个)选择性培养基双歧杆菌双歧杆菌培养基7.59±0.05∗动物双歧杆菌(5个)保加利亚乳杆菌酸化MRS7.92±0.02动物双歧杆菌(5个)样品2乳酸菌/9.08±0.00/嗜热链球菌MC9.04±0.02∗嗜热链球菌(5个)GB 4789.35双歧杆菌改良MRS7.69±0.08∗动物双歧杆菌(5个)乳杆菌和双歧杆菌MRS8.98±0.05动物双歧杆菌(3个)、嗜热链球菌(2个)乳酸菌/9.31±0.00/嗜热链球菌M179.10±0.00∗嗜热链球菌(5个)选择性培养基动物双歧杆菌双歧杆菌培养基7.07±0.03动物双歧杆菌(5个)保加利亚乳杆菌酸化MRS7.06±0.02德氏乳杆菌(5个)样品3乳酸菌/9.11±0.00/嗜热链球菌MC8.89±0.01∗嗜热链球菌(5个)GB 4789.35双歧杆菌改良MRS7.10±0.01动物双歧杆菌(5个)乳杆菌和双歧杆菌MRS9.00±0.00嗜热链球菌(5个)乳酸菌/9.25±0.00/
注:*表示两种方法的计数结果有显著性差异,/表示未检测该项目
2.2 菌株分离鉴定
2.2.1 MALDI-TOF快速鉴定
从每种计数平板上随机挑选5个菌落,进行分离纯化后,通过MALDI-TOF快速鉴定,确定培养基对目标菌种的选择性,结果如表2所示。
在样品1中,M17和MRS(含50 μg/mL的万古霉素)对样品中嗜热链球菌和干酪乳杆菌具有很好的选择性,随机挑选的5个菌落经MALDI-TOF鉴定,结果均为嗜热链球菌和干酪乳杆菌。表明在发酵乳中含有干酪乳杆菌的情况下,酸化MRS培养基上对德氏乳杆菌的选择性较差。
样品2和样品3中M17和双歧杆菌培养基对嗜热链球菌和动物双歧杆菌的选择性良好。在两种培养基上随机挑选的5个菌落经MALDI-TOF鉴定,结果均为目标菌种。但是酸化MRS培养基对德氏乳杆菌的选择性在两种样品中具有一定的差异。样品2的酸化MRS培养基上随机挑选的5个菌落,经鉴定均为动物双歧杆菌,样品3随机挑选的菌落鉴定结果均为德氏乳杆菌。这种差异性可能与菌种的数量有关。
GB 4789.35中的培养基经过MALDI-TOF快速鉴定,结果显示MC培养基和改良MRS培养基对嗜热链球菌和双歧杆菌具有良好的选择性。但在3个样品中,MRS培养基均有嗜热链球菌的生长。因此,GB 4789.35方法对乳杆菌和双歧杆菌计数的结果均高于选择性培养基,使得GB 4789.35检测的乳酸菌总数较实际结果偏高。
2.2.2 复合菌发酵乳中分离株的多相鉴定
选取9个分离株进行多相鉴定,发酵乳中分离株的鉴定结果均与发酵乳的标识一致(表3)。动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis)曾用名为乳双歧杆菌(Bifidobacterium lactis)[12];德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)的曾用名为保加利亚乳杆菌(Lactobacillus bulgaricus)[13]。干酪乳杆菌(Lactobacillu casei)在2020年其分类学地位变更为干酪乳酪杆菌Lacticaseibacillus casei [14]。德氏乳杆菌保加利亚亚种(L.delbrueckii subsp.bulgaricus)通过多相鉴定只能鉴定到种水平,需进一步通过全基因组测序及平均核苷酸一致性等方法鉴定到亚种水平。
表3 发酵乳分离株鉴定结果
Table 3 The identification results of isolates from the fermented milk

分离株分离培养基鉴定结果来源M-1M17嗜热链球菌(Streptoccus thermophilus)品牌A发酵乳V-2MRS(含50 μg/mL的万古霉素 )干酪乳酪杆菌(L. casei)A-1酸化MRS德氏乳杆菌(L. delbrueckii)M-2M17嗜热链球菌(S. thermophilus)品牌B发酵乳B-1双歧杆菌培养基动物双歧杆菌乳亚种(B. animalis subsp. lactis)A-2酸化MRS德氏乳杆菌(L. delbrueckii)M-3M17嗜热链球菌(S. thermophilus)品牌C发酵乳B-2双歧杆菌培养基动物双歧杆菌乳亚种(B. animalis subsp. lactis)A-3酸化MRS德氏乳杆菌(L. delbrueckii)
2.2.2.1 形态学特征观察
对9个分离株进行扫描电镜观察,其扫描电镜的形态特征如图1所示。M17培养基上获得的分离株的菌体形态特征为椭球形,单个、成对或呈链状排列,符合嗜热链球菌的典型形态特征;MRS(含50 μg/mL的万古霉素)培养基上的分离株的菌体形态特征为短杆状,单个或成对排列;双歧杆菌培养基分离株的菌体形态特征为不规则杆状,两端稍膨大;酸化MRS培养基分离株的菌体形态特征包括两种,在样品2和样品3中呈长杆状,在样品1中呈弯曲杆状,单个或成对排列。
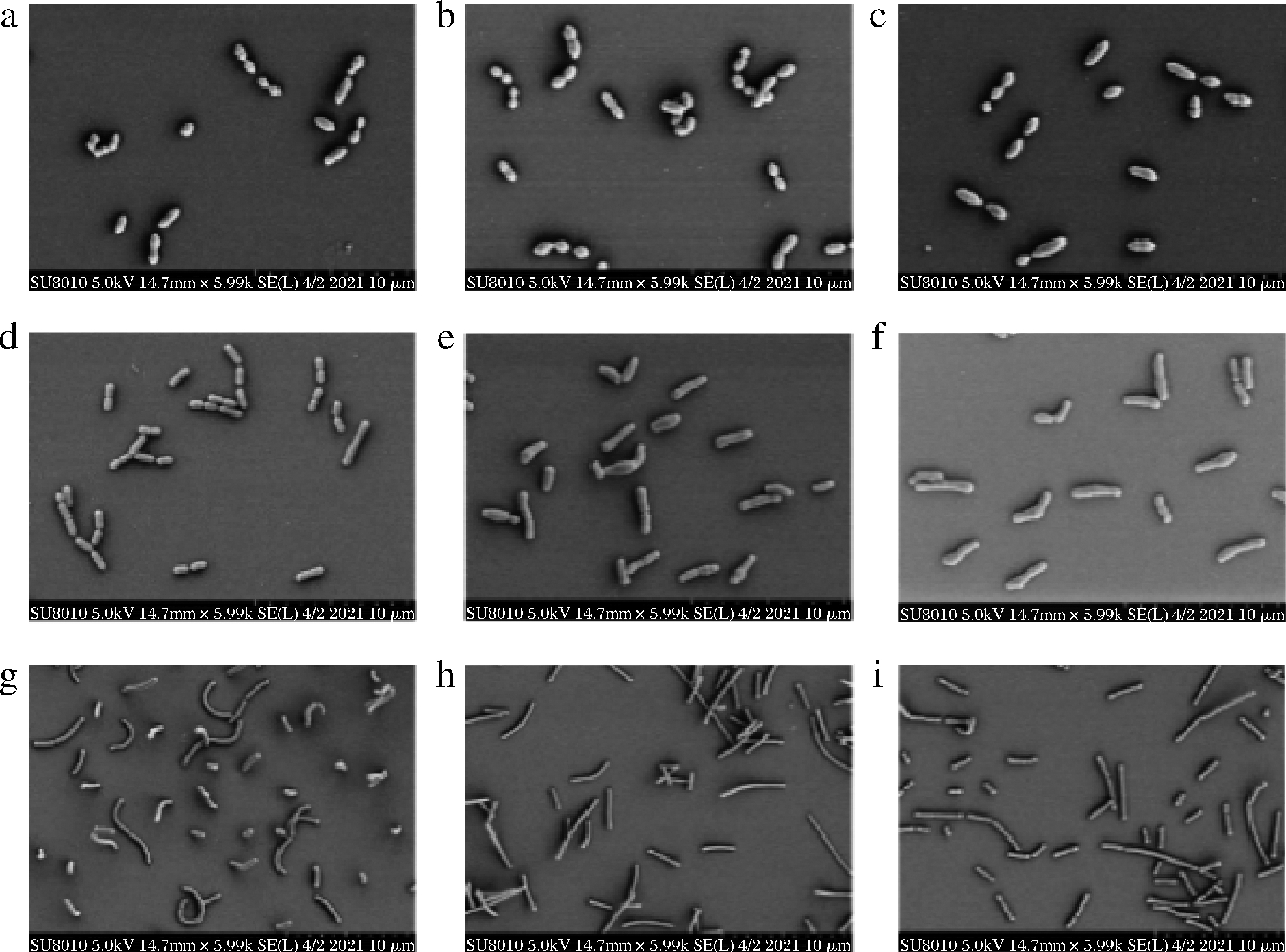
a-M-1;b-M-2;c-M-3;d-V-1;e-B-1;f-B-2;g-A-1;h-A-2;i-A-3
图1 分离株的扫描电镜图
Fig.1 The scanning electron microscope of the isolated strains
2.2.2.2 生理生化特性
通过VITEK2 compact对9个分离株进行生理生化检测,检测结果如表4所示。
表4 分离株的生理生化特征
Table 4 Physiological and biochemical characteristic of isolated strains
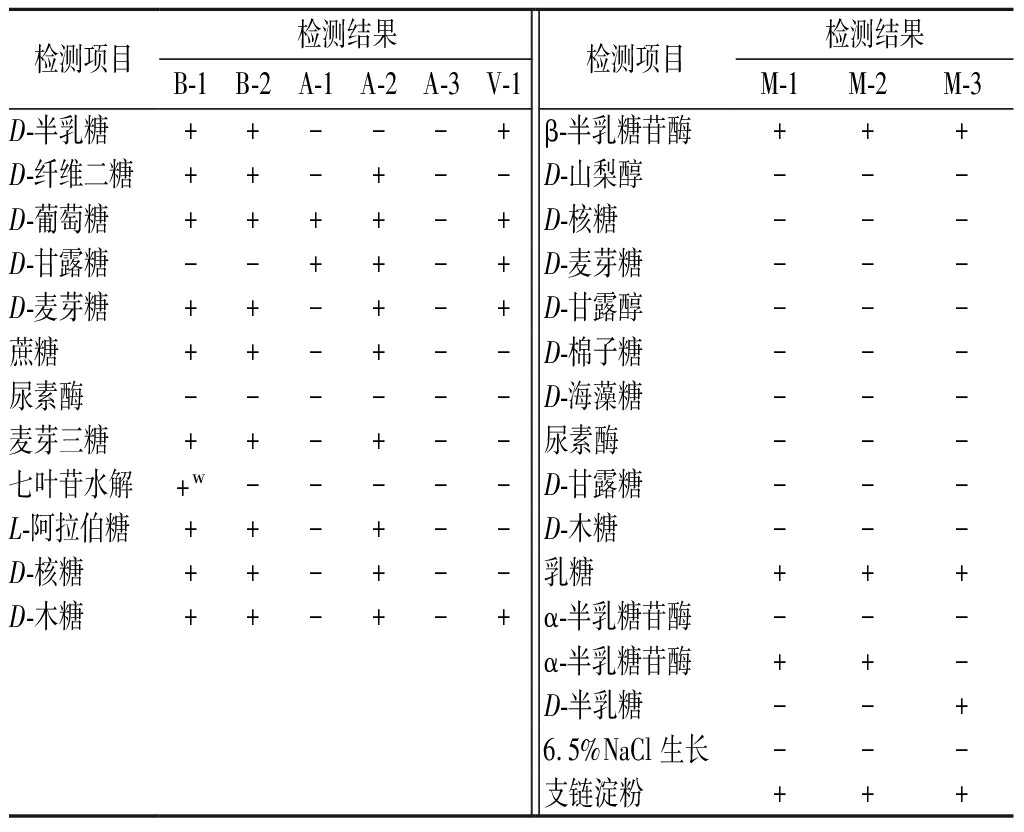
检测项目检测结果B-1B-2A-1A-2A-3V-1检测项目检测结果M-1M-2M-3D-半乳糖++---+β-半乳糖苷酶+++D-纤维二糖++-+--D-山梨醇---D-葡萄糖++++-+D-核糖---D-甘露糖--++-+D-麦芽糖---D-麦芽糖++-+-+D-甘露醇---蔗糖++-+--D-棉子糖---尿素酶------D-海藻糖---麦芽三糖++-+--尿素酶---七叶苷水解+w-----D-甘露糖---L-阿拉伯糖++-+--D-木糖---D-核糖++-+--乳糖+++D-木糖++-+-+α-半乳糖苷酶---α-半乳糖苷酶++-D-半乳糖--+6.5%NaCl 生长---支链淀粉+++
注:“+”阴性;“+w”弱阳性;“-”阴性
2.2.2.3 16S rRNA基因及功能基因序列鉴定
对9株分离株进行分子水平鉴定,扩增16S rDNA和相关持家基因的序列,并进行序列比对并构建系统发育树,如图2所示。分离株B-1和B-2,通过16S rDNA 和groEL基因序列的比对,和B.animalis subsp.lactis的相似性高达100%;分离株A-1、A-2、A-3,通过16S rDNA序列比对,和L.delbrueckii subsp.bulgaricus、Lactobacillus delbrueckii subsp.sunkii的序列相似性均高于99%;分离株M-1、M-2、M-3,通过16S rDNA 和pheS基因进行序列比对,和S.thermophilus的同源性为99.4%;分离株V-1,通过16S rDNA和pheS基因序列比对,和L.casei的序列相似性为100%。
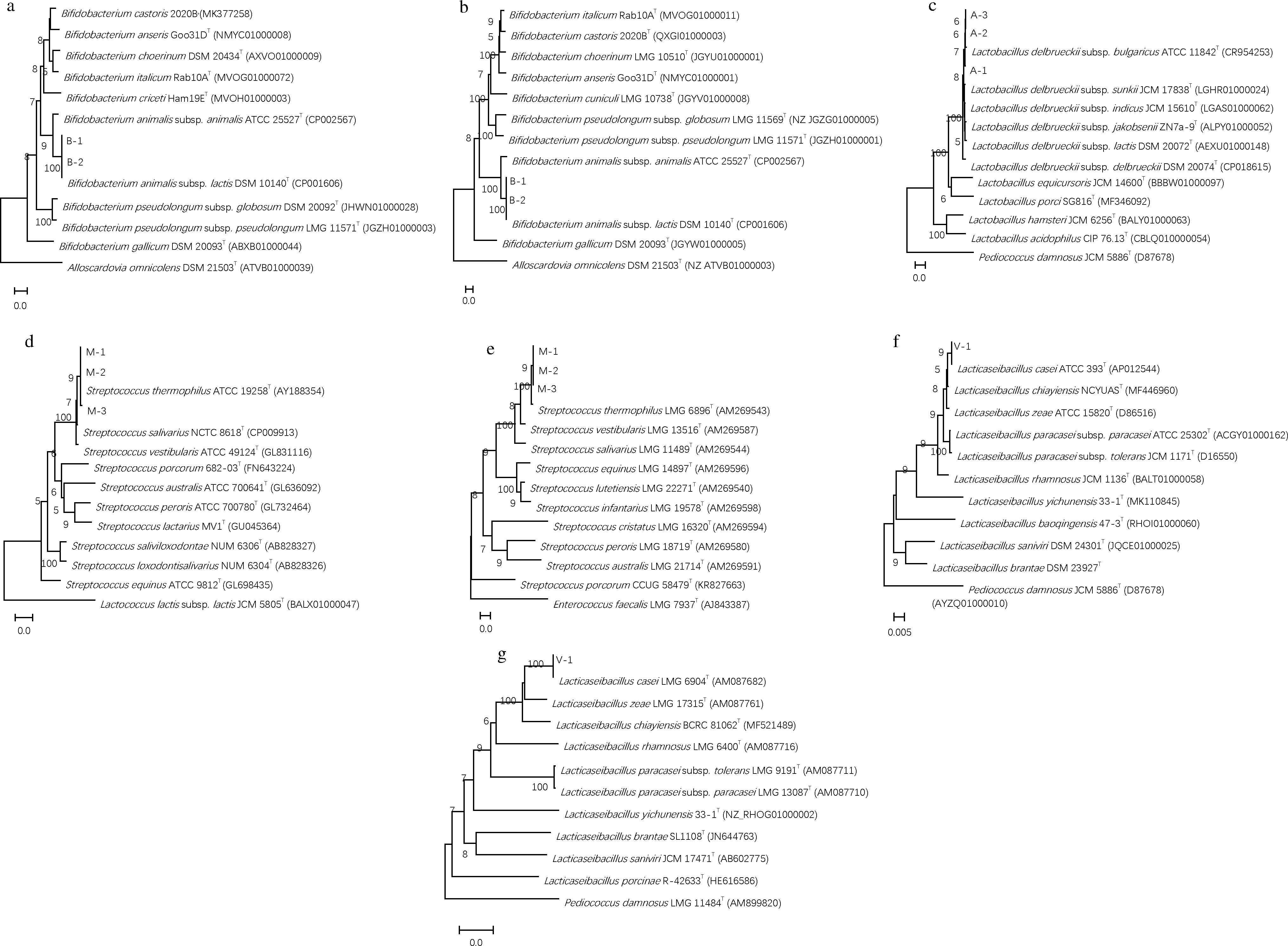
a、b-双歧杆菌培养基分离株的16S rRNA基因和groEL基因;c-酸化MRS培养基分离株的16S rRNA基因;d、e-M17培养基分离株的16S rRNA 基因和PheS基因;f、g-MRS培养基(含50 μg/mL的万古霉素)分离株16S rRNA基因和PheS基因
图2 分离株与相关种的系统发育树
Fig.2 The phylogenetic trees of isolated strain and other related species 注:采用MEGA5.0软件,邻位连接法显示菌株与相关模式种系统发育树,进行1 000次的相似度重复计算,图中发育树节点只显示Bootstrap值 >50%数值,“T”表示模式菌株
2.3 选择性培养基对目标菌种的选择性
本研究中,嗜热链球菌的选择性计数培养基M17和MC对嗜热链球菌都具有良好的选择性。但计数结果显示,3个样品中M17培养基的计数结果均高于MC培养基。M17培养基的营养丰富,有利于发酵乳中嗜热链球菌的复苏,其中高浓度的甘油磷酸钠不仅具有良好的缓冲作用,还能抑制发酵乳中其他乳酸菌如保加利亚乳杆菌的生长[15-16],MC培养基以碳酸钙作为缓冲剂,缓冲能力较弱,粉末容易沉淀或结块,会影响菌落生长[17]。国际标准和相关文献多数推荐采用M17培养基对嗜热链球菌计数[18]。
含有万古霉素的MRS培养基对干酪乳杆菌具有良好的选择性。干酪乳杆菌的选择性计数主要根据其理化特性设计选择性培养基,如刘爱萍等[6]研究表明以D-核糖为唯一碳源的培养基对干酪乳杆菌具有良好的选择性。本文依据干酪乳杆菌的万古霉素固有耐药实现对干酪乳杆菌选择性的计数。该选择性培养基的应用前提为发酵乳中含有嗜热链球菌、德氏乳杆菌和干酪乳杆菌。当发酵乳中含有其他万古霉素固有耐药的乳杆菌,如发酵乳杆菌、植物乳杆菌、鼠李糖乳杆菌[19],该方法则不适用。
酸化MRS培养基对不同发酵乳中德氏乳杆菌的计数结果准确性存在差异,该培养基ISO 7889中规定对德氏乳杆菌保加利亚亚种的分离计数,该方法适用于发酵乳中只含有嗜热链球菌和德氏乳杆菌保加利亚亚种,不具有普遍性。嗜酸乳杆菌、干酪乳杆菌和部分双歧杆菌等乳酸菌在酸化MRS培养基上也可以较好的生长嗜酸乳杆菌、干酪乳杆菌和部分双歧杆菌等在酸化MRS培养基上也可以较好的生长[20]。为更好的选择性分离德氏乳杆菌保加利亚亚种,在后续实验中可通过提高乙酸钠的含量、采用改良RCM培养基等方法提高计数的准确性[21-22]。
GB 4789.35—2016中规定,MRS培养基用于测定双歧杆菌属和乳杆菌属的总数,嗜热链球菌的总数采用MC培养基。3个样品的MRS培养基上均检测到嗜热链球菌,MRS培养基中的蛋白胨、牛肉粉、酵母粉和葡萄糖,可以为嗜热链球菌的生长提供碳源、氮源等相关营养物质,不能选择性的计数乳杆菌和双歧杆菌。俞漪等[5]提出可通过形态特征进行乳杆菌和厌氧菌的区分,提出在厌氧培养下,乳杆菌呈乳白色,较大,嗜热链球菌呈半透明状,较小,在乳酸菌计数的过程中可通过菌落形态特征实现乳杆菌计数。
3 结论
本研究以3种复合发酵乳为研究对象,采用不同的选择性培养基,结合MALDI-TOF MS快速鉴定和细菌多相鉴定技术,实现了发酵乳中不同乳酸菌的选择性计数及种水平的精准鉴定。研究表明M17培养基和双歧杆菌培养基对嗜热链球菌和双歧杆菌具有良好的选择性,可以对实现复合发酵乳产品中乳酸菌的精准计数。德氏乳杆菌的选择性计数较难,需进一步优化培养基或采用分子生物学方法等进行准确计数。本研究中选择性培养基应用前提为发酵乳产品的菌种种类标识范围。若乳酸菌种类组合变化,需对培养基的选择性进行重新评估。本文所研究的选择性计数培养基以及培养基选择性的评估方法,为完善复合发酵乳产品的质量控制和国家标准的修订提供技术支撑,助力提升发酵乳产品微生物质量控制及市场监管水平。
[1] ASHRAF R, SHAH N P.Selective and differential enumerations of Lactobacillus delbrueckii subsp.bulgaricus, Streptococcus thermpohilus, Lactobacillus acidophilus, Lactobacillus casei and Bifidobacterium spp.in yoghurt-A review[J].International Journal of Food Microbiology, 2011, 149(3):194-208.
[2] MORIYA J, FACHIN L, G NDARA A L N, et al.Evaluation of culture media for counts of Bifidobacterium animalis in the presence of yoghurt bacteria[J].Brazilian Journal of Microbiology, 2006, 37(4):516-520.
NDARA A L N, et al.Evaluation of culture media for counts of Bifidobacterium animalis in the presence of yoghurt bacteria[J].Brazilian Journal of Microbiology, 2006, 37(4):516-520.
[3] MÖLLER C, DE VRESE M D.Review:Probiotic effects of selected acid bacteria[J].Milchwissenschaft, 2004, 59(11):597-601.
[4] SÜLE J, KÖRÖSI T, HUCKER A, et al.Evaluation of culture media for selective enumeration of bifidobacteria and lactic acid bacteria [J].Brazilian Journal of Microbiology, 2014, 45(3):1 023-1 030.
[5] 俞漪,胡雪莲.酸乳中乳酸菌计数方法改进和研究[J].农产品加工(学刊), 2012(9):118-120.
YU Y, HU X L.Improvement and research of yogurt lactic acid bacteria count[J].Academic Periodical of Farm Products Processing, 2012(9):118-120.
[6] 刘爱萍, 蒋菁莉, 任发政,等.发酵乳中益生菌选择性计数培养基的研究[C].中国奶业协会2008年年会, 2008.
LIU A P, JIANG J L, REN F Z, et.al.Study on selective counting medium of probiotics in fermented milk[C].Annual meeting of China Dairy Association, 2008.
[7] Enumeration of Bifidobacteria in fermented milk products-Guideline[S]. Technical bulletin P-11, CHR-HANSEN,2007.
[8] MASCO L, VENTURA M, ZINK R, et al.Polyphasic taxonomic analysis of Bifidobacterium animalis and Bifidobacterium lactis reveals relatedness at the subspecies level:reclassification of Bifidobacterium animalis as Bifidobacterium animalis subsp.animalis subsp.nov.and Bifidobacterium lacti[J].International Journal of Systematic & Evolutionary Microbiology, 2004, 54(4):1 137-1 143.
[9] CHUN J, LEE J H, JUNG Y, et al.EzTaxon:A web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].International Journal of Systematic and Evolutionary Microbiology, 2007, 57(10):2 259-2 261.
[10] TAMURA K, DUDLEY J, NEI M, et al.MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Molecular Biology and Evolution, 2007, 24(8):1 596-1 599.
[11] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y.Handbook of Systematic Identification of Common Bacteria [M].Beijing:Science Press, 2001.
[12] ZHENG J S, WITTOUCK S, SALVETTI E, et al.A taxonomic note on the genus Lactobacillus:Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae[J].International Journal of Systematic and Evolutionary Microbiology, 2020, 70(4):2 782-2 858.
[13] MASCO L, VENTURA M., ZINK R., et al.Polyphasic taxonomic analysis of Bifidobacterium animalis and Bifidobacterium lactis reveals relatedness at the subspecies level:Reclassification of Bifidobacterium animalis as Bifidobacterium animalis subsp.animalis subsp.nov.and Bifidobacterium lactis as Bifidobacterium animalis subsp.lactis subsp.nove[J].International Journal of Systematic and Evolutionary Microbiology, 2004, 54(4):1 137-1 143.
[14] WEISS N, SCHILLINGER U, KANDLER O.Lactobacillus lactis, Lactobacillus leichmannii and Lactobacillus bulgaricus, subjective synonyms of Lactobacillus delbrueckii, and description of Lactobacillus delbrueckii subsp.lactis comb.nov.and Lactobacillus delbrueckii subsp.bulgaricus comb.nov[J].Systematic and Applied Microbiology, 1983, 4(4):552-557.
[15] SHANKAR P A, DAVIES F L.Recent developments in yoghurt starters:A note on the suppression of Lactobacillus bulgaricus in media containing β-glycerophosphate and application of such media to selective isolation of Streptococcus thermophilus from yoghurt [J].International Journal of Dairy Technology, 1977, 30(1):28-30.
[16] DAVE R I, SHAH N P.Evaluation of media for selective enumeration of Streptococcus thermophilus, Lactobacillus delbrueckii ssp.bulgaricus, Lactobacillus acidophilus, and bifidobacteria [J].Journal of Dairy Science, 1996, 79(9):1 529-1 536.
[17] 姜勇, 杨滔, 杨文奇,等.MC与M17琼脂在嗜热链球菌计数中的比对研究[J].食品安全质量检测学报, 2019, 10(17):5 896-5 902.
JIANG Y, YANG T, YANG W Q, et al.Comparative study of MC and M17 agar in enumeration of Streptococcus thermophilus[J].Journal of Food Safety & Quality, 2019, 10(17):5 896-5 902.
[18] TERZAGHI B E, SANDINE W E.Improved medium for Lactic streptococci and their bacteriophages [J].Applied Microbiology, 1975, 29(6):807-813.
[19] CLSI.Clinical and laboratory standards institute.Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria[S].Approved Guideline CLSI Document M45-A, 2016.
[20] TABASCO R, PAARUP T, JANER C, et al.Selective enumeration and identification of mixed cultures of Streptococcus thermophilus, Lactobacillus delbrueckii subsp. bulgaricus, L.acidophilus, L.paracasei subsp.paracasei and Bifidobacterium lactis in fermented milk[J].International Dairy Journal, 2007, 17(9):1 107-1 114.
[21] 岳林芳. 酸奶中保加利亚乳杆菌选择性计数方法的研究[D].呼和浩特:内蒙古农业大学, 2016.
YUE L F.Studies on methods of selective enumeration of Lactobacillus delbrueckii subsp.bulgaricus in yoghurt [D].Hohhot:Inner Mongolia Agricultural University, 2016.
[22] OYENIRAN A, IBRAHIM S A, GYAWALI R, et al.A modified reinforced clostridial medium for the isolation and enumeration of Lactobacillus delbrueckii ssp.bulgaricus in a mixed culture [J].Journal of Dairy Science, 2020, 103(6):5 030-5 042.