雪莲菌,又名开菲尔粒(Kefir grain),起源于高加索地区,呈白色或乳白色,表面卷曲类似花椰菜,外形不规则,大小不一[1],在我国西藏也有发现。雪莲菌作为一种原生态复合发酵剂,其内部和表面的微生物组成复杂,极易被生长条件所影响[2],不同地区的雪莲菌,菌群结构也不同。
雪莲菌发酵乳是经过雪莲菌发酵鲜牛乳或羊乳后得到的黏稠状、味微酸,同时伴有酒精味的发酵乳[2]。它是经过多种微生物共同发酵的产物,相对于普通的发酵型酸奶营养更加丰富,而且含有多种挥发性化合物,具有独特的香味。目前已经有多种研究表明雪莲菌发酵乳具有降血压[3]、改善便秘[4]、降胆固醇[5]、调节循环和呼吸系统功能[6]、防癌抗癌[7]、消炎抗菌[8]等作用。雪莲菌中混菌体系的作用使雪莲菌发酵乳具有独特的酸醇混合风味[9],而发酵乳制品的香气是决定消费者接受度的一个重要指标,但是目前关于雪莲菌发酵乳香气的研究报道较少。
顶空气相色谱-离子迁移色谱联用技术(headspace-gas chromatography-ion migration spectroscopy,HS-GC-IMS)是一种结合了气相色谱和离子迁移谱的新型检测技术,待测物质经过气相色谱预分离以后,经过离子迁移色谱二次分离,可以克服GC-MS耗时长,且解谱较难的缺点[10]。相对于其他检测技术,气相离子迁移色谱(gas chromatography-ion mobility spectrometry,GC-IMS)具有灵敏度高、现场移动性和实时监测的能力[11-12]。现如今,气相离子迁移色谱在食品领域中快速发展,基于其对挥发性气体的快速准确检测,在食品风味分析及香气指纹图谱构建中显示出巨大的潜力[13-15]。
本研究通过高通量测序和GC-IMS风味分析,得到了雪莲菌发酵乳随发酵时间变化的香气指纹图谱以及发酵过程中微生物组成的变化,并对雪莲菌发酵乳中微生物种类和其香气随时间的改变进行动态变化分析,揭示了微生物菌群和香气物质之间的关系。
1 材料与方法
1.1 试剂与仪器
菌种:雪莲菌菌种产地为西藏林芝地区;纯牛奶,伊利股份有限公司。
仪器:Flavour Spec®气相离子迁移谱联用仪,德国G.A.S公司;902GP型-80 ℃超低温冰箱,美国Thermo Fisher Scientific;IS-RDD3型恒温振荡器,美国精骐有限公司;GR60DA型灭菌锅,ZEALWAY仪器有限公司。
1.2 实验方法
1.2.1 雪莲菌活化
将雪莲菌以2%(质量分数)的比例接种于纯牛奶中,温度为28 ℃,转速140 r/min,用无菌纱布封口置于恒温振荡器中进行培养,每24 h更换牛奶。更换牛奶时需将菌种倒在滤网中,用无菌水进行冲洗,直到菌种表面无奶泡附着,再放入锥形瓶中加入适当比例的牛奶循环发酵培养。
1.2.2 雪莲菌发酵乳制备
将活化好的雪莲菌以2%(质量分数)接入150 mL纯牛奶中,于28 ℃、140 r/min的恒温振荡器中培养,分别在0、2、5、8、11、14 d时取样品10 mL(3个重复)。
1.2.3 GC-IMS测定不同发酵时间的雪莲菌发酵乳香气
样品处理:不同时间发酵的雪莲菌发酵乳样品均使用屈臣氏蒸馏水稀释5倍,且以屈臣氏蒸馏水作为空白对照,各取1 mL置于顶空进样瓶中,每个样品取3个重复测定。
顶空条件:孵育温度为60 ℃;孵育时间15 min;顶空进样量300 μL;样针温度80 ℃;孵育转速500 r/min;
GC-IMS条件:IMS温度45 ℃;色谱柱FC-SE-54-CB-1(15 m×0.53 mm,1 μm);柱温40 ℃;漂移气和载气均为高纯氮气(纯度≥99.999%);色谱洗脱程序:0~10 min,(E1)漂流气流量恒定为150 mL/min;0~2 min内,(E2)载气流量:初始2 mL/min,保持2 min,8 min 内增加到20 mL/min,10 min内增加到100 mL/min。
1.2.4 雪莲菌以及不同发酵时间的雪莲菌发酵乳中微生物菌群鉴定
对所购买的雪莲菌菌种进行菌种多样性检测,检测雪莲菌中是否含有致病菌,并且得到雪莲菌中的菌种组成。高通量测序委托诺禾致源公司测定,测序选择细菌16S rDNA的高度可变V3~V4区, 上游引物为5′-CCTACGGRRBGCASCAGKVRVGAA-3′,下游引物为5′-GGACTACNVGGGTWTCTAATCC-3′, 提取细菌全基因组DNA后进行PCR扩增和高通量测序。
1.2.5 数据处理
最终数据采用OriginPro-2021b软件进行数据处理及绘图。
HS-GC-IMS风味成分通过GC-IMS Library search 1.0.3软件进行分析,并采用LAV中Gallery插件构建指纹图谱。
2 结果与分析
2.1 不同发酵阶段雪莲菌发酵乳的特征指纹图谱
雪莲菌发酵乳经过GC-IMS检测以后,一共定性检测出49种成分(14种未知成分与27种已知成分),其中8个成分同时存在单体和二聚体。定性的已知成分中有酯类11种、醇类6种、酮类6种、醛类2种、酸类2种,各成分及其气味描述见表1。
表1 雪莲菌发酵乳中的挥发性化合物及其气味阈值
Table 1 Volatile compounds in Kefir milk and their odor thresholds

化合物成分CAS分子质量分子式气味描述[16]辛酸乙酯ethyl octanoate106-32-1172.26C10H20O2水果味、苹果味、酒味、菠萝味、杏味乙酸苄酯benzyl acetate140-11-4150.17C9H10O2茉莉花型特有香味苯甲酸甲酯methyl benzoate-M93-58-3136.15C8H8O2浓郁的花香、樱桃香味methyl benzoate-D苯乙酮acetophenone98-86-2120.15C8H8O山楂味异辛醇2-ethylhexanol104-76-7130.23C8H18O动物味、纸板味苯甲醛benzaldehyde-M100-52-7106.12C7H6O特殊的杏仁味benzaldehyde-D2-庚酮2-heptanone-M110-43-0114.19C7H14O类似梨的果香2-heptanone-D乙酸异戊酯3-methylbutyl acetate-M123-92-2130.18C7H14O2香蕉味3-methylbutyl acetate-D乙酸丁酯butyl acetate-M123-86-4116.16C6H8O2水果香butyl acetate-D乳酸乙酯ethyl lactate97-64-3118.13C5H10O3葡萄酒香气2-己酮2-hexanone-M591-78-6100.16C6H9O泥土味,水果味,木浆味,干草味2-hexanone-D正己醛hexanal66-25-1100.16C6H12O青草味,略带水果味,柠檬味2-己醇2-hexanol626-93-7102.17C6H14O辛辣甜香乙酸异丁酯isobutyl acetate110-19-0116.16C6H12O2成熟后的水果香2-甲基丁醇2-methylbutanol-M137-32-688.15C5H12O酒精味、塑料味2-methylbutanol-D异丁酸乙酯ethyl 2-methylpropanoate97-62-1116.16C6H12O2水果气味异戊醇3-methylbutanol123-51-388.15C5H12O麦芽味、花香味、酒精味丙酸乙酯ethyl propanoate105-37-3102.13C5H10O2菠萝香气乙酸丙酯propyl acetate109-60-4102.13C5H10O2水果香气乙酸乙酯ethyl acetate141-78-688.11C4H8O2水果味、菠萝味、苹果味丙酮acetone67-64-158.08C3H6O泥土味,水果味,木浆味,干草味乙醇ethanol-M64-17-546.07C2H6O酒味ethanol-D辛辣味2-甲基-1-丙醇2-methylpropanol78-83-174.12C4H10O麦芽味2,3-丁二酮2-3-butanedione207-069-886.09C4H6O2奶油味,脂肪味2,3-戊二酮2-3-pentanedione600-14-6100.12C5H8O2奶油味,奶酪味,油味,甜黄油味,焦糖味、杏仁味丙酸propanoic acid79-09-474.08C3H6O2刺激性气味羊油酸hexanoic acid142-62-1116.16C6H12O?/干酪味,辛辣味,山羊味,酸性
注:后缀“M(monomer)”表示物质的单体,“D(dimer)”表示物质的二聚体
图1-a为发酵不同时间的雪莲菌发酵乳中的香气二维图谱,红色竖线为反应离子峰(reaction ion peak,RIP),其右侧的每一个点代表一种挥发性化合物,颜色表示物质的浓度,白色表示浓度较低,红色表示浓度较高,颜色越深表示浓度越高,可以比较出不同发酵时间的雪莲菌发酵乳中挥发性物质种类和浓度的差异。其中黄色圆圈标注位置为0 d发酵样品的特有挥发性物质,红色方形标注位置是发酵不同时间的雪莲菌发酵乳中特有挥发性物质变化区域。经过发酵后产生很多新的挥发性物质,例如具有水果香味的乙酸丁酯,麦芽香味的异戊酯和发酵乳的特征香气物质2,3-丁二酮等。
图1-b是不同发酵时间的雪莲菌发酵乳的指纹图谱,比较挥发性物质之间的相对差异。不同挥发性物质的浓度随发酵时间的增加发生显著的变化,结合指纹图谱可以发现,发酵0 d时,苯甲酸甲酯、苯甲醛、2-庚酮、2,3-丁二酮等物质浓度较高,这些挥发性物质皆是纯牛奶的特征性风味物质,主要是加热灭菌的美拉德反应产物。发酵2 d后,上述化合物浓度明显降低。随发酵时间的延长,出现大量新的挥发性物质,其中醇酯类物质较多,如异戊醇、乙醇、2-甲基-1-丙醇等醇类物质,乙酸异戊酯、乙酸丁酯、异丁酸乙酯等酯类物质。其中异戊醇带有花香味和酒精味,乙醇和异戊醇的存在使雪莲菌发酵乳被称为“乳中香槟”,两种醇类物质在一般发酵乳内较少检出,但是本研究采用的雪莲菌是一种原生态复合发酵剂,故出现以上两种醇类物质,赋予雪莲菌发酵乳独特的风味。发酵至第5天时,作为发酵乳特征性风味物质的2,3-丁二酮浓度显著增高。发酵8 d以后,带有香蕉香味的乙酸异戊酯、带有青草味的正己醛和带有水果香味的2-己酮、以及乙酸异丁酯和辛酸乙酯等带有良好香味的物质浓度增加且发酵至第11天时,以上带有积极香气的化合物浓度皆大幅度降低。高薇等[17]对两种不同地理来源的西藏开菲尔粒的发酵乳中挥发性物质进行测定,在两种发酵乳中检测到7种酯类,其中乙酸苯乙酯是A发酵乳中特有,乙酸异戊酯是B发酵乳中特有,两种发酵乳中酯类化合物的总香气活力值(odor activity value,OVA)远高于其他4种化合物,表明酯类是两种发酵乳中最重要的香气贡献化合物。而雪莲菌发酵乳发酵至8 d后大多数酯类物质浓度降低,且发酵至14 d时,带有刺激性气味的丙酸浓度逐渐增大,且酒精浓度也逐渐增大,可能会给雪莲菌发酵乳风味带来具有消极影响的香气。故在雪莲菌发酵乳的实际生产中,发酵至第8天时,雪莲菌发酵乳香气最为丰富,带有积极香气的挥发性化合物最多,若持续发酵,则会损失部分重要的香气贡献化合物,且产生带有刺激性气味的化合物,进而影响雪莲菌发酵乳的风味。
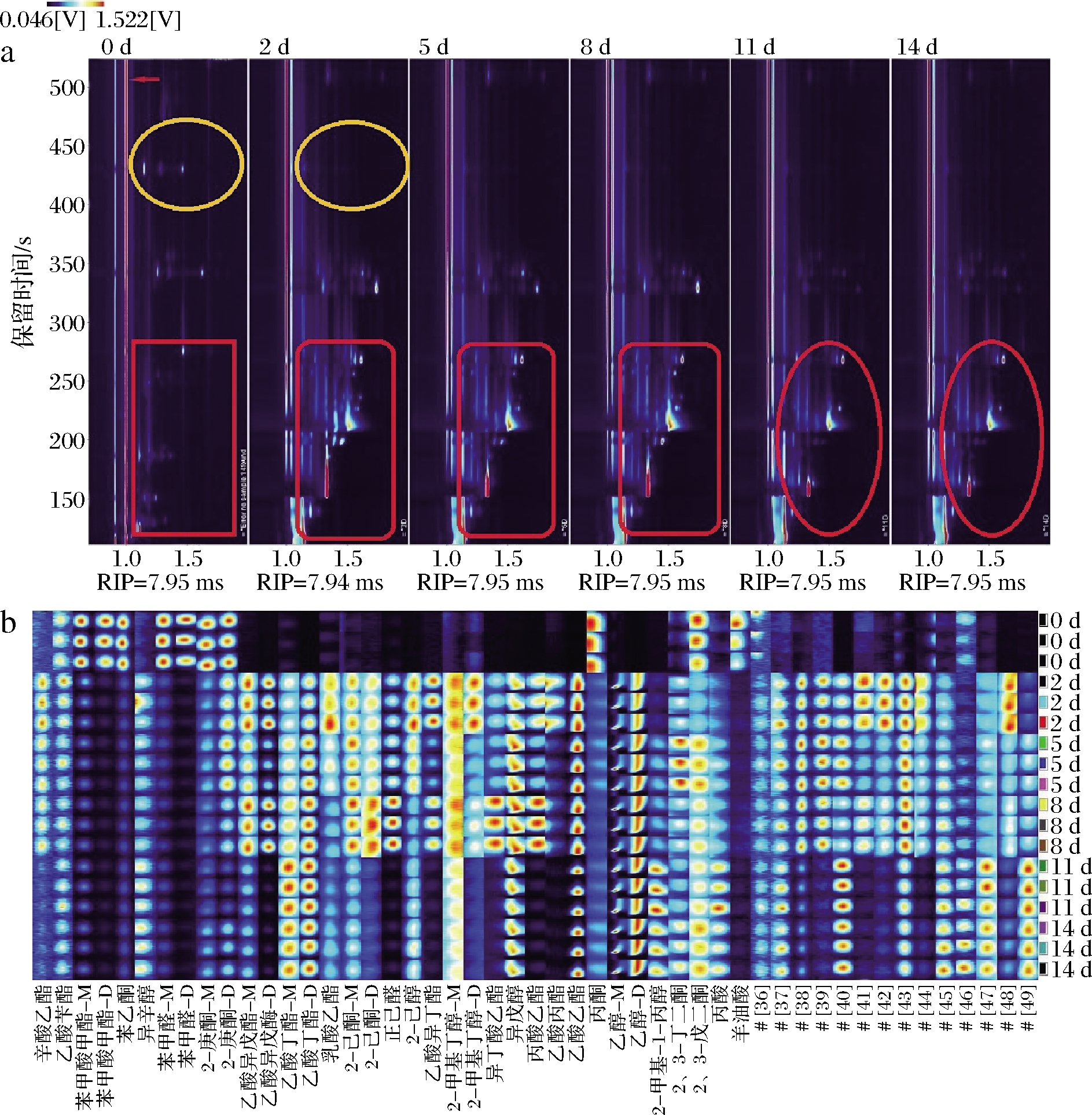
a-不同发酵时间的雪莲菌发酵乳的二维图谱; b-不同发酵时间的雪莲菌发酵乳的特征图谱
图1 不同发酵时间的雪莲菌发酵乳的二维图谱与指纹图谱
Fig.1 Two-dimensional chromatogram and fingerprint of Kefir milk of different fermentation
2.2 主成分分析(principal component analysis,PCA)
对不同发酵时间的雪莲菌发酵乳进一步做PCA,如图2所示。前两个主成分可以反映所有信息的87.9%,说明两个主成分可以代替原始的样品信息。从PCA中可以看出,每3个重复样本聚在一起,说明重复性较好。不同发酵时间的雪莲菌发酵乳挥发性化合物含量有所波动,其中发酵0 d的样品聚集在一起,发酵2、5、8 d的样品较为邻近,发酵11、14 d的样品相邻。PCA的结果与香气物质指纹图谱中得到的结论相似,随着发酵时间的延长,香气的浓度和种类都会发生变化,发酵至第8天大多数香气物质达到最高浓度,发酵至11 d开始大幅下降。
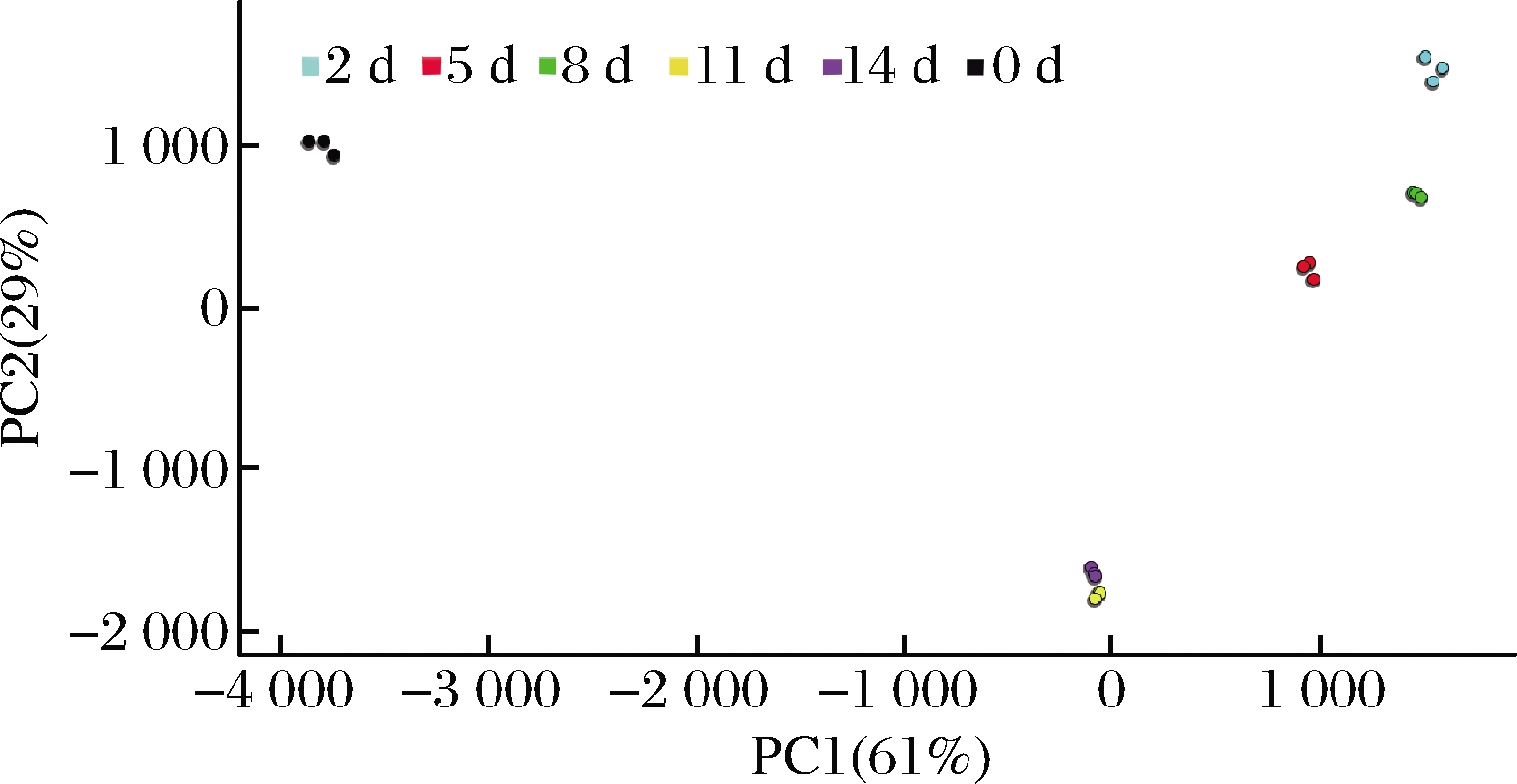
图2 不同发酵时间的雪莲菌发酵乳PCA图
Fig.2 PCA of Kefir milk in different fermentation days 注:相同样品有3个生物学重复
2.3 雪莲菌及雪莲菌发酵乳中微生物菌群动态变化规律
雪莲菌菌种的高通量测序结果表明,在种分类水平下可以得出所使用的雪莲菌菌种由乳杆菌属(Lactobacillus)和醋酸菌属(Acetobacter)组成,但是主要以乳杆菌属(Lactobacillus)为主,醋酸菌属(Acetobacter)丰度只有0.01,同时没有检测出致病菌及其他有害菌,符合已报道的雪莲菌菌种特征[18]。同时也可以保证此雪莲菌菌种可以用于发酵健康食品。图3为不同发酵时间的雪莲菌发酵乳16S rDNA高通量测序结果,可以看出乳杆菌是优势菌属,占所有雪莲菌微生物种群的92%以上,醋酸杆菌属于亚优势,占微生物种群的1%~8%,结果与其他研究结果相似[19]。0 d发酵(对照)时各种细菌的相对丰度较高,此结果与丁瑞雪等[20]的研究结果一致,纯牛奶中含有例如不动细菌属(Actinetobacter)、假单胞菌属(Pseudomonas)等微生物。发酵开始以后,纯牛奶中的原始菌群的丰度降低,Lactobacillus和Acetobacter丰度急剧升高。乳杆菌为厌氧发酵,且能够利用乳糖而生长速度较快,进行耗氧发酵的醋酸菌则生长缓慢。发酵前期Lactobacillus占据发酵的主导地位,相对丰度较高,香气物质增多。但随着发酵时间增长,供氧量增大,故Acetobacter相对丰度逐渐增加,随着发酵时间延长,醋酸杆菌的数量逐渐增多。
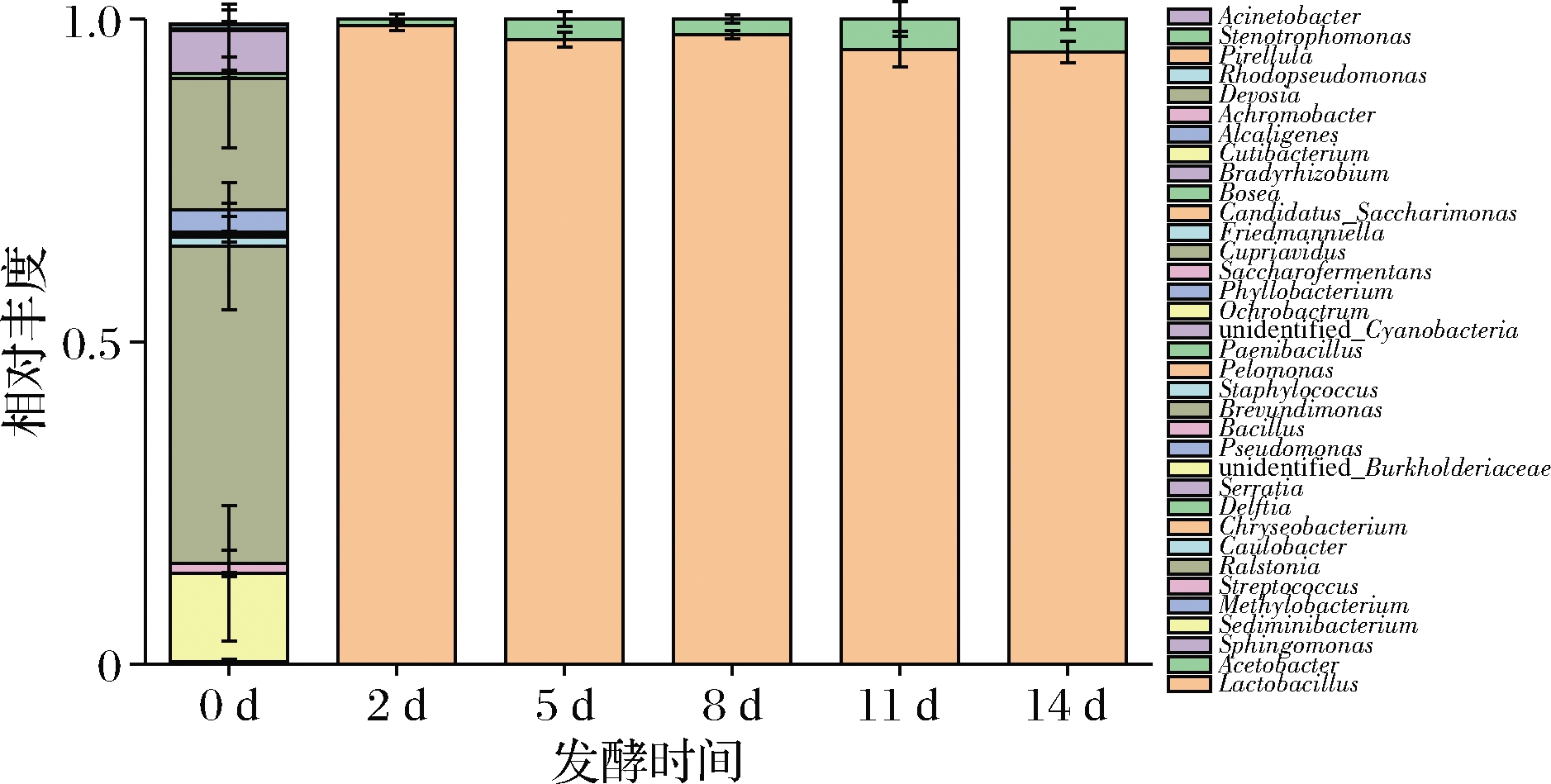
图3 不同发酵时间的雪莲菌发酵乳高通量测序结果
Fig.3 Sequencing results of Kefir milk amplicon in different fermentation days
2.4 雪莲菌发酵乳的香气与微生物菌群的动态变化关系解析
图4通过皮尔逊相关系数分析雪莲菌发酵过程中乳杆菌属和醋酸杆菌属与雪莲菌发酵乳的香气之间的相关性,图中紫色代表正相关,橙色代表负相关,圆点的大小代表相关性,圆点越大,其相关性越大。
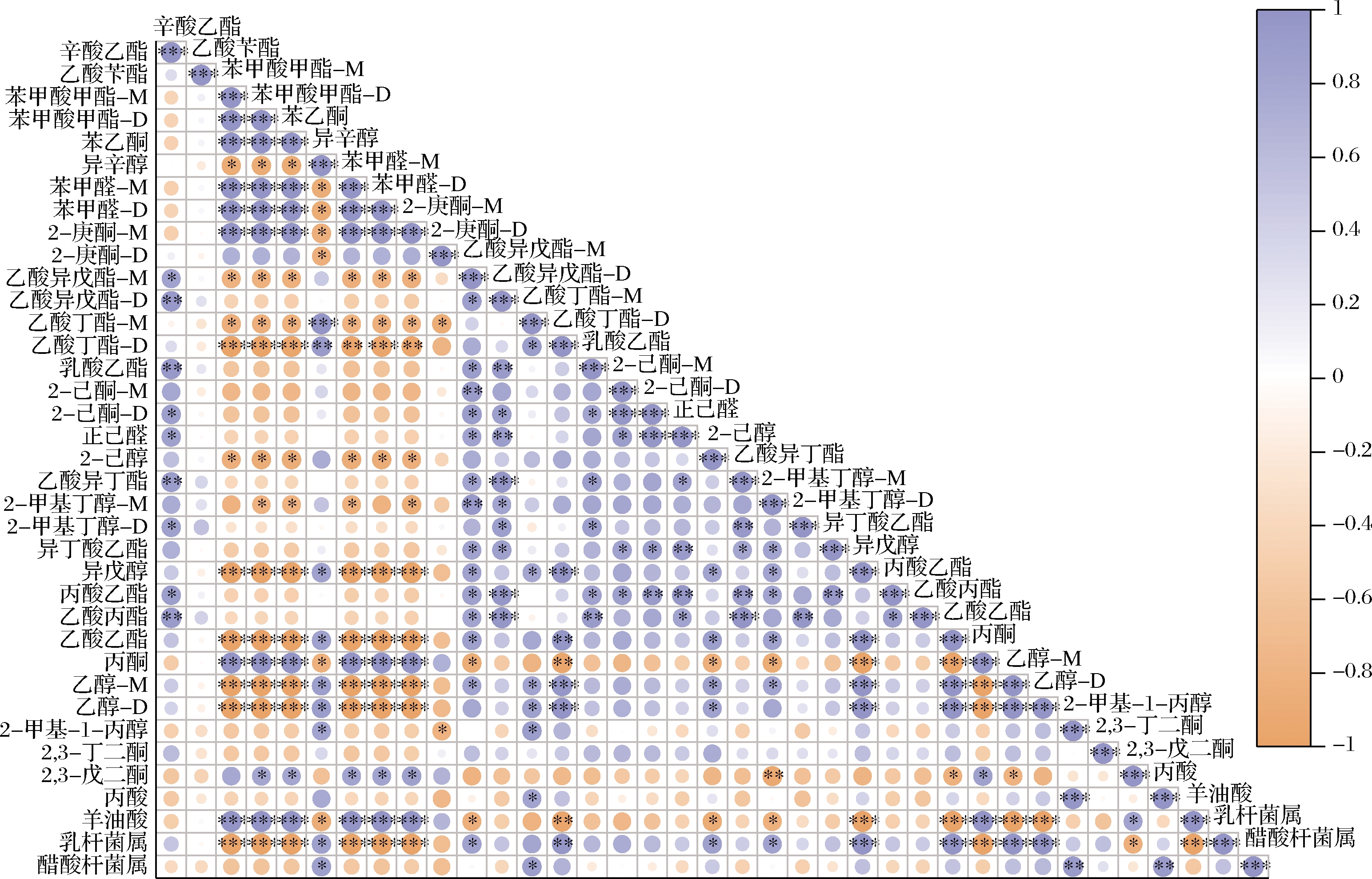
图4 雪莲菌发酵乳中主要菌属与香气的相关性
Fig.4 Correlation between main bacteria and volatile substances in Kefir milk
乳杆菌发酵和部分挥发性物质皆有相关性。乳杆菌在乳制品风味开发中主要通过乳糖、乳酸和柠檬酸的代谢,以及解离脂肪酸和蛋白质分解来调控或产生挥发性化合物。乳杆菌将乳糖分解和柠檬酸盐代谢后,形成乙醇、乳酸和一些C4挥发性风味物质。其中,柠檬酸盐作为乳制品的特征风味物质2,3-丁二酮和乙偶姻的前体物质,可以通过乳杆菌发酵进行降解得到。乳杆菌与苯甲酸甲酯、苯乙酮、苯甲醛和羊油酸(正己酸)等呈显著负相关。李娟等[21]在复原乳的样品中检测到相对含量较高的苯甲醛,在发酵过程中,乳杆菌菌体自身代谢的各种酶作用于苯丙氨酸,使得苯甲醛的含量发生变化,对于雪莲菌发酵乳的香气有一定的调和作用。而酮类化合物和有机酸类化合物生成,则与乳杆菌分解氨基酸及解离脂肪酸有关[22]。高浓度的羊油酸呈辛辣味、酸味,通过研究结果发现乳杆菌在发酵过程中可以降低其浓度,其机制有待深入研究。
乳杆菌与异戊醇、乙酸乙酯、乙醇等呈显著正相关,乙醇是具有乙醇脱氢酶活性的异型发酵乳酸菌发酵的结果[23],发酵后期,乙醇含量和供氧量的增多可能导致乳杆菌生长受到抑制,同时醋酸杆菌可以利用乙醇和氧气进行大量繁殖。醋酸杆菌属与异辛醇、乙酸丁酯、丙酸、2-甲基-1-丙醇等呈显著正相关,在发酵过程中,醋酸杆菌影响香气物质的数量和程度均少于乳杆菌,故认为醋酸杆菌相比较乳杆菌对雪莲菌发酵乳的香气影响较小。
3 结论
本研究通过GC-IMS技术和微生物菌群分析,揭示了在雪莲菌发酵乳的发酵过程中乳杆菌和醋酸杆菌是发酵优势菌,同时获得了发酵不同时间的雪莲菌发酵乳香气指纹图谱。通过GC-IMS测定得到49种挥发性物质,其中2-己酮、正己醛等可以被判定为发酵开始的标志物。发酵到第8天时,雪莲菌发酵乳中香气物质含量和种类最丰富,发酵至11 d时,香气物质种类和含量大幅减少,乙酸异戊酯、异丁酸乙酯、2-己酮等带有水果香气的化合物含量降低,且持续发酵会产生带有刺激性气味的丙酸等化合物。故发酵8 d时的雪莲菌发酵乳含有最丰富的香气物质。通过皮尔逊相关性系数分析,解析出了雪莲菌发酵乳发酵过程的动态变化关系,揭示了主要菌种和特征香气物质的关系。乳杆菌在发酵前期作为优势菌株,与苯甲酸甲酯、苯乙酮等呈显著负相关,与异戊醇、乙酸乙酯等呈显著正相关,说明其对雪莲菌发酵乳香气贡献较大。随着发酵时间的延长,醋酸杆菌的丰度逐渐增加,并与异辛醇、乙酸丁酯、丙酸、2-甲基-1-丙醇等4种物质呈显著正相关。GC-IMS和微生物菌群分析有助于评估雪莲菌发酵乳的香气和微生物菌群的动态变化关系。本研究为加强雪莲菌发酵乳的质量控制和雪莲菌发酵乳工业化生产过程中动态调控其风味与香气提供参考依据。
[1] IRIGOYEN A, ARANA I, CASTIELLA M, et al.Microbiological, physicochemical, and sensory characteristics of Kefir during storage[J].Food Chemistry, 2005, 90(4):613-620.
[2] GARROTE G L, ABRAHAM A G, DE ANTONI G L.Chemical and microbiological characterisation of Kefir grains[J].The Journal of Dairy Research, 2001, 68(4):639-652.
[3] FRIQUES A G F, ARPINI C M, KALIL I C, et al.Chronic administration of the probiotic Kefir improves the endothelial function in spontaneously hypertensive rats[J].Journal of Translational Medicine, 2015, 13(1):390.
[4] TURAN ![]() DEDELI Ö, BOR S, et al.Effects of a Kefir supplement on symptoms, colonic transit, and bowel satisfaction score in patients with chronic constipation:A pilot study[J].The Turkish Journal of Gastroenterology:the Official Journal of Turkish Society of Gastroenterology, 2014, 25(6):650-656.
DEDELI Ö, BOR S, et al.Effects of a Kefir supplement on symptoms, colonic transit, and bowel satisfaction score in patients with chronic constipation:A pilot study[J].The Turkish Journal of Gastroenterology:the Official Journal of Turkish Society of Gastroenterology, 2014, 25(6):650-656.
[5] AHMED Z, WANG Y P, AHMAD A, et al.Kefir and health:A contemporary perspective[J].Critical Reviews in Food Science and Nutrition, 2013, 53(5):422-434.
[6] LIU H, XIE Y H, HAN T, et al.Studies on the action mechanism for cholesterol-lowering of Lactobacillus which yields bile salt hydrolase from Kefir grains[J].Advanced Materials Research, 2013, 2 606(781-784):1 336-1 340.
[7] 毛健, 王豪, 苏米亚, 等.开菲尔中生物活性物质的益生作用[J].中国乳品工业, 2010, 38(12):30-35.
MAO J, WANG H, SU M Y, et al.Study on probiotic effect originated from bioactive ingredients in Kefir[J].China Dairy Industry, 2010, 38(12):30-35.
[8] LEE M Y, AHN K S, KWON O K, et al.Anti-inflammatory and anti-allergic effects of Kefir in a mouse asthma model[J].Immunobiology, 2007, 212(8):647-654.
[9] BESHKOVA D M, SIMOVA E D, FRENGOVA G I, et al.Production of volatile aroma compounds by Kefir starter cultures[J].International Dairy Journal, 2003, 13(7):529-535.
[10] EWING R G, ATKINSON D A, EICEMAN G A, et al.A critical review of ion mobility spectrometry for the detection of explosives and explosive related compounds[J].Talanta, 2001, 54(3):515-529.
[11] 陈通, 陈鑫郁, 谷航, 等.气相离子迁移谱对山茶油掺假的检测[J].食品科学, 2019, 40(8):275-279.
CHEN T, CHEN X Y, GU H, et al.Detection of adulterated Camellia oil using gas chromatography-ion mobility spectrometry[J].Food Science, 2019, 40(8):275-279.
[12] UNGETHÜM B, WALTE A, MÜNCHMEYER W, et al.Comparative measurements of toxic industrial compounds with a differential mobility spectrometer and a time of flight ion mobility spectrometer[J].International Journal for Ion Mobility Spectrometry, 2009, 12(4):131-137.
[13] TIAN H H, LI S Y, WEN H C, et al.Volatile organic compounds fingerprinting in faeces and urine of Alzheimer′s disease model SAMP8 mice by headspace-gas chromatography-ion mobility spectrometry and headspace-solid phase microextraction-gas chromatography-mass spectrometry[J].Journal of Chromatography A, 2020, 1 614:460717.
[14] M RQUEZ-SILLERO I, C
RQUEZ-SILLERO I, C RDENAS S, SIELEMANN S, et al.On-line headspace-multicapillary column-ion mobility spectrometry hyphenation as a tool for the determination of off-flavours in foods[J].Journal of Chromatography A, 2014, 1 333:99-105.
RDENAS S, SIELEMANN S, et al.On-line headspace-multicapillary column-ion mobility spectrometry hyphenation as a tool for the determination of off-flavours in foods[J].Journal of Chromatography A, 2014, 1 333:99-105.
[15] GALLEGOS J, ARCE C, JORDANO R, et al.Target identification of volatile metabolites to allow the differentiation of lactic acid bacteria by gas chromatography-ion mobility spectrometry[J].Food Chemistry, 2017, 220:362-370.
[16] 里奥·范海默特.化合物香味阈值汇编[M].第二版.北京:科学出版社, 2015.
VAN GEMERT L J.Compilations of Flavour Threshold Values in Water and Other Media[M].2th ed.Beijing:Science Press, 2015.
[17] 高薇, 张兰威.西藏开菲尔发酵乳中挥发性风味物质分析[J].食品研究与开发,2020, 41(3):183-188.
GAO W, ZHANG L W.Analysis of volatile flavor compounds in Tibetan kefir milks[J].Food Research and Development, 2020, 41(3):183-188.
[18] JIA S L, LI Y, ZHUANG S, et al.Biochemical changes induced by dominant bacteria in chill-stored silver carp (Hypophthalmichthysmolitrix) and GC-IMS identification of volatile organic compounds[J].Food Microbiology, 2019, 84:1 032-1 048.
[19] WALSH A M, CRISPIE F, KILCAWLEY K N, et al.Microbial succession and flavor production in the fermented dairy beverage Kefir[J].mSystems, 2016, 1(5):e00052-e00016.
[20] 丁瑞雪, 耿丽娟, 张铁华, 等.基于下一代测序技术分析巴氏杀菌乳中残留细菌在贮藏期间的动态变化[J].食品科学, 2019, 40(14):77-83.
DING R X, GENG L J, ZHANG T H, et al.Dynamic analysis of changes in residual bacteria in pasteurized milk during storage based on next generation sequencing[J].Food Science, 2019, 40(14):77-83.
[21] 李娟, 任芳, 甄大卫, 等.气相色谱-离子迁移谱分析乳制品挥发性风味化合物[J].食品科学, 2021, 42(10):235-240.
LI J, REN F, ZHEN D W, et al.Analysis of volatile flavor compounds dairy products by gas chromatography-ion mobility spectrometry[J].Food Science, 2021, 42(10):235-240.
[22] DELGADO F J, GONZ LEZ-CRESPO J, CAVA R, et al.Characterisation by SPME-GC-MS of the volatile profile of a Spanish soft cheese P.D.O.Torta del Casar during ripening[J].Food Chemistry, 2010, 118(1):182-189.
LEZ-CRESPO J, CAVA R, et al.Characterisation by SPME-GC-MS of the volatile profile of a Spanish soft cheese P.D.O.Torta del Casar during ripening[J].Food Chemistry, 2010, 118(1):182-189.
[23] KUNG L Jr, TAYLOR C C, LYNCH M P, et al.The effect of treating alfalfa with Lactobacillus buchneri 40788 on silage fermentation, aerobic stability, and nutritive value for lactating dairy cows[J].Journal of Dairy Science, 2003, 86(1):336-343.