肌肉保水性的变化会导致肉的风味、多汁性等随之改变,提高加工成本,导致经济损失[1]。目前,许多研究表明蛋白氧化对肉保水性有着不可忽视的作用。BERTRAM等[2]发现肌原纤维蛋白(myofibrillar protein,MP)在氧化后,MP保水性下降,形成大量二聚酪氨酸,提出氧化交联产物会对MP保水性产生消极影响。BAO等[3]研究认为氧化对于肉蛋白的保水能力是促进因子(氧化导致净负电荷增多)和抑制因子(氧化导致交联聚集)之间的平衡。ZHANG等[4]的研究也表明适度氧化有助于蛋白质凝胶保持较高的保水性,而过高的氧化会导致保水性降低。
通常,肌肉中的氧化以脂质氧化为主。脂质氧化过程中易生成α、β-不饱和醛等次级脂质氧化产物,例如丙二醛、丙烯醛等。不饱和脂肪酸易于氧化,生成多种活性氧(reactive oxygen species,ROS)物质,形成氧化胁迫环境[5]。ROS会攻击肌肉蛋白质并导致氧化修饰,从而影响其电荷变化以及肉品的保水性[6]。ZHANG等[7]研究表明,脂质氧化产生的ROS可以攻击蛋白质的敏感氨基酸侧链,从而诱发MP氧化。此外,蛋白质氧化产生的自由基物质也可以转移到脂质部分,从而促进脂质氧化[8]。目前,亚油酸已被广泛用于构建模拟脂质氧化系统。JIANG等[9]构建亚油酸氧化体系诱导MP去折叠和交联,发现MP凝胶保水性降低。杨玉玲等[10]通过亚油酸体系研究MP氧化对凝胶质构的影响,结果表明,适度氧化有助于改善凝胶特性。
我国肉用山羊中,重庆大足黑山羊因其处于特殊的自然环境与近百年的封闭养殖,具有营养丰富、肉质鲜美等特点,成为国内市场食用的优势品种,极具经济价值[11-12]。与其他肉类相比,大足黑山羊肉的多不饱和脂肪酸含量较高[13],其中,亚油酸含量约占总脂肪酸的10.48%[12]。黑山羊肌肉组织中,MP是最主要的功能性蛋白,在肉品中起着非常重要的作用。在羊肉推广运输和加工过程中,不可避免地会发生脂质氧化和蛋白质氧化等严重问题,使羊肉保水性及其制品品质下降,造成经济损失。
保水性是肉制品的重要品质属性,MP的氧化修饰会使得保水性发生改变[4]。净电荷的增加会引起MP膨胀并改善保水性,而结构限制则禁止无限膨胀[14]。然而,MP氧化如何调节促进因子和抑制因子之间的平衡来影响保水性,以及哪一个因子对这种平衡起主导作用还很少被探讨。因此,本研究基于亚油酸氧化体系探究黑山羊肉MP的氧化修饰及对电荷与保水性的影响,以期从电荷水平深入理解MP氧化并为有效调控黑山羊肉蛋白氧化带来的品质劣变提供理论参考。
1 材料与方法
1.1 材料与试剂
选取重庆大足县同一牧场(24±6)月龄的黑山羊,宰后取其背最长肌,在0~4 ℃下分割成每块200 g,置于液氮中快速运输至实验室,保存在-80 ℃冰箱中待使用。
酒石酸钾钠、磷酸氢二钠、磷酸二氢钠、氯化钠、三氯乙酸、乙酸乙酯、甘氨酸、溴酚蓝、2,4-二硝基苯肼、5,5-二硫代双(2-硝基苯甲酸)、十二烷基硫酸钠、亚油酸(分析纯),范德(北京)生物科技有限公司;SDS-PAGE试剂盒,北京索莱宝科技有限公司;脂肪氧合酶(分析纯),上海源叶生物科技有限公司。
1.2 仪器与设备
YP-B10002电子分析天平,上海光正医疗仪器有限公司;2K-15冷冻离心机,德国Sigma公司;F-2500荧光分光光度计、UV-16001紫外-可见分光光度计,日本岛津仪器有限公司;XHF-D内切式匀浆机、SCIENTZ-12 N真空冷冻干燥机,宁波新芝生物科技股份有限公司;DYY-8C型电泳仪,北京六一生物科技有限公司。
1.3 实验方法
1.3.1 MP提取
参考JIANG等[9]的方法提取MP。将黑山羊里脊肉的结缔组织和筋膜剔除,切碎后加入4倍体积的磷酸盐缓冲液(pH 7.0),11 500 r/min均质化2 min后冷冻离心(4 ℃、3 500×g、10 min),整个过程重复3次。随后加入磷酸盐缓冲液(pH 6.25、0.1 mol/L NaCl),相同条件下均质离心。接着加入磷酸盐缓冲液(pH 6.0、0.1 mol/L NaCl),均质后用4层纱布过滤,滤液离心10 min,所得沉淀即为MP提取物,贮存在4 ℃条件下并在12 h内使用。采用双缩脲法测定蛋白质浓度。
1.3.2 亚油酸氧化处理
参考JIANG等[9]的方法建立氧化体系。将MP重悬在磷酸盐缓冲液(pH 6.0、0.6 mol/L NaCl)中,调节MP质量浓度为10 mg/mL。在MP重悬液中加入3 750 unit/mL脂肪氧合酶和不同质量的亚油酸,其终浓度为0(对照组)、2、5、10、15、20 mmol/L。将样品置于4 ℃、黑暗、密封环境中孵育24 h后,加入丁基羟基甲苯终止反应,3 500×g、4 ℃离心10 min,所得沉淀用磷酸盐缓冲液(pH 6.0)洗涤2次,除去多余的丁基羟基甲苯和亚油酸。
1.3.3 保水性测定
参考PENG等[15]的方法并稍作修改。将MP置于离心管中,80 ℃干燥12 h。保水性计算如公式(1)所示:
保水性/(g水·g-1蛋白![]()
(1)
式中:W0,离心管质量,g;W1,干燥前离心管与MP沉淀质量,g;W2,干燥后离心管与MP沉淀质量,g。
1.3.4 Zeta电位测定
参考CAI等[16]的方法并稍作修改。将MP溶液(1 mg/mL)注入Zeta电位皿中,散射角调节为90°,平衡时间60 s,在25 ℃下进行测试。
1.3.5 氨基酸分析
参考ZHANG等[4]的方法并稍作修改。称取20 mg冻干MP于带盖消化玻璃管中,加入5 mL 6 mol/L HCl混匀,110 ℃水解24 h。冷却后,用氮气将水解产物吹干。随后用0.02 mol/L HCl定容至50 mL。取少量溶液离心后,用0.22 μm滤膜过滤。用自动氨基酸分析仪测试过滤后的溶液。
1.3.6 羰基含量测定
参考LEVINE等[17]的方法评估羰基含量。将MP溶液质量浓度稀释至 5 mg/mL。取2份等量MP溶液(0.8 mL)于5 mL的离心管中。其中一份用1 600 μL的2 mol/L HCl(含有2 g/L的2,4-二硝基苯肼)处理,记为处理组;另一份用1 600 μL 的2 mol/L HCl 处理,记为空白组。在室温下反应30 min 后,加入800 μL 的三氯乙酸(400 g/L)沉淀蛋白质。随后离心处理(5 000×g,5 min,4 ℃),弃清液。加入2 mL乙醇-乙酸乙酯混合液(体积比1∶1)沉淀用2,4-二硝基苯肼进行洗涤,5 000 ×g离心5 min除去不溶物质。随后用乙醇-乙酸乙酯洗涤3次。所得沉淀用3 mL磷酸盐缓冲液(pH 6.5、6 mol/L盐酸胍)溶解,37 ℃孵育30 min后,测量溶液在370 nm处的吸光度,羰基含量计算如公式(2)所示:
羰基含量![]()
(2)
1.3.7 总巯基含量测定
根据WANG等[18]的方法评估总巯基含量。取1 mL 5 mg/mL MP溶液用9 mL磷酸盐缓冲液(50 mmol/L、pH 7.0、0.6 mol/L NaCl、10 mmol/L EDTA-2 Na和8 mol/L 尿素)稀释。取3 mL稀释液与400 μL 1 mmol/L 2-硝基苯甲酸溶液混合,40 ℃孵育30 min后,测量溶液在412 nm处的吸光度。通过摩尔消光系数[13 600 mol/(L·cm)]计算总巯基的含量。
1.3.8 表面疏水性测定
参考CHELH等[19]的方法并稍作修改。用蒸馏水配制1 mg/mL的溴酚蓝溶液。将MP溶液稀释至5 mg/mL。分别取1 mL的稀释液、1 mL 磷酸盐缓冲液(对照组)与200 μL的溴酚蓝混匀,充分振荡,25 ℃ 的条件下反应 10 min,离心(2 000×g,15 min, 4 ℃)。取0.4 mL上清液,加入3.6 mL磷酸盐缓冲液(40 mmol/L,pH 6.8)稀释,在 595 nm处测定吸光度。表面疏水性以溴酚蓝的结合量表示,计算如公式(3)所示:
溴酚蓝![]()
(3)
1.3.9 傅里叶红外光谱分析
参考ZHOU等[20]的方法并稍作修改。准确称取1 mg MP冻干粉末,与100 mg KBr标准品混合研磨,压片后在400~4 000 cm-1进行全波段扫描,扫描次数累加64次。
1.3.10 色氨酸内源荧光分析
参考CAO等[21]的方法并稍作修改。将MP质量浓度调节至1 mg/mL。用荧光分光光度计在300~400 nm的光谱范围内进行扫描,激发波长为295 nm,扫描速度为1 500 nm/min,激发和发射狭缝宽度均为5 nm。
1.3.11 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis ,SDS-PAGE)分析
参考JIANG等[9]的方法并稍作修改。将MP质量浓度调节至2 mg/mL。加入3倍体积的buffer溶液(未还原状态不添加β-巯基乙醇)制备电泳样品,使用时取上清液进行电泳操作。电泳完成后,将凝胶染色30 min,随后用脱色液脱色40 min。分子质量由蛋白质标记物测定(10~180 kDa)。
1.3.12 数据处理
本研究中每个处理均进行3次平行试验。用SPSS统计软件(19.0 版本,美国 SPSS 公司)进行数据处理,采用单因素方差分析法进行显著性差异检验(P<0.05表示差异显著)。通过PeakFit 4.12分析红外光谱,用Origin 8.5进行数据绘图。
2 结果与分析
2.1 保水性及电荷分析
2.1.1 保水性
保水性主要取决于MP的结构性质与分子间相互作用力。由图1可知,MP保水性随着氧化强度的增加而显著上升(P < 0.05)。当亚油酸浓度为5 mmol/L时,MP保水性约为对照组(0 mmol/L)的2倍。这可能是由于低强度氧化时,净负电荷增加(图2) 导致保水性增加。随着氧化强度的进一步提高,MP保水性显著下降(P < 0.05),且均低于对照组。这与BAO等[3]对猪肉MP保水性的研究结果一致。LIU[22]的研究指出,高度氧化修饰引起的蛋白质交联和聚集可能是降低保水性的一个重要因素。
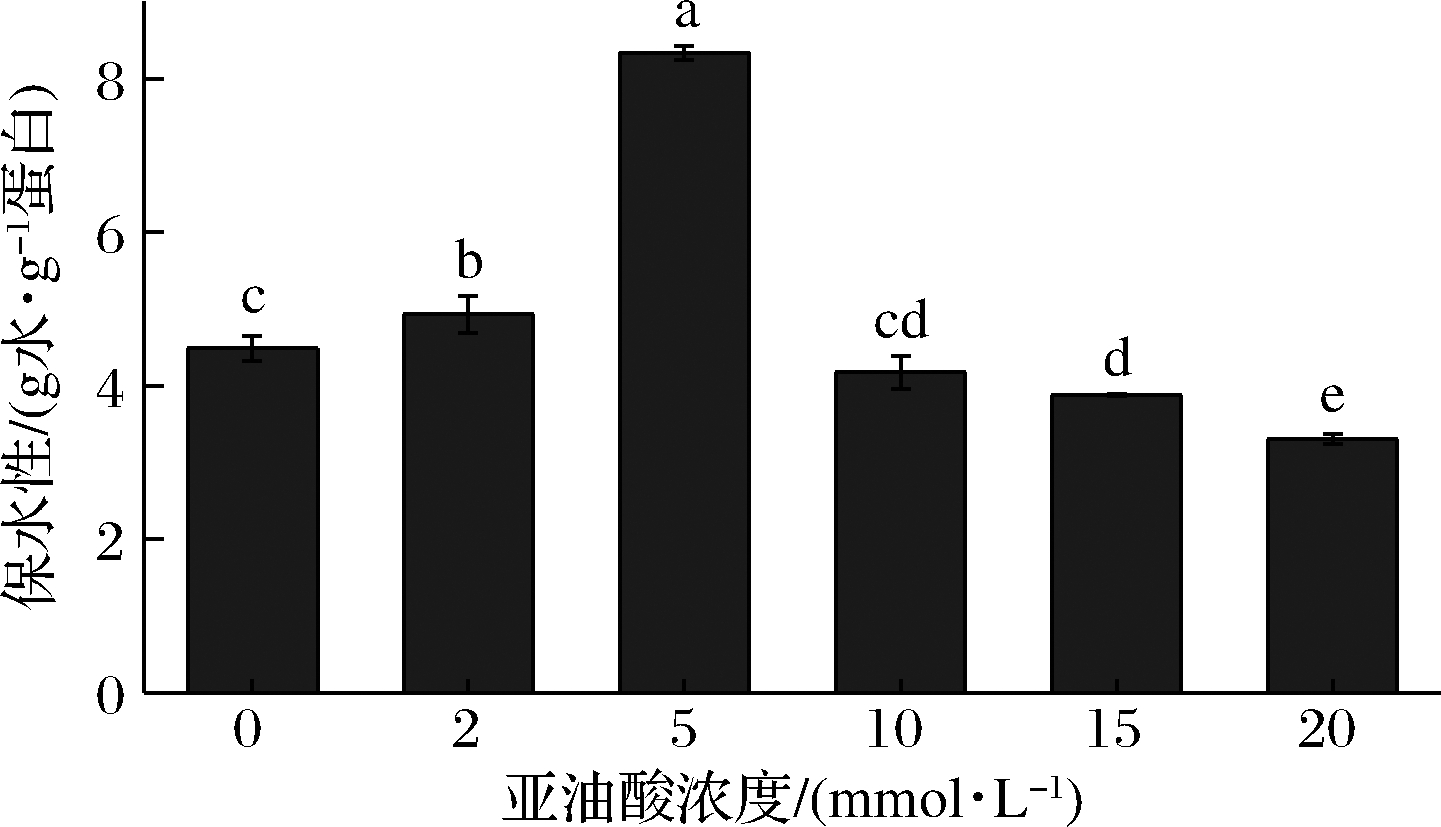
图1 不同浓度亚油酸氧化体系对MP 保水性的影响
Fig.1 The effect of different concentrations of linoleic acid oxidation system on MP water-holding 注:不同字母表示差异显著(P<0.05)(下同)
2.1.2 Zeta电位
Zeta电位值可以监测蛋白质物理和化学状态的细微变化,是直观表现蛋白净负电荷变化情况的重要指标[23]。由图2可知,电位绝对值整体呈现出先上升后下降的趋势,亚油酸浓度较低时(<10 mmol/L),MP的净负电荷增加(P<0.05),说明低强度的氧化使MP溶液体系变得稳定,这与张海璐等[24]的研究结果相同。BAO等[3]的研究指出,轻度氧化修饰使蛋白质净负电荷增加,改善交联和静电相互作用,从而提高保水性。亚油酸浓度较高时(>10 mmol/L),电位绝对值显著降低(P<0.05),这可能是因为氧化强度过高,使得MP剧烈氧化而发生蛋白间的聚集和包埋,导致净负电荷下降[16]。
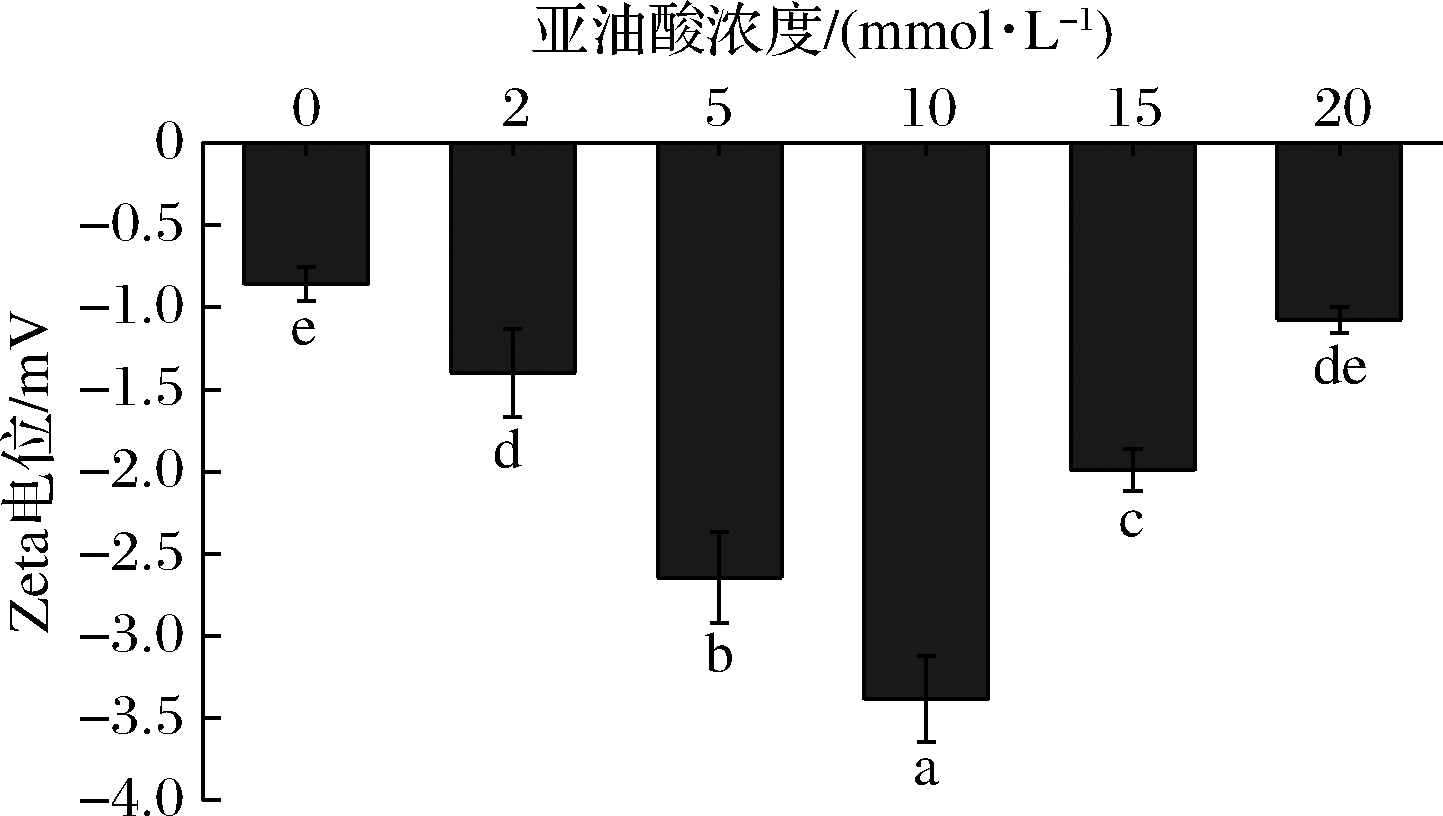
图2 不同浓度亚油酸氧化体系对MP Zeta电位值的影响
Fig.2 The effect of different concentrations of linoleic acid oxidation system on MP Zeta potential
2.1.3 氨基酸分析
氧化处理后MP总氨基酸含量明显少于对照样品(表1)。含硫氨基酸(半胱氨酸和蛋氨酸)和脯氨酸对ROS非常敏感[25],因此,这3种氨基酸含量大幅度下降。同时,脂质过氧化分解产物与赖氨酸共价结合[26],导致赖氨酸含量显著降低。与对照组相比,高亚油酸浓度(20 mmol/L)氧化导致组氨酸减少了17%(P<0.05)。通常,组氨酸残基以质子化形式存在,带有正电荷,且其氧化是羰基形成的原因[27](图3)。组氨酸含量降低使MP失去正电荷,导致肌球蛋白和肌动蛋白丝的净负电荷增加。此外,肽链断裂后的碎片可能会对MP产生额外的电荷[28]。一般认为,净负电荷增加可以提高肉的保水性[6]。
表1 不同浓度的亚油酸氧化体系对MP氨基酸含量的影响 单位:mg/g
Table 1 Effect of different concentration linoleic acid oxidation system on the amino acid content of MP
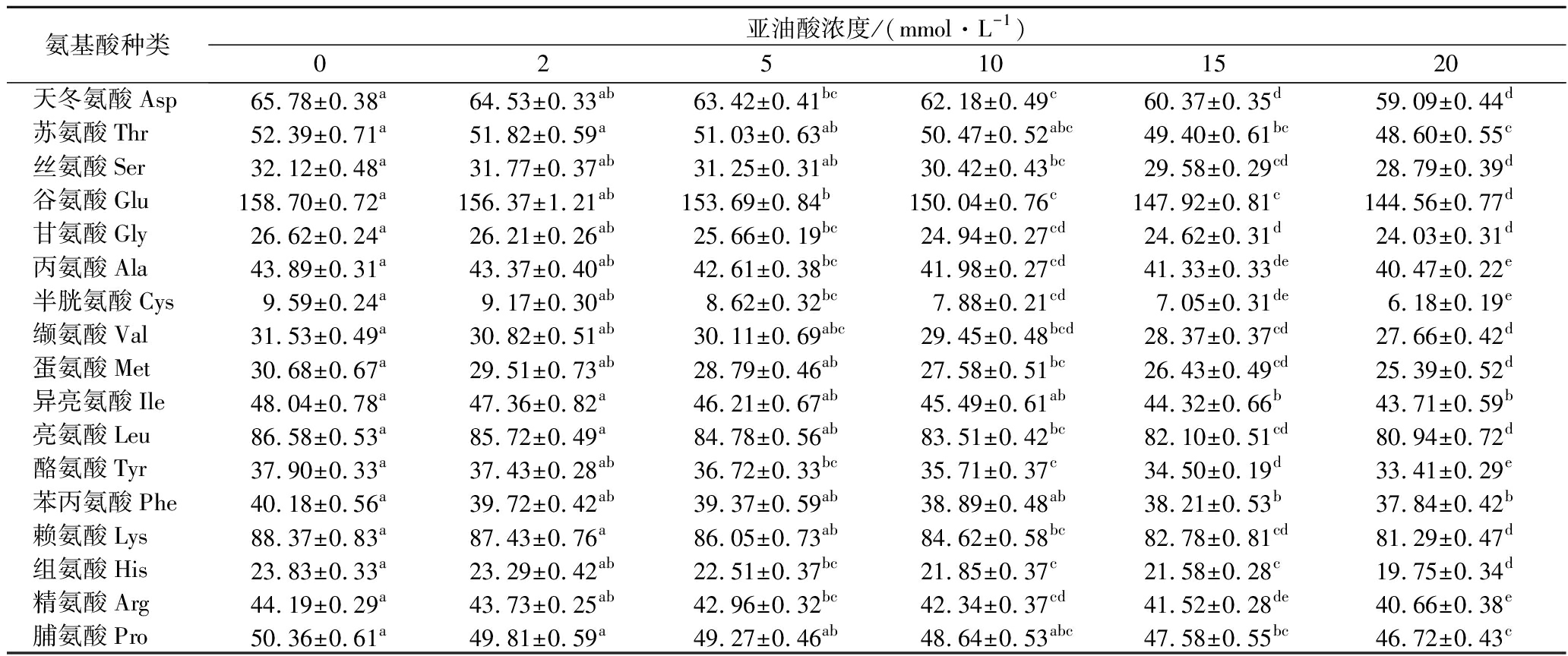
氨基酸种类亚油酸浓度/(mmol·L-1)025101520天冬氨酸Asp65.78±0.38a64.53±0.33ab63.42±0.41bc62.18±0.49c60.37±0.35d59.09±0.44d苏氨酸Thr52.39±0.71a51.82±0.59a51.03±0.63ab50.47±0.52abc49.40±0.61bc48.60±0.55c丝氨酸Ser32.12±0.48a31.77±0.37ab31.25±0.31ab30.42±0.43bc29.58±0.29cd28.79±0.39d谷氨酸Glu158.70±0.72a156.37±1.21ab153.69±0.84b150.04±0.76c147.92±0.81c144.56±0.77d甘氨酸Gly26.62±0.24a26.21±0.26ab25.66±0.19bc24.94±0.27cd24.62±0.31d24.03±0.31d丙氨酸Ala43.89±0.31a43.37±0.40ab42.61±0.38bc41.98±0.27cd41.33±0.33de40.47±0.22e半胱氨酸Cys9.59±0.24a9.17±0.30ab8.62±0.32bc7.88±0.21cd7.05±0.31de6.18±0.19e缬氨酸Val31.53±0.49a30.82±0.51ab30.11±0.69abc29.45±0.48bcd28.37±0.37cd27.66±0.42d蛋氨酸Met30.68±0.67a29.51±0.73ab28.79±0.46ab27.58±0.51bc26.43±0.49cd25.39±0.52d异亮氨酸Ile48.04±0.78a47.36±0.82a46.21±0.67ab45.49±0.61ab44.32±0.66b43.71±0.59b亮氨酸Leu86.58±0.53a85.72±0.49a84.78±0.56ab83.51±0.42bc82.10±0.51cd80.94±0.72d酪氨酸Tyr37.90±0.33a37.43±0.28ab36.72±0.33bc35.71±0.37c34.50±0.19d33.41±0.29e苯丙氨酸Phe40.18±0.56a39.72±0.42ab39.37±0.59ab38.89±0.48ab38.21±0.53b37.84±0.42b赖氨酸Lys88.37±0.83a87.43±0.76a86.05±0.73ab84.62±0.58bc82.78±0.81cd81.29±0.47d组氨酸His23.83±0.33a23.29±0.42ab22.51±0.37bc21.85±0.37c21.58±0.28c19.75±0.34d精氨酸Arg44.19±0.29a43.73±0.25ab42.96±0.32bc42.34±0.37cd41.52±0.28de40.66±0.38e脯氨酸Pro50.36±0.61a49.81±0.59a49.27±0.46ab48.64±0.53abc47.58±0.55bc46.72±0.43c
注:同行字母不同小写字母表示差异显著(P<0.05)
2.2 蛋白质氧化分析
2.2.1 羰基和巯基
蛋白质羰基化可以由多种途径引发并且涉及某些氨基酸残基的损失。通常,这些氨基酸以正电荷形式存在,损失后会增加蛋白质的净负电荷,从而预估蛋白质净电荷改变[29-30]。由图3可知,随着亚油酸浓度的增大,羰基含量由0.44 nmol/mg增加到2.09 nmol/mg,呈现连续上升趋势(P < 0.05),这一结果与JIANG等[9]报道的牛肉MP中羰基含量一致。UTRERA等[30]研究发现蛋白质羰基化与许多功能性指标(溶解度、保水性、起泡性等)相关,可质子化氨基酸的损失会改变MP电荷分布和整体电子排列,引起MP分子间相互作用发生变化,从而影响蛋白质的保水性。
MP中的半胱氨酸巯基在氧化体系中非常敏感,易提取氢原子生成硫中心自由基,从而导致巯基含量降低[12]。由图3可知,与未氧化(0 mmol/L)MP相比,氧化后MP巯基含量显著降低(P<0.05),该值接近于ZHOU等[31]报道的猪肉氧化过程中MP巯基含量。氧化程度越高,被氧化成二硫键的巯基越多,测得的总巯基含量就越少。
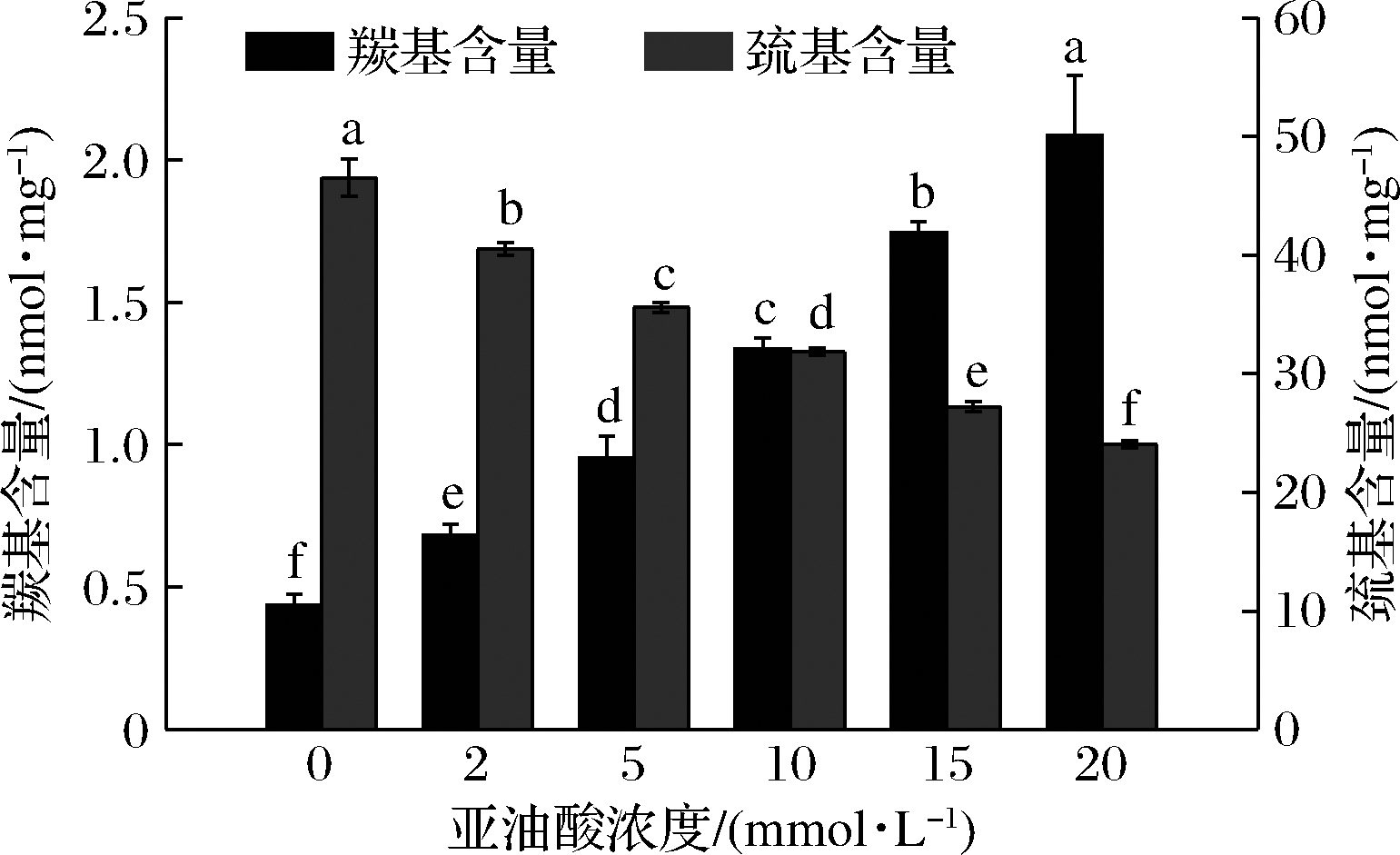
图3 不同浓度亚油酸氧化对MP羰基和巯基含量的影响
Fig.3 Effect of different concentration linoleic acid oxidation on the carbonyl and total sulfhydryl content of MP
2.2.2 表面疏水性
蛋白质表面疏水性是影响蛋白基团表面正负电荷数量和排列方式变化并表征蛋白水合效应和变性程度的重要指标[32]。由图4可知,随着亚油酸浓度的增加(0~10 mmol/L),MP表面疏水性逐渐增加(P<0.05),这一结果反映出疏水基团的暴露有助于增强表面疏水性,从而导致MP构象变化。较高亚油酸浓度(>10 mmol/L)下,MP的表面疏水性降低,这是由于MP之间形成高分子聚集体,部分屏蔽了蛋白解折叠的影响,或破坏了一些非极性氨基酸[7]。这与Zeta电位绝对值的变化趋势一致。SUN等[32]的研究表明,MP轻微氧化暴露疏水基团,并诱导电离基团数量增加,从而导致净负电荷增加,改善保水性。
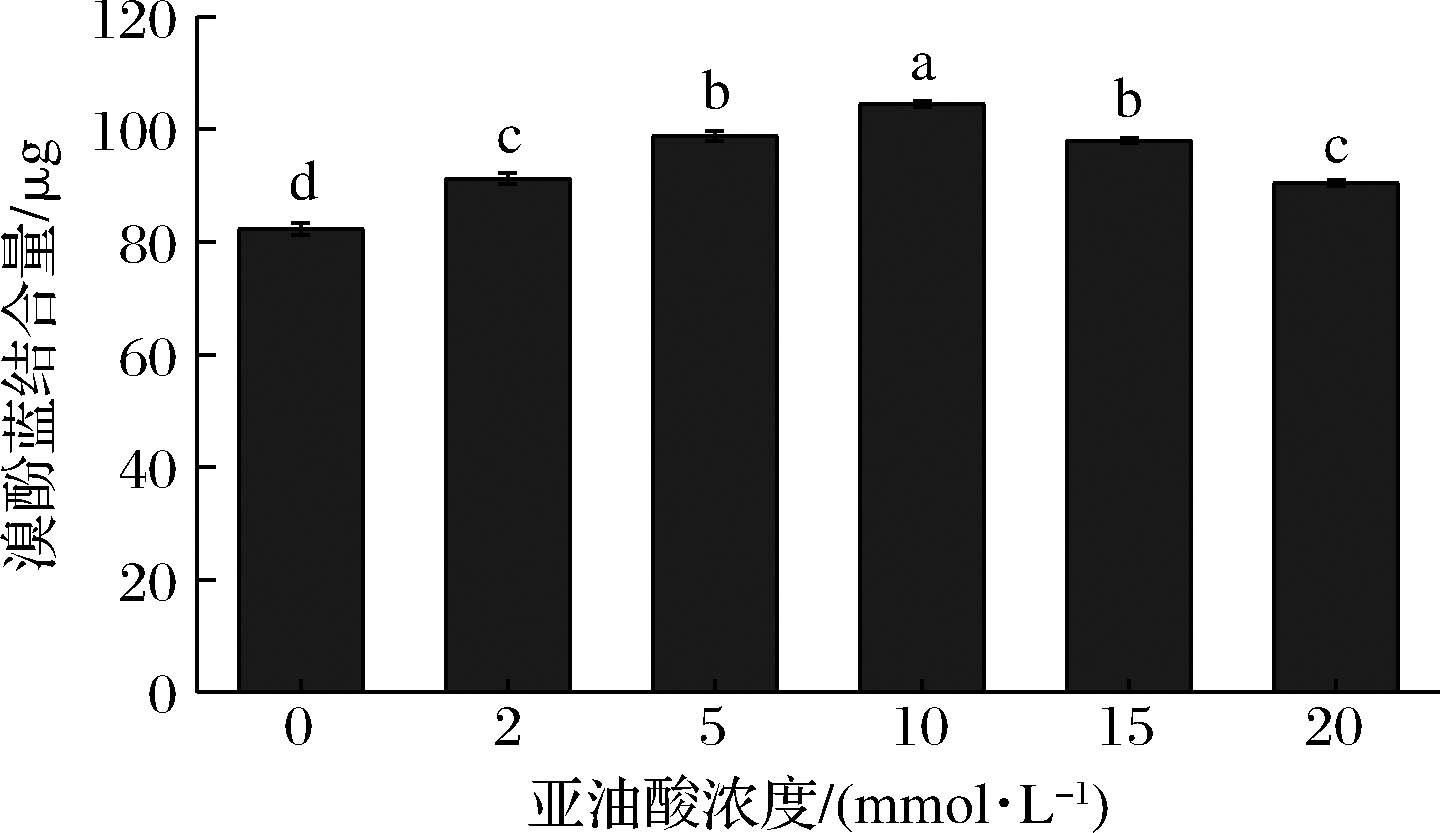
图4 不同浓度亚油酸氧化对MP表面疏水性的影响
Fig.4 Influence of different concentration linoleic acid oxidation on surface hydrophobicity of MP
2.2.3 二级结构分析(傅里叶红外光谱)
亚油酸浓度的增加没有导致红外谱线发生明显的偏移和变化,趋势基本保持一致。由图5分析可知,酰胺I带(1 600~1 700 cm-1)中呈现的二级结构含量变化非常明显。与对照相比,随着氧化剂的增加,α-螺旋和β-折叠含量呈现降低趋势,这意味着MP结构更加松散[20];而无规则卷曲结构显著增加,β-转角含量呈现先少量增加后降低趋势。结果表明,氧化使得羊肉MP的螺旋、折叠之间相互转化,且是有序向无序的转变。这是因为α-螺旋主要由肽链内的氢键稳定,β-折叠主要由肽链间的氢键稳定[33]。随着氧化程度的增加,MP膨胀,分子内氢键减少[34],导致α-螺旋的破坏和通过肽链间氢键稳定的β-折叠的形成,继而使β-转角和无规则卷曲结构在蛋白发生解折叠后形成。本试验结果与SUN等[32]报道的氧化猪肉MP中,α-螺旋变化趋势一致。

图5 不同浓度的亚油酸氧化对MP二级结构的影响
Fig.5 The effect of different concentrations of linoleic acid oxidation on the secondary structure of MP
2.2.4 内源荧光强度
蛋白质结构的变化可以通过内源荧光强度反映。由图6可知,当在295 nm激发波长时,MP 的色氨酸最大荧光发射波长(λmax)接近335 nm。随着亚油酸浓度的增加,荧光强度逐渐下降。这与GAN等[35]的研究结果类似。色氨酸荧光的损失可能是由于色氨酸残基被破坏或蛋白质的展开将色氨酸暴露在亲水性的环境中,因而导致荧光的淬灭[36]。上述结果与酪氨酸含量的变化趋势一致(表1)。因此,亚油酸氧化会降低色氨酸荧光强度,色氨酸残基暴露于更亲水的环境,从而导致MP构象变化。
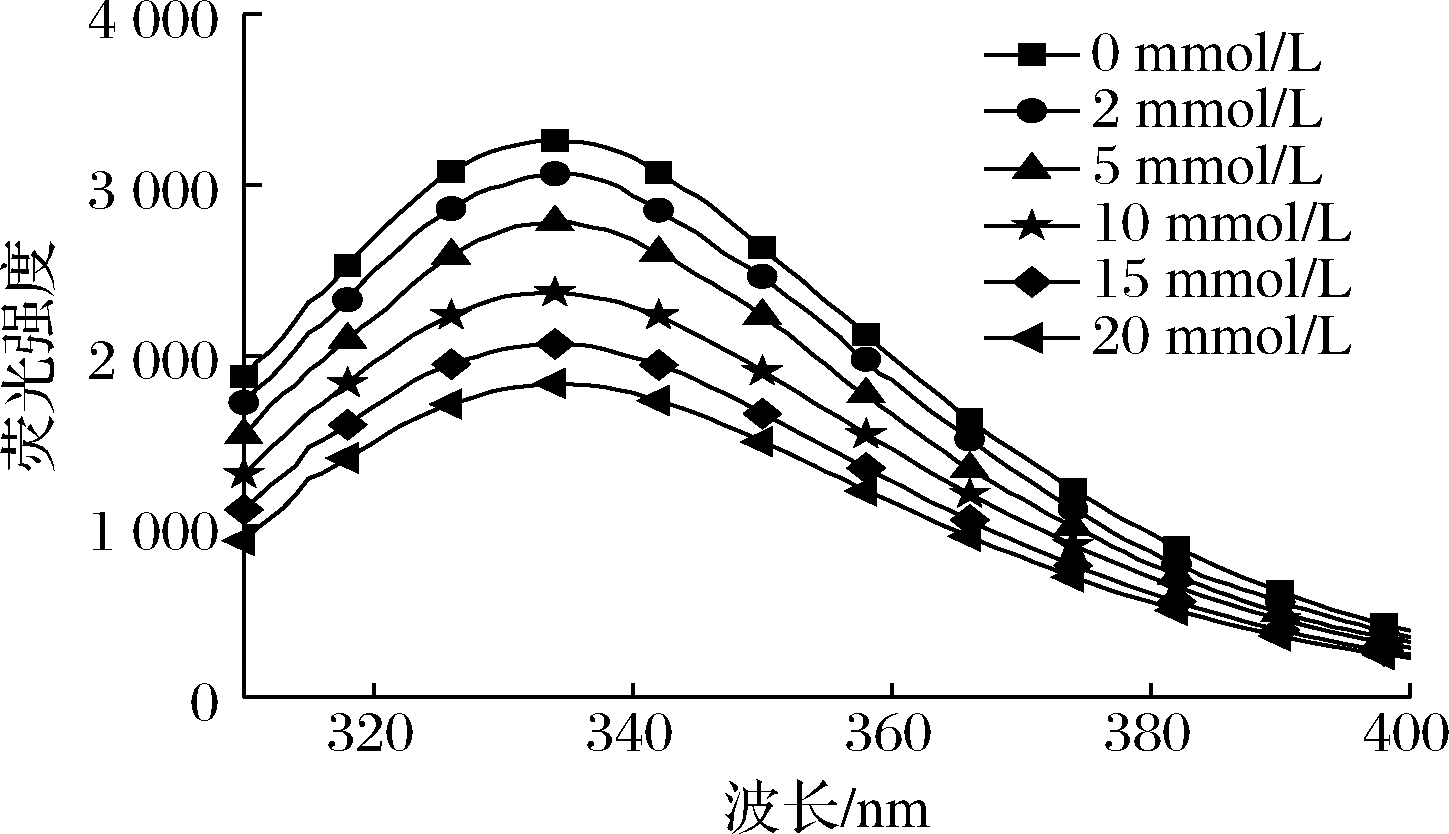
图6 不同浓度的亚油酸氧化对MP荧光强度的影响
Fig.6 The effect of different concentrations of linoleic acid oxidation on the fluorescence intensity of MP
2.2.5 SDS-PAGE
SDS-PAGE能够直观地反映蛋白亚基间发生的聚集、断裂或降解等情况。在不含有β-巯基乙醇的情况下(非还原条件,图7-A),MP肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白(actin)条带浓度随着亚油酸浓度的增加逐渐变浅,同时浓缩胶顶端条带变深,这说明氧化促进MHC和actin间的交联和聚集,使得MP分子质量过大而不能进入浓缩胶。在含有β-巯基乙醇的情况下(还原条件,图7-B),大部分消失的MP组分逐渐复原,表明MP聚合物通过二硫键促进蛋白质交联。该结果与总巯基含量变化趋势相一致。然而,图7-B仍然可以观察到浓缩胶顶端有聚合物堆积,这表明非蛋白质二硫键也参与了蛋白质交联。一方面,脂质氧化可通过多种途径引起蛋白质交联,如色氨酸-色氨酸交联和二聚酪氨酸交联等[37-38];另一方面,氧化激活了μ-钙蛋白酶等内源酶,使肌球蛋白重链和肌动蛋白降解为分子质量更小的蛋白。ZENG等[39]的研究表明蛋白质降解是引起MP肿胀的重要因素,从而影响MP的保水性。
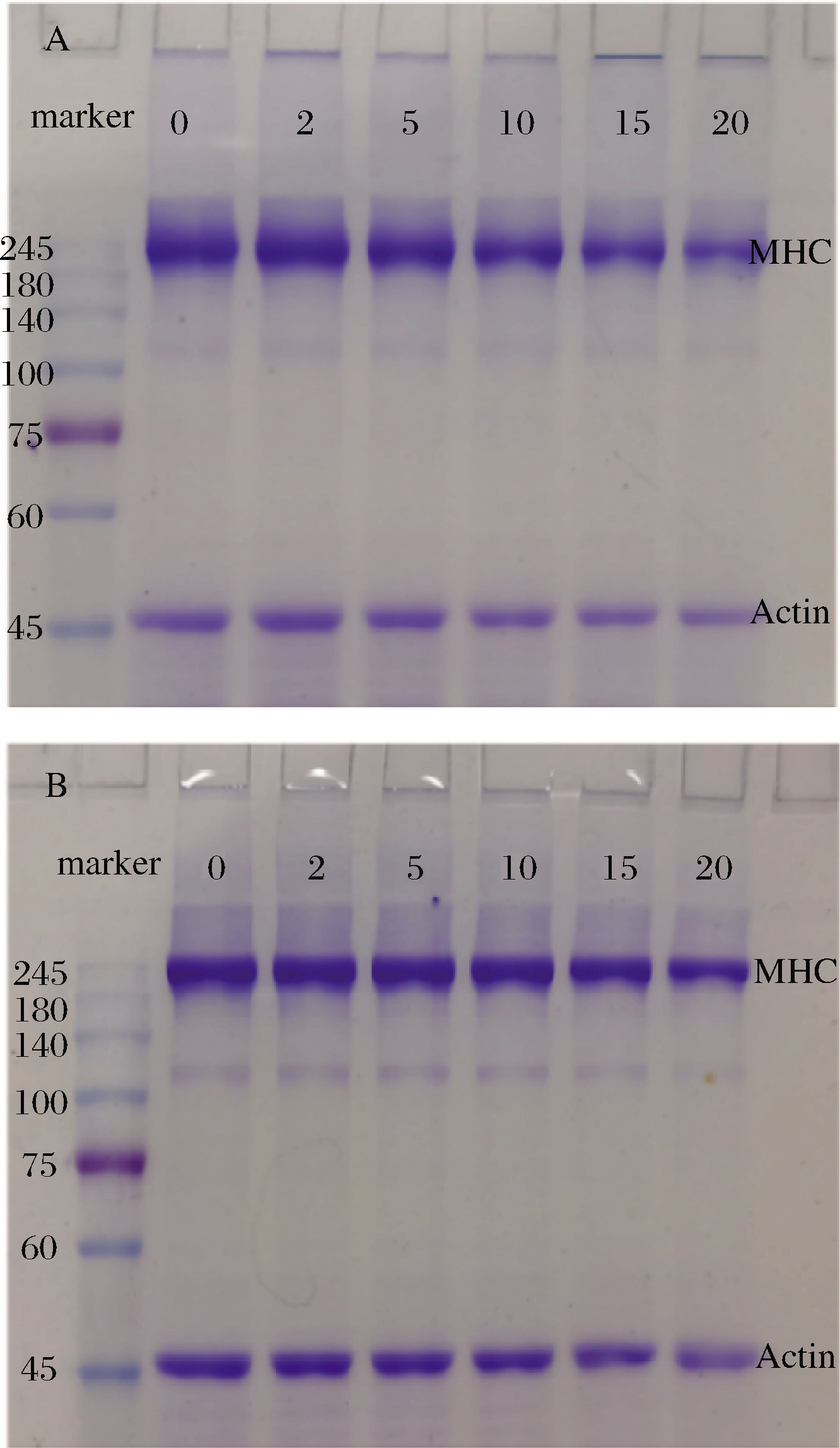
A-非还原条件;B-还原条件
图7 不同浓度的亚油酸氧化对MP在非还原和 还原条件下SDS-PAGE的影响
Fig.7 Influence of different concentration of linoleic acid oxidation on SDS-PAGE of MP in the absence of β-ME and in the presence of β-ME
3 结论
本研究采用不同浓度的亚油酸对黑山羊MP进行氧化,以探究不同程度的氧化修饰对羊肉MP电荷水平、结构变化的影响。研究证明,MP氧化会导致结构和电荷总量的改变,从而改变MP和水分子间的相互作用[40](图8)。随着亚油酸浓度升高,氧化加剧,巯基含量显著降低,进而导致MP二级结构之间发生转化。其中,α-螺旋结构遭到破坏,无规则卷曲结构形成,MP结构趋向于不稳定。MP表面疏水性先升高后降低,水合效应增强。氧化后带电氨基酸含量均有一定程度的下降,组氨酸侧链被羰基化,正电荷减少,羰基含量显著升高,因此MP中的净负电荷随着氧化而增加。低浓度氧化(5 mmol/L)条件下,促进因子占据主导地位,净负电荷的升高使蛋白与水的相互作用力增强,有助于改善肉蛋白的保水性;而高浓度氧化(10 mmol/L)条件下,抑制因子占据主导地位,蛋白结构剧烈变化导致的蛋白质交联和聚集使得MP的保水性降低。由此可见,亚油酸对黑山羊MP的氧化修饰会导致蛋白表面电荷及深层结构的变化,进而影响MP的保水性。
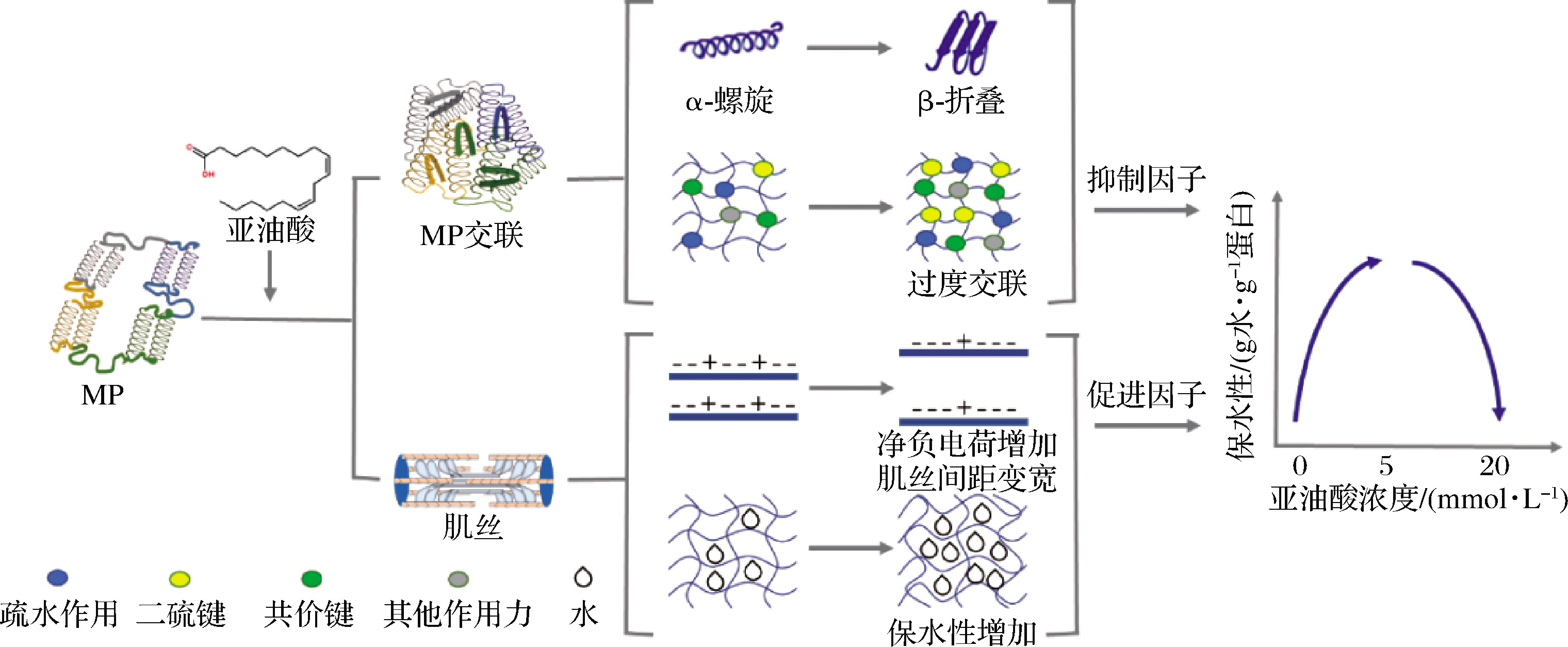
图8 亚油酸氧化介导的MP保水性机理
Fig.8 Mechanism of MP water-holding mediated by linoleic acid oxidation
[1] 刘广娟, 徐泽权, 邢世均, 等.磷酸盐对PSE猪肉食用品质和微观结构的影响 [J].中国农业科技导报, 2021, 23(3):114-121.
LIU G J, XU Z Q, XING S J, et al.Effect of phosphate on eating quality and microstructure of PSE pork [J].Journal of Agricultural Science and Technology, 2021, 23(3):114-121.
[2] BERTRAM H C, KRISTENSEN M, ØSTDAL H, et al.Does oxidation affect the water functionality of myofibrillar proteins? [J].Journal of Agricultural and Food Chemistry, 2007, 55(6):2 342-2 348.
[3] BAO Y L, BOEREN S, ERTBJERG P.Myofibrillar protein oxidation affects filament charges, aggregation and water-holding [J].Meat Science, 2018, 135:102-108.
[4] ZHANG D, LI H J, EMARA A M, et al.Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles [J].Food Chemistry, 2020, 315:126226.
[5] WANG Z M, HE Z F, EMARA A M, et al.Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat [J].Food Chemistry, 2019, 288:405-412.
[6] BAO Y L, ERTBJERG P.Effects of protein oxidation on the texture and water-holding of meat:A review [J].Critical Reviews in Food Science and Nutrition, 2018, 59(22):3 564-3 578.
[7] ZHANG W G, XIAO S, AHN D U.Protein oxidation:Basic principles and implications for meat quality [J].Critical Reviews in Food Science and Nutrition, 2013, 53(11):1 191-1 201.
[8] 王兆明, 贺稚非, 李洪军.脂质和蛋白质氧化对肉品品质影响及交互氧化机制研究进展 [J].食品科学, 2018, 39(11):295-301.
WANG Z M, HE Z F, LI H J.A review of the effect of lipid and protein oxidation on meat quality and their interrelationship [J].Food Science, 2018, 39(11):295-301.
[9] JIANG Y, LI D H, TU J C, et al.Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation:The role of protein unfolding and cross-linking [J].Food Chemistry, 2021, 344:128587.
[10] 杨玉玲, 周磊, 游远, 等.氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响 [J].中国农业科学, 2018, 51(18):3 570-3 581.
YANG Y L, ZHOU L, YOU Y, et al.The effects of oxidation on textural properties and water holding capacity of heat-induced myofibrillar protein gel [J].Scientia Agricultura Sinica, 2018, 51(18):3 570-3 581.
[11] WANG S P, WANG W J, WANG X R, et al.Physicochemical properties and eating quality of lamp meat of Dazu black goats [J].Animal Husbandry and Feed Science.2010, 2(S1):22-25.
[12] KIM H J, KIM H J, JANG A.Nutritional and antioxidative properties of black goat meat cuts [J].Asian-Australasian Journal of Animal Sciences, 2019, 32(9):1 423-1 429.
[13] AGHWAN Z A, ALIMON A R, GOH Y M, et al.Fatty acid profiles of supraspinatus, longissimus lumborum and semitendinosus muscles and serum in kacang goats supplemented with inorganic selenium and iodine [J].Asian-Australasian Journal of Animal Sciences, 2014, 27(4):543-550.
[14] OFFER G, TRINICK J.On the mechanism of water holding in meat:The swelling and shrinking of myofibrils[J].Meat Science, 1983, 8(4):245-281.
[15] PENG Z Y, ZHU M M, ZHANG J, et al.Physicochemical and structural changes in myofibrillar proteins from porcine longissimus dorsi subjected to microwave combined with air convection thawing treatment [J].Food Chemistry, 2021, 343:128412.
[16] CAI L Y, NIAN L Y, ZHAO G H, et al.Effect of herring antifreeze protein combined with chitosan magnetic nanoparticles on quality attributes in red sea bream (Pagrosomus major) [J].Food and Bioprocess Technology, 2019, 12(3):409-421.
[17] LEVINE R L, WILLIAMS J A, STADTMAN E P, et al.Carbonyl assays for determination of oxidatively modified proteins [J].Methods in Enzymology, 1994, 233:346-357.
[18] WANG Z M, HE Z F, GAN X, et al.Effect of peroxyl radicals on the structure and gel properties of isolated rabbit meat myofibrillar proteins [J].International Journal of Food Science & Technology, 2018, 53(12):2 687-2 696.
[19] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination [J].Meat Science, 2006, 74(4):681-683.
[20] ZHOU F B, ZHAO M M, SU G W, et al.Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress [J].Food Hydrocolloids, 2014, 40:153-162.
[21] CAO Y G, XIONG Y L.Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein [J].Food Chemistry, 2015, 180:235-243.
[22] LIU Z L, XIONG Y L, CHEN J.Protein oxidation enhances hydration but suppresses water-holding capacity in porcine longissimus muscle [J].Journal of Agricultural and Food Chemistry, 2010, 58(19):10 697-10 704.
[23] CEYLAN Z, UNAL SENGOR G F, ![]() O, et al.A novel approach to extend microbiological stability of sea bass (Dicentrarchus labrax) fillets coated with electrospun chitosan nanofibers [J].LWT-Food Science and Technology, 2017, 79:367-375.
O, et al.A novel approach to extend microbiological stability of sea bass (Dicentrarchus labrax) fillets coated with electrospun chitosan nanofibers [J].LWT-Food Science and Technology, 2017, 79:367-375.
[24] 张海璐, 黄翔, 杨燃, 等.氧化对羊肉肌原纤维蛋白分子与理化特性的影响 [J].食品科学, 2020, 41(23):8-14.
ZHANG H L, HUANG X, YANG R, et al.Effect of oxidation on molecular and physicochemical properties of mutton myofibrillar protein [J].Food Science, 2020, 41(23):8-14.
[25] DAVIES K J A.Degradation of oxidized proteins by the 20S proteasome [J].Biochimie, 2001, 83(3-4):301-310.
[26] REQUENA J R, FU M X, AHMED M U, et al.Quantification of malondialdehyde and 4-hydroxynonenal adducts to lysine residues in native and oxidized human low-density lipoprotein [J].The Biochemical Journal, 1997, 322:317-325.
[27] CAO J X, ZHOU C Y, WANG Y, et al.The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle [J].Food Chemistry, 2018, 240:346-353.
[28] ZHANG D, LI H J, WANG Z F, et al.Effects of in vitro oxidation on myofibrillar protein charge, aggregation, and structural characteristics [J].Food Chemistry, 2020, 332:127 396.
[29] STADTMAN E R, LEVINE R L.Free radical-mediated oxidation of free amino acids and amino acid residues in proteins [J].Amino Acids, 2003, 25(3-4):207-218.
[30] UTRERA M, ESTéVEZ M.Oxidation of myofibrillar proteins and impaired functionality:Underlying mechanisms of the carbonylation pathway [J].Journal of Agricultural and Food Chemistry, 2012, 60(32):8 002-8 011.
[31] ZHOU F B, ZHAO M M, CUI C, et al.Influence of linoleic acid-induced oxidative modifications on physicochemical changes and in vitro digestibility of porcine myofibrillar proteins [J].LWT - Food Science and Technology, 2015, 61(2):414-421.
[32] SUN W Z, ZHOU F B, SUN D W, et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins [J].Food and Bioprocess Technology, 2013, 6(7):1 703-1 712.
[33] ZHANG Z Y, YANG Y L, ZHOU P, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein [J].Food Chemistry, 2017, 217:678-686.
[34] BAO Z J, WU J P, CHENG Y, et al.Effects of lipid peroxide on the structure and gel properties of ovalbumin [J].Process Biochemistry, 2017, 57:124-130.
[35] GAN X, LI H J, WANG Z M, et al.Does protein oxidation affect proteolysis in low sodium Chinese traditional bacon processing? [J].Meat Science, 2019, 150:14-22.
[36] WANG Z M, HE Z F, GAN X, et al.The effects of lipid oxidation product acrolein on the structure and gel properties of rabbit meat myofibrillar proteins [J].Food Biophysics, 2018, 13(4):374-386.
[37] PAVIANI V, GALDINO G, DOS PRAZERES J, et al.Ditryptophan cross-links as novel products of protein oxidation [J].Journal of the Brazilian Chemical Society, 2018, 29(5):925-933.
[38] SEGAT A, MISRA N N, FABBRO A, et al.Effects of ozone processing on chemical, structural and functional properties of whey protein isolate [J].Food Research International, 2014, 66:365-372.
[39] ZENG Z, LI C, ERTBJERG P.Relationship between proteolysis and water-holding of myofibrils [J].Meat Science, 2017, 131:48-55.
[40] ESTÉVEZ M, VENTANAS S, HEINONEN M, et al.Protein carbonylation and water-holding capacity of pork subjected to frozen storage:Effect of muscle type, premincing, and packaging [J].Journal of Agricultural and Food Chemistry, 2011, 59(10):5 435-5 443.