近几年来,食品中生物性污染问题一直被广泛关注。真菌毒素与食品污染息息相关,其中黄曲霉毒素B1(aflatoxin B1,AFB1)是真菌毒素中较为常见的一种,主要由丝状真菌黄曲霉产生[1]。1993年黄曲霉毒素(aflatoxins,AFs)被国际癌症机构归为I类致癌物质[2]。调查显示,2015—2018年国家市场监督管理局报道我国因真菌毒素污染引起的事件高达602起;在此期间我国出口的食品及饲料中真菌毒素超标事件达241起[3]。食品经黄曲霉污染没有简便可行的脱毒措施[4],为延长食品的保质期,保障食品安全,人们主要采用生物脱毒法、物理法、化学法灭活有毒有害微生物,延缓或阻止它的生长[5]。添加防腐剂是最常见的方法,如常见的山梨酸钾(potassium sorbate,PS)、苯甲酸钠、双乙酸钠等,这些防腐剂或多或少都会对人体健康产生一定的副作用[6],因而使得许多科研人员对天然安全的抗菌物质更为关注。
抗菌肽(antimicrobial peptides,AMPs)是一类广泛存在于微生物、动植物及人体内的小分子多肽,其抗菌谱广,具有热稳定性好、不易产生耐药性、易被人体消化吸收、无毒等优点[7]。近年来抗菌肽在食品领域逐渐成为研究热点并取得了一定的成果[8]。从鱼类中分离的抗菌肽Pleurocidin和鱼精蛋白,均对单核细胞增生李斯特菌和其他食品腐败微生物具有抑制活性,可用于食品保藏[9]。TENEA等[10]从植物乳杆菌UTNGt2中提取的抗菌肽能抑制番茄中的沙门氏菌,延长番茄的保质期,显示了其潜在的防腐潜力。国内外公认的天然防腐剂——乳酸菌素Nisin是食物防腐保鲜剂的最佳选择之一[11]。这些都提示了抗菌肽在食品防腐保鲜中有较大的应用市场价值。
AMP-17是课题组采用原核表达体系获得的重组蛋白,实验证实其具有显著的抗菌作用,特别是对白色念珠菌等真菌具有较强的抗菌活性,且热稳定性强,耐反复冻融,安全性较好,对人和鼠红细胞基本没有溶血性[12-13]。另外还发现AMP-17能延长草莓的保质期,起到保鲜作用[14]。但AMP-17对黄曲霉的生长和产毒有无影响还不得而知。故本研究拟探讨AMP-17对食源性真菌黄曲霉的抗菌效果,分析其对黄曲霉菌丝、孢子、产毒等方面的影响,研究结果为进一步了解AMP-17的功能,研发安全有效的抗菌肽类防腐剂提供一定的实验依据。
1 材料与方法
1.1 实验菌株
黄曲霉菌株(Aspergillus flavus link)由贵州医科大学食品科学学院微生物实验室提供。
1.2 培养基
马铃薯葡萄糖液体(potato dextrose broth medium,PDB)培养基、马铃薯葡萄糖固体(potato dextrose agar,PDA)培养基,北京索莱宝科技有限公司。
1.3 试剂与仪器
磷酸盐缓冲盐溶液,北京索莱宝科技有限公司;细胞滤网(40 μm),安徽Biosharp公司;AFB1酶联免疫检测试剂盒,上海佑隆生物科技有限公司;PS(纯度>99%)、吐温-80,大连美仑生物技术有限公司。
HVE-50型灭菌锅,日本ALR公司;X30R冷冻高速离心机,美国BECKMAN公司;SPX-150B-Z型生化培养箱,上海博讯医疗生物仪器股份有限公司;IMARK酶标仪,美国BIO-RAD公司;YS100普通光学显微镜,日本Nikon公司;SW-CJ-1D型超净工作台,江苏净化设备有限公司;AL104-IC电子天平,上海梅特勒拖利多仪器公司;HITACHI S-3400 N扫描电镜,日本HITACHI公司。
1.4 实验方法
1.4.1 黄曲霉孢子悬液制备
参照BEN TAHEUR等[15]方法并做适当修改。取出适量黄曲霉甘油菌,接种到PDA培养基上,于28 ℃温箱培养7 d,吐温-80洗脱固体培养基上的黄曲霉,200 r/min振荡30 min,收集处理后的洗脱溶液,医用纱布过滤,于冷冻离心机离心后,重复加入无菌水3~5次,得到孢子沉淀物,在将沉淀物重悬在无菌水中,于-80 ℃保存备用。
1.4.2 AMP-17的制备
参考杨隆兵等[16]方法操作获得抗菌肽AMP-17。
1.4.3 AMP-17对黄曲霉最低抑菌浓度的测定
采用微量液体稀释法检测AMP-17对黄曲霉的最低抑菌浓度(minimum inhibitory concentration,MIC)[17]。在96孔板中加入100 μL黄曲霉孢子悬液(1.0×104CFU/mL),再加入一定浓度AMP-17,使其终质量浓度为6.25~100 μg/mL。同时以加等体积的无菌水为阴性对照组、100 μg/mL PS为阳性对照组,只加PDB培养液的为空白对照组(下同)。于28 ℃ 恒温培养箱内放置2 d后,肉眼观察清澈透明的孔所对应的药物浓度即为MIC。
1.4.4 AMP-17对黄曲霉生长曲线的影响
于96孔板中加入孢子悬液及不同浓度AMP-17,置28 ℃培养箱中56 h,每隔8 h检测630 nm的吸光度值。以时间为X轴,吸光度为Y轴,绘制黄曲霉生长曲线。
1.4.5 AMP-17对黄曲霉孢子萌发率的影响
将100 μL不同浓度 AMP-17与黄曲霉孢子悬浮液等体积加入96孔板,放置在28 ℃恒温培养箱24 h后,取适量菌液充入血球计数板观察并计算孢子萌发率。根据公式(1)计算孢子萌发率[18]。
孢子萌发率![]()
(1)
式中:n1为萌芽孢子数,n2总孢子数。
1.4.6 AMP-17对黄曲霉菌丝干重的测定
按照王同等[19]的方法,于20 mL PDB中加入黄曲霉孢子悬液,置28 ℃,150 r/min培养10 h,待孢子完全萌发后,加入不同浓度的AMP-17,同时加入适量吐温-80,继续培养5 d,纱布过滤,菌丝体烘干称重,并按照公式(2)计算AMP-17对菌丝生长的抑制率。
抑制率![]()
(2)
式中:m1为阴性组菌丝干重,g;m2为实验组菌丝干重,g。
1.4.7 AMP-17对黄曲霉产AFB1的影响
参考徐杨玉等[20]的方法,将孢子悬液和AMP-17加到10 mL的PDB中,使APM-17终质量浓度为25~100 μg/mL。于28 ℃恒温摇床中,180 r/min培养10 d。根据AFB1快速检测试剂盒提供的方法,采用酶联免疫法对其毒素积累进行定量分析,判断AFB1积累量。
1.4.8 扫描电镜观察AMP-17对黄曲霉形态的影响
制备黄曲霉电镜标本:将浓度为1×106CFU/mL黄曲霉孢子悬液与50 μg/mL AMP-17混合,取0.2 mL 混合液于PDA培养基上均匀涂布,无菌盖玻片与培养基水平面45°角插入培养皿中;使得盖破片与培养基平面接触面积最大。将PDA培养基置于37 ℃ 恒温培养箱培养48 h后。取爬满黄曲霉菌丝的盖破片,用2.5%戊二醛固定过夜[21]。经不同浓度的乙醇逐级脱水后,将样品放入临界点干燥器内,干燥后的标本置于高真空蒸发器中,离子喷溅仪喷金后,用S-3400 N扫描电镜上机观察。
1.4.9 数据处理及统计学分析
以上实验每组均处理3个重复,实验重复3次。应用GraphPad Prism 8.0统计软件分析处理结果,计量资料以均数±标准差表示,组间差异比较采用单因素方差分析,Tukey′s多重比较分析统计学差异。P<0.05为差异有统计学意义。
2 结果与分析
2.1 最低抑菌浓度
本实验以常用的防腐剂PS作阳性药物,结果显示,AMP-17质量浓度≥50 μg/mL的孔内清澈透明,即其对黄曲霉的MIC为50 μg/mL。而山梨酸钾的MIC大于最高质量浓度100 μg/mL,提示抗菌肽AMP-17对黄曲霉的抑制效果比山梨酸钾更为显著。
2.2 生长曲线
前24 h各组黄曲霉生长速率都较慢,24 h后吸光度值逐渐增高,而低浓度的AMP-17组生长速度亦较快,12.5 μg/mL组与阴性对照生长曲线基本一致。当AMP-17质量浓度≥50 μg/mL后,生长曲线近乎一条直线,吸光度值无明显增加,提示在此浓度下黄曲霉生长受到明显抑制(图1)。
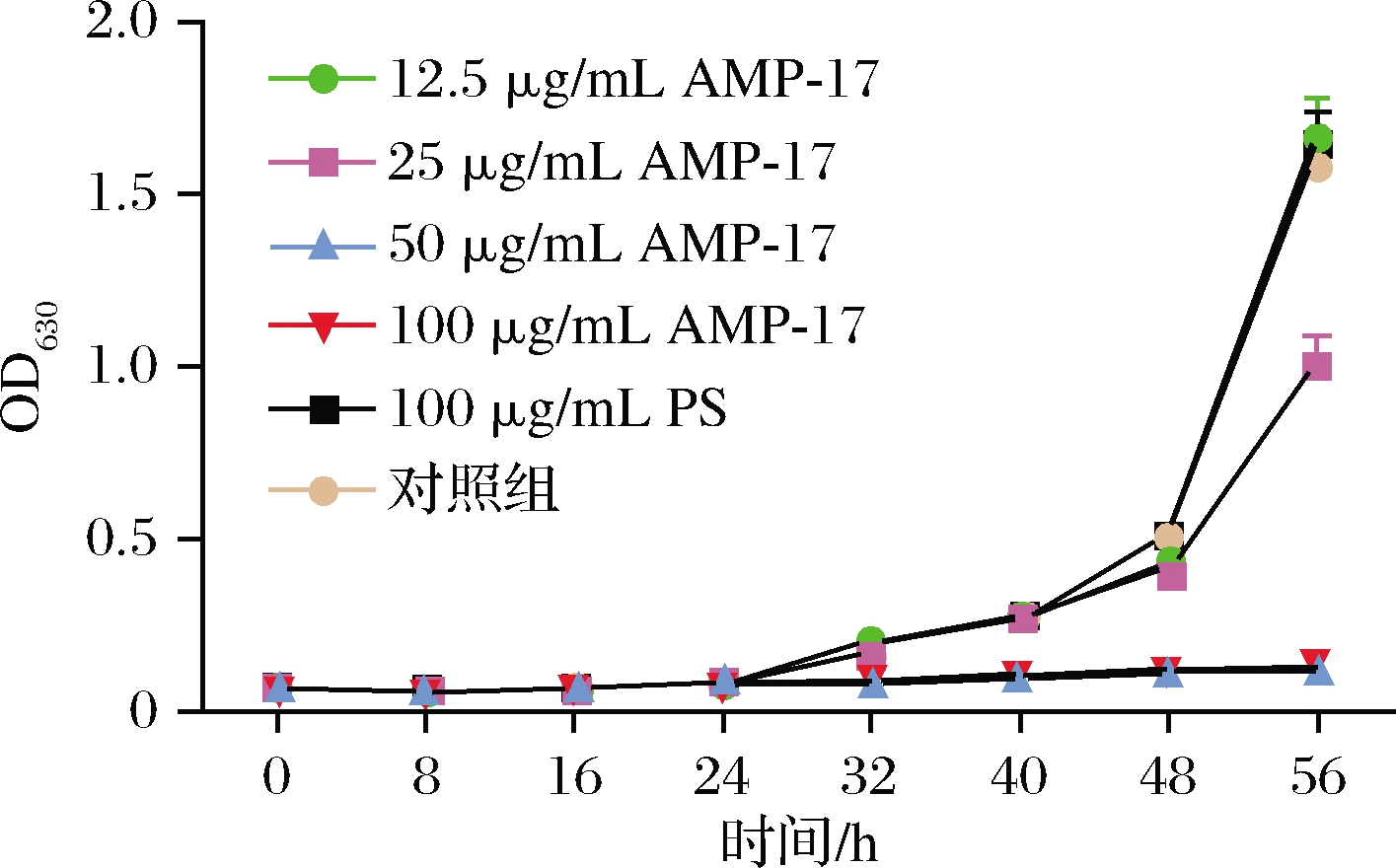
图1 黄曲霉生长曲线
Fig.1 Growth curve of A.flavus
2.3 黄曲霉孢子萌发率
培养24 h后,镜下观察到对照组黄曲霉孢子萌发较好,萌发率达94%,经AMP-17作用后,各组萌发率均明显降低,25 μg/mL AMP-17处理后萌发率为16.3%,50 μg/mL组萌发率仅为8%(图2)。提示AMP-17对黄曲霉的孢子萌发具有较强的抑制作用。
2.4 对黄曲霉菌丝生长的影响
黄曲霉菌丝体干重可以反映黄曲霉的生长情况,与对照组相比,菌丝体干重越小,说明抑制作用越显著。图中对照组黄曲霉形成较多且体积较大的菌丝球,随着AMP-17作用浓度的增大,菌丝球的数量越来越少,体积也逐渐减小(图3-A),50 μg/mL AMP-17的菌丝体干重约为0.004 67 g,提示对菌丝体抑制率达72.5%(图3-B)。令人惊奇的是,经PS干预5 d后反而促进了黄曲霉菌丝体的形成(P<0.01),但在24 h时山梨酸钾对黄曲霉孢子萌发有明显抑制作用,猜测山梨酸钾主要是在前期抑制黄曲霉孢子的萌发,但随着培养时间的延长,山梨酸钾对黄曲霉的抑制能力下降并促进菌丝的生长发育。
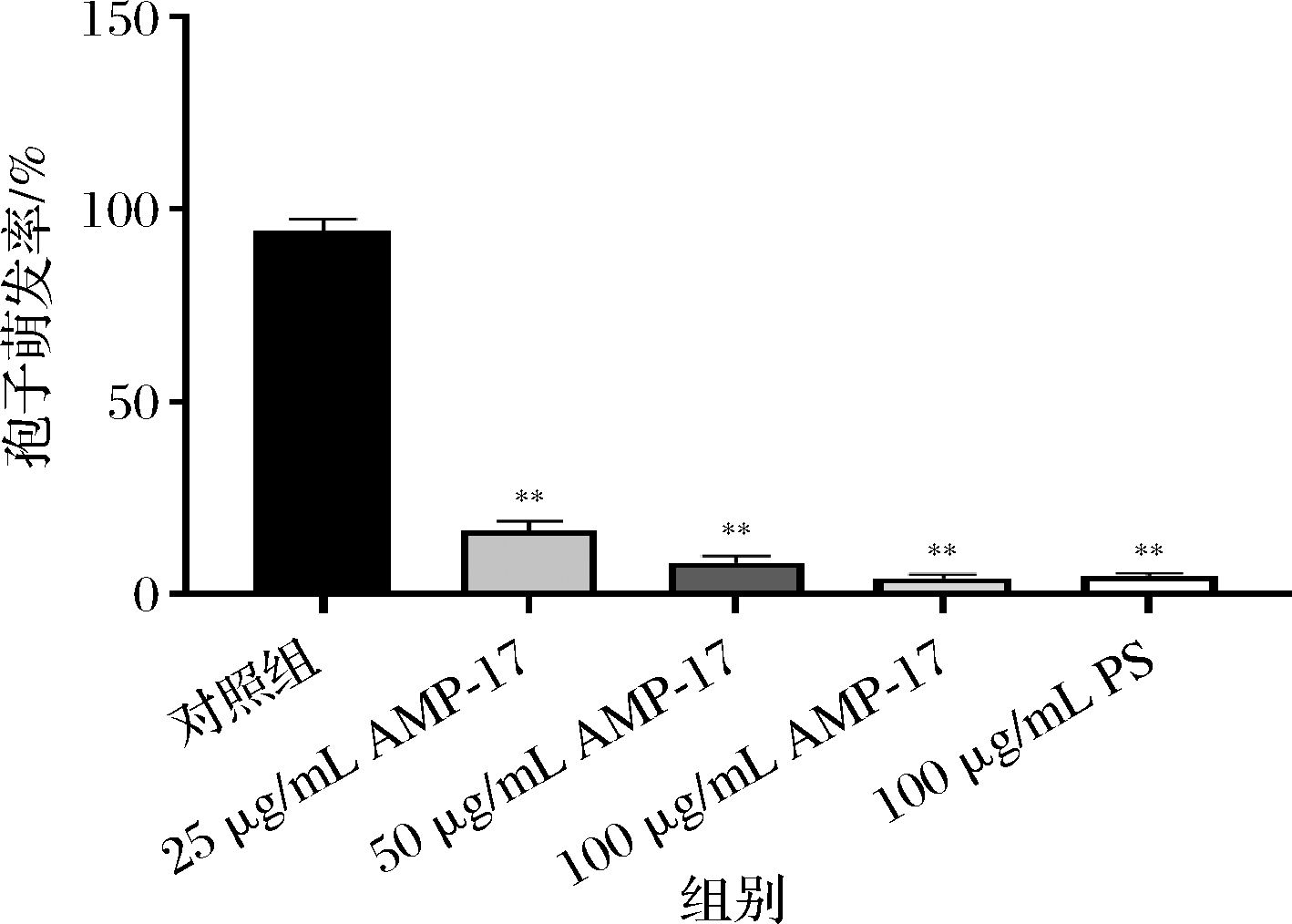
图2 AMP-17对黄曲霉孢子萌发率的影响
Fig.2 Effect of AMP-17 on spore germination rate of A.flavus 注:与对照组比较,*表示P<0.05,**表示P<0.01(下同)
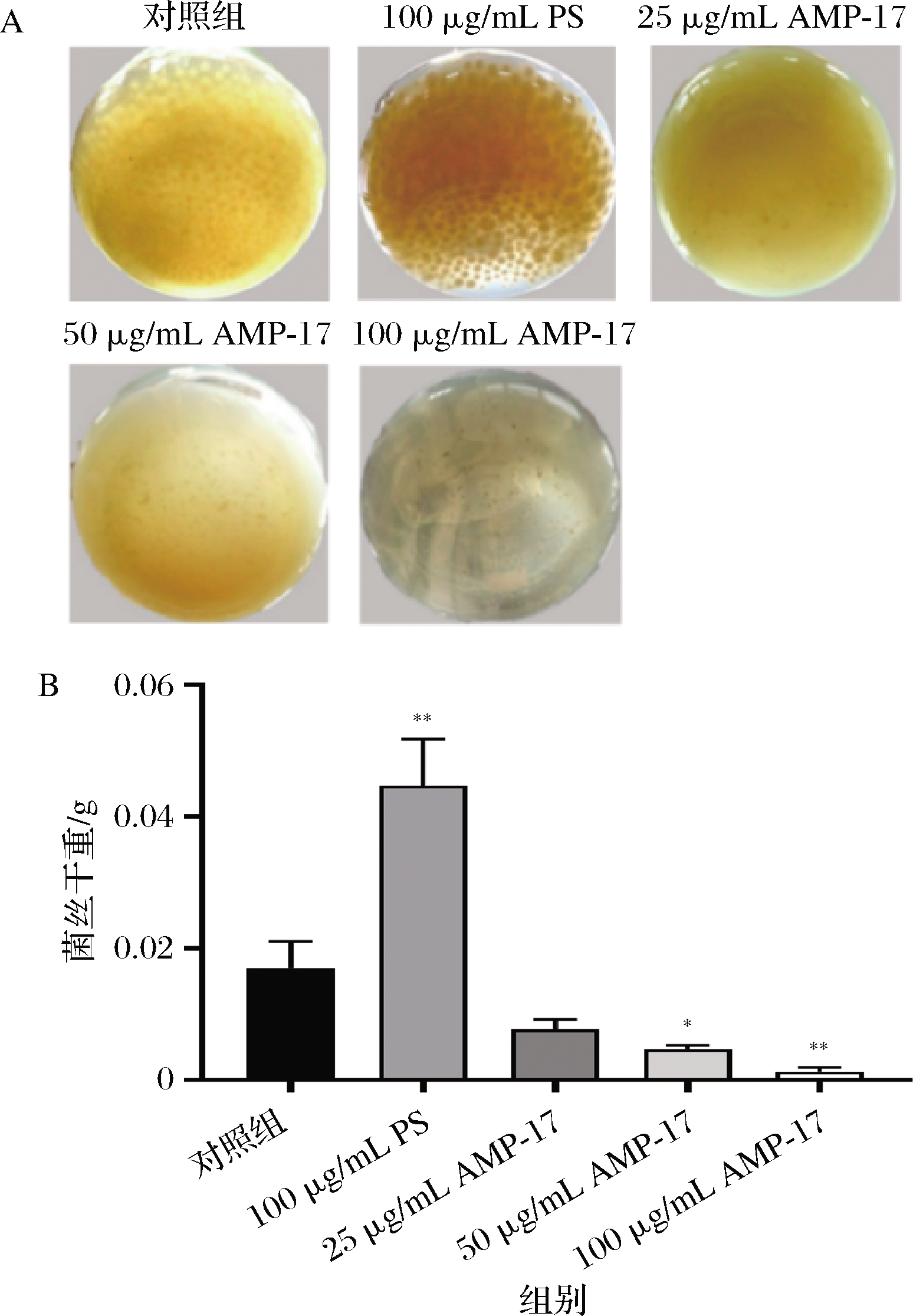
A-AMP-17对黄曲霉菌丝球形成的影响;B-AMP-17对 黄曲霉菌体生长的影响
图3 AMP-17对黄曲霉菌丝生长的影响
Fig.3 Effect of AMP-17 on the mycelium growth of A.flavus
2.5 对黄曲霉产AFB1的影响
对照组AFB1的量高达2.189 ng/mL,而25 μg/mL的AMP-17作用后产毒量显著降低,只有0.056 ng/mL;质量浓度为100 μg/mL时,毒素仅有0.020 ng/mL。而PS则促进了黄曲霉产毒(图4)。说明AMP-17能显著抑制黄曲霉合成AFB1。
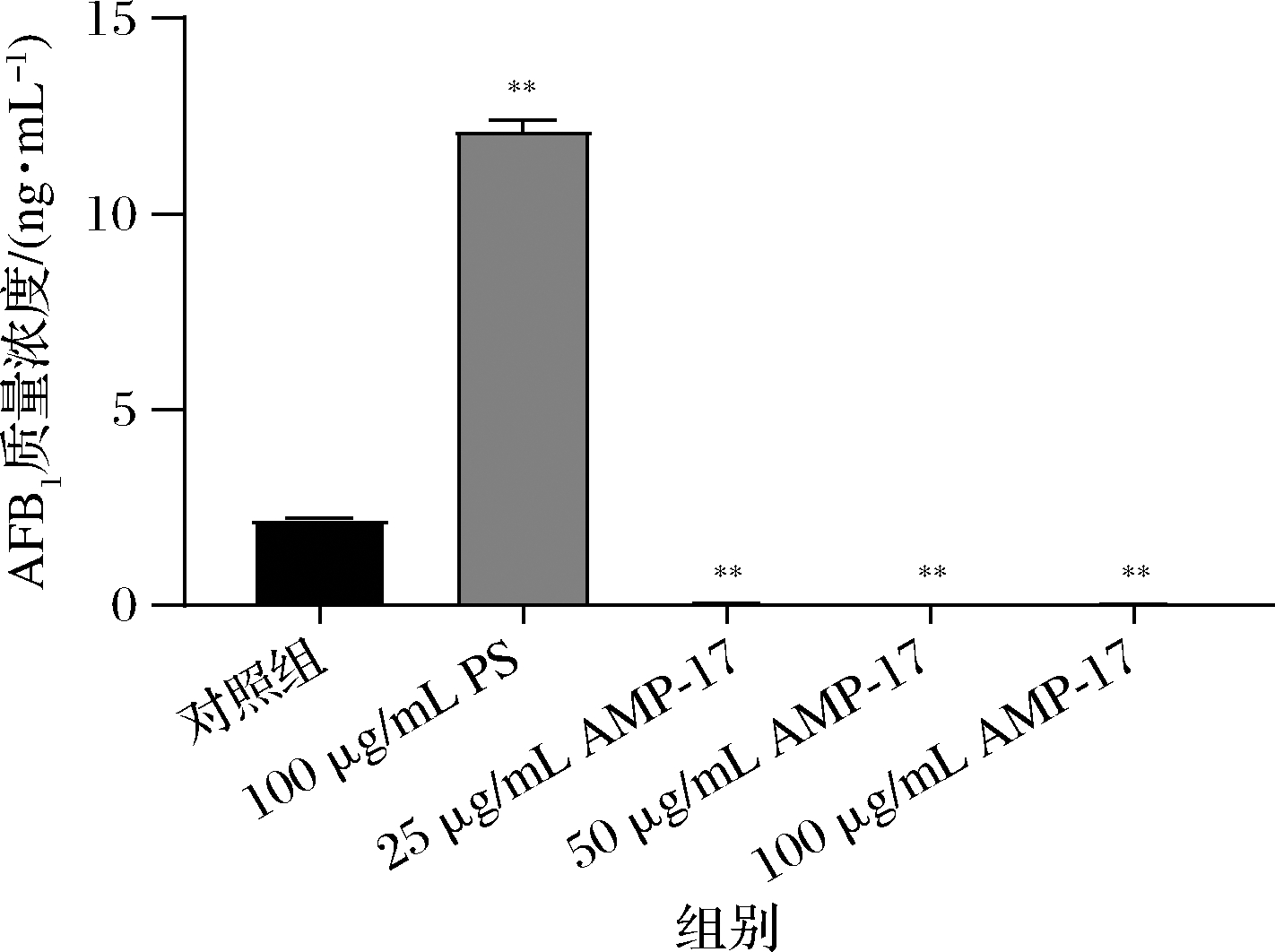
图4 AMP-17对黄曲霉产AFB1的影响
Fig.4 Effects of AMP-17 on AFB1 production by A.flavus
2.6 扫描电镜观察黄曲霉结构变化
镜下观察到,培养了24 h的正常黄曲菌体细胞形态完好且饱满,孢子梗较多并形成了大量孢子,孢子呈球形,外部光滑,颜色清亮,细胞之间界限清晰(图5-A~图5-C)。经AMP-17作用后,黄曲霉不能形成完整的孢子梗,孢子脱离散落,同时表面出现了褶皱、凹陷、破裂、粗糙(图5-D),甚至有些细胞出现碎片,内部物质流出、菌体形态发生部分扭曲变形(图5-E),有些菌丝形态发生严重扭曲变形,断裂成凝絮状(图5-F)。结果表明AMP-17能够破坏黄曲霉的孢子,菌丝体结构。
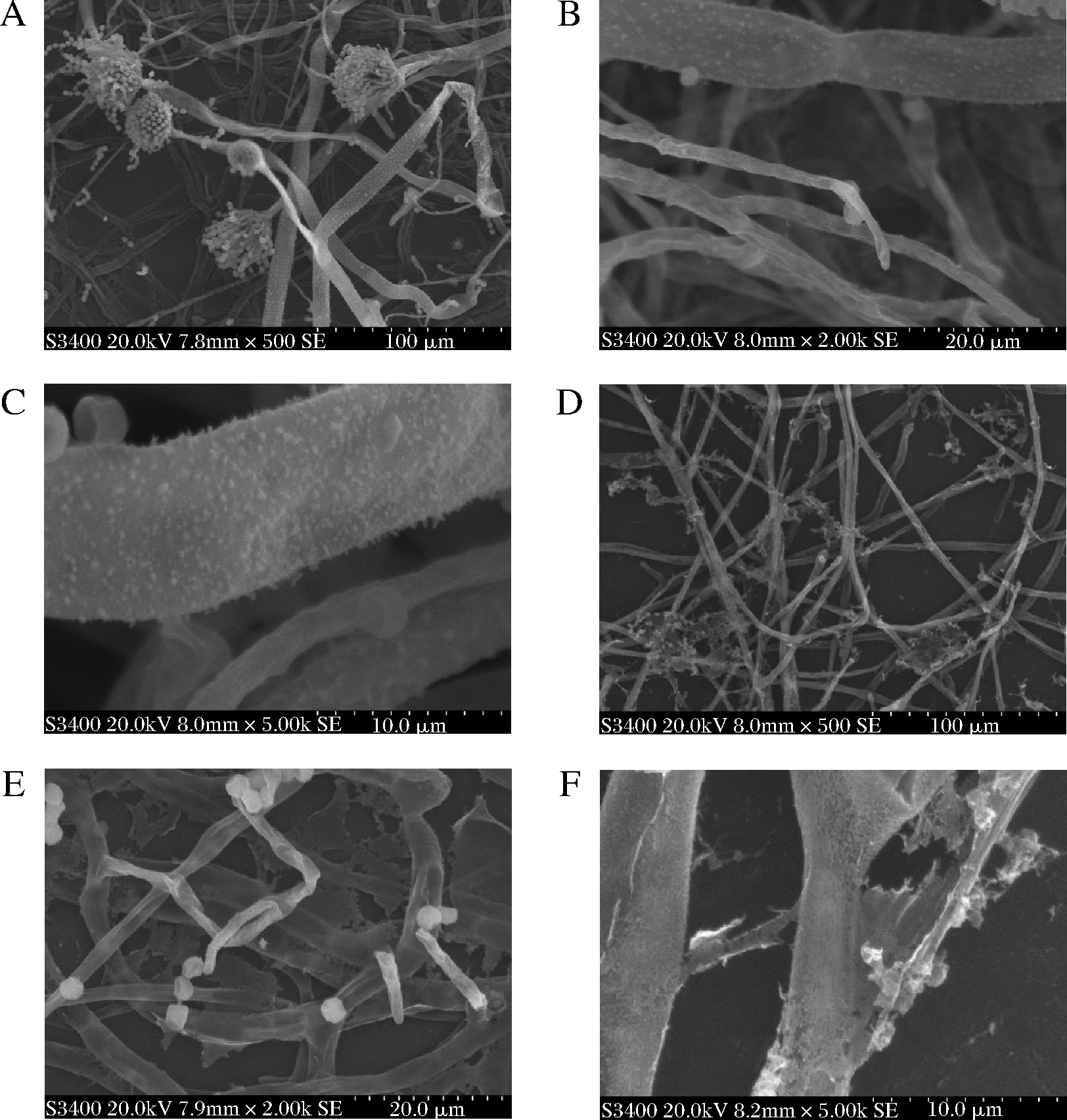
A-对照组×500;B-对照组×2 000;C-对照组×5 000; D-AMP-17组×500;E-AMP-17组×2 000;F- AMP-17组×5 000
图5 AMP-17作用于黄曲霉的扫描电镜观察
Fig.5 SEM of AMP-17 against on A.flavus
3 讨论
黄曲霉易污染大豆、花生和玉米等作物,是我国乃至全球谷物最重要的污染真菌之一[22]。黄曲霉菌体由许多复杂的菌丝构成,主要为营养菌丝和气生菌丝。菌丝形成分生孢子梗从而产生孢子,可随空气传播侵染宿主。菌丝在一定的环境下可产生黄曲霉毒素[23],黄曲霉毒素中AFB1对人的肝脏组织破坏作用最严重,可能导致肝癌甚至死亡[24]。
本实验从黄曲霉孢子、菌丝及产AFB1等方面探索AMP-17对黄曲霉的抗菌功效。研究发现AMP-17对黄曲霉菌的MIC值仅为50 μg/mL,远远低于常用的防腐剂山梨酸钾的抑菌浓度。结合黄曲霉生长曲线来看,证明AMP-17能显著抑制黄曲霉的生长。研究结果与小麦PINA蛋白抑制黄曲霉生长是一致的[25]。蒋立科等[26]研究证实0.5 mg/L柠檬醛能使孢子抑制率达61.4%,本研究也发现黄曲霉萌发率随AMP-17浓度升高而降低,当AMP-17质量浓度为50 μg/mL时,其萌发率仅为8%,孢子萌发受阻从而抑制了黄曲霉形态的转换,进一步阻止黄曲霉形成新的孢子。最重要的是AMP-17通过抑制黄曲霉生长从而较少合成AFB1,这与枯草芽孢杆菌及其杆菌霉素D能有效抑制黄曲霉毒素的合成结果吻合[27]。
扫描电镜结果显示AMP-17可阻止黄曲霉分生孢子梗的形成,破坏孢子和菌丝结构完整性,提示其可能是通过损伤黄曲霉孢子及菌丝体细胞膜,使菌体形态结构改变、胞质外流,导致菌细胞破裂死亡,从而有效抑制黄曲霉生长发育。在前期研究中我们已证实AMP-17对真菌细胞膜麦角甾醇的合成有影响[28],赵欣宇等[12]发现AMP-17能显著抑制白色念珠菌菌丝的形成并且能破坏已形成的菌丝结构。故我们推测AMP-17也可能通过影响黄曲霉孢子及菌丝细胞膜上的麦角甾醇的合成而导致细胞膜功能异常,但具体的抗菌机制还有待于进一步研究。
4 结论
本文研究了AMP-17对黄曲霉的生长发育和产毒的影响,发现其能抑制黄曲霉孢子萌发、破坏孢子及菌丝结构、降低黄曲霉AFB1的含量。提示AMP-17具有强效的防霉防腐效果,可应用于粮食作物的保鲜贮藏,延长保质期,为开发新天然防腐剂提供了一定的实验支持。
[1] ALSHANNAQ A F, GIBBONS J G, LEE M K, et al.Controlling aflatoxin contamination and propagation of Aspergillus flavus by a soy-fermenting Aspergillus oryzae strain[J].Scientific Reports, 2018, 8(1):16871.
[2] MEDINA A, RODRIGUEZ A, MAGAN N.Effect of climate change on Aspergillus flavus and aflatoxin B1 production[J].Frontiers in Microbiology, 2014, 5:348.
[3] 杨博磊, 耿海荣, 王刚, 等.我国花生土壤黄曲霉菌分布与产后花生黄曲霉毒素污染相关性研究[J].核农学报, 2021, 35(4):863-869.
YANG B L, GENG H R, WANG G, et al.The relationship between Aspergillus flavus in peanut soil and aflatoxin contamination of peanut in China[J].Journal of Nuclear Agricultural Sciences, 2021, 35(4):863-869.
[4] YU J J, PAYNE G A, NIERMAN W C, et al.Aspergillus flavus genomics as a tool for studying the mechanism of aflatoxin formation[J].Food Additives & Contaminants.Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2008, 25(9):1 152-1 157.
[5] 王婧莹, 王琢, 闫培生.黄曲霉毒素的脱毒研究进展[J].中国农业科技导报, 2019, 21(4):42-51.
WANG J Y, WANG Z, YAN P S.Research progress on aflatoxin detoxification[J].Journal of Agricultural Science and Technology, 2019, 21(4):42-51.
[6] RAJASEKARAN K, SAYLER R J, SICKLER C M, et al.Control of Aspergillus flavus growth and aflatoxin production in transgenic maize kernels expressing a tachyplesin-derived synthetic peptide, AGM182[J].Plant Science, 2018, 270:150-156.
[7] 周建烈, 张兴权.抗菌肽在维生素D免疫调节功能中的作用[J].食品与营养科学, 2020, 9(2):182-186.
ZHOU J L, ZHANG X Q.The role of cathelicidin in the immune regulation of vitamin D[J].Hans Journal of Food and Nutrition Science, 2020, 9(2):182-186.
[8] MA W B, ZHAO L L, XIE Y L.Inhibitory effect of (E)-2-hexenal as a potential natural fumigant on Aspergillus flavus in stored peanut seeds[J].Industrial Crops and Products, 2017, 107:206-210.
[9] RAI M, PANDIT R, GAIKWAD S, et al.Antimicrobial peptides as natural bio-preservative to enhance the shelf-life of food[J].Journal of Food Science and Technology, 2016, 53(9):3 381-3 394.
[10] TENEA G N, DELGADO POZO T.Antimicrobial peptides from Lactobacillus plantarum UTNGt2 prevent harmful bacteria growth on fresh tomatoes[J].Journal of Microbiology and Biotechnology, 2019, 29(10):1 553-1 560.
[11] LIU J H, XIONG H, DU Y H, et al.NisI maturation and its influence on Nisin resistance in Lactococcus lactis[J].Applied and Environmental Microbiology China, 2020, 86(19).e01306-e01320.
[12] 赵欣宇, 国果, 苏佩佩, 等.家蝇抗菌肽AMP-17对白色念珠菌菌丝的抑制作用[J].微生物学通报, 2020, 47(3):843-851.
ZHAO X Y, GUO G, SU P P, et al.Inhibitory effect of housefly antimicrobial peptide AMP-17 on hyphae of Candida albicans[J].Microbiology China, 2020, 47(3):843-851.
[13] YANG L B, GUO G, ZHAO X Y, et al.Antifungal activity and physicochemical properties of a novel antimicrobial protein AMP-17 from Musca domestica[J].Polish Journal of Microbiology, 2019, 68(3):383-390.
[14] 宋小娟, 杨隆兵, 刘仁明, 等.抗菌肽AMP-17的抗菌活性及其对草莓低温贮藏品质的影响[J].北方园艺, 2021(11):44-50.
SONG X J, YANG L B, LIU R M, et al.Antibacterial activity of antimicrobial peptide AMP-17 and its effect on strawberry cryopreservation quality impact[J].Northern Horticulture, 2021(11):44-50.
[15] BEN TAHEUR F, MANSOUR C, KOUIDHI B, et al.Use of lactic acid bacteria for the inhibition of Aspergillus flavus and Aspergillus carbonarius growth and mycotoxin production[J].Toxicon, 2019, 166:15-23.
[16] 杨隆兵, 国果, 马慧玲, 等.家蝇抗菌肽AMPs17蛋白原核表达条件的优化及其抗真菌活性检测[J].中国生物工程杂志, 2019, 39(4):24-31.
YANG L B, GUO G, MA H L, et al.Optimization of prokaryotic expression conditions and antifungal activity detection of antibacterial peptide AMPs17 protein in Musca domestica[J].China Biotechnology, 2019, 39(4):24-31.
[17] PARK S I,YOE S M.A novel cecropin-like peptide from black soldier fly, Hermetia illucens:Isolation, structural and functional characterization[J].Entomological Research, 2017, 47(2):115-124.
[18] 张晓君, 路来风, 李淑华, 等.Streptomyces alboflavus TD-1产挥发性抑菌物质对黄曲霉菌生长及其毒素的抑制作用[J].食品科学,2021,42(18):51-57.
ZHANG X J, LU L F, LI S H, et al.Effects of volatile organic compounds from Streptomyces alboflavus TD-1 against Aspergillus flavus growth and aflatoxin production[J].Food Science,2021,42(18):51-57.
[19] 王同, 谢华里, 王婷, 等.非脱羧勒克菌wt16对黄曲霉菌生长与产毒的抑制作用[J].食品工业科技, 2018, 39(16):80-86.
WANG T, XIE H L, WANG T, et al.Inhibition effect of Leclercia adecarboxylata strain wt16 on the growth and aflatoxin production of Aspergillus flavus[J].Science and Technology of Food Industry, 2018, 39(16):80-86.
[20] 徐杨玉, 刘付香, 洪彦彬, 等.绿色木霉对花生黄曲霉毒素污染的防治[J].热带生物学报, 2019, 10(4):367-371.
XU Y Y, LIU F X, HONG Y B, et al.Guangdong agribusiness tropical agriculture research institute Co., Ltd[J].Journal of Tropical Biology, 2019, 10(4):367-371.
[21] GANDOMI H, MISAGHI A, BASTI A A, et al.Effect of Zataria multiflora Boiss.essential oil on colony morphology and ultrastructure of Aspergillus flavus[J].Mycoses, 2011, 54(5):e429-e437.
[22] 尚艳娥, 杨卫民.CAC、欧盟、美国与中国粮食中真菌毒素限量标准的差异分析[J].食品科学技术学报, 2019, 37(1):10-15.
SHANG Y E, YANG W M.Variation analysis of cereals mycotoxin limit standards of CAC, EU, USA, and China[J].Journal of Food Science and Technology, 2019, 37(1):10-15.
[23] 孙琦. 肉桂醛对黄曲霉菌生长和产毒的影响机制研究[D].北京:中国农业科学院, 2016.
SUN Q.The study on the mechanism for the cinnamaldehyde-caused inhibition of fungal growth and aflatoxin biosynthesis of Aspergillus flavus[D].Beijing:Chinese Academy of Agricultural Sciences, 2016.
[24] 徐杨玉, 梁炫强, 李玲.环境胁迫影响黄曲霉毒素合成研究进展[J].广东农业科学, 2011,38(S1):38-41;49.
XU Y Y, LIANG X Q, LI L.Advances of enviromental stress on the synthesis of aflatoxin[J].Guangdong Agricultural Sciences, 2011,38(S1):38-41;49.
[25] 吕昂. 小麦PINA蛋白体外表达及其抗黄曲霉作用研究[D].郑州:河南工业大学, 2019.
LYU A.Expression of wheat PINA protein in vitro and its antifungal effect against Aspergillus flavus[D].Zhengzhou:Henan University of Technology, 2019.
[26] 蒋立科, 罗曼.柠檬醛抗黄曲霉作用的分子机理[J].生命科学研究, 2005,9(S1):81-94.
JIANG L K, LUO M.Molecular mechanism of inhibitory effects of citral on Aspergillus flavus[J].Life Science Research, 2005,9(S1):81-94.
[27] 马芳芬, 殷海成.枯草芽孢杆菌及其杆菌霉素D对黄曲霉毒素作用机制的研究进展[J].粮食与饲料工业, 2016(4):48-50;54.
MA F F, YIN H C.Research progress on the inhibition mechanism of Bacillus subtilis and bacillimycin D against aflatoxin[J].Cereal and Feed Industry, 2016(4):48-50;54.
[28] MA H L, ZHAO X Y, YANG L B, et al.Antimicrobial peptide AMP-17 affects Candida albicans by disrupting its cell wall and cell membrane integrity[J].Infection and Drug Resistance, 2020, 13:2 509-2 520.