根据QB/T 5323—2018《植物酵素》规定,食用植物酵素是指以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类使用的酵素产品。其含多种功效酶[1],多酚类物质[2],有机酸、氨基酸以及维生素[3-4]等活性成分,使得食用植物酵素具有润肠通便[1],清除自由基、抗氧化[4],解酒护肝[5]等生理功能。随着公众健康意识的增强,酵素产品倍受推崇。葡萄(Vitis vinifera L.)为葡萄科葡萄属落叶藤本植物,广泛分布于温带及亚热带地区[6]。由于其具有较高的食用、药用及营养价值而受到公众欢迎[7],据2019年国家统计局数据,我国葡萄年产量达1 419.54万 t。但其季节性较强,多汁皮薄含糖量高,采后贮藏期短、易腐烂变质,因此葡萄采后深加工对其提高附加值、拓宽市场极为重要,目前产品多以葡萄酒、葡萄干、葡萄果汁等为主。而以葡萄为原料开发新型酵素产品,不仅可以最大限度保留葡萄固有营养物质,还可增加新的活性成分,是集营养、保健、食疗等功能于一身的产品,具有广泛的市场前景[6]。蒋增良等[8-9]通过研究葡萄酵素自然发酵过程中抗氧化性能的变化及其与有机酸之间的关系,表明葡萄酵素在发酵过程中具有良好的抗氧化性与自由基清除能力,整体呈上升趋势,并且发现其功能与有机酸、多酚以及超氧化物歧化酶(superoxide dismutase, SOD)等的协同作用有关。但自然发酵不易控制,易染杂菌且发酵时间长,因此安全可控的接种发酵技术可为实现工业化生产提供技术参考。
目前,研究表明食用植物酵素发酵过程中优势微生物主要为酵母菌、醋酸菌和乳酸菌[3]。首先,基质中的各种微生物及酶类将多糖分解为单糖,葡萄糖在酵母菌作用下转化为乙醇,同时,也可在醋酸菌的作用下转化为葡萄糖酸,并且将乙醇转化为乙酸,基质糖浓度下降,此过程伴随着酶类的释放,如蛋白酶、淀粉酶以及SOD等,因此酵母菌和醋酸菌在发酵过程中具有互利共生关系[10]。乳酸菌则能产生丰富的有机酸,改善酵素风味,同时作为有益菌还有维持人体肠道菌群平衡、提高免疫力、促进蛋白质和镁元素吸收等作用[4]。LUCENA-PADR S等[11]利用聚合酶链式反应-变性梯度凝胶电泳(PCR-denaturing gradient gel electrophoresis,PCR-DGGE)技术研究了西班牙绿橄榄发酵过程中的微生物变化,检测出乳酸菌、马内杆菌和丙酸杆菌,其中乳酸菌为整个发酵过程的优势菌。王海英[12]利用16S和18S测序技术分析了番木瓜自然发酵过程中微生物组成,并从中筛选出2株优势植物乳杆菌菌种以及2株优势毕赤酵母菌种用于发酵番木瓜酵素,结果表明接种发酵的番木瓜酵素抗氧化能力高于自然发酵。
S等[11]利用聚合酶链式反应-变性梯度凝胶电泳(PCR-denaturing gradient gel electrophoresis,PCR-DGGE)技术研究了西班牙绿橄榄发酵过程中的微生物变化,检测出乳酸菌、马内杆菌和丙酸杆菌,其中乳酸菌为整个发酵过程的优势菌。王海英[12]利用16S和18S测序技术分析了番木瓜自然发酵过程中微生物组成,并从中筛选出2株优势植物乳杆菌菌种以及2株优势毕赤酵母菌种用于发酵番木瓜酵素,结果表明接种发酵的番木瓜酵素抗氧化能力高于自然发酵。
本研究通过探究不同酵母菌发酵葡萄过程中物质变化规律,筛选出适合葡萄发酵的酵母菌,然后将其与醋酸菌、乳酸菌进行依次接种发酵制备葡萄酵素,分析该过程中γ-氨基丁酸、有机酸、香气成分等的变化规律,旨在明确接种发酵对葡萄酵素品质的影响,从而为葡萄酵素发酵条件的优化以及品质的提升提供理论基础,为实现其产业化发展提供理论依据。
1 材料与方法
1.1 材料与试剂
夏黑葡萄(Summer Black),河南南阳社旗县;酿酒酵母 CL-13、JL-11、JL-24、XQ-05、发酵毕赤酵母 CL-03、库德里毕赤酵母 CL-19、曼束里卡毕赤酵母 JL-25,河南省工业微生物菌种保藏中心;巴氏醋杆菌CGMCC 1.41、植物乳杆菌ACCC 11095,北京生物保藏中心。
MRS肉汤(BR),北京奥博星生物技术公司;3,5-二硝基水杨酸(AR),天津市光复精细化工研究所;草酸、酒石酸、苹果酸、丙酮酸、乳酸、乙酸、柠檬酸(HPLC级),美国Sigma公司;三羟甲基氨基甲烷、乙二胺四乙酸二钠、邻苯三酚、对硝基苯酚(HPLC级),上海科密欧公司。
1.2 培养基
YEPD培养基(g/L):葡萄糖20,蛋白胨20,酵母浸出粉10,121 ℃下灭菌20 min(固体培养基,再加入15 g/L琼脂粉)。
许氏醋酸菌种子培养基(g/L):葡萄糖5,酵母浸出粉5,121 ℃下灭菌20 min,冷却后加入30 mL无水乙醇。
1.3 仪器与设备
GC-7890气相色谱仪、7890A-5975C气相色谱-质谱联用仪、Agilent 1260高效液相色谱仪,美国Agilent仪器有限公司;50/30 μm DVB/CAR/PDMS固相微萃取头,美国Supelco公司;CR-400色差计,日本柯尼卡美能达公司;UV-752 N紫外可见分光光度计,上海精密科学仪器有限公司。
1.4 试验方法
1.4.1 发酵基质制备
挑选无机械伤、病害的新鲜葡萄,洗净、晾干、打浆后倒入灭菌后的玻璃罐中,添加红糖至糖度为18 °Bx,用75 mg/mL的果胶酶(酶活力500 U/mg)于50 ℃下酶解40 min。之后100 ℃灭菌15 min[6,13],为避免转移过程污染杂菌再置于超净工作台上紫外杀菌15 min,冷却至室温,得发酵基质。
1.4.2 酵母菌筛选
1.4.2.1 酵母菌液制备
活化:将甘油管中的7株酵母菌,分别取20 μL涂布于YEPD固体培养基上,培养2~3 d,挑取单菌落,接种于液体培养基中,37 ℃培养36 h,得酵母菌活化液,菌液浓度>106 CFU/mL。
生长曲线测定:采用比浊法,将7种酵母菌活化液,分别以3%接种量接种于液体培养基中,置于28 ℃、150 r/min下摇床培养,并于0、2、4、6、8、10、12、14、16、18、20、22、24 h测定其OD600值,以未接种活化液YEPD培养基为对照,绘制生长曲线[14]。
分别将7株酵母菌对数生长期末期的菌液进行收集,做接种用酵母菌液。
1.4.2.2 不同酵母菌发酵
将7种酵母菌液,分别以5%接种量接种于发酵基质中,常温避光发酵6 d,每隔1 d取样,分析不同酵母菌发酵特性与主要功效酶活性的动态变化。
1.4.3 葡萄酵素制备
将筛选出的酵母菌于对数生长期末期收集,制备酵母菌液;将前期试验筛选出的醋杆菌、乳杆菌,按1.4.2.1中的方法培养至对数生长期末期(醋杆菌于30 ℃,180 r/min摇床培养48 h;乳杆菌于37 ℃、200 r/min 摇床培养22 h)收集,制备醋酸菌液、乳酸菌液。
将3%酵母菌液接入发酵基质中,发酵6 d,再接入5%醋酸菌液,发酵至第27天,过滤除菌,最后接入3%乳酸菌液,发酵至第41天。分别于第0、3、6、13、20、27、34、41天取样。为避免杂菌污染所有操作均在超净工作台中进行。
1.4.4 发酵特性测定
采用3,5-二硝基水杨酸比色法测定还原糖含量[15];参照陈玉香等[16]的方法测定乙醇含量;参照GB 12456—2021《食品安全国家标准 食品中总酸的测定》测定总酸含量;利用酸度计测定pH值。
1.4.5 主要功效酶活性测定
采用GB/T 5009.171—2003中邻苯三酚自氧化法测定SOD活性;参照侯晓瑞[17]的方法测定β-葡萄糖苷酶活性。
1.4.6 颜色评估
采用色差计和CIELab 颜色空间分析颜色变化[18],其中L*描述从黑色到白色的亮度范围,a*表示红色到绿色、b*表示黄色到蓝色的变化情况,色度(CI)为A420、A520和A620之和,色调(Hue)为A420/A520的比值。
1.4.7 有机酸含量测定
样品前处理:将2.5 mL样品与1 mL 10.6%的K4Fe(CN)6·3H2O溶液、1 mL 30.0%的ZnSO4溶液混合,用去离子水定容至50 mL,反应30 min后取上清液离心,然后经0.45 μm膜和C18柱过滤,待测[19]。
色谱检测条件:色谱柱Eclipse XDB-C18(4.6 mm×250 mm×5 μm),进样量10 μL,流速0.9 mL/min,流动相0.02 mol/L NaH2PO4(用磷酸调pH至2.1),柱温30 ℃,二极管阵列检测器,波长210 nm[20]。
1.4.8 γ-氨基丁酸含量测定
参照QB/T 4587—2013《γ-氨基丁酸》中的方法测定。
1.4.9 香气成分测定
采用顶空固相微萃取法对香气成分进行富集。将7.5 mL样品、1 g NaCl和25 μL 300 μg/mL的3-辛醇置于20 mL顶空瓶中,40 ℃水浴平衡15 min后插入纤维头吸附40 min,再放入GC进样器中解析6 min。
检测条件参照AUBERT等[21]气相色谱-质谱联用的方法稍作修改。色谱柱HP-INNOWax毛细管柱(60 m×0.25 mm×0.25 μm),烘箱升温程序:50 ℃保持2 min,以3 ℃/min升温至80 ℃,再以5 ℃/min升温至230 ℃,保持6 min,注射器温度240 ℃,载气(氦气)流量1.45 mL/min,分流比5∶1,离子源和质谱传输线温度分别为240、250 ℃,电子能量70 eV,质量范围33~550 m/z。
1.5 数据处理
使用IBM SPSS Statistics 26对数据进行单因素方差分析(P<0.05)及LSD、Duncan多重比较分析,采用Origin 2019进行图形绘制。
2 结果与分析
2.1 酵母菌筛选
2.1.1 不同酵母菌生长曲线分析
酵母菌生长曲线一般分为4个时期,在制备酵素时,酵母菌最佳收集菌体接种时间为对数生长期末期,故通过测定7株酵母菌生长曲线,确定最佳收集菌体接种时间[22]。由图1可知,JL-25、CL-03于20 h,JL-11、JL-24、XQ-05、CL-13于14 h,CL-19于16 h左右进入对数生长期末期。因此,确定20 h为JL-25、CL-03的收集接种时间,14 h为JL-11、JL-24、XQ-05、CL-13,16 h为CL-19的收集接种时间。

图1 不同酵母菌的生长曲线
Fig.1 Growth curve of different yeasts
2.1.2 不同酵母菌发酵特性分析
糖类是酵母菌生长代谢的主要碳源,通过糖代谢可生成酒精等代谢产物,还原糖、乙醇含量的变化不仅能反映出微生物生长代谢情况,还可直接影响产品风味[23]。由图2-a、图2-b可知,不同酵母菌在发酵过程中还原糖含量逐渐下降,其中JL-11、JL-24、CL-13和XQ-05在发酵基质中适应能力强,发酵速度快,第2天时含量即趋于0,同时,酒精度也于第2天达到最大值,之后趋于稳定;JL-25、CL-3和CL-19适应能力弱,发酵时间较长,还原糖含量分别于第4、5、6天趋于0。不同酵母菌发酵结束时酒精含量在8.00%vol左右。总酸度和pH的变化可反映发酵过程是否正常。由图2-c、图2-d可知,不同酵母菌在发酵过程中总酸度总体呈升高趋势,pH值则与之相反,其中酿酒酵母XQ-05相较于其他菌株产酸能力稳定,受基质酸度影响不大,表现出较强发酵产酸性能与基质适应能力,在发酵第6天时总酸含量显著高于其他菌株(P<0.05)且pH最低为3.50。
2.1.3 不同酵母菌主要功效酶活性分析
由表1可知,7株酵母菌在发酵过程中,SOD活力呈先上升后下降再上升趋势,下降的原因可能是由于酵母菌正处于快速生长时期,密度增高以及衰老时消耗次级代谢产物,使得SOD活力降低[24],其中XQ-05 于第2天达到最大值58.06 U/mL,其余菌株均在第6天达到最大值,表明其产酶速度相较于其他菌株快。β-葡萄糖苷酶对酵素香气成分的形成有重要作用[25],由表2可知,不同酵母菌产β-葡萄糖苷酶的能力有显著差异(P<0.05),JL-11和JL-24仅在发酵第2天检出,CL-19和CL-13在发酵过程中未检出、CL-03和JL-25呈不稳定的波动趋势,而XQ-05在发酵过程中β-葡萄糖苷酶活性稳步升高,并于第5天增至518.06 μU/mL。这可能是由于不同酵母菌合成、释放β-葡萄糖苷酶的能力及所处发酵环境的影响所导致[17]。
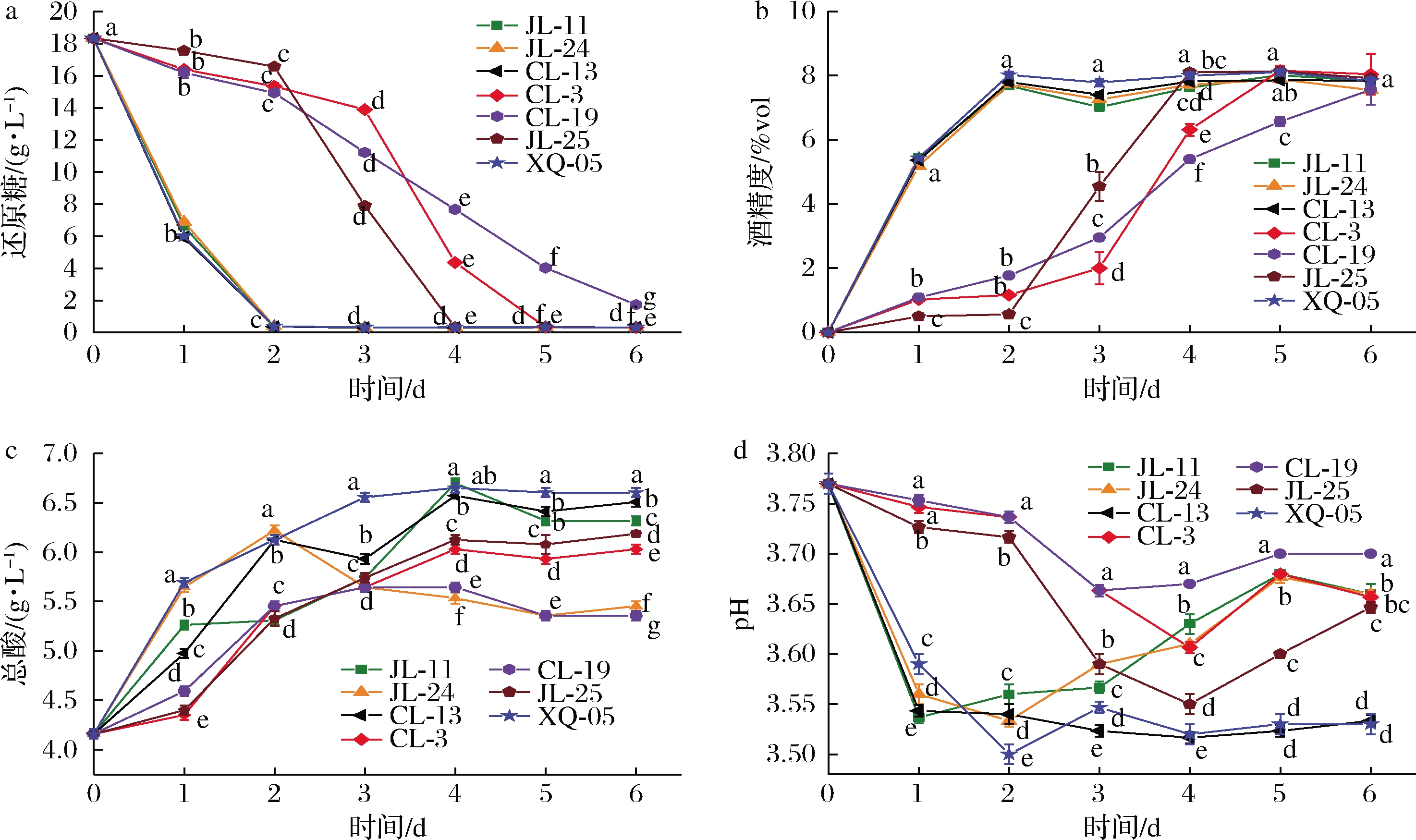
a-还原糖;b-酒精度;c-总酸;d-pH值
图2 不同酵母菌发酵过程中还原糖、酒精度、总酸和pH值的变化
Fig.2 Changes of reducing sugar, alcohol, total acid and pH of different yeasts during fermentation 注:不同小写字母表示差异显著(P<0.05)
表1 不同酵母菌发酵过程中SOD活力的变化 单位:U/mL
Table 1 Changes of SOD activity of different yeasts during fermentation
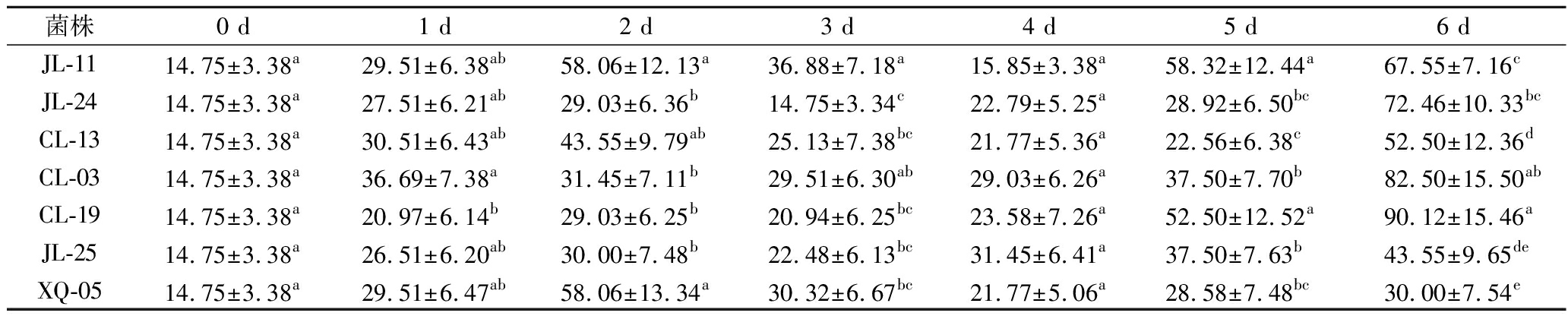
菌株0 d1 d2 d3 d4 d5 d6 dJL-1114.75±3.38a29.51±6.38ab58.06±12.13a36.88±7.18a15.85±3.38a58.32±12.44a67.55±7.16cJL-2414.75±3.38a27.51±6.21ab29.03±6.36b14.75±3.34c22.79±5.25a28.92±6.50bc72.46±10.33bcCL-1314.75±3.38a30.51±6.43ab43.55±9.79ab25.13±7.38bc21.77±5.36a22.56±6.38c52.50±12.36dCL-0314.75±3.38a36.69±7.38a31.45±7.11b29.51±6.30ab29.03±6.26a37.50±7.70b82.50±15.50abCL-1914.75±3.38a20.97±6.14b29.03±6.25b20.94±6.25bc23.58±7.26a52.50±12.52a90.12±15.46aJL-2514.75±3.38a26.51±6.20ab30.00±7.48b22.48±6.13bc31.45±6.41a37.50±7.63b43.55±9.65deXQ-0514.75±3.38a29.51±6.47ab58.06±13.34a30.32±6.67bc21.77±5.06a28.58±7.48bc30.00±7.54e
注:由Duncan测验,同一列中不同小写字母表示在0.05水平上有显著性差异(表2同)
表2 不同酵母菌发酵过程中β-葡萄糖苷酶活力的变化 单位:μU/mL
Table 2 Changes of β-glucosidase activity of different yeasts during fermentation

菌株0 d1 d2 d3 d4 d5 d6 dJL-11n.dn.d450.99±29.04cn.dn.dn.dn.dJL-24n.dn.d31.86±29.04dn.d n.d n.d n.dCL-13n.dn.dn.dn.dn.dn.dn.dCL-03n.d31.86±5.04b702.48±76.83b585.12±58.08b115.68±6.30c803.07±14.04a165.98±10.03CL-19n.dn.dn.dn.dn.dn.dn.dJL-25n.d568.35±133.07a844.31±12.05a2 110.79±104.70a333.64±29.04b752.77±12.04bn.dXQ-05n.dn.d31.86±29.04d231.24±13.56c410.59±19.89a518.06±8.66cn.d
注:n.d表示未检出(下同)
综上分析7株酵母菌发酵过程中物质变化规律可知,酿酒酵母XQ-05在葡萄基质中适应性强,发酵速度快,产酶能力较强且稳定,适合葡萄酵素快速发酵生产,可用于进一步研究。
2.2 葡萄酵素品质特性分析
将筛选出的酿酒酵母XQ-05与巴氏醋杆菌、植物乳杆菌依次接种发酵制备葡萄酵素。经测定,发酵结束后其各项基本理化指标,如还原糖含量0.46 g/L,酒精度(0.47±0.02)%vol,总酸含量(19.09±0.36)g/L,pH(3.19±0.03)等,均满足QB/T 5323—2018《植物酵素》规定的要求。
2.2.1 葡萄酵素发酵过程中颜色的变化
颜色是葡萄酵素最直观的感官特征,主要呈色物质为花色苷,其组成和含量对酵素色泽有显著影响,花色苷不稳定在发酵中易受pH值、温度和微生物等因素的影响,颜色特征能够反映出酵素发酵工艺和原料的好坏,也是人们接受度的重要参考指标[26]。由表3可知,发酵过程中,a*值在0.40~2.15内波动,发酵结束时颜色偏红;b*值在-4.29~2.34内变化;第41天时样品亮度(L*)显著的高于其他样品(P<0.05)。ΔE表示总色差,反映葡萄酵素在发酵过程中与葡萄汁相比颜色的变化程度,发现第41天时样品色差最大,其次是第20和27天的样品,表明接种发酵改变了葡萄酵素的颜色,这可能是由于发酵过程中酚类物质的转变和发酵基质酸碱度的变化所导致[27]。葡萄酵素发酵过程中CI和Hue呈先降低后升高的趋势,与对照相比,发酵结束后色调升高,色度降低。
表3 葡萄酵素发酵过程中颜色的变化
Table 3 Changes of color during fermentation of grape Jiaosu
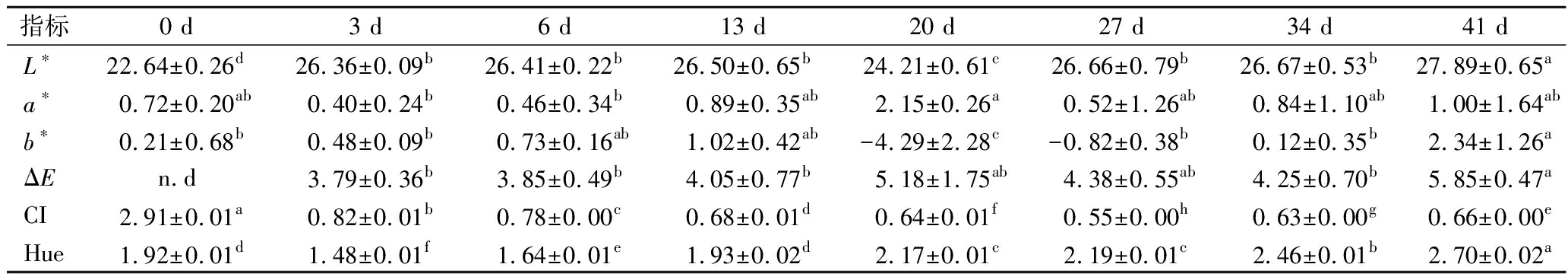
指标0 d3 d6 d13 d20 d27 d34 d41 dL∗22.64±0.26d26.36±0.09b26.41±0.22b26.50±0.65b24.21±0.61c26.66±0.79b26.67±0.53b27.89±0.65aa∗0.72±0.20ab0.40±0.24b0.46±0.34b0.89±0.35ab2.15±0.26a0.52±1.26ab0.84±1.10ab1.00±1.64abb∗0.21±0.68b0.48±0.09b0.73±0.16ab1.02±0.42ab-4.29±2.28c-0.82±0.38b0.12±0.35b2.34±1.26aΔEn.d3.79±0.36b3.85±0.49b4.05±0.77b5.18±1.75ab4.38±0.55ab4.25±0.70b5.85±0.47aCI2.91±0.01a0.82±0.01b0.78±0.00c0.68±0.01d0.64±0.01f0.55±0.00h0.63±0.00g0.66±0.00eHue1.92±0.01d1.48±0.01f1.64±0.01e1.93±0.02d2.17±0.01c2.19±0.01c2.46±0.01b2.70±0.02a
注:由Duncan测验,同一行中不同小写字母表示在0.05水平上有显著性差异(表4同)
2.2.2 葡萄酵素发酵过程中γ-氨基丁酸的变化
γ-氨基丁酸是一种重要的抑制性神经递质,具有改善脑功能、降血压、促进生长激素分泌等功能,为新型功能食品因子[3]。由图3可知,葡萄酵素发酵过程中γ-氨基丁酸含量呈逐渐上升趋势,发酵前3 d即酵母菌发酵前期,γ-氨基丁酸含量增长速度较快,而后(3~20 d)逐渐减慢,这可能是由于前期酵母菌生长代谢旺盛,分泌的蛋白酶活性高,故合成γ-氨基丁酸的速率较快,随着发酵进行,酵母菌发酵产生乙醇、醋酸菌发酵产生乙酸等代谢产物,使得发酵基质环境发生改变,导致其合成的关键酶谷氨酸脱羧酶活性下降,故增加速度减慢[28]。第27天后,随着乳酸菌发酵的作用,γ-氨基丁酸含量持续增加,发酵结束时达到38.95 μg/mL,显著高于其他发酵时间样品(P<0.05),符合QB/T 5323—2018中规定的γ-氨基丁酸含量≥0.03 mg/kg的要求。葡萄酵素在接种发酵过程中,γ-氨基丁酸主要在酵母菌发酵阶段产生,因此,在后续优化葡萄酵素品质时,可对酵母菌发酵阶段的参数进行调节,从而提高葡萄酵素γ-氨基丁酸含量。
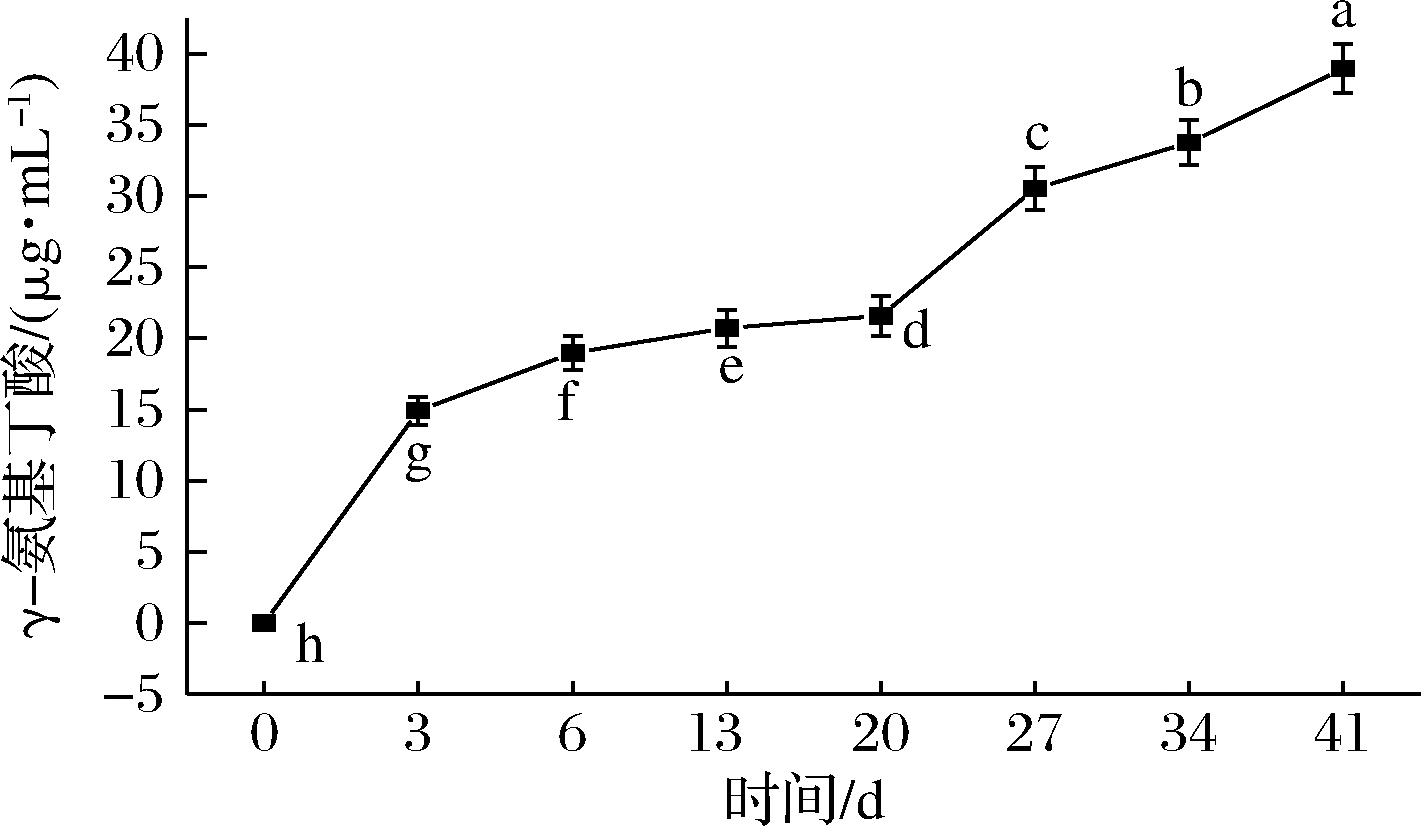
图3 葡萄酵素发酵过程γ-氨基丁酸的变化
Fig.3 Changes of γ-aminobutyric acid content during fermentation of grape Jiaosu
2.2.3 葡萄酵素发酵过程中SOD活力的变化
食用植物酵素富含多种功效酶类,例如淀粉酶、蛋白酶和SOD等。其中SOD常被用来评价酵素酶活性的高低[1]。因此,分析葡萄酵素发酵过程中SOD活力的变化具有重要意义。如图4所示,葡萄酵素发酵过程中SOD活力整体呈升高趋势,分析其原因主要是由于发酵过程中基质环境的改变以及微生物不断分泌相应的功效酶等因素,从而使得SOD活力逐渐升高[22]。发酵前20 d,SOD活力变化不显著(P>0.05),为22.89~45.00 U/L;第20~27天时,SOD活力显著升高(P<0.05);接种乳酸菌后,SOD活力持续升高,于第41天升至135.00 U/L。表明葡萄酵素在依次接种发酵过程中SOD活力主要在醋酸菌发酵后期以及乳酸菌发酵过程中大幅提高,因此,在优化葡萄酵素品质以及工业化生产中可针对性对发酵阶段进行调节控制,从而生产出富含高活性功效酶的产品,提高附加值。发酵结束时,葡萄酵素SOD活力符合QB/T5323—2018 中≥15 U/L的要求。与葡萄浆汁相比,发酵结束时SOD活力增长6倍,表明在葡萄酵素发酵过程中产生了较多抗氧化酶系,有利于清除活性氧。
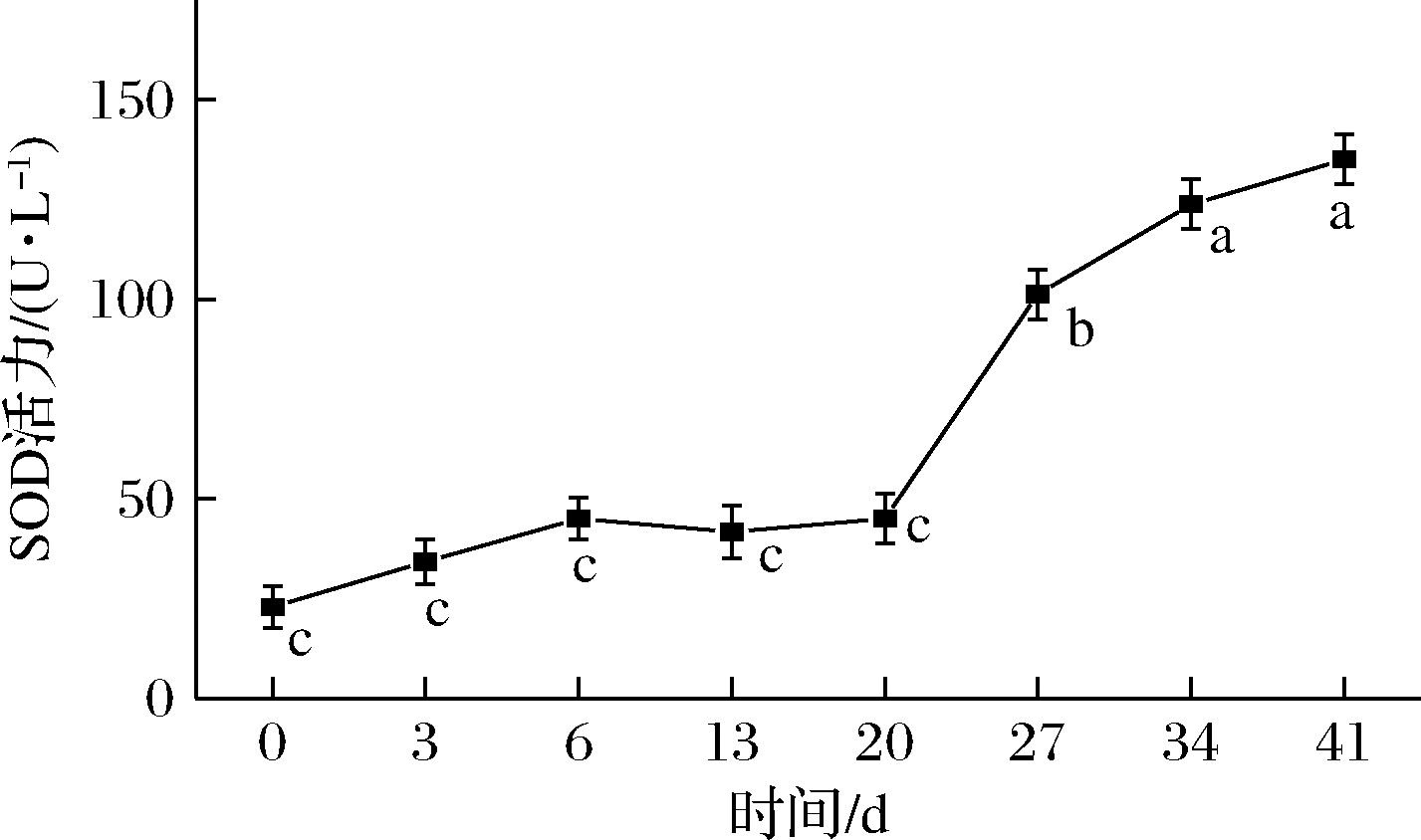
图4 葡萄酵素发酵过程中SOD活力的变化
Fig.4 Changes of SOD activity during fermentation of grape Jiaosu
2.2.4 葡萄酵素发酵过程中有机酸的变化
有机酸是酵素发酵过程中的代谢产物,可赋予酵素独特风味,所形成的酸性环境对某些有害微生物有抑制作用,并且在发酵过程中其种类和数量也会发生变化[29]。因此,研究酵素发酵过程中有机酸的种类和含量,对其感官质量评价极为重要。由表4可知,在发酵前6 d未检测到乙酸,而丙酮酸、柠檬酸和苹果酸含量增多,表明这一时期酵母菌主要通过糖代谢积累代谢产物;接种醋酸菌后,醋酸菌利用乙醇生成乙酸,乙酸显著增加(P<0.05);第27天时未检测出乳酸,乙酸含量显著升高(P<0.05),这可能是由于某些微生物具有降解乳酸转化为乙酸的能力[9];而接种乳酸菌后,乳酸和柠檬酸含量分别增至102.09 mg/L和67.70 mg/L,苹果酸含量下降至0,这可能是由于乳酸菌通过三羧酸循环将苹果酸转化成柠檬酸、通过苹果酸发酵途径将苹果酸转化成乳酸所致[30]。
表4 葡萄酵素发酵过程中有机酸的变化
Table 4 Changes of organic acid during fermentation of grape Jiaosu
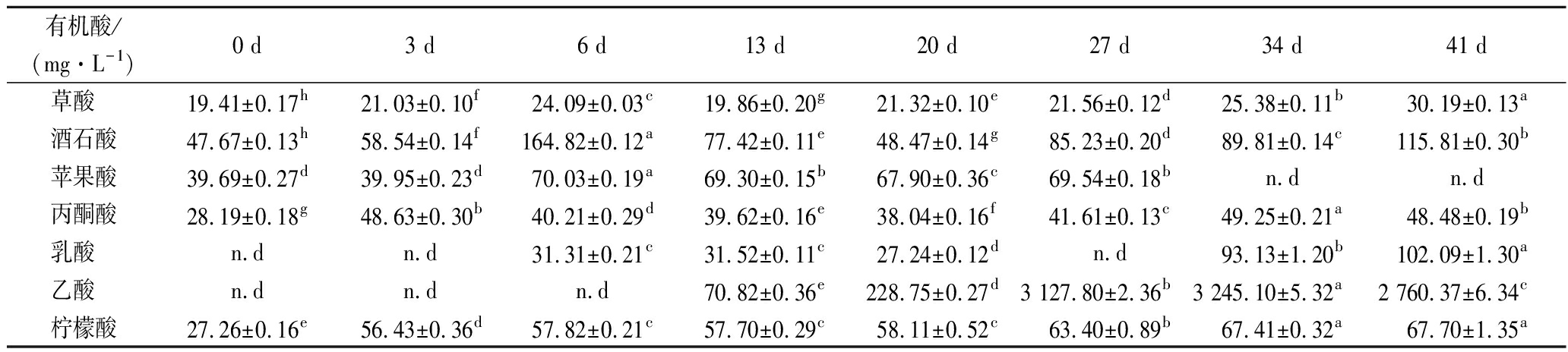
有机酸/(mg·L-1)0 d3 d6 d13 d20 d27 d34 d41 d草酸 19.41±0.17h21.03±0.10f24.09±0.03c19.86±0.20g21.32±0.10e21.56±0.12d25.38±0.11b30.19±0.13a酒石酸47.67±0.13h58.54±0.14f164.82±0.12a77.42±0.11e48.47±0.14g85.23±0.20d89.81±0.14c115.81±0.30b苹果酸39.69±0.27d39.95±0.23d70.03±0.19a69.30±0.15b67.90±0.36c69.54±0.18bn.dn.d丙酮酸28.19±0.18g48.63±0.30b40.21±0.29d39.62±0.16e38.04±0.16f41.61±0.13c49.25±0.21a48.48±0.19b乳酸 n.dn.d31.31±0.21c31.52±0.11c27.24±0.12dn.d93.13±1.20b102.09±1.30a乙酸 n.dn.dn.d70.82±0.36e228.75±0.27d3 127.80±2.36b3 245.10±5.32a2 760.37±6.34c柠檬酸27.26±0.16e56.43±0.36d57.82±0.21c57.70±0.29c58.11±0.52c63.40±0.89b67.41±0.32a67.70±1.35a
2.2.5 葡萄酵素发酵过程中香气成分的变化
葡萄酵素香气成分与原料、菌种和发酵环境等多种因素有关,研究发酵过程中香气成分的变化,对酵素品质评价具有重要意义。葡萄酵素发酵过程中香气成分变化的相应结果见附表1(https://kns.cnki.net/kcms/detail/11.1802.TS.20211115.2144.004.html)。发酵过程中共检出43种香气成分,其中醇类化合物和酯类化合物占比较高,香气成分的种类随着发酵时间而变化。
醇类化合物来源于酵母菌等微生物分解糖、蛋白质及氨基酸等物质产生[13],共检出14种。其中苯乙醇主要是由酵母菌以L-苯丙氨酸为前体通过戊糖磷酸途径或利用葡萄糖通过草莽酸途径生成,具有玫瑰香、紫罗兰香和茉莉花香等多种香味,于第3天显示出最高的浓度,随后降低,这可能是由于发酵后期醇类物质与脂肪酸酯化所致[31]。高级醇是酵母菌的次级代谢产物,包括异丁醇、正丁醇、异戊醇、1-戊醇、5-甲基-2-环己醇、2-庚醇,主要来自葡萄糖的合成代谢及相应氨基酸的分解代谢途径。酯类化合物构成了葡萄酵素的独特风味,共检出13种,总体呈先升高后降低的趋势,降低的原因可能是由于发酵后期pH降低,酯类物质发生水解所致[32]。其中乙酸乙酯是葡萄酵素中含量较高的成分,在发酵第13天检测出最高质量浓度,为30.07 μg/mL,随着发酵时间的延长浓度降低,该物质广泛存在于苹果、梨等水果中,是构成葡萄酵素令人愉悦的花果香气的主体成分。脂肪酸是构成葡萄酵素风味的重要化合物,共检出4种,分别是乙酸、丙酸、异丁酸和异戊酸。乙酸在发酵过程中呈先升高后降低的趋势,并于第27天检测出最高值47.49 μg/mL,可能是因为这一时期醋酸菌利用乙醇生成大量乙酸。
醛类化合物是构成葡萄酵素发酵前期成熟果味的化学成分之一,其感官阈值较低,共检出4种,分别是乙醛、己醛、(2Z)-2-庚醛和反式-2-己烯醛,乙醛在发酵过程中呈先升高后降低的趋势,己醛、(2Z)-2-庚醛和反式-2-己烯醛仅在葡萄汁中检测得到,质量浓度为0.03~0.14 μg/mL。酮类化合物在葡萄酵素香气成分中占比较少,共检出3种。其中3-羟基-2-丁酮在发酵后期浓度较大,4-羟基-2-丁酮仅在第27天检出,2,3-丁二酮在发酵第34天检出,3-羟基-2-丁酮和2,3-丁二酮是醋酸发酵阶段的代表性产物,并且研究指出该物质的生成与乳酸有关[33]。
3 结论
在分析7株酵母菌发酵特性及功效酶的动态变化中,发现酿酒酵母XQ-05消耗还原糖能力快,产酸能力强,发酵速度快,且表现出较强的产酶能力,因此该菌株能很好地适应葡萄基质,适合葡萄快速发酵。在依次接种发酵葡萄酵素过程中,相比葡萄浆汁而言,产品偏红;发酵过程中γ-氨基丁酸含量和SOD活力逐渐升高,第41天时分别达到38.95 μg/mL和135.00 U/L;有机酸含量的变化与微生物之间有着密切关系,造成各微生物发酵阶段有机酸差异的主要为苹果酸、乙酸和乳酸;发酵过程中共检出43种香气成分,其中醇类化合物和酯类化合物占比较高。本研究明确了不同酵母菌发酵葡萄过程中物质变化规律以及接种发酵过程中对葡萄酵素品质变化的影响,从而为葡萄酵素发酵条件的优化以及品质的提升提供理论基础。
[1] FENG Y J, ZHANG M, MUJUMDAR A S, et al.Recent research process of fermented plant extract:A review[J].Trends in Food Science & Technology, 2017, 65:40-48.
[2] JIANG K K, ZHAO Y L, LIANG C, et al.Composition and antioxidant analysis of jiaosu made from three common fruits:Watermelon, cantaloupe and orange[J].CyTA-Journal of Food, 2021, 19(1):146-151.
[3] DAI J, SHA R Y, WANG Z Z, et al.Edible plant Jiaosu:Manufacturing, bioactive compounds, potential health benefits, and safety aspects[J].Journal of the Science of Food and Agriculture, 2020, 100(15):5 313-5 323.
[4] GUAN Q Q, XIONG T, XIE M Y.Influence of probiotic fermented fruit and vegetables on human health and the related industrial development trend[J].Engineering, 2021, 7(2):212-218.
[5] JE J, KIM H, PARK E J, et al.Fermentation of sprouted ginseng (Panax ginseng) increases flavonoid and phenolic contents to attenuate alcoholic hangover and acute liver injury in mice[J].The American Journal of Chinese Medicine, 2021, 49(1):1-16.
[6] 洪厚胜, 朱曼利, 李伟, 等.葡萄果渣酵素的发酵工艺优化及其理化特性[J].食品科学, 2019, 40(8):63-72.
HONG H S, ZHU M L, LI W, et al.Optimization of fermentation process and physicochemical properties of probiotic fermented grape pomace[J].Food Science, 2019, 40(8):63-72.
[7] 谢梦洲.中医药膳学[M].北京:中国中医药出版社,2013:89-90.
XIE M Z.Chinese Traditional Medicine Scienctific Diet[M].Beijing:China Press of Traditional Chinese Medicine,2013:89-90.
[8] 蒋增良, 毛建卫, 黄俊, 等.葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J].中国食品学报, 2014, 14(10):29-34.JIANG Z L, MAO J W, HUANG J, et al.Changes in antioxidant activity of grape-ferment in vitro during natural fermentation process[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(10):29-34.
[9] 蒋增良, 刘晓庆, 王珍珍, 等.葡萄酵素有机酸分析及其体外抗氧化性能[J].中国食品学报, 2017, 17(5):255-262.
JIANG Z L, LIU X Q, WANG Z Z, et al.Analysis of organic acids and in vitro antioxidant activity of grape-ferment[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(5):255-262.
[10] AYED L, BEN ABID S, HAMDI M.Development of a beverage from red grape juice fermented with the Kombucha consortium[J].Annals of Microbiology, 2017, 67(1):111-121.
[11] LUCENA-PADR S H, JIMÉNEZ E, MALDONADO-BARRAG
S H, JIMÉNEZ E, MALDONADO-BARRAG N A, et al.PCR-DGGE assessment of the bacterial diversity in Spanish-style green table-olive fermentations[J].International Journal of Food Microbiology, 2015, 205:47-53.
N A, et al.PCR-DGGE assessment of the bacterial diversity in Spanish-style green table-olive fermentations[J].International Journal of Food Microbiology, 2015, 205:47-53.
[12] 王海英. 番木瓜酵素的研究与制备[D].天津:天津科技大学, 2018.
WANG H Y.Study and preparation of Papaya Jiaosu[D].Tianjin:Tianjin University of Science and Technology, 2018.
[13] 任婷婷, 岳田利, 魏欣, 等.益生菌发酵苹果浆工艺优化及发酵前后挥发性风味成分分析[J].食品科学, 2019, 40(8):87-93.
REN T T, YUE T L, WEI X, et al.Process optimization for production of fermented apple pulp with probiotics and analysis of volatile flavor components before and after fermentation[J].Food Science, 2019, 40(8):87-93.
[14] 白梦洋, 吴祖芳, 李若云, 等.果酒酵母菌多菌种混合培养的生长规律及挥发性风味物质的差异性分析[J].中国食品学报, 2019, 19(5):214-221.
BAI M Y, WU Z F, LI R Y, et al.The growth law of wine yeasts in a mixed culture and difference analysis of volatile flavor compounds[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(5):214-221.
[15] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry, 1959, 31(3):426-428.
[16] 陈玉香, 张雯, 蔡琪琪, 等.发酵温度对异常维克汉姆酵母产挥发性风味物质的影响[J].中国食品学报, 2016, 16(9):122-128.
CHEN Y X, ZHANG W, CAI Q Q, et al.Effect of fermentation temperature on volatile flavor compounds produced by Wickerhamomyces anomalus[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(9):122-128.
[17] 侯晓瑞. 甘肃河西走廊葡萄酒产区产β-葡萄糖苷酶酵母菌株的筛选[D].兰州:甘肃农业大学, 2014.
HOU X R.Screening of β-glucosidase producing yeast strains from Hexi Corridor wine regions of Gansu Province[D].Lanzhou:Gansu Agricultural University, 2014.
[18] KWAW E, MA Y K, TCHABO W, et al.Effect of lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry, 2018, 250(1):148-154.
[19] DING Y F, MA Y L, LI S P, et al.Characterization of biochemical compositions, volatile compounds and sensory profiles of cabernet sauvignon wine in successive vintages (2008-2017)[J].American Journal of Biochemistry and Biotechnology, 2020, 16(3):380-391.
[20] SCHERER R, RYBKA A C P, BALLUS C A, et al.Validation of a HPLC method for simultaneous determination of main organic acids in fruits and juices[J].Food Chemistry, 2012, 135(1):150-154.
[21] AUBERT C, CHALOT G.Chemical composition, bioactive compounds, and volatiles of six table grape varieties (Vitis vinifera L.)[J].Food Chemistry, 2018, 240:524-533.
[22] 孙淑夷. 荔枝汁混菌发酵工艺及其功能活性成分研究[D].广州:华南农业大学, 2016.
SUN S Y.The research of technology and functional active ingredients for Litchi juice mixed strains fermentation[D].Guangzhou:South China Agricultural University, 2016.
[23] 陈小伟, 程勇杰, 蒋立新, 等.草莓酵素发酵过程中代谢产物及抗氧化性的变化研究[J].中国食品学报, 2020, 20(5):157-165.
CHEN X W, CHENG Y J, JIANG L X, et al.Studies on the changes of metabolites and antioxidant activity during the fermentation process of strawberry Jiaosu[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):157-165.
[24] 赵敏, 王瑜, 李立郎, 等.天麻酵素化过程中风味物质及抗氧化活性动态变化[J].食品与发酵工业,2021,47(22):92-98.
ZHAO M, WANG Y, LI L L, et al.Dynamic study on flavor components and antioxidant activity in the fermentation of Gastrodia elata[J].Food and Fermentation Industries,2021,47(22):92-98.
[25] MA D C, YAN X, WANG Q Q, et al.Performance of selected P.fermentans and its excellular enzyme in co-inoculation with S.cerevisiae for wine aroma enhancement[J].LWT, 2017, 86:361-370.
[26] FANZONE M, GONZ LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
LEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chemistry, 2015, 175:166-173.
[27] LIU S W, CHANG X D, LIU X F, et al.Effects of pretreatments on anthocyanin composition, phenolics contents and antioxidant capacities during fermentation of hawthorn (Crataegus pinnatifida)drink[J].Food Chemistry, 2016, 212(1):87-95.
[28] 刘加友. 富含γ-氨基丁酸葛根酵素发酵及其解酒功能的研究[D].镇江:江苏大学, 2016.
LIU J Y.Fermention and alcoholic intoxication prevention of kudzu ferment rich in γ-aminobutyric acid[D].Zhenjiang:Jiangsu University, 2016.
[29] HUGENHOLTZ J.Traditional biotechnology for new foods and beverages[J].Current Opinion in Biotechnology, 2013, 24(2):155-159.
[30] G NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
NZLE M G.Lactic metabolism revisited:Metabolism of lactic acid bacteria in food fermentations and food spoilage[J].Current Opinion in Food Science, 2015, 2:106-117.
[31] 王成涛, 梁婧如, 尹胜, 等.溶氧量对酿酒酵母及其工程菌的β-苯乙醇合成代谢的影响及调控效应[J].中国食品学报, 2016, 16(8):78-86.
WANG C T, LIANG J R, YIN S, et al.Effects and biosynthetic metabolism regulation of dissolved oxygen on β-phenethylalcohol in Saccharomyces cerevisiae and its engineering strains[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(8):78-86.
[32] 范昊安, 沙如意, 杜柠, 等.苹果梨酵素发酵过程中香气成分的变化[J].食品科学, 2021, 42(2):177-184.
FAN H A, SHA R Y, DU N, et al. Changes in aroma components during fermentation of ‘pingguoli’ pear jiaosu(fermented fruit juice)[J]. Food Science, 2021, 42(2):177-184.
[33] ZHANG X, WANG P, XU D D, et al.Aroma patterns of Beijing rice vinegar and their potential biomarker for traditional Chinese cereal vinegars[J].Food Research International, 2019, 119:398-410.