硒是人体必需微量元素之一[1],主要以硒结合蛋白及含硒肽等形式在生物体内发挥其生理功能,表现为抗癌、增强免疫力及促进生长发育等[2]。自1817年硒元素被发现至今,逐渐成为热点研究课题;早期研究以硒蛋白的作用机理[3]、硒的代谢机制[4]为主,近年来富硒食品受到关注,富硒大米[5]、富硒茶[6]等研究不断深入,含硒蛋白及含硒肽的功能活性被挖掘,同时研究表明含硒小分子肽更利于人体吸收。相关研究聚焦于硒的活性分析,但富硒肽类的功能营养产品的研究与开发较少,而含硒量高且产量大的主料是发富硒营养产品的关键。
前期研究结果显示湛江海区产的华贵栉孔扇贝可食用部位硒含量1.39 μg/g(干基),远高于食品安全国家标准《预包装食品营养标签通则》(GB 28050—2011)富硒食品标准(0.15 μg/g)。据《2021渔业统计年鉴》的数据,2020年扇贝年产量达175万t,仅次于牡蛎及蛤类。广东湛江作为华贵栉孔扇贝主产区之一,产量达11万t,具有独特的资源优势,为贝类富硒产品的研究与开发提供原料保障。华贵栉孔扇贝富硒蛋白粉的开发能拓展其市场前景,使华贵栉孔扇贝资源的价值得到充分体现。当前,将原料酶解制备蛋白酶解产物是开发易吸收蛋白类产品的主要途径,如涂晓玲[7]的研究表明蓝圆鲹鱼酶解蛋白粉具有较高的营养价值及波纹巴非蛤酶解蛋白粉具有氨基酸种类齐全,营养丰富的特点[8]。本文通过酶解法利用华贵栉孔扇贝制备富硒蛋白粉,并对其进行营养评价,为华贵栉孔扇贝富硒蛋白粉的研究与开发提供理论基础。
1 材料与方法
1.1 材料与试剂
华贵栉孔扇贝于2021年9月购自于湛江市霞山工农市场,开壳取肉去内脏团后,洗净沥干,分装-20 ℃贮藏备用。
枯草杆菌中性蛋白酶(酶活100 U/mg,以下称中性蛋白酶)、动物蛋白酶(67 U/mg)、木瓜蛋白酶(70 U/mg)、菠萝蛋白酶(16 U/mg)、胰蛋白酶(58 U/mg)、Protamex 1.6(63 U/mg),南宁市庞博生物工程有限公司;抑肽酶(6 511.51 Da,CAS号9087-70-1)、溶菌酶(2 899.27 Da,CAS号12650-88-3)、维生素B12(1 355.37 Da,CAS号68-19-9)、L-酪氨酸(181.19 Da,CAS号60-18-4),美国Sigma公司;甲酸、乙腈为色谱纯,硝酸为优级纯,其他试剂为分析纯。
1.2 仪器与设备
FE28型pH计,梅特勒-托利多仪器(上海)有限公司;XP205型分析天平,上海天平仪器厂;7500cx型ICP-MS,美国Agilent公司;Waters-e2694高效液相色谱仪,美国Waters公司;Xevo RP-HPLC-Q-Tof MS质谱,美国Waters公司;DX-7000型喷雾干燥机,东京理化器械株式会社。
1.3 实验方法
1.3.1 华贵栉孔扇贝酶解产物的制备
将华贵栉孔扇贝肉经过4 ℃冰箱中冷藏解冻,用打浆机将贝肉打成肉糜,准确称取20.00 g肉糜于烧杯中加入一定质量体积比的蒸馏水,以8 000 r/min均质90 s,用1 mol/L的NaOH或HCl调节蛋白酶解所需pH,加入适量的蛋白酶并设置相应酶解温度,酶解过程中维持pH稳定;酶解结束后,95~100 ℃下灭酶10 min,混合液4 ℃离心(4 500 r/min,10 min),取上清液备用。
1.3.2 华贵栉孔扇贝水解蛋白酶的选择
据GUERRA等[9]文献报道并结合课题组前期研究,选择中性蛋白酶(最适pH 7.0,后以数字表示)、木瓜蛋白酶(6.5)、动物的蛋白酶(6.5)、胰蛋白酶(7.0)、Protamex 1.6(7.0)和菠萝蛋白酶(7.0)6种蛋白酶分别对华贵栉孔扇贝进行酶解;按1.3.1调节各酶所需pH,加酶量3 000 U/g,料液比1∶3,温度50 ℃ 酶解3 h,以水解度(degree of hydrolysis,DH)为测定指标,进行水解蛋白酶的筛选。水解度计算如公式(1)所示:
(1)
式中:X为水解度,%;A为酶解液氨基氮含量,g/100g(下同);B为原料游离氨基氮含量;C为原料总氮含量;D为原料中非蛋白氮含量。酶解液及游离氨基氮测定采用中性甲醛电位滴定法测定。
1.3.3 华贵栉孔扇贝中性蛋白酶单因素试验
根据1.3.2中选择水解度最高的中性蛋白酶进行单因素试验,探究中性蛋白酶酶解温度、料液比及加酶量3个因素对华贵栉孔扇贝水解度的影响;设置酶解温度40、45、50、55、60 ℃,料液比1∶2、1∶3、1∶4、1∶5、1∶6,加酶量1 000、2 000、3 000、4 000、5 000 U/g,酶解pH 7.0,酶解时间3 h的酶解条件,比较不同条件对华贵栉孔扇贝水解度的影响。
1.3.4 响应面优化华贵栉孔扇贝酶解工艺
在单因素的基础上,设计加酶量,温度,料液比3因素3水平试验,如表1所示,以华贵栉孔扇贝蛋白水解度及酶解产物中硒溶出率(selenium dissolution rate,SDR)为指标,计算如公式(2)所示:
(2)
式中:Y为硒溶出率,%;C为酶解液中硒含量,μg/L;V为酶解液总体积,L;M为华贵栉孔扇贝总硒含量,μg/g;m为样品称重质量,g。酶解液中硒含量测定参考GB/T 5009.263—2016法。
表1 Box-Behnken实验因素水平表
Table 1 Box-Behnken experimental factor level table

水平因素A(温度)/℃B(料液比)C(加酶量)/(U·g-1)-1451∶23 0000501∶34 0001551∶45 000
1.3.5 酶解时间对华贵栉孔扇贝酶解工艺的影响
在优化工艺最优条件下,比较不同酶解时间对蛋白水解度和硒溶出率的影响,酶解时间设置为2、3、4、5、6、7 h,酶解pH为7.0。
1.3.6 华贵栉孔扇贝酶解产物分子质量分布及肽质谱分析
HPSEC分析不同时间酶解产物分子质量分布情况。色谱柱:TSK gel G 4000 SW(7.5 mm×300 mm)柱;检测波长:214 nm;流动相速率:0.7 mL/min;柱温:室温;进样体积:20 μL;流动相:50 mmol/L磷酸盐缓冲液,含0.3 mol/L NaCl,pH 7.0。标准品及样品进样溶液配制,L-酪氨酸、维生素B12、溶菌酶、抑肽酶各取10 mg,溶于10 mL流动相中,配制成1 mg/mL标准溶液(样品根据实际情况稀释),过0.22 μm滤膜,标准品分子质量分布结果如图1所示。以保留时间为横坐标,以lgMw为纵坐标,得到标准曲线方程为:lgMw=-0.080 7t+4.560 6,R2=0.980 6。
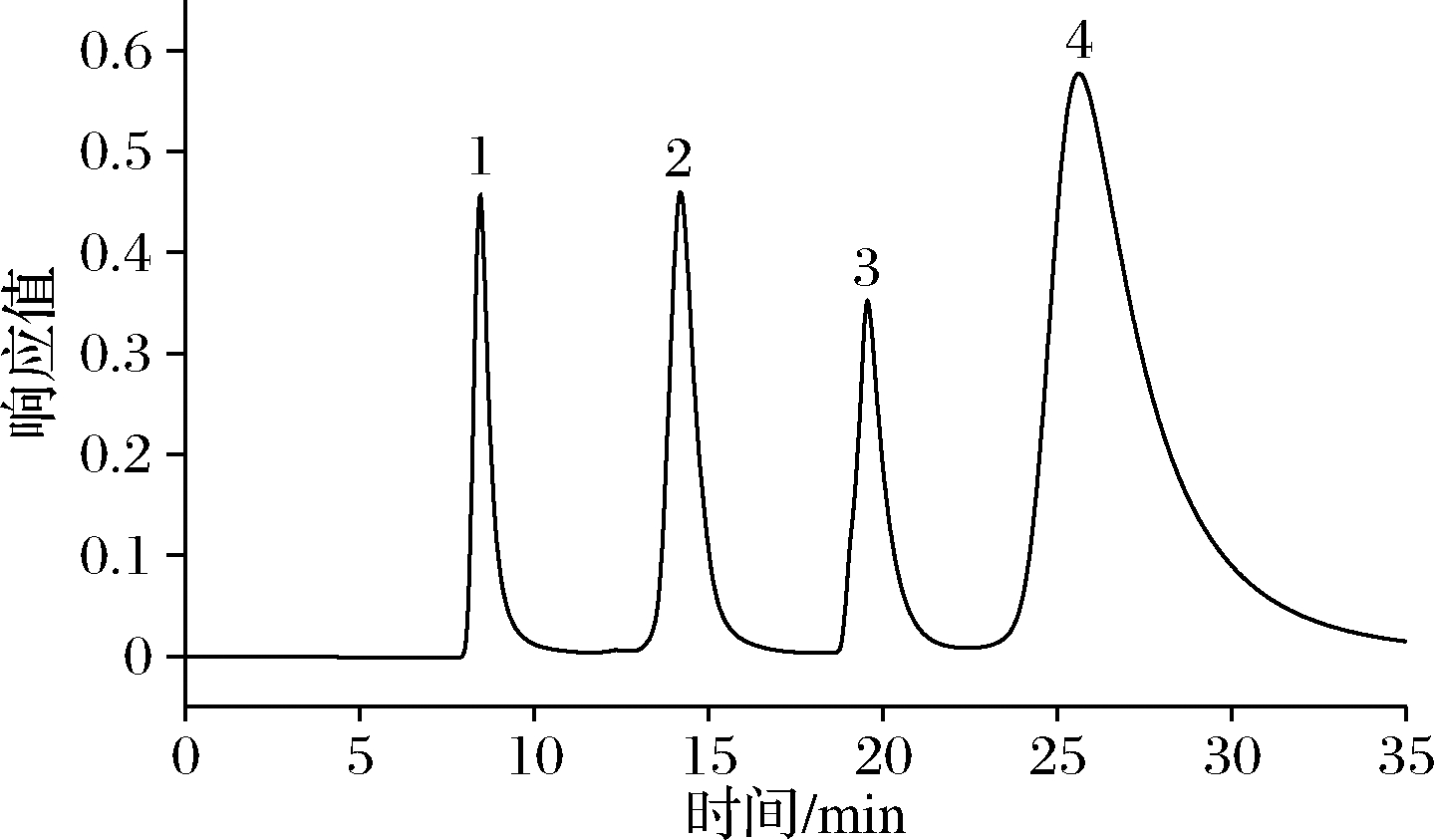
1-抑肽酶;2-溶菌酶;3-维生素B12;4-L-酪氨酸
图1 标准品分子质量分布图谱
Fig.1 Molecular weight distribution map of the reference materials
采用Xevo RP-HPLC-Q-Tof-MS质谱,分析不同酶解时间酶解产物中蛋白肽及氨基酸成分分布情况。酶解产物经过截留量100 Da透析袋脱盐;流动相为20%的乙腈水溶液(含0.1% FA),流动相流速0.5 mL/min,色谱柱:Waters UPLC&BEH C18 2.1 mm×50 mm,1.7 μm。质谱条件:离子化模式,ESI(±);毛细管电压,2~2.5 kV(+)/(-);一级锥孔电压,20 V;破碎电压,20~30 V;源温度,120 ℃;干燥气流,700 L/h;干燥气温度450 ℃。
1.3.7 基本成分测定
水分含量:参考GB 5009.3—2016《食品中水分的测定》;灰分含量:参考GB 5009.4—2016《食品中灰分的测定》;蛋白质含量:参考GB 5009.5—2016《食品中蛋白质的测定》;总糖含量:参考GB/T 9695.31—2008 《肉制品总糖含量测定》;脂肪含量:参考GB 5009.5—2016《食品中脂肪的测定》。
1.3.8 酶解蛋白粉氨基酸测定
通过质谱测定酶解产物肽分布情况及硒溶出率比较,在工艺优化的基础上,以酶解时间6 h制备酶解产物,浓缩至固形物含量为20%~25%,进行喷雾干燥制备粉剂。喷雾条件:蠕动泵流速:约42.86 mL/min;进风口温度(165±3) ℃,出风口温度100 ℃,均质化压力0.5 MPa;得到的蛋白粉参照GB 5009.124—2016《食品中氨基酸的测定》测定游离氨基酸和水解氨基酸含量。氨基酸营养评价参考1973 FAO/WHO成人标准模式,通过氨基酸评分(amino acid score,AAS)、氨基酸化学评分(chemical score,CS)及氨基酸系数评分(essential amino acid index,EAAI)进行评价,计算如公式(3)~公式(5)所示,
(3)
(4)
(5)
式中:x,样品中蛋白质氨基酸含量,mg/g;y,FAO/WHO推荐模式下蛋白质氨基酸含量,mg/g;z:参考标准全鸡蛋蛋白质氨基酸含量,mg/g。a:样品中蛋白质必需氨基酸含量,mg/g;b:参考标准全鸡蛋蛋白质必需氨基酸含量,mg/g;n:被比较的必需氨基酸数量。
1.3.9 酶解蛋白粉矿物质组成测定
参考GB 10765—2010《婴儿配方食品》测定酶解蛋白粉中矿物质元素及重金属铅含量指标:钠、钾、磷、钙、镁、铁、锌、硒、铜、锰及重金属铅,采用电感耦合等离子体质谱法进行矿物质含量测定。
1.4 数据处理
采用Excel 2010进行数据处理及方差分析,实验数据以![]() 表示,实验平行3次,Origin 2018作图;通过Design-Expert 8.0.6进行响应面优化设计及相关分析。
表示,实验平行3次,Origin 2018作图;通过Design-Expert 8.0.6进行响应面优化设计及相关分析。
2 结果与分析
2.1 华贵栉孔扇贝最佳水解蛋白酶的选择
选择常用于水产品及肉制品小分子活性肽制备与提取的蛋白酶是制备目标产物的关键,中性蛋白酶和菠萝蛋白酶分别应用于凡纳冰对虾[10]和罗非鱼[11]ACE抑制肽的功能活性和活性作用机制的研究,动物蛋白酶、木瓜蛋白酶应用于池蝶蚌酶解产物功能活性的研究[12],胰蛋白酶在罗非鱼肉酶解产物矿物离子结合能力的应用研究[13],以及Protamax复合蛋白酶应用牡蛎风味物质的研究[14],诸多研究表明以上蛋白酶对水产品蛋白水解能力显著,因此选择这6种蛋白酶应用于华贵栉孔扇贝蛋白粉的制备研究。硒在生物体内以硒结合蛋白的形式存在,枯草杆菌中性蛋白酶是一种包含内切酶和外切酶的复合蛋白酶[15]。由图2可以看出,在含肌基质蛋白较高的华贵栉孔扇贝组织中,其蛋白水解度较高,达到28.53%,高于动物蛋白酶的26.12%(P<0.05)。其余4种蛋白酶对华贵栉孔扇贝的水解能力较低,其水解度均低于25%。因此选择中性蛋白酶用于后续研究。

图2 不同蛋白酶对华贵栉孔扇贝蛋白水解能力的影响
Fig.2 Effects of proteases on the proteolytic ability of Chlamys nobilis 注:不同字母表示差异显著(P<0.05)(下同)
2.2 中性蛋白酶酶解单因素试验结果
2.2.1 加酶量对华贵栉孔扇贝水解度的影响
如图3-a所示,加酶量为1 000~4 000 U/g时,水解度逐步增加,当加酶量为4 000 U/g时水解度29.65%,达到最大值,加酶量继续增加水解度反而略微下降,但较4 000 U/g时差异不显著(P>0.05);当加酶量达到5 000 U/g时,酶催化底物反应接近饱和状态。因此,结合生产成本选择4 000 U/g作为响应面优化中心点。
2.2.2 料液比对华贵栉孔扇贝水解度的影响
料液比的变化影响溶质的分散程度,因此探究物料在溶液中合理的分散比例,能更好地促进酶与底物的催化反应进行。如图3-b所示,料液比为1∶2时,水解度较低,仅为22.55%,此时物料含量为0.5 g/mL,实验观察发现溶液过于浓稠,待酶解反应1 h后逐渐呈现水液状态,表明华贵栉孔扇贝肉糜的分散比例低影响酶与底物的接触,从而影响酶的水解能力;当料液比增大到1∶3时,物料含量0.33 g/mL,水解度相较于料液比1∶2迅速增加,增幅趋势明显(P<0.05);之后随料液比的增加,水解度变化基本趋于稳定(P>0.05)伴小幅波动。因此选择料液比1∶3作为优化中心点。
2.2.3 温度对华贵栉孔扇贝水解度的影响
中性蛋白酶对温度致敏,温度过低或过高影响酶活性从而导致水解度降低。由图3-c可以看出,中性蛋白酶水解能力随温度升高呈现出先增后减的趋势,温度为50 ℃时水解度达到最大值为28.84%,50~55 ℃水解度有所降低;这一结果与吕振磊等[16]优化紫贻贝工艺条件酶解温度对水解度的影响趋势一致。55~60 ℃时水解度大幅降低,降幅相较前一个温度跨度极为显著(P<0.05),说明温度升高导致酶活性降低或部分酶活性丧失。由45~55 ℃,水解度先升后降的特点,可推测中性蛋白酶最适酶解温度在这一范围内,因此选择以50 ℃为优化中心点。
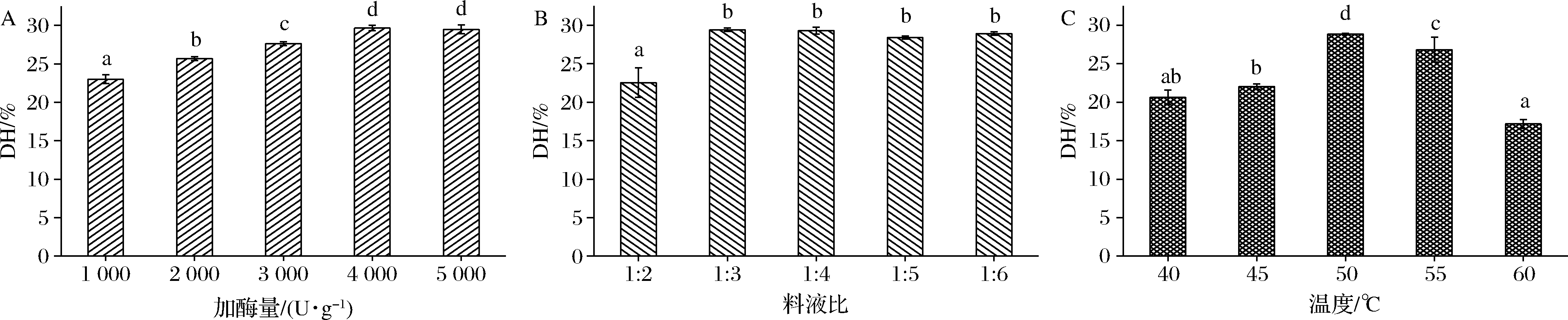
a-加酶量;b-料液比;c-温度
图3 不同条件对华贵栉孔扇贝蛋白水解度的影响
Fig.3 Effects of different conditions on the DH of Chlamys nobilis protein
2.3 华贵栉孔扇贝蛋白水解度及硒溶出率响应面优化
Box-Behnken响应面优化设计实验结果如表2所示,以水解度和硒溶出率为测定指标。编码实验结果进行模型拟合和方差分析,结果见表3,可以看出DH及SDR拟合模型F值分别为51.95和101.21,模型极显著(P<0.01),表明模型拟合度良好,拟合方程可用于模拟分析[15]。
通过Design-Expert 8.0.6得出水解度拟合方程为DH=30.57+2.50A+2.98B+1.23C+0.24AB+0.33AC+1.19BC-2.48A2-2.50B2-1.37C2,硒溶出率拟合方程为SDR=75.26+6.10A+6.23B+2.27C+1.31AB-0.087AC+3.38BC-3.75A2-4.19B2-2.11C2;由表3可知,所选自变量对中性蛋白酶水解度和硒溶出率影响较大,影响程度由大到小依次为料液比>温度>加酶量,水解度模型拟合系数为0.985 2,模型校正系数0.966 3,硒溶出率模型拟合系数为0.992 4,校正系数0.982 6,说明水解度和硒溶出率模型分别有96.63%和98.26%的概率解释自变量对因变量的变化规律。
表2 Box-Behnken响应面优化设计试验
Table 2 Box-Behnken response surface optimization design test
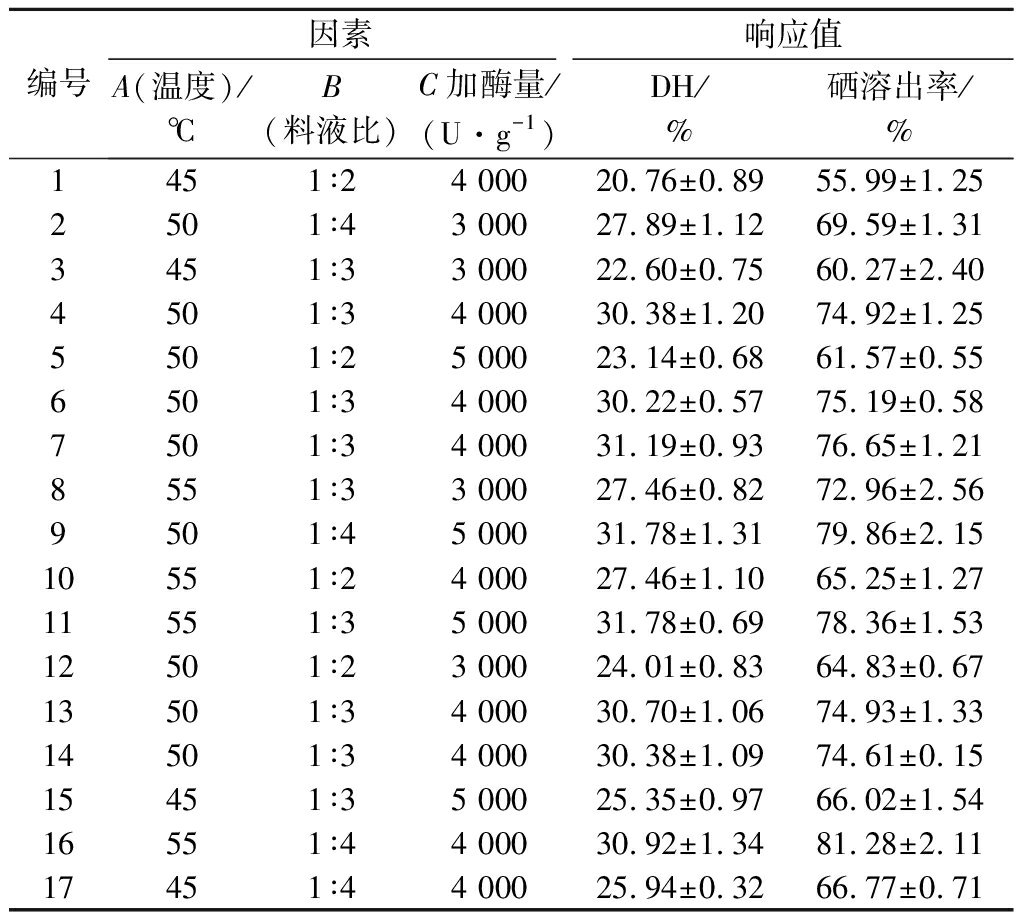
编号因素响应值A(温度)/℃B(料液比)C加酶量/(U·g-1)DH/%硒溶出率/%1451∶24 00020.76±0.8955.99±1.252501∶43 00027.89±1.1269.59±1.313451∶33 00022.60±0.7560.27±2.404501∶34 00030.38±1.2074.92±1.255501∶25 00023.14±0.6861.57±0.556501∶34 00030.22±0.5775.19±0.587501∶34 00031.19±0.9376.65±1.218551∶33 00027.46±0.8272.96±2.569501∶45 00031.78±1.3179.86±2.1510551∶24 00027.46±1.1065.25±1.2711551∶35 00031.78±0.6978.36±1.5312501∶23 00024.01±0.8364.83±0.6713501∶34 00030.70±1.0674.93±1.3314501∶34 00030.38±1.0974.61±0.1515451∶35 00025.35±0.9766.02±1.5416551∶44 00030.92±1.3481.28±2.1117451∶44 00025.94±0.3266.77±0.71
由图4-c、图4-f可以看出,因素料液比和加酶量对水解度和硒溶出率具有交互作用,表3中料液比和加酶量交互作用F值分别为12.82和47.90,在统计学上具有极显著性差异(P<0.01);RUAN等[17]研究认为酶活性中心包埋在蛋白分子结构中是影响蛋白水解的关键因素。表2中实验2、4、5和实验10~16结果均表明,酶在反应体系中的分散系数(酶添加量与体系溶剂体积比值)增大,水解度和硒溶出率呈现先升后降趋势,说明酶在反应体系中与底物的结合效率在某一分散系数下达到饱和,增加或降低酶分散系数,则会出现酶竞争性抑制[15]或酶与底物结合比例降低,从而影响水解度和硒溶出率。同样表现出具有交互作用的是图4-d温度和料液比对硒溶出率影响,表3中其交互影响F值7.23,达到显著水平(P<0.05);其余因素交互影响均不显著。经过对响应面3个因素分析得出最佳组合参数为酶解温度53.03 ℃、料液比1∶3.84、加酶量4 885.33 U/g,模型预测水解度达到33.12%,硒溶出率为83.34%。为方便实验操作,将参数调整为酶解温度53 ℃、料液比1∶3.8,加酶量4 885 U/g (为原料质量的0.48%),以验证模型准确性;在该条件下,测定水解度值为(32.40±0.32)%,硒溶出率为(81.78±1.39)%,与预测值相比差异均不显著(P>0.05),表明模型拟合较好,进一步验证模型准确性。
表3 DH及SDR响应面二次回归模型及方差分析
Table 3 DH and SDR response surface quadratic regression model and analysis of variance

方差来源DH/%硒溶出率/%F值 P值显著性F值P值显著性模型51.95<0.000 1∗∗101.21<0.000 1∗∗A113.44<0.000 1∗∗311.42<0.000 1∗∗B161.57<0.000 1∗∗325.30<0.000 1∗∗C27.380.001 2 ∗∗43.090.000 3∗∗AB0.540.484 6-7.230.031 1∗AC0.960.359 5-0.0320.863 7-BC12.820.009 0∗∗47.900.000 2∗∗A258.55<0.000 1∗∗61.970.000 1∗∗B259.77<0.000 1∗∗77.38<0.000 1∗∗C217.840.003 9∗∗19.600.003 1∗∗失拟项5.540.065 9-2.130.238 7-R20.985 20.992 4R2adj0.966 30.982 6
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01);-表示差异不显著(P>0.05)
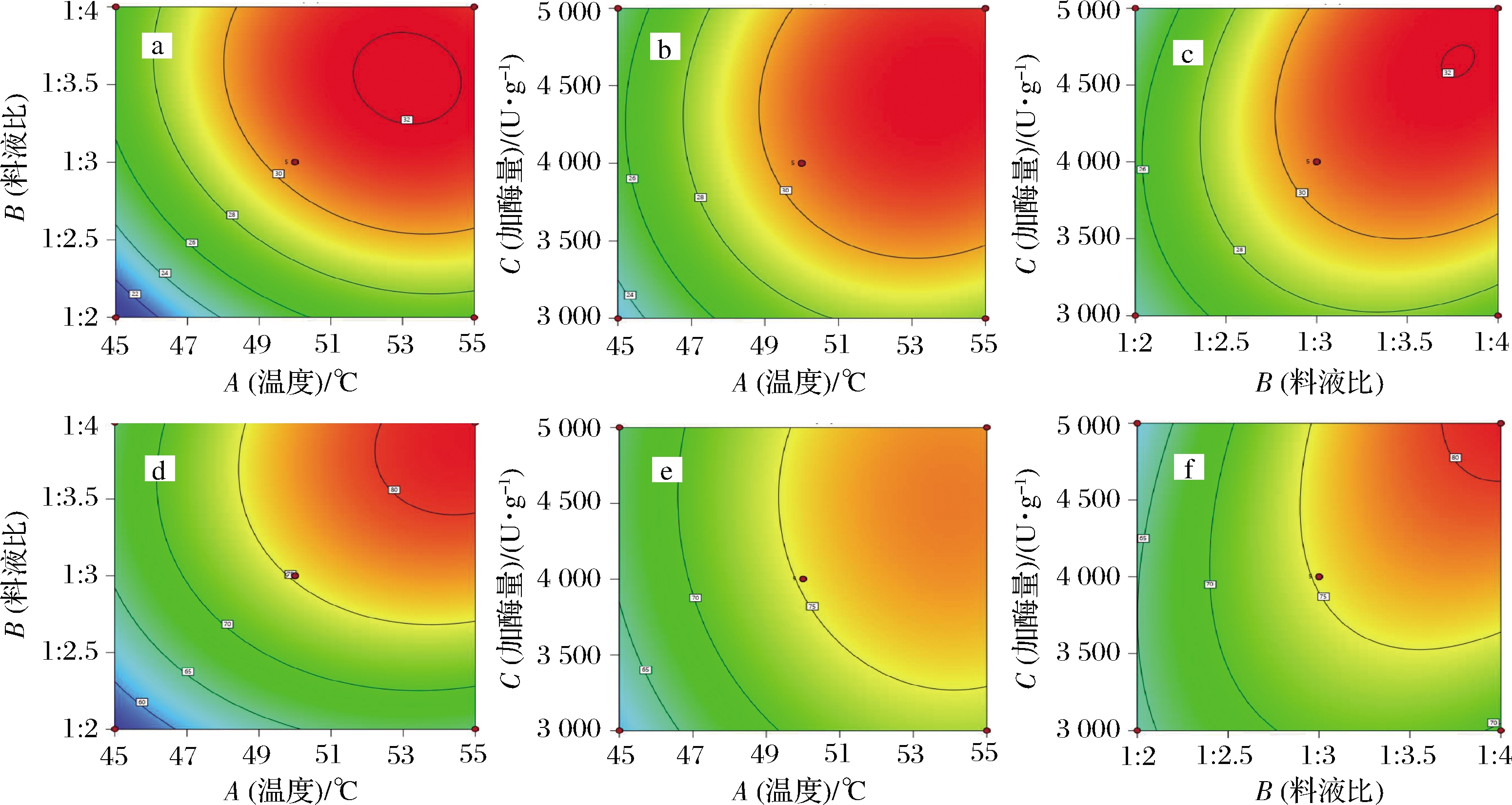
a~c-DH影响因素的交互作用;d~f-SDR影响因素的交互作用
图4 水解度和硒溶出率因素交互作用等高线图
Fig.4 Contour maps of the interaction between the DH and the SDR
2.4 不同酶解时间对DH和SDR影响
以响应面模型优化参数,进一步探究不同酶解时间对水解度及硒溶出率的影响,结果如图5所示。从整体可以看出,硒溶出率与水解度呈现正相关,在一定酶解时间内,硒溶出率随水解度增大而增加。在酶解时间2~3 h的过程中水解速率和硒溶出率均增长迅速,在这一过程中大量可溶性蛋白被释放出来,增加了酶与底物蛋白的接触面积从而使水解速率加快,已有研究表明[18]硒在生物体中多以蛋白肽形式存在,随蛋白肽被释放到酶解液中,硒溶出率也迅速增长;之后水解度呈现稳步增长趋势,硒溶出率在3~5 h 增长趋势较为缓慢,5 h后迅速增加到最大值,继续酶解硒溶出率反而有所降低。通过实验观察发现,酶解过程中酶解液逐渐澄清,可能存在不溶性肌基质蛋白也逐步被分解,释放出含硒肽,从而使硒溶出率增加;当酶解时间达到6 h,硒溶出率达到最大97.02%,此时水解度达到46.95%,之后继续酶解硒溶出率为95.05%略有降低,与酶解6 h相比硒溶出率差异不显著(P>0.05)。
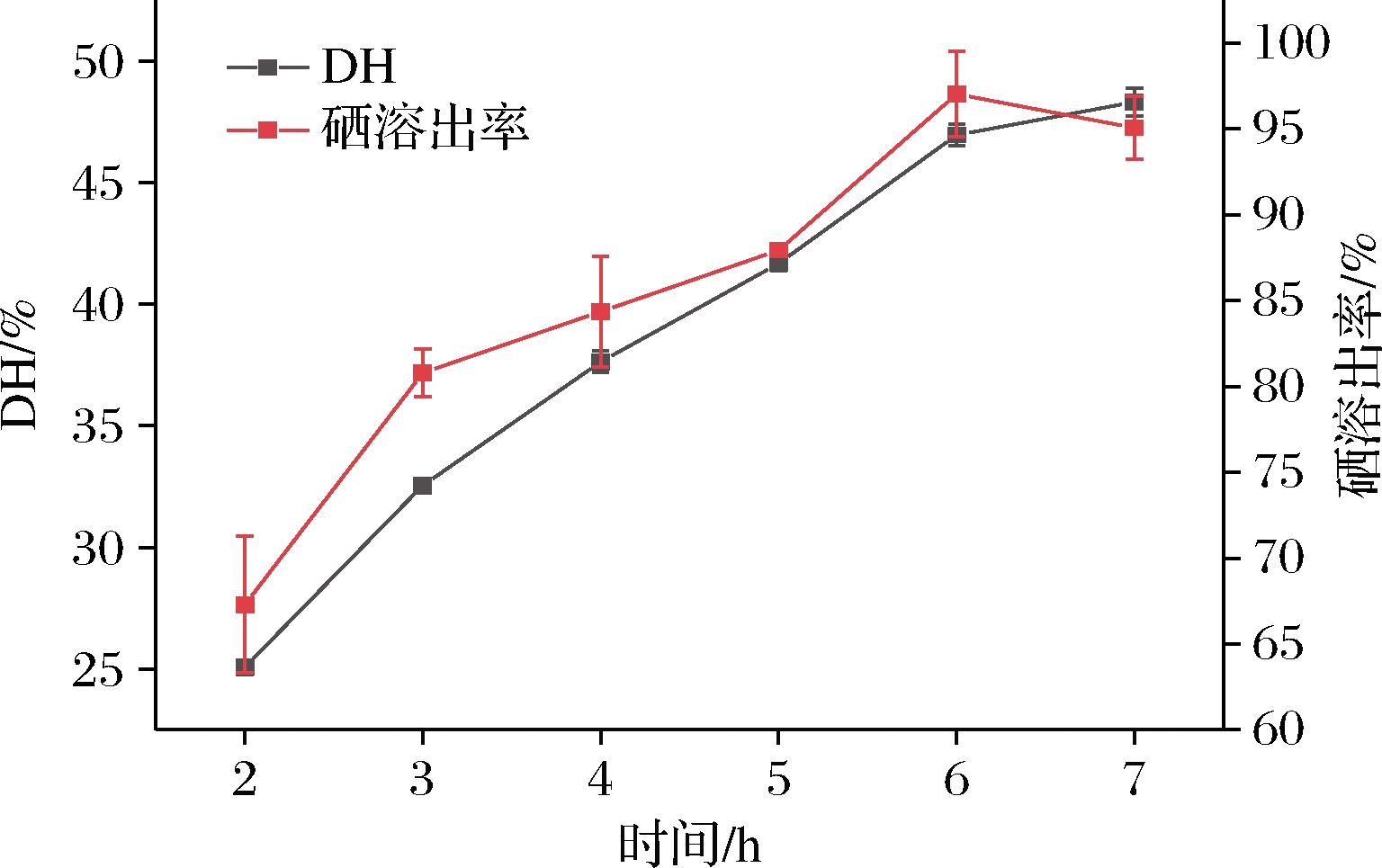
图5 酶解时间对水解度和硒溶出率的影响
Fig.5 Effects of enzymatic hydrolysis time on DH and SDR
2.5 不同酶解时间酶解产物分子质量分布及肽质谱分析
采用体积排阻色谱对不同时间酶解产物分子质量的分布进行测定,结果见图6-a,由图6-a可以看出,华贵栉孔扇贝未经过酶解和酶解在之后分子质量分布差异明显;随酶解时间延长酶解产物种类变化不明显。对不同酶解时间产物分子质量分布峰面积占比统计,结果见图6-b,当酶解时间为0.5 h,分子质量大于5 kDa的肽类减少,同时3~5 kDa和1~3 kDa的肽含量迅速增多,小于1 kDa的肽在酶解1 h后明显增多;酶解时间2 h后,4个组分增量变化平缓,其中1~3 kDa肽含量分别占比58%、56%、56%,酶解6 h小于1 kDa肽占比11%,说明贝类酶解产物主要以小分子肽为主;何小庆等[19]波纹巴非蛤酶解液分子质量小于3 kDa占比55.12%。酶解产物中小于1 kDa肽种类变化对产品风味影响较大,因此选择对2、4和6 h酶解产物进行0~1 200 m/z一级质谱分析,结果如图6-c所示,酶解2 h酶解液中包含质荷比122 m/z~1 197 m/z的小分子肽,平均肽链长度为3.99,与酶解4 h和6 h肽段区间相似。从离子丰度可以看出,不同酶解时间节点质荷比小于800 m/z肽离子丰度相对质荷比800~1 200 m/z要高,邬威等[20]研究中性蛋白酶酶解牛心肌分子质量分布小于500 Da占40%以上。当酶解时间增加到4 h,酶解液中肽的离子丰度也相应增加,平均肽链长度为3.07,质荷比266~460 m/z的小分子肽增多;当酶解时间达到6 h后,平均肽链长度降低为2.13,质荷比274 m/z的吸收峰丰度降低甚至消失,说明小分子肽也逐步被分解。质谱结果表明,小分子肽种类随酶解时间延长而增多,小分子肽的增多更有利于华贵栉孔扇贝蛋白粉的开发;由图6-b可以看出,6 h后继续酶解小于3 kDa 的小分子肽含量仍有增长趋势,但有研究表明[21],酶解时间过长会使苦味肽含量增加,影响产品感官;因此控制酶解时间为6 h,酶解产物小于3 kDa肽的含量占67%,为高品质蛋白粉的开发提供保障。
2.6 华贵栉孔扇贝及酶解蛋白粉基本成分分析
华贵栉孔扇贝及蛋白粉基本成分如表4所示,华贵栉孔扇贝蛋白含量为12.46 g/100g(湿基),经过酶解得到蛋白粉蛋白含量达到82.58 g/100g,水分含量较低,灰分和粗脂肪含量较酶解前均有所降低,总糖含量升高,得到的酶解蛋白粉具有高蛋白低脂的特点。
2.7 华贵栉孔扇贝酶解蛋白粉营养评价
华贵栉孔扇贝酶解蛋白粉氨基酸含量测定结果如表5所示,华贵栉孔扇贝酶解蛋白粉总氨基酸含量达到65.15 g/100g,游离氨基酸总量为8.12 g/100g,肽基氨基酸含量为57.03 g/100g,占氨基酸总量的87.54%,其中参与人脑组织化学合成主要氨基酸谷氨酸含量最高占10.5%,可促进学龄儿童大脑发育。FAO/WHO推荐的理想蛋白模式认为,质量较好的蛋白质其氨基酸组成EAA/TAA在40%左右,EAA/NEAA在0.6以上[22];华贵栉孔扇贝酶解蛋白粉必需氨基酸种类齐全,EAA/TAA为37.57%,EAA/NEAA为0.6019,符合这一模式。如表6所示,华贵栉孔扇贝蛋白粉EAA为122.01%,远高于大黄鱼鱼卵蛋白粉(EAAI为51.9%)[23],可见华贵栉孔扇贝酶解蛋白粉氨基酸含量均高于比较蛋白氨基酸含量,且华贵栉孔扇贝酶解蛋白粉色氨酸含量较高,色氨酸参与IgG/IgM的合成,可增强人体免疫力[22];同时蛋白粉中赖氨酸含量也较高为4.66%,其AAS为190.35,可很好与谷类等主食[24](第一限制氨基酸为赖氨酸)形成互补,提高蛋白利用率。根据1973年FAO/WHO推荐的理想蛋白模式,华贵栉孔扇贝酶解蛋白粉第一限制氨基酸为缬氨酸,AAS为69.72,氨基酸化学评分结果表明,华贵栉孔扇贝酶解蛋白粉营养价值远超鸡蛋;综上可以说明华贵栉孔扇贝酶解蛋白粉是一种优质蛋白,可用于营养保健品的研究与开发。

a-不同时间酶解产物分子质量分布图;b-不同时间各分子质量组分占比; c-2~6 h肽质谱图
图6 华贵栉孔扇贝酶解产物分子质量分布及肽质谱图
Fig.6 Molecular weight distribution and peptide mass spectrometry of the enzymatic hydrolysate of Chlamys nobilis
表4 华贵栉孔扇贝及其酶解蛋白粉的基本成分 单位:g/100g
Table 4 General basic composition of Chlamys nobilis and its enzymatically hydrolyzed protein powder
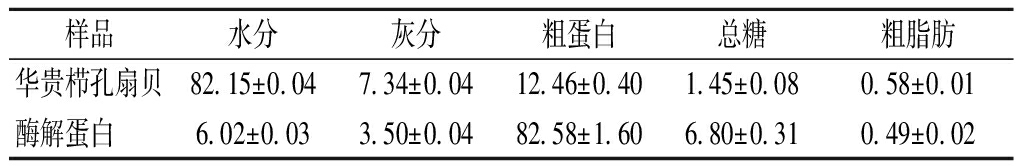
样品水分灰分粗蛋白总糖粗脂肪华贵栉孔扇贝82.15±0.047.34±0.0412.46±0.401.45±0.080.58±0.01酶解蛋白 6.02±0.033.50±0.0482.58±1.606.80±0.310.49±0.02
2.8 华贵栉孔扇贝酶解蛋白粉矿物质元素分析
矿物质元素含量对人体生长发育至关重要,由表7可知,人体必需微量元素中Mn、Fe、Cu、Zn和Se含量丰富,其中Zn含量达到72.22 μg/g,其次是Fe含量为3.744 μg/g;Se含量为1.80 μg/g达到《预包装食品营养标签通则》富硒食品标准(0.15 μg/g),高于富硒大米粉[25](0.57 μg/g),相较于新鲜华贵栉孔扇贝硒含量(0.25 μg/g)有大幅提高,可见酶解使贝肉中硒释放到酶解产物中,使蛋白粉中硒含量较为丰富,提高硒的生物利用率。华贵栉孔扇贝酶解蛋白粉铅含量远低于GB 2762—2017《食品中污染物限量》标准。
表5 华贵栉孔扇贝酶解蛋白粉氨基酸组成含量 及肽基氨基酸含量
Table 5 Amino acid composition and peptide-amino acids content of Chlamys nobilis enzymatically hydrolyzed protein powder
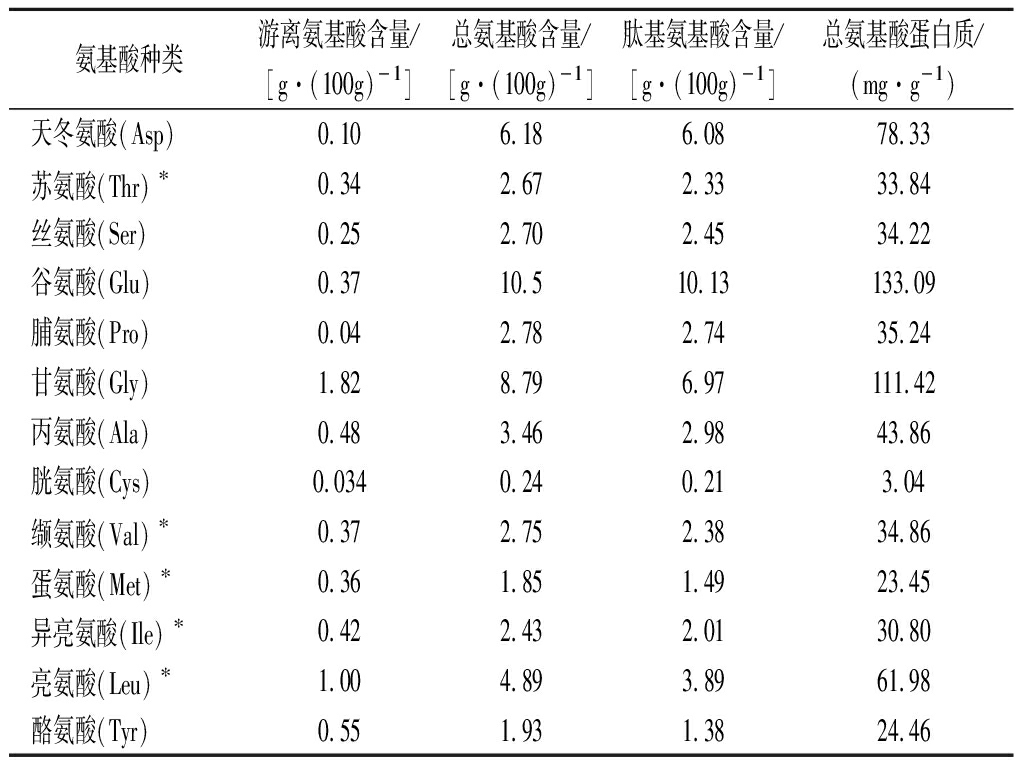
氨基酸种类游离氨基酸含量/[g·(100g)-1]总氨基酸含量/[g·(100g)-1]肽基氨基酸含量/[g·(100g)-1]总氨基酸蛋白质/(mg·g-1)天冬氨酸(Asp)0.106.186.0878.33苏氨酸(Thr)∗0.342.672.3333.84丝氨酸(Ser)0.252.702.4534.22谷氨酸(Glu)0.3710.510.13133.09脯氨酸(Pro)0.042.782.7435.24甘氨酸(Gly)1.828.796.97111.42丙氨酸(Ala)0.483.462.9843.86胱氨酸(Cys)0.0340.240.213.04缬氨酸(Val)∗0.372.752.3834.86蛋氨酸(Met)∗0.361.851.4923.45异亮氨酸(Ile)∗0.422.432.0130.80亮氨酸(Leu)∗1.004.893.8961.98酪氨酸(Tyr)0.551.931.3824.46
续表5

氨基酸种类游离氨基酸含量/[g·(100g)-1]总氨基酸含量/[g·(100g)-1]肽基氨基酸含量/[g·(100g)-1]总氨基酸蛋白质/(mg·g-1)苯丙氨酸(Phe)∗0.642.011.3725.48赖氨酸(Lys)∗0.324.664.3459.07组氨酸(His)0.131.181.0514.96精氨酸(Arg)0.635.094.4664.52色氨酸(Trp)∗0.271.050.7813.31氨基酸总量(TAA)8.1265.1557.03必需氨基酸(EAA)24.48非必需氨基酸(NEAA)40.67EAA/TAA/%37.57NEAA/TAA0.601 9
注:此处*表示必需氨基酸
表6 华贵栉孔扇贝酶解蛋白粉氨基酸营养评价
Table 6 Evaluation of amino acid nutrition of Chlamys nobilis enzymatically hydrolyzed protein powder
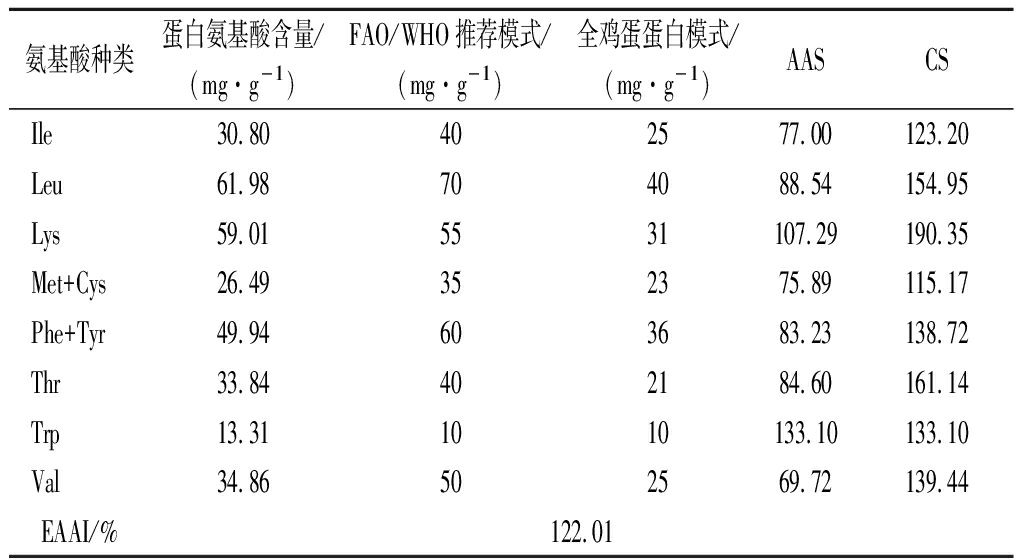
氨基酸种类蛋白氨基酸含量/(mg·g-1)FAO/WHO推荐模式/(mg·g-1)全鸡蛋蛋白模式/(mg·g-1)AASCSIle30.80402577.00123.20Leu61.98704088.54154.95 Lys59.015531107.29190.35Met+Cys26.49352375.89115.17Phe+Tyr49.94603683.23138.72Thr33.84402184.60161.14Trp13.311010133.10133.10Val34.86502569.72139.44EAAI/%122.01
表7 华贵栉孔扇贝酶解蛋白粉矿物质元素含量
Table 7 Mineral element contents of Chalmys nobilis enzymatically hydrolyzed protein powder
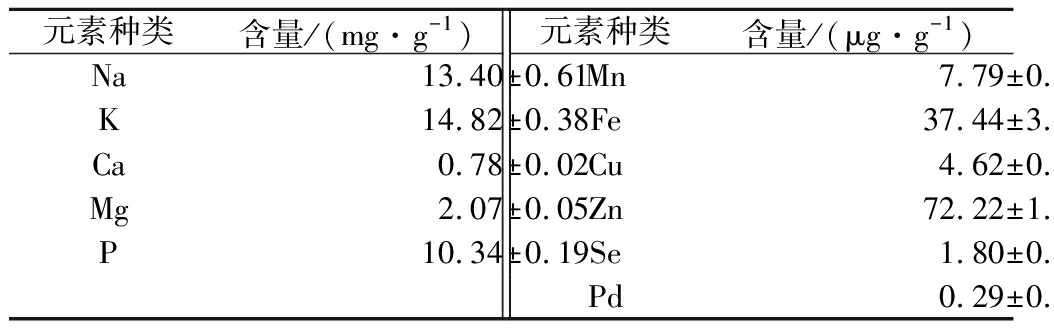
元素种类含量/(mg·g-1)元素种类含量/(μg·g-1)Na13.40±0.61Mn7.79±0.02K14.82±0.38Fe37.44±3.69Ca0.78±0.02Cu4.62±0.10Mg2.07±0.05Zn72.22±1.21P10.34±0.19Se1.80±0.16Pd0.29±0.03
注:重金属铅的国标限量为1.5 μg/g
3 结论
华贵栉孔扇贝最佳酶解工艺为:采用中性蛋白酶,酶解温度53 ℃、料液比1∶3.8、加酶量4 885 U/g,水解度达32.40%,硒溶出率81.78%。比较不同酶解时间对水解度和硒溶出率的影响,结果显示酶解时间6 h时硒溶出率达到最大值97.02%,水解度达到46.95%,酶解产物小于3 kDa肽的含量占67%;质谱结果显示随酶解时间延长,0~1 200 m/z肽比例显著增加。华贵栉孔扇贝酶解蛋白粉蛋白含量为82.58 g/100g,脂肪含量0.49 g/100g,氨基酸总量为65.15 g/100g,其EAAI评分为122.01%,且矿物质元素含量丰富,硒含量高达1.80 μg/g,远超富硒食品标准。综上,华贵栉孔扇贝酶解蛋白粉具有高蛋白低脂肪的特点,且营养价值和含硒量高,可作为硒补充剂用于高端营养保健品的研究与开发。
[1] ASBAGHI, SABOORI, HEKMATDOOST, et al.Effects of selenium supplementation on serum C reactive protein level:A systematic review and meta-analysis of randomized controlled clinical trials[J].Obesity Medicine, 2020, 17:178-182.
[2] PAP L, HOLMGREN A, KHABBA K.Selenium and selenoproteins in health and disease[J].Antioxidants Journal,2010.12:793-795.
[3] SUMANGALA S, COPELAND P R.Molecular mechanism of selenoprotein P synthesis[J].Biochimica et Biophysica Acta, 2018, 1862(11):2 506-2 510.
[4] SHAHID M A, BALAL R M, KHAN N, et al.Selenium impedes cadmium and arsenic toxicity in potato by modulating carbohydrate and nitrogen metabolism[J].Ecotoxicology and Environmental safety, 2019, 180(30):588-599.
[5] WU J, DING J, SHI Y, et al.Inhibition of immunotoxicity of Pb2+-induced RAW264.7 macrophages by selenium species in selenium-enriched rice[J].Food and Chemical Toxiclolgy, 2021, 148:111943.
[6] LIU K H, LI S Y, HAN J D, et al.Effect of selenium on tea (Camellia sinensis) under low temperature:Changes in physiological and biochemical responses and quality[J].Environmental and Experimental Botany, 2021, 188:104-475.
[7] 涂晓玲. 蓝圆鰺蛋白肽粉的营养价值及其免疫活性研究[D].福州:福建农林大学, 2018.
TU X L.Study on the nutritional values and immune activity of Decapterus maruadsi peptide power[D].Fuzhou:Fujian Agriculture and Forestry University, 2018.
[8] 陈海燕. 波纹巴非蛤酶解工艺的研究及其产品开发[D].湛江:广东海洋大学, 2017.
CHEN H Y.Study on the enzymeatic hydrolysis of Paphia undulata and its producrs development[D].Zhanjiang:Guangdong Ocean University, 2017.
[9] GUERRA A, ETIENNE M, LIVRELLI V, et al.Relevance and challenges in modeling human gastric and small intestinal digestion[J].Trends in Biotechnology, 2012, 30(11):591-600.
[10] FENG S M, LIMWACHIRANON J, LUO Z S, et al.Preparation and purification of angiotensin-converting enzyme inhibitory peptides from hydrolysate of shrimp (Litopenaeus vannamei) shell waste[J].International Journal of Food Science and Technology, 2016,51:1 610-1 617.
[11] CHEN J D, SUN S S, LI Y S, et al.Proteolysis of tilapia skin collagen:Identification and release behavior of ACE-inhibitory peptides[J].Food science and Technology, 2021, 139:110502.
[12] 江林. 池蝶蚌酶解产物和多糖生物活性功能分析[D].南昌:南昌大学, 2019.
JIANG L.Analysis on the bioactivity functon of enzyme product and polysaccharides from Hyriopsis schgelii[D].Nanchang:Nanchang University, 2019.
[13] 张金杨, 胡晓, 李来好, 等.罗非鱼酶解物矿物离子结合能力及其结合物抗氧化活性[J].食品与发酵工业, 2018, 44(5):76-81.
ZHANG J Y, HU X, LI L H, et al.Mineral ion binding activity of hydrolysates from Tilapia muscle and antioxidant activities of combinations[J].Food and Fermentation Industries, 2018, 44(5):76-81.
[14] TAE HYUN, JIN HEE, JIYONG S, et al.Optimization of hydrolysis using oyster and oyster cooking drip[J]. Journal of Life Science, 2015, 25(7):795-800.
[15] 柏昌旺. 可控酶解制备牡蛎短肽工艺及其产品开发[D].湛江:广东海洋大学, 2019.
BAI C W.Study on the process of controlled enzymatic hydrolysis of oyster oligopeptides and its product development[D].Zhanjiang:Guangdong Ocean University, 2019.
[16] 吕振磊, 刘朝龙, 王雨生, 等.响应面法优化紫贻贝蛋白酶解工艺条件[J].食品科学, 2012, 33(10):61-66.
LYU Z L, LIU C L, WANG Y S, et al.Optimization of Hydrolysis conditions for Mussel (Mytilus edulis) protein by response surface methodology[J].Food Science, 2012, 33(10):61-66.
[17] RUAN S Y, XIONG J, LI Y L, et al.Improvement in enzymolysis efficiency and bioavailability of rapeseed meal protein concentrate by sequential dual frequency ultrasound pretreatment[J].Process Biochemistry, 2021, 102(12):240-249.
[18] FANG Y, CATRON B, ZHANG Y F, et al.Distribution and in vitro availability of selenium in selenium-containing storage protein from selenium-enriched rice utilizing optimized extraction[J].Journal of Agriculture & Developmental Biology-Animal, 2018, 54(5):335-347.
[19] 何小庆, 曹文红, 章超桦, 等.波纹巴非蛤蛋白酶解产物的抗氧化活性及分子量分布研究[J].现代食品科技, 2014, 30(1):74-80.
HE X Q, CAO W H, ZHANG C H, et al.Antioxidant activity and molecular weight distribution of protease from Paphia undulata[J].Modern Food Technology, 2014, 30(1):74-80.
[20] 邬威,王瑾,付余.牛心肌蛋白酶解物的呈味特性与其结构关系研究[J/OL].食品与发酵工业, 2021.DOI:org/10.13995/j.cnki.11-1802/ts.028741.
WU W, WANG J, FU Y.Study on the relationship between taste characteristics and structure of bovine cardiac muscle protein hydrolysates[J/OL].Food and Fermentation Industries, 2021.DOI:org/10.13995/j.cnki.11-1802/ts.028741.
[21] TONG X H, LIAN Z T, MIAO L M, et al.An innovative two-step enzyme-assisted aqueous extraction for the production of reduced bitterness soybean protein hydrolysates with high nutritional value[J].Food science and Technology, 2020, 134:110151.
[22] CHEN L H, ZENG W H RONG Y Z, et al.Nutritional composition and textural quality of wild-caught and cage-cultured small yellow croaker (Larimichthys polyactis)[J].Journal of Food Composition and Analysis, 2021.DOI:https://org/10.1016/j.jfca.2021.104370.
[23] 周静, 李惠芳, 梁鹏.大黄鱼脱脂鱼卵蛋白粉品质分析及其营养评价[J].食品工业, 2020, 41(7):322-325.
ZHOU J, LI H F, LIANG P.Quality analysis and nutritional evaluation of defatted fish roe protein powder in Large yellow croaker[J].Food Industry, 2020, 41(7):322-325.
[24] 喻芸. 复配大米蛋白理化性质和功能特性的研究[D].南昌:南昌大学, 2017.
YU Y.Chenges of physical chemical properties and functional properties of ricemixed protein[D].Nanchang:Nanchang University, 2017.
[25] 龚如雨, 钟松臻, 张宝军, 等.富硒、非富硒大米有机硒的组成及硒的可利用度分析[J].食品研究与开发, 2017, 38(20):11-15.
GONG R Y, ZHONG S Z, ZHANG Z J, et al.Organic selenium composition and availability of selenium in se-enriched and non-se-enriched rice[J].Food Research and Development, 2017, 38(20):11-15.