肌氨酸氧化酶(sarcosine oxidase,SOX,EC.1.5.3.1)是一种黄素氧化酶,催化肌氨酸的甲基脱除反应从而生成甘氨酸,其辅因子是黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)或黄素单核苷酸(flavin mononucleotide,FMN)[1-2]。近年来,SOX已被广泛应用于临床测试中,与肌酸酐酶、肌酸酐酶一起测定人体中肌酐含量[3]。此外,在食品工业中,基于SOX的生物传感器和探针已被用于在葡萄酒发酵中测定有机酸和甘油的含量[4-5]。在之前的报道中,芽孢杆菌属(Bacillus sp.)的SOX(BSOX)基因(GenBank:A Y626822.2)在大肠杆菌中高效表达[6-7],但由于疏水基团容易暴露,较长的储存时间往往导致二级结构的破坏和最终聚集,导致该酶的热稳定性较差[8]。为筛选出具有良好耐热性的菌株,从来源于美国黄石公园碱性温泉极端嗜热菌Therommicrobium roseum DSM 5159[9]的全基因组中筛选出一个假设的SOX基因(GenBank:ACM06094.1),命名为TrSOX。将TrSOX基因插入含有L-鼠李糖诱导的启动子的pRhamTM质粒中,并在大肠杆菌BL21(DE3)中表达,但大部分重组酶为包涵体。之后又通过随机诱变,筛选到稳定性低的可溶性突变体(F235V/F339L)[10]。
枯草芽孢杆菌(Bacillus subtilis)WB600是重组表达外源蛋白较为便利的宿主细胞[11-12],所以为尝试提高目的蛋白的可溶性,将TrSOX基因插入到pMA5质粒中,然后在该系统中表达,结果表明TrSOX的可溶性表达水平升高并表现出明显的耐热性和有机溶剂耐受性[13]。为进一步提高TrSOX在枯草芽孢杆菌WB600中的表达水平,构建了含有木糖诱导启动子的pMA5-Pxyl质粒并设计了S320R突变体来降低TrSOX[14]的表面疏水性。此外,TrSOX已被证明是一种手性特异性N-甲基脱除酶,能够识别N-甲基-L-氨基酸类化合物和其他N-甲基非氨基酸化合物[13-14]。在之前的工作中,TrSOX还被证明可以促进N-甲基氮农药的降解[15],并且对环境的毒害较少,这为酶法降解此类农药开创了先河。
N-甲基脱除反应对科研工作者仍然是一个巨大的挑战,虽然人们已经研究了许多化学方法[16-17],但是所有这些化学反应都需要极端的反应条件,反应速度较慢,而且所用试剂大多有一定的毒性。目前,虽然已经报道了几种能够在温和环境、友好反应条件下通过特定的酶完成N-脱甲基化的反应,然而,这些酶对底物没有手性选择性[18-19]。由于TrSOX能够有效地去除具有手性特异性底物中的N-甲基[20],因此在化学、医药和食品领域有很大的应用潜力。但是野生型TrSOX对N-甲基-L-氨基酸类的底物适应性仍然有限,有必要扩大底物谱,提高催化活性。
氨基酸序列比对表明TrSOX第54位的Arg是同源家族催化中心限制性保守残基之一,其蛋白结构中胍基可能和氨基酸类底物的羧酸基形成直接的相互作用,也可能会影响底物的手性选择性,因此R54位的突变可能在TrSOX的催化活性中起着重要的作用[13-14]。然而,目前还不清楚该位点如何改造会影响催化性能,在某些酶的分子进化研究中发现,一些严格保守位点的突变带来了有趣的结果[21-22],因此本研究采用R54定点饱和突变来影响TrSOX对N-甲基底物的催化性质。
1 材料和方法
1.1 材料
1.1.1 菌种与质粒
克隆宿主Escherichia coli JM109、DH5α菌种、表达宿主B.subtilis WB600菌种,粮食发酵工艺与技术国家工程实验室保存;质粒pMA5(启动子经过优化),目的基因TrSOX基因(GenBank:ACM06094.1)已经克隆于pMA5质粒上[14],以下简称Pxyl-pMA5-TrSOX质粒,本实验室完成。
1.1.2 实验试剂和培养基
氨苄青霉素、硫酸卡那霉素、溶菌酶、2×Taq PCR Master Mix、辣根过氧化物酶、SDS-PAGE变性凝胶电泳试剂盒,生工生物工程(上海)股份有限公司;质粒抽提试剂盒,天根生物有限公司;咪唑、4-氨基-安替比林,国药集团化学试剂有限公司;Mut Express ⅡFast Mutagenesis Kit V2突变试剂盒,诺唯赞生物科技有限公司;N-甲基底物,麦克林生化科技有限公司;DNA marker、蛋白质分子量标准品、限制性核酸内切酶(Nde I和Mlu I),TaKaRa 公司(大连);合成并且基因的测序,金唯智生物科技有限公司。
木糖诱导剂:无菌水配成200 g/L的木糖溶液装于无菌容器中,在向菌液中加入诱导剂时,于超净台中用0.22 μm水系滤膜过滤。
显色液:1 mmol/L 4-氨基-安替比林、6 mmol/L苯酚、7 000 U/L辣根过氧化物酶,缓冲液为20 mmol/L pH为8的Tris-HCl溶液。
LB(种子液)培养基(g/L):酵母提取物5.0、蛋白胨10.0、氯化钠10.0、LB固体培养基需要另加20.0 g的琼脂。
TB(发酵)培养基(g/L):蛋白胨12.0、酵母提取物24.0、甘油4 mL、磷酸二氢钾2.31、磷酸氢二钾16.2。培养基使用时根据抗性选择需要添加终质量浓度为0.1 mg/mL的氨苄青霉素/硫酸卡那霉素。
筛选平板:酵母培养基5.0 g/L,蛋白胨10.0 g/L,氯化钠10.0 g/L,琼脂粉20.0 g/L,121 ℃灭菌20 min。待培养基冷却至50 ℃左右,加入经灭菌0.22 μm针头式过滤器过滤的200 g/L木糖诱导剂,0.1 mg/mL卡那抗生素,8.8 mmol/L的底物,1 mmol/L 4-氨基-安替比林、6 mmol/L苯酚、7 000 U/L辣根过氧化物酶[10]。
1.1.3 仪器与设备
紫外可见分光光度计,上海元析仪器有限公司;高温灭菌锅,致徽(厦门)仪器有限公司;双人单面净化工作台,苏州净化设备有限公司;紫外检测仪,上海金达生化仪器有限公司;恒温金属浴,杭州米欧仪器有限公司;镍柱,江苏千纯生物有限公司;EDG-81 PCR仪,东胜创新生物技术科技有限公司。
1.2 实验方法
1.2.1 结构模拟
将高产突变菌株TrSOX(S320R)[14]进行蛋白结晶,使用NeXtal系列蛋白质结晶试剂盒(Qiagen, USA)筛选结晶条件,获得的棒状晶体于上海同步光源(SSFR)Beamline 17U进行X-射线晶体衍射,衍射收集数据使用CCP4 Program Suite 6.1.3软件进行解析,获得的结构已经上传 RCSB Protein Data Bank 数据库(PDB ID:7EXS)。原始TrSOX结构的构建在Discovery Studio 2019软件 “Mutate Protein”模块进行,TrSOX与底物的对接采用该软件中“CDOCKER”模块完成。
1.2.2 定点饱和诱变文库的制备和筛选
根据已报道的方法[23-24],设计含有简并碱基(N=A/T/C/G,K=G/T)的引物,引物序列如表1所示。PCR反应在40 μL系统中进行,其中包括8 μL ddH2O,25 μL 2×max Buffer,1 μL dNTP Mix(10 mmol/L each),1 μL pMA5-Pxyl-trsox质粒,2 μL上游引物,2 μL下游引物。PCR过程:在95 ℃反应30 s,67 ℃反应15 s,72 ℃反应8.5 min,最后72 ℃反应5 min,并进行30个循环。PCR反应产物用DpnⅠ酶切1~2 h,并对消化后的产物进行37 ℃、30 min的环化重组反应,环化重组产物冰水浴5 min后获得含有目的基因的重组质粒。
表1 定点饱和突变体引物
Table 1 Degenerate primers used for site-saturation mutagenesis
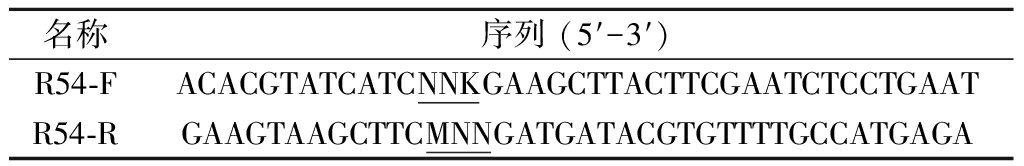
名称序列 (5′-3′)R54-FACACGTATCATCNNKGAAGCTTACTTCGAATCTCCTGAATR54-RGAAGTAAGCTTCMNNGATGATACGTGTTTTGCCATGAGA
注:下划线为突变位点
将得到的质粒转化到B.subtilis WB600感受态细胞中,涂布于含有卡那霉素的LB平板中,将得到的单菌落标号,用灭菌的牙签挑取单菌落再斜插到筛选平板(含有显色反应体系和N-甲基-甘氨酸、N-甲基-L-亮氨酸等底物)中,过夜培养。若筛选平板中出现粉红色圈落,挑取对应的菌落接入含有卡那霉素的LB培养基中,于37 ℃和200 r/min培养12 h,得到的新鲜菌液进行DNA测序,测序正确的菌液提取质粒并保存。
1.2.3 TrSOX的表达和制备
将验证正确的突变体菌株质粒转化到B. subtilis WB600感受态细胞中,将得到的单菌落进行菌液PCR验证,引物如表2所示。
表2 菌液PCR引物
Table 2 PCR primers for bacterial liquid
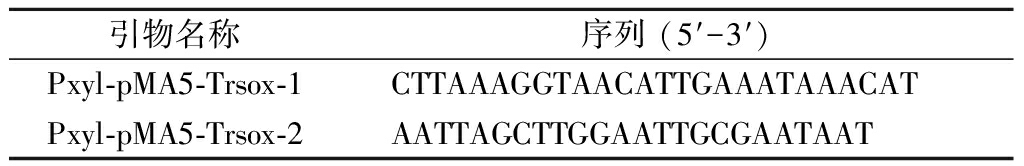
引物名称序列 (5′-3′)Pxyl-pMA5-Trsox-1CTTAAAGGTAACATTGAAATAAACATPxyl-pMA5-Trsox-2AATTAGCTTGGAATTGCGAATAAT
将验证成功的菌株接种于LB培养基(含0.1 mg/mL硫酸卡那霉素)中,37 ℃培养12 h得到种子液,以5%的接种量转接到TB培养基(含0.1 mg/mL硫酸卡那霉素)中,37 ℃(200 r/min)培养10~11 h,当发酵液的OD600 nm达到2.0时加入2%的木糖诱导剂,2 h后离心收菌[14]。将收到的菌体与20 mmol/L pH为8的Tris-HCL溶液以1∶20(g∶mL)的比例重悬,并向重悬液里加入0.5 mol/L NaCl、20 mmol/L咪唑和1%的溶菌酶,37 ℃静置3 h,经过超声波破碎细胞,高速离心(8 000 r/min,20 min)得到上清液即为粗酶液。粗酶液经过镍亲和层析柱纯化,将400 mmol/L洗脱下来的蛋白经过超滤浓缩得到纯化浓缩过的肌氨酸氧化酶蛋白。
1.2.4 蛋白浓度的测定
以牛血清白蛋白(bull serum albumin,BSA)为参照物,采用Bradford法测定蛋白质浓度。
1.2.5 酶活性的测定
为测定TrSOX对N-甲基底物的活性,用实时比色法测定OD500 nm的吸光度,以确定H2O2的产生量。以4-氨基安替比林和苯酚为显色底物,与辣根过氧化物酶(horse radish peroxidase,HRP)偶联,在1 mL反应混合物 (200 mmol/L底物,1 mmol/L 4-氨基安替比林,6 mmol/L苯酚,7U HRP)中加入5 μg酶,在500 nm处测定吸光度,37 ℃反应5 min~3 h,用A500 nm计算反应生成的H2O2含量[25]。用Origin 2021软件中的Michaelis-Menten方程通过“非线性曲线拟合”计算Km和kcat。
1.2.6 圆二色光谱(circular dichroism,CD)分析
使用CD对不同突变体进行二级结构的预测分析,用无菌水作为空白对照,通过195~250 nm的CD光谱扫描纯化的TrSOX,扫描时间2 s,狭缝宽度4.0 nm,比色皿宽度1.0 nm,测定椭圆率(θ),计算摩尔椭圆率[θ]。
1.2.7 Nano DSC热稳定性的测定
根据Nano-DSC(美国TA仪器)说明书,将300 μL的20 mmol/L pH 8的Tris-HCl缓冲液加入样品槽中作为对照,再将等体积纯化的突变TrSOX(1 mg/mL)注入样品槽中进行实验,以2 ℃/min的速度在-10~130 ℃扫描;响应时间为5 s,内置的加压扰动达6 atm。然后测定样品的熔化温度(Tm)和变性焓(ΔH)[14]。
2 结果与分析
2.1 R54位点分析
如图1-a所示,在TrSOX的三维结构(PDB ID:7EXS)中,Arg 54位于活性位点,其应靠近辅酶FAD。对接后,对接得分最高的被选为模型。在图1-b和图1-c中,对于初始底物肌氨酸(N-甲基-甘氨酸),在R54的胍基和N-甲基-甘氨酸的羧酸基之间形成了氢键作用力而产生了直接相互作用;此外,对于另一个初始底物N-甲基-L-色氨酸,R54的胍基和N-甲基-L-色氨酸的羧酸基之间也形成了氢键而产生相互作用(图1-d和图1-e)。结果表明,催化中心保守的R54残基可能通过与N-甲基氨基酸底物的酸性侧链直接相互作用而有助于维持底物与催化中心的结合。

a-R54位于活性口袋的一侧(绿色网状标记),而辅酶FAD位于活性中心的底部(紫色);b、c-在N-甲基-甘氨酸与催化口袋的结合中, R54与底物的羧酸基形成氢键产生直接相互作用;d、e-在N-甲基-L-色氨酸与催化口袋的结合中,R54与底物的羧酸基形成氢键产生 直接的相互作用
图1 TrSOX(R54)的三维结构和相互作用分析
Fig.1 Three-dimensional structure and interaction analysis of TrSOX(R54)
2.2 突变株的筛选
在含有不同N-甲基氨基酸底物的筛选平板上,由于反应产物H2O2在辣根过氧化物酶的作用下被降解成水和氧气,而4-氨基安替比林则同酚类物质去氢缩合成红色的醌类化合物,所以有活性的突变体则出现粉红色圈落。通过N-甲基-甘氨酸筛选平板筛选到R54 N、R54K、R54D;N-甲基-L-丙氨酸筛选平板筛选出R54M/N/K/P/L/D;而N-甲基-L-苯丙氨酸、N-甲基-L-色氨酸和N-甲基-L-亮氨酸每种筛选平板都筛选出R54Y、R54A、R54I、R54Q、R54E、R54F、R54M、R54 N、R54G、R54K、R54P、R54L、R54D、R54V 14个突变体。R54S、R54C、R54H、R54T、R54 W未能够在平板筛选得到的活性单克隆中获得,则通过定点突变方式得到突变基因。
2.3 TrSOX的表达和纯化
经DNA测序证实的质粒在表达前用Nde Ⅰ和Mlu Ⅰ双酶切,酶切结果显示载体带7 008 bp,目的基因条带1 171 bp,将重组质粒转化枯草杆菌WB600感受态细胞后,用菌液PCR方法验证重组质粒的存在,野生型和突变体显示存在1 500 bp左右的条带,并将该菌液用于发酵。如之前的工作所述,突变体得到了表达和纯化,并将纯化浓缩后的突变体蛋白进行SDS-PAGE分析,天然TrSOX和突变体均在43 kDa左右显示单一条带(图2),证明15种突变体均得到了正确的表达;而R54C、R54 W、R54T和R54H四个突变体无法在该表达体系中完成可溶性表达,这与平板筛选的结果是一致的,因为携带上述4个突变体基因的质粒无法在宿主细胞中表达出可溶性的带有活性的酶分子。

a-M-标准蛋白质分子质量,1~8-野生TrSOX,R54E, R54Y,R54A,R54F,R54I,R54V,R54 N;b-TrSOX 突变体蛋白纯化产物;1~8-R54,R54G,R54M, R54P,R54D,R54K,R54L和R54Q
图2 TrSOX突变体纯化产物的 SDS-PAGE 电泳分析
Fig.2 SDS-PAGE analysis of the purified product of TrSOX mutants
正确表达的15种突变体在1.5 L的发酵液中发酵培养,通过测定粗酶液的蛋白浓度发现R54D、R54K、R54Q和R54V的蛋白总量增加,而R54D的蛋白总量增加约2.5倍(表3)。
表3 TrSOX突变体的蛋白表达量
Table 3 The production of TrSOX mutants

突变体菌体量/g粗酶液酶量/mg产量/(μg·g-1)菌体)相对蛋白产量TrSOX24.5±1.31.5±0.161.2±1.21.00R54E27.8±1.81.35±0.048.6±1.20.79R54Y22.5±1.10.64±0.128.45±0.50.46R54A24.9±1.61.43±0.157.4±0.80.94R54Q27.5±2.02.76±0.1100.4±1.31.64R54F23.5±0.80.68±0.028.9±0.70.47R54I26.0±1.11.59±0.161.1±0.61.00R54S25.0±1.00.15±0.06.0±0.50.10R54N25.3±2.51.83±0.172.3±0.91.18R54G26.7±2.70.57±0.021.2±0.40.35R54M22.8±1.80.57±0.025.0±0.20.41R54K25.6±1.52.83±0.1110.5±1.11.81R54P21.8±0.91.19±0.154.6±0.70.89R54L28.7±2.11.54±0.153.7±0.60.88R54V26.7±2.32.79±0.1104.5±1.31.71R54D27.0±2.14.13±0.2152.9±1.42.50
注:野生型TrSOX的相对蛋白产量设为1;突变体的相对蛋白产量为其产量与野生型产量的比值
2.4 TrSOX的特性分析
对于Nano-DSC分析,R54突变体的解链温度Tm和变性焓ΔH与野生TrSOX相比没有明显的波动(图3),这表明野生型TrSOX良好的热稳定性保持不变。

图3 TrSOX突变体的热稳定性
Fig.3 The thermal stability of TrSOX mutants
用Dichro Web (http://dichroweb.cryst.b bt.ac.uk/html/home.shtml)对获得的数据进行分析和处理,得到突变体二级结构中的α-螺旋、β-折叠、β-转角和无规则卷曲的含量如表4所示,大多数突变体的二级结构都受到显著的影响,这可能是因为R54位点本身对TrSOX整体结构的维持具有较为重要的作用,其突变影响了蛋白结构整体的折叠,而有趣的是,具有相似碱性侧链的突变体R54K也能降低α-螺旋的含量,这表明R54作为一个限制性的保守残基,可能在整个酶的结构中起着至关重要的作用。
表4 TrSOX突变体的二级结构
Table 4 The secondary structure of TrSOX mutants

突变体α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%TrSOX32.717.820.628.5R54Y8.729.425.336.6R54A2.443.022.331.7R54I5.630.620.242.5R54Q22.32813.636.1R54E2.348.322.726.4R54F1.235.621.939.3R54M5.931.125.422.4R54N33.22024.422.4R54G6.831.621.838.0R54K21.720.119.837.1R54P9.230.723.436.7R54L6.429.621.043.0R54D24.919.821.034.3R54V31.216.420.132.3R54S1.347.620.330.8
虽然大多数突变体的二级结构受到影响,但是热稳定性并无太大影响,与理论有出入,这可能是因为二级结构产生变化的区域并不影响突变体的解链温度,也不会对破坏蛋白整体结构的能量有所改变,从而造成突变体延续了天然TrSOX优异的热稳定性。
2.5 TrSOX突变体的催化性能分析
用Origin 2021软件中的Michaelis-Menten方程对反应中H2O2的含量进行非线性拟合,得到突变株对不同底物的Km和kcat,并分析TrSOX的酶催化活性。如图4所示,R54位的各个突变体显示出与野生型TrSOX相同的手性选择性,它们能特异性识别N-甲基-L-氨基酸,但不能识别D-型。对于相似的碱性残基突变体R54K,对N-甲基-甘氨酸、N-甲基-L-丙氨酸、N-甲基-L-苯丙氨酸、N-甲基-L-亮氨酸、N-甲基-L-色氨酸和N-甲基-L-天冬氨酸的催化效率分别提高了3.17、5.99、9.12、7.61、1.00和2.07倍。然而,除了酸性残基突变体R54D外,其他无碱性侧链的突变体对相同底物的Km上升,kcat降低,甚至完全失活。这一现象应该与54位残基的碱性侧链与底物的羧酸基之间的直接相互作用有关,而K54可能有助于增强相互作用并降低这些底物的接近性。
通过研究分析发现酸性突变体R54D也能提高对N-甲基-L-氨基酸的催化效率,对N-甲基-甘氨酸、N-甲基-L-丙氨酸、N-甲基-L-苯丙氨酸、N-甲基-L-亮氨酸和N-甲基-L-色氨酸的催化效率分别提高了1.79、5.57、17.92、9.00和1.43倍。而对N-甲基-L-天冬氨酸活性的显著降低可能是由于D54的羧酸基与底物之间的排斥所致。此外,与R54D类似的酸性残基突变体R54E几乎完全失活,这可能与其二级结构中α-螺旋含量的急剧下降有密切的关系,这进一步说明了R54位点对维持TrSOX的整体结构具有重要的影响(表3)。而R54S虽然获得了可溶性的蛋白,但对于N-甲基-L-氨基酸类底物完全失活,这也是其无法在筛选平板中获得的原因。

a-突变体对N-甲基氨基酸的Kcat;b-突变体对N-甲基氨基酸的Km;c-突变体对N-甲基氨基酸的kcat/km; d-突变体对N-甲基氨基酸的相对催化效率(kcat/Km倍数),将野生型TrSOX的kcat/Km设为1, 相对催化效率为各突变体与野生型TrSOX的比值,其中Novel为野生型不具备的催化活性
图4 突变体对N-甲基氨基酸的催化特性
Fig.4 Catalytic properties of the mutants against N-methyl-amino acids
对于非氨基酸底物,天然TrSOX对除L-高脯氨酸外的底物,均未有活性。R54I/Q/N/G/K/P/D等突变体,在以吡咯烷[(3S)-(+)-3-(甲氨基)吡咯烷]、哌啶(哌啶和2-甲基哌啶)、甚至结构更大的(己内酰胺)或更复杂的(1,2,3,4-四氢异喹啉和1-甲基-1,2,3,4-四氢异喹啉)生物碱分子为底物时,检测到了野生型TrSOX不具备的催化活性(图5)。这表明R54的碱性胍基侧链可能排斥这些底物,而在上述突变体中,底物可以进入活性口袋并转化为相关产物。TrSOX突变体蛋白对N-甲基非氨基酸类底物的催化机制是把底物中—C—N—键氧化成—C![]() N—键,释放H2O2,水解释放游离的伯氨基(图6-b),而原始的催化机制(如图6-a)形成更稳定的共轭体系,所以可能不会像末端N-甲基那样通过水解反应释放出伯氨基。TrSOX突变体蛋白催化N-甲基非氨基酸底物与催化N-甲基氨基酸类底物都伴随H2O2的产生,证明原始催化机制并没有改变,但是其具体产物还需进一步的液相色谱-质谱,以及核磁共振进行鉴定。N-甲基非氨基酸底物与N-甲基氨基酸类底物不同点在于其侧链不含羧酸基,而R54突变体能够对处于非侧链位置的羧酸基也能产生相互作用也进一步证明了TrSOX蛋白对底物的特异性。
N—键,释放H2O2,水解释放游离的伯氨基(图6-b),而原始的催化机制(如图6-a)形成更稳定的共轭体系,所以可能不会像末端N-甲基那样通过水解反应释放出伯氨基。TrSOX突变体蛋白催化N-甲基非氨基酸底物与催化N-甲基氨基酸类底物都伴随H2O2的产生,证明原始催化机制并没有改变,但是其具体产物还需进一步的液相色谱-质谱,以及核磁共振进行鉴定。N-甲基非氨基酸底物与N-甲基氨基酸类底物不同点在于其侧链不含羧酸基,而R54突变体能够对处于非侧链位置的羧酸基也能产生相互作用也进一步证明了TrSOX蛋白对底物的特异性。
然而,这些非氨基酸结合的底物的催化效率远远低于N-甲基氨基酸的催化效率(图5-c),此外,氨基酸的催化机理和产物尚不清楚。在未来工作中,有必要进一步强化对这类底物的催化能力,并对产物进行纯化和表征。同时,对氨基酸类底物活性急剧下降的R54Y/A/E/F/M/L/V/S等突变体对上述底物完全未显示活性,这进一步说明,其二级结构中α-螺旋含量的显著下降导致了其活性部位的错误折叠。R54Y/A/L等突变导致二级结构中α-螺旋含量的降低,可能对活性部位的正确折叠具有较大的影响。但从重组整体表达来看,并没有产生因为错误折叠而导致的包涵体增多现象,由此证明酶分子只是进行错误的折叠并未影响其蛋白的可溶性表达。

a-突变体对非氨基酸底物的Kcat;b-突变体对非氨基酸底物的Km;c-突变体对非氨基酸底物的Kcat/km; d-突变体对非氨基酸底物的相对催化效率(Kcat/Km倍数),将野生型TrSOX的kcat/Km设为1, 相对催化效率为各突变体与野生型TrSOX的比值,其中Novel为天然TrSOX不具备的催化活性
图5 突变体对非氨基酸类底物的催化特性
Fig.5 Catalytic properties of the mutants against non-amino acid substrates

a-TrSOX对N-甲基-甘氨酸的催化反应过程; b-TrSOX对1,2,3,4-四氢异喹啉的潜在作用机制
图6 TrSOX的N-甲基脱除反应
Fig.6 N-methyl removal of TrSOX
3 结论与讨论
在本次工作中,为研究R54保守位点对TrSOX催化性能的影响,采用定点饱和突变试图获得19个突变体。进一步通过活性显色平板筛选配合定点突变获得了14个具有活性以及1个完全失活的突变体。R54位的单点突变体保持了天然TrSOX优异的热稳定性。在具有活性的突变体中,R54K和R54D对大多数N-甲基-氨基酸的催化效率显著提高而其他二级结构中α-螺旋含量急剧下降的突变体则显著降低。这表明R54对TrSOX的折叠与整体结构的维持具有重要的意义。此外,54位残基的碱性或酸性侧链可以直接与底物的活性侧链相互作用并引导底物的进入与产物的释放,从而提高催化效率。
由于天然TrSOX对大多数非氨基酸相关底物都不起作用,R54上的突变体可以帮助拓宽底物的适应性。一些吡咯烷、哌啶相关的底物甚至更大的含氮杂环类底物都可以被催化,这些天然TrSOX不具备催化活性的催化效率虽然没有N-甲基氨基酸类底物高,但是仍有进一步优化的潜力。由于R54突变体对N-甲基非氨基酸类底物的反应机理尚不清楚,还需要更多的研究来鉴定产物,而TrSOX突变体对此类底物的催化活性,在食品行业具有一定的应用价值,能够用于食品添加剂(如N-甲基-D-天冬氨酸的手性拆分)的制备,生物毒性物质(如含氮杂环类生物碱)的检测与降解,以及N-甲基-有机氮农药的降解等方面。
[1] HASSAN-ABDALLAH A, ZHAO G H, ESCHENBRENNER M, et al.Cloning, expression and crystallization of heterotetrameric sarcosine oxidase from Pseudomonas maltophilia[J].Protein Expression and Purification, 2005, 43(1):33-43.
[2] DIJKMAN W P, DE GONZALO G, MATTEVI A, et al.Flavoprotein oxidases:Classification and applications[J].Applied Microbiology and Biotechnology, 2013, 97(12):5 177-5 188.
[3] BACON B L, PARDUE H L.Predictive, error-compensating kinetic method for enzymatic quantification of creatinine in serum[J].Clinical Chemistry, 1991, 37(8):1 338-1 344.
[4] MONO
 K R, UKROPCOV
K R, UKROPCOV D, STRE
D, STRE ANSK
ANSK M, et al.Multienzymatic amperometric biosensor based on gold and nanocomposite planar electrodes for glycerol determination in wine[J].Analytical Biochemistry, 2012, 421(1):256-261.
M, et al.Multienzymatic amperometric biosensor based on gold and nanocomposite planar electrodes for glycerol determination in wine[J].Analytical Biochemistry, 2012, 421(1):256-261.
[5] ZERAVIK J, FOHLEROVA Z, MILOVANOVIC M, et al.Various instrumental approaches for determination of organic acids in wines[J].Food Chemistry, 2016, 194:432-440.
[6] TONG Y J, FENG S S, XIN Y, et al.Enhancement of soluble expression of codon-optimized Thermomicrobium roseum sarcosine oxidase in Escherichia coli via chaperone co-expression[J].Journal of Biotechnology, 2016, 218:75-84.
[7] GUO K P, MA X H, SUN G Q, et al.Expression and characterization of a thermostable sarcosine oxidase (SOX) from Bacillus sp.in Escherichia coli[J].Applied Microbiology and Biotechnology, 2006, 73(3):559-566.
[8] TONG Y J, XIN Y, YANG H L, et al.Efficient improvement on stability of sarcosine oxidase via poly-lysine modification on enzyme surface[J].International Journal of Biological Macromolecules, 2014, 67:140-146.
[9] MENG D D, LIANG A L, WEI X L, et al.Enzymatic characterization of a thermostable phosphatase from Thermomicrobium roseum and its application for biosynthesis of fructose from maltodextrin[J].Applied Microbiology and Biotechnology, 2019, 103(15):6 129-6 139.
[10] ZHENG M L, HAO M Y, FAN G M, et al.Preparation, reconstruction, and characterization of a predicted Thermomicrobium roseum sarcosine oxidase[J].Molecular Catalysis, 2018, 455:132-142.
[11] NIU C T, LIU C F, LI Y X, et al.Production of a thermostable 1, 3-1, 4-β-glucanase mutant in Bacillus subtilis WB600 at a high fermentation capacity and its potential application in the brewing industry[J].International Journal of Biological Macromolecules, 2018, 107:28-34.
[12] WU X C, LEE W, TRAN L, et al.Engineering a Bacillus subtilis expression-secretion system with a strain deficient in six extracellular proteases[J].Journal of Bacteriology, 1991, 173(16):4 952-4 958.
[13] XIN Y, HAO M Y, FAN G M, et al.Soluble expression of Thermomicrobium roseum sarcosine oxidase and characterization of N-demethylation activity[J].Molecular Catalysis, 2019, 464:48-56.
[14] GAO Q Y, SHAO J, TANG M W, et al.Promote the expression and corrected folding of an extremely stable N-demethylase by promoter reconstruction, native environment simulation and surface design[J].International Journal of Biological Macromolecules, 2021, 178:434-443.
[15] 辛瑜, 张梁.一种重组枯草芽孢杆菌细胞在酶法生物降解N-甲基有机氮农药中的应用:中国,CN111111085A[P].2020-05-18.
XIN Y,ZHANG L.Application of recombinant Bacillus subtilis cells in enzymatic biodegradation of N-methyl organic nitrogen pesticides:China, CN111111085A[P].2021-05-18.
[16] SELFRIDGE B R, WANG X H, ZHANG Y N, et al.Structure-activity relationships of (+)-naltrexone-inspired toll-like receptor 4 (TLR4) antagonists[J].Journal of Medicinal Chemistry, 2015, 58(12):5 038-5 052.
[17] KOK G, ASHTON T, SCAMMELLS P.An improved process for the N-demethylation of opiate alkaloids using an iron(II) catalyst in acetate buffer[J].Advanced Synthesis & Catalysis, 2009, 351(1-2):283-286.
[18] KIM J H, KIM B H, BROOKS S, et al.Structural and mechanistic insights into caffeine degradation by the bacterial N-demethylase complex[J].Journal of Molecular Biology, 2019, 431(19):3 647-3 661.
[19] AUGUSTIN M M, AUGUSTIN J M, BROCK J R, et al.Enzyme morphinan N-demethylase for more sustainable opiate processing[J].Nature Sustainability, 2019, 2(6):465-474.
[20] 辛瑜, 张梁, 张瑶, 等.一种酶法拆分制备N-甲基-D-天冬氨酸的方法:中国,CN109628519A[P].2019-04-16.
XIN Y,ZHANG L,ZHANG Y,et al.A kind of method for preparing N-methyl-D-aspartic acid by enzymatic splitting:China, CN109628519A[P] 2019-04-16.
[21] SONG B W, CHEN K Q, TANG Y J, et al.ConsRM:collection and large-scale prediction of the evolutionarily conserved RNA methylation sites, with implications for the functional epitranscriptome[J].Briefings in Bioinformatics, 2021, 22(6):bbab088.
[22] UCHIDA T, DOJUN N, OTA K, et al.Role of conserved arginine in the heme distal site of HutZ from Vibrio cholerae in the heme degradation reaction[J].Archives of Biochemistry and Biophysics, 2019, 677:108165.
[23] LI X H, SUN J J, WANG W, et al.Site-saturation mutagenesis of proline 176 in cyclodextrin glucosyltransferase from Bacillus sp.Y112 effects product specificity and enzymatic properties[J].Process Biochemistry, 2020, 94:180-189.
[24] KE T, LIU J, ZHAO S, et al.Using global transcription machinery engineering (GTME) and site-saturation mutagenesis technique to improve ethanol yield of Saccharomyces cerevisiae[J].Applied Biochemistry and Microbiology, 2020, 56(5):563-568.
[25] 季文明, 陈毅力, 张和春, 等.比色法测定胆固醇氧化酶酶活[J].无锡轻工大学学报, 2000, 19(3):251-254.
JI W M, CHEN Y L, ZHANG H C, et al.Colorimetric determination of the activity of cholesterol oxidase[J].Journal of Wuxi University of Light Industry, 2000, 19(3):251-254.