为解决功能性疏水物质水溶性低、生物活性发挥受限等难题,两亲性聚合物自聚集形成的具有疏水核-亲水壳结构的纳米胶束材料应运而生[1]。从头合成的两亲性聚合物材料在食品应用中可能存在安全性问题,适度疏水改性的天然多糖材料因其较高的安全性、良好的生物相容性和可降解性而备受食品工业的欢迎并得到广泛研究。与原多糖材料相比,疏水化天然多糖具有更优异的胶体特性、界面特性和营养特性[2]。截至目前,有多种针对天然多糖疏水化改性的方法,但在食品科学与营养学界研究和应用最多的仍是辛烯基琥珀酸酐酯化改性。辛烯基琥珀酸淀粉酯安全可靠,可作为食品添加剂在各类食品中按生产需要量适量使用。同时,辛烯基琥珀酸淀粉酯还具有优良的乳化、增稠和稳定功能,是优秀的食品高分子乳化剂、稳定剂和包被材料[3-4]。β-葡聚糖是公认的食品功能性碳水化合物,具有抗癌、抗炎、调节血糖和血脂及免疫调节等健康效应[5]。为拓展其在食品工业中的应用,辛烯基琥珀酸燕麦β-葡聚糖酯(octenylsuccinate modified oat β-glucan ester,OSβG)被合成,其在水相中能自发形成壳核结构纳米级球形自聚集胶束[6],该胶束对姜黄素、β-胡萝卜素等脂溶性食品具有良好的增溶和稳定作用[7-8]。
与单纯的理论研究体系不同,食品体系的共存物质和加工条件对OSβG胶束的形成及特性可能产生不可估计的影响,这是决定OSβG胶束能否在真实食品体系中应用的关键所在。目前有关食品共存成分及加工条件对疏水改性多糖自聚集胶束影响的研究鲜见报道。已有研究发现,环境温度[9-10]和氨基酸的存在[11-12]都会对表面活性剂自聚集行为带来积极或消极的影响。因此,本研究选取7种不同性质的氨基酸,开展氨基酸-加工温度对OSβG胶束形成及特性的交互影响,重点考察氨基酸的荷电情况和亲疏水性在不同加工温度下(25、40、55、70、85 ℃)的影响,以期为OSβG胶束在富含氨基酸食品体系中的应用提供理论支撑。
1 材料与方法
1.1 材料与试剂
燕麦β-葡聚糖(食品级,纯度80%,分子质量1.68×105 Da),张家口一康生物科技有限公司;2-辛烯基琥珀酸酐(97%)、芘试剂(光谱纯),美国Sigma-Aldrich公司;谷氨酸(Glu)、赖氨酸(Lys)、异亮氨酸(Ile)、苯丙氨酸(Phe)、半胱氨酸(Cys)、丙氨酸(Ala)、丝氨酸(Ser),上海阿达玛斯有限公司;透析袋(分子截流量14 000 Da),美国联合碳化物公司;其他试剂均为分析纯,成都市科龙化工试剂厂。
1.2 仪器与设备
BSA323S电子分析天平,赛多利斯科学仪器有限公司;T25高速分散机,德国IKA仪器设备有限公司;GL-16G高速离心机,上海安亭科学仪器厂;Zetasizer Nano ZS 90激光粒度仪,英国Malvern仪器有限公司;PHSJ-3F型pH计,上海雷磁仪器有限公司;Sigma 700全自动表面张力仪,瑞典百欧林科技有限公司;H01-1D数显恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;F-2500荧光分光光度计,日本株式会社日立制作所。
1.3 实验方法
1.3.1 OSβG及其胶束的制备方法
OSβG的合成参照文献[13]的方法,所制备的OSβG取代度为0.018。将0.05 g OSβG分散于20 mL蒸馏水中,加热至沸2 min,冷却后定容至20 mL,常温磁力搅拌24 h,即得透明的OSβG胶束水溶液。
1.3.2 氨基酸-温度交互处理体系设计
用30 g/L NaOH和2 mol/L HCl溶液调整氨基酸溶液(1 mol/L)和OSβG胶束溶液(2.5 mg/mL)pH至6,向OSβG胶束溶液中添加不同种类的氨基酸溶液使得最终溶液中氨基酸的浓度为0.01 mol/L,在不同温度条件下(25、40、55、70、85 ℃)磁力搅拌3 h,冷却至常温后立即测定。
1.3.3 临界胶束浓度(critical micelle concentration,CMC)的测定
CMC采用疏水探针芘标记荧光法测定[14]。首先制备OSβG与氨基酸互混溶液[OSβG质量浓度(1.2~7.5)×10-4 mg/mL];取少量芘甲醇溶液(2×10-4 mol/L)于离心管,氮吹去除溶剂后,再向离心管中加入上述OSβG与氨基酸互混溶液10 mL(芘探针浓度6×10-7mol/L),不同温度下(25、40、55、70、85 ℃)磁力搅拌处理3 h,冷却至常温后测定。荧光测试参数:激发波长335 nm,发射波长360~460 nm,狭缝宽度2.5 nm,通过芘探针的第一(I1)和第三吸收峰(I3)的荧光强度的比值与OSβG浓度的对数(logCOSβG)作图,分段线性拟合方法求出OSβG的CMC值。
1.3.4 粒径、多分散系数和ζ-电位的测定
采用动态光散射技术测定OSβG胶束及其与氨基酸互混溶液的粒径、多分散系数(polydispersity index,PDI)和ζ-电位[15]。测试条件:氩离子激光器,波长633 nm,室温,散射角90°。
1.3.5 表面张力的测定
使用白金板法测定OSβG胶束溶液及其与氨基酸互混溶液的表面张力。在每次测量前,先用乙醇-盐酸溶液清洁白金板并进行火焰灼烧处理,再用去离子水清洗白金板和玻璃容器2~3次,去除干扰和杂质;准确量取25 mL待测溶液于专用的测量杯中,浸润后测定。
1.4 统计分析方法
所有实验数据均采用平均值±标准偏差表示(n=3)。使用SPSS 22进行显著性分析(Tukey’s HSD,P<0.05),采用双因素方差分析(two-way ANOVA)评价氨基酸种类和温度及其互作对OSβG的CMC值及其胶束理化特性的贡献。
2 结果与分析
2.1 氨基酸-温度对OSβG胶束形成的交互影响
在两亲性聚合物分子自聚集过程中,其单体分子与其自组装胶束始终处于动力学和热力学平衡之中[16]。当添加其他组分时或改变环境温度时,这种动力学和热力学平衡将会被打破,表现为其CMC值的变化。因此,CMC值是表征聚合物胶束稳定性的基本参数[11]。本实验采用高疏水性荧光标记物芘荧光光谱法研究氨基酸与温度对OSβG的CMC值的交互影响,结果见表1。
从表1可以看出,除谷氨酸之外,在添加氨基酸或不添加的情况下,CMC随温度的升高呈“U型”变化趋势,说明55 ℃时OSβG的自聚集倾向最强,主要原因在于:(1)温度从25 ℃升高至55 ℃的过程中,相比于逐渐增强的布朗运动以及逐渐减弱的氢键对OSβG自聚集的抑制作用,OSβG链间逐渐增强的疏水相互作用对OSβG自聚集的推动作用更强,从而导致CMC逐渐降低;(2)当温度从55 ℃增至85 ℃时,虽然OSβG分子间疏水作用力会得到进一步加强,但分子间氢键会遭到严重破坏,分子的布朗运动会急剧加速,这必然会导致CMC增加。就氨基酸对OSβG自聚集的影响而言,表1表明在任何温度下添加谷氨酸的样品均具有最低的CMC值,这可能与pH=6时谷氨酸与OSβG都带有负电荷,从而产生分子间斥力,推动OSβG胶束的形成有关。总体而言,在55 ℃及以下,谷氨酸在25 ℃导致CMC显著下降,赖氨酸和半胱氨酸在55 ℃导致CMC下降,但不显著(P>0.05),其余氨基酸的存在对CMC无显著影响;而当温度在70 ℃及以上时,在85 ℃时赖氨酸、苯丙氨酸、半胱氨酸和丙氨酸导致CMC显著上升,其余氨基酸的存在对CMC无显著影响。25 ℃时谷氨酸导致CMC下降的原因与其带有负电荷密切相关。而赖氨酸、苯丙氨酸、半胱氨酸和丙氨酸在85 ℃时导致CMC显著升高的原因是:(1)赖氨酸为碱性氨基酸,在pH=6时其侧链质子化、带正电荷,在高温的协作下更不利于OSβG分子的自聚集;(2)苯丙氨酸、半胱氨酸和丙氨酸为疏水性氨基酸,其与OSβG的游离辛烯基琥珀酸链存在较强的疏水作用力,但OSβG分子间及其与氨基酸侧链间的氢键被严重破坏,使得难以维持稳定的胶束亲水壳结构[17];(3)此时异亮氨酸对CMC的增加效应不显著,主要原因在于异亮氨酸的疏水性更强,一定程度上弥补了上述不利作用。同样地,带有正电荷的赖氨酸对CMC的提升幅度不及带有负电荷的谷氨酸对CMC的降低幅度,这可能是赖氨酸[(CH2)4]比谷氨酸[(CH2)2]具有较大的疏水链段,与OSβG分子之间具有更强的疏水相互作用。
此外,较低CMC值通常标志着胶束具有较好的动力学和热力学稳定性。因此,根据以上数据可以得出:(1)在25 ℃,谷氨酸可以提升OSβG胶束的稳定,对其他温度下胶束稳定性的影响不显著;(2)在40~70 ℃,除个别情况下胶束稳定性略有降低之外,大多数情况下氨基酸对胶束的稳定性影响不显著;(3)在85 ℃,谷氨酸、异亮氨酸和丝氨酸对胶束稳定性影响不显著,其他氨基酸会导致胶束稳定性显著下降。这些变化与胶束亲疏水链性质、氨基酸的性质以及环境条件密切相关[18-19],可能涉及到氨基酸与OSβG亲疏水链间相互作用(氢键、疏水相互作用及静电斥力)变化以及这些作用力受温度的影响[17]。后续理化实验中所采用的OSβG浓度均高于其在不同种类氨基酸和温度条件下的CMC值,以保证OSβG能形成胶束。
表1 氨基酸对不同温度下OSβG的CMC的影响
Table 1 Effects of amino acids on the CMC of OSβG under different temperatures

氨基酸不同温度下OSβG的CMC/(mg·mL-1)25 ℃40 ℃55 ℃70 ℃85 ℃对照组0.130±0.017ABa0.112±0.017Bab0.073±0.002Ca0.144±0.005Aab0.153±0.009Ad谷氨酸0.024±0.001Cb0.069±0.006Bb0.067±0.008Bab0.091±0.025Bab0.157±0.013Ad赖氨酸0.151±0.002BCa0.130±0.011BCab0.056±0.004Cb0.199±0.007Ba0.337±0.105Ab异亮氨酸0.157±0.016Ba0.135±0.018Bab0.079±0.003Ca0.081±0.005Cab0.203±0.006Acd苯丙氨酸0.145±0.005Aba0.139±0.105ABa0.074±0.007Ba0.146±0.117ABab0.299±0.022Abc半胱氨酸0.149±0.015Ba0.079±0.002Cab0.054±0.001Cb0.068±0.001Cb0.353±0.026Ab丙氨酸0.144±0.008Ba0.110±0.004BCab0.077±0.004Ca0.122±0.001Bab0.489±0.027Aa丝氨酸0.144±0.013Aa0.121±0.005ABab0.079±0.006Ba0.124±0.007ABab0.172±0.041Ad
注:同行中带有不同上标大写字母的数据差异显著(P<0.05);同列中带有不同上标小写字母的数据差异显著(P<0.05)(下同)
2.2 氨基酸-温度对OSβG胶束粒径及其分布的交互影响
通过观察一定条件下聚合物胶束粒径及其分布的变化情况可以了解胶束体系的稳定性。由表2和表3可知,在任一温度条件下,与对照或其他氨基酸相比,添加谷氨酸的样品OSβG胶束的粒径均最小,即胶束发生明显收缩,其主要原因一方面可能是在谷氨酸的静电排斥下,OSβG更易发生胶束化并导致参与每个胶束形成的OSβG分子减少;另一方面可能是因为来自谷氨酸的静电斥力使胶束内OSβG分子链之间排列更加紧凑。从总的趋势来看,未添加和添加氨基酸OSβG胶束的粒径随着温度的升高呈“抛物线型”变化趋势,而除添加谷氨酸外的PDI变化趋势呈“U型”,其峰值和谷值大多出现在55 ℃。温度从25 ℃增至55 ℃时胶束粒径增大,可能主要是升温导致维持胶束亲水性外壳(往往比疏水性内核具有更大尺寸)的OSβG亲水链之间氢键作用降低,从而使胶束变得更加松散[17];而温度从55 ℃增至85 ℃,胶束粒径减小,一方面可能是由于温度会使CMC增大,使参与胶束形成的OSβG分子数量减少,另一方面可能是温度提升了OSβG疏水链间的疏水相互作用,从而使胶束变得更加紧凑。就氨基酸-温度对OSβG胶束粒径的交互影响而言,除谷氨酸在大多数温度下均能显著降低粒径之外,其他氨基酸与温度之间没有明显的规律可循,这也就说明氨基酸-温度对胶束粒径的影响受多种因素和机制的控制,在不同氨基酸-温度组合条件下,影响粒径的各种分子间相互作用(如OSβG之间以及OSβG和氨基酸之间的氢键、疏水相互作用等)变化不一[20]。通过关联表2和表3数据可知,胶束PDI的变化趋势与胶束粒径的变化趋势密切相关,一般来说,增大胶束的粒径往往伴随着PDI的增大。
表2 氨基酸/温度对OSβG胶束粒径的交互影响
Table 2 Interactive effects of amino acid and temperature on the size of OSβG micelles

氨基酸不同温度下胶束的粒径/nm25 ℃40 ℃55 ℃70 ℃85 ℃对照组314.7±2.5Dc417.8±28.0Babc465.2±0.4Aab353.8±8.6Cbc351.2±0.5Cab谷氨酸147.2±1.1Cd253.2±14.8Be352.6±10.4Ad320.6±27.9Ac315.7±15.0Ac赖氨酸348.9±9.8Bbc459.2±6.3Aa488.6±32.5Aa391.3±24.9Bab374.7±6.3Ba异亮氨酸423.1±17.6Aa430.2±15.8Aab435.4±25.4Aabc438.9±28.1Aa319.7±8.0Bc苯丙氨酸387.4±33.1Aab403.1±26.6Aabc403.2±30.5Abcd404.6±19.2Aab337.9±5.4Bbc半胱氨酸302.9±3.7Cc367.7±18.1ABcd396.7±12.5Acd342.7±38.5ABCbc338.3±9.3BCbc丙氨酸312.6±9.9Cc343.0±26.9BCd456.8±13.1Aabc382.0±20.3Babc380.2±14.4Ba丝氨酸397.7±29.0Aab398.5±17.2Abcd403.0±34.1Abcd379.1±14.3Aabc376.6±16.3Aa
表3 氨基酸/温度对OSβG胶束PDI的交互影响
Table 3 Interactive effects of amino acid and temperature on PDI of OSβG micelles

氨基酸不同温度下胶束的PDI25 ℃40 ℃55 ℃70 ℃85 ℃对照组0.416±0.066ABb0.397±0.087Bab0.393±0.019Babc0.450±0.034ABa0.509±0.070Aab谷氨酸0.121±0.026Bc0.431±0.044Aab0.497±0.026Aa0.488±0.041Aa0.433±0.026Ab赖氨酸0.468±0.046ABab0.483±0.057ABa0.339±0.046Bbc0.467±0.046ABa0.524±0.081Aab异亮氨酸0.463±0.080Aab0.456±0.042Aab0.436±0.036Aab0.474±0.039Aa0.497±0.027Aab苯丙氨酸0.474±0.032Aab0.476±0.068Aa0.306±0.011Bc0.481±0.072Aa0.556±0.035Aa半胱氨酸0.343±0.074Bb0.321±0.035Bb0.312±0.032Bc0.539±0.033Aa0.550±0.053Aa丙氨酸0.587±0.011Aa0.520±0.045ABa0.399±0.069Babc0.426±0.079Ba0.431±0.047Bb丝氨酸0.423±0.039ABb0.413±0.032ABab0.373±0.032Bbc0.459±0.016Aa0.463±0.082Aab
2.3 氨基酸-温度对OSβG胶束ζ-电位的交互影响
ζ-电位是胶束表面电荷密度的表征,其决定了相邻胶束粒子之间的排斥程度,是保证胶束粒子完整性、稳定胶束粒子、防止胶束粒子合并的主要作用力[21]。氨基酸/温度对OSβG胶束ζ-电位的交互影响见表4。
表4 氨基酸/温度对OSβG胶束ζ-电位的交互影响
Table 4 Interactive effects of amino acid and temperature on the ζ-potential of OSβG micelles

氨基酸不同温度下胶束的ζ-电位/mV25 ℃40 ℃55 ℃70 ℃85 ℃对照组-16.1±0.7Bb-15.6±0.9Bab-11.8±0.8Aab-15.1±0.6Bbc-15.4±0.4Bb谷氨酸-3.3±0.4Aa-14.9±0.8BCab-13.5±0.4Bbc-15.0±0.6BCbc-15.7±0.6Cb赖氨酸-20.8±1.3Dc-13.2±0.4ABa-12.8±0.2Aabc-15.7±1.1BCbc-15.9±1.3Cb异亮氨酸-19.9±0.5Cc-16.0±0.7Bb-12.3±1.1Aabc-16.1±1.6Bc-19.5±0.4Cc苯丙氨酸-19.4±1.4Cc-14.2±0.5ABab-11.8±0.9Aab-13.3±1.3ABab-15.9±0.2Bb半胱氨酸-16.4±0.5Bb-16.2±0.9Bb-11.0±0.9Aa-11.7±0.6Aa-12.2±0.6Aa丙氨酸-19.9±0.5Bc-19.1±1.6ABc-16.2±0.1Ad-20.1±0.6Bd-23.8±1.7Cd丝氨酸-20.5±0.7Cc-20.2±0.7Cc-14.2±0.7Acd-16.8±0.8Bc-16.7±0.9Bb
总体来看,OSβG胶束始终具有负的ζ-电位,这与pH=6时OSβG分子中辛烯基琥珀酸链上的羧基(pKa≈4.2)发生脱质子化现象直接相关[22]。在不添加氨基酸的情况下,除55 ℃外,温度变化对OSβG胶束ζ-电位没有显著影响。在不同温度下,各种氨基酸对OSβG胶束ζ-电位影响规律不同,可基本分为以下3种情况:(1)在25 ℃-谷氨酸、70 ℃-半胱氨酸和80 ℃-半胱氨酸组合条件下,OSβG胶束ζ-电位绝对值显著降低,最小值(-3.3 mV)出现在25 ℃-谷氨酸,这表示胶束粒子之间的斥力减小,胶束的稳定性弱化[21];(2)丙氨酸在任何温度下,丝氨酸在低于55 ℃时,赖氨酸、异亮氨酸和苯丙氨酸在25 ℃会导致OSβG胶束ζ-电位绝对值显著升高,从而提升胶束的稳定性,但在相同温度下,这些升高量在氨基酸种类之间没有显著差异。(3)在其他氨基酸/温度组合条件下,OSβG胶束ζ-电位绝对值都无显著变化。这充分说明,OSβG胶束ζ-电位绝对值受到氨基酸种类及环境温度的双重调节,较低温度(25 ℃)及较小分子的氨基酸(丙氨酸、丝氨酸)对OSβG胶束ζ-电位的总体影响更大[12]。
2.4 氨基酸-温度对OSβG胶束溶液表面张力的交互影响
浓度在CMC以上,两亲性聚合物分散体系往往是游离单分子与自聚集共存的动态平衡体系[23]。分散液中未参与聚集的聚合物分子可能以单分子或不完整胶束形式分布在分散液与空气接触的界面上,从而改变分散液的表面张力。这类不完整胶束也被称为“界面胶束”,类似于半球结构,其与溶液中的具有完整球形结构的“本体胶束”不同[24-25]。一般来说,两亲性聚合物形成胶束的倾向越弱或形成的胶束越不稳定,其占据气液界面的分子及界面胶束就越多,分散液的表面张力就越低。因此评价两亲性聚合物胶束分散液的表面张力也在一定程度反映其胶束的形成与稳定状况[26]。氨基酸/温度对OSβG胶束分散液表面张力的交互影响见表5。
表5 氨基酸/温度对OSβG胶束溶液表面张力的交互影响
Table 5 Interactive effects of amino acid and temperature on the surface tension of OSβG micelles solutions
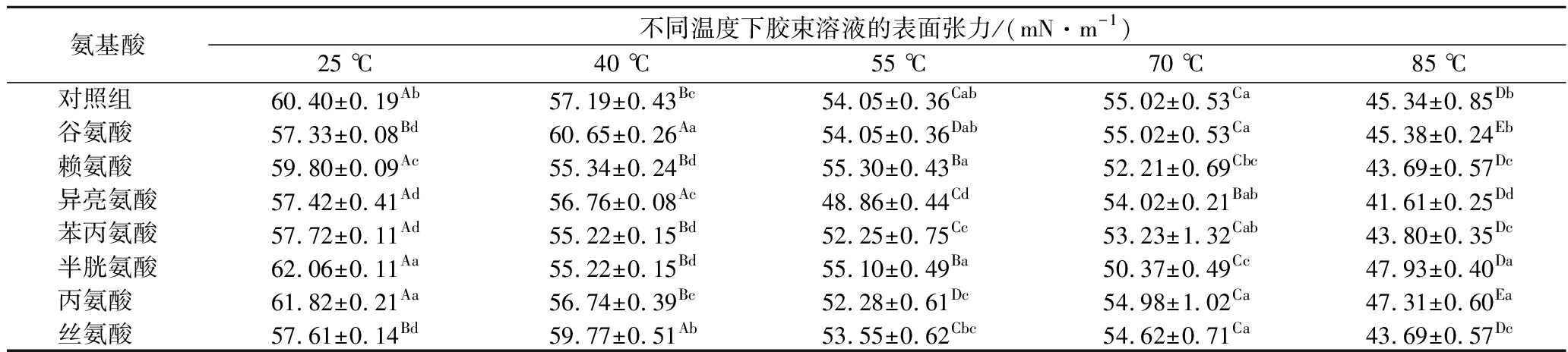
氨基酸不同温度下胶束溶液的表面张力/(mN·m-1)25 ℃40 ℃55 ℃70 ℃85 ℃对照组60.40±0.19Ab57.19±0.43Bc54.05±0.36Cab55.02±0.53Ca45.34±0.85Db谷氨酸57.33±0.08Bd60.65±0.26Aa54.05±0.36Dab55.02±0.53Ca45.38±0.24Eb赖氨酸59.80±0.09Ac55.34±0.24Bd55.30±0.43Ba52.21±0.69Cbc43.69±0.57Dc异亮氨酸57.42±0.41Ad56.76±0.08Ac48.86±0.44Cd54.02±0.21Bab41.61±0.25Dd苯丙氨酸57.72±0.11Ad55.22±0.15Bd52.25±0.75Cc53.23±1.32Cab43.80±0.35Dc半胱氨酸62.06±0.11Aa55.22±0.15Bd55.10±0.49Ba50.37±0.49Cc47.93±0.40Da丙氨酸61.82±0.21Aa56.74±0.39Bc52.28±0.61Dc54.98±1.02Ca47.31±0.60Ea丝氨酸57.61±0.14Bd59.77±0.51Ab53.55±0.62Cbc54.62±0.71Ca43.69±0.57Dc
未添加氨基酸的OSβG胶束溶液的表面张力随着温度的增加总体上呈降低趋势,说明随着温度的增加OSβG胶束溶液中的游离疏水链倾向于在空气-缓冲液界面处形成规则的排列和分布,这主要是因为升温加剧了溶液内部未定位和游离的辛烯基琥珀酸链的分子运动,使其更易在界面堆积而形成“界面胶束”。在不同氨基酸下,温度对表面张力的影响规律各异,可基本分为以下3种情况:(1)添加赖氨酸、苯丙氨酸、半胱氨酸和丙氨酸的OSβG胶束表面张力随温度的升高而逐渐降低,说明升温过程中这些氨基酸的疏水链段能促进溶液中游离的疏水链向界面转移;(2)添加谷氨酸和丝氨酸时,表面张力变化趋势呈“抛物线型”;(3)异亮氨酸变化较为复杂,但总趋势是降低的。表5表明在85 ℃下任何氨基酸样品均具有最低的表面张力,这可能与高温加剧溶液中游离的疏水链段向界面的迁移相关。这均说明OSβG胶束表面张力与氨基酸的性质及所处温度密切相关,可能受分子间作用力及位阻效应的调节[27-28]。
2.5 氨基酸种类及温度变化对OSβG胶束各性能影响的贡献分析
上述研究已充分表明氨基酸种类和温度变化对OSβG胶束会产生明显的影响,但2个因素影响的相对强弱以及他们之间是否存在交互作用尚不清楚。鉴于此,利用双因素方差分析对此进行了评价,结果见表6。
表6 氨基酸种类及温度对OSβG的胶束特性贡献
Table 6 Contribution of amino acid type and temperature on the micellarproperties of OSβG micelles

贡献来源因变量对应的F值CMC粒径PDIζ-电位表面张力氨基酸种类16.0∗71.5∗4.5∗113.6∗ 66.4∗温度130.5∗81.5∗19.7∗90.5∗2 908.4∗氨基酸种类×温度9.3∗11.7∗7.7∗33.6∗42.7∗
注:*表示在P<0.05水平上显著
由表6可知,氨基酸种类和温度对OSβG胶束所有特性参数都有显著影响。根据F值可以得出,对ζ-电位的影响氨基酸种类强于温度变化;对其他指标的影响温度均明显强于氨基酸种类。温度对表面张力的贡献远大于氨基酸,且二者互作影响显著。此外,除了氨基酸的酸碱性和亲疏水性及其取向性,氨基酸自身的溶解性也对表面活性剂的自聚集有一定的影响[29]。氨基酸种类与温度对OSβG胶束各特性均表现出显著的互作效应,但互作效应的强度都不及各因素单独的作用。
3 结论
研究了氨基酸(谷氨酸、赖氨酸、异亮氨酸、苯丙氨酸、半胱氨酸、丙氨酸和丝氨酸)和温度(25、40、55、70、85 ℃)对OSβG分子自聚集行为的交互影响,通过测定OSβG形成胶束的CMC、OSβG胶束的粒径、PDI、表面电荷和表面张力等理化指标,明确了这7种氨基酸及其所处温度条件影响OSβG自聚集行为的初步机制。结果表明:(1)随着温度的升高,添加谷氨酸OSβG胶束化的CMC呈现递增趋势,其余氨基酸及对照OSβG胶束化的CMC变化趋势均呈“U型”,其峰值总体上位于55 ℃;(2)随着温度的升高,各氨基酸及对照OSβG胶束的粒径变化趋势呈“抛物线型”,其峰值总体上位于55 ℃;(3)随着温度的升高,各氨基酸(除谷氨酸)及对照OSβG胶束的ζ-电位绝对值总体变化趋势呈“U型”,其峰值总体上位于55 ℃;(4)随着温度的升高,多数氨基酸及对照OSβG胶束溶液的表面张力总体呈现降低趋势。主要原因在于谷氨酸主要通过静电作用力、其余各氨基酸主要通过氢键和疏水作用力影响OSβG胶束的亲水壳和疏水核结构及其紧凑性,而温度主要以相反的方式影响OSβG分子间及其与氨基酸侧链间的氢键和疏水作用力,进而共同影响OSβG胶束的聚集结构及其特性。氨基酸的荷电状况或亲疏水性并非其影响OSβG胶束结构及其应用特性的唯一因子,还与氨基酸侧链链长、极性、空间位阻效应及其本身水溶性等因素有关,同时更受到所处环境温度因子的调控。但还需要进一步从氨基酸(同种氨基酸不同形式——非离子、阴离子、阳离子或两性离子视角)和OSβG(胶束化动力学和热力学过程视角)深入研究氨基酸-温度对OSβG自聚集的交互影响。总之,选择氨基酸作为食品组分代表物,研究氨基酸-加工温度交互影响OSβG自聚集行为的本质规律,旨在揭示氨基酸-温度对OSβG分子自聚集形成胶束的促进或阻碍效应,最终为构建“可控制备、稳定和可调控”的OSβG胶束在富含氨基酸类食品中的加工和应用提供新的策略。
[1] GHEZZI M, PESCINA S, PADULA C, et al.Polymeric micelles in drug delivery:An insight of the techniques for their characterization and assessment in biorelevant conditions[J].Journal of Controlled Release, 2021, 332:312-336.
[2] ZHI K K, WANG R X, WEI J Q, et al.Self-assembled micelles of dual-modified starch via hydroxypropylation and subsequent debranching with improved solubility and stability of curcumin[J].Food Hydrocolloids, 2021, 118:106809.
[3] NO J, SHIN M.Preparation and characteristics of octenyl succinic anhydride-modified partial waxy rice starches and encapsulated paprika pigment powder[J].Food Chemistry, 2019, 295:466-474.
[4] 周凤超, 杨庆余, 林国荣, 等.疏水改性淀粉基皮克林乳化液在乳化肉糜制品中的应用前景[J].食品与发酵工业, 2021, 47(21):290-295.
ZHOU F C, YANG Q Y, LIN G R, et al.Application prospect of Pickering emulsions based on hydrophobically modifified starches in emulsified minced meat products[J].Food and Fermentation Industries, 2021, 47(21):290-295.
[5] ZHU F M, DU B, XU B J.A critical review on production and industrial applications of beta-glucans[J].Food Hydrocolloids, 2016, 52:275-288.
[6] LIU J, CHEN F, TIAN W N, et al.Optimization and characterization of curcumin loaded in octenylsuccinate oat β-glucan micelles with an emphasis on degree of substitution and molecular weight[J].Journal of Agricultural and Food Chemistry, 2014, 62(30):7 532-7 540.
[7] 高丽, 刘嘉, 董楠, 等.OSG胶束增溶姜黄素在果汁中的热及贮藏稳定性[J].食品与发酵工业, 2016, 42(8):71-74.
GAO L, LIU J, DONG N, et al.Thermal and storage stability of solubilized curcumin in OSG micelles using in juices[J].Food and Fermentation Industries, 2016, 42(8):71-74.
[8] 魏富彬, 马雅钦, 李升, 等.荷载β-胡萝卜素OS-葡聚糖酯胶束结肠靶向递送特性的研究[J].现代食品科技, 2016, 32(6):93-97;129.
WEI F B, MA Y Q, LI S, et al.Study on colon-specific delivery of β-carotene with oat β-glucan octenylsuccinate micelles[J].Modern Food Science and Technology, 2016, 32(6):93-97;129.
[9] WANG S M, YE F Y, WEI F B, et al.Spray-drying of curcumin-loaded octenylsuccinated corn dextrin micelles stabilized with maltodextrin[J].Powder Technology, 2017, 307:56-62.
[10] KUMAR B, TIKARIHA D, GHOSH K K, et al.Effect of polymers and temperature on critical micelle concentration of some gemini and monomeric surfactants[J].The Journal of Chemical Thermodynamics, 2013, 62:178-185.
[11] SHARMA K, CHAUHAN S.Effect of biologically active amino acids on the surface activity and micellar properties of industrially important ionic surfactants[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2014, 453:78-85.
[12] QIU X M, LEI Q F, FANG W J, et al.A calorimetric study on interactions of amino acids with sodium dodecylsulfate and dodecyltrimethylammonium bromide in aqueous solutions at 298.15 K[J].Thermochimica Acta, 2008, 478(1-2):54-56.
[13] LIU J, LI J, MA Y Q, et al.Synthesis, characterization, and aqueous self-assembly of octenylsuccinate oat β-glucan[J].Journal of Agricultural and Food Chemistry, 2013, 61(51):12 683-12 691.
[14] KALYANASUNDARAM K, THOMAS J K.Environmental effects on vibronic band intensities in pyrene monomer fluorescence and their application in studies of micellar systems[J].Journal of the American Chemical Society, 1977, 99(7):2 039-2 044.
[15] WU Z, ZHAO C Y, HUANG Y X, et al.Molecular mechanism underlying the effects of temperature and pH on the size and surface charge of octenylsuccinated oat β-glucan aggregates[J].Carbohydrate Polymers, 2020, 237:116115.
[16] WU X J, ZHOU L Z, SU Y, et al.An autoreduction method to prepare plasmonic gold-embedded polypeptide micelles for synergistic chemo-photothermal therapy[J].Journal of Materials Chemistry.B, 2016, 4(12):2 142-2 152.
[17] WU Z, ZHAO C Y, LI R H, et al.Insights into micellization of octenylsuccinated oat β-glucan and uptake and controlled release of β-carotene by the resultant micelles[J].Journal of Agricultural and Food Chemistry, 2019, 67(26):7 416-7 427.
[18] VARSHOSAZ J, SADRI F, ROSTAMI M, et al.Synthesis of pectin-deoxycholic acid conjugate for targeted delivery of anticancer drugs in hepatocellular carcinoma[J].International Journal of Biological Macromolecules, 2019, 139:665-677.
[19] SAYEM A M, MANDAL A B.The clouding phenomena of mixed surfactant (non-ionic Triton X-114+cationic gemini 16-5-16) solutions:Influence of inorganic and organic additives on the cloud point[J].Journal of Molecular Liquids, 2015, 212:237-244.
[20] NAZARI M, FAN H Y, HEERKLOTZ H.Effect of hydrophobic interactions on volume and thermal expansivity as derived from micelle formation[J].Langmuir, 2012, 28(40):14 129-14 136.
[21] MEHNERT W, M DER K.Solid lipid nanoparticles:Production, characterization and applications[J].Advanced Drug Delivery Reviews, 2001, 47(2-3):165-196.
DER K.Solid lipid nanoparticles:Production, characterization and applications[J].Advanced Drug Delivery Reviews, 2001, 47(2-3):165-196.
[22] XIE Y, YAO Y.Octenylsuccinate hydroxypropyl phytoglycogen, a dendrimer-like biopolymer, solubilizes poorly water-soluble active pharmaceutical ingredients[J].Carbohydrate Polymers, 2018, 180:29-37.
[23] PILLAI S A, BHARATIYA B, CASAS M, et al.A multitechnique approach on adsorption, self-assembly and quercetin solubilization by Tetronics® micelles in aqueous solutions modulated by glycine[J].Colloids and Surfaces B:Biointerfaces, 2016, 148:411-421.
[24] PHAN C M, YUSA S I, HONDA T, et al.Micelle and surface tension of double-chain cationic surfactants[J].ACS Omega, 2018, 3(9):10 907-10 911.
[25] ATKIN R, CRAIG V S J, WANLESS E J, et al.Mechanism of cationic surfactant adsorption at the solid-aqueous interface[J].Advances in Colloid and Interface Science, 2003, 103(3):219-304.
[26] HARUTYUNYAN L R, HARUTYUNYAN R S.Effect of amino acids on micellization and micellar parameters of anionic surfactant alpha olefin sulfonate C14-C16 in aqueous solutions:Surface tension, conductometric, volumetric, and fluorescence studies[J].Journal of Chemical & Engineering Data, 2019, 64(2):640-650.
[27] MAHAJAN S, SHAHEEN A, BANIPAL T S, et al.Cloud point and surface tension studies of triblock copolymer-ionic surfactant mixed systems in the presence of amino acids or dipeptides and electrolytes[J].Journal of Chemical & Engineering Data, 2010, 55(9):3 995-4 001.
[28] ROJAS M, MISKOLCZY Z, BICZ K L, et al.Effect of amino acid addition on the micelle formation of the surface-active ionic liquid 1-tetradecyl-3-methylimidazolium bromide in aqueous solution[J].Journal of Physical Organic Chemistry, 2019, 32(1):e3814.
K L, et al.Effect of amino acid addition on the micelle formation of the surface-active ionic liquid 1-tetradecyl-3-methylimidazolium bromide in aqueous solution[J].Journal of Physical Organic Chemistry, 2019, 32(1):e3814.
[29] PATIDAR P, BAHADUR A.Modulating effect of different biomolecules and other additives on cloud point and aggregation of amphiphilic linear and starblock copolymer[J].Journal of Molecular Liquids, 2018, 249:219-226.